Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Diseño de un biorreactor para mejorar la adquisición de datos y el rendimiento del modelo de tejidos cardíacos diseñados
En este artículo
Erratum Notice
Resumen
Los tejidos cardíacos tridimensionales biodiseñados con cardiomiocitos derivados de células madre han surgido como modelos prometedores para estudiar el miocardio humano sano y enfermo in vitro , al tiempo que recapitulan aspectos clave del nicho cardíaco nativo. Este manuscrito describe un protocolo para la fabricación y el análisis de tejidos cardíacos de ingeniería de alto contenido generados a partir de cardiomiocitos derivados de células madre pluripotentes inducidas humanas.
Resumen
La insuficiencia cardíaca sigue siendo la principal causa de muerte en todo el mundo, lo que crea una necesidad apremiante de mejores modelos preclínicos del corazón humano. La ingeniería de tejidos es crucial para la investigación cardíaca de la ciencia básica; El cultivo de células humanas in vitro elimina las diferencias entre especies de los modelos animales, mientras que un entorno 3D más parecido a un tejido (por ejemplo, con matriz extracelular y acoplamiento heterocelular) simula las condiciones in vivo en mayor medida que el cultivo bidimensional tradicional en placas de Petri de plástico. Sin embargo, cada modelo de sistema requiere equipos especializados, por ejemplo, biorreactores diseñados a medida y dispositivos de evaluación funcional. Además, estos protocolos suelen ser complicados, laboriosos y están plagados de fallos en los tejidos pequeños y delicados.
Este artículo describe un proceso para generar un sistema modelo robusto de tejido cardíaco humano (hECT) utilizando cardiomiocitos derivados de células madre pluripotentes inducidas para la medición longitudinal de la función tisular. Se cultivan seis hECT con geometría de tira lineal en paralelo, con cada hECT suspendida de un par de postes de polidimetilsiloxano con detección de fuerza (PDMS) unidos a bastidores de PDMS. Cada publicación está cubierta con un rastreador de publicaciones estables (SPoT) PDMS negro, una nueva característica que mejora la facilidad de uso, el rendimiento, la retención de tejidos y la calidad de los datos. La forma permite el seguimiento óptico fiable de las deflexiones posteriores, lo que produce trazados mejorados de la fuerza de contracción con tensión activa y pasiva absoluta. La geometría de la tapa elimina la falla del tejido debido a que los hECT se deslizan de los postes y, como implican un segundo paso después de la fabricación del bastidor de PDMS, los SPoT se pueden agregar a los diseños existentes basados en postes de PDMS sin cambios importantes en el proceso de fabricación del biorreactor.
El sistema se utiliza para demostrar la importancia de medir la función de la TEC a temperaturas fisiológicas y muestra una función tisular estable durante la adquisición de datos. En resumen, describimos un sistema modelo de última generación que reproduce condiciones fisiológicas clave para avanzar en la biofidelidad, la eficiencia y el rigor de los tejidos cardíacos diseñados para aplicaciones in vitro .
Introducción
Los modelos de tejido cardíaco diseñados vienen en una amplia gama de geometrías y configuraciones para recapitular varios aspectos del nicho cardíaco nativo que son difíciles de lograr con el cultivo celular bidimensional tradicional. Una de las configuraciones más comunes es la tira de tejido lineal, con anclajes flexibles en cada extremo para inducir el autoensamblaje del tejido y proporcionar al tejido una precarga definida y una lectura de las fuerzas de contracción resultantes 1,2,3,4,5,6,7,8,9,10,11, 12,13,14,15,16,17,18,19,20,21
,22,23,24,25,26,27. La fuerza generada se puede determinar de manera robusta a través del seguimiento óptico del acortamiento del tejido y utilizando la teoría del haz elástico para calcular la fuerza a partir de las deflexiones medidas y la constante de resorte de los anclajes 1,2,3,4,5,6,7,8,9,10,11, 12,13,14,15,16,17,18,19,20,
21,22,25,26,28.
Sin embargo, la ingeniería de tejidos cardíacos sigue siendo un campo en evolución y aún quedan algunos desafíos. Se requieren equipos especializados, como biorreactores hechos a medida y dispositivos de evaluación funcional, para cada sistema modelo 10,29,30,31. El tamaño y la complejidad del microambiente de estas construcciones a menudo están limitados por el bajo rendimiento debido a protocolos intensivos en mano de obra, alto número de células y fragilidad de los tejidos. Para abordar esto, algunos grupos han recurrido a la fabricación de microtejidos que contienen solo cientos o miles de células para facilitar ensayos de alto rendimiento que son útiles para el descubrimiento de fármacos. Sin embargo, esta escala reducida complica la evaluación precisa de la función12, elimina aspectos clave del nicho cardíaco nativo (como los gradientes de difusión de nutrientes/oxígeno y la arquitectura compleja36) y limita la cantidad de material disponible para el análisis molecular y estructural posterior (que a menudo requiere la agrupación de los tejidos). En la Tabla 1 se resumen algunas de las configuraciones de los modelos de tiras de tejido lineales en la literatura 1,2,3,4,5,6,7,8,9,10,11,12,13,14,15, 16,17,18,19,20,
21,22,23,24,25,26,37,38,39,40.
| Grupo | Células por tejido | Pañuelos de papel por placa | Formato de placa | Función de anclaje | Método de adquisición de datos funcionales | ¿Baño multimedia compartido? | Medida funcional- ¿Es posible que se trate de un proceso in situ? | ||||
| Yoshida (ECT)38 | 4 millones | 6 | Placa modificada de 6 pocillos* | transductor de fuerza | Medición directa de la fuerza | No | No | ||||
| Chan (hESC-CM-ECTs)26 | 310 k | 6 | Plato personalizado de 6 pocillos | Publicaciones de PDMS | Medición directa de la fuerza | Sí | No | ||||
| Feinberg (dyn-EHT)16 | 1,5 millones | 6 | Plato personalizado de 6 pocillos | Alambre PDMS | Forma del tejido | No | Sí | ||||
| RADISIC (BioWire)39, 40 | 110 k | 8 | alambre de polímero | Forma del alambre | Sí | Sí | |||||
| Costa (ECT única)1, 2 | 1-2 millones | 4** | Placa de Petri de 10 cm** | Publicaciones de PDMS | Deflexión óptica (seguimiento de bordes/objetos) | Sí | Sí | ||||
| Costa (multi-hECT)3–9 | 500 K-1 millón | 6 | Placa de Petri de 6 cm | Publicaciones de PDMS | Deflexión óptica (seguimiento de bordes/objetos) | Sí | Sí | ||||
| Costa (multi-hECT con SPoT) | 1 millón | 6 | Placa de Petri de 6 cm | Postes PDMS con tapas negras | Deflexión óptica (seguimiento de objetos) | Sí | Sí | ||||
| Passier (EHT)17 | 245 k | 36 | Placa de 12 pocillos | Postes PDMS con tapas negras | Deflexión óptica (seguimiento de objetos) | Sí | Sí | ||||
| Vunjak-Novakovic13, 18 | 1 millón | 12 | Placa de Petri de 6 cm | Postes PDMS con tapas | Deflexión óptica (detección de bordes) | Sí | Sí | ||||
| Vunjak-Novakovic (MilliPillar)14 | 550 k | 6 | Plato personalizado de 6 pocillos | Postes PDMS con tapas | deflexión óptica (seguimiento de objetos); Imágenes de calcio | No | Sí | ||||
| Eschenhagen (EHT)10, 19–21 | 1 millón | 12 | Placa de 12 pocillos | Postes PDMS con tapas | deflexión óptica (detección de bordes de la deflexión posterior); Imágenes de calcio | No | Sí | ||||
| Zandstra (CaMiRi)22 | 25-150 k | 96 | Placa de 96 pocillos | Postes PDMS con ganchos | Deflexión óptica (detección de bordes) | No | Sí | ||||
| Murry23, 24 | 900 k | 24 | Placa de 24 pocillos | Postes PDMS con tapas, imán integrado | Sensor magnético | No | Sí | ||||
| Reich (μTUG)11, 12, 25 | indefinido | 156 | Plato de 156 pocillos | Postes PDMS con tapas, imán integrado | Seguimiento óptico (perla fluorescente) | Sí | Sí | ||||
Tabla 1: Características de algunos modelos lineales de tejido cardíaco de ingeniería en la literatura. Los modelos de tejido cardíaco de ingeniería lineal varían en tamaño, rendimiento, diseños de características de anclaje y la facilitación de baños de medios compartidos, así como los requisitos de un sistema de baño muscular separado para la caracterización funcional. * Los investigadores utilizaron un sistema de tejido de ingeniería disponible comercialmente basado en las dimensiones de una placa estándar de 6 pocillos. ** Un sistema modular en el que los biorreactores de un solo tejido se anclan a cualquier placa de cultivo de plástico en el número y ubicación deseados.
Este artículo describe el protocolo más reciente para la fabricación de nuestro modelo establecido de tejido cardíaco humano lineal (hECT)1,2,3,4,5,6,7,8,9,15,27 y métodos para evaluar la función contráctil de la TECh. Cada biorreactor multitejido tiene capacidad para hasta seis hECT en un baño de medio compartido y está compuesto por dos piezas de "rack" hechas de elastómero de silicona polidimetilsiloxano (PDMS) montadas en un marco rígido de polisulfona. Cada bastidor PDMS contiene seis postes flexibles integrados de detección de fuerza de 0,5 mm de diámetro y 3,25 mm de largo, y juntos, dos bastidores proporcionan seis pares de postes, cada uno de los cuales tiene una hECT. La inversión del biorreactor ayuda a superar cualquier obstáculo para la visualización de los hECTs desde abajo debido a la condensación de agua del medio de cultivo o a las distorsiones del menisco de la interfaz aire-líquido. Cada contracción de una hECT provoca la deflexión de los postes finales integrados, y la medición óptica de la señal de deflexión se procesa en un trazado de fuerza frente al tiempo que representa la función contráctil de la hECT 1,2,3,4,5,6,7,8,9,15,27 . En comparación con los biorreactores de un solo tejido que se utilizan normalmente para tejidos de este tamaño, el diseño multitejido mejora el rendimiento experimental y permite el estudio de la señalización paracrina entre tejidos adyacentes de composición celular potencialmente diferente. Este sistema ha sido validado en estudios publicados que describen aplicaciones en modelización de enfermedades 4,8, señalización paracrina 6,7, cultivo heterocelular 5,9 y cribado terapéutico 7,9.
En este sistema, los hECT están diseñados para tener aproximadamente 6 mm de largo y 0,5 mm de diámetro para facilitar un seguimiento óptico robusto de las mediciones de fuerza con poco ruido. Además, los aspectos de la complejidad de los tejidos, como los gradientes de difusión y la organización celular, se equilibran con un requerimiento manejable de 1 millón de células por tejido. Con la tecnología de cámara CCD estándar, fuerzas tan débiles como 1 μN (que representan menos de 5 μm después de la deflexión) generan una señal clara, lo que garantiza que incluso la función contráctil extremadamente débil, como se observa con algunos modelos de enfermedad de TEC hequimoroidal, se pueda medir con precisión. Esto también facilita el análisis detallado de la curva de fuerza de contracción, lo que permite el análisis de alto contenido de hasta 16 métricas de contractilidad41, incluida la fuerza desarrollada, las tasas de contracción (+dF/dt) y relajación (−dF/dt) y la variabilidad de la frecuencia de batido.
Este protocolo comienza con instrucciones para la fabricación de los componentes del biorreactor. Se presta especial atención a los pasos para maximizar el rendimiento de la TECH, reducir la variabilidad técnica en la función tisular y optimizar la calidad y profundidad de la evaluación tisular. La mayoría de los estudios de ingeniería de tejidos cardíacos no informan sobre las tasas de pérdida de tejido durante la fabricación y las pruebas a largo plazo, aunque es un desafío bien conocido en el campo y reduce el rendimiento y la eficiencia de los estudios27. Los métodos de ingeniería de tejidos descritos aquí se han perfeccionado a lo largo de los años para garantizar la retención de todos los hECT en la mayoría de los biorreactores (independientemente de cómo se fabriquen los racks de PDMS). Sin embargo, incluso una pérdida de tejidos del 5% al 20% puede afectar significativamente el poder estadístico, particularmente en experimentos más pequeños limitados por el número de cardiomiocitos disponibles (por ejemplo, debido a los desafíos de diferenciación con algunas líneas celulares enfermas4 o debido al alto costo de los cardiomiocitos comprados comercialmente), o por la condición del tratamiento (por ejemplo, disponibilidad limitada o alto costo de varios compuestos de tratamiento).
Este protocolo describe la fabricación de rastreadores de postes estables (SPoTs), una nueva característica de los racks PDMS, que funcionan como tapas en los extremos de los postes de detección de fuerza que sostienen los hECTs27. Se demuestra cómo la geometría de la tapa reduce significativamente la pérdida de hECT por caída o tirón de los postes, lo que abre nuevas oportunidades para el cultivo de hECT con una mayor variedad de rigideces y tensiones, que son difíciles de cultivar en postes sin tapa. Además, los SPoT proporcionan un objeto de alto contraste para mejorar el seguimiento óptico de la contracción de la TEC a través de una forma consistente y bien definida27. A continuación, se describe el cultivo de células madre pluripotentes inducidas humanas (iPSC) y la diferenciación de cardiomiocitos con base en protocolos publicados anteriormente 3,42,43 y una explicación de la fabricación, el cultivo y las mediciones funcionales de la TECH.
Este artículo también aborda la necesidad de medir la función tisular a temperatura fisiológica. El miocardio humano (tejido sano y enfermo fetal y adulto), así como el tejido cardíaco de una amplia gama de especies animales (incluidas ratas, gatos, ratones, hurones y conejos)44,45, muestra un marcado aumento en la fuerza de contracción de frecuencia a temperaturas de 28 °C-32 °C en comparación con la temperatura fisiológica, un fenómeno conocido como inotropía hipotérmica45, Artículo 46. Sin embargo, los efectos de la temperatura sobre la función tisular miocárdica modificada siguen siendo poco estudiados. Muchos modelos recientes de tejido cardíaco diseñados en la literatura están diseñados para ser evaluados funcionalmente a 37 °C para aproximarse a las condiciones fisiológicas 13,14,37. Sin embargo, hasta donde sabemos, los efectos dependientes de la temperatura sobre la fuerza generada por los tejidos cardíacos modificados no se han investigado sistemáticamente. Este protocolo describe un diseño de electrodo de estimulación que minimiza la pérdida de calor durante las pruebas, además de permitir la incorporación de un elemento calefactor aislado en la configuración para mediciones funcionales, que puede mantener los hECT a temperatura fisiológica sin comprometer la esterilidad27. A continuación, informamos de algunos de los efectos observados de la temperatura sobre la función de la TECh, incluyendo la fuerza desarrollada, la frecuencia de latido espontáneo, +dF/dt y −dF/dt. En conjunto, este artículo proporciona los detalles necesarios para fabricar este sistema de biorreactor de detección de fuerza de múltiples tejidos para fabricar tejidos cardíacos de ingeniería humana y evaluar su función contráctil, y se presenta un conjunto de datos que proporciona una base para la comparación de mediciones a temperatura ambiente y a 37 °C27.
Protocolo
Este protocolo utilizó una línea iPSC no identificada, SkiPS 31.3 (originalmente reprogramada con fibroblastos dérmicos de un varón sano de 45 años)47 y, por lo tanto, estaba exenta de la aprobación específica de la Junta de Revisión Institucional, en concordancia con las directrices del comité de ética de la investigación en humanos de la institución. Realice toda la manipulación celular y de la TEC en condiciones asépticas en una cabina de seguridad biológica de clase II con filtro HEPA o en un banco de trabajo de flujo laminar. Esterilizar todas las soluciones no estériles mediante filtración a través de un filtro de 0,22 μm, y mantener todas las células y hECT en una incubadora a 37 °C, 95% de humedad relativa y 5% de CO2.
1. Fabricación de biorreactores
- Componentes de biorreactores y fabricación de fundición maestra de aluminio
NOTA: Los archivos de diseño asistido por computadora (CAD) se proporcionan en el Archivo Suplementario 1. El protocolo puede detenerse en cualquier momento entre estos pasos. Se recomienda contratar a un maquinista profesional para fabricar los moldes maestros descritos en esta sección, ya que se requieren altas tolerancias (≤5 μm) y un acabado liso para una geometría precisa del poste y para un ajuste a presión adecuado de los marcos de polisulfona a las placas base de politetrafluoroetileno (PTFE) (con el objetivo de un ajuste de fricción perfecto, pero no demasiado apretado).- Usando un molino de control numérico computarizado (CNC), mecanize la placa base de PTFE de acuerdo con los esquemas de la Figura 1A. Los hECTs se formarán en los seis pocillos espaciados uniformemente (flechas blancas).
- Usando una fresadora CNC, mecanize el maestro maestro negativo de bastidor de polidimetilsiloxano (PDMS) fundido en aluminio de acuerdo con los esquemas de la Figura 1B, con tres soportes de marco (asteriscos verdes). Taladre seis orificios espaciados uniformemente (puntas de flecha magenta) de 0,5 mm de diámetro para crear los postes PDMS.
- Usando una fresadora CNC, mecanize el marco del biorreactor de polisulfona de acuerdo con los esquemas de la Figura 1C. Los soportes del marco (asteriscos verdes) corresponden a los soportes del marco que se ven en el molde del bastidor (Figura 1B, asteriscos verdes).
- Con una fresadora CNC, mecanize el soporte de fundición de aluminio de acuerdo con los esquemas de la Figura 1D. Cada ranura contiene un estante triangular (triángulo naranja) de 0,25 mm de altura para proporcionar un espacio muerto para que el PDMS fluya a través de los orificios de las fundiciones del bastidor del PDMS (Figura 1B, puntas de flecha magenta).
- Fundición del bastidor PDMS a partir de los maestros negativos de aluminio
- Utilizando una impresora 3D de modelado por deposición fundida termoplástica, imprima dos soportes de aparatos de fundición en bastidor PDMS (Archivo complementario 1). Utilice los siguientes ajustes de impresión: una altura de capa de 0,1 mm, un grosor de pared/inferior/superior de 1 mm, una densidad de relleno del 90% con triángulos, una temperatura de impresión de 230 °C, una temperatura de la placa de impresión de 70 °C y un borde para la adhesión.
- Coloque cuatro moldes maestros negativos de aluminio en el soporte de fundición (Figura 2AI) de modo que los orificios de los postes se alineen con el espacio muerto opuesto a los estantes triangulares (consulte la Figura 1D). Envuelva el aparato en una pieza rectangular de lámina de silicona de 0,5 mm de espesor (Figura 2B, flechas blancas) como junta para evitar fugas del PDMS líquido y sujételo entre dos soportes paralelos impresos en 3D con una abrazadera de tornillo.
- Agregue 0,5 ml de agente de curado PDMS a 5 ml de base de elastómero PDMS (proporción 1:10, según las instrucciones del fabricante) en un recipiente poco profundo y mezcle vigorosamente durante 5 minutos. Desgasifique la mezcla de PDMS en una cámara de vacío y aplique un vacío fuerte (0,1-1 kPa) durante 20-60 minutos a temperatura ambiente o hasta que desaparezcan las burbujas.
- Vierta la mezcla de PDMS en el aparato de fundición, llenando en exceso para asegurar la cobertura completa de cada ranura (Figura 2AII). Si lo desea, agregue pequeñas cuentas de vidrio de colores al cuerpo de los bastidores PDMS (Figura 2AII), opuesto al lado con los postes (Figura 2B), para la identificación única de cada bastidor PDMS. Regrese el aparato de fundición a la cámara de vacío (asegurándose de que esté nivelado horizontalmente) y aplique un vacío fuerte durante al menos 12 h. Deje que el PDMS se cure a temperatura ambiente durante aproximadamente 48 h lejos del polvo para permitir el curado completo y la máxima resistencia de los postes delicados. Evite usar un horno, ya que esto deforma los componentes impresos en 3D.
NOTA: El protocolo se puede pausar aquí.
- Extracción de la cremallera PDMS de las fundiciones maestras negativas de aluminio
- Retire la abrazadera, los soportes y las láminas de silicona del aparato de fundición. Con una cuchilla de afeitar de acero inoxidable, recorte la película PDMS en la parte superior del aparato de fundición y los soportes del marco, y use suavemente los dedos para separar los bastidores PDMS de los lados del soporte de fundición. Inserte una cuchilla de afeitar de acero inoxidable desafilada en el espacio muerto entre el yeso y el soporte del yeso, y sepárelos (Figura 2CI, II), asegurándose de que el PDMS que llena el espacio muerto permanezca con el soporte del yeso (ya que está unido a los postes). Con una cuchilla afilada de acero inoxidable, corte las películas de PDMS restantes y corte el PDMS de espacio muerto de las puntas de los postes (Figura 2C III-V).
- PASO CRÍTICO: Libere el bastidor PDMS de la yeso (Figura 2D). Comenzando con el lado opuesto a los postes, use los dedos para separar lentamente el bastidor PDMS del molde, trabajando en lados alternativos hasta que los postes estén libres de los moldes maestros.
- Repita el paso anterior hasta que se liberen todos los bastidores PDMS y todos los postes. Use una cuchilla de afeitar afilada para recortar cualquier exceso de PDMS restante de los estantes. El resultado es un bastidor PDMS (Figura 2E) con seis postes intactos (puntas de flecha naranjas) y cuentas de colores (flecha azul) para su identificación.
NOTA: El protocolo se puede pausar aquí.
- Fabricación de rastreadores de postes estables (SPoT)
- Utilizando una impresora 3D de modelado por deposición fundida termoplástica, imprima los componentes del aparato de fundición SPoT (Archivo suplementario 2 y Figura 3AI, II). Utilice los siguientes ajustes de impresión: una altura de capa de 0,1 mm, un grosor de pared/inferior/superior de 1 mm, una densidad de relleno del 80% con triángulos, una temperatura de impresión de 230 °C, una temperatura de la placa de impresión de 70 °C y un borde para la adhesión.
- Asegúrese de que las estanterías de PDMS encajen perfectamente con los postes que llegan al fondo de los pozos sin doblarse. Recorta o lima el plástico si es necesario.
- Agregue 0,5 ml de PDMS negro de la parte A a 0,5 ml de la parte B (proporción 1:1, según las instrucciones del fabricante) a un bote de pesaje pequeño (o un recipiente pequeño y poco profundo similar) y mezcle bien hasta que tenga un color uniforme. Desgasificar el PDMS negro mezclado en una cámara de vacío bajo un fuerte vacío durante 20 min. Vierte el PDMS negro desgasificado sobre la base impresa en 3D para rellenar los agujeros, y golpea para asegurarte de que no quedan burbujas. Raspe la mayor cantidad posible de PDMS de la base.
- Encaje la pieza de tres puntas en la base y coloque las rejillas de PDMS en las ranuras de la plantilla de tres puntas (Figura 3AII, rectángulo turquesa), asegurándose de que los extremos de los postes se sumerjan en el PDMS negro en los pozos circulares (Figura 3B, C). Cura el PDMS negro a temperatura ambiente y protegido del polvo durante 48 h.
NOTA: El protocolo se puede pausar aquí. - Deslice hacia afuera la pieza de tres puntas, minimizando la tensión en los postes. Use pinzas pequeñas para raspar la película delgada de PDMS negro que rodea cada SPoT; luego, inserte pinzas dobladas de punta fina en el pocillo SPoT para liberarlo de la base impresa en 3D (Figura 3D).
- Inspeccione los SPoT (Figura 3E) y recorte cualquier resto de película negra de PDMS del proceso de fundición que no se haya eliminado en el paso 1.4.5 con unas tijeras finas de Vannas. Asegúrese de que los postes terminados tengan la longitud correcta colocando los bastidores PDMS en el marco de polisulfona y luego deslizándolo sobre la placa base negra (Figura 4A).
NOTA: El protocolo se puede pausar aquí. - Empareje los bastidores PDMS y agréguelos al marco con las pestañas del marco (Figura 4A). Autoclave en una bolsa con una placa base de PTFE durante un ciclo de al menos 30 minutos (<122 °C para reducir la deformación).
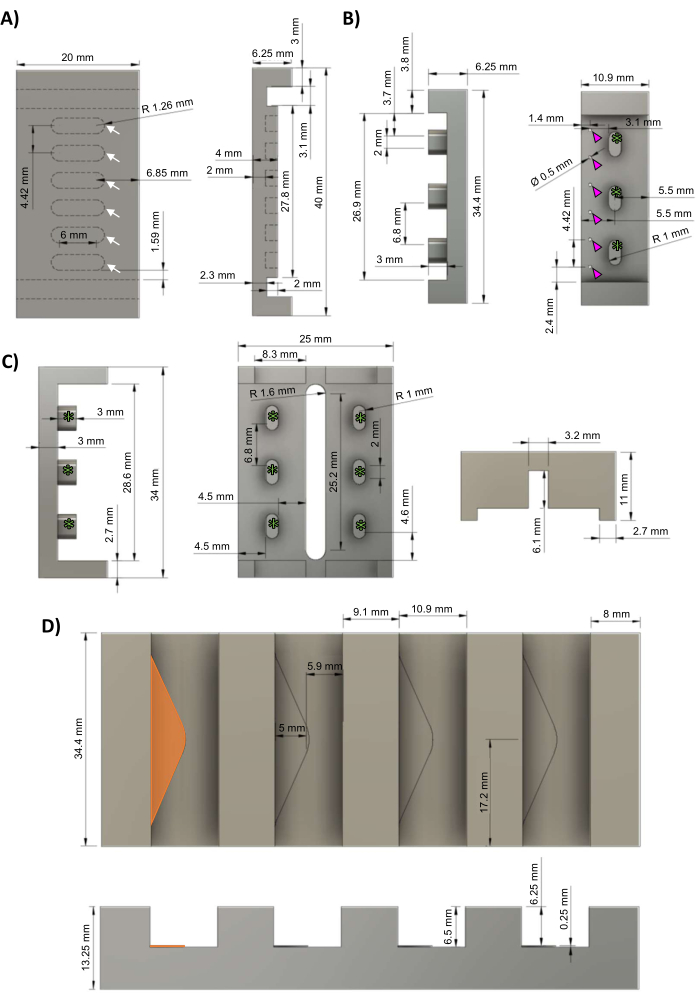
Figura 1: Componentes del biorreactor de hECT. (A) Vista superior (izquierda) y vista lateral (derecha) de la placa base de PTFE con seis pocillos espaciados uniformemente para formar hECT (flechas blancas). (B) Vista lateral (izquierda) y vista superior (derecha) de las fundiciones maestras negativas de aluminio para los bastidores PDMS con seis postes espaciados uniformemente (puntas de flecha magenta) y tres huecos para sujetarlos al marco del biorreactor (asteriscos verdes). (C) Vista lateral (izquierda) y vista inferior (derecha) de los bastidores de polisulfona para los bastidores PDMS con tres soportes de bastidor espaciados uniformemente (asteriscos verdes) correspondientes a los soportes del bastidor en la fundición del bastidor PDMS (panel B). (D) Vista superior (arriba) y vista lateral (abajo) del soporte de fundición de aluminio con cuatro ranuras para las fundiciones de bastidor PDMS, cada una con un estante triangular de 0,25 mm de altura (estante más a la izquierda resaltado en naranja). Esta cifra fue modificada a partir de van Neste27. Abreviaturas: hECT = tejido cardíaco humano modificado; Ø = diámetro; PTFE = politetrafluoroetileno; PDMS = polidimetilsiloxano; R = radio. Haga clic aquí para ver una versión más grande de esta figura.
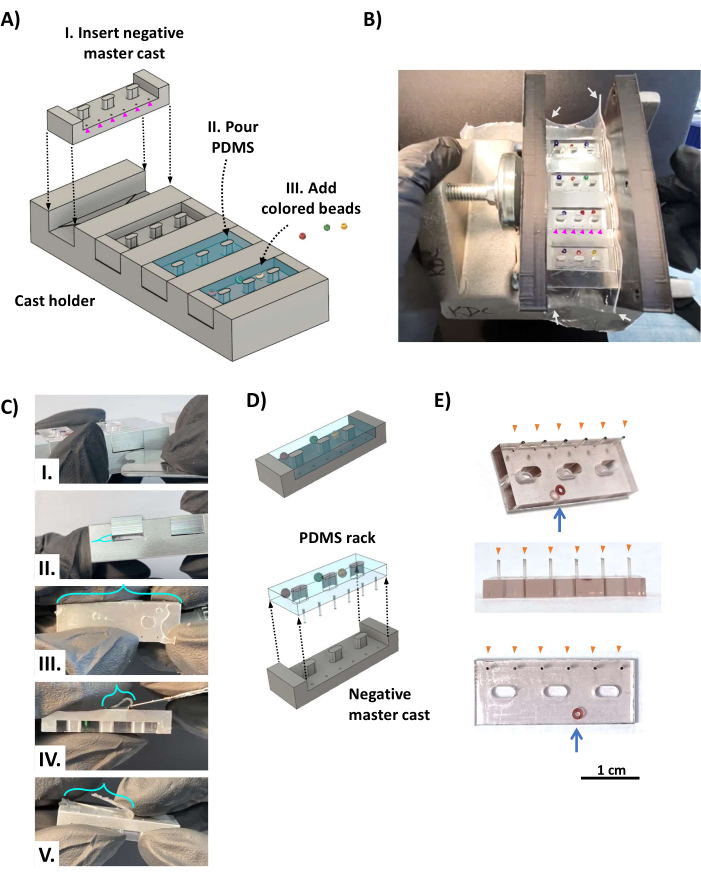
Figura 2: Fabricación de los racks PDMS. (A) Las representaciones CAD muestran una vista oblicua del aparato de fundición. (I) Se inserta una fundición maestra de bastidor PDMS negativa en cada una de las cuatro ranuras del soporte de fundición con los orificios que forman los postes PDMS (puntas de flecha magenta) colocados sobre el espacio muerto opuesto al estante triangular (Figura 1D, triángulo naranja). (II) El PDMS se vierte en cada cavidad del molde maestro negativo. (III) Las cuentas de colores se agregan al PDMS sin curar como un sistema de identificación codificado por colores. (B) Foto que muestra el aparato de fundición en bastidor PDMS ensamblado, que se sujeta a cada lado con dos soportes impresos en 3D que se mantienen en su lugar mediante una abrazadera de tornillo y se envuelven con láminas de silicona de 0,5 mm de espesor (flechas blancas) para sellar los lados sujetos. Las cuentas de colores se colocan de manera que no tapen los agujeros de 0,5 mm de diámetro que forman los postes (puntas de flecha magenta). (C) Una vez curado el PDMS, el yeso se retira del soporte del yeso. (I) Se inserta una cuchilla de afeitar de acero inoxidable desafilada o una herramienta similar de metal delgado entre el yeso y el soporte de yeso para sacar el yeso del soporte de yeso (II). (III) La película (soportes turquesas) formada por el PDMS que fluye a través de los orificios de los postes se adhiere a las puntas de los postes y debe cortarse con una cuchilla afilada (IV, V). (D) El bastidor PDMS está separado de la fundición. (E) Fotos que muestran vistas oblicuas (arriba), lateral (centro) e inferior (abajo) del estante PDMS con una cuenta de vidrio incrustada en el cuerpo para su identificación (flecha azul). Las puntas de los postes (puntas de flecha naranjas) se han marcado con tinta negra. Barra de escala = 1 cm. Esta cifra fue modificada a partir de van Neste27. Abreviaturas: CAD = diseño asistido por ordenador; PDMS = polidimetilsiloxano. Haga clic aquí para ver una versión más grande de esta figura.
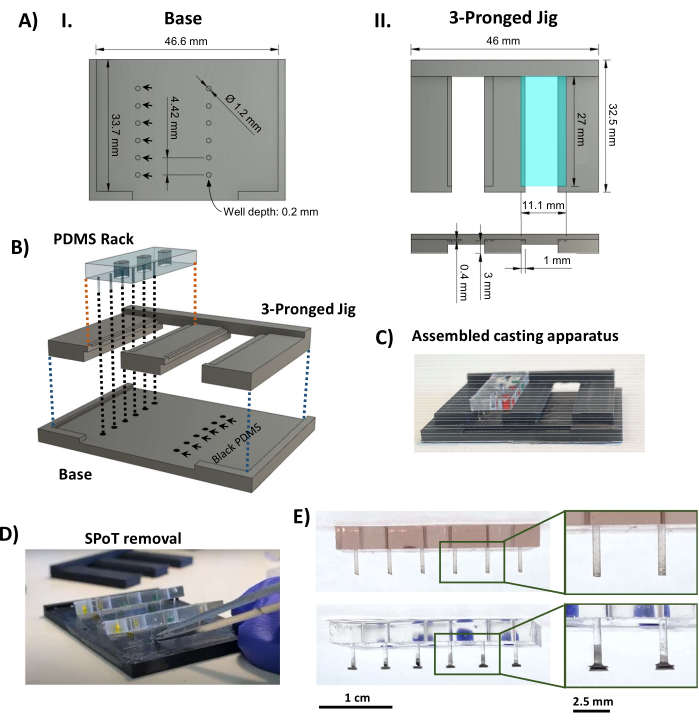
Figura 3: Fabricación de SPoT. (A) Representaciones CAD que indican las dimensiones clave de la (I) base y (II) pieza de tres puntas de la plantilla de fundición SPoT. Las dimensiones de los formularios circulares de SPoT (AI, flechas negras) se establecen en 0,2 mm de profundidad x 1,2 mm de diámetro, y cada uno contiene el PDMS negro para un SPoT individual. El estante de 11,1 mm x 27 mm que se ve en la vista superior (AII, arriba, rectángulo turquesa) se presiona 0,4 mm (como se ve en la vista lateral de abajo) para mantener la rejilla PDMS en su lugar durante el curado. (B) Representación CAD que muestra el montaje del aparato de fundición SPoT. (C) Una foto del aparato de fundición SPoT ensamblado. (D) Después de que el PDMS se haya curado, la plantilla de tres puntas se desliza hacia afuera de debajo de los bastidores del PDMS y los SPoT se liberan de sus pocillos con pinzas finas. (E) Fotos del rack PDMS sin (arriba) y con (abajo) SPoTs. Los recuadros muestran vistas ampliadas de las publicaciones. Barras de escala = 1 cm (E), 2,5 cm (imágenes ampliadas en E). Esta cifra fue modificada a partir de van Neste27. Abreviaturas: CAD = diseño asistido por ordenador; Ø = diámetro; PDMS = polidimetilsiloxano; R = radio; SPoT = rastreador de publicaciones estable. Haga clic aquí para ver una versión más grande de esta figura.
2. Cultivo celular
- Cultivo de las iPSC
NOTA: Es posible que las diferentes líneas celulares requieran ajustes en la dilución de paso y la frecuencia y/o la valoración de los aditivos del medio.- Cubra una placa de 6 pocillos tratada con cultivo celular con una matriz de membrana basal calificada (diluida en Dulbecco's Modified Eagle Medium:Ham's F12 Nutrient Solution [DMEM/F12] 1:1 de acuerdo con las instrucciones del fabricante) e incube la placa a 37 °C durante al menos 30 min. Prepare 500 ml de medio de cultivo iPSC de acuerdo con las instrucciones del fabricante y agregue 5 ml de solución madre de penicilina-estreptomicina (10,000 UI/ml a 10,000 μg/mL).
- Para pasar las iPSC, aspire el medio de los pocillos y lave cada pocillo una vez con 1 ml de solución salina tamponada con fosfato (PBS). Agregue 1 ml de solución de disociación de iPSC por pocillo e incube en una campana de flujo laminar durante 1 minuto.
- Aspirar la solución de disociación de iPSC e incubar las células a 37 °C (sin ningún medio) durante 5 min. Añadir 1 mL de 2 μM de tiazovivina en medio iPSC para neutralizar la solución de disociación de iPSC.
- Utilice una pipeta serológica de 2 ml para disociar las colonias en grupos de aproximadamente 10 células, y lave bien cada una con 1 ml adicional de 2 μM de tiazovivina en medio iPSC. Añadir 2 mL de suspensión celular a cada pocillo de la placa recién recubierta con matriz de membrana basal (paso 2.1.1).
- Después de 24 h, retire el medio y agregue el medio iPSC fresco (sin tiazovivina). Alimente las iPSC cada 48 h con 2 mL de medio iPSC o cada 72 h con 4 mL de medio. Vuelva a colocar las células en una dilución de 1:6 para pasar cada 3 días o cuando alcancen el 80% de confluencia.
NOTA: Diferentes líneas celulares pueden requerir un ajuste de la dilución y la frecuencia de paso.
- Diferenciación de cardiomiocitos
- Comience la diferenciación cuando las monocapas de iPSC sean 80%-90% confluentes.
- Prepare el medio de diferenciación agregando 10 ml de suplemento de B27 sin insulina y 5 ml de solución madre de penicilina y estreptomicina a 500 ml de medio Roswell Park Memorial Institute 1640 (RPMI). Prepare el medio de mantenimiento de cardiomiocitos añadiendo 10 ml de suplemento de B27 y 5 ml de solución madre de penicilina-estreptomicina a 500 ml de RPMI 1640.
NOTA: El medio de diferenciación y el medio de mantenimiento de cardiomiocitos pueden almacenarse a 4 °C durante un máximo de 2 semanas. - Día 0: Lavar las células con 1 mL de DMEM/F12, y añadir 2 mL de 10 μM CHIR99021 y matriz de membrana basal diluida en medio de diferenciación.
- Día 1: Después de 24 h, o cuando la confluencia celular se haya reducido por debajo del 70%, lavar las células con 1 mL de DMEM/F12, agregar 2 mL de medio de diferenciación e incubar durante 48 h.
- Días 3-4: Lavar las células con 1 mL de DMEM/F12, y añadir 2 mL de 5 μM de IWR-1 en medio de diferenciación. Repita el día 4.
- Días 5-6: Lavar las células con 1 mL de DMEM/F12, y añadir 2 mL de medio de diferenciación. Repita el día 6.
- Días 7-10: Lavar las células con 1 mL de DMEM/F12 y añadir 2 mL de medio de mantenimiento de cardiomiocitos. Repetir cada 24 h.
- Días 11+: Reemplace el medio con 4 mL de medio de mantenimiento de cardiomiocitos frescos cada 48-72 h. Aspire y pipetee lentamente para evitar dañar las monocapas que baten vigorosamente.
3. Cultura de la TEC
- Recolección de los cardiomiocitos
- Recolectar las monocapas de cardiomiocitos para su uso en la fabricación de la TEC de 8 a 60 días después de la inducción de la diferenciación. Espere de 2 a 5 millones de células por pocillo.
NOTA: Si las células no han comenzado a latir en el día 10, es poco probable que la diferenciación tenga éxito. Las monocapas que baten vigorosamente a menudo se desprenden después de 11-15 días en la diferenciación y se compactan en tejidos densos. Se recomienda utilizar o replatear dichas células en este momento. - Enjuague cada pocillo de cardiomiocitos 2 veces con 2 ml de PBS. Añadir 1 ml de tripsina-EDTA al 0,25% a temperatura ambiente. Incubar a 37 °C durante 5-10 min hasta que las células parezcan redondeadas y se desprendan con un ligero golpeteo de la placa.
- Agregue 1 mL de FBS al 10% en medio de mantenimiento de cardiomiocitos a cada pocillo para neutralizar la disociación. Pipetear suavemente las monocapas con una punta de pipeta serológica de 5 ml y transferirlas a un tubo cónico de 50 ml para romper el gránulo en grupos de 10-20 células.
- Mezcle la suspensión celular invirtiendo el tubo cónico antes de transferir 10 μL de células a 10 μL de azul de tripano. Cuente las células con un contador de células automatizado o un hemocitómetro de vidrio. Separe la suspensión celular de manera apropiada si no se van a utilizar todas las células o si algunas células se reservan para la citometría de flujo.
NOTA: En este punto, se pueden agregar células suplementarias (como fibroblastos). - Centrifugar las células a 250 × g durante 5 min. Aspire inmediatamente la mayor cantidad posible de sobrenadante sin alterar el gránulo de la celda y manténgalo en hielo. Trabaje rápidamente para minimizar el tiempo que las células pasan en el gránulo.
- Recolectar las monocapas de cardiomiocitos para su uso en la fabricación de la TEC de 8 a 60 días después de la inducción de la diferenciación. Espere de 2 a 5 millones de células por pocillo.
- Fabricación de hECT
- Utilice los volúmenes de la Tabla 2 y ajústelos de acuerdo con el número de células en el gránulo para que cada hECT contenga 1 millón de células. Después de cada paso, mezcle pipeteando lentamente para evitar burbujas.
NOTA: Realice los pasos 3.2.2-3.2.3 protegidos de la luz directa, ya que algunos componentes son sensibles a la luz. - Prepare una solución de colágeno tipo 1 de 2,9 g/ml en un microtubo de 1,7 ml añadiendo 13,442 μl de agua destilada, 4,4 μl de PBS 10x y 0,638 μl de NaOH 1M. Añadir 25,52 μL de solución madre de colágeno de 5 mg/mL y mezclar lentamente.
- Preparar la mezcla de matriz extracelular (mezcla de ECM de la Tabla 2): Añadir 5,5 μL de solución HEPES de pH 9 0,2 N seguida de 5,5 μL de MEM 10x. Mezcle bien hasta que se observe un color uniforme de amarillo claro a rosa claro. Transfiera 35,2 μL de la solución de mezcla de ECM al gránulo de la célula y agregue 4,4 μL de matriz de membrana basal.
- Abra la bolsa esterilizada en autoclave de las piezas del biorreactor (paso 1.4.7, Figura 4A). Con guantes esterilizados con etanol al 70%, retire la placa base negra de la bolsa del autoclave y colóquela en un plato de 60 mm con los pocillos hacia arriba. Pipetear 44 μL de la mezcla celular en cada pocillo lentamente para evitar la introducción de burbujas. Si es necesario, utilice la pipeta para eliminar las burbujas introducidas por pipeteo o que se hayan formado debido a la hidrofobicidad del PTFE. Restaure el volumen de la hECT de manera que la superficie del líquido quede al ras con el borde del pocillo (Figura 4BI).
- Póngase un par de guantes esterilizados nuevos y retire el marco de polisulfona con las gradillas de PDMS de la bolsa del autoclave. Baje el marco sobre la placa base de modo que los extremos del marco encajen en las ranuras de los extremos de la placa base (Figura 4BII, III). Inspeccione el biorreactor para asegurarse de que los postes estén rectos y que el marco no esté inclinado antes de colocarlo en un plato de 60 mm.
- Agregue 1 ml de FBS al 10% en medio de mantenimiento de cardiomiocitos a la placa de 60 mm (tenga cuidado de no alterar los hECT) para aumentar la humedad en el plato a medida que los hECT se solidifican. Coloque el plato de 60 mm sin tapa en un plato de 100 mm de perfil alto (20 mm de altura), cúbralo con una tapa de plato de 100 mm y devuelva el biorreactor a la incubadora a 37 °C y 5% de CO2 para permitir que el colágeno forme un gel con las células en suspensión.
- Después de 2 h, retire el plato de la incubadora. Agregue 13 ml de FBS al 10% en el medio de mantenimiento de cardiomiocitos, inclinando el plato para estimular el flujo del medio entre la placa base de PTFE y las gradillas de PDMS.
- Inspeccione el biorreactor desde un lado para asegurarse de que no haya burbujas de aire atrapadas entre las superficies hidrofóbicas de la placa base de PTFE y las gradillas de PDMS, y devuelva el plato a la incubadora. Si hay aire atrapado, incline el biorreactor fuera del medio para dejar que la burbuja se rompa y vuelva a bajarlo lentamente, o use una micropipeta con una punta de carga de gel para extraer el aire, teniendo cuidado de no perturbar los postes.
- Utilice los volúmenes de la Tabla 2 y ajústelos de acuerdo con el número de células en el gránulo para que cada hECT contenga 1 millón de células. Después de cada paso, mezcle pipeteando lentamente para evitar burbujas.
- Extracción de la placa base
- Inspeccione la compactación hECT a través del espacio en el marco. En el transcurso de 24-96 h, los ECTh se compactan y se vuelven más opacos (Figura 4CI-III). Una vez que haya un espacio visible entre los ECTh y la pared de la placa base (Figura 4CII), realice dos cambios de medio volumen para cambiar el medio a medio de mantenimiento de cardiomiocitos sin FBS. Retire la placa base cuando los hECT estén compactados en al menos un 30% en comparación con el diámetro original (Figura 4CIII). Llene la placa de 60 mm que contiene el biorreactor con medio de mantenimiento de cardiomiocitos hasta que el líquido esté al ras con el borde de la placa y agregue 14 ml a una nueva placa de 60 mm.
- PASO CRÍTICO: Mientras usa guantes estériles, voltee el biorreactor en su plato para que la placa base quede en la parte superior (Figura 4BIV). Inspeccione si hay burbujas de aire atrapadas como en el paso 3.2.8. Levante lentamente la placa base, manteniéndola nivelada (Figura 4BV).
- Si un TCE se cae durante la extracción de la placa base, pero permanece en la placa base, utilice pinzas finas curvas estériles para transferir la TCE de la placa base a la placa de 60 mm. Utilice las pinzas para guiar el extremo de la TCE hasta su puesto. Use un segundo par de pinzas para mantener el poste firme y páselo a través del orificio en la TEC. Repita para la segunda publicación si es necesario.
- Con todos los hECT unidos a los postes, transfiera el marco con los hECT a la nueva antena parabólica de 60 mm y coloque el marco con los postes apuntando hacia abajo (Figura 4BVI). Inspeccione el biorreactor para asegurarse de que los hECT permanezcan en sus puestos justo proximales a los SPoT.
- Si un TEC ha sido empujado por tensión superficial a la base de sus postes, estabilice el marco con un par de pinzas curvas estériles. Inserte el otro par de pinzas a través de la ranura del marco, manteniéndola cerrada. Una vez que la punta de la pinza se haya bajado más allá de las gradillas del PDMS, gírela para que llegue al poste y use las puntas cerradas para empujar suavemente la TEC hacia el extremo del poste hasta que descanse sobre el SPoT (Figura 4BVI, recuadro).
- Mantenimiento de hECT
- Realizar cambios de medio volumen con medio de mantenimiento de cardiomiocitos cada 24-48 h (después de 2 semanas de cultivo, la frecuencia puede reducirse a dos veces por semana).
- Cuando los ECTh muestran grupos de latidos espontáneos, generalmente en el día 3, y latidos coordinados con una deflexión visible posterior al día 5, comience las mediciones funcionales y repita tantas veces como se desee.
NOTA: Es poco probable que los ECE que no hayan comenzado a golpear coordinadamente el día 7 lo hagan.
| Componente | Volumen (μL) | |||||||
| destilado H2O | 13.442 | 2,9 mg/ml de solución de colágeno | "Mezcla ECM" | mezcla final de células ECCh | ||||
| NaOH 1N | 0.638 | |||||||
| PBS 10x | 4.4 | |||||||
| 5 mg/ml de caldo de colágeno | 25.52 | |||||||
| 0,2 N pH 9 HEPES | 5.5 | |||||||
| 10x MEM | 5.5 | |||||||
| Volumen de la mezcla de ECM para transferir al gránulo de la célula | 35.2 | |||||||
| Volumen de Matrigel | 4.4 | |||||||
Tabla 2: Reactivos de TEC hemoroidal. Los componentes deben agregarse en el orden indicado y mantenerse en hielo.
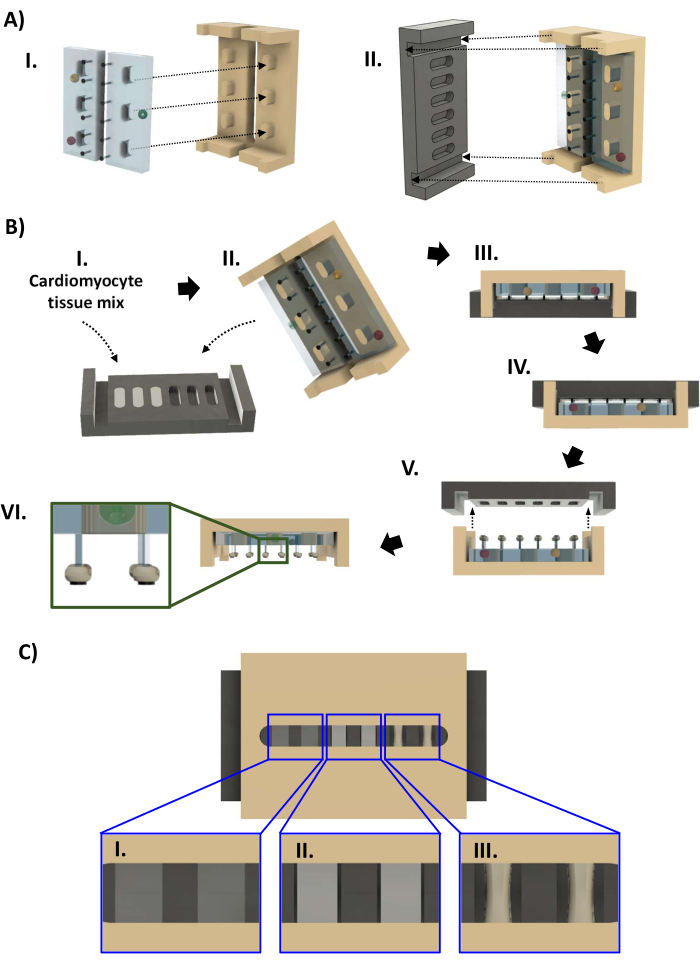
Figura 4: Montaje del biorreactor y fabricación de hECT. (A) (I) Dos bastidores PDMS (izquierda, azul claro) instalados en el marco de polisulfona (derecha, marrón). (II) A continuación, la placa base de PTFE (negro, izquierda) encaja en el bastidor (derecha) de modo que cada par de postes encaje en un hueco de la placa base. (B) (I) Se agregan cuarenta y cuatro microlitros de suspensión de cardiomiocitos en matriz extracelular a base de colágeno a cada uno de los seis pocillos de la placa base. (II, III) El bastidor con bastidores PDMS se ajusta a presión en la placa base. Después de 1 a 4 días, los TCE se pueden retirar de la placa base. (IV) Primero, el biorreactor se invierte antes de que (V) la placa base se levante del marco. (VI) Vista lateral del biorreactor con seis hECTs. Recuadro: vista ampliada que muestra la posición de hECT en los postes en relación con los SPoT (recuadro). (C) Representación CAD que muestra tres niveles de compactación hECT ([I] bajo, [II] medio y [III] alto) visto a través del espacio en el marco de polisulfona. Esta cifra fue modificada a partir de van Neste27. Abreviaturas: CAD = diseño asistido por ordenador; PDMS = polidimetilsiloxano; PTFE = politetrafluoroetileno; SPoT = rastreador de postes estable; hECT = tejido cardíaco humano modificado genéticamente. Haga clic aquí para ver una versión más grande de esta figura.
4. Equipo de estimulación ECTh
- Chaqueta para el escenario climatizado
- Utilice una máquina de corte por láser para cortar los componentes de la cubierta aislante acrílica de una lámina acrílica transparente de 0,635 cm de espesor (Archivo suplementario 3), uno de cada una de las Figuras 5A-D y dos de cada una de las Figuras 5E, F.
- Ensamble las piezas (B), (C), (D) y una de (E) de la Figura 5 y péguelas con pegamento acrílico como se muestra en la Figura 5GI. Coloque el panel superior (Figura 5GII), espere varias horas para que el pegamento se asiente y luego deslice la platina calentada en el costado de la chaqueta (Figura 5GIII).
- Una vez que la cubierta esté en su lugar, use cinta adhesiva para asegurar los insertos entre las patas del escenario calentado y agregue el panel frontal (Figura 5GIV) para terminar el ensamblaje (Figura 5GV).
- Fabricación de electrodos de grafito
- Corte barras de grafito de 6,25 mm de grosor y 25 mm de ancho con una sierra de cinta en bloques de 35 mm de largo; Luego, corte cada bloque a lo largo en una línea curva para que cada electrodo tenga 13-16 mm de altura en un extremo y 8-10 mm de altura en el otro extremo. Taladre dos agujeros de 0,7 mm de diámetro en la esquina superior (Figura 6AI). Pule las piezas con toallas de papel y sonicate en agua durante 20 minutos para eliminar el polvo de grafito. Asegúrese de que los electrodos encajen entre las paredes de la placa y el biorreactor de 25 mm de ancho para garantizar una distancia constante entre los electrodos (Figura 6AII).
- Pase un alambre de acero de 150 mm de largo x 0,25 mm de diámetro a través de los orificios de los electrodos y dóblelo para que encaje sobre el borde del plato de 60 mm y alrededor de las paredes del plato de 100 mm para que la tapa pueda cerrarse (Figura 6AII).
- Limpie los electrodos sumergiéndolos en agua destilada durante 1-2 h después de cada uso para eliminar cualquier medio absorbido, déjelos secar durante la noche y luego los autoclave a 132 °C durante 30 min. Antes de comenzar las mediciones, coloque un electrodo a cada lado del biorreactor (Figura 6AII). Coloque los cables de modo que se pueda cerrar la tapa del plato de 100 mm y devuelva el biorreactor a la incubadora para que se equilibre.
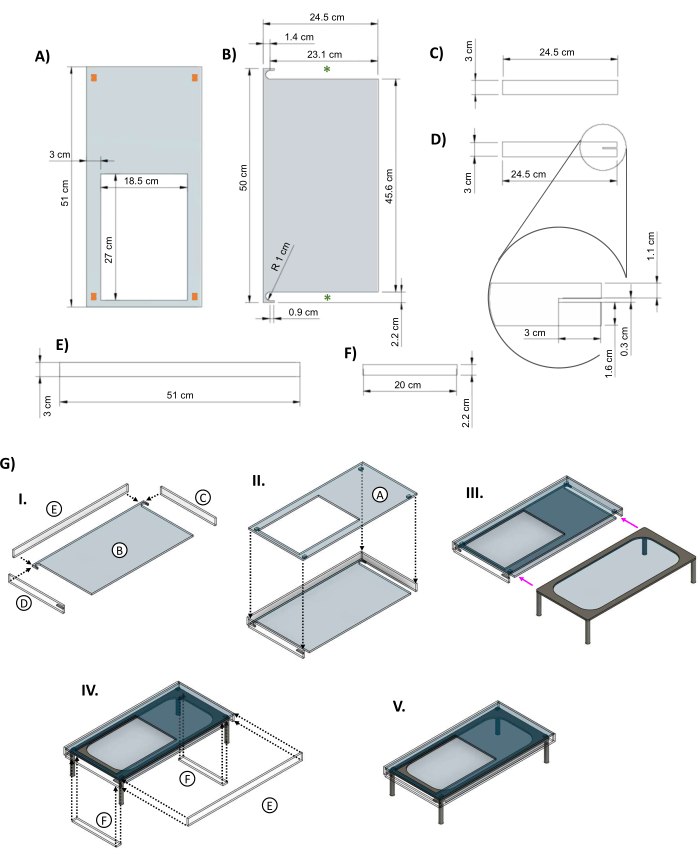
Figura 5: Cubierta acrílica para aislar la platina de vidrio calefactado. Imágenes CAD que muestran las dimensiones clave de las piezas de la cubierta acrílica diseñada para la mesa de cristal. (A) El panel superior tiene un orificio recortado de 27 cm x 18,5 cm para permitir que el plato del biorreactor se asiente sobre el elemento calefactor. Los rectángulos naranjas en las esquinas indican la colocación sugerida de pequeñas piezas espaciadoras para proporcionar espacio entre la parte superior de la chaqueta y el elemento calefactor. (B) La pieza inferior de la chaqueta tiene dos recortes para permitir que las patas del escenario calentado se deslicen hacia adentro (asteriscos verdes). (C&D) Dos paneles laterales encajan debajo de la pieza superior. (D) El panel lateral izquierdo incluye un recorte de 3 cm x 0,3 cm (recuadro) para el cable de alimentación del escenario. (E) Los paneles largos encajan en la parte delantera y trasera. (F) Se agregan insertos para llenar los huecos una vez que la mesa está dentro. (G) (I) Los paneles laterales y traseros se unen a la pieza inferior, y luego (II) se agrega el panel superior. (III) La mesa de cristal se desliza dentro de la cubierta (flechas magenta). (IV) Los insertos se fijan entre las patas de la mesa y la parte posterior encaja en la abertura para cerrar la caja. (V) El ensamblaje completo de la chaqueta. Esta cifra fue modificada a partir de van Neste27. Abreviaturas: CAD = diseño asistido por ordenador; R = radio; Ø = diámetro. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Adquisición de datos de la contracción de la TEC. (A) (I) Fotos de los electrodos cortados de barras de grafito. Las flechas magenta indican los orificios para sujetar los cables de acero inoxidable. Barra de escala = 1 cm. (II) Vista oblicua (izquierda) y vista superior (derecha) que muestra la colocación de los electrodos de grafito en el biorreactor. Los electrodos ocupan el espacio entre el biorreactor de 25 mm de ancho y la pared de la placa para garantizar una distancia constante entre los electrodos. Los alambres están doblados para permitir el cierre de la tapa del plato. (B) Foto de la configuración de estimulación de hECT dentro del banco limpio de flujo laminar: todo el equipo se coloca en la mesa de aislamiento de vibraciones para reducir el ruido de vibración del banco limpio. El biorreactor (punta de flecha magenta) se encuentra en el escenario calefactado encamisado, iluminado por una fuente de luz LED desde arriba. El microscopio de disección apunta horizontalmente a un espejo en ángulo recto (asterisco naranja) para ver el biorreactor desde abajo y está equipado con una cámara CCD (izquierda). El soporte turquesa indica un baño de agua para el monitoreo continuo de la temperatura para proporcionar retroalimentación al controlador de escenario calentado de circuito cerrado. Esta cifra fue modificada a partir de van Neste27. Abreviaturas: hECT = tejido cardíaco humano modificado; LED = diodo emisor de luz. Haga clic aquí para ver una versión más grande de esta figura.
5. Mediciones funcionales de la TEC
- Configuración del espacio de trabajo de ritmo
- Encienda la platina calentada a 39,5 °C y coloque el equipo de estimulación en una mesa de aislamiento de vibraciones dentro de un banco de limpieza de flujo laminar de acuerdo con la Figura 6B. Monte el microscopio de disección en un soporte de brazo y apúntelo a un espejo en ángulo recto (Figura 6B, asterisco naranja) ubicado en un conector de laboratorio debajo de la mesa de vidrio para ver el biorreactor desde abajo. Coloque una cámara CCD de alta velocidad en el microscopio y conéctela a la computadora. Irradie la instalación con luz ultravioleta durante 15 minutos para esterilizar el espacio de trabajo.
- Coloque el biorreactor (Figura 6B, punta de flecha magenta) en la platina calefactada encamisada, iluminada por una fuente de luz LED de cuello de cisne de doble cabezal desde arriba (los cuellos de las lámparas LED se pueden sujetar de forma más segura a la unidad principal en comparación con las lámparas de fibra óptica). Minimice el ruido adicional asegurándose de que el equipo de estimulación en la mesa vibratoria (y la mesa en sí) no toque ninguna parte del banco de limpieza de flujo laminar.
- Agregue un segundo plato de 60 mm lleno de agua precalentada dentro de un plato de 100 mm sobre la mesa calentada (Figura 6B, soporte turquesa) y equipe con una sonda de temperatura para el monitoreo continuo de la temperatura. Ajuste el ajuste de temperatura de la platina calentada según sea necesario para mantener la temperatura del plato de referencia a 36-37 °C.
- Ajuste el aumento del microscopio a 1,5x (u otro aumento deseado con el que se pueda visualizar una ECTh en su totalidad con una resolución adecuada).
- Ajuste de la configuración de la cámara
- Abra el software de la cámara. Cambie el tamaño de la transmisión de vídeo para recortar el campo de visión tanto como sea posible sin dejar de visualizar una hECT completa. Esto maximiza la velocidad de la cámara.
- Establezca la velocidad de captura en 90 fotogramas por segundo. Ajuste el tiempo de exposición y la posición de la fuente de luz para optimizar la uniformidad de las condiciones de iluminación en todo el campo de visión y maximizar el contraste de los SPoT.
- Configuración del software de adquisición
- Encienda el estimulador de pulsos cuadrado y conéctelo a la computadora. Ajuste la configuración para entregar pulsos bifásicos con una amplitud de 12 V y una duración de 5 ms.
- Abra el software de adquisición de datos y, a continuación, abra el archivo "AutomatedPostTracking3.vi" (Archivo complementario 4). Una vez que se cargue, haga clic en la flecha blanca en el lado izquierdo de la barra de herramientas para inicializar el programa (Figura 7A).
- Calibre el software con un hemocitómetro de vidrio en la platina calentada. En la barra de herramientas (Figura 7B), haga clic en la herramienta de línea para dibujar una línea a lo largo de 1 mm de las marcas del hemocitómetro (no se muestra). En el cuadro Calibración de distancia (píxeles/mm) (Figura 7C), establezca la Longitud de referencia (mm) en 1 y, a continuación, haga clic en el botón Calcular .
- Mida el área de la sección transversal de la TEC utilizando la herramienta de línea para dibujar una línea a lo ancho del tejido. Haga clic en el 1 en el cuadro Área de la sección transversal (mm^2) (Figura 7D) para calcular el área (asumiendo una geometría cilíndrica de las tiras de tejido lineales, según lo establecido en la literatura 1,2,3,4,5,6,7,8,9,10,11, 12,15,16,18,19,20,
21,22,23,24,25,26,37,38). Repita a lo largo de diferentes partes del hECT y registre los valores debajo de los otros dos botones del cuadro. El archivo de tabla de datos de salida informa el promedio de estos tres valores para calcular el diámetro del tejido.
- Caracterización funcional de la TEC
- Asegúrate de que los consejos de las publicaciones estén enfocados. Encienda el interruptor de umbral (Figura 7E) y ajuste el control deslizante (Figura 7F) hasta que los SPoT (Figura 7G) estén bien demarcados y no cambien de forma a medida que se contrae la hECT.
- Use la herramienta de rectángulo para dibujar un rectángulo alrededor de uno de los SpoT (Figura 7, rectángulo verde) y haga clic en el botón Establecer 1 dentro del cuadro Límites de la publicación (Figura 7H) para establecer la posición del rectángulo alrededor del SPoT, asegurándose de que el SPoT permanezca dentro del límite del rectángulo en todo momento. Repita para la otra publicación y grábela en el Conjunto 2.
- Ajuste la configuración del tamaño del objeto (Figura 7I) para evitar que el programa realice un seguimiento de los objetos más pequeños. Asegúrese de que el número de objetos de los que se realiza un seguimiento en cada rectángulo permanezca constante. La interfaz (Figura 7J) muestra la distancia medida entre los objetos rastreados en tiempo real. Utilice este gráfico para controlar el ruido.
- Seleccione un directorio para guardar los archivos (Figura 7K). Almacene los datos de diferentes días en carpetas separadas. Seleccione el número de tejido actual y escriba los comentarios deseados en el cuadro Comentarios .
- Debajo del encabezado Frecuencia de estimulación (Hz) (Figura 7L), indique el rango de frecuencias deseadas (Min y Max) y el intervalo deseado para pasar de Min a Max. Si se controlan los ECTh en todo su rango de captura, pruebe diferentes frecuencias de estimulación para encontrar la frecuencia más baja en la que se logra una relación estímulo:pico de 1:1 y continúe aumentando la frecuencia hasta que se pierda esa relación. Mida la función espontánea eligiendo un rango de frecuencia arbitrario (por ejemplo, de 0,01 Hz a 0,01 Hz) y manteniendo apagada la salida del estimulador de pulsos cuadrados.
- En los cuadros de la derecha, elija el tiempo de ajuste deseado (un intervalo de tiempo después de que se haya establecido la frecuencia pero no se hayan registrado los datos) para permitir que la hECT se ajuste a la nueva frecuencia de estimulación. Especifique el tiempo de grabación (s) y el voltaje de estimulación (V). Inicie el programa haciendo clic en el botón Iniciar programa (Figura 7M).
NOTA: Los resultados se guardan automáticamente en el directorio seleccionado. Después de cada grabación, observe que el script muestra la transformación de Fourier de los datos (Figura 7N), donde los picos corresponden a la frecuencia de batido detectada. - Si lo desea, ejecute el programa "Excitation Threshold Finding" para encontrar el voltaje mínimo requerido para estimular la hECT a la vista (Figura 7O). Si lo desea, calcule las deflexiones máximas y mínimas de los postes (Figura 7P).
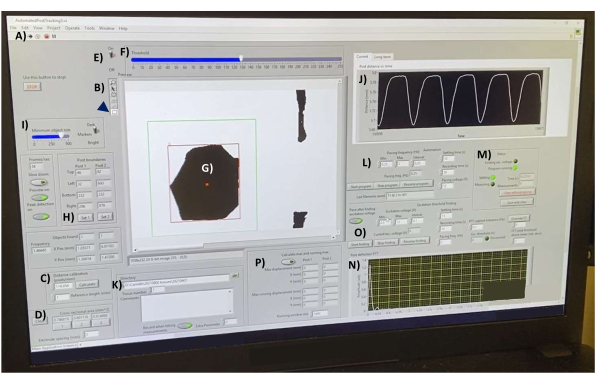
Figura 7: Interfaz de adquisición de datos posterior a la deflexión. (A) Botón para ejecutar el software. (B) Barra de herramientas que contiene las herramientas de línea y rectángulo para las medidas de longitud y la selección de objetos, respectivamente. (C) Controles de calibración de distancia. (D) Herramientas para medir el área de la sección transversal de la TEC en tres puntos diferentes. (E) Interruptor de umbral y control deslizante (F) para convertir la transmisión de video en imágenes de alto contraste en tiempo real. (G) Un SPoT visible en la ventana de vista previa. (H) Herramientas para seleccionar los SPoT. (I) Control deslizante para filtrar los objetos por tamaño. (J) Gráfico que muestra la distancia medida entre los objetos rastreados en tiempo real. (K) Opciones para seleccionar el directorio para guardar los archivos de salida. (L) Opciones para ajustar el rango de frecuencia, el intervalo de frecuencia, el tiempo de grabación y el tiempo de ajuste entre grabaciones para el programa de seguimiento posterior (M). (N) Salida gráfica de la transformación de Fourier de la curva de deflexión de la última grabación guardada. (O) Programa para encontrar el voltaje mínimo requerido para estimular las hECTs. (P) Programa para calcular las flechas máximas y mínimas de los postes. Abreviaturas: hECT = tejido cardíaco humano modificado; SPoT = rastreador de publicaciones estable. Haga clic aquí para ver una versión más grande de esta figura.
6. Medidas del bastidor PDMS
- Distancias descargadas
- Antes de la fabricación de hECT, monte el par deseado de bastidores PDMS en un marco. Utilice la configuración de estimulación y el software descritos en el paso 5.1 para las mediciones funcionales. Seleccione los SPoT estacionarios en los extremos de las publicaciones.
- Ajuste la fuente de luz y/o el umbral si es necesario para reducir el ruido a <2 μm. Registre el valor y promedio en vivo indicado en el gráfico en una hoja de cálculo.
- Alturas de poste y alturas hECT
- De la configuración de estimulación descrita en el paso 5.2, retire el espejo en ángulo y la platina calefactada. Coloque el biorreactor directamente en el conector de laboratorio para obtener una vista lateral del biorreactor.
- Abra el software de la cámara. Ajuste el tiempo de exposición y la posición de la fuente de luz para optimizar la uniformidad de las condiciones de iluminación en todo el campo de visión y maximizar la visibilidad de las publicaciones.
- Abra el software de adquisición de datos y, a continuación, abra el archivo "PostMeasurement_PB3.vi" (Archivo complementario 5). Una vez que se cargue, haga clic en la flecha blanca en el lado izquierdo de la barra de herramientas para inicializar el programa.
- Calibre el software con un hemocitómetro de vidrio. Haga clic en la herramienta de línea en la barra de herramientas vertical a la izquierda de la ventana de visualización y dibuje una línea a lo largo de 1 mm de las marcas del hemocitómetro. En el cuadro Calibración de distancia (píxeles/mm) en la parte inferior izquierda de la pantalla, establezca la Longitud de referencia (mm) en 1 y luego haga clic en el botón Calcular .
- Debajo de los campos de calibración, establezca el número de tejido deseado (para su identificación) en el campo Número de tejido . Enfoca la cámara en el poste izquierdo del hECT y selecciona Izquierda en el cuadro Lado del poste .
- Use la herramienta de línea para dibujar una línea desde la base del poste (arriba) hasta la punta de los SPoT (abajo) y registre haciendo clic en Medir la altura del poste.
- Dibuje una línea desde la base del poste hasta el borde más alejado de la hECT y registre haciendo clic en Medir la parte superior del tejido Ht. Dibuje una línea desde la base del poste hasta el borde cercano de la hECT y registre haciendo clic en Medir la base del tejido Ht.
- En este punto, gire el biorreactor para medir la altura del poste derecho. Seleccione la opción de publicación correcta para registrar las mismas medidas. Haga clic en el botón Agregar para completar la hoja de cálculo con los valores medidos y calcular automáticamente la altura promedio de la hECT, que se utilizará en el paso 7.
- Una vez que haya terminado de registrar las alturas de los tejidos, haga clic en el botón Guardar para guardar los valores en un archivo de texto.
7. Procesamiento funcional de datos mediante scripts de análisis personalizados
- En un editor de hojas de cálculo, rellene el archivo de resumen utilizando la plantilla (Archivo complementario 6). Utilice los valores de longitud del poste y altura media del tejido adquiridos en los pasos 6.2. Asegúrese de que todos los hECT que tienen datos en la carpeta estén representados en el archivo de resumen. Asigne al archivo el nombre "resumen #.csv", donde # hace referencia al número de días del experimento.
NOTA: Los datos funcionales de hECT deben estar en carpetas separadas de acuerdo con el día del experimento. - Asegúrese de que la carpeta que contiene los scripts AnalyzeLogsGUI (archivo complementario 7) y la carpeta con las grabaciones hECT se agreguen a la ruta.
- Abra el software de análisis de datos. A la izquierda de la barra de directorios, haga clic en el botón Buscar carpeta para navegar a la carpeta principal que contiene tanto la carpeta AnalyzeLogsGUI como los datos funcionales de hECT. En la barra lateral Ventana actual , haga clic con el botón derecho en estas carpetas para Agregar a la ruta | Agregue carpetas y subcarpetas seleccionadas.
- Abra el archivo "AnalyzeLogsGui_SC.m". En la pestaña Editor, presione el botón Ejecutar y espere a que la interfaz gráfica de usuario (GUI) aparezca en una nueva ventana.
- En el cuadro Selección de registro (Figura 8AI), haga clic en el botón Seleccionar directorio y navegue hasta la carpeta que incluye los datos funcionales de hECT. Seleccione la TEC que desea procesar en el menú desplegable Tejido .
- En el cuadro Entradas de datos (Figura 8AII), ingrese la distancia descargada entre los postes registrados en los pasos 6.1 en el campo Distancia diastólica. Introduzca 0,25 en el campo Radio de publicación (mm).
- En el cuadro Restricciones de análisis (Figura 8AIII), elija las frecuencias que desea omitir del análisis o seleccione las frecuencias específicas que desea incluir (separadas por comas). La hora de inicio y la hora de finalización se establecen en 0 y −1, respectivamente, de forma predeterminada para procesar toda la duración de las grabaciones. Cambie estos valores para recortar las grabaciones si es necesario.
- Cambie los parámetros de filtro (Figura 8AIV) de Orden polinómico y Tamaño de fotograma para modificar el nivel de suavizado durante el proceso de filtrado y el control deslizante Umbral de detección de picos para establecer el tamaño de pico mínimo que reconocerán los scripts.
NOTA: El script contiene la opción Eliminación de picos, que recorta picos altos causados por artefactos; Sin embargo, esto no se recomienda, ya que cambia la forma de los espasmos. En su lugar, elimine los artefactos recortando la grabación (Figura 8AIII). - Utilice opciones adicionales (Figura 8AV) para obtener resultados de análisis de datos adicionales: análisis posterior a la deflexión para ejecutar un algoritmo de detección de picos adicional, Escalado automático del eje Y en gráficos de zoom para ajustar automáticamente los ejes de la curva de fuerza de contracción (Figura 8B), Guardar curvas de trazado de fuerza para guardar cada figura de fuerza de contracción en un archivo .fig y Guardar datos de tiempo de fuerza para guardar las coordenadas x e y de los datos filtrados trazados en la figura de la curva de fuerza de contracción.
- Haga clic en Ejecutar análisis para generar un archivo de .txt que contenga los atributos de la curva de fuerza de contracción (Archivo complementario 8) promediados en toda una grabación.
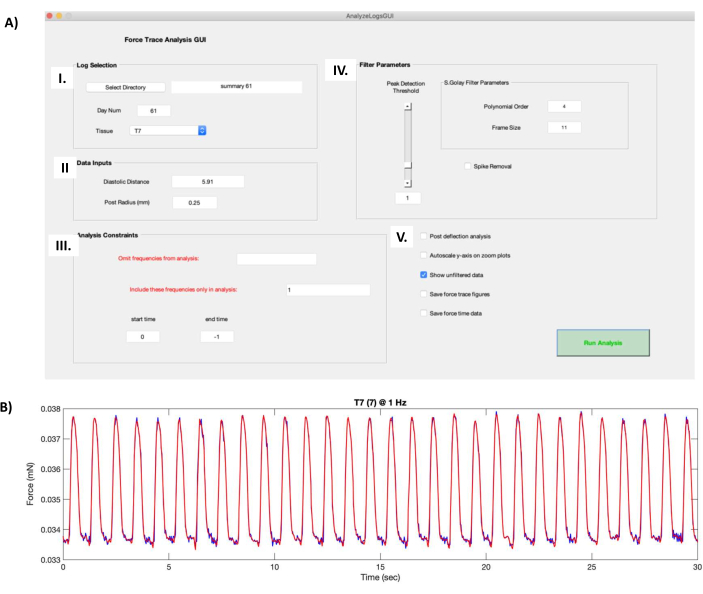
Figura 8: Cálculos de la curva de fuerza de contracción. (A) Al ejecutar el archivo "AnalyzeLogsGUI.m" en el software de procesamiento de datos, se abre la ventana de la interfaz gráfica de usuario. (I) El cuadro Selección de registro permite al usuario seleccionar el directorio de la carpeta que contiene los datos funcionales de hECT. El campo Número de día se rellena automáticamente a partir del título del archivo de resumen creado en el paso 7.1 del protocolo. La TEC que se va a procesar se selecciona mediante el menú desplegable Tejido . (II) El cuadro Entradas de datos contiene información sobre el par de postes PDMS que soportan el hECT, como la distancia en vacío (obtenida en el paso 6.1 del protocolo) y el radio del poste (0,25 mm). (III) El cuadro Restricciones de análisis permite al usuario elegir las frecuencias que desea omitir o incluir y recortar las grabaciones. (IV) El cuadro de parámetros de filtro contiene las opciones para elegir cómo se filtra la curva de fuerza de contracción sin procesar. El orden polinómico y el tamaño de fotograma cambian el nivel de suavizado durante el proceso de filtrado. El control deslizante Umbral de detección de picos decide el tamaño mínimo de pico que reconocerán los scripts. La opción Eliminación de picos recorta picos altos causados por artefactos. (V) Las opciones adicionales incluyen el análisis posterior a la deflexión, que ejecuta un algoritmo de detección de picos adicional, el eje Y de escalado automático en los gráficos de zoom, que actúa sobre la curva de fuerza de contracción, Guardar curvas de seguimiento de fuerza, que guarda las cifras de fuerza de contracción y Guardar datos de tiempo de fuerza, que guarda los datos de fuerza de contracción trazados. (B) Ejemplo de la curva de fuerza de contracción de una grabación de 30 s de una ECTh a ritmo de 1 Hz producida por la captura de pantalla de la GUI del panel A. La curva roja de fuerza de contracción muestra la fuerza filtrada producida por los parámetros en AIV, superpuesta a la curva de fuerza de contracción sin procesar (curva azul oscuro, aparece cuando se selecciona la opción Mostrar datos sin filtrar en AV ). Abreviaturas: hECT = tejido cardíaco humano modificado; GUI = interfaz gráfica de usuario; PDMS = polidimetilsiloxano. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Siguiendo el protocolo anterior, se generaron cardiomiocitos a partir de una línea de iPSC sana utilizada previamente por nuestro grupo 9,15 y se fabricaron en TEC después de 8-61 días en cultivo. La Figura 9A muestra imágenes representativas de los TEC vistos desde abajo, que se crearon sin (arriba) y con (abajo) SPoT. Las mediciones funcionales se tomaron a temperatura ambiente (23 °C) y a temperatura fisiológica (36 °C) ent...
Discusión
Existen numerosos modelos de tejido cardíaco de ingeniería lineal publicados en la literatura, algunos de los cuales se describen en la Tabla 1. Algunos modelos implican la medición directa de la fuerza tisular, pero estos típicamente requieren la transferencia de la construcción a un baño muscular separado38. La mayoría de los modelos están diseñados con los tejidos anclados permanentemente en ambos extremos, más comúnmente a los postes PDMS
Divulgaciones
K.D.C. es cofundador y director científico de Novoheart y posee el capital social de la empresa medidora Biopharmaceutical. Novoheart no contribuyó a la financiación, planificación o ejecución de este estudio; sin embargo, los resultados del estudio podrían tener un impacto financiero en Novoheart y Medera. Los demás autores declaran que no tienen intereses contrapuestos.
Agradecimientos
Los autores agradecen al Dr. Timothy Cashman por su trabajo previo en este método. Este estudio fue financiado por los Institutos Nacionales de Salud (NIH, por sus siglas en inglés) (R01-HL132226 y K01 HL133424) y el Programa de Redes Internacionales de Excelencia de la Fundación Leducq (CURE-PLaN).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.25 mm diamete 304 Stainless Steel Wire | McMaster Carr | 6517K61 | |
| 0.25% trypsin-EDTA | Gibco | 25200056 | |
| 1.7 mL Microtubes | Axygen | MCT-175-C | |
| 10 cm dishes (20 mm tall) | Corning | 353003 | |
| 10 mL Serological Pipette | Drummond | 6-000-010 | |
| 10 N NaOH | Fisher Scientific | SS225-1 | dilute 1:10 in sterile distilled water |
| 10X Modified Eagle Medium | Sigma Aldrich | M0275 | |
| 20 - 200 μL Micropipette | Eppendorf | 3123000055 | |
| 200 μL MicroPipette Tips | VWR | 76322-150 | |
| 5 mL Serological Pipette | Drummond | 6-000-005 | |
| 50 mL Conical Centrifuge Tubes | Falcon | 352070 | |
| 6 cm Petri Dish | Corning | 353002 | |
| 6 Watt LED Dual Gooseneck Illuminator | AmScope | LED-6W | |
| 6-Well Plates | Corning | 353046 | |
| 90 degree angle mirror | Edmund Optics | 45-594 | |
| Acrylic bonding glue | SCIGRIP | #4 | |
| Adjustable 10 cm x 10 cm jack | Fisher Scientific | 14-673-50 | |
| Aluminum 6061 | McMaster Carr | 9008K82 | |
| A-Plan 10X Objective Lens | ZEISS | 1020-863 | |
| Autoclave Bags | Propper | 21002 | |
| B-27 supplement | ThermoFisher | 17504044 | |
| B-27 supplement (without insulin) | ThermoFisher | A1895601 | |
| Benchtop Centrifuge | Eppendorf | 5810 R | |
| Black ABS | Ultimaker | 2.85 mm wide | |
| Bovine Collagen I | Gibco | A1064401 | |
| CHIR99021 | Tocris | 4423 | |
| Class II Biosafety Cabinet | Labconco | 3430009 | |
| Clear Acrylic Sheeting | estreetplastics | 1002502436 | 6.25 mm thick |
| CNC Vertical Mill | Haas | VF-1 | |
| Conductive Graphite Bars | McMaster Carr | 1763T33 | |
| Dissection microscope | Olympus | SZ61 | |
| Dulbecco's Modified Eagle Medium/Ham's F-12 Nutrient Mix | ThermoFisher | 11330032 | |
| Ethanol | Fisher Scientific | A4094 | Dilute to 70% in water |
| EVE Automated Cell counter | NanoEntek | E1000 | |
| EVE Cell Counting Slide | NanoEntek | EVS-050 | |
| Fetal Bovine Serum | Life Technologies | 10438026 | |
| Fine Curved Forceps | Fine Science Tools | 11253-25 | |
| Forma Series II Water Jacketed CO2 Incubator | Thermo Electron Corporation | 3110 | AKA "incubator". With HEPA class 100 filter |
| Fusion360 software | Autodesk | AKA "CAD software" | |
| Glass Hemocytometer | Reichert | 1475 | 0.1 mm deep |
| HEPES | Sigma Aldrich | H3784 | |
| hESC qualified matrigel | Corning | 354277 | AKA "basement membrane matrix". Store in frozen aliquots |
| High Speed CCD Camera | PixelLINK | P7410 | |
| Inverted Microscope | Carl Zeiss Werk | Axiovert 40 CFL | 10X phase contrast objective |
| IWR-1 | Selleck Chem | S7086 | |
| LabView Software | National Instruments | 2016 | |
| Laminar flow clean bench | NuAire | NU-201-330 | necessary for hECT functional analysis |
| Laptop | AsusTek | Strix | Intel Core i& processor ,CPU 2.8GHz, 16GB RAM |
| Laser Cutting Machine | Epilog | Helix 24 | |
| Magnification headset | ExcelBlades | 70020 | Recommended for steps requiring fine manipulations |
| Matlab | Mathworks | Version 2019b or later | AKA "data analysis software" |
| Micro Vannas Scissors, 3 mm blade | WPI Instruments | 501839 | |
| Microscope Boom Stand | Olympus | SZ2-STU1 | |
| Penicillin-Streptomycin stock solution | ThermoFisher | 15140122 | 10,000 IU/ml penicillin; 10,000 μg/ml streptomycin |
| Phosphate-buffered saline without divalent cations | Sigma Aldrich | P3813 | Diluted in distilled water to 1X and 10X concentrations |
| Pipette Controller | Drummond | 4-000-100 | |
| PixelLINK Capture OEM | PixelLINK | 10.2.1.6 | AKA "Camera Software" |
| Polysulfone | McMaster Carr | 86735K73 | translucent amber color |
| Polytetrafluoroethylene (PTFE) | McMaster Carr | 8545K176 | Black, molded |
| ReLeSR | Stem Cell Technologies | 5872 | AKA "iPSC dissociation media" |
| Rosewell Park Memorial Institute 1640 Media | ThermoFisher | 11875135 | |
| Silicone Sheeting | SMI manufacturing | glossy, 0.02 in thickness, durometer 40 | |
| Size 10/0 Blue, Green, Red, and Yellow Glass Seed Beads | Michael's | color should withstand autoclaving | |
| Spatula | Fisher Scientific | 14-373 | used for mixing PDMS |
| Square Pulse Stimulator | Astro-Med / Grass Technologies | S88X | |
| Stainless Steel Razoblades | GEM | 62-0179-CTN | preferred over non-stainless steel due to lower hardness |
| Stemflex | ThermoFisher | A3349401 | AKA "iPSC culture media" |
| Sterile distilled water | ThermoFisher | 5230 | |
| Sylgard 170 - Silicone Elastomer Encapsulant Black 0.9 kg Kit | Dow | DOWSIL 170 2LB KIT | AKA black Polydimethylsiloxane (black PDMS) |
| Sylgard 184 - Silicone Elastomer Clear 1 lb Kit | Dow | DC 184 SYLGARD 0.5KG 1.1LB KIT | AKA Polydimethylsiloxane (PDMS) |
| Temperature-controlled heated stage | Okolab | H401-HG-SMU | Set height to 10 cm |
| Thermoplastic 3D printer | Ultimaker | Ultimaker 3 | |
| Thiazovivin | Selleck Chem | S1459 | |
| Trypan Blue | NanoEntek | EBT-001 | |
| Vacuum Chamber | Bel-Art Parts | F42027-0000 | |
| Variable Speed Mini Band Saw | Micro-Mark | 82203 | |
| Variable Speed Miniature Drill Press | Micro-Mark | 82959 | |
| Vibration Isolation Table | Labconco | 3618000 | |
| Weighing Boats | VWR | 10803-140 | |
| Talon Cylinder Bench Clamp | VWR | 97035-528 | AKA screw clamp |
Referencias
- Serrao, G. W., et al. Myocyte-depleted engineered cardiac tissues support therapeutic potential of mesenchymal stem cells. Tissue Engineering. Part A. 18 (13-14), 1322-1333 (2012).
- Turnbull, I. C., et al. Advancing functional engineered cardiac tissues toward a preclinical model of human myocardium. FASEB Journal. 28 (2), 644-654 (2014).
- Cashman, T. J., et al. Construction of defined human engineered cardiac tissues to study mechanisms of cardiac cell therapy. Journal of Visualized Experiments. (109), e53447 (2016).
- Stillitano, F., et al. Genomic correction of familial cardiomyopathy in human engineered cardiac tissues. European Heart Journal. 37 (43), 3282-3284 (2016).
- Mayourian, J., et al. Experimental and computational insight into human mesenchymal stem cell paracrine signaling and heterocellular coupling effects on cardiac contractility and arrhythmogenicity. Circulation Research. 121 (4), 411-423 (2017).
- Mayourian, J., et al. therapeutic paracrine modulation of cardiac excitation-contraction coupling. Circulation Research. 122 (1), 167-183 (2018).
- Mayourian, J., et al. Exosomal microRNA-21-5p mediates mesenchymal stem cell paracrine effects on human cardiac tissue contractility. Circulation Research. 7 (122), 933-944 (2018).
- Turnbull, I. C., et al. Cardiac tissue engineering models of inherited and acquired cardiomyopathies. Methods in Molecular Biology. 1816, 145-159 (2018).
- Murphy, J. F., et al. Adult human cardiac stem cell supplementation effectively increases contractile function and maturation in human engineered cardiac tissues. Stem Cell Research & Therapy. 10 (1), 373 (2019).
- Breckwoldt, K., et al. Differentiation of cardiomyocytes and generation of human engineered heart tissue. Nature Protocols. 12 (6), 1177-1197 (2017).
- Huang, C. Y., et al. Enhancement of human iPSC-derived cardiomyocyte maturation by chemical conditioning in a 3D environment. Journal of Molecular and Cellular Cardiology. 138, 1-11 (2020).
- Ramade, A., Legant, W. R., Picart, C., Chen, C. S., Boudou, T. Microfabrication of a platform to measure and manipulate the mechanics of engineered microtissues. Methods in Cell Biology. 121, 191-211 (2014).
- Ronaldson-Bouchard, K., et al. Engineering of human cardiac muscle electromechanically matured to an adult-like phenotype. Nature Protocols. 14 (10), 2781-2817 (2019).
- Tamargo, M. A., et al. milliPillar: A platform for the generation and real-time assessment of human engineered cardiac tissues. ACS Biomaterials Science & Engineering. 7 (11), 5215-5229 (2021).
- Ceholski, D. K., et al. CXCR4 and CXCR7 play distinct roles in cardiac lineage specification and pharmacologic β-adrenergic response. Stem Cell Research. 23, 77-86 (2017).
- Bliley, J. M., et al. Dynamic loading of human engineered heart tissue enhances contractile function and drives a desmosome-linked disease phenotype. Science Translational Medicine. 13 (603), (2021).
- Ribeiro, M. C., et al. A new versatile platform for assessment of improved cardiac performance in human-engineered heart tissues. Journal of Personalized Medicine. 12 (2), 214 (2022).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Mannhardt, I., et al. Human engineered heart tissue: Analysis of contractile force. Stem Cell Reports. 7 (1), 29-42 (2016).
- Mannhardt, I., et al. Blinded contractility analysis in hiPSC-cardiomyocytes in engineered heart tissue format: Comparison with human atrial trabeculae. Toxicological Sciences. 158 (1), 164-175 (2017).
- Saleem, U., et al. Force and calcium transients analysis in human engineered heart tissues reveals positive force-frequency relation at physiological frequency. Stem Cell Reports. 14 (2), 312-324 (2020).
- Thavandiran, N., et al. Functional arrays of human pluripotent stem cell-derived cardiac microtissues. Scientific Reports. 10 (1), 6919 (2020).
- Bielawski, K. S., Leonard, A., Bhandari, S., Murry, C. E., Sniadecki, N. J. Real-time force and frequency analysis of engineered human heart tissue derived from induced pluripotent stem cells using magnetic sensing. Tissue Engineering. Part C, Methods. 22 (10), 932-940 (2016).
- Leonard, A., et al. Afterload promotes maturation of human induced pluripotent stem cell derived cardiomyocytes in engineered heart tissues. Journal of Molecular and Cellular Cardiology. 118, 147-158 (2018).
- Bose, P., Huang, C. Y., Eyckmans, J., Chen, C. S., Reich, D. H. Fabrication and mechanical properties measurements of 3D microtissues for the study of cell-matrix interactions. Methods in Molecular Biology. 1722, 303-328 (2018).
- Zhang, W., et al. Maturation of human embryonic stem cell-derived cardiomyocytes (hESC-CMs) in 3D collagen matrix: Effects of niche cell supplementation and mechanical stimulation. Acta Biomaterialia. 49, 204-217 (2017).
- van Neste, C. Advances in bioreactor design and multi-dimensional analysis for assessing maturation phenotype of human engineered cardiac tissues. PhD thesis. Icahn School of Medicine at Mount Sinai. , (2022).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Salazar, B. H., Cashion, A. T., Dennis, R. G., Birla, R. K. Development of a cyclic strain bioreactor for mechanical enhancement and assessment of bioengineered myocardial constructs. Cardiovascular Engineering and Technology. 6 (4), 533-545 (2015).
- Putame, G., et al. Application of 3D printing technology for design and manufacturing of customized components for a mechanical stretching bioreactor. Journal of Healthcare Engineering. 2019, 3957931 (2019).
- Akintewe, O. O., Roberts, E. G., Rim, N. -. G., Ferguson, M. A. H., Wong, J. Y. Design approaches to myocardial and vascular tissue engineering. Annual Review of Biomedical Engineering. 19, 389-414 (2017).
- Chen, G., et al. Phospholamban as a crucial determinant of the inotropic response of human pluripotent stem cell-derived ventricular cardiomyocytes and engineered 3-dimensional tissue constructs. Circulation. Arrhythmia and Electrophysiology. 8 (1), 193-202 (2015).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Beauchamp, P., et al. 3D co-culture of hiPSC-derived cardiomyocytes with cardiac fibroblasts improves tissue-like features of cardiac spheroids. Frontiers in Molecular Biosciences. 7, 14 (2020).
- Campostrini, G., et al. functional analysis and applications of isogenic three-dimensional self-aggregating cardiac microtissues from human pluripotent stem cells. Nature Protocols. 16 (4), 2213-2256 (2021).
- Swiatlowska, P., Iskratsch, T. Tools for studying and modulating (cardiac muscle) cell mechanics and mechanosensing across the scales. Biophysical Reviews. 13 (5), 611-623 (2021).
- Zhao, Y., et al. Engineering microenvironment for human cardiac tissue assembly in heart-on-a-chip platform. Matrix Biology. 85-86, 189-204 (2020).
- Fujiwara, Y., Deguchi, K., Miki, K., Nishimoto, T., Yoshida, Y. A method for contraction force measurement of hiPSC-derived engineered cardiac tissues. Methods in Molecular Biology. 2320, 171-180 (2021).
- Wang, E. Y., et al. Biowire model of interstitial and focal cardiac fibrosis. ACS Central Science. 5 (7), 1146-1158 (2019).
- Zhao, Y., et al. A platform for generation of chamber-specific cardiac tissues and disease modeling. Cell. 176 (4), 913-927 (2019).
- Lee, E. K., et al. Machine learning of human pluripotent stem cell-derived engineered cardiac tissue contractility for automated drug classification. Stem Cell Reports. 9 (5), 1560-1572 (2017).
- Batalov, I., Feinberg, A. W. Differentiation of cardiomyocytes from human pluripotent stem cells using monolayer culture. Biomarker Insights. 10, 71-76 (2015).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), E1848-E1857 (2012).
- Penefsky, Z. J., Buckley, N. M., Litwak, R. S. Effect of temperature and calcium on force-frequency relationships in mammalian ventricular myocardium. Pflugers Archiv. 332 (4), 271-282 (1972).
- Bers, D. M. . Excitation-Contraction Coupling and Cardiac Contractile Force. , (2001).
- Kanaya, N., Gable, B., Wickley, P. J., Murray, P. A., Damron, D. S. Experimental conditions are important determinants of cardiac inotropic effects of propofol. Anesthesiology. 103 (5), 1026-1034 (2005).
- Galende, E., et al. Amniotic fluid cells are more efficiently reprogrammed to pluripotency than adult cells. Cellular Reprogramming. 12 (2), 117-125 (2010).
- Wacker-Gussmann, A., Strasburger, J. F., Cuneo, B. F., Wakai, R. T. Diagnosis and treatment of fetal arrhythmia. American Journal of Perinatology. 31 (7), 617-628 (2014).
- Federmann, M., Hess, O. M. Differentiation between systolic and diastolic dysfunction. European Heart Journal. 15, 2-6 (1994).
- Knight, W. E., et al. Maturation of pluripotent stem cell-derived cardiomyocytes enables modeling of human hypertrophic cardiomyopathy. Stem Cell Reports. 16 (3), 519-533 (2021).
- Ma, Z., et al. Contractile deficits in engineered cardiac microtissues as a result of MYBPC3 deficiency and mechanical overload. Nature Biomedical Engineering. 2 (12), 955-967 (2018).
- de Lange, W. J., et al. Human iPSC-engineered cardiac tissue platform faithfully models important cardiac physiology. American Journal of Physiology. Heart and Circulatory Physiology. 320 (4), H1670-H1686 (2021).
- Hiranandani, N., Varian, K. D., Monasky, M. M., Janssen, P. M. L. Frequency-dependent contractile response of isolated cardiac trabeculae under hypo-, normo-, and hyperthermic conditions. Journal of Applied Physiology. 100 (5), 1727-1732 (2006).
- Puglisi, J. L., Bassani, R. A., Bassani, J. W., Amin, J. N., Bers, D. M. Temperature and relative contributions of Ca transport systems in cardiac myocyte relaxation. The American Journal of Physiology. 270 (5), H1772-H1778 (1996).
- Puglisi, J. L., Yuan, W., Bassani, J. W., Bers, D. M. Ca(2+) influx through Ca(2+) channels in rabbit ventricular myocytes during action potential clamp: Influence of temperature. Circulation Research. 85 (6), e7-e16 (1999).
- Li, R. A., et al. Bioengineering an electro-mechanically functional miniature ventricular heart chamber from human pluripotent stem cells. Biomaterials. 163, 116-127 (2018).
- Sharma, A., et al. Biomanufacturing in low Earth orbit for regenerative medicine. Stem Cell Reports. 17 (1), 1-13 (2022).
- Strauss, D. G., Wu, W. W., Li, Z., Koerner, J., Garnett, C. Translational models and tools to reduce clinical trials and improve regulatory decision making for QTc and proarrhythmia risk (ICH E14/S7B updates). Clinical Pharmacology & Therapeutics. 109 (2), 319-333 (2021).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756 (2020).
Erratum
Formal Correction: Erratum: Designing a Bioreactor to Improve Data Acquisition and Model Throughput of Engineered Cardiac Tissues
Posted by JoVE Editors on 1/10/2024. Citeable Link.
An erratum was issued for: Designing a Bioreactor to Improve Data Acquisition and Model the Throughput of Engineered Cardiac Tissues. The title was corrected from:
Designing a Bioreactor to Improve Data Acquisition and Model the Throughput of Engineered Cardiac Tissues
to:
Designing a Bioreactor to Improve Data Acquisition and Model Throughput of Engineered Cardiac Tissues
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados