このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
人工心臓組織のデータ取得とモデルスループットを向上させるバイオリアクターの設計
Erratum Notice
要約
幹細胞由来の心筋細胞を用いてバイオエンジニアリングされた3次元心臓組織は、健康なヒト心筋と病気のヒト心筋を in vitro で研究するための有望なモデルとして浮上し、天然の心臓ニッチの重要な側面を再現しています。この原稿では、ヒト人工多能性幹細胞由来心筋細胞から生成されたハイコンテント人工心臓組織を作製および分析するためのプロトコルについて説明します。
要約
心不全は依然として世界の主要な死因であり、ヒトの心臓のより優れた前臨床モデルが急務となっています。組織工学は、基礎科学の心臓研究に不可欠です。 in vitro でのヒト細胞培養では、動物モデルの種間の違いが排除されますが、より組織に似た3D環境(細胞外マトリックスやヘテロ細胞カップリングなど)では、プラスチック製のペトリ皿での従来の2次元培養よりもin vivo 条件をシミュレートできます。ただし、各モデルシステムには、カスタム設計のバイオリアクターや機能評価デバイスなど、特殊な機器が必要です。さらに、これらのプロトコルはしばしば複雑で労働集約的であり、小さくて繊細な組織の障害に悩まされています。
この論文では、組織機能の縦断的測定のために人工多能性幹細胞由来心筋細胞を使用して、堅牢なヒト人工心臓組織(hECT)モデルシステムを生成するプロセスについて説明します。直線的なストリップ形状の6つのhECTを並行して培養し、各hECTはPDMSラックに取り付けられた一対の力感知ポリジメチルシロキサン(PDMS)ポストから吊り下げられます。各ポストは、使いやすさ、スループット、組織保持、データ品質を向上させる新機能である黒色のPDMS安定ポストトラッカー(SPoT)で覆われています。この形状により、ポストのたわみを確実に光学的に追跡でき、絶対的な能動的および受動的張力による痙攣力の追跡が改善されます。キャップ形状により、hECTがポストから滑り落ちることによる組織障害が排除され、PDMSラック製造後の第2ステップが含まれるため、バイオリアクター製造プロセスに大きな変更を加えることなく、SPoTを既存のPDMSポストベースの設計に追加できます。
このシステムは、生理学的温度でhECT機能を測定することの重要性を実証するために使用され、データ取得中に安定した組織機能を示します。要約すると、主要な生理学的条件を再現して、 in vitro アプリケーション用に設計された心臓組織の生体忠実度、効率、および厳密性を向上させる最先端のモデルシステムについて説明します。
概要
人工心臓組織モデルは、従来の2次元細胞培養では実現が困難であった在来の心臓ニッチのさまざまな側面を再現するために、さまざまな形状と構成で提供されます。最も一般的な構成の1つは、組織の自己組織化を誘導し、定義されたプリロードと結果として生じるけいれん力の読み出しを組織に与えるために、両端に柔軟なアンカーを備えた線形組織ストリップです1,2,3,4,5,6,7,8,9,10,11、12、13、14、15、16、17、18、19、20、21
、22、23、24、25、26、27。発生する力は、組織の短縮の光学追跡と、アンカー1,2,3,4,5,6,7,8,9,10,11の測定されたたわみとばね定数から力を計算する弾性ビーム理論を使用して、ロバストに決定することができます。12、13、14、15、16、17、18、19、20、
21、22、25、26、28。
しかし、心臓組織工学はまだ発展途上の分野であり、いくつかの課題が残っています。カスタムメイドのバイオリアクターや機能評価装置などの専用機器は、各モデルシステム10,29,30,31に必要です。これらのコンストラクトの微小環境のサイズと複雑さは、多くの場合、労働集約的なプロトコル、多数の細胞、および組織の脆弱性による低スループットによって制限されます。これに対処するために、一部のグループは、創薬に役立つハイスループットアッセイを容易にするために、数百または数千の細胞のみを含む微小組織の作製に目を向けています。しかし、この縮小されたスケールは、機能12の正確な評価を複雑にし、本来の心臓ニッチの重要な側面(栄養素/酸素拡散勾配や複雑な構造36など)を排除し、その後の分子および構造分析に利用できる材料の量を制限します(多くの場合、組織のプールが必要です)。表1は、文献1,2,3,4,5,6,7,8,9,10,11,12,13,14,15における線状組織ストリップモデルの構成のいくつかを要約したものである。16、17、18、19、20、
21、22、23、24、25、26、37、38、39、40。
| 群 | 組織あたりの細胞数 | プレートあたりの組織数 | プレートフォーマット | アンカー機能 | 機能データ取得方式 | 共有メディアバス? | 機能測定- その場で? | ||||
| 吉田 (ECT)38 | 400万人 | 6 | 修正型6ウェルプレート* | 力変換器 | 直接力測定 | いいえ | いいえ | ||||
| チャン(hESC-CM-ECT)26 | 310キロメートル | 6 | カスタム6ウェルディッシュ | PDMSの投稿 | 直接力測定 | はい | いいえ | ||||
| ファインバーグ (dyn-EHT)16 | 150万人 | 6 | カスタム6ウェルディッシュ | PDMSワイヤー | 組織形状 | いいえ | はい | ||||
| RADISIC (BioWire)39, 40 | 110キロメートル競走 | 8 | ポリマーワイヤー | ワイヤー形状 | はい | はい | |||||
| 肋骨(単一のhECT)1、2 | 1-200万 | 4** | 10cmシャーレ** | PDMSの投稿 | 光学偏向(エッジ/オブジェクトトラッキング) | はい | はい | ||||
| 肋骨(multi-hECT)3–9 | 500 k-100万 | 6 | 6cmシャーレ | PDMSの投稿 | 光学偏向(エッジ/オブジェクトトラッキング) | はい | はい | ||||
| コスタ(マルチhECT W/ SPoT) | 100万人 | 6 | 6cmシャーレ | 黒いキャップのPDMSポスト | 光学偏向(オブジェクトトラッキング) | はい | はい | ||||
| パッシエ(EHT)17 | 245キロメートル | 36 | 12ウェルプレート | 黒いキャップのPDMSポスト | 光学偏向(オブジェクトトラッキング) | はい | はい | ||||
| ヴンジャク-ノヴァコビッチ13, 18 | 100万人 | 12 | 6cmシャーレ | キャップ付きPDMSポスト | 光学偏向(エッジ検出) | はい | はい | ||||
| Vunjak-Novakovic (ミリピラー)14 | 550キロメートル | 6 | カスタム6ウェルディッシュ | キャップ付きPDMSポスト | 光学偏向(物体追跡);カルシウムイメージング | いいえ | はい | ||||
| エッシェンハーゲン (EHT)10, 19–21 | 100万人 | 12 | 12ウェルプレート | キャップ付きPDMSポスト | 光学的偏向(ポストたわみのエッジ検出);カルシウムイメージング | いいえ | はい | ||||
| ザンドストラ(CaMiRi)22 | 25〜150キロメートル | 96 | 96ウェルプレート | フック付きのPDMSポスト | 光学偏向(エッジ検出) | いいえ | はい | ||||
| マリー23、24 | 900キロ | 24 | 24ウェルプレート | キャップ付きPDMSポスト、一体型マグネット | 磁気センサー | いいえ | はい | ||||
| ドイツ (μTUG)11, 12, 25 | 未定義 | 156 | 156ウェルディッシュ | キャップ付きPDMSポスト、一体型マグネット | 光学トラッキング(蛍光ビーズ) | はい | はい | ||||
表1:文献中のいくつかの線形工学心臓組織モデルの特徴。 線形工学的心臓組織モデルは、サイズ、スループット、アンカー機能の設計、共有培地浴の容易化、および機能特性評価のための個別の筋浴システムの要件が異なります。*研究者は、標準的な6ウェルプレートの寸法に基づいて、市販の人工組織システムを使用しました。** 単一組織バイオリアクターを任意のプラスチック培養皿に所望の数と位置で固定するモジュラーシステム。
この論文では、線形ヒト工学心臓組織(hECT)1,2,3,4,5,6,7,8,9,15,27の確立されたモデルを作製するための最新のプロトコルについて説明しますhECT収縮機能を評価する方法。各マルチティッシュバイオリアクターは、共有培地に最大6台のhECTを収容し、硬質ポリスルホンフレームに取り付けられたシリコーンエラストマーポリジメチルシロキサン(PDMS)製の2つの「ラック」ピースで構成されています。各PDMSラックには、直径0.5 mm、長さ3.25 mmの柔軟な統合型フォースセンシングポストが6つ含まれており、2つのラックには6組のポストがあり、それぞれが1つのhECTを保持します。バイオリアクターの反転は、培地からの結露や空気と液体界面のメニスカスによる歪みによる下からのhECTの可視化の障害を克服するのに役立ちます。hECTが収縮するたびに、統合されたエンドポストのたわみが発生し、たわみ信号の光学的測定は、hECT 1,2,3,4,5,6,7,8,9,15,27の収縮機能を表す力対時間追跡に処理されます.このサイズの組織に通常使用される単一組織バイオリアクターと比較して、マルチティッシュデザインは実験スループットを向上させ、潜在的に異なる細胞組成の隣接する組織間のパラクリンシグナル伝達の研究を可能にします。このシステムは、疾患モデリング4,8、パラクリンシグナル伝達6,7、ヘテロ細胞培養5,9、および治療スクリーニング7,9への応用を説明する発表された研究で検証されています。
このシステムでは、hECTは長さ約6mm、直径0.5mmに設計されており、低ノイズで力測定の堅牢な光学的追跡を容易にします。さらに、拡散勾配や細胞組織などの組織の複雑さの側面は、組織あたり100万個の細胞という管理可能な要件とバランスが取れています。標準的なCCDカメラ技術では、1μNという弱い力(たわみ後5μm未満を表す)で明確な信号を生成するため、一部のhECT疾患モデルで観察されるような非常に弱い収縮機能でも正確に測定できます。これにより、痙攣力曲線の詳細な分析も容易になり、したがって、発達力、収縮率(+dF/dt)および弛緩率(−dF/dt)、および拍動率変動を含む、最大16の収縮性指標41のハイコンテント分析が可能になる。
このプロトコルは、バイオリアクターコンポーネントを製造するための指示から始まります。hECT収量を最大化し、組織機能の技術的変動性を低減し、組織評価の質と深さを最適化するためのステップに特別な注意が払われています。ほとんどの心臓組織工学研究は、製造および長期検査中の組織損失率を報告していませんが、これはこの分野ではよく知られた課題であり、研究のスループットと効率を低下させます27。ここで説明する組織工学的手法は、(PDMSラックの製造方法に関係なく)ほとんどのバイオリアクターですべてのhECTを確実に保持するために、長年にわたって改良されてきました。しかしながら、組織の5%〜20%の損失でさえ、特に利用可能な心筋細胞の数によって制限される小規模な実験において(例えば、いくつかの疾患細胞株4 の分化の課題のため、または市販の心筋細胞の高コストのために)、または治療条件(例えば、様々な治療化合物の限られた入手可能性または高コスト)によって、統計的検出力に大きく影響し得る。
このプロトコルは、hECTを保持する力感知ポストの端部でキャップとして機能するPDMSラックの新機能である安定したポストトラッカー(SPoT)の製造について説明します27。キャップ形状により、ポストの落下や引き抜きによるhECTの損失が大幅に減少し、キャップのないポストでの培養が困難な、より多様な剛性と張力を持つhECTを培養するための新しい機会が開かれることが実証されています。さらに、SPoTは、一貫性のある明確に定義された形状27を通じて、hECT収縮の光学的追跡を改善するための高コントラストの物体を提供する。これに続いて、ヒト人工多能性幹細胞(iPS細胞)の培養と、以前に発表されたプロトコル3,42,43に基づく心筋細胞の分化、およびhECTの作製、培養、および機能測定の説明が続きます。
この記事では、生理学的温度で組織機能を測定する必要性についても説明します。ヒト心筋(胎児および成人の健康および罹患組織)、および広範囲の動物種(ラット、ネコ、マウス、フェレット、ウサギを含む)の心臓組織44,45は、生理学的温度と比較して28°C-32°Cの温度で周波数整合痙攣力の著しい増加を示します-低体温異方性45として知られる現象、46。しかし、人工心筋組織機能に対する温度の影響は、まだ十分に研究されていません。文献にある最近の人工心臓組織モデルの多くは、生理学的条件を近似するために37°Cで機能的に評価されるように設計されています13,14,37。しかし、私たちの知る限り、人工心臓組織によって生成される力に対する温度依存的な影響は体系的に調査されていません。このプロトコルは、試験中の熱損失を最小限に抑え、無菌性を損なうことなくhECTを生理学的温度に維持できる機能測定用のセットアップに絶縁発熱体を組み込むことを可能にするペーシング電極設計について説明しています27。次に、発達力、自発拍数、+dF/dt、-dF/dtなど、hECT機能に観測された温度の影響のいくつかを報告します。全体として、この論文は、ヒトで操作された心臓組織を作製し、それらの収縮機能を評価するために、この多組織力感知バイオリアクターシステムを製造するために必要な詳細を提供し、室温および37°Cでの測定の比較の基礎を提供する一連のデータを提示します27。
Access restricted. Please log in or start a trial to view this content.
プロトコル
このプロトコルは、匿名化されたiPS細胞株であるSkiPS 31.3(元々は健康な45歳男性の真皮線維芽細胞を用いて再プログラムされた)47を使用し、したがって、同機関のヒト研究倫理委員会のガイドラインに従って、特定の治験審査委員会の承認を免除された。すべての細胞およびhECT操作は、HEPAフィルター付きクラスII生物学的安全キャビネットまたは層流作業台で無菌状態で行います。すべての非滅菌溶液を0.22 μmフィルターでろ過して滅菌し、すべての細胞とhECTをインキュベーター内で37°C、相対湿度95%、CO25%に維持します。
1. バイオリアクターの作製
- バイオリアクター部品とアルミニウムマスターキャスト製造
注: コンピュータ支援設計 (CAD) ファイルは、 補足ファイル 1 で提供されています。 プロトコルは、これらのステップの間の任意の場所で一時停止できます。高い公差(≤5 μm)と滑らかな仕上げは、正確なポスト形状とポリテトラフルオロエチレン(PTFE)ベースプレートへのポリスルホンフレームの適切な圧入(ぴったりとした摩擦フィットを目指しているが、きつすぎない)に必要であるため、このセクションで説明するマスター金型の製造には専門の機械工に依頼することをお勧めします。- コンピュータ数値制御(CNC)ミルを使用して、 図1Aの回路図に従ってPTFEからベースプレートを機械加工します。hECTは、等間隔に並んだ6つのウェル(白い矢印)に形成されます。
- CNCミルを使用して、 図1Bの回路図に従って、3つのフレームサポート(緑色のアスタリスク)を使用して、アルミニウムから鋳造されたポリジメチルシロキサン(PDMS)ラックネガティブマスターを加工します。PDMSポストを作成するために、直径0.5mmの6つの等間隔の穴(マゼンタの矢印)をドリルで開けます。
- CNCミルを使用して、 図1Cの回路図に従って、バイオリアクターフレームをポリスルホンから機械加工します。フレーム・サポート(緑色のアスタリスク)は、ラック・キャストに見られるフレーム・サポート(図1B、緑色のアスタリスク)に対応しています。
- CNCミルを使用して、 図1Dの回路図に従って、アルミニウムからアルミニウム鋳造ホルダーを機械加工します。各スロットには、高さ0.25 mmの三角形の棚(オレンジ色の三角形)があり、PDMSラックキャストの穴にPDMSが流れるデッドスペースを提供します(図1B、マゼンタの矢印)。
- アルミニウムネガマスターからのPDMSラックの鋳造
- 熱可塑性溶融堆積モデリング3Dプリンターを使用して、PDMSラック鋳造装置ブラケット2個をプリントします(補足ファイル1)。次のプリント設定を使用します:レイヤーの高さ0.1mm、壁/底/上部の厚さ1mm、三角形のインフィル密度90%、プリント温度230°C、ビルドプレート温度70°C、接着用ブリム。
- 4つのアルミニウムネガティブマスターキャストをキャストホルダー(図2AI)に配置し、支柱の穴が三角形の棚の反対側のデッドスペースに揃うようにします( 図1Dを参照)。液体PDMSの漏れを防ぐために、ガスケットとして厚さ0.5mmのシリコンシート(図2B、白い矢印)の長方形のピースで装置を包み、スクリュークランプを使用して2つの平行な3Dプリントブラケットの間にクランプします。
- 浅い容器にPDMS硬化剤0.5mLとPDMSエラストマーベース5mL(メーカーの指示による1:10の比率)を加え、5分間激しく混合します。真空チャンバー内でPDMS混合物を脱気し、室温で20〜60分間、または気泡が消えるまで強力な真空(0.1〜1 kPa)を適用します。
- PDMS混合物を鋳造装置に注ぎ、各スロットを完全に覆うようにオーバーフィルします(図2AII)。必要に応じて、PDMSラックの本体(図2AII)、支柱のある側(図2B)の反対側に小さな色付きガラスビーズを追加して、各PDMSラックを一意に識別できるようにします。鋳造装置を真空チャンバーに戻し(水平に水平であることを確認してください)、少なくとも12時間強力な真空を適用します。PDMSを埃から離して室温で約48時間硬化させ、デリケートな支柱の完全な硬化と最大の強度を可能にします。オーブンを使用すると、3Dプリントされたコンポーネントが歪むため、使用しないでください。
注: プロトコルはここで一時停止できます。
- アルミニウムネガマスターキャストからのPDMSラックの取り外し
- クランプ、ブラケット、シリコンシートを鋳造装置から取り外します。ステンレス鋼のかみそりの刃を使用して、鋳造装置とフレームサポートの上部にあるPDMSフィルムを切り取り、指を使ってPDMSラックをキャストホルダーの側面からそっと分離します。鈍いステンレス鋼のかみそりの刃をキャストとキャストホルダーの間のデッドスペースに挿入し、こじ開けて(図2CI、II)、デッドスペースを埋めるPDMSがキャストホルダーに残るようにします(これはポストに取り付けられているため)。鋭利なステンレス鋼の刃を使用して、残りのPDMSフィルムを切り取り、支柱の先端からデッドスペースPDMSを切り取ります(図2C III-V)。
- 重要な手順: PDMSラックをキャストから外します(図2D)。支柱の反対側から始めて、指を使ってPDMSラックをキャストからゆっくりと離し、支柱からマスターキャストがなくなるまで反対側で作業します。
- すべての PDMS ラックとすべての支柱が解放されるまで、前の手順を繰り返します。鋭利なカミソリの刃を使用して、ラックに残っている余分な PDMS を切り取ります。その結果、PDMSラック(図2E)には、6本の支柱(オレンジ色の矢印)と識別用の色付きのビーズ(青色の矢印)が取り付けられています。
注: プロトコルはここで一時停止できます。
- 安定したポストトラッカー(SPoT)の製造
- 熱可塑性溶融堆積モデリング3Dプリンタを使用して、SPoT鋳造装置のコンポーネントを印刷します(補足ファイル2および図3AI、II)。次のプリント設定を使用します:レイヤーの高さ0.1 mm、壁/底/上部の厚さ1 mm、三角形のインフィル密度80%、プリント温度230°C、ビルドプレート温度70°C、接着用のブリム。
- 3Dプリントされた部品の間、およびPDMSラックと三又治具の間にしっかりと圧入されていることを確認し、PDMSラックが曲げられずにウェルの底に届くポストにぴったりとフィットしていることを確認します。必要に応じて、プラスチックをトリミング/ヤスリで削ります。
- 0.5 mLの黒色PDMSパートAと0.5 mLのパートB(メーカーの指示に従って1:1の比率)を小型計量ボート(または同様の小型で浅い容器)に加え、色が均一になるまで完全に混合します。混合黒色PDMSを真空チャンバー内で20分間、強真空下で脱気する。脱気した黒いPDMSを3Dプリントしたベースに流し込んで穴を埋め、泡が残らないように叩きます。ベースから余分なPDMSをできるだけ削り取ります。
- 3本又の部品をベースにはめ込み、PDMSラックを3本柱の治具(図3AII、ターコイズブルーの長方形)の溝に置き、支柱の端が円形ウェルの黒いPDMSに浸るようにします(図3B、C)。黒色のPDMSを室温で硬化させ、粉塵から48時間保護します。
注: プロトコルはここで一時停止できます。 - 三又をスライドさせて、支柱の張力を最小限に抑えます。小さな鉗子を使用して、各SPoTを囲む黒いPDMSの薄膜をこすり落とします。次に、先端が細かく曲がった鉗子をSPoTウェルに挿入して、3Dプリントされたベースから解放します(図3D)。
- SPoT(図3E)を検査し、細いVannasハサミを使用して、ステップ1.4.5で除去されなかった鋳造プロセスに残っている黒いPDMSフィルムを切り取ります。PDMSラックをポリスルホンフレームに取り付け、これを黒いベースプレートにスライドさせて、完成した支柱が正しい長さであることを確認します(図4A)。
注: プロトコルはここで一時停止できます。 - PDMSラックをペアにし、フレームタブを使用してフレームに追加します(図4A)。PTFEベースプレート付きのバッグに少なくとも30分間オートクレーブを入れます(反りを減らすために<122°C)。
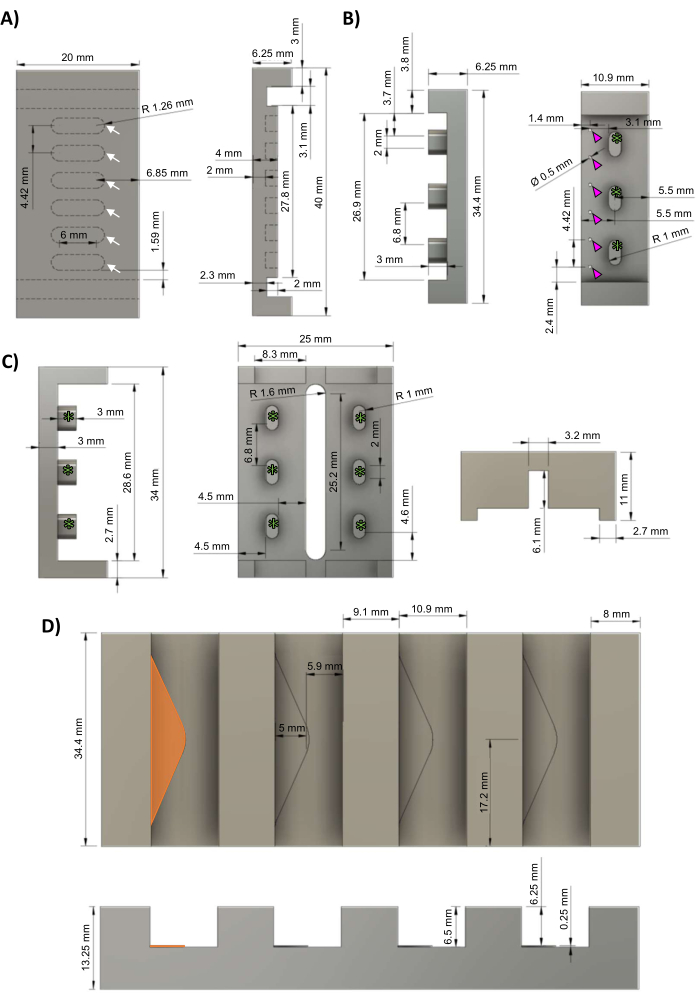
図1:hECTバイオリアクターのコンポーネント。 (A)hECTを形成するための6つの等間隔のウェルを備えたPTFEベースプレートの上面図(左)と側面図(右)(白い矢印)。(B)6本の等間隔の支柱(マゼンタの矢印)とバイオリアクターフレームに取り付けるための3つの隙間(緑色のアスタリスク)を備えたPDMSラックのアルミニウムネガマスターキャストの側面図(左)と上面図(右)。(C) PDMS ラック・キャストのフレーム・サポートに対応する 3 つの等間隔のフレーム・サポート(緑色のアスタリスク)を備えた PDMS ラックのポリスルホン・フレームの側面図(左)と底面図 (右)。(D)高さ0.25 mmの三角形の棚(オレンジ色で強調表示された左端の棚)を備えた、PDMSラック鋳造用の4つのスロットを備えたアルミニウム鋳造ホルダーの上面図(上面図)と側面図(下面図)。この図はvan Neste27から修正されたものです。略語:hECT = Human Engineered Cardiac Tissue;Ø =直径;PTFE =ポリテトラフルオロエチレン;PDMS = ポリジメチルシロキサン;R = 半径。 この図の拡大版をご覧になるには、ここをクリックしてください。
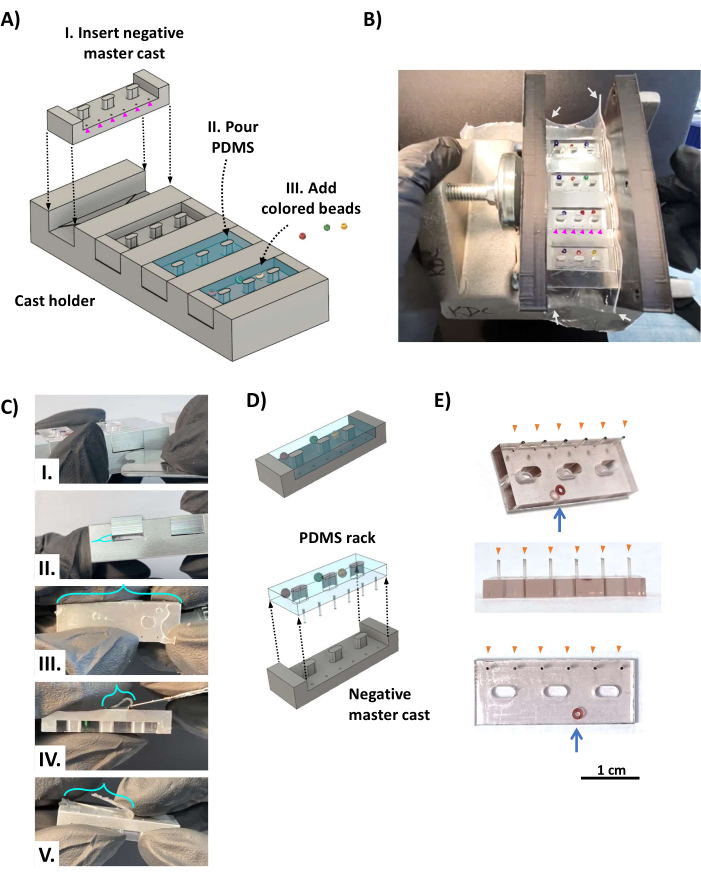
図2:PDMSラックの製作。 (A)CADレンダリングは、鋳造装置の斜め図を示しています。(I)三角形の棚の反対側のデッドスペースに配置されたPDMSポスト(マゼンタの矢印)を形成する穴(図1D、オレンジ色の三角形)を使用して、負のPDMSラックマスターキャストをキャストホルダーの4つのスロットのそれぞれに挿入します。(ii)PDMSは、ネガティブマスターキャストの各キャビティに注がれます。(III)着色ビーズは、色分けされた識別システムとして未硬化のPDMSに添加される。(B)組み立てられたPDMSラックキャスティング装置を、3Dプリントした2つのブラケットで両側にクランプし、スクリュークランプで固定し、厚さ0.5mmのシリコンシート(白い矢印)で包んでクランプした側面を密封した写真。色付きのビーズは、支柱を形成する直径0.5mmの穴(マゼンタの矢じり)を覆わないように配置されます。(C)PDMSが硬化したら、ギプスをギプスホルダーから取り外します。(I)鈍いステンレス鋼のかみそりの刃または同様の薄い金属工具をキャストとキャストホルダーの間に挿入して、キャストホルダーからキャストをこじ開けます(II)。(III)支柱の穴を流れるPDMSによって形成されたフィルム(ターコイズブルーのブラケット)は、支柱の先端に取り付けられ、鋭利な刃(IV、V)を使用して切断する必要があります。(D)PDMSラックはキャストから分離されています。(E)識別のためにガラスビードを本体に埋め込んだPDMSラックの斜め(上)、側面(中央)、および下(下)の図を示す写真(青い矢印)。支柱の先端(オレンジ色の矢じり)には黒インクでマークされています。スケールバー = 1 cm。この図はvan Neste27から修正されたものです。略語:CAD = computer-aided design;PDMS = ポリジメチルシロキサン。この図の拡大版をご覧になるには、ここをクリックしてください。
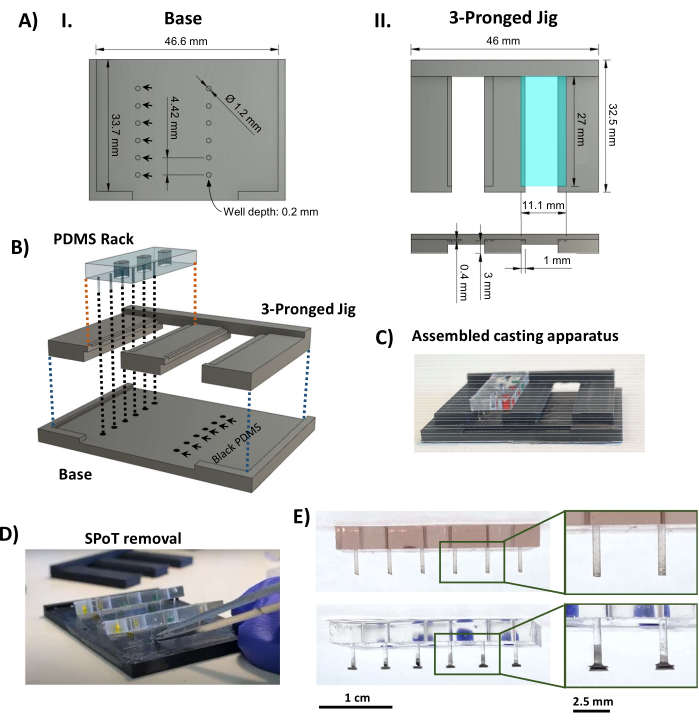
図3:SPoT製造。 (A)SPoT鋳造治具の(I)ベースと(II)3本柱の部分の主要な寸法を示すCADレンダリング。円形のSPoTフォーム(AI、黒い矢印)の寸法は、深さ0.2 mm x 直径1.2 mmに設定され、それぞれが個々のSPoTの黒いPDMSを保持します。上面図に見られる11.1 mm x 27 mmの棚(AII、上面、ターコイズブルーの長方形)は、硬化中にPDMSラックを所定の位置に保持するために0.4 mm押し下げられています(下の側面図を参照)。(B)SPoT鋳造装置の組み立てを示すCADレンダリング。(C)組み立てたSPoT鋳造装置の写真。(D)PDMSが硬化した後、PDMSラックの下から三又の治具をスライドさせ、SPoTを微細な鉗子を使用してウェルから解放します。(E)SPoTなし(上)とSPoTあり(下)のPDMSラックの写真。インセットには、投稿が拡大表示されます。縮尺記号 = 1 cm (E)、2.5 cm ( E のズームイン画像)。この図はvan Neste27から修正されたものです。略語:CAD = computer-aided design;Ø =直径;PDMS = ポリジメチルシロキサン;R =半径;SPoT = 安定したポストトラッカー。 この図の拡大版をご覧になるには、ここをクリックしてください。
2. 細胞培養
- iPS細胞の培養
注:細胞株が異なれば、継代希釈率と頻度、および/または培地添加剤の滴定の調整が必要になる場合があります。- 細胞培養処理した6ウェルプレートを適格な基底膜マトリックス(メーカーの指示に従って1:1 Dulbecco's Modified Eagle Medium:Ham's F12 Nutrient Solution [DMEM/F12]で希釈)でコーティングし、プレートを37°Cで少なくとも30分間インキュベートします。メーカーの指示に従ってiPS細胞培養液500mLを調製し、ペニシリン-ストレプトマイシン(10,000IU/mL〜10,000μg/mL)原液5mLを加えます。
- iPS細胞を継代するには、ウェルから培地を吸引し、各ウェルを1 mLのリン酸緩衝生理食塩水(PBS)で1回洗浄します。ウェルあたり1 mLのiPS細胞解離溶液を添加し、層流フード内で1分間インキュベートします。
- iPS細胞解離液を吸引し、37°C(培地なし)で5分間インキュベートします。iPS細胞培地に2 μMチアゾビビン1 mLを添加し、iPS細胞解離溶液を中和します。
- 2 mLの血清ピペットを使用してコロニーを約10個の細胞の塊に解離させ、iPS細胞培地中の2 μMチアゾビビンを追加1 mLでウェルに洗浄します。基底膜マトリックスで新たにコーティングしたプレートの各ウェルに2 mLの細胞懸濁液を加えます(ステップ2.1.1)。
- 24時間後、培地を取り出し、新しいiPS細胞培地(チアゾビビンなし)を添加します。2 mLのiPS細胞培地を48時間ごとに、または4 mLの培地を72時間ごとにiPS細胞に供給します。細胞を1:6希釈で再抹録し、3日ごと、または80%のコンフルエントに達したら継代します。
注:細胞株が異なれば、希釈率と継代頻度の調整が必要になる場合があります。
- 心筋細胞の分化
- iPS細胞単分子膜が80%〜90%コンフルエントになったら分化を開始します。
- 500 mLのRoswell Park Memorial Institute 1640培地(RPMI)に、インスリンを含まないB27サプリメント10 mLとペニシリン-ストレプトマイシンストック溶液5 mLを加えて、分化培地を調製します。10 mLのB27サプリメントと5 mLのペニシリン-ストレプトマイシンストック溶液を500 mLのRPMI 1640に添加して、心筋細胞維持培地を調製します。
注:分化培地および心筋細胞維持培地は、4°Cで最大2週間保存できます。 - 0日目:細胞を1 mLのDMEM/F12で洗浄し、2 mLの10 μM CHIR99021と希釈した基底膜マトリックスを分化培地に加えます。
- 1日目:24時間後、または細胞コンフルエントが70%未満に減少したら、細胞を1 mLのDMEM/F12で洗浄し、2 mLの分化培地を加え、48時間インキュベートします。
- 3〜4日目:細胞を1 mLのDMEM/F12で洗浄し、2 mLの5 μM IWR-1を分化培地に加えます。4日目に繰り返します。
- 5〜6日目:細胞を1 mLのDMEM/F12で洗浄し、2 mLの分化培地を加えます。6日目に繰り返します。
- 7〜10日目:細胞を1 mLのDMEM / F12で洗浄し、2 mLの心筋細胞維持培地を追加します。24時間ごとに繰り返します。
- 11+日目:培地を48〜72時間ごとに4mLの新鮮な心筋細胞維持培地と交換します。激しく鼓動する単層を傷つけないように、ゆっくりと吸引してピペットで操作します。
3. hECT培養
- 心筋細胞の採取
- 分化誘導後8〜60日でhECT製造に使用する心筋細胞単層を採取します。ウェルあたり200万〜500万個の細胞が期待できます。
注:10日目までに細胞が叩き始めていない場合、分化が成功する可能性は低いです。激しく叩く単層は、分化に11〜15日後に剥離し、密集した組織に圧縮されることがよくあります。現時点では、そのような細胞を使用または再播種することをお勧めします。 - 心筋細胞の各ウェルを2 mLのPBSで2回すすぎます。室温で0.25%トリプシン-EDTAを1 mL添加します。細胞が丸みを帯び、プレートを軽く叩くと剥離するまで、37°Cで5〜10分間インキュベートします。
- 心筋細胞維持培地に10%FBSを1 mLずつ各ウェルに加え、解離を中和します。5 mLの血清ピペットチップを使用して単層を静かにピペット化し、50 mLのコニカルチューブに移してペレットを10〜20個の細胞の塊に分解します。
- 10 μLの細胞を10 μLのトリパンブルーに移す前に、コニカルチューブを反転させて細胞懸濁液を混合します。自動セルカウンターまたはガラス血球計算盤を使用して細胞をカウントします。すべての細胞を使用しない場合、または一部の細胞をフローサイトメトリー用に取っておく場合は、細胞懸濁液を適切に分離します。
注:この時点で、補助細胞(線維芽細胞など)を追加することができます。 - 細胞を250 × g で5分間遠心分離します。細胞ペレットを乱さずにできるだけ多くの上清を直ちに吸引し、氷上に保管してください。細胞がペレット内で費やす時間を最小限に抑えるために迅速に作業します。
- 分化誘導後8〜60日でhECT製造に使用する心筋細胞単層を採取します。ウェルあたり200万〜500万個の細胞が期待できます。
- hECT製造
- 表 2 の容量を使用し、各 hECT に 100 万個の細胞が含まれるように、ペレット中の細胞数に応じて調整します。各ステップの後、気泡を避けるためにゆっくりとピペッティングで混合します。
注意: 一部のコンポーネントは光に敏感であるため、直接光から遮蔽された状態で手順3.2.2〜3.2.3を実行してください。 - 13.442 μLの蒸留水、4.4 μLの10x PBS、および0.638 μLの1M NaOHを加えて、1.7 mLのマイクロチューブに2.9 g/mLの1型コラーゲン溶液を調製します。5 mg/mLのコラーゲン原液25.52 μLを加え、ゆっくりと混合します。
- 細胞外マトリックスミックス(表2のECMミックス)を調製します:5.5 μLの0.2 N pH 9 HEPES溶液を加え、続いて5.5 μLの10x MEMを加えます。均一な薄黄色から薄ピンク色が観察されるまで、完全に混合します。35.2 μL の ECM 混合溶液を細胞ペレットに移し、4.4 μL の基底膜マトリックスを加えます。
- バイオリアクター部品の入ったオートクレーブバッグを開けます(ステップ1.4.7、図4A)。70%エタノールで滅菌した手袋を着用しながら、オートクレーブバッグから黒いベースプレートを取り出し、ウェルを上に向けて60mmの皿に入れます。44 μLの細胞混合物を各ウェルにゆっくりとピペットで移し、気泡が入らないようにします。必要に応じて、ピペットを使用して、ピペッティングによって導入された気泡や、PTFEの疎水性によって形成された気泡を取り除きます。液体の表面がウェルのリップと同じ高さになるようにhECTの容量を復元します(図4BI)。
- 新しい滅菌済み手袋を着用し、PDMSラック付きのポリスルホンフレームをオートクレーブバッグから取り外します。フレームの端がベースプレートの端の溝に収まるように、フレームをベースプレートに下ろします(図4BII、III)。60 mmディッシュに入れる前に、バイオリアクターを点検して、支柱がすべてまっすぐで、フレームが傾いていないことを確認します。
- 心筋細胞維持培地に1 mLの10%FBSを60 mmのディッシュに加え(hECTを乱さないように注意してください)、hECTが固化するにつれてディッシュ内の湿度を上げます。蓋のない60mmのディッシュを高さ20mmの100mmのディッシュに入れ、100mmのディッシュの蓋で覆い、バイオリアクターを37°C、5%CO2 インキュベーターに戻して、コラーゲンが懸濁液中の細胞とゲルを形成するようにします。
- 2時間後、インキュベーターから皿を取り出します。心筋細胞維持培地に10%FBSを13 mL添加し、皿を傾けて培地がPTFEベースプレートとPDMSラックの間を流れるようにします。
- バイオリアクターを側面から点検し、PTFEベースプレートとPDMSラックの疎水性表面の間に気泡が閉じ込められていないことを確認し、ディッシュをインキュベーターに戻します。空気が閉じ込められている場合は、バイオリアクターを培地から傾けて気泡を破裂させ、ゆっくりと再び下げるか、ポストを乱さないように注意しながら、ゲルローディングチップ付きのマイクロピペットを使用して空気を吸い上げます。
- 表 2 の容量を使用し、各 hECT に 100 万個の細胞が含まれるように、ペレット中の細胞数に応じて調整します。各ステップの後、気泡を避けるためにゆっくりとピペッティングで混合します。
- ベースプレートの取り外し
- フレームの隙間からhECTの圧縮を検査します。24〜96時間の間に、hECTは圧縮され、より不透明になります(図4CI-III)。hECTとベースプレートの壁の間に目に見える隙間ができたら(図4CII)、半容量培地交換を2回行い、培地をFBSを含まない心筋細胞維持培地に交換します。hECTが元の直径と比較して少なくとも30%圧縮されたら、ベースプレートを取り外します(図4CIII)。バイオリアクターを含む60 mmのディッシュに心筋細胞維持培地を、液体がディッシュの縁と同じ高さになるまで充填し、新しい60 mmディッシュに14 mLを加えます。
- 重要なステップ:滅菌手袋を着用した状態で、ベースプレートが上になるように、バイオリアクターを皿の中で裏返します(図4BIV)。手順3.2.8のように気泡が閉じ込められていないか検査します。ベースプレートを水平に保ちながら、ゆっくりと持ち上げます(図4BV)。
- ベースプレートの取り外し中にhECTが脱落したが、ベースプレートに残っている場合は、滅菌された湾曲した微細な鉗子を使用して、ベースプレートから60mmディッシュにhECTを移します。鉗子を使用して、hECTの端をそのポストにガイドします。2組目の鉗子を使用して支柱を安定させ、hECTの穴に通します。必要に応じて、2 番目の投稿についても繰り返します。
- すべてのhECTを支柱に取り付けた状態で、hECTの入ったフレームを新しい60 mmディッシュに移し、支柱を下に向けてフレームを置きます(図4BVI)。バイオリアクターを検査して、hECTがSPoTのすぐ近くのポストに残っていることを確認します。
- hECTが表面張力によって支柱の基部に押し出された場合は、滅菌された湾曲した鉗子のペアでフレームを安定させます。もう一方の鉗子をフレームのスロットに挿入し、閉じたままにします。鉗子の先端がPDMSラックを越えて下がったら、支柱に到達するようにひねり、閉じた先端を使用して、SPoTに載るまでhECTを支柱の端に向かってゆっくりと押します(図4BVI、挿入図)。
- hECTメンテナンス
- 24〜48時間ごとに心筋細胞維持培地を使用して半量培地交換を行います(培養2週間後、頻度を週に2回に減らすことができます)。
- hECTが自発的な拍動のクラスターを示し、通常は3日目までに、5日目までに目に見えるポストデフレクションを伴う協調的な拍動を示したら、機能測定を開始し、必要に応じて何度でも繰り返します。
注:7日目までに協調的な叩動を開始していないhECTは、そうする可能性はまったくありません。
| コンポーネント | 容量(μL) | |||||||
| 蒸留H2O | 13.442 | 2.9 mg/mL コラーゲン溶液 | 「ECMミックス」 | 最終hECT細胞混合物 | ||||
| NaOHの1N | 0.638 | |||||||
| PBSの10倍速 | 4.4 | |||||||
| 5 mg/mL コラーゲンストック | 25.52 | |||||||
| 0.2 N pH 9 HEPES | 5.5 | |||||||
| 10 個の MEM | 5.5 | |||||||
| 細胞ペレットに転写するECM混合物の量 | 35.2 | |||||||
| マトリゲルの量 | 4.4 | |||||||
表2:hECT試薬。 コンポーネントはリストされている順序で追加し、氷上に保管する必要があります。
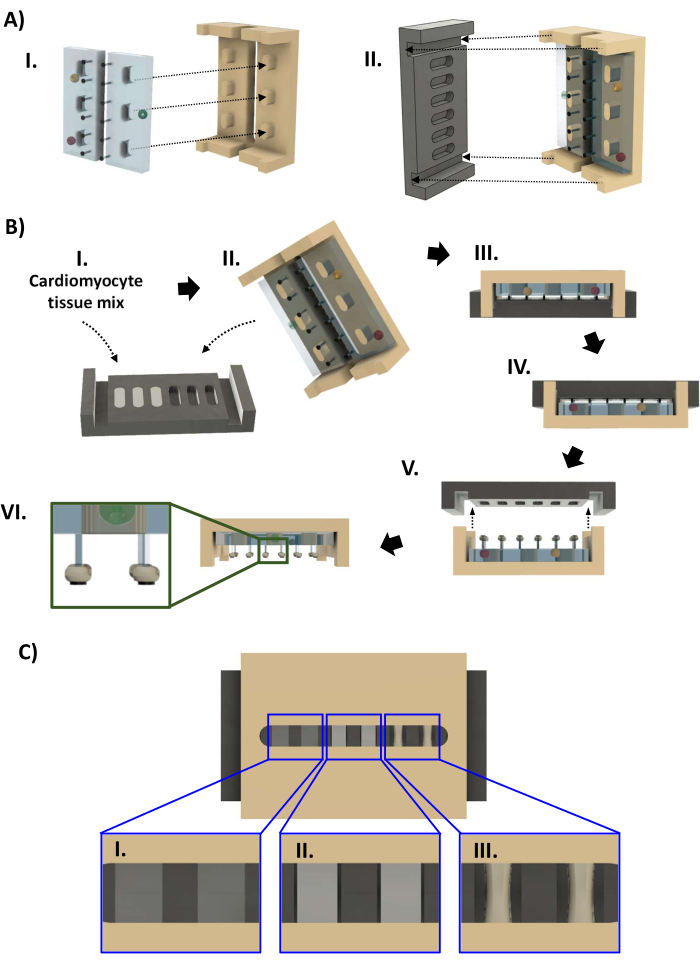
図4:バイオリアクターの組み立てとhECTの作製。 (A) (I)ポリスルホンフレーム(右、黄褐色)に取り付けられた2つのPDMSラック(左、水色)。(ii)次に、PTFEベースプレート(黒、左)をフレーム(右)に取り付け、支柱の各ペアがベースプレートのウェルに収まるようにします。(B)(I)コラーゲンベースの細胞外マトリックス中の44マイクロリットルの心筋細胞懸濁液を、6つのベースプレートウェルのそれぞれに添加する。(II、III)PDMS ラック付きのフレームは、ベースプレートに圧入されます。1〜4日後、hECTをベースプレートから取り外すことができます。(IV)まず、(V)ベースプレートをフレームから持ち上げる前に、バイオリアクターを反転させます。(VI)6つのhECTを備えたバイオリアクターの側面図。インセット:SPoT(インセット)に対するポスト上のhECT位置の拡大図。(C)ポリスルホンフレームの隙間を通して見た3段階のhECT圧縮([I]低、[II]中、[III]高)を示すCADレンダリング。この図はvan Neste27から修正されたものです。略語:CAD = computer-aided design;PDMS = ポリジメチルシロキサン;PTFE =ポリテトラフルオロエチレン;SPoT = 安定したポストトラッカー;hECT = Human Engineered Cardiac Tissue(ヒト人工心臓組織)。この図の拡大版をご覧になるには、ここをクリックしてください。
4.hECTペーシング装置
- 加熱ステージ用ジャケット
- 厚さ0.635cmの透明アクリルシート(補足ファイル3)から、 図5A〜Dに各1枚、 図5E、Fに各2枚ずつ、レーザー切断機を使用してアクリル絶縁ジャケットの部品を切り取ります。
- 図5の部品(B)、(C)、(D)、(E)のいずれかを組み立て、図5GIに示すようにアクリル接着剤を使用して接着します。トップパネルを取り付け(図5GII)、接着剤が固まるまで数時間待ってから、加熱ステージをジャケットの側面にスライドさせます(図5GIII)。
- ジャケットを取り付けたら、テープを使用して加熱ステージの脚の間にインサートを固定し、フロントパネル(図5GIV)を追加して組み立てを終了します(図5GV)。
- 黒鉛電極作製
- 厚さ6.25 mm、幅25 mmのグラファイトバーをバンドソーを使用して長さ35 mmのブロックに切断します。次に、各電極の一方の端の高さが13〜16 mm、もう一方の端の高さが8〜10 mmになるように、各ブロックを曲線状に縦に切断します。上隅に直径0.7mmの穴を2つ開けます(図6AI)。ペーパータオルでピースを磨き、水で20分間超音波処理してグラファイトダストを取り除きます。電極間の距離が一定になるように、電極がディッシュの壁と幅25 mmのバイオリアクターの間にくさびでくさびになっていることを確認します(図6AII)。
- 長さ150mm×直径0.25mmの鋼線を電極の穴に通し、蓋を閉めることができるように、60mmの皿の縁と100mmの皿の壁の周りに合うように曲げます(図6AII)。
- 使用後、毎回蒸留水に1〜2時間浸して電極を洗浄し、吸収された媒体を除去し、一晩乾燥させてから、132°Cで30分間オートクレーブします。測定を開始する前に、バイオリアクターの両側に電極を1つ配置します(図6AII)。100mmのディッシュリッシュの蓋が閉じられるようにワイヤーを配置し、バイオリアクターをインキュベーターに戻して平衡化します。
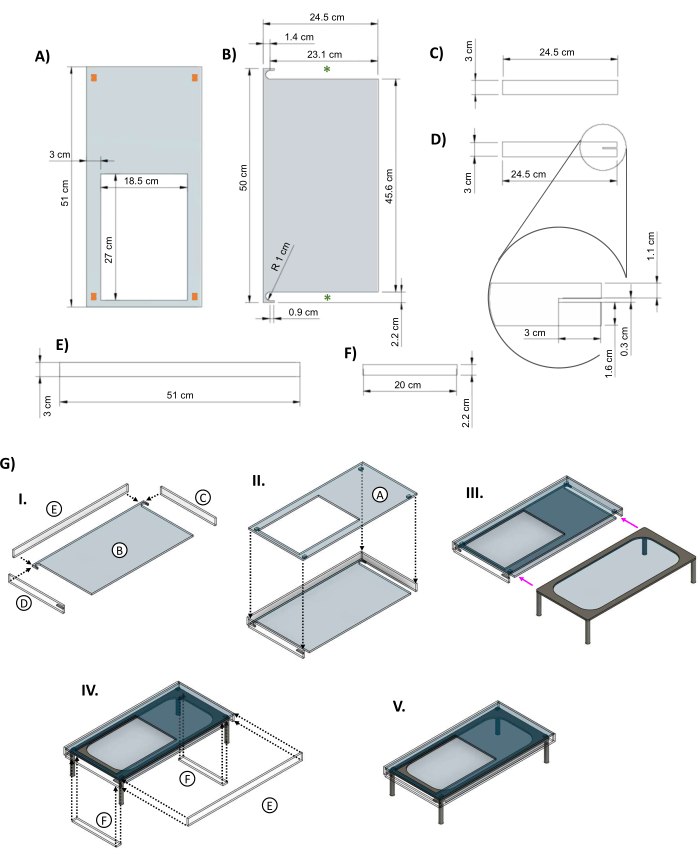
図5:加熱されたガラスステージを断熱するためのアクリルジャケット。 ガラステーブル用に設計されたアクリルジャケットの部品の主要な寸法を示すCAD画像。(A)天板には27 cm x 18.5 cmの穴が開いており、バイオリアクターディッシュを発熱体の上に置けます。角のオレンジ色の長方形は、ジャケットの上部と発熱体の間にスペースを確保するための小さなスペーサーピースの推奨配置を示しています。(B)ジャケットの底部には、加熱ステージの脚をスライドさせるための2つの切り欠きがあります(緑色のアスタリスク)。(C&D)2つのサイドパネルがトップピースの下に収まります。(D)左側のサイドパネルには、ステージ電源コード用の3 cm x 0.3 cmの切り欠き(はめ込み)があります。(E)長いパネルは前面と背面に収まります。(F)テーブルが内部に入ると、ギャップを埋めるために挿入が追加されます。(G)(I)サイドパネルとバックパネルをボトムピースに取り付け、(II)トップパネルを追加します。(III)ガラステーブルをジャケットにスライドさせます(マゼンタの矢印)。(IV)インサートはテーブルの脚の間に取り付けられ、背面は開口部にはめ込まれてボックスを閉じます。(V)完成したジャケットアセンブリ。この図はvan Neste27から修正されたものです。略語:CAD = computer-aided design;R =半径;Ø = 直径。 この図の拡大版をご覧になるには、ここをクリックしてください。

図6:hECT収縮のデータ収集。 (A) (I)グラファイトバーから切り出された電極の写真。マゼンタの矢印は、ステンレス鋼線を取り付けるための穴を示しています。スケールバー = 1 cm。 (ii)バイオリアクター内のグラファイト電極の配置を示す斜め図(左)と上面図(右)。電極は、幅25mmのバイオリアクターとディッシュの壁の間のスペースを占め、電極間の距離を一定に保ちます。ワイヤーは、皿の蓋を閉じることができるように曲げられています。(B)層流クリーンベンチ内のhECTペーシングセットアップの写真-クリーンベンチからの振動音を低減するために、すべての機器を除振テーブルに配置します。バイオリアクター(マゼンタの矢じり)は、ジャケット付きの加熱ステージ上にあり、上からLED光源で照らされています。解剖顕微鏡は、バイオリアクターを下から見るために直角鏡(オレンジ色のアスタリスク)に水平に向けられ、CCDカメラ(左)が取り付けられています。ターコイズブルーのブラケットは、連続温度監視用のウォーターバスを示し、クローズドループ加熱ステージコントローラーにフィードバックを提供します。この図はvan Neste27から修正されたものです。略語:hECT = Human Engineered Cardiac Tissue;LED = 発光ダイオード。 この図の拡大版をご覧になるには、ここをクリックしてください。
5. hECT機能測定
- ペーシング・ワークスペースのセットアップ
- 加熱ステージを39.5°Cにオンにし、 図6Bに従って層流クリーンベンチ内の除振テーブルにペーシング装置を設置します。解剖顕微鏡をブームスタンドに取り付け、ガラステーブルの下のラボジャックにある直角ミラー(図6B、オレンジ色のアスタリスク)に向けると、バイオリアクターを下から見ることができます。顕微鏡に高速CCDカメラを取り付け、パソコンと接続します。セットアップにUVライトを15分間照射して、作業スペースを滅菌します。
- バイオリアクター(図6B、マゼンタの矢印)をジャケット付きの加熱ステージに置き、上からデュアルヘッドグースネックLED光源で照らします(LEDランプのネックは、光ファイバーランプと比較して本体にしっかりと固定できます)。振動テーブル(およびテーブル自体)のペーシング装置が層流クリーンベンチのどの部分にも触れていないことを確認することで、追加のノイズを最小限に抑えます。
- 100 mmのディッシュの内側に予熱した水で満たされた2番目の60 mmディッシュを加熱テーブル(図6B、ターコイズブルーのブラケット)に追加し、継続的な温度監視用の温度プローブを取り付けます。必要に応じて加熱ステージの温度設定を調整し、基準皿の温度を36〜37°Cに維持します。
- 顕微鏡の倍率を1.5倍(またはhECT全体を適切な解像度で視覚化できる別の所望の倍率)に設定します。
- カメラ設定の調整
- カメラソフトウェアを開きます。ビデオフィードのサイズを変更して、hECT全体を視覚化しながら、視野を可能な限りトリミングします。これにより、カメラの速度が最大化されます。
- キャプチャレートを 90 フレーム/秒に設定します。露光時間と光源の位置を調整して、視野全体の照明条件の均一性を最適化し、SPoTのコントラストを最大化します。
- アクイジションソフトウェアのセットアップ
- 矩形パルス刺激装置をオンにし、コンピュータに接続します。振幅 12 V、持続時間 5 ミリ秒の二相性パルスを配信するように設定を調整します。
- データ集録ソフトウェアを開き、「AutomatedPostTracking3.vi」ファイル(補足ファイル4)を開きます。ロードされたら、ツールバーの左側にある白い矢印をクリックして、プログラムを初期化します(図7A)。
- 加熱ステージ上でガラス血球計算盤を使用してソフトウェアを校正します。ツールバー(図7B)で、 ラインツール をクリックして、血球計算盤のマーキング(図には示されていません)の1 mmを横切る線を引きます。[ Distance calibration (pixels/mm)] ボックス (図 7C) で、[ Reference length (mm)] を 1 に設定し、[ Calculate ] ボタンをクリックします。
- ラインツールを使用して組織の幅全体に線を引くことにより、hECT断面積を測定します。[断面積(mm ^ 2)]ボックス(図7D)の1をクリックして、面積を計算します(文献1,2,3,4,5,6,7,8,9,10,11で確立されている線状組織ストリップの円筒形状を仮定します)。12、15、16、18、19、20、
21,22,23,24,25,26,37,38)。hECTのさまざまな部分に沿って繰り返し、ボックス内の他の2つのボタンの下に値を記録します。出力データテーブルファイルは、これら3つの値の平均を報告して、組織の直径を計算します。
- hECT機能特性評価
- 投稿のヒントにフォーカスが合っていることを確認します。閾値設定スイッチをオンにし(図7E)、SPoT(図7G)が明確に区切られ、hECTが収縮しても形状が変わらないまでスライダ(図7F)を調整します。
- 長方形ツールを使用して、いずれかの SpoT の周囲に長方形を描画し (図 7、緑色の長方形)、Post boundaries ボックス内の [Set 1] ボタンをクリックして SPoT の周囲に長方形の位置を設定し、SPoT が常に長方形の境界内に収まるようにします。他の投稿についても繰り返し、セット2で記録します。
- オブジェクトのサイズ設定(図7I)を調整して、プログラムが小さなオブジェクトを追跡しないようにします。各四角形で追跡されるオブジェクトの数が一定であることを確認します。インターフェース(図7J)は、追跡対象物間の測定距離をリアルタイムで表示します。このグラフを使用して、ノイズを監視します。
- ファイルを保存するディレクトリを選択します(図7K)。異なる日のデータを別々のフォルダーに保存します。現在の ティッシュ番号を選択し、[ コメント ]ボックスに任意のコメントを入力します。
- ペーシング周波数(Hz)ヘッダー(図7L)で、必要な周波数の範囲(最小と最大)と、最小から最大にステップアップするための必要な間隔を指定します。捕捉範囲全体にわたってhECTのペーシングを行う場合は、異なるペーシング周波数をテストして、刺激:ピーク比が1:1になる最低周波数を見つけ、その比率が失われるまで周波数を上げ続けます。任意の周波数範囲(例:0.01 Hz〜0.01 Hz)を選択し、方形パルス刺激器の出力をオフにして、自発関数を測定します。
- 右側のボックスで、hECTが新しいペーシング周波数に調整できるように、希望の設定 時間 (周波数が設定されてからデータが記録されない時間間隔)を選択します。 記録時間(秒) と ペーシング電圧(V)を指定します。[ Start Program](プログラムの開始 )ボタンをクリックしてプログラムを開始します(図7M)。
注: 結果は、選択したディレクトリに自動的に保存されます。各記録の後、スクリプトにデータのフーリエ変換が表示され(図7N)、ピークが検出された拍動周波数に対応していることを確認します。 - 必要に応じて、「Excitation Threshold Finding」プログラムを実行して、hECTを刺激するのに必要な最小電圧を求めます(図7O)。必要に応じて、支柱の最大たわみと最小たわみを計算します(図 7P)。
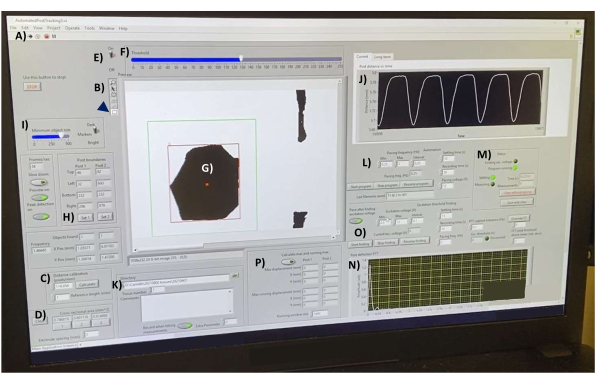
図7:たわみ後のデータ収集インターフェース。 (A)ソフトウェアを実行するためのボタン。(B)長さの測定とオブジェクトの選択のための線と長方形のツールをそれぞれ含むツールバー。(C)距離キャリブレーションコントロール。(D)3つの異なる点でhECT断面積を測定するためのツール。(E)閾値スイッチと(F)スライダーは、ビデオフィードをリアルタイムで高コントラストの画像に変換するためのものです。(G) プレビュー ウィンドウに表示される SPoT。(H) SPoTを選択するためのツール。(I)オブジェクトをサイズでフィルタリングするためのスライダー。(j)被追跡物間の距離をリアルタイムで測定したグラフ。(K) 出力ファイルを保存するディレクトリを選択するためのオプション。(L)ポストトラッキングプログラム(M)の周波数範囲、周波数間隔、録音時間、および録音間の時間を設定するためのオプション。(N)最後に保存された記録のたわみ曲線のフーリエ変換のグラフ出力。(O)hECTを刺激するために必要な最小電圧を見つけるようにプログラムします。(P)支柱の最大たわみと最小たわみを計算するプログラム。略語:hECT = Human Engineered Cardiac Tissue;SPoT = 安定したポストトラッカー。 この図の拡大版をご覧になるには、ここをクリックしてください。
6. PDMSラック測定
- 無負荷距離
- hECTを製造する前に、PDMSラックの希望のペアをフレームに取り付けます。機能測定には、手順5.1で説明したペーシング設定とソフトウェアを使用します。支柱の両端にある固定 SPoT を選択します。
- 必要に応じて光源や閾値を調整し、 ノイズ を <2μmに低減します。グラフに示されている平均ライブ y 値をスプレッドシートに記録します。
- 支柱の高さとhECTの高さ
- ステップ5.2で説明したペーシング設定から、アングルミラーと加熱ステージを取り外します。バイオリアクターをラボジャックに直接置いて、バイオリアクターの側面図を表示します。
- カメラソフトウェアを開きます。露光時間と光源の位置を調整して、視野全体の照明条件の均一性を最適化し、支柱の視認性を最大化します。
- データ集録ソフトウェアを開き、「PostMeasurement_PB3.vi」ファイル(補足ファイル5)を開きます。読み込まれたら、ツールバーの左側にある白い矢印をクリックして、プログラムを初期化します。
- ガラス製血球計算盤を使用してソフトウェアを校正します。表示ウィンドウの左側にある垂直ツールバーの線ツールをクリックし、血球計算盤のマーキングの1mmを横切って線を引きます。画面左下の [距離キャリブレーション (ピクセル/mm)] ボックスで、[基準長さ (mm)] を 1 に設定し、[計算] ボタンをクリックします。
- キャリブレーションフィールドの下の Tissue Number フィールドに目的の組織番号(同定用)を設定します。hECT の左ポストにカメラの焦点を合わせ、[Post Side] ボックスで [Left] を選択します。
- ラインツールを使用して、ポストの基部(上)からSPoTの先端(下)までラインを描画し、[Measure Post Ht]をクリックして記録します。
- 支柱の基部からhECTの遠端まで線を引き、 Measure Tissue Top Htをクリックして記録します。支柱の基部からhECTの近端まで線を引き、 Measure Tissue Base Htをクリックして記録します。
- この時点で、バイオリアクターを回転させて、適切なポストの高さを測定します。同じ測定値を記録する には、適切な投稿 オプションを選択します。 [追加 ]ボタンをクリックすると、スプレッドシートに測定値が入力され、ステップ7で使用されるhECTの平均高さが自動的に計算されます。
- 組織の高さの記録が終了したら、[保存]ボタンをクリックして値をテキストファイルに保存します。
7. カスタム分析スクリプトを使用した機能データ処理
- スプレッドシートエディタで、テンプレート(補足ファイル6)を使用して概要ファイルに入力します。ステップ6.2で取得した ポストの長さ と 平均組織高さ の値を使用します。フォルダーにデータがあるすべての hECT がサマリー ファイルで表されていることを確認します。ファイルに "summary #.csv" という名前を付けます (# は実験開始までの日数を表します)。
注:hECT機能データは、実験日に応じて別々のフォルダに保存する必要があります。 - AnalyzeLogsGUIスクリプト(補足ファイル7)を含むフォルダーとhECT記録を含むフォルダーの両方がパスに追加されていることを確認します。
- データ解析ソフトウェアを開きます。ディレクトリバーの左側にある[ フォルダーの参照 ]ボタンをクリックして、AnalyzeLogsGUIフォルダーとhECT機能データの両方を含む親フォルダーに移動します。 [現在のウィンドウ ]サイドバーで、これらのフォルダを右クリックして[ パスに追加] |選択したフォルダとサブフォルダを追加します。
- 「AnalyzeLogsGui_SC.m」ファイルを開きます。「エディタ」タブで、「ファイル名を指定して実行」ボタンを押し、グラフィカル・ユーザー・インターフェース (GUI) が新しいウィンドウに表示されるのを待ちます。
- [Log Selection]ボックス(図8AI)で、[Select Directory]ボタンをクリックし、hECT機能データを含むフォルダに移動します。Tissueドロップダウンメニューから、処理するhECTを選択します。
- [Data Inputs]ボックス(図8AII)で、手順6.1で記録したポスト間の無負荷距離を[拡張期距離]フィールドに入力します。[支柱半径(mm)]フィールドに 0.25 と入力します。
- [ Analysis Constraints ]ボックス(図8AIII)で、解析から 除外する周波数 を選択するか、 含める特定の周波数 を(カンマで区切って)選択します。 開始時刻 と 終了時刻 は、デフォルトでそれぞれ 0 と −1 に設定され、録画の全長が処理されます。必要に応じて、これらの値を変更して録音をトリミングします。
- [Polynomial Order]と[Frame Size]のフィルタパラメータ(図8AIV)を変更してフィルタリングプロセス中の平滑化レベルを変更し、[Peak Detection Threshold]スライダを変更してスクリプトで認識される最小ピークサイズを設定します。
注: このスクリプトには、アーチファクトによって生じた高いピークをクリップする Spike Removal オプションが含まれています。ただし、これはけいれんの形が変わるため、お勧めできません。代わりに、記録をトリミングしてアーティファクトを除去します(図8AIII)。 - 追加のデータ解析出力には、追加のピーク検出アルゴリズムを実行するポストたわみ解析、トゥイッチ力曲線上の軸を自動的に調整するズームプロットのY軸の自動スケーリング(図8B)、各トゥイッチ力の数値を.figファイルに保存するためのフォーストレース曲線の保存、およびフォースタイムデータの保存などの追加オプション(図8AV)を使用しますをクリックして、けいれんフォースカーブ図にプロットされたフィルタリングされたデータのX座標とY座標を保存します。
- Run Analysis をクリックして、記録全体で平均化されたけいれん力曲線(補足ファイル8)の属性を含む.txtファイルを生成します。
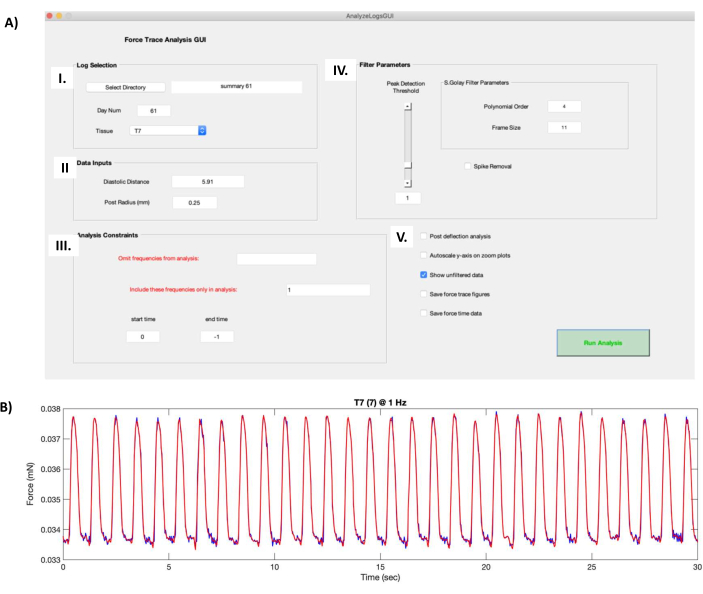
図8:けいれん力曲線の計算。 (A)データ処理ソフトウェアで「AnalyzeLogsGUI.m」ファイルを実行すると、GUIウィンドウが開きます。(I) Log Selectionボックスでは、hECT機能データを含むフォルダのディレクトリを選択できます。[Day Num] フィールドは、プロトコル ステップ 7.1 で作成したサマリー ファイルのタイトルから自動的に入力されます。処理するhECTは、Tissueドロップダウンメニューを使用して選択します。(ii)[データ入力]ボックスには、無負荷距離(プロトコルステップ6.1で取得)やポスト半径(0.25 mm)など、hECTをサポートするPDMSポストのペアに関する情報が含まれています。(III) [Analysis Constraints] ボックスでは、録音を省略したり、含めたりトリミングしたりする周波数を選択できます。(IV) フィルター パラメーター ボックスには、生のけいれん力曲線をフィルターする方法を選択するオプションが含まれています。多項式次数(Polynomial Order)とフレーム サイズ(Frame Size)は、フィルタリング処理中のスムージングのレベルを変更します。ピーク検出しきい値スライダーは、スクリプトによって認識される最小ピークサイズを決定します。「スパイク除去」オプションは、アーチファクトによって生じた高いピークをクリップします。(V)その他のオプションには、追加のピーク検出アルゴリズムを実行するポストたわみ解析、けいれん力曲線に作用するズームプロットの自動スケーリングy軸、けいれん力の数値を保存する力-トレース曲線の保存、プロットされたけいれん力データを保存する力-時間データの保存が含まれます。(B)パネルAのGUIスクリーンショットで生成された、1HzでペーシングされたhECTの30秒記録のけいれん力曲線の例。赤色のけいれん力曲線は、AIVのパラメーターによって生成されたフィルタリングされた力を示し、生のけいれん力曲線に重ね合わされています(濃い青色の曲線は、AVでフィルタリングされていないデータを表示オプションが選択されている場合に表示されます)。略語:hECT = Human Engineered Cardiac Tissue;GUI = グラフィカル・ユーザー・インターフェース。PDMS = ポリジメチルシロキサン。この図の拡大版をご覧になるには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
結果
上記のプロトコルに従って、心筋細胞は、以前に私たちのグループによって使用された健康なiPS細胞株から生成されました9,15、培養で8〜61日後にhECTに作製されました。図9Aは、SPoTなし(上)とSPoTあり(下)で作成されたhECTを下から見た代表的な画像を示しています。機能測定は、hECT製造後37日から52日の間に室温(23°C)および生理...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
文献には多数の線形改変心臓組織モデルが公開されており、その一部を表1に記載する。いくつかのモデルは、組織力の直接測定を含むが、これらは典型的には、構築物を別個の筋浴38に移すことを必要とする。ほとんどのモデルはPDMSのポスト1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16に両端で永久に固定されるティッシュと、最も一般的である設計...
Access restricted. Please log in or start a trial to view this content.
開示事項
K.D.C.は、Novoheartの共同設立者兼最高科学責任者であり、持ち株会社であるMedera Biopharmaceuticalの株式を保有しています。Novoheartは、この研究の資金調達、計画、または実行に貢献していません。しかし、この研究結果は、ノボハートとメデラに経済的影響を与える可能性があります。他の著者は、競合する利害関係はないと宣言しています。
謝辞
著者らは、この方法に関する以前の研究について、Timothy Cashman博士に感謝しています。この研究は、米国国立衛生研究所(NIH)(R01-HL132226およびK01 HL133424)およびLeducq Foundation International Networks of Excellence Program(CURE-PLaN)からの資金提供を受けて行われました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 0.25 mm diamete 304 Stainless Steel Wire | McMaster Carr | 6517K61 | |
| 0.25% trypsin-EDTA | Gibco | 25200056 | |
| 1.7 mL Microtubes | Axygen | MCT-175-C | |
| 10 cm dishes (20 mm tall) | Corning | 353003 | |
| 10 mL Serological Pipette | Drummond | 6-000-010 | |
| 10 N NaOH | Fisher Scientific | SS225-1 | dilute 1:10 in sterile distilled water |
| 10X Modified Eagle Medium | Sigma Aldrich | M0275 | |
| 20 - 200 μL Micropipette | Eppendorf | 3123000055 | |
| 200 μL MicroPipette Tips | VWR | 76322-150 | |
| 5 mL Serological Pipette | Drummond | 6-000-005 | |
| 50 mL Conical Centrifuge Tubes | Falcon | 352070 | |
| 6 cm Petri Dish | Corning | 353002 | |
| 6 Watt LED Dual Gooseneck Illuminator | AmScope | LED-6W | |
| 6-Well Plates | Corning | 353046 | |
| 90 degree angle mirror | Edmund Optics | 45-594 | |
| Acrylic bonding glue | SCIGRIP | #4 | |
| Adjustable 10 cm x 10 cm jack | Fisher Scientific | 14-673-50 | |
| Aluminum 6061 | McMaster Carr | 9008K82 | |
| A-Plan 10X Objective Lens | ZEISS | 1020-863 | |
| Autoclave Bags | Propper | 21002 | |
| B-27 supplement | ThermoFisher | 17504044 | |
| B-27 supplement (without insulin) | ThermoFisher | A1895601 | |
| Benchtop Centrifuge | Eppendorf | 5810 R | |
| Black ABS | Ultimaker | 2.85 mm wide | |
| Bovine Collagen I | Gibco | A1064401 | |
| CHIR99021 | Tocris | 4423 | |
| Class II Biosafety Cabinet | Labconco | 3430009 | |
| Clear Acrylic Sheeting | estreetplastics | 1002502436 | 6.25 mm thick |
| CNC Vertical Mill | Haas | VF-1 | |
| Conductive Graphite Bars | McMaster Carr | 1763T33 | |
| Dissection microscope | Olympus | SZ61 | |
| Dulbecco's Modified Eagle Medium/Ham's F-12 Nutrient Mix | ThermoFisher | 11330032 | |
| Ethanol | Fisher Scientific | A4094 | Dilute to 70% in water |
| EVE Automated Cell counter | NanoEntek | E1000 | |
| EVE Cell Counting Slide | NanoEntek | EVS-050 | |
| Fetal Bovine Serum | Life Technologies | 10438026 | |
| Fine Curved Forceps | Fine Science Tools | 11253-25 | |
| Forma Series II Water Jacketed CO2 Incubator | Thermo Electron Corporation | 3110 | AKA "incubator". With HEPA class 100 filter |
| Fusion360 software | Autodesk | AKA "CAD software" | |
| Glass Hemocytometer | Reichert | 1475 | 0.1 mm deep |
| HEPES | Sigma Aldrich | H3784 | |
| hESC qualified matrigel | Corning | 354277 | AKA "basement membrane matrix". Store in frozen aliquots |
| High Speed CCD Camera | PixelLINK | P7410 | |
| Inverted Microscope | Carl Zeiss Werk | Axiovert 40 CFL | 10X phase contrast objective |
| IWR-1 | Selleck Chem | S7086 | |
| LabView Software | National Instruments | 2016 | |
| Laminar flow clean bench | NuAire | NU-201-330 | necessary for hECT functional analysis |
| Laptop | AsusTek | Strix | Intel Core i& processor ,CPU 2.8GHz, 16GB RAM |
| Laser Cutting Machine | Epilog | Helix 24 | |
| Magnification headset | ExcelBlades | 70020 | Recommended for steps requiring fine manipulations |
| Matlab | Mathworks | Version 2019b or later | AKA "data analysis software" |
| Micro Vannas Scissors, 3 mm blade | WPI Instruments | 501839 | |
| Microscope Boom Stand | Olympus | SZ2-STU1 | |
| Penicillin-Streptomycin stock solution | ThermoFisher | 15140122 | 10,000 IU/ml penicillin; 10,000 μg/ml streptomycin |
| Phosphate-buffered saline without divalent cations | Sigma Aldrich | P3813 | Diluted in distilled water to 1X and 10X concentrations |
| Pipette Controller | Drummond | 4-000-100 | |
| PixelLINK Capture OEM | PixelLINK | 10.2.1.6 | AKA "Camera Software" |
| Polysulfone | McMaster Carr | 86735K73 | translucent amber color |
| Polytetrafluoroethylene (PTFE) | McMaster Carr | 8545K176 | Black, molded |
| ReLeSR | Stem Cell Technologies | 5872 | AKA "iPSC dissociation media" |
| Rosewell Park Memorial Institute 1640 Media | ThermoFisher | 11875135 | |
| Silicone Sheeting | SMI manufacturing | glossy, 0.02 in thickness, durometer 40 | |
| Size 10/0 Blue, Green, Red, and Yellow Glass Seed Beads | Michael's | color should withstand autoclaving | |
| Spatula | Fisher Scientific | 14-373 | used for mixing PDMS |
| Square Pulse Stimulator | Astro-Med / Grass Technologies | S88X | |
| Stainless Steel Razoblades | GEM | 62-0179-CTN | preferred over non-stainless steel due to lower hardness |
| Stemflex | ThermoFisher | A3349401 | AKA "iPSC culture media" |
| Sterile distilled water | ThermoFisher | 5230 | |
| Sylgard 170 - Silicone Elastomer Encapsulant Black 0.9 kg Kit | Dow | DOWSIL 170 2LB KIT | AKA black Polydimethylsiloxane (black PDMS) |
| Sylgard 184 - Silicone Elastomer Clear 1 lb Kit | Dow | DC 184 SYLGARD 0.5KG 1.1LB KIT | AKA Polydimethylsiloxane (PDMS) |
| Temperature-controlled heated stage | Okolab | H401-HG-SMU | Set height to 10 cm |
| Thermoplastic 3D printer | Ultimaker | Ultimaker 3 | |
| Thiazovivin | Selleck Chem | S1459 | |
| Trypan Blue | NanoEntek | EBT-001 | |
| Vacuum Chamber | Bel-Art Parts | F42027-0000 | |
| Variable Speed Mini Band Saw | Micro-Mark | 82203 | |
| Variable Speed Miniature Drill Press | Micro-Mark | 82959 | |
| Vibration Isolation Table | Labconco | 3618000 | |
| Weighing Boats | VWR | 10803-140 | |
| Talon Cylinder Bench Clamp | VWR | 97035-528 | AKA screw clamp |
参考文献
- Serrao, G. W., et al. Myocyte-depleted engineered cardiac tissues support therapeutic potential of mesenchymal stem cells. Tissue Engineering. Part A. 18 (13-14), 1322-1333 (2012).
- Turnbull, I. C., et al. Advancing functional engineered cardiac tissues toward a preclinical model of human myocardium. FASEB Journal. 28 (2), 644-654 (2014).
- Cashman, T. J., et al. Construction of defined human engineered cardiac tissues to study mechanisms of cardiac cell therapy. Journal of Visualized Experiments. (109), e53447(2016).
- Stillitano, F., et al. Genomic correction of familial cardiomyopathy in human engineered cardiac tissues. European Heart Journal. 37 (43), 3282-3284 (2016).
- Mayourian, J., et al. Experimental and computational insight into human mesenchymal stem cell paracrine signaling and heterocellular coupling effects on cardiac contractility and arrhythmogenicity. Circulation Research. 121 (4), 411-423 (2017).
- Mayourian, J., et al. therapeutic paracrine modulation of cardiac excitation-contraction coupling. Circulation Research. 122 (1), 167-183 (2018).
- Mayourian, J., et al. Exosomal microRNA-21-5p mediates mesenchymal stem cell paracrine effects on human cardiac tissue contractility. Circulation Research. 7 (122), 933-944 (2018).
- Turnbull, I. C., et al. Cardiac tissue engineering models of inherited and acquired cardiomyopathies. Methods in Molecular Biology. 1816, 145-159 (2018).
- Murphy, J. F., et al. Adult human cardiac stem cell supplementation effectively increases contractile function and maturation in human engineered cardiac tissues. Stem Cell Research & Therapy. 10 (1), 373(2019).
- Breckwoldt, K., et al. Differentiation of cardiomyocytes and generation of human engineered heart tissue. Nature Protocols. 12 (6), 1177-1197 (2017).
- Huang, C. Y., et al. Enhancement of human iPSC-derived cardiomyocyte maturation by chemical conditioning in a 3D environment. Journal of Molecular and Cellular Cardiology. 138, 1-11 (2020).
- Ramade, A., Legant, W. R., Picart, C., Chen, C. S., Boudou, T. Microfabrication of a platform to measure and manipulate the mechanics of engineered microtissues. Methods in Cell Biology. 121, 191-211 (2014).
- Ronaldson-Bouchard, K., et al. Engineering of human cardiac muscle electromechanically matured to an adult-like phenotype. Nature Protocols. 14 (10), 2781-2817 (2019).
- Tamargo, M. A., et al. milliPillar: A platform for the generation and real-time assessment of human engineered cardiac tissues. ACS Biomaterials Science & Engineering. 7 (11), 5215-5229 (2021).
- Ceholski, D. K., et al. CXCR4 and CXCR7 play distinct roles in cardiac lineage specification and pharmacologic β-adrenergic response. Stem Cell Research. 23, 77-86 (2017).
- Bliley, J. M., et al. Dynamic loading of human engineered heart tissue enhances contractile function and drives a desmosome-linked disease phenotype. Science Translational Medicine. 13 (603), (2021).
- Ribeiro, M. C., et al. A new versatile platform for assessment of improved cardiac performance in human-engineered heart tissues. Journal of Personalized Medicine. 12 (2), 214(2022).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Mannhardt, I., et al. Human engineered heart tissue: Analysis of contractile force. Stem Cell Reports. 7 (1), 29-42 (2016).
- Mannhardt, I., et al. Blinded contractility analysis in hiPSC-cardiomyocytes in engineered heart tissue format: Comparison with human atrial trabeculae. Toxicological Sciences. 158 (1), 164-175 (2017).
- Saleem, U., et al. Force and calcium transients analysis in human engineered heart tissues reveals positive force-frequency relation at physiological frequency. Stem Cell Reports. 14 (2), 312-324 (2020).
- Thavandiran, N., et al. Functional arrays of human pluripotent stem cell-derived cardiac microtissues. Scientific Reports. 10 (1), 6919(2020).
- Bielawski, K. S., Leonard, A., Bhandari, S., Murry, C. E., Sniadecki, N. J. Real-time force and frequency analysis of engineered human heart tissue derived from induced pluripotent stem cells using magnetic sensing. Tissue Engineering. Part C, Methods. 22 (10), 932-940 (2016).
- Leonard, A., et al. Afterload promotes maturation of human induced pluripotent stem cell derived cardiomyocytes in engineered heart tissues. Journal of Molecular and Cellular Cardiology. 118, 147-158 (2018).
- Bose, P., Huang, C. Y., Eyckmans, J., Chen, C. S., Reich, D. H. Fabrication and mechanical properties measurements of 3D microtissues for the study of cell-matrix interactions. Methods in Molecular Biology. 1722, 303-328 (2018).
- Zhang, W., et al. Maturation of human embryonic stem cell-derived cardiomyocytes (hESC-CMs) in 3D collagen matrix: Effects of niche cell supplementation and mechanical stimulation. Acta Biomaterialia. 49, 204-217 (2017).
- van Neste, C. Advances in bioreactor design and multi-dimensional analysis for assessing maturation phenotype of human engineered cardiac tissues. PhD thesis. Icahn School of Medicine at Mount Sinai. , New York. https://www.prouest.com/docview/2722362863 (2022).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Salazar, B. H., Cashion, A. T., Dennis, R. G., Birla, R. K. Development of a cyclic strain bioreactor for mechanical enhancement and assessment of bioengineered myocardial constructs. Cardiovascular Engineering and Technology. 6 (4), 533-545 (2015).
- Putame, G., et al. Application of 3D printing technology for design and manufacturing of customized components for a mechanical stretching bioreactor. Journal of Healthcare Engineering. 2019, 3957931(2019).
- Akintewe, O. O., Roberts, E. G., Rim, N. -G., Ferguson, M. A. H., Wong, J. Y. Design approaches to myocardial and vascular tissue engineering. Annual Review of Biomedical Engineering. 19, 389-414 (2017).
- Chen, G., et al. Phospholamban as a crucial determinant of the inotropic response of human pluripotent stem cell-derived ventricular cardiomyocytes and engineered 3-dimensional tissue constructs. Circulation. Arrhythmia and Electrophysiology. 8 (1), 193-202 (2015).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Beauchamp, P., et al. 3D co-culture of hiPSC-derived cardiomyocytes with cardiac fibroblasts improves tissue-like features of cardiac spheroids. Frontiers in Molecular Biosciences. 7, 14(2020).
- Campostrini, G., et al. functional analysis and applications of isogenic three-dimensional self-aggregating cardiac microtissues from human pluripotent stem cells. Nature Protocols. 16 (4), 2213-2256 (2021).
- Swiatlowska, P., Iskratsch, T. Tools for studying and modulating (cardiac muscle) cell mechanics and mechanosensing across the scales. Biophysical Reviews. 13 (5), 611-623 (2021).
- Zhao, Y., et al. Engineering microenvironment for human cardiac tissue assembly in heart-on-a-chip platform. Matrix Biology. 85-86, 189-204 (2020).
- Fujiwara, Y., Deguchi, K., Miki, K., Nishimoto, T., Yoshida, Y. A method for contraction force measurement of hiPSC-derived engineered cardiac tissues. Methods in Molecular Biology. 2320, 171-180 (2021).
- Wang, E. Y., et al. Biowire model of interstitial and focal cardiac fibrosis. ACS Central Science. 5 (7), 1146-1158 (2019).
- Zhao, Y., et al. A platform for generation of chamber-specific cardiac tissues and disease modeling. Cell. 176 (4), 913-927 (2019).
- Lee, E. K., et al. Machine learning of human pluripotent stem cell-derived engineered cardiac tissue contractility for automated drug classification. Stem Cell Reports. 9 (5), 1560-1572 (2017).
- Batalov, I., Feinberg, A. W. Differentiation of cardiomyocytes from human pluripotent stem cells using monolayer culture. Biomarker Insights. 10, 71-76 (2015).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), E1848-E1857 (2012).
- Penefsky, Z. J., Buckley, N. M., Litwak, R. S. Effect of temperature and calcium on force-frequency relationships in mammalian ventricular myocardium. Pflugers Archiv. 332 (4), 271-282 (1972).
- Bers, D. M. Excitation-Contraction Coupling and Cardiac Contractile Force. , Springer. Dordrecht, the Netherlands. (2001).
- Kanaya, N., Gable, B., Wickley, P. J., Murray, P. A., Damron, D. S. Experimental conditions are important determinants of cardiac inotropic effects of propofol. Anesthesiology. 103 (5), 1026-1034 (2005).
- Galende, E., et al. Amniotic fluid cells are more efficiently reprogrammed to pluripotency than adult cells. Cellular Reprogramming. 12 (2), 117-125 (2010).
- Wacker-Gussmann, A., Strasburger, J. F., Cuneo, B. F., Wakai, R. T. Diagnosis and treatment of fetal arrhythmia. American Journal of Perinatology. 31 (7), 617-628 (2014).
- Federmann, M., Hess, O. M. Differentiation between systolic and diastolic dysfunction. European Heart Journal. 15, 2-6 (1994).
- Knight, W. E., et al. Maturation of pluripotent stem cell-derived cardiomyocytes enables modeling of human hypertrophic cardiomyopathy. Stem Cell Reports. 16 (3), 519-533 (2021).
- Ma, Z., et al. Contractile deficits in engineered cardiac microtissues as a result of MYBPC3 deficiency and mechanical overload. Nature Biomedical Engineering. 2 (12), 955-967 (2018).
- de Lange, W. J., et al. Human iPSC-engineered cardiac tissue platform faithfully models important cardiac physiology. American Journal of Physiology. Heart and Circulatory Physiology. 320 (4), H1670-H1686 (2021).
- Hiranandani, N., Varian, K. D., Monasky, M. M., Janssen, P. M. L. Frequency-dependent contractile response of isolated cardiac trabeculae under hypo-, normo-, and hyperthermic conditions. Journal of Applied Physiology. 100 (5), 1727-1732 (2006).
- Puglisi, J. L., Bassani, R. A., Bassani, J. W., Amin, J. N., Bers, D. M. Temperature and relative contributions of Ca transport systems in cardiac myocyte relaxation. The American Journal of Physiology. 270 (5), H1772-H1778 (1996).
- Puglisi, J. L., Yuan, W., Bassani, J. W., Bers, D. M. Ca(2+) influx through Ca(2+) channels in rabbit ventricular myocytes during action potential clamp: Influence of temperature. Circulation Research. 85 (6), e7-e16 (1999).
- Li, R. A., et al. Bioengineering an electro-mechanically functional miniature ventricular heart chamber from human pluripotent stem cells. Biomaterials. 163, 116-127 (2018).
- Sharma, A., et al. Biomanufacturing in low Earth orbit for regenerative medicine. Stem Cell Reports. 17 (1), 1-13 (2022).
- Strauss, D. G., Wu, W. W., Li, Z., Koerner, J., Garnett, C. Translational models and tools to reduce clinical trials and improve regulatory decision making for QTc and proarrhythmia risk (ICH E14/S7B updates). Clinical Pharmacology & Therapeutics. 109 (2), 319-333 (2021).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756(2020).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Designing a Bioreactor to Improve Data Acquisition and Model Throughput of Engineered Cardiac Tissues
Posted by JoVE Editors on 1/10/2024. Citeable Link.
An erratum was issued for: Designing a Bioreactor to Improve Data Acquisition and Model the Throughput of Engineered Cardiac Tissues. The title was corrected from:
Designing a Bioreactor to Improve Data Acquisition and Model the Throughput of Engineered Cardiac Tissues
to:
Designing a Bioreactor to Improve Data Acquisition and Model Throughput of Engineered Cardiac Tissues
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved