需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
设计生物反应器以改善工程心脏组织的数据采集和模型通量
Erratum Notice
摘要
使用干细胞来源的心肌细胞进行生物工程改造的三维心脏组织已成为在 体外 研究健康和患病人类心肌的有前途的模型,同时概括了天然心脏生态位的关键方面。该手稿描述了一种用于制造和分析由人类诱导的多能干细胞来源的心肌细胞产生的高内涵工程心脏组织的方案。
摘要
心力衰竭仍然是全球死亡的主要原因,因此迫切需要更好的人类心脏临床前模型。组织工程对于基础科学心脏研究至关重要; 体外 人类细胞培养消除了动物模型的种间差异,而更像组织的 3D 环境(例如,具有细胞外基质和异细胞偶联)比塑料培养皿上的传统二维培养更能模拟 体内 条件。然而,每个模型系统都需要专门的设备,例如定制设计的生物反应器和功能评估设备。此外,这些方案通常很复杂,劳动密集型,并且受到小而脆弱组织的失败的困扰。
本文描述了一种使用诱导多能干细胞来源的心肌细胞生成强大的人类工程心脏组织 (hECT) 模型系统的过程,用于组织功能的纵向测量。并行培养六个具有线性条形几何形状的 hECT,每个 hECT 悬挂在连接到 PDMS 架上的一对力感应聚二甲基硅氧烷 (PDMS) 柱上。每个帖子都有一个黑色的PDMS稳定帖子跟踪器(SPoT),这是一项新功能,可提高易用性、通量、组织保留率和数据质量。该形状允许对柱子挠度进行可靠的光学跟踪,从而产生具有绝对主动和被动张力的改进的抽搐力跟踪。帽的几何形状消除了由于 hECT 从柱子上滑落而导致的组织失效,并且由于它们涉及 PDMS 支架制造后的第二步,因此可以将 SPoT 添加到现有的基于 PDMS 柱子的设计中,而无需对生物反应器制造过程进行重大更改。
该系统用于证明在生理温度下测量 hECT 功能的重要性,并在数据采集过程中显示稳定的组织功能。总之,我们描述了一种最先进的模型系统,该系统再现了关键的生理条件,以提高体 外 应用工程心脏组织的生物保真度、效率和严谨性。
引言
工程心脏组织模型具有多种几何形状和配置,用于概括传统二维细胞培养难以实现的天然心脏生态位的各个方面。最常见的配置之一是线性组织条,两端都有柔性锚点以诱导组织自组装,并为组织提供定义的预紧力和由此产生的抽搐力的读数 1,2,3,4,5,6,7,8,9,10,11,12、13、14、15、16、17、18、19、20、21
,22,23,24,25,26,27.通过对组织缩短的光学跟踪,并使用弹性束理论根据测得的挠度和锚栓的弹簧常数计算力,可以稳健地确定产生的力 1,2,3,4,5,6,7,8,9,10,11,12、13、14、15、16、17、18、19、20、
21,22,25,26,28。
然而,心脏组织工程仍然是一个不断发展的领域,仍然存在一些挑战。每个模型系统10,29,30,31都需要专用设备,例如定制的生物反应器和功能评估设备。由于劳动密集型方案、大量细胞和组织脆性,这些构建体的微环境的大小和复杂性通常受到低通量的限制。为了解决这个问题,一些研究小组已经转向制造仅包含数百或数千个细胞的微组织,以促进对药物发现有用的高通量测定。然而,这种缩小的规模使功能12的准确评估变得复杂,消除了天然心脏生态位的关键方面(如营养/氧扩散梯度和复杂结构36),并限制了可用于后续分子和结构分析的材料数量(通常需要组织混合)。表1总结了文献1,2,3,4,5,6,7,8,9,10,11,12,13,14,15, 16,17,18,19,20,
21,22,23,24,25,26,37,38,39,40。
| 群 | 每个组织的细胞数 | 每块板的组织 | 板格式 | 锚定功能 | 功能数据采集方法 | 共享媒体浴? | 功能测量- 原地? | ||||
| 吉田 (ECT)38 | 400万 | 6 | 改良的 6 孔板* | 力传感器 | 直接力测量 | 不 | 不 | ||||
| 陈 (hESC-CM-ECT)26 | 310 千米 | 6 | 定制 6 孔培养皿 | PDMS帖子 | 直接力测量 | 是的 | 不 | ||||
| 范伯格 (dyn-EHT)16 | 150万 | 6 | 定制 6 孔培养皿 | PDMS线 | 组织形状 | 不 | 是的 | ||||
| RADISIC(生物线)39、40 | 110 千米 | 8 | 高分子线材 | 线材形状 | 是的 | 是的 | |||||
| Costa(单 hECT)1, 2 | 1-200万 | 4** | 10 厘米培养皿** | PDMS帖子 | 光学偏转(边缘/物体跟踪) | 是的 | 是的 | ||||
| Costa(多 hECT)3–9 | 500 K-100万 | 6 | 6厘米培养皿 | PDMS帖子 | 光学偏转(边缘/物体跟踪) | 是的 | 是的 | ||||
| Costa(多 hECT 带 SPoT) | 100万 | 6 | 6厘米培养皿 | 带黑色大写字母的 PDMS 帖子 | 光学偏转(物体跟踪) | 是的 | 是的 | ||||
| 帕西尔掀背/两厢车(EHT)17 | 245 千米 | 36 | 12孔板 | 带黑色大写字母的 PDMS 帖子 | 光学偏转(物体跟踪) | 是的 | 是的 | ||||
| Vunjak-Novakovic13, 18 | 100万 | 12 | 6厘米培养皿 | 带大盖的 PDMS 柱 | 光学偏转(边缘检测) | 是的 | 是的 | ||||
| Vunjak-Novakovic(MilliPillar)14 | 550 千米 | 6 | 定制 6 孔培养皿 | 带大盖的 PDMS 柱 | 光学偏转(物体跟踪);钙成像 | 不 | 是的 | ||||
| 埃申哈根 (EHT)10, 19–21 | 100万 | 12 | 12孔板 | 带大盖的 PDMS 柱 | 光学偏转(后偏转的边缘检测);钙成像 | 不 | 是的 | ||||
| 赞德斯特拉 (CaMiRi)22 | 25-150 千米 | 96 | 96孔板 | 带钩子的PDMS柱 | 光学偏转(边缘检测) | 不 | 是的 | ||||
| 穆里23, 24 | 900 千米 | 24 | 24孔板 | 带盖的PDMS接线柱,集成磁铁 | 磁性传感器 | 不 | 是的 | ||||
| 帝国 (μTUG)11, 12, 25 | 定义 | 156 | 156孔培养皿 | 带盖的PDMS接线柱,集成磁铁 | 光学跟踪(荧光珠) | 是的 | 是的 | ||||
表1:文献中一些线性工程心脏组织模型的特征。 线性工程心脏组织模型在大小、通量、锚定特征设计、共享介质浴的便利性以及对用于功能表征的单独肌肉浴系统的要求方面各不相同。* 研究人员使用了基于标准 6 孔板尺寸的市售工程组织系统。** 一种模块化系统,其中单组织生物反应器以所需的数量和位置锚定在任何塑料培养皿上。
本文描述了构建我们建立的线性人类工程心脏组织 (hECT) 模型的最新协议1,2,3,4,5,6,7,8,9,15,27 以及评估 hECT 收缩功能的方法。每个多组织生物反应器在共享培养基浴中最多可容纳 6 个 hECT,并由两个由有机硅弹性体聚二甲基硅氧烷 (PDMS) 制成的"架"件组成,安装在刚性聚砜框架上。每个PDMS机架包含六个直径为0.5 mm,长为3.25 mm的柔性集成力传感柱,两个机架共同提供六对立柱,每个柱可容纳一个hECT。生物反应器的倒置有助于克服由于培养基中的水冷凝或气液界面弯月面的变形而对hECT的可视化的任何障碍。hECT 的每次收缩都会导致集成端柱的偏转,并且偏转信号的光学测量被处理成表示 hECT 收缩函数的力与时间的追踪 1,2,3,4,5,6,7,8,9,15,27 .与通常用于这种大小组织的单组织生物反应器相比,多组织设计提高了实验通量,并能够研究具有潜在不同细胞组成的相邻组织之间的旁分泌信号传导。该系统已在已发表的研究中得到验证,这些研究描述了疾病建模 4,8、旁分泌信号转导 6,7、异细胞培养 5,9 和治疗筛查 7,9 中的应用。
在该系统中,hECT 设计为长约 6 mm,直径约 0.5 mm,以便以低噪声对力测量进行稳健的光学跟踪。此外,扩散梯度和细胞组织等组织复杂性的各个方面都与每个组织 100 万个细胞的可管理要求相平衡。使用标准CCD相机技术,低至1 μN的力(表示小于5 μm的偏转后)会产生清晰的信号,确保即使是极弱的收缩功能,如某些hECT疾病模型所观察到的那样,也可以准确测量。这也有助于对抽搐力曲线进行详细分析,从而能够对多达 16 个收缩力指标41 进行高内涵分析,包括发展力、收缩率 (+dF/dt) 和松弛率 (−dF/dt) 以及节拍率变异性。
该协议从制造生物反应器组件的说明开始。特别注意最大限度地提高hECT产量,减少组织功能的技术差异,并优化组织评估的质量和深度的步骤。大多数心脏组织工程研究没有报告制造和长期测试期间的组织损失率,尽管这是该领域众所周知的挑战,并降低了研究的通量和效率27。这里描述的组织工程方法经过多年的改进,以确保所有hECT在大多数生物反应器中保留(无论PDMS架是如何制造的)。然而,即使是 5%-20% 的组织损失也会显着影响统计功效,特别是在受可用心肌细胞数量限制的小型实验中(例如,由于某些患病细胞系的分化挑战4 或由于商业购买的心肌细胞的高成本),或受治疗条件(例如,各种治疗化合物的可用性有限或成本高)。
该协议描述了稳定柱跟踪器(SPoTs)的制造,这是PDMS机架的一个新功能,其功能是固定hECT27的力感应柱末端的盖子。它展示了帽的几何形状如何显着减少因掉落或拉下柱子而造成的 hECT 损失,从而为培养具有更多刚度和张力的 hECT 开辟了新的机会,这在无盖柱上培养具有挑战性。此外,SPoT提供了一个高对比度的物体,通过一致且定义明确的形状27来改善hECT收缩的光学跟踪。接下来是根据先前发表的方案 3,42,43 描述培养人诱导多能干细胞 (iPSC) 和心肌细胞分化,并解释 hECT 制造、培养和功能测量。
本文还讨论了在生理温度下测量组织功能的必要性。人心肌(胎儿以及成人健康和患病组织)以及来自多种动物物种(包括大鼠、猫、小鼠、雪貂和兔子)的心脏组织44,45,与生理温度相比,在28°C-32°C的温度下,频率匹配的抽搐力显着增加 - 这种现象称为低温正性肌力45,46.然而,温度对工程心肌组织功能的影响仍未得到充分研究。文献中许多最近的工程心脏组织模型被设计为在37°C下进行功能评估,以接近生理条件13,14,37。然而,据我们所知,尚未系统地研究温度对工程心脏组织产生的力的影响。该协议描述了一种起搏电极设计,该设计可最大限度地减少测试期间的热损失,并允许将绝缘加热元件合并到设置中以进行功能测量,这可以将 hECT 保持在生理温度而不会影响无菌性 27。然后,我们报告了温度对hECT功能的一些观察到的影响,包括对产生的力,自发跳动频率,+dF / dt和−dF / dt。总而言之,本文提供了制造这种多组织力感应生物反应器系统所需的细节,以制造人类工程心脏组织并评估其收缩功能,并提供了一组数据,为室温和 37 °C 下的测量结果提供了比较基础27。
Access restricted. Please log in or start a trial to view this content.
研究方案
该协议使用了去识别化的 iPSC 系 SkiPS 31.3(最初使用来自健康 45 岁男性的真皮成纤维细胞重新编程)47,因此,根据该机构的人类研究伦理委员会指南,免于特定的机构审查委员会批准。在无菌条件下,在HEPA过滤的II类生物安全柜或层流工作台中进行所有细胞和hECT操作。通过0.22μm过滤器过滤对所有非无菌溶液进行灭菌,并将所有细胞和hECT保持在37°C,95%相对湿度和5%CO2的培养箱中。
1. 生物反应器制造
- 生物反应器组件和铝母铸件制造
注: 补充文件 1 中提供了计算机辅助设计 (CAD) 文件。 可以在这些步骤之间的任何位置暂停协议。建议聘请专业机械师来制造本节中描述的母模,因为需要高公差 (≤5 μm) 和平滑的光洁度才能实现准确的后几何形状,并将聚砜框架正确压合到聚四氟乙烯 (PTFE) 底板上(旨在紧密摩擦配合,但不要太紧)。- 使用计算机数控 (CNC) 铣床,根据 图 1A 中的原理图加工出 PTFE 基板。hECT将在六个均匀分布的孔(白色箭头)中形成。
- 使用数控铣床,根据 图1B中的原理图加工由铝铸造的聚二甲基硅氧烷(PDMS)机架负极母版,并带有三个框架支架(绿色星号)。钻六个直径为 0.5 毫米的均匀分布的孔(洋红色箭头),用于创建 PDMS 柱。
- 使用数控铣床,根据 图1C中的示意图从聚砜中加工出生物反应器框架。框架支架(绿色星号)对应于机架铸件中看到的框架支架(图1B,绿色星号)。
- 使用数控铣床,根据 图1D中的原理图从铝中加工出铝铸件。每个插槽都包含一个 0.25 mm 高的三角形搁板(橙色三角形),为 PDMS 流过 PDMS 机架铸件中的孔提供死角(图 1B,洋红色箭头)。
- 从铝负极母版铸造PDMS机架
- 使用热塑性熔融沉积建模 3D 打印机,打印两个 PDMS 机架铸造设备支架(补充文件 1)。使用以下打印设置:层高 0.1 mm,壁/底/顶厚 1 mm,三角形填充密度为 90%,打印温度 230 °C,构建版温度 70 °C,帽檐用于附着力。
- 在铸件架中放置四个铝负母铸件(图2AI),使柱孔与三角形搁板对面的死角对齐(见 图1D)。将设备包裹在一块 0.5 毫米厚的矩形硅胶片(图 2B,白色箭头)中作为垫圈,以防止液体 PDMS 泄漏,并使用螺丝夹将其夹在两个平行的 3D 打印支架之间。
- 在浅容器中将 0.5 mL PDMS 固化剂加入 5 mL PDMS 弹性体基质(根据制造商说明,比例为 1:10)中,并剧烈混合 5 分钟。在真空室中对PDMS混合物脱气,并在室温下施加强真空(0.1-1kPa)20-60分钟或直到气泡消失。
- 将PDMS混合物倒在浇注装置上,过量填充以确保完全覆盖每个槽(图2AII)。如果需要,在PDMS机架的主体(图2AII)上添加小的彩色玻璃珠,与柱子相对的一侧(图2B),以便对每个PDMS机架进行唯一标识。将铸造设备放回真空室(确保其水平水平),并施加强真空至少 12 小时。让PDMS在室温下固化约48小时,远离灰尘,以实现完全固化和最大强度的精密柱子。避免使用烤箱,因为这会使 3D 打印组件变形。
注意:协议可以在此处暂停。
- 从铝负极母铸件上拆下 PDMS 机架
- 拆下夹子、支架和硅胶片从铸造设备上取下。使用不锈钢剃须刀片,修剪掉浇注设备和框架支架顶部的 PDMS 薄膜,然后用手指轻轻地将 PDMS 架与铸件支架的侧面分开。将钝的不锈钢剃须刀片插入铸件和铸件支架之间的死角,然后将它们撬开(图 2CI、II),确保填充死角的 PDMS 保持在铸件支架上(因为它连接到柱子上)。使用锋利的不锈钢刀片,切掉剩余的PDMS薄膜,并从柱子的尖端切割死区PDMS(图2C III-V)。
- 关键步骤:将PDMS机架从铸件中释放出来(图2D)。从立柱对面的一侧开始,用手指慢慢将 PDMS 机架与铸件分开,在交替的一侧工作,直到立柱没有主铸件。
- 重复上一步,直到释放所有 PDMS 机架和所有柱子。使用锋利的剃须刀片修剪掉机架上任何剩余的多余 PDMS。结果是一个PDMS架(图2E),具有六个完整的柱子(橙色箭头)和用于识别的彩色珠子(蓝色箭头)。
注意:协议可以在此处暂停。
- 稳定后跟踪器(SPoT)制造
- 使用热塑性熔融沉积建模 3D 打印机,打印 SPoT 铸造装置的组件(补充文件 2 和图 3AI、II)。使用以下打印设置:层高 0.1 mm,壁/底/顶厚 1 mm,三角形填充密度为 80%,打印温度为 230 °C,构建板温度为 70 °C,以及用于附着力的边缘。
- 确保 3D 打印件之间以及 PDMS 支架和三叉夹具之间牢固的压合,并确认 PDMS 支架与刚好到达孔底部的柱子紧密贴合而不会弯曲。如有必要,修剪/锉削塑料。
- 将 0.5 mL 黑色 PDMS A 部分加入 0.5 mL B 部分(根据制造商说明,比例为 1:1)到小型称重船(或类似的小型浅容器)中,并充分混合直至颜色均匀。在强真空下将混合的黑色PDMS在真空室中脱气20分钟。将脱气的黑色PDMS倒在3D打印的底座上以填充孔,然后敲击以确保没有气泡残留。尽可能多地刮掉底座上多余的PDMS。
- 将三叉板卡在底座上,并将PDMS机架放在三叉夹具上的凹槽中(图3AII,绿松石矩形),确保柱子的末端浸入圆形孔中的黑色PDMS中(图3B,C)。在室温下固化黑色PDMS,并保护灰尘48小时。
注意:协议可以在此处暂停。 - 滑出三叉戟,最大限度地减少柱子上的张力。使用小镊子刮掉每个SPoT周围的黑色PDMS薄膜;然后,将细尖弯曲的镊子插入SPoT孔中,以将其从3D打印的底座中释放出来(图3D)。
- 检查SPoT(图3E),并使用细Vannas剪刀从铸造过程中修剪掉步骤1.4.5中未去除的任何剩余的黑色PDMS薄膜。通过将PDMS机架安装到聚砜框架上,然后将其滑到黑色底板上,确保成品柱的长度正确(图4A)。
注意:协议可以在此处暂停。 - 配对PDMS机架,并使用框架标签将它们添加到框架中(图4A)。在带有PTFE底板的袋子中高压灭菌至少30分钟(<122°C以减少翘曲)。
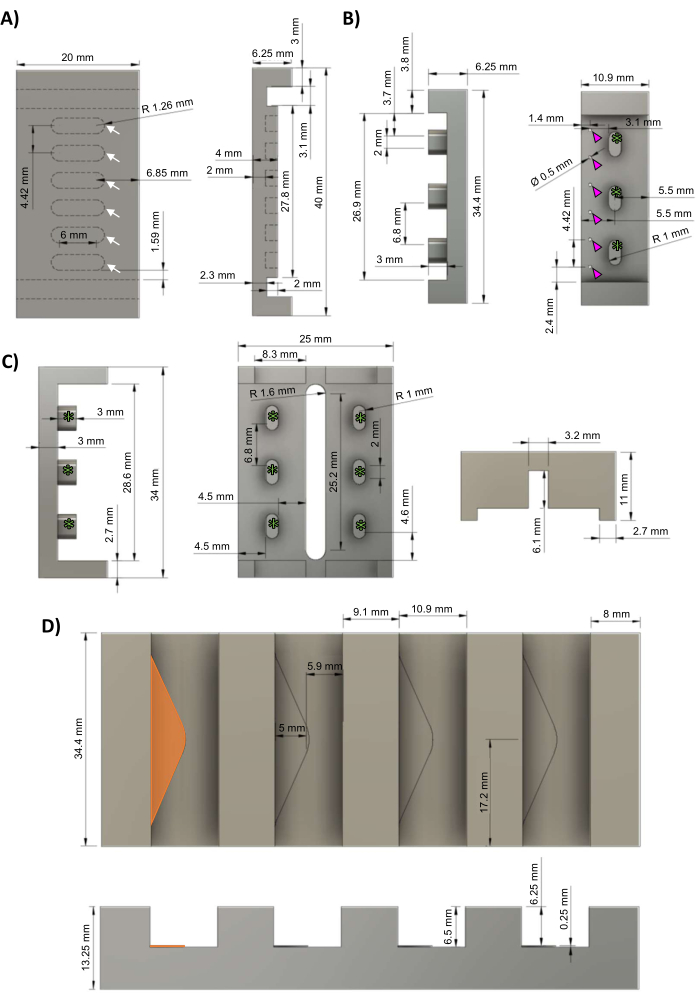
图 1:hECT 生物反应器组件。 (A) PTFE底板的顶视图(左)和侧视图(右),有六个均匀分布的孔,用于形成hECT(白色箭头)。(B) PDMS 机架的铝负极母铸件的侧视图(左)和顶视图(右),带有六个均匀分布的柱子(洋红色箭头)和三个用于连接到生物反应器框架的间隙(绿色星号)。(C) PDMS 机架聚砜框架的侧视图(左)和底视图(右),具有三个均匀分布的框架支架(绿色星号),对应于 PDMS 机架铸件中的框架支架(面板 B)。(D) 铝铸件支架的顶视图(顶部)和侧视图(底部),带有四个用于 PDMS 机架铸件的插槽,每个插槽都有一个 0.25 毫米高的三角形搁板(最左侧的搁板以橙色突出显示)。这个数字是从van Neste27修改而来的。缩写:hECT = 人类工程心脏组织;Ø = 直径;PTFE = 聚四氟乙烯;PDMS = 聚二甲基硅氧烷;R = 半径。 请点击这里查看此图的较大版本.
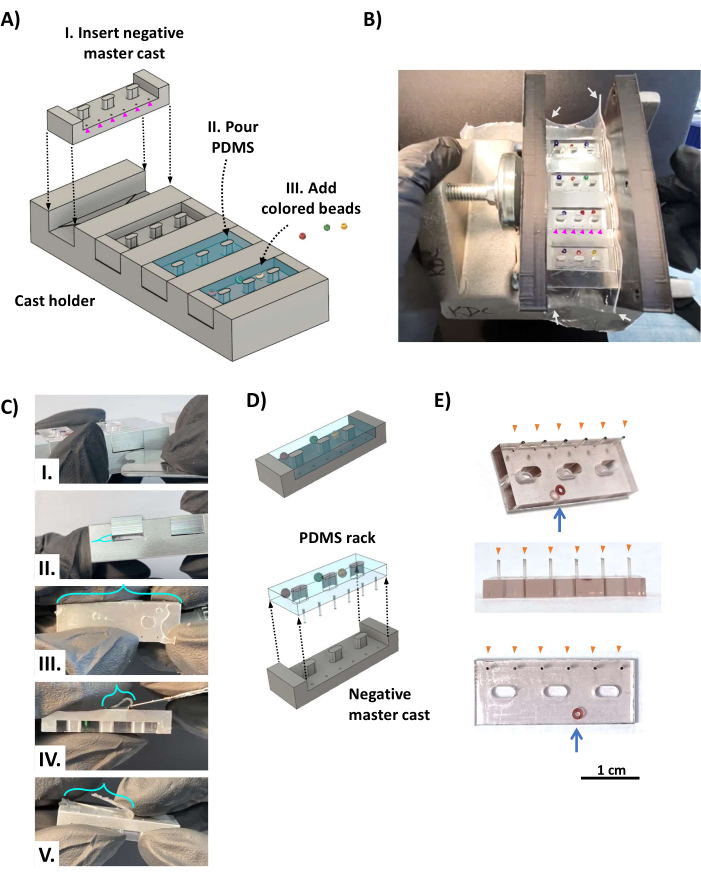
图 2:PDMS 机架的制造。 (A) CAD 效果图显示了铸造设备的倾斜视图。(I) 将负 PDMS 机架主铸件插入铸件支架的四个槽中的每一个,形成 PDMS 柱(洋红色箭头)的孔放置在三角形搁板对面的死角上(图 1D,橙色三角形)。(II)将PDMS倒入负极母铸件的每个型腔中。(III) 将彩色珠子作为颜色编码识别系统添加到未固化的 PDMS 中。(B) 照片显示了组装好的 PDMS 机架铸造装置,该装置用两个 3D 打印支架夹在两侧,由螺丝夹固定到位,并用 0.5 毫米厚的硅胶片(白色箭头)包裹以密封夹紧的侧面。放置彩色珠子,使它们不会覆盖形成柱子的直径为 0.5 毫米的孔(洋红色箭头)。(C) 一旦PDMS固化,铸件就会从铸件支架上取下。(I) 在铸件和铸件支架之间插入钝的不锈钢剃须刀片或类似的薄金属工具,以将铸件从铸件支架 (II) 中撬开。(III) PDMS流经柱子孔形成的薄膜(绿松石支架)附着在柱子的尖端,必须用锋利的刀片(IV,V)切掉。(D) PDMS 机架与铸件分离。(E) 显示 PDMS 机架的倾斜(顶部)、侧面(中部)和底部(底部)视图的照片,其中嵌入了玻璃珠以进行识别(蓝色箭头)。柱子的尖端(橙色箭头)用黑色墨水标记。比例尺 = 1 厘米。这个数字是从van Neste27修改而来的。缩写:CAD = 计算机辅助设计;PDMS = 聚二甲基硅氧烷。请点击这里查看此图的较大版本.
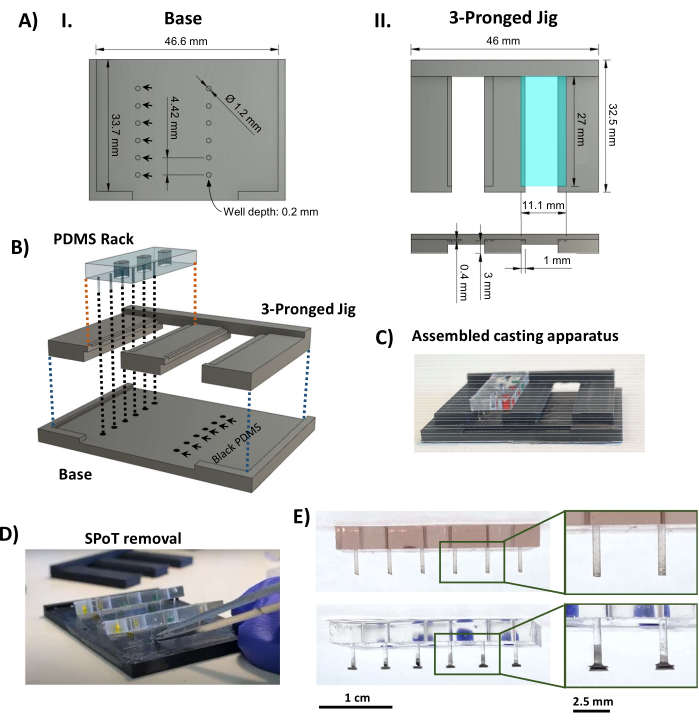
图 3:SPoT 制造。 (A) CAD 效果图,显示 SPoT 铸造夹具的 (I) 底座和 (II) 三叉件的关键尺寸。圆形 SPoT 表单(AI,黑色箭头)的尺寸设置为深 0.2 mm x 直径 1.2 mm,每个表单都包含单个 SPoT 的黑色 PDMS。顶视图(AII,顶部,绿松石矩形)中看到的 11.1 mm x 27 mm 搁板被压低 0.4 mm(如下图侧视图所示),以在固化过程中将 PDMS 搁板固定到位。(B) 显示 SPoT 铸造设备组装的 CAD 渲染图。(C) 组装的 SPoT 铸造设备的照片。(D) PDMS 固化后,将三叉夹具从 PDMS 架下方滑出,并使用细镊子将 SPoT 从孔中释放出来。(E) 不带(顶部)和带(底部)SPoT 的 PDMS 机架的照片。插图显示帖子的放大视图。比例尺 = 1 cm (E)、2.5 cm( E 的放大图像)。这个数字是从van Neste27修改而来的。缩写:CAD = 计算机辅助设计;Ø = 直径;PDMS = 聚二甲基硅氧烷;R = 半径;SPoT = 稳定的帖子跟踪器。 请点击这里查看此图的较大版本.
2. 细胞培养
- 培养 iPSC
注:不同的细胞系可能需要调整传代稀释度和频率和/或培养基添加剂的滴定。- 用合格的基底膜基质(根据制造商的说明在1:1 Dulbecco改良的Eagle培养基:Ham's F12营养液[DMEM / F12]中稀释)包被细胞培养处理的6孔板,并将板在37°C下孵育至少30分钟。根据制造商的说明制备 500 mL iPSC 培养基,并加入 5 mL 青霉素-链霉素(10,000 IU/mL 至 10,000 μg/mL)储备液。
- 要传代 iPSC,请从孔中吸出培养基,并用 1 mL 磷酸盐缓冲盐水 (PBS) 洗涤每个孔一次。每孔加入 1 mL iPSC 解离溶液,并在层流罩中孵育 1 分钟。
- 吸出iPSC解离溶液,并将细胞在37°C(不含任何培养基)下孵育5分钟。在 iPSC 培养基中加入 1 mL 2 μM 噻唑维星以中和 iPSC 解离溶液。
- 使用 2 mL 血清移液管将菌落解离成大约 10 个细胞的团块,并在 iPSC 培养基中用另外 1 mL 的 2 μM 噻唑维星洗涤每个孔。向新包被基底膜基质的板的每个孔中加入 2 mL 细胞悬液(步骤 2.1.1)。
- 24小时后,取出培养基,加入新鲜的iPSC培养基(不含噻唑维星)。每 48 小时用 2 mL iPSC 培养基喂食一次 iPSC,或每 72 小时用 4 mL 培养基喂食一次 iPSC。以 1:6 的稀释度重新铺板细胞,每 3 天传代一次,或在细胞达到 80% 汇合度时进行传代。
注意:不同的细胞系可能需要调整稀释度和传代频率。
- 心肌细胞分化
- 当 iPSC 单层汇合 80%-90% 时开始分化。
- 通过向 500 mL Roswell Park Memorial Institute 1640 培养基 (RPMI) 中加入 10 mL 不含胰岛素的 B27 补充剂和 5 mL 青霉素-链霉素储备液来制备分化培养基。通过向 500 mL RPMI 1640 中加入 10 mL B27 补充剂和 5 mL 青霉素-链霉素储备液来制备心肌细胞维持培养基。
注:分化培养基和心肌细胞维持培养基可在4°C下储存长达2周。 - 第 0 天:用 1 mL DMEM/F12 洗涤细胞,并在分化培养基中加入 2 mL 10 μM CHIR99021和稀释的基底膜基质。
- 第 1 天:24 小时后,或当细胞汇合度降至 70% 以下时,用 1 mL DMEM/F12 洗涤细胞,加入 2 mL 分化培养基,孵育 48 小时。
- 第 3-4 天:用 1 mL DMEM/F12 洗涤细胞,并在分化培养基中加入 2 mL 5 μM IWR-1。在第 4 天重复。
- 第 5-6 天:用 1 mL DMEM/F12 洗涤细胞,并加入 2 mL 分化培养基。在第 6 天重复。
- 第 7-10 天:用 1 mL DMEM/F12 洗涤细胞,并加入 2 mL 心肌细胞维持培养基。每24小时重复一次。
- 第 11+ 天:每 48-72 小时用 4 mL 新鲜心肌细胞维持培养基替换培养基。缓慢吸气和移液,以免损坏剧烈跳动的单层。
3. hECT培养
- 采集心肌细胞
- 收获心肌细胞单层,用于分化诱导后 8-60 天的 hECT 制造。预计每孔有 2-500 万个细胞。
注意:如果细胞在第 10 天之前没有开始跳动,则分化不太可能成功。剧烈跳动的单层细胞通常在 11-15 天后分离进入分化并压实成致密组织。建议此时使用或重新铺板此类细胞。 - 用 2 mL PBS 冲洗每个心肌细胞孔 2 次。加入 1 mL 室温 0.25% 胰蛋白酶-EDTA。在37°C孵育5-10分钟,直到细胞呈圆形,并且轻轻敲击板即可分离。
- 向每个孔中加入 1 mL 10% FBS 的心肌细胞维持培养基以中和解离。使用 5 mL 血清移液器吸头轻轻移液单层,然后转移到 50 mL 锥形管中,将沉淀分解成 10-20 个细胞的团块。
- 在将 10 μL 细胞转移到 10 μL 台盼蓝之前,通过倒置锥形管混合细胞悬液。使用自动细胞计数仪或玻璃血细胞计数器对细胞进行计数。如果不是所有细胞都会被使用,或者如果一些细胞被留作流式细胞术,则适当地分离细胞悬液。
注意:此时可以添加补充细胞(如成纤维细胞)。 - 将细胞以250× g 离心5分钟。立即吸出尽可能多的上清液,而不会干扰细胞沉淀,并保持在冰上。快速工作以尽量减少细胞在沉淀中花费的时间。
- 收获心肌细胞单层,用于分化诱导后 8-60 天的 hECT 制造。预计每孔有 2-500 万个细胞。
- hECT制造
- 使用 表2中的体积,并根据沉淀中的细胞数进行调整,使每个hECT包含100万个细胞。每一步后,通过缓慢移液混合以避免气泡。
注意: 由于某些组件对光敏感,因此在屏蔽直射光的情况下执行步骤 3.2.2-3.2.3。 - 通过加入 13.442 μL 蒸馏水、4.4 μL 10x PBS 和 0.638 μL 1M NaOH,在 1.7 mL 微管中制备 2.9 g/mL 1 型胶原蛋白溶液。加入 25.52 μL 5 mg/mL 胶原原原液,慢慢混合。
- 制备细胞外基质混合物(表2中的ECM混合物):加入5.5μL的0.2N pH 9 HEPES溶液,然后加入5.5μL的10x MEM。充分混合,直到观察到均匀的浅黄色至浅粉红色。将 35.2 μL ECM 混合溶液转移到细胞沉淀中,并加入 4.4 μL 基底膜基质。
- 打开生物反应器部件的高压灭菌袋(步骤1.4.7, 图4A)。戴上用 70% 乙醇消毒的手套时,从高压灭菌袋中取出黑色底板,然后放入 60 毫米的培养皿中,孔朝上。将 44 μL 细胞混合物缓慢移液到每个孔中,以避免引入气泡。如有必要,使用移液器去除移液时引入的任何气泡或由于PTFE的疏水性而形成的气泡。恢复hECT的体积,使液体表面与孔的边缘齐平(图4BI)。
- 戴上一副新的消毒手套,然后从高压灭菌袋中取出带有PDMS架的聚砜框架。将框架降低到底板上,使框架的末端适合底板末端的凹槽(图 4BII,III)。在放入 60 毫米培养皿之前,检查生物反应器以确保柱子都是直的并且框架没有倾斜。
- 向 60 mm 培养皿中加入 1 mL 心肌细胞维持培养基中的 10% FBS(注意不要干扰 hECT),以在 hECT 凝固时增加培养皿中的湿度。将不带盖的60mm培养皿放入高调(20mm高)的100mm培养皿中,盖上100mm的培养皿盖,然后将生物反应器放回37°C,5%CO2 培养箱中,使胶原蛋白与悬浮细胞形成凝胶。
- 2小时后,从培养箱中取出培养皿。在心肌细胞维持培养基中加入 13 mL 10% FBS,倾斜培养皿以促进培养基在 PTFE 底板和 PDMS 架之间流动。
- 从侧面检查生物反应器,确保 PTFE 底板的疏水表面和 PDMS 架之间没有气泡滞留,然后将培养皿放回培养箱。如果有滞留的空气,将生物反应器从培养基中倾斜出来,让气泡破裂,然后再次缓慢降低,或使用带有凝胶加载尖端的微量移液器吸出空气,注意不要干扰柱子。
- 使用 表2中的体积,并根据沉淀中的细胞数进行调整,使每个hECT包含100万个细胞。每一步后,通过缓慢移液混合以避免气泡。
- 底板拆卸
- 通过框架的间隙检查 hECT 压实情况。在24-96小时的过程中,hECTs变稠并变得更加不透明(图4CI-III)。一旦hECT和底板壁之间有明显的间隙(图4CII),进行两次半体积培养基更换,将培养基更换为没有FBS的心肌细胞维持培养基。当hECT与原始直径相比压实至少30%时,取下底板(图4CIII)。用心肌细胞维持培养基填充含有生物反应器的 60 mm 培养皿,直到液体与培养皿的边缘齐平,然后向新的 60 mm 培养皿中加入 14 mL。
- 关键步骤:戴上无菌手套,将生物反应器翻转过来,使底板位于顶部(图4BIV)。按照步骤 3.2.8 检查是否有滞留的气泡。慢慢抬起底板,保持其水平(图4BV)。
- 如果 hECT 在取出底板期间脱落但仍留在底板中,请使用无菌弯曲细镊子将 hECT 从底板转移到 60 mm 培养皿中。使用镊子将 hECT 的末端引导到其柱子上。使用第二对镊子将柱子固定稳定,并将其穿过 hECT 中的孔。如有必要,对第二篇文章重复上述步骤。
- 将所有 hECT 连接到柱子上,将带有 hECT 的框架转移到新的 60 mm 培养皿中,并将框架放置在柱子朝下的位置(图 4BVI)。检查生物反应器,确保 hECT 保持在靠近 SPoT 的岗位上。
- 如果 hECT 已被表面张力推到其柱子的底部,则使用一对无菌弯曲镊子稳定框架。将另一对镊子插入框架中的插槽,保持关闭。一旦镊子的尖端下降到PDMS架上,将其扭转以使其到达柱子,并使用关闭的尖端轻轻地将hECT推向柱子的末端,直到它停留在SPoT上(图4BVI,插图)。
- hECT维持
- 每 24-48 小时用心肌细胞维持培养基进行半体积培养基更换(培养 2 周后,频率可降低至每周两次。
- 当 hECT 显示自发跳动簇时,通常在第 3 天出现,并在第 5 天显示协调跳动并伴有可见的后偏转,开始功能测量,并根据需要重复。
注意:在第 7 天之前尚未开始协调跳动的 hECT 根本不可能这样做。
| 元件 | 体积 (μL) | |||||||
| 蒸馏 H2O | 13.442 | 2.9 mg/mL 胶原蛋白溶液 | "ECM组合" | 最终的hECT细胞混合物 | ||||
| 氢氧化钠 1N | 0.638 | |||||||
| PBS 10x | 4.4 | |||||||
| 5 mg/mL 胶原蛋白原液 | 25.52 | |||||||
| 0.2 N pH 9 HEPES | 5.5 | |||||||
| 10倍内存 | 5.5 | |||||||
| 要转移到细胞沉淀的 ECM 混合物的体积 | 35.2 | |||||||
| 基质胶体积 | 4.4 | |||||||
表2:hECT试剂。 这些成分应按所列顺序添加并保存在冰上。
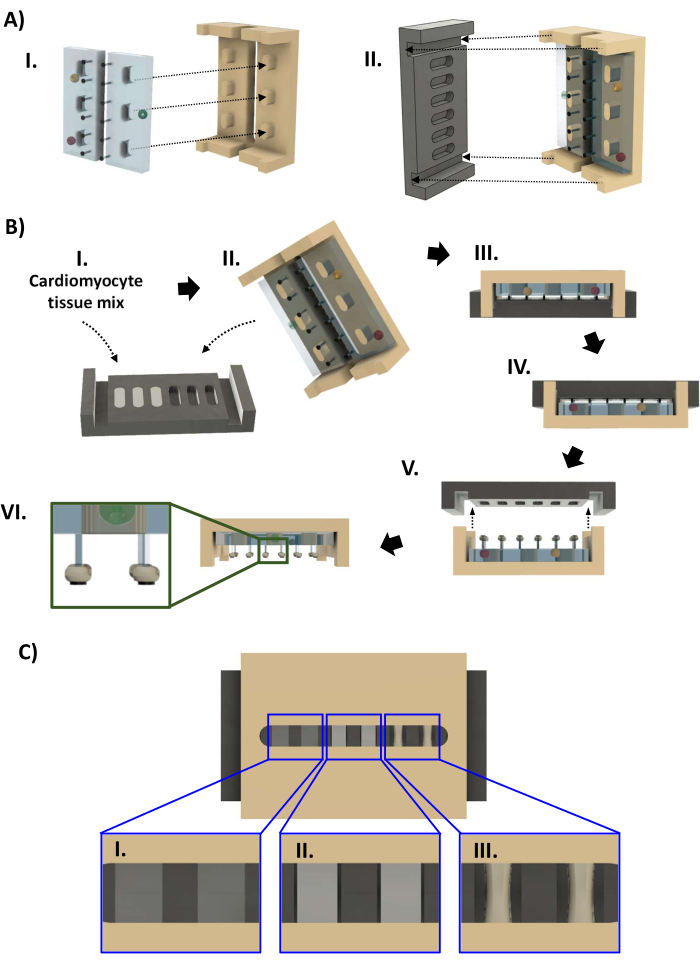
图 4:生物反应器组装和 hECT 制造。 (一) (I) 两个PDMS支架(左,浅蓝色)安装在聚砜框架上(右,棕褐色)。(II) 然后将 PTFE 底板(黑色,左)安装到框架(右)上,使每对柱子都适合基板的孔中。(B) (I) 将基于胶原蛋白的细胞外基质中的 44 微升心肌细胞悬浮液添加到六个基板孔中的每一个孔中。(二、三)带有PDMS机架的框架压合到底板上。1-4 天后,可以从底板上取出 hECT。(IV) 首先,在(V)底板从框架上抬起之前,将生物反应器倒置。(VI) 具有六个 hECT 的生物反应器的侧视图。插图:放大视图,显示柱子上相对于 SPoT 的 hECT 位置(插图)。(C) CAD 渲染图,通过聚砜框架的间隙显示三个级别的 hECT 压实([I] 低、[II] 中和 [III] 高)。这个数字是从van Neste27修改而来的。缩写:CAD = 计算机辅助设计;PDMS = 聚二甲基硅氧烷;PTFE = 聚四氟乙烯;SPoT = 稳定帖子跟踪器;hECT = 人类工程心脏组织。 请点击这里查看此图的较大版本.
4. hECT起搏设备
- 加热台护套
- 使用激光切割机从0.635厘米厚的透明亚克力板(补充文件3)中切割出丙烯酸绝缘护套的组件,图5A-D各一个,图5E,F各两个。
- 组装图 5 中的零件 (B)、(C)、(D) 和 (E) 之一,并使用丙烯酸胶粘合在一起,如图 5GI 所示。安装顶板(图5GII),等待几个小时让胶水凝固,然后将加热的载物台滑入护套的侧面(图5GIII)。
- 护套就位后,使用胶带将插入物固定在加热台的腿之间,并添加前面板(图5GIV)以完成组装(图5GV)。
- 石墨电极制造
- 使用带锯将 6.25 毫米厚、25 毫米宽的石墨棒切割成 35 毫米长的块;然后,将每个块纵向切割成一条曲线,使每个电极的一端高 13-16 毫米,另一端高 8-10 毫米。在上角钻两个直径为 0.7 毫米的孔(图 6AI)。用纸巾擦拭碎片,并在水中超声处理 20 分钟以去除石墨粉尘。确保电极楔入培养皿壁和 25 mm 宽的生物反应器之间,以确保电极之间的距离一致(图 6AII)。
- 将一根 150 毫米长 x 0.25 毫米直径的钢丝穿过电极的孔,并将其弯曲以适合 60 毫米培养皿的边缘和 100 毫米培养皿的壁周围,以便盖子可以关闭(图 6AII)。
- 每次使用后,通过在蒸馏水中浸泡1-2小时来清洁电极,以除去任何吸收的介质,使其干燥过夜,然后在132°C下高压灭菌30分钟。在开始测量之前,在生物反应器的两侧放置一个电极(图6AII)。放置电线,使 100 毫米培养皿盖可以关闭,然后将生物反应器返回培养箱进行平衡。
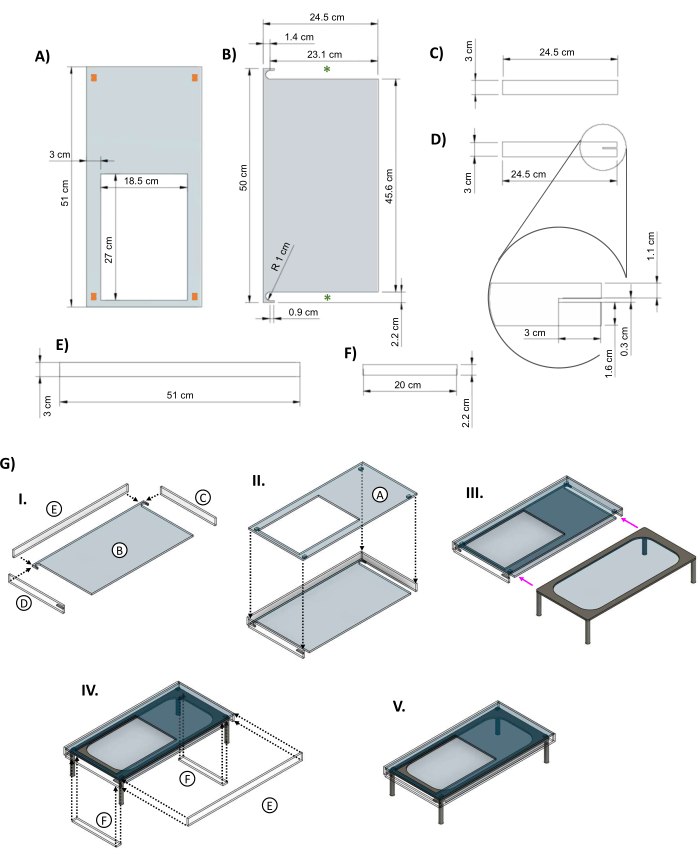
图 5:用于隔热加热玻璃舞台的亚克力护套。 CAD图像显示了为玻璃桌设计的亚克力护套的关键尺寸。(A) 顶部面板有一个 27 cm x 18.5 cm 的孔切口,允许生物反应器培养皿位于加热元件上。角落中的橙色矩形表示建议放置小垫片,以在护套顶部和加热元件之间提供空间。(B) 护套的底部有两个切口,以允许加热台的腿滑入(绿色星号)。(C&D)两个侧板安装在顶部下方。(D) 左侧面板包括一个 3 cm x 0.3 cm 的切口(插图),用于舞台电源线。(E) 长面板适合正面和背面。(F) 一旦桌子进入内部,就会添加插入物以填补间隙。(G) (I) 将侧板和背板连接到底件上,然后 (II) 添加顶板。(III) 将玻璃桌滑入夹克(洋红色箭头)。(IV) 插入物连接在桌子的腿之间,背面贴合开口以关闭盒子。(五)完成的护套装配。这个数字是从van Neste27修改而来的。缩写:CAD = 计算机辅助设计;R = 半径;Ø = 直径。 请点击这里查看此图的较大版本.

图 6:hECT 收缩的数据采集。 (A) (I) 从石墨棒上切割的电极的照片。洋红色箭头表示用于连接不锈钢丝的孔。比例尺 = 1 cm。 (II) 倾斜视图(左)和顶视图(右)显示石墨电极在生物反应器中的位置。电极占据了 25 mm 宽的生物反应器和培养皿壁之间的空间,以确保电极之间的距离一致。电线弯曲以允许关闭碟盖。(B) 层流洁净工作台内的 hECT 起搏装置照片——所有设备都放置在隔振台上,以减少洁净工作台的振动噪音。生物反应器(洋红色箭头)位于夹套加热台上,由上方的 LED 光源照亮。解剖显微镜水平指向直角镜(橙色星号),从下方观察生物反应器,并配有CCD相机(左)。绿松石支架表示用于连续温度监控的水浴,以向闭环加热舞台控制器提供反馈。这个数字是从van Neste27修改而来的。缩写:hECT = 人类工程心脏组织;LED = 发光二极管。 请点击这里查看此图的较大版本.
5. hECT功能测量
- 设置起搏工作区
- 将加热台打开至39.5°C,并根据 图6B将起搏设备设置在层流洁净工作台内的隔振台上。将解剖显微镜安装在吊杆支架上,并将其指向位于玻璃台下方实验室插孔上的直角镜子(图6B,橙色星号),以便从下方观察生物反应器。将高速CCD相机固定在显微镜上,并连接到计算机。用紫外线照射装置 15 分钟以对工作空间进行消毒。
- 将生物反应器(图6B,洋红色箭头)放在夹套加热台上,由上方的双头鹅颈LED光源照亮(与光纤灯相比,LED灯的颈部可以更安全地固定在主机上)。通过确保振动台(和振动台本身)上的起搏设备不接触层流洁净工作台的任何部分,最大限度地减少额外的噪音。
- 在加热的桌子上加入第二个 60 毫米的培养皿,在 100 毫米培养皿内装满预热水(图 6B,绿松石支架),并配备温度探头以进行连续温度监测。根据需要调整加热台的温度设置,以将参考皿的温度保持在 36-37 °C。
- 将显微镜放大倍率设置为1.5倍(或其他所需的放大倍率,该放大倍率可以以足够的分辨率完整地显示hECT)。
- 调整相机设置
- 打开相机软件。调整视频源的大小以尽可能地裁剪视野,同时仍可显示整个 hECT。这样可以最大限度地提高相机速度。
- 将捕获速率设置为每秒 90 帧。调整曝光时间和光源位置,以优化整个视场照明条件的均匀性,并最大限度地提高 SPoT 的对比度。
- 采集软件设置
- 打开方形脉冲刺激器,并将其连接到计算机。调整设置以提供幅度为 12 V、持续时间为 5 ms 的双相脉冲。
- 打开数据采集软件,然后打开"AutomatedPostTracking3.vi"文件(补充文件4)。加载后,单击工具栏左侧的白色箭头以初始化程序(图 7A)。
- 在加热的载物台上使用玻璃血细胞计数器校准软件。在工具栏(图7B)中,单击 线条工具 以在血细胞计数器标记的1 mm上绘制一条线(未显示)。在 "距离校准(像素/毫米) "框(图7C)中,将 "参考长度(毫米) "设置为 "1",然后单击 "计算 "按钮。
- 使用线条工具在组织宽度上画一条线来测量 hECT 横截面积。单击横截面积(mm^2)框中的1(图7D)以计算面积(假设线性组织条的圆柱形几何形状,如文献1,2,3,4,5,6,7,8,9,10,11,12、15、16、18、19、20、
21,22,23,24,25,26,37,38)。沿着 hECT 的不同部分重复,并在框中的其他两个按钮下记录值。输出数据表文件报告这三个值的平均值,以计算组织的直径。
- hECT功能表征
- 确保帖子提示处于焦点位置。打开 阈值开关 (图7E),并调整滑块(图7F),直到SPoT(图7G)被很好地划分,并且不会随着hECT收缩而改变形状。
- 使用矩形工具在其中一个 Spot 周围绘制一个矩形(图 7,绿色矩形),然后单击 Post boundaries 框(图 7H)中的 Set 1 按钮以设置 SPoT 周围的矩形位置,确保 SPoT 始终保持在矩形的边界内。对另一篇文章重复上述步骤,并将其记录在"设置 2"下。
- 调整对象大小设置(图7I)以防止程序跟踪较小的对象。确保每个矩形中跟踪的对象数保持不变。该界面(图7J)实时显示被跟踪对象之间的测量距离。使用此图来监视噪声。
- 选择一个目录来保存文件(图7K)。将不同日期的数据存储在单独的文件夹中。选择当前 组织编号,并在 "注释 "框中写下任何所需的注释。
- 在起搏频率(Hz)标题(图7L)下,指示所需的频率范围(最小值和最大值),以及从最小值到最大值的所需间隔。如果在整个捕获范围内对 hECT 进行起搏,请测试不同的起搏频率以找到达到 1:1 刺激:峰值比的最低频率,并继续增加频率,直到该比率丢失。通过选择任意频率范围(例如,0.01 Hz 至 0.01 Hz)并保持方形脉冲刺激器输出关闭来测量自发函数。
- 在右侧的框中,选择所需的 设置时间(s)( 设置频率但未记录数据后的时间间隔),以允许 hECT 调整到新的起搏频率。指定 录制时间(s) 和 起搏电压(V)。通过单击 "启动程序 "按钮开始程序(图7M)。
注意:结果会自动保存在所选目录中。每次记录后,观察脚本显示数据的傅里叶变换(图7N),其中峰值对应于检测到的跳动频率。 - 如果需要,运行"激励阈值查找"程序,以找到刺激视图中的hECT所需的最小电压(图7O)。如果需要,计算柱子的最大和最小挠度(图7P)。
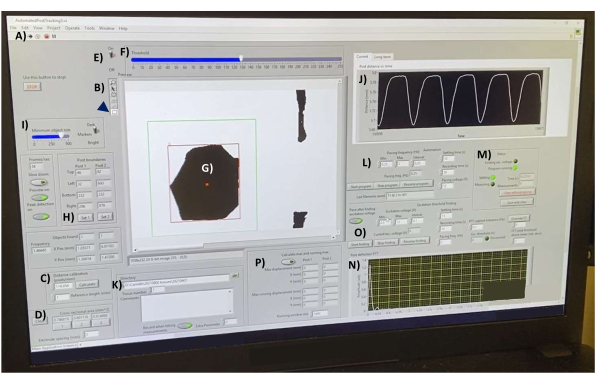
图 7:后挠度数据采集接口。 (A) 用于运行软件的按钮。(B) 工具栏,分别包含用于长度测量和对象选择的线条和矩形工具。(C) 距离校准控制。(D) 用于测量三个不同点的hECT横截面积的工具。(E) 阈值开关和 (F) 滑块,用于将视频源实时转换为高对比度图像。(G) 预览窗口中可见的 SPoT。(H) 用于选择 SPoT 的工具。(I) 用于按大小过滤对象的滑块。(J) 实时显示被跟踪物体之间测量距离的图表。(K) 用于选择保存输出文件的目录的选项。(L) 用于设置后期跟踪程序 (M) 的频率范围、频率间隔、录制时间和录制间隔时间的选项。(N) 上次保存的记录的偏转曲线的傅里叶变换的图形输出。(O) 编程以找到刺激 hECT 所需的最小电压。(P) 计算柱子最大和最小挠度的程序。缩写:hECT = 人类工程心脏组织;SPoT = 稳定的帖子跟踪器。 请点击这里查看此图的较大版本.
6. PDMS机架测量
- 空载距离
- 在制造 hECT 之前,将所需的一对 PDMS 机架安装到框架上。使用步骤 5.1 中描述的起搏设置和软件进行功能测量。选择柱子末端的固定 SPoT。
- 如有必要,调整光源和/或阈值,将 噪声 降低到 <2μm。在电子表格中记录图表中指示的平均实时 y 值。
- 柱子高度和 hECT 高度
- 从步骤 5.2 中描述的起搏设置中,取下倾斜的镜子和加热阶段。将生物反应器直接放在实验室千斤顶上,以获得生物反应器的侧视图。
- 打开相机软件。调整曝光时间和光源位置,以优化整个视野中照明条件的均匀性,并最大限度地提高柱子的可见性。
- 打开数据采集软件,然后打开"PostMeasurement_PB3.vi"文件(补充文件5)。加载后,单击工具栏左侧的白色箭头以初始化程序。
- 使用玻璃血细胞计数器校准软件。单击观察窗口左侧垂直工具栏中的线条工具,然后在血细胞计数器标记的 1 mm 上画一条线。在屏幕左下角的距离校准(像素/毫米)框中,将参考长度(毫米)设置为 1,然后单击"计算"按钮。
- 在校准字段下方,在组织编号字段中设置所需的组织编号(用于识别)。将相机对焦在 hECT 的左柱上,然后在"后置侧"框中选择"左"。
- 使用 线条工具 从柱子的底部(顶部)到 SPoT 的尖端(底部)绘制一条线,然后单击测量 柱子 Ht 进行记录。
- 从柱子的底部到 hECT 的远边缘画一条线,然后单击 测量组织顶部 Ht 进行记录。从柱子的底部到hECT的近边缘画一条线,然后单击 "测量组织基底Ht"进行记录。
- 此时,转动生物反应器以测量正确的立柱高度。选择 正确的开机自检 选项以记录相同的测量值。单击 "添加 "按钮,在电子表格中填充测量值,并自动计算 hECT 的平均高度,这将在步骤 7 中使用。
- 记录完组织高度后,单击"保存"按钮将值保存到文本文件中。
7. 使用自定义分析脚本进行功能数据处理
- 在电子表格编辑器中,使用模板填写摘要文件(补充文件 6)。使用在步骤6.2中获得 的柱子长度 和 平均组织高度 值。确保文件夹中包含数据的所有 hECT 都显示在摘要文件中。将文件命名为"摘要 #.csv",其中 # 表示实验的天数。
注意:根据实验日,hECT功能数据必须放在单独的文件夹中。 - 确保包含 AnalyzeLogsGUI 脚本的文件夹(补充文件 7)和包含 hECT 记录的文件夹都添加到路径中。
- 打开数据分析软件。在目录栏的左侧,单击" 浏览文件夹 "按钮以导航到包含 AnalyzeLogsGUI 文件夹和 hECT 功能数据的父文件夹。在 "当前窗口 "边栏中,右键单击这些文件夹以 添加到"路径"|"添加选定的文件夹和子文件夹。
- 打开"AnalyzeLogsGui_SC.m"文件。在"编辑器"选项卡中,按"运行"按钮,然后等待图形用户界面 (GUI) 出现在新窗口中。
- 在 "日志选择 "框(图8AI)中,单击 "选择目录 "按钮,然后导航到包含hECT功能数据的文件夹。从 组织 下拉菜单中选择要处理的所需 hECT。
- 在"数据输入"框(图8AII)中,在舒张距离字段中输入步骤6.1中记录的柱子之间的空载距离。在后半径 (mm) 字段中输入 0.25。
- 在"分析约束"框(图8AIII)中,选择要从分析中省略的频率,或选择要包含的特定频率(用逗号分隔)。默认情况下,开始时间和结束时间分别设置为 0 和 −1,以处理录制的整个长度。如有必要,更改这些值以修剪录制内容。
- 更改多项式阶数和帧大小的滤波器参数(图8AIV),以改变滤波过程中的平滑水平,并更改峰值检测阈值滑块,以设置脚本将识别的最小峰值大小。
注意:该脚本包含 "尖峰移除 "选项,该选项可剪裁由伪影引起的高峰;但是,不建议这样做,因为它会改变抽搐的形状。通过修剪记录来去除伪影(图 8AIII)。 - 使用其他选项(图8AV)进行其他数据分析输出: 后挠度分析 以运行额外的峰值检测算法, 在缩放图上自动缩放y轴 以自动调整抽搐力曲线上的轴(图8B), 保存力跟踪曲线 以将每个抽搐力图保存到.fig文件,以及 保存力时间数据 保存绘制在 Twitch 力曲线图中的过滤数据的 x 和 y 坐标。
- 单击 "运行分析 "以生成一个.txt文件,其中包含在整个记录中平均的抽搐力曲线(补充文件 8)的属性。
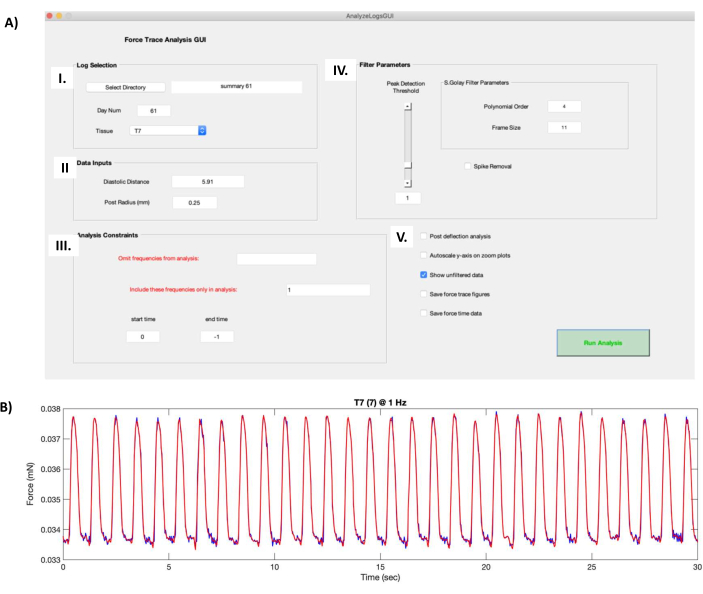
图 8:Twitch 力曲线计算。 (A) 在数据处理软件中运行"AnalyzeLogsGUI.m"文件将打开 GUI 窗口。(I) 日志选择框允许用户选择包含 hECT 功能数据的文件夹的目录。"天数"字段将从协议步骤 7.1 中创建的摘要文件的标题自动填充。使用组织下拉菜单选择要处理的 hECT。(II) "数据输入"框包含有关支持 hECT 的一对 PDMS 柱的信息,例如空载距离(在协议步骤 6.1 中获得)和柱半径 (0.25 mm)。(III) "分析约束"(Analysis Constraints) 框允许用户选择要省略或包含的频率,以及修剪录音。(IV) 过滤器参数框包含用于选择如何过滤原始抽搐力曲线的选项。多项式顺序和帧大小会改变过滤过程中的平滑级别。"峰值检测阈值"滑块决定脚本将识别的最小峰值大小。"尖峰移除"(Spike Removal) 选项可剪裁由伪影引起的高峰。(V) 其他选项包括后挠度分析(运行额外的峰值检测算法)、缩放图上的自动缩放 y 轴(作用于抽搐力曲线)、保存力轨迹曲线(保存抽搐力图)和保存力时间数据(保存绘制的抽搐力数据)。(B) 面板 A 的 GUI 屏幕截图生成的以 1 Hz 起搏的 hECT 的 30 秒记录的抽搐力曲线示例。红色抽搐力曲线显示 AIV 中参数产生的过滤力,叠加到原始抽搐力曲线上(深蓝色曲线,在 AV 中选择"显示未过滤的数据"选项时出现)。缩写:hECT = 人类工程心脏组织;GUI = 图形用户界面;PDMS = 聚二甲基硅氧烷。请点击这里查看此图的较大版本.
Access restricted. Please log in or start a trial to view this content.
结果
按照上述方案,心肌细胞从我们 9,15 组先前使用的健康 iPSC 系中产生,并在培养 8-61 天后制成 hECT。图9A显示了从底部观察的hECT的代表性图像,这些图像是在没有(顶部)和(底部)SPoT的情况下创建的。在hECT制备后37天至52天之间,在室温(23°C)和生理温度(36°C)下进行功能测量。在PDMS机架的制造过程中,我们已经证明,有经?...
Access restricted. Please log in or start a trial to view this content.
讨论
文献中发表了许多线性工程心脏组织模型,其中一些在表1中进行了描述。一些模型涉及组织力的直接测量,但这些模型通常需要将结构转移到单独的肌肉浴38中。大多数型号的设计将组织永久固定在两端,最常见的是PDMS柱1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16
Access restricted. Please log in or start a trial to view this content.
披露声明
K.D.C. 是 Novoheart 的联合创始人兼首席科学官,并持有控股公司 Medera Biopharmaceutical 的股权。Novoheart 没有为这项研究的资助、规划或执行做出贡献;然而,研究结果可能会对 Novoheart 和 Medera 产生财务影响。其他作者声明他们没有竞争利益。
致谢
作者感谢Timothy Cashman博士之前对这种方法所做的工作。这项研究得到了美国国立卫生研究院 (NIH)(R01-HL132226 和 K01 HL133424)和 Leducq 基金会国际卓越网络计划 (CURE-PLaN) 的资助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 0.25 mm diamete 304 Stainless Steel Wire | McMaster Carr | 6517K61 | |
| 0.25% trypsin-EDTA | Gibco | 25200056 | |
| 1.7 mL Microtubes | Axygen | MCT-175-C | |
| 10 cm dishes (20 mm tall) | Corning | 353003 | |
| 10 mL Serological Pipette | Drummond | 6-000-010 | |
| 10 N NaOH | Fisher Scientific | SS225-1 | dilute 1:10 in sterile distilled water |
| 10X Modified Eagle Medium | Sigma Aldrich | M0275 | |
| 20 - 200 μL Micropipette | Eppendorf | 3123000055 | |
| 200 μL MicroPipette Tips | VWR | 76322-150 | |
| 5 mL Serological Pipette | Drummond | 6-000-005 | |
| 50 mL Conical Centrifuge Tubes | Falcon | 352070 | |
| 6 cm Petri Dish | Corning | 353002 | |
| 6 Watt LED Dual Gooseneck Illuminator | AmScope | LED-6W | |
| 6-Well Plates | Corning | 353046 | |
| 90 degree angle mirror | Edmund Optics | 45-594 | |
| Acrylic bonding glue | SCIGRIP | #4 | |
| Adjustable 10 cm x 10 cm jack | Fisher Scientific | 14-673-50 | |
| Aluminum 6061 | McMaster Carr | 9008K82 | |
| A-Plan 10X Objective Lens | ZEISS | 1020-863 | |
| Autoclave Bags | Propper | 21002 | |
| B-27 supplement | ThermoFisher | 17504044 | |
| B-27 supplement (without insulin) | ThermoFisher | A1895601 | |
| Benchtop Centrifuge | Eppendorf | 5810 R | |
| Black ABS | Ultimaker | 2.85 mm wide | |
| Bovine Collagen I | Gibco | A1064401 | |
| CHIR99021 | Tocris | 4423 | |
| Class II Biosafety Cabinet | Labconco | 3430009 | |
| Clear Acrylic Sheeting | estreetplastics | 1002502436 | 6.25 mm thick |
| CNC Vertical Mill | Haas | VF-1 | |
| Conductive Graphite Bars | McMaster Carr | 1763T33 | |
| Dissection microscope | Olympus | SZ61 | |
| Dulbecco's Modified Eagle Medium/Ham's F-12 Nutrient Mix | ThermoFisher | 11330032 | |
| Ethanol | Fisher Scientific | A4094 | Dilute to 70% in water |
| EVE Automated Cell counter | NanoEntek | E1000 | |
| EVE Cell Counting Slide | NanoEntek | EVS-050 | |
| Fetal Bovine Serum | Life Technologies | 10438026 | |
| Fine Curved Forceps | Fine Science Tools | 11253-25 | |
| Forma Series II Water Jacketed CO2 Incubator | Thermo Electron Corporation | 3110 | AKA "incubator". With HEPA class 100 filter |
| Fusion360 software | Autodesk | AKA "CAD software" | |
| Glass Hemocytometer | Reichert | 1475 | 0.1 mm deep |
| HEPES | Sigma Aldrich | H3784 | |
| hESC qualified matrigel | Corning | 354277 | AKA "basement membrane matrix". Store in frozen aliquots |
| High Speed CCD Camera | PixelLINK | P7410 | |
| Inverted Microscope | Carl Zeiss Werk | Axiovert 40 CFL | 10X phase contrast objective |
| IWR-1 | Selleck Chem | S7086 | |
| LabView Software | National Instruments | 2016 | |
| Laminar flow clean bench | NuAire | NU-201-330 | necessary for hECT functional analysis |
| Laptop | AsusTek | Strix | Intel Core i& processor ,CPU 2.8GHz, 16GB RAM |
| Laser Cutting Machine | Epilog | Helix 24 | |
| Magnification headset | ExcelBlades | 70020 | Recommended for steps requiring fine manipulations |
| Matlab | Mathworks | Version 2019b or later | AKA "data analysis software" |
| Micro Vannas Scissors, 3 mm blade | WPI Instruments | 501839 | |
| Microscope Boom Stand | Olympus | SZ2-STU1 | |
| Penicillin-Streptomycin stock solution | ThermoFisher | 15140122 | 10,000 IU/ml penicillin; 10,000 μg/ml streptomycin |
| Phosphate-buffered saline without divalent cations | Sigma Aldrich | P3813 | Diluted in distilled water to 1X and 10X concentrations |
| Pipette Controller | Drummond | 4-000-100 | |
| PixelLINK Capture OEM | PixelLINK | 10.2.1.6 | AKA "Camera Software" |
| Polysulfone | McMaster Carr | 86735K73 | translucent amber color |
| Polytetrafluoroethylene (PTFE) | McMaster Carr | 8545K176 | Black, molded |
| ReLeSR | Stem Cell Technologies | 5872 | AKA "iPSC dissociation media" |
| Rosewell Park Memorial Institute 1640 Media | ThermoFisher | 11875135 | |
| Silicone Sheeting | SMI manufacturing | glossy, 0.02 in thickness, durometer 40 | |
| Size 10/0 Blue, Green, Red, and Yellow Glass Seed Beads | Michael's | color should withstand autoclaving | |
| Spatula | Fisher Scientific | 14-373 | used for mixing PDMS |
| Square Pulse Stimulator | Astro-Med / Grass Technologies | S88X | |
| Stainless Steel Razoblades | GEM | 62-0179-CTN | preferred over non-stainless steel due to lower hardness |
| Stemflex | ThermoFisher | A3349401 | AKA "iPSC culture media" |
| Sterile distilled water | ThermoFisher | 5230 | |
| Sylgard 170 - Silicone Elastomer Encapsulant Black 0.9 kg Kit | Dow | DOWSIL 170 2LB KIT | AKA black Polydimethylsiloxane (black PDMS) |
| Sylgard 184 - Silicone Elastomer Clear 1 lb Kit | Dow | DC 184 SYLGARD 0.5KG 1.1LB KIT | AKA Polydimethylsiloxane (PDMS) |
| Temperature-controlled heated stage | Okolab | H401-HG-SMU | Set height to 10 cm |
| Thermoplastic 3D printer | Ultimaker | Ultimaker 3 | |
| Thiazovivin | Selleck Chem | S1459 | |
| Trypan Blue | NanoEntek | EBT-001 | |
| Vacuum Chamber | Bel-Art Parts | F42027-0000 | |
| Variable Speed Mini Band Saw | Micro-Mark | 82203 | |
| Variable Speed Miniature Drill Press | Micro-Mark | 82959 | |
| Vibration Isolation Table | Labconco | 3618000 | |
| Weighing Boats | VWR | 10803-140 | |
| Talon Cylinder Bench Clamp | VWR | 97035-528 | AKA screw clamp |
参考文献
- Serrao, G. W., et al. Myocyte-depleted engineered cardiac tissues support therapeutic potential of mesenchymal stem cells. Tissue Engineering. Part A. 18 (13-14), 1322-1333 (2012).
- Turnbull, I. C., et al. Advancing functional engineered cardiac tissues toward a preclinical model of human myocardium. FASEB Journal. 28 (2), 644-654 (2014).
- Cashman, T. J., et al. Construction of defined human engineered cardiac tissues to study mechanisms of cardiac cell therapy. Journal of Visualized Experiments. (109), e53447(2016).
- Stillitano, F., et al. Genomic correction of familial cardiomyopathy in human engineered cardiac tissues. European Heart Journal. 37 (43), 3282-3284 (2016).
- Mayourian, J., et al. Experimental and computational insight into human mesenchymal stem cell paracrine signaling and heterocellular coupling effects on cardiac contractility and arrhythmogenicity. Circulation Research. 121 (4), 411-423 (2017).
- Mayourian, J., et al. therapeutic paracrine modulation of cardiac excitation-contraction coupling. Circulation Research. 122 (1), 167-183 (2018).
- Mayourian, J., et al. Exosomal microRNA-21-5p mediates mesenchymal stem cell paracrine effects on human cardiac tissue contractility. Circulation Research. 7 (122), 933-944 (2018).
- Turnbull, I. C., et al. Cardiac tissue engineering models of inherited and acquired cardiomyopathies. Methods in Molecular Biology. 1816, 145-159 (2018).
- Murphy, J. F., et al. Adult human cardiac stem cell supplementation effectively increases contractile function and maturation in human engineered cardiac tissues. Stem Cell Research & Therapy. 10 (1), 373(2019).
- Breckwoldt, K., et al. Differentiation of cardiomyocytes and generation of human engineered heart tissue. Nature Protocols. 12 (6), 1177-1197 (2017).
- Huang, C. Y., et al. Enhancement of human iPSC-derived cardiomyocyte maturation by chemical conditioning in a 3D environment. Journal of Molecular and Cellular Cardiology. 138, 1-11 (2020).
- Ramade, A., Legant, W. R., Picart, C., Chen, C. S., Boudou, T. Microfabrication of a platform to measure and manipulate the mechanics of engineered microtissues. Methods in Cell Biology. 121, 191-211 (2014).
- Ronaldson-Bouchard, K., et al. Engineering of human cardiac muscle electromechanically matured to an adult-like phenotype. Nature Protocols. 14 (10), 2781-2817 (2019).
- Tamargo, M. A., et al. milliPillar: A platform for the generation and real-time assessment of human engineered cardiac tissues. ACS Biomaterials Science & Engineering. 7 (11), 5215-5229 (2021).
- Ceholski, D. K., et al. CXCR4 and CXCR7 play distinct roles in cardiac lineage specification and pharmacologic β-adrenergic response. Stem Cell Research. 23, 77-86 (2017).
- Bliley, J. M., et al. Dynamic loading of human engineered heart tissue enhances contractile function and drives a desmosome-linked disease phenotype. Science Translational Medicine. 13 (603), (2021).
- Ribeiro, M. C., et al. A new versatile platform for assessment of improved cardiac performance in human-engineered heart tissues. Journal of Personalized Medicine. 12 (2), 214(2022).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Mannhardt, I., et al. Human engineered heart tissue: Analysis of contractile force. Stem Cell Reports. 7 (1), 29-42 (2016).
- Mannhardt, I., et al. Blinded contractility analysis in hiPSC-cardiomyocytes in engineered heart tissue format: Comparison with human atrial trabeculae. Toxicological Sciences. 158 (1), 164-175 (2017).
- Saleem, U., et al. Force and calcium transients analysis in human engineered heart tissues reveals positive force-frequency relation at physiological frequency. Stem Cell Reports. 14 (2), 312-324 (2020).
- Thavandiran, N., et al. Functional arrays of human pluripotent stem cell-derived cardiac microtissues. Scientific Reports. 10 (1), 6919(2020).
- Bielawski, K. S., Leonard, A., Bhandari, S., Murry, C. E., Sniadecki, N. J. Real-time force and frequency analysis of engineered human heart tissue derived from induced pluripotent stem cells using magnetic sensing. Tissue Engineering. Part C, Methods. 22 (10), 932-940 (2016).
- Leonard, A., et al. Afterload promotes maturation of human induced pluripotent stem cell derived cardiomyocytes in engineered heart tissues. Journal of Molecular and Cellular Cardiology. 118, 147-158 (2018).
- Bose, P., Huang, C. Y., Eyckmans, J., Chen, C. S., Reich, D. H. Fabrication and mechanical properties measurements of 3D microtissues for the study of cell-matrix interactions. Methods in Molecular Biology. 1722, 303-328 (2018).
- Zhang, W., et al. Maturation of human embryonic stem cell-derived cardiomyocytes (hESC-CMs) in 3D collagen matrix: Effects of niche cell supplementation and mechanical stimulation. Acta Biomaterialia. 49, 204-217 (2017).
- van Neste, C. Advances in bioreactor design and multi-dimensional analysis for assessing maturation phenotype of human engineered cardiac tissues. PhD thesis. Icahn School of Medicine at Mount Sinai. , New York. https://www.prouest.com/docview/2722362863 (2022).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Salazar, B. H., Cashion, A. T., Dennis, R. G., Birla, R. K. Development of a cyclic strain bioreactor for mechanical enhancement and assessment of bioengineered myocardial constructs. Cardiovascular Engineering and Technology. 6 (4), 533-545 (2015).
- Putame, G., et al. Application of 3D printing technology for design and manufacturing of customized components for a mechanical stretching bioreactor. Journal of Healthcare Engineering. 2019, 3957931(2019).
- Akintewe, O. O., Roberts, E. G., Rim, N. -G., Ferguson, M. A. H., Wong, J. Y. Design approaches to myocardial and vascular tissue engineering. Annual Review of Biomedical Engineering. 19, 389-414 (2017).
- Chen, G., et al. Phospholamban as a crucial determinant of the inotropic response of human pluripotent stem cell-derived ventricular cardiomyocytes and engineered 3-dimensional tissue constructs. Circulation. Arrhythmia and Electrophysiology. 8 (1), 193-202 (2015).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Beauchamp, P., et al. 3D co-culture of hiPSC-derived cardiomyocytes with cardiac fibroblasts improves tissue-like features of cardiac spheroids. Frontiers in Molecular Biosciences. 7, 14(2020).
- Campostrini, G., et al. functional analysis and applications of isogenic three-dimensional self-aggregating cardiac microtissues from human pluripotent stem cells. Nature Protocols. 16 (4), 2213-2256 (2021).
- Swiatlowska, P., Iskratsch, T. Tools for studying and modulating (cardiac muscle) cell mechanics and mechanosensing across the scales. Biophysical Reviews. 13 (5), 611-623 (2021).
- Zhao, Y., et al. Engineering microenvironment for human cardiac tissue assembly in heart-on-a-chip platform. Matrix Biology. 85-86, 189-204 (2020).
- Fujiwara, Y., Deguchi, K., Miki, K., Nishimoto, T., Yoshida, Y. A method for contraction force measurement of hiPSC-derived engineered cardiac tissues. Methods in Molecular Biology. 2320, 171-180 (2021).
- Wang, E. Y., et al. Biowire model of interstitial and focal cardiac fibrosis. ACS Central Science. 5 (7), 1146-1158 (2019).
- Zhao, Y., et al. A platform for generation of chamber-specific cardiac tissues and disease modeling. Cell. 176 (4), 913-927 (2019).
- Lee, E. K., et al. Machine learning of human pluripotent stem cell-derived engineered cardiac tissue contractility for automated drug classification. Stem Cell Reports. 9 (5), 1560-1572 (2017).
- Batalov, I., Feinberg, A. W. Differentiation of cardiomyocytes from human pluripotent stem cells using monolayer culture. Biomarker Insights. 10, 71-76 (2015).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), E1848-E1857 (2012).
- Penefsky, Z. J., Buckley, N. M., Litwak, R. S. Effect of temperature and calcium on force-frequency relationships in mammalian ventricular myocardium. Pflugers Archiv. 332 (4), 271-282 (1972).
- Bers, D. M. Excitation-Contraction Coupling and Cardiac Contractile Force. , Springer. Dordrecht, the Netherlands. (2001).
- Kanaya, N., Gable, B., Wickley, P. J., Murray, P. A., Damron, D. S. Experimental conditions are important determinants of cardiac inotropic effects of propofol. Anesthesiology. 103 (5), 1026-1034 (2005).
- Galende, E., et al. Amniotic fluid cells are more efficiently reprogrammed to pluripotency than adult cells. Cellular Reprogramming. 12 (2), 117-125 (2010).
- Wacker-Gussmann, A., Strasburger, J. F., Cuneo, B. F., Wakai, R. T. Diagnosis and treatment of fetal arrhythmia. American Journal of Perinatology. 31 (7), 617-628 (2014).
- Federmann, M., Hess, O. M. Differentiation between systolic and diastolic dysfunction. European Heart Journal. 15, 2-6 (1994).
- Knight, W. E., et al. Maturation of pluripotent stem cell-derived cardiomyocytes enables modeling of human hypertrophic cardiomyopathy. Stem Cell Reports. 16 (3), 519-533 (2021).
- Ma, Z., et al. Contractile deficits in engineered cardiac microtissues as a result of MYBPC3 deficiency and mechanical overload. Nature Biomedical Engineering. 2 (12), 955-967 (2018).
- de Lange, W. J., et al. Human iPSC-engineered cardiac tissue platform faithfully models important cardiac physiology. American Journal of Physiology. Heart and Circulatory Physiology. 320 (4), H1670-H1686 (2021).
- Hiranandani, N., Varian, K. D., Monasky, M. M., Janssen, P. M. L. Frequency-dependent contractile response of isolated cardiac trabeculae under hypo-, normo-, and hyperthermic conditions. Journal of Applied Physiology. 100 (5), 1727-1732 (2006).
- Puglisi, J. L., Bassani, R. A., Bassani, J. W., Amin, J. N., Bers, D. M. Temperature and relative contributions of Ca transport systems in cardiac myocyte relaxation. The American Journal of Physiology. 270 (5), H1772-H1778 (1996).
- Puglisi, J. L., Yuan, W., Bassani, J. W., Bers, D. M. Ca(2+) influx through Ca(2+) channels in rabbit ventricular myocytes during action potential clamp: Influence of temperature. Circulation Research. 85 (6), e7-e16 (1999).
- Li, R. A., et al. Bioengineering an electro-mechanically functional miniature ventricular heart chamber from human pluripotent stem cells. Biomaterials. 163, 116-127 (2018).
- Sharma, A., et al. Biomanufacturing in low Earth orbit for regenerative medicine. Stem Cell Reports. 17 (1), 1-13 (2022).
- Strauss, D. G., Wu, W. W., Li, Z., Koerner, J., Garnett, C. Translational models and tools to reduce clinical trials and improve regulatory decision making for QTc and proarrhythmia risk (ICH E14/S7B updates). Clinical Pharmacology & Therapeutics. 109 (2), 319-333 (2021).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756(2020).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Designing a Bioreactor to Improve Data Acquisition and Model Throughput of Engineered Cardiac Tissues
Posted by JoVE Editors on 1/10/2024. Citeable Link.
An erratum was issued for: Designing a Bioreactor to Improve Data Acquisition and Model the Throughput of Engineered Cardiac Tissues. The title was corrected from:
Designing a Bioreactor to Improve Data Acquisition and Model the Throughput of Engineered Cardiac Tissues
to:
Designing a Bioreactor to Improve Data Acquisition and Model Throughput of Engineered Cardiac Tissues
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。