Method Article
نموذج فأر لانتقال العقدية الرئوية من المستعمر إلى العامل الممرض عند العدوى الفيروسية المشتركة يلخص المرض المتفاقم حسب العمر
* These authors contributed equally
In This Article
Summary
تصف هذه الورقة نموذجا جديدا للفأر لانتقال المكورات الرئوية من مستعمر بدون أعراض إلى ممرض مسبب للأمراض أثناء العدوى الفيروسية. يمكن تكييف هذا النموذج بسهولة لدراسة التفاعلات متعددة الميكروبات والمضيف الممرض خلال المراحل المختلفة لتطور المرض وعبر المضيفين المختلفين.
Abstract
العقدية الرئوية (المكورات الرئوية) هي مستعمر بدون أعراض للبلعوم الأنفي في معظم الأفراد ولكن يمكن أن تتطور إلى مسببات الأمراض الرئوية والجهازية عند الإصابة بفيروس الأنفلونزا A (IAV). يعزز التقدم في العمر قابلية المضيف للإصابة بالالتهاب الرئوي الثانوي بالمكورات الرئوية ويرتبط بتفاقم نتائج المرض. العوامل المضيفة التي تقود هذه العمليات ليست محددة بشكل جيد ، ويرجع ذلك جزئيا إلى نقص النماذج الحيوانية التي تعيد إنتاج الانتقال من الاستعمار بدون أعراض إلى المرض السريري الشديد.
تصف هذه الورقة نموذجا جديدا للفأر يعيد إنشاء انتقال المكورات الرئوية من النقل بدون أعراض إلى المرض عند الإصابة الفيروسية. في هذا النموذج ، يتم تلقيح الفئران أولا عن طريق الأنف بالمكورات الرئوية المزروعة بالأغشية الحيوية لإنشاء نقل بدون أعراض ، تليها عدوى IAV لكل من البلعوم الأنفي والرئتين. وهذا يؤدي إلى انتشار البكتيريا إلى الرئتين ، والتهاب رئوي ، وعلامات واضحة للمرض يمكن أن تتطور إلى الفتك. تعتمد درجة المرض على السلالة البكتيرية والعوامل المضيفة.
الأهم من ذلك ، أن هذا النموذج يعيد إنتاج قابلية الشيخوخة ، لأنه بالمقارنة مع الفئران الشابة ، تظهر الفئران المسنة مرضا سريريا أكثر حدة وتستسلم للمرض بشكل متكرر. من خلال فصل النقل والمرض إلى خطوات متميزة وتوفير الفرصة لتحليل المتغيرات الجينية لكل من العامل الممرض والمضيف ، يسمح نموذج العدوى المشتركة S. pneumoniae / IAV هذا بالفحص التفصيلي لتفاعلات مرضي مهم مع المضيف في مراحل مختلفة من تطور المرض. يمكن أن يكون هذا النموذج أيضا بمثابة أداة مهمة لتحديد الأهداف العلاجية المحتملة ضد الالتهاب الرئوي بالمكورات الرئوية الثانوية في المضيفين المعرضين للإصابة.
Introduction
العقدية الرئوية (المكورات الرئوية) هي بكتيريا إيجابية الجرام تتواجد بدون أعراض في البلعوم الأنفي لمعظم الأفراد الأصحاء 1,2. يمكن أن تنتقل المكورات الرئوية ، التي تعززها عوامل غير محددة تماما ، من مستعمرات حميدة للبلعوم الأنفي إلى مسببات الأمراض التي تنتشر إلى أعضاء أخرى مما يؤدي إلى عدوى خطيرة ، بما في ذلك التهاب الأذن الوسطى والالتهاب الرئوي وتجرثم الدم3. يعتمد عرض مرض المكورات الرئوية ، جزئيا ، على الاختلافات الخاصة بالسلالة ، بما في ذلك النمط المصلي ، الذي يعتمد على تكوين السكريات المحفظة. كان هناك أكثر من 100 نمط مصلي تم توصيفها حتى الآن ، وبعضها يرتبط بعدوى أكثر توغلا 4,5. هناك عدة عوامل أخرى تزيد من خطر الإصابة بمرض المكورات الرئوية. أحد هذه العوامل هو العدوى الفيروسية ، حيث يزداد خطر الإصابة بالالتهاب الرئوي بالمكورات الرئوية 100 ضعف بمقدارIAV 6,7. تاريخيا ، S. الرئوية هي واحدة من الأسباب الأكثر شيوعا للالتهاب الرئوي الجرثومي الثانوي بعد الأنفلونزا ويرتبط بنتائج أسوأ8. عامل خطر رئيسي آخر هو التقدم في العمر. في الواقع ، S. الرئوية هو السبب الرئيسي للالتهاب الرئوي الجرثومي المكتسب من المجتمع لدى الأفراد المسنين الذين تزيد أعمارهم عن65 عاما 9,10. يمثل الأفراد المسنون غالبية (>75٪) من الوفيات الناجمة عن الالتهاب الرئوي والإنفلونزا ، مما يشير إلى أن عاملي الخطر - الشيخوخة وعدوى IAV - يؤديان إلى تفاقم قابلية المرض بشكل تآزري11،12،13،14. ومع ذلك ، فإن الآليات التي تدفع بها العدوى الفيروسية انتقال المكورات الرئوية من مستعمر بدون أعراض إلى مسببات الأمراض الغازية وكيف يتم تشكيل ذلك من خلال العوامل المضيفة لا تزال غير محددة بشكل جيد. ويرجع ذلك إلى حد كبير إلى عدم وجود نموذج حيواني صغير يلخص الانتقال من استعمار المكورات الرئوية بدون أعراض إلى مرض سريري حرج.
تم تصميم دراسات العدوى المشتركة بشكل كلاسيكي في الفئران الملقحة بالمكورات الرئوية مباشرة في الرئتين بعد 7 أيام من الإصابة بالأنفلونزا15,16. هذا يعيد إنتاج القابلية للإصابة بالالتهاب الرئوي الجرثومي الثانوي وهو مثالي لدراسة كيفية إضعاف الاستجابات المناعية المضادة للفيروسات للدفاعات المضادة للبكتيريا17. ومع ذلك ، فقد أظهرت الدراسات الطولية في البشر أن نقل المكورات الرئوية في البلعوم الأنفي ، حيث يمكن للبكتيريا أن تشكل الأغشية الحيوية عديمة الأعراض18 ، يرتبط بشكل موحد بالأمراض الغازية 19,20. العزلات البكتيرية الناتجة عن التهابات الأذن الوسطى والرئة والدم متطابقة وراثيا مع تلك الموجودة في البلعوم الأنفي20. وهكذا ، لدراسة الانتقال من النقل بدون أعراض إلى المرض الغازي بعد عدوى IAV ، تم إنشاء نموذج تم فيه إعطاء الفئران عن طريق الأنف المكورات الرئوية المزروعة بالأغشية الحيوية تليها عدوى IAV للبلعوم الأنفي21,22. أدت العدوى الفيروسية في مجرى الهواء العلوي إلى تغيرات في البيئة المضيفة أدت إلى تشتت المكورات الرئوية من الأغشية الحيوية وانتشارها إلى الشعب الهوائية السفلية21. كانت هذه البكتيريا المشتتة قد نظمت التعبير عن عوامل الفوعة المهمة للعدوى ، وتحويلها من مستعمرين إلى مسببات الأمراض21. تسلط هذه الملاحظات الضوء على التفاعل المعقد بين الفيروس والمضيف والبكتيريا وتثبت أن التغييرات التي تطرأ على المضيف والتي تسببها العدوى الفيروسية لها تأثير مباشر على سلوك المكورات الرئوية ، والذي بدوره يغير مسار العدوى البكتيرية. ومع ذلك ، فشل هذا النموذج في تلخيص العلامات الشديدة للمرض التي لوحظت في البشر ، على الأرجح لأن الفيروس يقتصر على تجويف الأنف ، ولم يتم تلخيص الآثار الجهازية للعدوى الفيروسية على مناعة المضيف وتلف الرئة.
لقد أنشأنا مؤخرا نموذجا يتضمن التفاعل المعقد بين المضيف ومسببات الأمراض ولكنه يحاكي أيضا بشكل أوثق شدة المرض التي لوحظت في البشر23. في هذا النموذج ، تصاب الفئران أولا عن طريق الأنف بالمكورات الرئوية المزروعة بالأغشية الحيوية لإنشاء نقل بدون أعراض ، تليها عدوى IAV لكل من البلعوم الأنفي والرئتين. أدى ذلك إلى انتشار البكتيريا إلى الرئتين ، والتهاب رئوي ، ومرض تطور إلى الفتك في جزء صغير من الفئرانالشابة 23. أظهرت هذه الدراسة السابقة أن كلا من العدوى الفيروسية والبكتيرية غيرت دفاع المضيف: عززت العدوى الفيروسية الانتشار البكتيري ، وأضعف الاستعمار البكتيري السابق قدرة المضيف على التحكم في مستويات IAV الرئوية23. كشف فحص الاستجابة المناعية أن عدوى IAV قللت من النشاط المضاد للبكتيريا للعدلات ، في حين أن الاستعمار البكتيري أضعف استجابة الإنترفيرون من النوع الأول الحاسمة للدفاع المضاد للفيروسات23. الأهم من ذلك ، أن هذا النموذج أعاد إنتاج قابلية الشيخوخة. بالمقارنة مع الفئران الشابة ، أظهرت الفئران المسنة علامات المرض في وقت سابق ، وأظهرت مرضا سريريا أكثر حدة ، واستسلمت للعدوى بشكل متكرر23. يظهر العمل المقدم في هذه المخطوطة أن درجة المرض تعتمد أيضا على السلالة البكتيرية ، لأن سلالات المكورات الرئوية الغازية تظهر انتشارا أكثر كفاءة عند الإصابة بعدوى IAV ، وتظهر علامات أكثر وضوحا للالتهاب الرئوي ، وتؤدي إلى تسارع معدلات المرض مقارنة بالسلالات غير الغازية. وهكذا، فإن نموذج العدوى المشتركة للمكورات الرئوية/داء السيليكون المستقل يسمح بالفحص التفصيلي لكل من العوامل الممرضة والعوامل المضيفة، وهو مناسب تماما لدراسة الاستجابات المناعية للعدوى المتعددة الميكروبات في المراحل المختلفة لتطور المرض.
Protocol
تم إجراء جميع الدراسات على الحيوانات وفقا للتوصيات الواردة في دليل رعاية واستخدام المختبر. تمت الموافقة على جميع الإجراءات من قبل لجنة رعاية واستخدام الحيوانات المؤسسية بجامعة بوفالو.
1. تحضير الوسائط المعرفة كيميائيا (CDM)
- قم بإعداد المخزون على النحو التالي:
- قم بإذابة مركبات المزيج I المدرجة في الجدول 1 في 100 مل من الماء عالي النقاء مع التحريك. يخزن في 200 ميكرولتر من القسمة عند -20 درجة مئوية.
- قم بإذابة مركبات المزيج II المدرجة في الجدول 1 في 20 مل من 0.1 M NaOH مع التحريك. يخزن في 100 ميكرولتر من القسمة عند -20 درجة مئوية.
- قم بإذابة مركبات المزيج الثالث المدرجة في الجدول 1 في 1 مل من الماء عالي النقاء مع التحريك. يحفظ في 10 ميكرولتر من القسامات عند 4 درجات مئوية.
- قم بإذابة مركب المزيج الرابع المدرج في الجدول 1 في 1 مل من الماء عالي النقاء مع التحريك. يخزن في 10 ميكرولتر من القسامات عند -20 درجة مئوية.
- قم بإذابة المركبات المدرجة في الجدول 2 في البداية في 15 مل من الماء عالي النقاء مع التحريك. اضبط الرقم الهيدروجيني على 7.0 مع بضع قطرات من 0.1 M NaOH واضبط الحجم النهائي على 20 مل باستخدام ماء فائق النقاء. يخزن في 1 مل من القسامات عند -20 درجة مئوية.
- قم بإذابة المركبات المدرجة في الجدول 3 في 90 مل من الماء عالي النقاء على طبق ساخن عند 50 درجة مئوية مع التحريك. اضبط الرقم الهيدروجيني على 7.0 باستخدام 0.1 M NaOH ، ثم اضبط الحجم النهائي على 100 مل باستخدام ماء فائق النقاء. يخزن في 5 مل من القسامات عند -20 درجة مئوية.
- اصنع المرق البادئ طازجا في كل مرة عن طريق إذابة المركبات الموجودة في الجدول 4 في 70 مل من الماء عالي النقاء مع التحريك.
- إلى مخزون المبتدئين الطازج ، أضف مخزون المزيج التالي بالترتيب: 200 ميكرولتر من مخزون Mix I (الجدول 1) ، و 80 ميكرولتر من مخزون Mix II (الجدول 1) ، و 10 ميكرولتر من مخزون Mix III (الجدول 1) ، و 10 ميكرولتر من مخزون Mix IV (الجدول 2) ، و 1 مل من مخزون الفيتامينات (الجدول 3) ، و 5 مل من مخزون الأحماض الأمينية (الجدول 4).
- بمجرد إضافة المخزون ، اضبط الحجم النهائي على 100 مل عن طريق إضافة 30 مل من الماء عالي النقاء إلى الدورق.
- تكملة آلية التنمية النظيفة بمركبات من الجدول 4. بمجرد خلطها جيدا ، قم بتعقيمها وتخزينها على حرارة 4 درجات مئوية لمدة أقصاها 2 أسابيع.
2. زراعة الأغشية الحيوية S. pneumoniae
- تحضير وسط RP-10 عن طريق خلط 445 مل من RPMI 1640 مع 50 مل من مصل بقري الجنين المعطل بالحرارة (FBS) و 5 مل من البنسلين / الستربتومايسين عند 10000 وحدة / مل و 10000 ميكروغرام / مل ، على التوالي.
- تنمو خط خلايا سرطان الجلد المخاطي NCI-H292 (H292). أضف الخلايا من قارورة واحدة تم شراؤها إلى 5 مل من وسط RP-10 في دورق T-25 معالج بزراعة الأنسجة. احتضان عند 37 درجة مئوية / 5٪ CO2 لمدة 3-5 أيام للوصول إلى التقاء 100٪.
- تحقق من الخلايا تحت المجهر الضوئي باستخدام تكبير 10x لتقييم التقارب.
ملاحظة: عندما تكون جميع الخلايا على اتصال بخلايا أخرى ولا توجد فجوات بينهما ، يتم الوصول إلى التقاء 100٪ المطلوب. - اغسل الخلايا 2x في 5 مل من PBS بدرجة حرارة الغرفة. تأكد من خلو المخزن المؤقت من الكالسيوم لتجنب مخلب EDTA في الخطوة التالية.
- أضف 1 مل من التربسين-EDTA إلى الدورق واحتضانه عند 37 درجة مئوية / 5٪ CO2 لمدة 5-10 دقائق حتى تنفصل الخلايا. تحييد مع 4 مل من RP-10 المتوسطة. امزج برفق عن طريق سحب الماصة لأعلى ولأسفل وانقلها إلى أنبوب مخروطي سعة 50 مل.
- أضف 500 ميكرولتر من معلق الخلية لكل بئر إلى صفيحة 24 بئر معالجة بزراعة الأنسجة. من قارورة T-25 متقاربة ، توقع 2 × 10 6-4 × 106 خلايا / مل.
- في اليوم التالي ، تحقق من الخلايا الموجودة تحت المجهر الضوئي للتأكد من أنها متقاربة ، كما في الخطوة 2.3. إذا لم تكن كذلك ، ثم احتضان لفترة أطول.
- بمجرد أن تتلاقى خلايا H292 بنسبة 100٪ في اللوحة المكونة من 24 بئرا ، اغسل الخلايا برفق 3x باستخدام 1 مل من برنامج تلفزيوني بدرجة حرارة الغرفة لضمان عدم وجود وسط يحتوي على مضادات حيوية أو حطام.
- بعد غسل الخلايا ، أضف 250 ميكرولتر / بئر من 4٪ بارافورمالدهايد لإصلاح الخلايا. احتضان إما لمدة 1 ساعة على الجليد أو بين عشية وضحاها في 4 درجات مئوية.
- في الليلة التي تسبق تثبيت الخلية ، قم بخط سلالة S. pneumoniae ذات الأهمية على ألواح أجار الدم واحتضانها طوال الليل عند 37 درجة مئوية / 5٪ CO2.
ملاحظة: البيانات المقدمة هنا هي مع سلالات S. pneumoniae التالية التي تم الحصول عليها عن طريق التبادل التعاوني: عزل التهاب الأذن الوسطى من النمط المصلي 19F EF3030 24 ، النمط المصلي الكلاسيكي 2 سلالة أفيري D3925 ، وعزل تجرثم الدم من النمط المصلي 4 TIGR426. السلالات متاحة أيضا من المجموعات العامة المشار إليها في جدول المواد. - تحضير آلية التنمية النظيفة بالإضافة إلى أوكسيراس (0.15 وحدة / مل) بإضافة 100 ميكرولتر من الأوكسيراس (30 وحدة / مل) إلى 20 مل من آلية التنمية النظيفة.
ملاحظة: يستخدم Oxyrase للتخلص من الأكسجين للسماح بالنمو الفعال للمكورات العنقودية الرئوية في الثقافة السائلة27. - قم بتلقيح البكتيريا من اللوحة إلى CDM + oxyrase الطازج عن طريق غسل البكتيريا من اللوحة عن طريق إضافة 1 مل من CDM + oxyrase ورفع المستعمرات البكتيرية برفق باستخدام جانب طرف ماصة 1 مل ، مع الحرص على عدم كشط الآجار. بدلا من ذلك ، استخدم حلقة تلقيح لرفع البكتيريا وتلقيحها في أنبوب يحتوي على 1 مل من CDM + oxyrase.
- تمييع البكتيريا في CDM + oxyrase إلى بداية OD600 من 0.05.
- قم بزراعة البكتيريا في أنبوب مخروطي مغطى بشكل فضفاض سعة 50 مل يقف عند 37 درجة مئوية / 5٪ CO 2 حتى يتم الوصول إلىOD 600 من 0.2 (سيستغرق ذلك ما بين2-5 ساعات). تحقق من OD600 كل ساعة للتأكد من أن OD لا يتجاوز 0.2.
- بمجرد وصول OD إلى 0.2 ، دوامة أنبوب الثقافة البكتيرية. بذر 0.5 مل من البكتيريا على خلايا H292 الثابتة وإضافة 0.5 مل أخرى من وسط CDM + oxyrase لكل بئر. أضف 1 مل من CDM + oxyrase إلى آبار التحكم الخالية من البكتيريا. احتضان اللوحة لمدة 48 ساعة عند 34 درجة مئوية / 5٪ CO2.
ملاحظة: يستخدم النمو عند 34 درجة مئوية لمحاكاة درجة الحرارة المنخفضة في البلعوم الأنفي21 عن كثب. - كل 12 ساعة بعد البذر الأولي ، قم بإزالة 0.5 مل من الوسط برفق وقم بتجديده ب 0.5 مل من CDM + oxyrase الطازج. احرص على عدم تعطيل الغشاء الحيوي المتكون. تحقق من الجزء السفلي من اللوحة بحثا عن الأغشية الحيوية وابحث عن زيادة الغيوم مع مرور الوقت بسبب نمو الغشاء الحيوي. للتحكم في التلوث ، افحص الآبار الخالية من البكتيريا للتأكد من أن آبار التحكم تظل نظيفة.
- في 48 ساعة بعد التلقيح ، قم بإزالة المادة الطافية واغسل 2x برفق شديد باستخدام 1 مل من PBS. أعد التعليق في 1 مل من آلية التنمية النظيفة الطازجة والماصة لأعلى ولأسفل بقوة لرفع الغشاء الحيوي. لكل سلالة بكتيرية ، قم بتجميع البكتيريا من جميع الآبار في أنبوب مخروطي سعة 50 مل. تخلط جيدا عن طريق إمالة الأنبوب المغطى بإحكام برفق لأعلى ولأسفل عدة مرات.
- إلى الأنبوب المخروطي سعة 50 مل ، أضف 40٪ من الجلسرين في CDM بأحجام متساوية لتحقيق تعليق بكتيري بتركيز نهائي قدره 20٪ جلسرين. القسمة 1 مل في أنابيب الطرد المركزي الدقيقة ، وتجميد فلاش على الثلج الجاف ، وتوفير في -80 درجة مئوية.
- قبل الاستخدام ، قم بتعداد البكتيريا عن طريق إذابة قسامة واحدة على الجليد ، وتدوير الأنبوب عند 1700 × جم لمدة 5 دقائق ، وإزالة المادة الطافية ، وتعليق الحبيبات في 1 مل من PBS ، وطلاء التخفيفات التسلسلية على ألواح أجار الدم28.
- قم بزراعة ألواح الآجار طوال الليل عند 37 درجة مئوية / 5٪ CO2 وعد المستعمرات عند التخفيفات ذات الصلة للحصول على تركيز البكتيريا في وحدات تكوين المستعمرات (CFU) / مل.
ملاحظة: يوصى بتعداد البكتيريا الموجودة في المخزون بعد يوم على الأقل من التجميد أو بعد ذلك ، حيث يوجد انخفاض في صلاحية البكتيريا خلال ال 24 ساعة الأولى. يمكن استخدام القسامات المجمدة المخزنة للعدوى اللاحقة للفئران لمدة أقصاها 2 أشهر.
3. التلقيح الأنفي للفئران بالأغشية الرئوية المزروعة بالأغشية الحيوية
- شراء الفئران واستخدامها في العمر المطلوب.
ملاحظة: تفضل الفئران التي تتراوح أعمارها بين 3-4 أشهر على نمذجة المضيفين الصغار ، ويمكن استخدام الفئران التي تتراوح أعمارها بين 21 و 24 شهرا لنمذجة الأفراد المسنين >65 عاما من العمر29 عاما. البيانات المقدمة هنا هي مع الفئران الذكور C57BL / 6. - قم بإذابة القسامات البكتيرية المزروعة بالأغشية الحيوية على الثلج وقم بتدويرها بمعدل 1700 × جم لمدة 5 دقائق. قم بإزالة المادة الطافية والتخلص منها بعناية دون تعطيل الحبيبات ، واغسل البكتيريا عن طريق تعليق الحبيبات في 1 مل من برنامج تلفزيوني ، وقم بتدويرها مرة أخرى عند 1700 × جم لمدة 5 دقائق. قم بإزالة المادة الطافية وأعد تعليق الحبيبات بالحجم اللازم للوصول إلى التركيز المطلوب (استهدف 5 × 106 CFU / 10 μL للتلقيح داخل الأنف). تأكد من كميات البكتيريا التي يتم إعطاؤها عن طريق طلاء اللقاح المحضر على ألواح أجار الدم كما في الخطوة 2.19.
- تلقيح الفئران عن طريق الأنف مع 5 × 106 CFU عن طريق سحب 5 ميكرولتر من اللقاح المخفف في كل ناريس. تأكد من إمساك الفئران بإحكام ، وتثبيت الرأس ، حتى يتم استنشاق الحجم (عادة في غضون ثوان من سحب الحجم في النار). نفذ هذه الخطوة في حالة عدم وجود تخدير لمنع الطموح الرئوي للقاح.
4. العدوى الفيروسية بفيروس الأنفلونزا A (IAV)
- في 48 ساعة بعد التلقيح عن طريق الأنف مع S. الرئوية ، إذابة سلالة IAV من الفائدة على الجليد.
ملاحظة: البيانات المقدمة هنا هي مع سلالة متكيفة مع الفئران من فيروس الأنفلونزا A A/PR/8/34 H1N1 تم الحصول عليها عن طريق التبادل التعاوني30. - بمجرد ذوبان الفيروس ، قم بتخفيف الفيروس في برنامج تلفزيوني إلى التركيز المطلوب ؛ تهدف إلى 20 وحدة تشكيل البلاك (PFU) / 50 ميكرولتر للعدوى داخل القصبة الهوائية و 200 PFU / 10 ميكرولتر للعدوى داخل الأنف. بالنسبة للمجموعات المصابة بالوهمية والبكتيريا فقط ، استخدم برنامج تلفزيوني لتلقيح الفئران.
- ضع مواد تشحيم العيون على عيون الفئران قبل التخدير. تخدير الفئران باستخدام 5٪ إيزوفلوران وتأكيد التخدير بواسطة قرصة إصبع القدم الثابتة.
- بمجرد تخدير الحيوان ، قم بإزالته من غرفة الأيزوفلوران وأصاب الفئران المخدرة على الفور ب 50 ميكرولتر (20 PFU) من IAV داخل القصبة الهوائية باستخدام ملاقط حادة لسحب اللسان من الفم وسحب حجم السائل أسفل القصبة الهوائية.
- ضع الفئران في قفص منفصل وراقبها حتى الشفاء التام (فهي قادرة على الحفاظ على الاستلقاء القصي [قادرة على وضع مستقيم على الصدر]).
- بعد الشفاء ، قم بتلقيح الفئران عن طريق الأنف مباشرة ب 10 ميكرولتر (200 PFU) من IAV باستخدام طريقة التلقيح في الخطوة 3.3.
- الفئران المنزلية التي خضعت لعدوى بكتيرية وفيروسية مفردة أو مزدوجة مع نفس مجموعة العدوى وفصلها عن المجموعات الأخرى.
5. مراقبة الفئران لأعراض المرض
- راقب الفئران يوميا لمدة 10 أيام على الأقل وسجل بشكل أعمى علامات المرض على النحو التالي:
- النتيجة على النحو التالي لفقدان الوزن: 0 = 5٪ أو أقل ؛ 1 = 5٪ -10٪ ؛ 2 = 10٪ -15٪ ؛ 3 = 20٪ أو أكثر. القتل الرحيم للفئران باستخدام استنشاق CO2 عندما تكون درجة فقدان الوزن عند 3.
- النتيجة على النحو التالي للنشاط: 0 = عادي / نشط ؛ 1 = تتحرك ولكن تتضاءل قليلا ؛ 2 = تقلصت. 3 = تناقص شديد / خامل (يتحرك فقط إذا تم لمسه) ، 4 = غيبوبة / غير متحرك. القتل الرحيم للفئران عندما تكون درجة النشاط عند 3.
- النتيجة على النحو التالي للموقف: 0 = لا حدس (طبيعي) ؛ 1 = وضعية منحنية قليلا ؛ 2 = حدس شديد. القتل الرحيم للفئران عندما تكون درجة الموقف عند 2.
- النتيجة على النحو التالي للعيون: 0 = طبيعي ؛ 1 = جاحظ ؛ 1 = غارقة ؛ 1 = مغلق ؛ 1 = التفريغ. يمكن أن يكون مزيج. اجمع المجاميع للحصول على درجة العين النهائية.
- النتيجة على النحو التالي للتنفس: 0 = التنفس الطبيعي. 1 = غير منتظم أو معدل (معدل أعلى / أقل) ؛ 2 = عمل (جهد مبالغ فيه أو يلهث). القتل الرحيم للفئران عندما تكون درجة التنفس عند 2.
- بناء على المعايير المذكورة أعلاه ، أضف الدرجات الفردية للحصول على درجة سريرية إجمالية صحية (0) إلى مريضة للغاية (15). ضع في اعتبارك أن أي ماوس يعرض درجة إجمالية أعلى من 2 مريض. القتل الرحيم بشكل إنساني لأي فئران تعرض درجة إجمالية أعلى من 9 أو الدرجات المشار إليها لكل معيار وقم بتمييزها على منحنى البقاء على قيد الحياة.
6. معالجة الأنسجة المصابة للتعداد البكتيري
- في 48 ساعة بعد عدوى IAV ، القتل الرحيم الفئران.
- ضع الماوس في وضع ضعيف. باستخدام 70 ٪ من الإيثانول ، رش الصدر والبطن من الماوس لتنظيف الفراء. باستخدام الملقط ، قرصة الفراء والجلد في منتصف الماوس وقطع الفراء مع 4.5 في مقص تشريح لفضح المنطقة من الكبد حتى الصدر.
- جمع الدم
- باستخدام مقص التشريح ، قطع بلطف في التجويف البريتوني لفضح الكبد. باستخدام ملقط ، كشف الوريد البابي الكبدي في الجزء العلوي من الكبد بالقرب من الحجاب الحاجز. قطع الوريد البابي الكبدي باستخدام مقص التشريح. بمجرد أن يبدأ الدم في التجمع في التجويف البريتوني ، اجمع 10 ميكرولتر من الدم باستخدام ماصة دقيقة وضعها في 90 ميكرولتر من محلول مضاد للتخثر (محلول 50 مللي متر EDTA في PBS) في أنبوب طرد مركزي دقيق للطلاء للعبء البكتيري.
- استخدم ماصة P-1000 الدقيقة لجمع بقية الدم ، ووضعها في أنبوب جمع الدم ، وأجهزة الطرد المركزي عند 7600 × جم لمدة 2 دقيقة لجمع المصل. حفظ الأمصال في أنابيب الطرد المركزي الدقيقة في -80 درجة مئوية للتحليل اللاحق لأي سيتوكين أو مستقلب مطلوب.
- جمع الرئة
- باستخدام مقص التشريح ، قم بقطع جوانب القفص الصدري المكشوف واسحب الأضلاع برفق نحو رأس الفأر لفضح القلب. أدخل إبرة 25 جيجا متصلة بحقنة سعة 10 مل مملوءة مسبقا ب PBS في البطين الأيمن وابدأ في التعتيم ببطء. ابحث عن تبييض الرئتين كمؤشر على التروية الناجحة. احمر ببطء لتجنب كسر الأنسجة الرئوية.
- ارفع القلب بالملقط وقم بعمل قطع لفصل الرئتين والقلب. بمجرد الانفصال ، التقط جميع فصوص الرئة بالملقط واشطفها في طبق به برنامج تلفزيوني معقم لإزالة أي دم متبقي. في طبق بتري ، يفرم الرئتين إلى قطع صغيرة ويخلط جيدا. قم بإزالة نصف مزيج الرئة لتحديد CFU البكتيري أو PFU الفيروسي وضعه في أنبوب دائري القاع سعة 15 مل مملوء مسبقا ب 0.5 مل من PBS للتجانس.
ملاحظة: من المهم عدم أخذ فصوص مختلفة من نفس الرئة لإجراء التقييمات المختلفة. بدلا من ذلك ، يجب فرم جميع الفصوص وخلطها جيدا معا وتحليلها بالتساوي للتقييمات المختلفة. - قم بإزالة النصف الآخر من الرئة لقياس التدفق الخلوي (القسم 7 أدناه) وضعه في صفيحة 24 بئرا غير معالجة بزراعة الأنسجة مع كل بئر مملوءة مسبقا ب 0.5 مل من RP-10. اتركيه في درجة حرارة الغرفة حتى المعالجة.
- جمع البلعوم الأنفي
- في الرقبة ، استخدم مقص التشريح لقطع الفراء ، ثم قطع العضلات وفضح القصبة الهوائية.
ملاحظة: القصبة الهوائية عبارة عن هيكل يشبه الأنبوب يقع تحت العضلات. - ضع ملقط صغير تحت القصبة الهوائية على مسافة 1 سم من فك الماوس لتثبيته. باستخدام مقص التشريح ، قم بعمل شق 0.1 سم برفق على الجزء الأمامي من القصبة الهوائية ، وتجنب قطع القصبة الهوائية تماما.
- قم بإعداد حقنة سعة 1 مل مملوءة ب 0.5 مل من PBS مع أنبوب 0.58 مم متصل بإبرة 25 جرام. اجمع غسول الأنف عن طريق إدخال الأنبوب في القصبة الهوائية متجها صعودا نحو البلعوم الأنفي. بمجرد الشعور بالمقاومة التي تدخل تجويف الأنف ، ضع أنبوب طرد مركزي دقيق عند الأنف واغسل برنامج تلفزيوني ببطء عبر القصبة الهوائية لجمع غسل الأنف.
- ضع الماوس في وضعية الانبطاح. رش رأس الماوس بالإيثانول. استخدم مقص التشريح لقطع الفراء والوسادة الصوفية لفضح عظم رأس الفأر.
- باستخدام مقص التشريح ، قم بقطع 1 سم على جانبي الفك السفلي وبين العينين. باستخدام الملقط ، اسحب عظام الوجه ببطء بعيدا عن الجسم لكشف تجويف الأنف.
- استخدم الملقط لإزالة أنسجة الأنف برفق ووضعها في أنبوب دائري القاع مملوء مسبقا ب 0.5 مل من برنامج تلفزيوني للتجانس.
- في الرقبة ، استخدم مقص التشريح لقطع الفراء ، ثم قطع العضلات وفضح القصبة الهوائية.
- لتجانس الأنسجة التي تم جمعها ، قم أولا بتنظيف مسبار الخالط عن طريق وضعه في 70٪ من الإيثانول وتشغيل الخالط بنسبة 60٪ من الطاقة لمدة 30 ثانية. كرر الخطوة في الماء المعقم لمدة 10 ثوان. تجانس كل الأنسجة لمدة 1 دقيقة. قم بتنظيف مسبار الخالط في ماء معقم بين كل عينة وفي أنبوب جديد يحتوي على 70٪ من الإيثانول بين كل عضو ومجموعة عينة.
- تعداد الأعداد البكتيرية
- بمجرد حصاد جميع الأعضاء وتجانسها ، يتم تخفيف الصفائح التسلسلية على ألواح أجار الدم. لحساب إجمالي CFU ، استخدم 10 ميكرولتر للوحة وتدوين الحجم النهائي بالمل لكل عينة. قم بمسح عينات البلعوم الأنفي على ألواح أجار الدم المكملة ب 3 ميكروغرام / مل جنتاميسين لاختيار نمو العقدية الرئوية مع تثبيط نمو الكائنات الحية الدقيقة الأخرى التي تستعمر هذا النسيج. احتضان بين عشية وضحاها في 37 درجة مئوية / 5 ٪ CO2.
- لتعداد CFU البكتيري للرئة والبلعوم الأنفي ، قم أولا بحساب المستعمرات على ألواح أجار الدم. ثم استخدم المعادلة (1) والمعادلة (2) لحساب المبلغ لكل مل والعدد الإجمالي.
المبلغ لكل مل = عدد المستعمرات × عامل التخفيف × 100 (1)
العدد الإجمالي = الكمية لكل مل × الحجم الإجمالي لكل عينة (2)
ملاحظة: في المعادلة (1) ، يتم استخدام 100 للضرب لأن 10 ميكرولتر مطلية ، وهو تخفيف 100 ضعف بمقدار 1 مل. الحجم الإجمالي لكل عينة في المعادلة (2) هو من الخطوة 6.7.1 ، مما ينتج عنه حد الكشف عن 100 لكل عضو. - لتعداد CFU البكتيرية لتجرثم الدم ، عد أولا المستعمرات على ألواح أجار الدم. ثم استخدم المعادلة (3) لتحديد الكمية لكل مل من الدم.
المبلغ لكل مل من الدم = عدد المستعمرات × عامل التخفيف × 100 × 10 (3)
ملاحظة: في المعادلة (3) ، يتم استخدام 100 حيث يتم طلاء 10 ميكرولتر ، وهو تخفيف 100 ضعف بمقدار 1 مل ، ويشير 10 إلى تخفيف الدم بنسبة 1:10 في مضادات التخثر. ينتج عن هذا حد الكشف عن 1000 / مل.
7. تجهيز عينات الرئة لقياس التدفق الخلوي
- قم بإعداد الوسائط المطلوبة على النحو التالي:
- قم بإعداد RP-10 كما هو موضح في الخطوة 2.1.
- تحضير محلول الهضم عن طريق خلط RP-10 مع 2 ملغ / مل كولاجيناز و 30 ميكرولتر / مل DNase I.
- تحضير محلول التحلل عن طريق إذابة 8.29 g من NH4Cl و 1 g من NaHCO3 و 0.038 g من EDTA في 1 L من H2O.
- قم بإعداد 10x FACS buffer عن طريق خلط 450 مل من HBSS مع 50 مل من FBS المعطل بالحرارة و 5 جم من أزيد الصوديوم.
- تحضير 1x FACS buffer عن طريق تخفيف 50 مل من 10x FACS buffer في 450 مل من HBSS.
- خذ عينات الرئة من الخطوة 6.4.3 وضعها في طبق من 24 بئرا. أضف 500 ميكرولتر من محلول الهضم إلى كل بئر. احتضان لمدة 45 دقيقة حتى 1 ساعة عند 37 درجة مئوية / 5٪ CO2.
- قم بتعبئة 50 مل من الأنابيب المخروطية لكل عينة ب 5 مل من RP-10. عندما تنتهي الحضانة ، ضع مرشحا 100 ميكرومتر في الجزء العلوي من الأنبوب المخروطي سعة 50 مل ورطبه ب 1 مل من RP-10.
- باستخدام ميكروبيت P-1000 ، حرك الرئتين المهضومتين وضعهما على الفلتر. استخدم مكبس حقنة سعة 3 مل لهرس العضو. شطف 2x مع 1 مل من RP-10 في كل مرة.
- أدر العينات على حرارة 4 درجات مئوية و 327 × جم لمدة 5 دقائق. نضح المادة الطافية وأعد تعليق الحبيبات في 1 مل من محلول التحلل. اتركيه لمدة 3 دقائق للسماح بتحلل خلايا الدم الحمراء. تحييد مع 5 مل من RP-10.
- أدر العينات على حرارة 4 درجات مئوية و 327 × جم لمدة 5 دقائق. نضح المادة الطافية ، وأعد تعليق الحبيبات في 1 مل من RP-10 ، وخذ 10 ميكرولتر لحساب العينات.
- أدر العينات على حرارة 4 درجات مئوية و 327 × جم لمدة 5 دقائق. نضح المادة الطافية وإعادة تعليق الحبيبات في RP-10 عند 2 × 10 6-4 × 106 خلايا / مل. أضف 60 ميكرولتر من كل عينة إلى صفيحة 96 بئرا لتلطيخ أنواع الخلاياالمرغوبة 23 المدرجة في الخطوة 7.9 والجدول 5 والجدول 6.
- أدري الطبق على حرارة 4 درجات مئوية و 327 × جم لمدة 5 دقائق.
- وفي الوقت نفسه ، قم بإعداد الخلطات الرئيسية للأجسام المضادة ، والفلورسنت ناقص واحد (FMOs) ، وأدوات التحكم في البقعة الواحدة باستخدام الأجسام المضادة المطلوبة. لتلطيخ كريات الدم البيضاء متعددة الأشكال (PMNs) ، والبلاعم ، والوحيدات ، والخلايا المتغصنة ، والخلايا التائية ، استخدم الأجسام المضادة والتخفيفات النهائية المدرجة في الجدول 5 والجدول 6. استخدم حجما إجماليا قدره 100 ميكرولتر / بئر من مزيج الأجسام المضادة. اتبع التخفيفات المدرجة في الجداول لتحديد الحجم المناسب للمزيج الرئيسي والأجسام المضادة الفردية المطلوبة.
- عند الانتهاء من الدوران (الخطوة 7.8) ، صب المادة الطافية ، وأعد تعليق الكريات في 100 ميكرولتر من خلطات الأجسام المضادة ، أو FMOs ، أو عناصر التحكم في البقعة الواحدة ، واحتضانها على الجليد لمدة 30 دقيقة في الظلام.
- اغسل الخلايا 2x بإضافة 150 ميكرولتر من المخزن المؤقت FACS إلى الآبار وتدوير اللوحة عند 4 درجات مئوية و 327 × جم لمدة 5 دقائق.
- عند الانتهاء من الدوران ، صب المادة الطافية ، وأعد تعليق الكريات في 100 ميكرولتر من محلول التثبيت ، واحتضانها على الجليد لمدة 20 دقيقة.
- اغسل الخلايا 2x بإضافة 150 ميكرولتر من محلول FACS إلى الآبار وتدوير اللوحة عند 4 درجات مئوية و 327 × جم لمدة 5 دقائق.
- تحضير أنابيب FACS الموسومة ب 200 ميكرولتر من المخزن المؤقت FACS. أعد تعليق الكريات في 150 ميكرولتر من المخزن المؤقت FACS. قم بتصفية كل عينة بشكل فردي في أنبوب FACS المقابل لها باستخدام مرشح 100 ميكرومتر. يحفظ على الجليد أو عند 4 درجات مئوية ويحمي من الضوء حتى يصبح جاهزا للتحليل.
- تحليل الخلايا باستخدام مقياس التدفق الخلوي.
8. مقايسة البلاك لتعداد IAV
- قم بإعداد الوسائط المطلوبة على النحو التالي:
- تحضير وسط العدوى عن طريق إذابة 2.5 غرام من ألبومين مصل البقر (BSA) في 40 مل من DMEM مع التحريك على حرارة 37 درجة مئوية لمدة 10-20 دقيقة حتى يذوب. تصفية تعقيم في 460 مل من DMEM.
- تحضير 2.4 ٪ السليلوز الجريزوفولفين عن طريق إذابة 1.2 ملغ من السليلوز الجريزوفولفين في 50 مل من H2O. الأوتوكلاف على إعداد السائل وتخزينها في درجة حرارة الغرفة.
- تحضير 5٪ من BSA DMEM عن طريق إذابة 2.5 جم من BSA في 40 مل من DMEM مع التحريك عند 37 درجة مئوية لمدة 10-20 دقيقة. أضف ال 10 مل المتبقية من DMEM للحصول على حجم نهائي قدره 50 مل. قم بتعقيمه بالتصفية وتخزينه في درجة حرارة 4 درجات مئوية.
- تحضير 2x MEM / 0.5٪ BSA عن طريق خلط 1 مل من 5٪ BSA DMEM مع 9 مل من 2x MEM.
- تحضير وسط تراكب منخفض اللزوجة عن طريق خلط نسبة 1: 1 من السليلوز الجريزوفولفين 2.4٪ و 2x MEM / 0.5٪ BSA مع 1 مجم / مل TPCK (مثبط الكيموتريبسين) التربسين.
- قم بإعداد EMEM / 10٪ FBS عن طريق خلط 450 مل من الحد الأدنى من الوسط الأساسي النسر (EMEM) مع 50 مل من FBS المعطل بالحرارة.
- تنمو خط خلايا كلية الكلاب Madin-Darby (MDCK). أضف الخلايا من قارورة واحدة تم شراؤها إلى 5 مل من EMEM / 10٪ FBS في دورق T-25 معالج بزراعة الأنسجة. احتضان لمدة 3-5 أيام عند 37 درجة مئوية / 5٪ CO2 حتى تصل الخلايا إلى التقاء 100٪. تحقق من وجود التقاء كما في الخطوة 2.3.
- قم بإزالة وسط الاستزراع والتخلص منه ، واشطف 2x ب 5 مل من برنامج تلفزيوني بدرجة حرارة الغرفة. أضف 1 مل من التربسين-EDTA إلى الدورق واحتضانه عند 37 درجة مئوية / 5٪ CO2 لمدة 10-15 دقيقة حتى تنفصل الخلايا. بمجرد رفعه ، قم بتحييده باستخدام 4 مل من EMEM / 10٪ FBS للحصول على تعليق خلية عند 2 × 105 خلايا / مل.
- قم بزرع خلايا MDCK في صفيحة معالجة بزراعة الأنسجة مكونة من 12 بئرا عن طريق إضافة 1 مل من الخلايا المعاد تعليقها لكل بئر (عند 2 × 105 خلايا / بئر) قبل يوم واحد من بدء فحص البلاك.
ملاحظة: تأكد من وصول الخلايا إلى التقاء 100٪ قبل الاستخدام واحتضانها لفترة أطول إذا لزم الأمر للوصول إلى نقطة التقاء. - للاستخدام كمعايير ، قم بعمل تخفيفات تسلسلية بمقدار 10 أضعاف (106-10 1) من مخزون IAV (من عيار معروف) في وسط العدوى المدرج في الخطوة 8.1.1. اصنع 1.2 مل من كل تخفيف لاختباره في ثلاث نسخ.
- ذوبان متجانسة الجهاز على الجليد. قم بالدوران على جهاز طرد مركزي منضدية عند 2000 × جم واجمع المادة الطافية الشفافة.
- كرر الخطوة 8.5 ولكن مع المادة الطافية من العينات في الخطوة 8.6.
- نضح الوسط من الخلايا واغسل 2x مع 1 مل من PBS لإزالة كل FBS.
- أضف 300 ميكرولتر من كل تخفيف قياسي أو عينة مخففة بشكل متسلسل برفق على طول جانب كل بئر ، بدءا من أعلى تخفيف إلى أدنى مستوى ، وافعل ذلك في ثلاث نسخ.
- ضع الألواح في الحاضنة عند 37 درجة مئوية / 5٪ CO2 ، مع هز اللوحة كل 10 دقائق لمدة 50 دقيقة. تأكد من وضعها بشكل مسطح في الحاضنة وعدم تكديسها.
- بعد 50 دقيقة ، اغسل الخلايا 2x مع 1 مل من برنامج تلفزيوني.
- أضف 2 مل من وسط التراكب منخفض اللزوجة في كل بئر باستثناء الآبار الأقل تخفيفا والخالية من الفيروسات ؛ لهؤلاء ، أضف وسط العدوى والتربسين.
- ضع اللوحة مرة أخرى في الحاضنة عند 37 درجة مئوية / 5٪ CO 2 لمدة2-4 أيام لتحقيق لويحات يمكن رؤيتها بالعين المجردة.
- اغسل الألواح بإضافة 2 مل من PBS إلى كل بئر بسرعة من الجانب ورجها برفق لتعليق وسط التراكب منخفض اللزوجة المستقر.
- تخلص من حجم السائل بالكامل في البئر عن طريق سحب الوسط برفق.
- كرر الغسيل مرة أخرى مع 2 مل من PBS في كل بئر ، ثم تخلص من حجم السائل بالكامل عن طريق السحب اللطيف.
- لإصلاح اللويحات ، أضف 500 ميكرولتر من 4٪ بارافورمالدهيد في كل بئر ، رجها واتركها لمدة 30 دقيقة.
- تغسل ببطء أسفل الجانب مع 1 مل من PBS. ثم تخلص من السائل برفق.
- أضف 500 ميكرولتر من 1٪ من البنفسج البلوري (المخفف في الماء) إلى كل بئر لتغطية الطبقة الأحادية للخلية. احتضان لمدة 5 دقائق.
- يغسل مع 1 مل من ماء الصنبور. تأكد من التخلص من كل السائل في البئر عن طريق السحب اللطيف. ضع الطبق رأسا على عقب على وسادة حفاضات حتى يجف طوال الليل.
- عد اللوحات بصريا واحفظ الصور على أي جهاز تصوير متاح.
النتائج
تم استخدام S. pneumoniae المزروعة بالأغشية الحيوية (الشكل 1 أ) لإصابة الفئران (الشكل 1 ب) باستخدام لقاح صغير سعة 10 ميكرولتر يتم توصيله عن طريق الأنف إلى الفئران غير المخدرة. ينتج عن هذا اللقاح صغير الحجم نقل متسق للمكورات الرئوية يقتصر على البلعوم الأنفي (الشكل 2A ، + مجموعات sp) مع تجنب الانتشار الجهازي (الشكل 2B ، C ، + مجموعات sp). بعد يومين من التلقيح عن طريق الأنف ، أصيبت الفئران بفيروس H1N1 A المكيف مع الأنفلونزا A A / PR / 8/34 (IAV) 22،30 الذي تم تسليمه عن طريق الأنف وداخل القصبة الهوائية لتحقيق توصيل ثابت لكميات محددة إلى البلعوم الأنفي والرئتين23.
هنا ، تم استخدام النموذج لمقارنة مسار المرض بعد العدوى الفيروسية في الفئران التي تم تحديها داخل الأنف مع سلالات مختلفة من S. pneumoniae ، بما في ذلك TIGR4 و D39 ، وهي سلالات غازية تؤدي إلى الالتهاب الرئوي الذي يتطور إلى تجرثم الدم ، و EF3030 ، وهو سلالة التهاب الأذن الوسطى 21،24،25،26،31. كان عرض المرض في الفئران المصابة بعدوى S. pneumoniae / IAV يعتمد على السلالة البكتيرية (الشكل 2). في حين لم يكن هناك فرق كبير في أعداد البكتيريا من البلعوم الأنفي (الشكل 2A) بين أي من السلالات ، S. الرئوية TIGR4 و D39 ، ولكن ليس EF3030 ، انتشرت إلى الرئتين بحلول 48 ساعة بعد عدوى IAV (الشكل 2B). أظهر أربعون بالمائة من الفئران المصابة عن طريق الأنف ب S. pneumoniae TIGR4 انتشارا بكتيريا إلى الرئتين ، ومن بين هؤلاء ، أصبح نصفهم جراثيما (الشكل 2C) ، بما يتفق مع النتائج السابقة23.
أظهرت الفئران المصابة عن طريق الأنف ب S. pneumoniae D39 انتشارا أكثر كفاءة ، لأنه لوحظ انتشاره إلى الرئتين في 100٪ من الفئران المصابة بعدوى مشتركة (الشكل 2B). على غرار S. pneumoniae TIGR4 ، عانى نصف هؤلاء من تجرثم الدم (الشكل 2C). في تتبع البقاء على قيد الحياة بشكل عام ، بغض النظر عن السلالة البكتيرية ، كان معدل بقاء الفئران المصابة بعدوى مشتركة أقل بكثير من الفئران التي تم تحديها بشكل فردي مع S. pneumoniae وحدها لجميع السلالات التي تم اختبارها (الشكل 2D). بالمقارنة مع الفئران الضابطة التي تم تحديها مع IAV وحده ، أظهرت الفئران المصابة عن طريق الأنف ب S. pneumoniae TIGR4 و D39 ، ولكن ليس EF3030 ، معدلات متسارعة من المرض. بحلول اليوم الثاني بعد الإصابة ب IAV ، استسلم 30٪ (D39) و 20٪ (TIGR4) من الفئران ، في حين أن مجموعات التحكم IAV فقط لم تبدأ في الاستسلام حتى اليوم الخامس بعد التحدي (الشكل 2D). كان لدى الفئران المصابة بعدوى S. pneumoniae EF3030 و IAV أعراض متأخرة ، تشبه إلى حد كبير عناصر التحكم في IAV فقط (الشكل 2D). توضح هذه النتائج أن نموذج العدوى المشتركة يؤدي إلى مرض في الفئران الشابة السليمة يعتمد على الإجهاد البكتيري ، مما يجعله مثاليا لاستكشاف العوامل البكتيرية المطلوبة في كل خطوة من خطوات تطور المرض.
تم استخدام هذا النموذج لتقييم وجود خلايا مناعية مختلفة في الرئتين (أنواع الخلايا واستراتيجية البوابة في الشكل 3) بعد عدوى IAV في الفئران الملقحة عن طريق الأنف بسلالات مختلفة من S. pneumoniae. أثارت السلالات البكتيرية D39 و TIGR4 ، التي انتشرت في الرئتين بعد عدوى IAV ، زيادة كبيرة فوق خط الأساس (غير المصابة) في تدفق الخلايا المناعية الالتهابية من الدورة الدموية ، مثل العدلات (PMNs) والوحيدات ، في حين أن EF3030 لم تفعل ذلك (الشكل 4A-C). أثارت عدوى IAV وحدها زيادة كبيرة فوق خط الأساس في تدفق الخلايا المناعية المهمة للدفاع المضيف ضد العدوى الفيروسية ، مثل الخلايا القاتلة الطبيعية وخلايا جاما دلتا التائية (الشكل 4A-C). تم إضعاف هذه الاستجابات المضادة للفيروسات بشكل كبير في الفئران المصابة عن طريق الأنف بالمكورات الرئوية قبل التحدي الفيروسي (الشكل 4A-C). وهذا يتفق مع الدراسات السابقة التي قيمت استجابات السيتوكين التي وجدت أن نقل S. pneumoniae أضعف إنتاج الإنترفيرون من النوع الأول وأضعف قدرة المضيف على التحكم في أحمال IAV في الرئتين23. توضح هذه النتائج أنه يمكن استخدام نموذج العدوى المشتركة لدراسة كيفية تغير الاستجابات المناعية في العدوى الأحادية مقابل العدوى متعددة الميكروبات.
تم استخدام هذا النموذج أيضا لتقييم تأثير الشيخوخة على مسار المرض بعد عدوى IAV في الفئران المصابة عن طريق الأنف ب S. pneumoniae TIGR4. في الفئران المصابة منفردة ، لم يختلف التتر الفيروسي بين الأفواج الصغيرة والمسنة (الشكل 5 أ)23. كما هو الحال في الدراسات السابقة23 ، أظهرت الفئران المسنة علامات مرض مبكرة وأكثر حدة مقارنة بنظيراتها الشابة ، كما يتضح من الدرجات السريرية الأعلى (الشكل 5 ب). تمشيا مع أعراض المرض ، بدأت الفئران المسنة الملقحة ب S. pneumoniae تموت بشكل أسرع في غضون 24 ساعة بعد الإصابة ب IAV ، واستسلمت جميعها للمرض ، في حين نجت الضوابط الشابة من العدوى بمعدل أعلى بكثير (33٪) (الشكل 5C). توضح هذه النتائج أنه يمكن استخدام نموذج العدوى المشتركة للكشف عن مرض أكثر وخامة في المضيفين المعرضين للخطر ، مما يجعله مثاليا لاستكشاف العوامل المضيفة التي تمنح المقاومة أو القابلية للإصابة بالعدوى المشتركة.
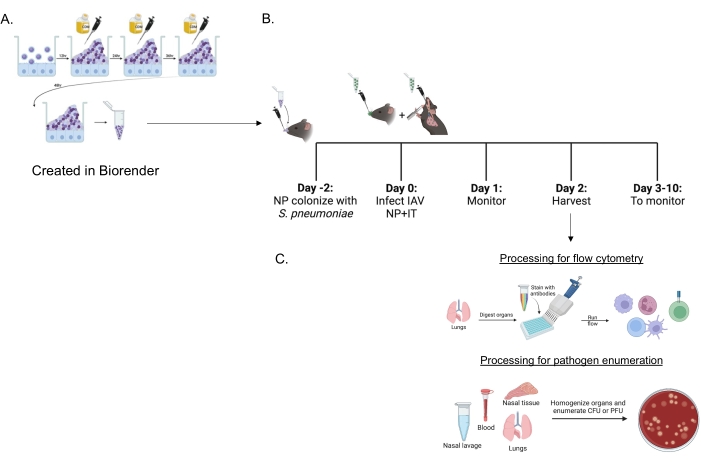
الشكل 1: الجدول الزمني للعدوى المشتركة ومعالجة الأعضاء لتقييم تدفق الخلايا المناعية وعبء مسبب المرض . (أ) تزرع العقدية الرئوية في الأغشية الحيوية. (ب) يتم تلقيح الفئران عن طريق الأنف ب 5 × 106 CFU من سلالة S. pneumoniae المشار إليها المزروعة بالأغشية الحيوية لإنشاء نقل البلعوم الأنفي أو تركها دون علاج. بعد ثمان وأربعين ساعة ، يتم علاج الفئران إما ب PBS أو تلقي 200 PFU من فيروس الأنفلونزا A PR8 داخل الأنف و 20 PFU داخل القصبة الهوائية. تتم مراقبة الفئران بمرور الوقت للحصول على درجات الأمراض السريرية والبقاء على قيد الحياة. (ج) في 48 ساعة بعد الإصابة ب IAV ، يتم تقييم CFU البكتيري أو PFU الفيروسي في الأعضاء المختلفة أو تدفق الخلايا المناعية في الرئتين. الاختصارات: CFU = وحدات تشكيل المستعمرة ؛ PFU = وحدات تشكيل البلاك ؛ IAV = فيروس الأنفلونزا A PR8 ؛ تكنولوجيا المعلومات = داخل القصبة الهوائية ؛ NP = البلعوم الأنفي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
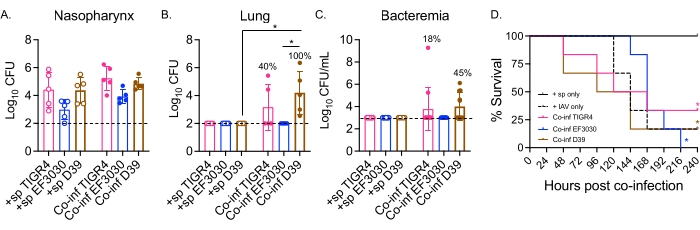
الشكل 2: تؤدي عدوى IAV المزدوجة داخل الأنف / داخل القصبة الهوائية للفئران الملقحة بالعقدية الرئوية إلى انتشار البكتيريا والمرض الذي يعتمد على السلالة البكتيرية. أصيبت ذكور الفئران الصغيرة (10-12 أسبوعا) C57BL / 6 (B6) كما في الشكل 1. تم تحديد الأعداد البكتيرية في الدم (أ) البلعوم الأنفي و (ب) و (ج) عند 48 ساعة بعد عدوى IAV. (ب، ج) تشير النسب المئوية إلى جزء الفئران التي أظهرت انتشارا. (د) تمت مراقبة البقاء على قيد الحياة لمدة 10 أيام بعد الإصابة ب IAV. يتم عرض البيانات المجمعة من (A ، B) n = 5 و (C) n = 11 و (D) n = 6 فئران لكل مجموعة. تتوافق كل دائرة مع ماوس واحد ، وتشير الخطوط المتقطعة إلى حد الكشف. (A-C) * ، يشير إلى وجود فرق كبير (p < 0.05) بين المجموعات المشار إليها كما هو محدد في اختبار Kruskal-Wallis. (D) * ، يشير إلى وجود فرق كبير (p < 0.05) بين + sp و Co-inf الفئران لكل سلالة بكتيرية كما هو محدد في اختبار رتبة اللوغاريتم (Mantel-Cox). الاختصارات: + sp = الفئران المصابة عن طريق الأنف بالبكتيريا فقط باستخدام السلالة المشار إليها ؛ Co-inf = الفئران المصابة بالبكتيريا المصابة ب IAV ؛ IAV = الفئران التي تلقت فيروس الأنفلونزا A ؛ CFU = وحدات تشكيل المستعمرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
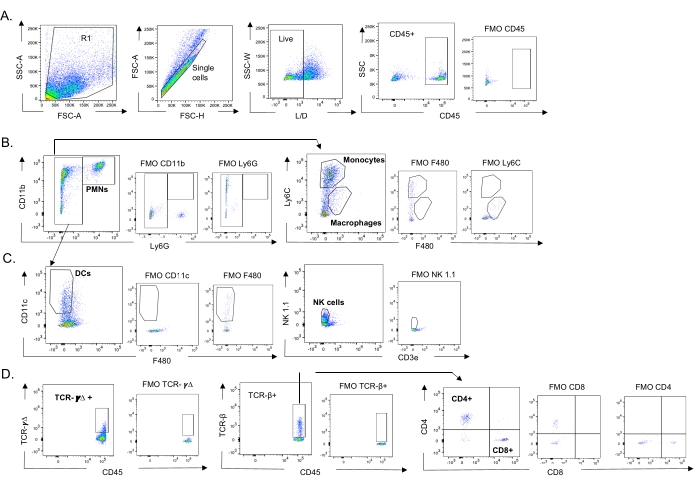
الشكل 3: استراتيجية بوابات الخلايا المناعية. تم حصاد الرئتين ، وتم تحديد تدفق الخلايا المناعية عن طريق قياس التدفق الخلوي. يتم عرض استراتيجية البوابة التمثيلية لأنواع الخلايا المختلفة. (أ) CD45 + ، تم إغلاق الخلايا المفردة الحية والنسب المئوية ل (B) PMNs (Ly6G + ، CD11b +) ، الضامة (Ly6G- ، Ly6C- ، F480+) ، والوحيدات (Ly6G- ، Ly6C +) ، (C) DCs (Ly6G- ، CD11c +) والخلايا القاتلة الطبيعية (NK1.1+ ، CD3-) ، (D) TCR- γΔ و CD8 (CD8 + ، TCRβ +) و CD4 (CD4 + ، TCRβ + ) تم تحديد الخلايا التائية. الاختصارات: SSC-A = منطقة ذروة التشتت الجانبية ؛ FSC-A = منطقة ذروة التشتت الأمامية ؛ FSC-H = ارتفاع ذروة التشتت الأمامي ؛ SSC-W = عرض ذروة التشتت الجانبي ؛ L / D = حي / ميت ؛ FMO = الفلورسنت ناقص واحد ؛ NK = قاتل طبيعي ؛ PMN = الكريات البيض متعددة الأشكال النووية. DC = خلية متغصنة ؛ TCR = مستقبلات الخلايا التائية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
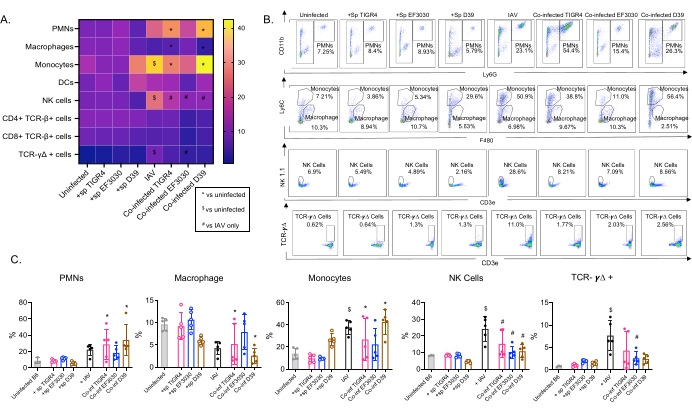
الشكل 4: تعتمد الاستجابات المناعية الرئوية على السلالة البكتيرية. كانت الفئران الشابة (10-12 أسبوعا) C57BL / 6 إما غير مصابة ، أو ملقحة منفردة بسلالة العقدية الرئوية المشار إليها (+ sp) ، أو تم تحديها بشكل فردي مع IAV (IAV) ، أو مصابة بعدوى S. pneumoniae و IAV (Co-inf). بعد ثمان وأربعين ساعة من الإصابة ب IAV (انظر التصميم التجريبي في الشكل 1) ، تم حصاد الرئتين ، وتم تحديد تدفق الخلايا المناعية عن طريق قياس التدفق الخلوي باتباع استراتيجية البوابة في الشكل 3. (أ) يتم عرض متوسط النسب المئوية لكل نوع خلية محدد داخل بوابة CD45 لجميع مجموعات المعالجة على الخريطة الحرارية. (ب) تظهر مخططات نقطية تمثيلية لأنواع الخلايا التي أظهرت اختلافات كبيرة بين المعالجات لكل مجموعة فأر. (ج) النسب المئوية لأنواع الخلايا المناعية المشار إليها. كل دائرة تتوافق مع ماوس واحد. (أ، ج) يتم عرض البيانات المجمعة من n = 5 فئران لكل مجموعة. * ، يشير إلى وجود فرق كبير (p < 0.05) بين Co-inf وغير المصاب ؛ $ ، يشير إلى وجود أهمية كبيرة بين IAV وغير المصابين ؛ # ، يشير إلى وجود فرق كبير بين Co-inf و IAV وحدهما. تم تحديد فروق ذات دلالة إحصائية بين مجموعات التحدي لكل نوع من الخلايا بواسطة ANOVA متبوعا باختبار Tukey. الاختصارات: NK = قاتل طبيعي ؛ PMN = الكريات البيض متعددة الأشكال النووية. DC = خلية متغصنة ؛ TCR = مستقبلات الخلايا التائية ؛ IAV = فيروس الأنفلونزا أ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
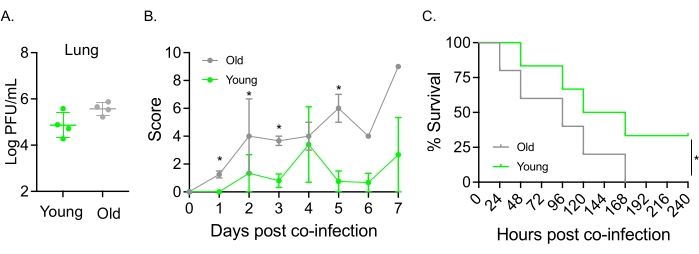
الشكل 5: الشيخوخة وزيادة قابلية المضيف للإصابة بالعدوى المشتركة ل IAV / العقدية الرئوية . الشباب (10-12 أسبوعا) والذين تتراوح أعمارهم بين (21-22 شهرا) C57BL / 6 الفئران الذكور أصيبوا بعدوى S. pneumoniae TIGR4 i.n. و IAV i.n. و i.t. (كما في الشكل 1) أو تم تحديهم بشكل فردي مع IAV وحده. (أ) تم تحديد التتر الفيروسي بعد 48 ساعة. تشير العلامات النجمية إلى دلالة إحصائية (p < 0.05) كما يحددها اختبار t للطالب. يتم تجميع البيانات من n = 4 الفئران لكل مجموعة. (ب) تمت مراقبة النتيجة السريرية و (ج) البقاء على قيد الحياة بمرور الوقت. (ب) يتم عرض متوسط ± SEM المجمعة من n = 6 فئران لكل مجموعة. تشير العلامات النجمية إلى دلالة إحصائية (p < 0.05) بين الفئران الصغيرة مقابل الفئران القديمة في النقطة الزمنية المشار إليها على النحو المحدد في اختبار Mann-Whitney. (ج) يتم تجميع البيانات من n = 6 فئران لكل مجموعة. تشير العلامات النجمية إلى دلالة إحصائية (p < 0.05) بين الفئران الصغيرة مقابل الفئران القديمة كما هو محدد في اختبار رتبة اللوغاريتم (Mantel-Cox). الاختصارات: IAV = فيروس الأنفلونزا A ؛ i.n. = داخل الأنف ؛ i.t. = داخل القصبة الهوائية ؛ SEM = خطأ قياسي للمتوسط. أعيد طبع الشكل 5 أ بإذن من Joma et al.23. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مزيج أنا الأسهم لآلية التنمية النظيفة | |
| الادنين | 0.1 غرام |
| د-ألانين | 0.25 غ |
| CaCl2 اللامائي | 0.025 جرام |
| كبريتات المنغنيز | 0.03 غ |
| سيانوكوبالامين | 100 ميكرولتر من مخزون 10 ملغم/مل |
| حمض بارا أمينوبنزويك | 400 ميكرولتر من مخزون 5 ملغم/مل |
| بيريدوكسامين 2HCl | 100 ميكرولتر من مخزون 10 ملغم/مل |
| مخزون المزيج الثاني لآلية التنمية النظيفة | |
| جوانين | 0.05 غ |
| يوراسيل | 0.05 غ |
| مخزون المزيج الثالث لآلية التنمية النظيفة | |
| نترات الحديديك 9H2O | 50 ملغ/مل |
| كبريتات الحديديك 7H2O | 10 ملغم/مل |
| مزيج المخزون الرابع لآلية التنمية النظيفة | |
| بيتا نيكوتيناميد الأدينين ثنائي النوكليوتيد | 25 ملغم/مل |
الجدول 1: المخزونات المختلطة الأول والثاني والثالث والرابع لآلية التنمية النظيفة. الاختصار: CDM = وسائط محددة كيميائيا.
| فيتامين ميكس الأسهم لآلية التنمية النظيفة | |
| بيريدوكسال هيدروكلوريد | 0.8 غ |
| الثيامين Cl2 | 0.4 غ |
| الريبوفلافين | 0.4 غ |
| كا-بانتوثينات | 0.4 غ |
| البيوتين | 0.04 غ |
| حمض الفوليك | 0.4 غ |
| نياكيناميدي | 0.4 غ |
الجدول 2: مخزون مزيج الفيتامينات لآلية التنمية النظيفة. الاختصار: CDM = وسائط محددة كيميائيا.
| مخزون الأحماض الأمينية لآلية التنمية النظيفة | |
| إل-ألانين | 0.480 غ |
| إل-أرجينين | 0.250 غ |
| L- الهليون | 0.700 غ |
| حمض الأسبارتيك | 0.600 غ |
| ل-سيستين | 1.000 جرام |
| ل-سيستين | 0.100 غ |
| حمض الجلوتاميك | 0.200 غ |
| إل-جلوتامين | 0.780 جرام |
| إل-جلايسين | 0.350 غ |
| إل-هستيدين | 0.300 غ |
| إل-آيسولوسين | 0.430 غ |
| ل-ليوسين | 0.950 غ |
| ل-ليسين | 0.880 جرام |
| إل-ميثيونين | 0.250 غ |
| إل-فينيل ألانين | 0.550 غ |
| إل-برولين | 1.350 غ |
| ل-سيرين | 0.680 جرام |
| ل-ثريونين | 0.450 غ |
| إل-تريبتوفان | 0.100 غ |
| إل-فالين | 0.650 غ |
الجدول 3: مخزون الأحماض الأمينية لآلية التنمية النظيفة. الاختصار: CDM = وسائط محددة كيميائيا.
| مخزون المبتدئين لآلية التنمية النظيفة | |
| سكر العنب | 1.0 جرام |
| كبريتات المغنيسيوم-7-هيدرات | 0.070 غ |
| فوسفات البوتاسيوم ثنائي القاعدة | 0.02 غ |
| فوسفات البوتاسيوم أحادي القاعدة | 0.1 غرام |
| خلات الصوديوم اللامائية | 0.45 غ |
| بيكربونات الصوديوم | 0.25 غ |
| فوسفات الصوديوم ثنائي القاعدة | 0.735 جرام |
| فوسفات الصوديوم أحادي القاعدة | 0.32 غ |
| المكملات النهائية لآلية التنمية النظيفة | |
| كلوريد الكولين | 0.1 غرام |
| L- السيستين حمض الهيدروكلوريك | 0.075 جرام |
| بيكربونات الصوديوم | 0.25 غ |
الجدول 4: مخزون المبتدئين والملاحق النهائية لآلية التنمية النظيفة. الاختصار: CDM = وسائط محددة كيميائيا.
| الأجسام المضادة / الفلوروفور | استنساخ | عامل التخفيف |
| L / D لإثارة الأشعة فوق البنفسجية | غير متوفر | 0.38888889 |
| Ly6G AF 488 | 1 أ 8 | 0.25 |
| CD11b APC | م1/70 | 0.25 |
| CD11c PE | إن 418 | 0.18055556 |
| كتلة الماوس Fc | 2.4 جرام 2 | 0.11111111 |
| F4 / 80 PE Cy7 | بي إم 8 | 0.18055556 |
| Ly6C BV605 | ال-21 | 0.25 |
| CD103 BV 421 | م290 | 0.18055556 |
| CD45 APC-eF-780 | 30-F11 | 0.18055556 |
الجدول 5: لوحة الأجسام المضادة 1.
| الأجسام المضادة / الفلوروفور | استنساخ | عامل التخفيف |
| L / D لإثارة الأشعة فوق البنفسجية | غير متوفر | 0.388888889 |
| TCR-β APC Cy7 | ح57-597 | 0.180555556 |
| CD4 V450 (أزرق المحيط الهادئ) | RM4-5 | 0.25 |
| CD8 BV650 | 53-6.7 | 0.180555556 |
| كتلة الماوس Fc | 2.4 جرام 2 | 0.111111111 |
| CD45 PE | 30-F11 | 0.180555556 |
| CD3 AF488 | 145-2 ج11 | 0.180555556 |
| TCR- γΔ APC | جي ال -3 | 0.180555556 |
| NK1.1 AF 700 | PK136 | 0.180555556 |
الجدول 6: لوحة الأجسام المضادة 2.
Discussion
تعتمد معظم الدراسات التجريبية الحالية للعدوى المشتركة للمكورات الرئوية / IAV على توصيل البكتيريا إلى رئتي الفئران المصابة مسبقا ب IAV. ساعدت هذه النماذج في تحديد التغيرات في البيئة الرئوية والاستجابة المناعية الجهازية التي تجعل المضيف عرضة للعدوى البكتيرية الثانوية 15،16،17،32،33،34،35،36،37. ومع ذلك ، فشلت هذه النماذج في محاكاة انتقال S. pneumoniae من مستعمر بدون أعراض إلى ممرض قادر على التسبب في التهابات رئوية وجهازية خطيرة. علاوة على ذلك ، فإن هذه النماذج ليست مناسبة لدراسة العوامل المضيفة والتفاعلات بين المضيف والممرض في الجهاز التنفسي العلوي التي تساهم في التعرض للعدوى. اعتمد نموذج سابق لحركة المكورات الرئوية من البلعوم الأنفي إلى الرئة بعد عدوى IAV على العدوى البكتيرية للبلعوم الأنفي تليها العدوى الفيروسية. ومع ذلك ، فقد فشل في إعادة إنتاج العلامات الشديدة للمرض التي لوحظت في المرضى من البشر21. يلخص نموذج عدوى الفئران المعدل الموصوف هنا انتقال العقدية الرئوية من النقل بدون أعراض إلى ممرض يسبب مرضا سريريا شديدا.
الخطوة الحاسمة في هذا النموذج هي إنشاء عدوى S. الرئوية في البلعوم الأنفي. العقدية الرئوية تشكل الأغشية الحيوية وتستعمر البلعوم الأنفي بكفاءات مختلفة21,38. لإثبات العدوى المتسقة ، يلزم ما لا يقل عن 5 × 106 CFU من السلالات البكتيرية المزروعة بالأغشية الحيوية التي تم اختبارها حتى الآن23. يوصى باختبار أي سلالة بكتيرية جديدة بحثا عن عدوى مستقرة بالبلعوم الأنفي قبل الإصابة بالعدوى الفيروسية. بالنسبة للعدوى الفيروسية المشتركة ، وجدت الدراسات السابقة أن العدوى عن طريق الأنف مع IAV مطلوبة لتشتت البكتيريا من البلعوم الأنفي21،22،23. في تلك الدراسات السابقة ، تم استخدام 500 PFU من IAV للتسليم عن طريق الأنف ، بينما في هذه الدراسة ، كان 200 PFU كافيا لزيادة أعداد البكتيريا في البلعوم الأنفي. لا تقتصر عدوى IAV على الشعب الهوائية العليا ويمكن أن تنتشر إلى الرئتين39,40 ، وهو أمر أساسي لجعل البيئة الرئوية أكثر تساهلا للعدوى البكتيرية15,16,41. يمكن تحقيق توصيل IAV إلى الرئتين إما عن طريق التوصيل عن طريق الأنف أو التركيب داخل القصبة الهوائية للفئران المخدرة. وجد العمل السابق مع الفئران BALB / cByJ أن الولادة عن طريق الأنف تؤدي إلى الالتهاب الرئوي الفيروسي21; ومع ذلك ، فإن وصول اللقاح إلى الرئتين بعد التلقيح عن طريق الأنف يكون أكثر تقييدا في الفئران C57BL / 6. في الفئران C57BL / 6 ، يلزم التثبيت داخل القصبة الهوائية للتوصيل المتسق للفيروس23. في هذا النموذج ، يسرع الاستعمار البكتيري السابق من ظهور أعراض المرض بعد العدوى الفيروسية23. نظرا لأن العدوى الفيروسية نفسها يمكن أن تسبب أعراضا مرضية مع اختلاف محتمل في الحركية ، فمن المستحسن أولا اختبار مجموعة من الجرعات لأي سلالة فيروسية جديدة تم اختبارها واختيار جرعة تكشف عن الحركية المتسارعة في المضيفين المصابين بعدوى مشتركة.
توفر الرئتان قراءة مهمة أخرى لتقييم المرض في هذا النموذج. لتقييم عبء مسببات الأمراض وتدفق الخلايا المناعية ، يمكن استخدام رئة من نفس الفأر. ومع ذلك ، نظرا لأن شدة العدوى والالتهاب يمكن أن تختلف بين الفصوص ، فمن المستحسن عدم أخذ فصوص مختلفة من نفس الرئة لإجراء التقييمات المختلفة. بدلا من ذلك ، يمكن فرم جميع الفصوص إلى قطع صغيرة ، وخلطها جيدا معا ، ثم تحليلها بالتساوي للتقييمات المختلفة. وبالمثل ، يمكن استخدام البلعوم الأنفي لتعداد CFU البكتيري أو PFU الفيروسي والاستجابة المناعية. ومع ذلك ، فإن عدد الخلايا التي تم الحصول عليها من الغسلات والأنسجة منخفض جدا لإجراء قياس التدفق الخلوي دون تجميع العينات من الفئران داخل نفس المجموعة. بدلا من ذلك ، يمكن تقييم الالتهاب في البلعوم الأنفي نسيجيا23.
من السمات الحاسمة لهذا النموذج أنه يلخص المرض السريري الذي يظهر في المرضى. في البشر ، غالبا ما يؤدي الالتهاب الرئوي الثانوي بالمكورات الرئوية بعد عدوى IAV إلى علامات واضحة للمرض ، بما في ذلك السعال وضيق التنفس والحمى وآلام العضلات التي يمكن أن تؤدي إلى دخول المستشفى وفشل الجهاز التنفسي وحتى الوفاة8،15،42،43. يلخص هذا النموذج العلامات الشديدة للأمراض السريرية التي لوحظت في البشر من حيث صعوبة التنفس (تنعكس في درجة التنفس) والشعور بالضيق العام (ينعكس في درجات الموقف والحركة) التي أظهرتها الفئران ، وكذلك الموت في بعض الضوابط الشابة الأصحاء. من المحتمل أن تكون أعراض المرض المتفاقمة في الفئران المصابة بعدوى مشتركة نتيجة لكل من انتشار البكتيريا إلى الرئتين وضعف التصفية الفيروسية في الفئران مع نقل المكورات الرئوية23. يتمثل أحد قيود النموذج في أن حدوث المرض السريري وانتشار البكتيريا من البلعوم الأنفي يختلف بين الفئران ويتأثر بالسلالة البكتيرية وعمر المضيف والنمط الجيني21،22،23. مما يعكس ذلك ، بالنسبة للسلالات الغازية ، يمكن أن يحدث التقدم من العدوى الموضعية (مع عدم وجود تجرثم الدم القابل للاكتشاف) إلى الموت في غضون 24 ساعة. لذلك ، من أجل تقييم حقيقي للانتشار الجهازي ، يجب متابعة تجرثم الدم على فترات أقصر (كل 6-12 ساعة). وبالمثل ، يمكن أن تتغير درجة المرض بسرعة ، لا سيما في أول 72 ساعة بعد الإصابة المشتركة. لذلك ، لتتبع أعراض المرض عن كثب ، ينصح بمراقبة الفئران ثلاث مرات يوميا لمدة 1-3 أيام بعد الإصابة ب IAV.
باختصار ، يكرر هذا النموذج حركة S. pneumoniae من مستعمر بدون أعراض للبلعوم الأنفي إلى ممرض قادر على التسبب في مرض رئوي وجهازي عند الإصابة بعدوى IAV. في هذا النموذج ، يؤدي IAV إلى انتقال S. pneumoniae عن طريق تعديل السلوك البكتيري في البلعوم الأنفي ، وزيادة انتشار البكتيريا إلى الرئة ، وتغيير المناعة المضادة للبكتيريا23. وبالمثل ، فإن النقل البكتيري يضعف الاستجابات المناعية المضادة للفيروسات ويضعف إزالة IAV من الرئتين23. هذا يجعل هذا النموذج مثاليا لتحليل التغيرات في الاستجابات المناعية في العدوى الفردية مقابل العدوى متعددة الميكروبات. بالإضافة إلى ذلك ، فإن مسار المرض بعد العدوى المشتركة يعتمد ، جزئيا ، على سلالة المكورات الرئوية الموجودة في البلعوم الأنفي. لذلك ، فإن النموذج مناسب لتشريح العوامل البكتيرية المطلوبة للاستعمار بدون أعراض مقابل الانتقال الممرض للمكورات العنقودية الرئوية. أخيرا ، يعيد هذا النموذج إنتاج قابلية الشيخوخة للعدوى المشتركة ، وعلى الرغم من أن هذا لم يتم اختباره هنا ، إلا أنه يمكن استخدامه بسهولة لتقييم تأثير خلفية المضيف على مسار المرض. في الختام ، يوفر فصل النقل والمرض إلى خطوات متميزة الفرصة لتحليل المتغيرات الجينية لكل من مسببات الأمراض والمضيف ، مما يسمح بالفحص التفصيلي لتفاعلات المرض المهم مع المضيف في مراحل مختلفة من تطور المرض. من الآن فصاعدا ، يمكن استخدام هذا النموذج لتخصيص خيارات العلاج للمضيفين المعرضين للخطر.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
نود أن نشكر لينهارد على القراءة النقدية وتحرير هذه المخطوطة. نود أيضا أن نشكر أندرو كاميلي وأنتوني كامباجناري على السلالات البكتيرية وبروس ديفيدسون على السلالات الفيروسية. تم دعم هذا العمل من قبل منحة المعهد الوطني للصحة (R21AG071268-01) إلى JL ومنح المعهد الوطني للصحة (R21AI145370-01A1) ، (R01AG068568-01A1) ، (R21AG071268-01) إلى E.N.B.G.
Materials
| Name | Company | Catalog Number | Comments |
| 4-Aminobenzoic acid | Fisher | AAA1267318 | Mix I stock |
| 96-well round bottom plates | Greiner Bio-One | 650101 | |
| 100 µm Filters | Fisher | 07-201-432 | |
| Adenine | Fisher | AC147440250 | Mix I stock |
| Avicel | Fisher | 501785325 | Microcyrstalline cellulose |
| BD Cytofix Fixation Buffer | Fisher | BDB554655 | Fixation Buffer |
| BD Fortessa | Flow cytometer | ||
| BD Intramedic Polyethylene Tubing | Fisher | 427410 | Tubing for nasal lavage |
| BD Disposable Syringes with Luer-Lok Tips (1 mL) | Fisher | 14-823-30 | |
| BD Microtainer Capillary Blood Collector and BD Microgard Closure | Fisher | 02-675-185 | Blood collection tubes |
| Beta-Nicotinamide adenine dinucleotide | Fisher | AAJ6233703 | Mix IV stock |
| Biotin | Fisher | AC230090010 | Vitamin stock |
| C57BL/6J mice | The Jackson Laboratory | #000644 | Mice used in this study |
| Calcium Chloride Anhydrous | Fisher Chemical | C77-500 | Mix I stock |
| CD103 BV 421 | BD Bioscience | BDB562771 | Clone: M290 DF 1:200 |
| CD11b APC | Invitrogen | 50-112-9622 | Clone: M1/70, DF 1:300 |
| CD11c PE | BD Bioscience | BDB565592 | Clone: N418 DF 1:200 |
| CD3 AF 488 | BD Bioscience | OB153030 | Clone: 145-2C11 DF 1:200 |
| CD4 V450 | BD Horizon | BDB560470 | Clone: RM4.5 DF 1:300 |
| CD45 APC eF-780 | BD Bioscience | 50-112-9642 | Clone: 30-F11 DF 1:200 |
| CD45 PE | Invitrogen | 50-103-70 | Clone: 30-F11 DF 1:200 |
| CD8α BV 650 | BD Horizon | BDB563234 | Clone: 53-6.7 DF 1:200 |
| Choline chloride | Fisher | AC110290500 | Final supplement to CDM |
| Corning Disposable Vacuum Filter/Storage Systems | Fisher | 09-761-107 | Filter sterilzation apparatus |
| Corning Tissue Culture Treated T-25 Flasks | Fisher | 10-126-9 | |
| Corning Costar Clear Multiple Well Plates | Fisher | 07-201-590 | |
| Corning DMEM With L-Glutamine and 4.5 g/L Glucose; Without Sodium Pyruvate | Fisher | MT10017CM | |
| Cyanocobalamin | Fisher | AC405925000 | Mix I stock |
| D39 | National Collection of Type Culture (NCTC) | NCTC 7466 | Streptococcus pneumoniae strain |
| D-Alanine | Fisher | AAA1023114 | Mix I stock |
| D-Calcium pantothenate | Fisher | AC243301000 | Vitamin stock |
| Dextrose | Fisher Chemical | D16-500 | Starter stock |
| Dnase | Worthington Biochemical | LS002147 | |
| Eagles Minimum Essential Medium | ATCC | 30-2003 | |
| EDTA | VWR | BDH4616-500G | |
| EF3030 | Center for Disease Control and Prevention | Available via the isolate bank request | Streptococcus pneumoniae strain, request using strain name |
| F480 PE Cy7 | BD Bioscience | 50-112-9713 | Clone: BMB DF 1:200 |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | 50 mL round bottom tube |
| Falcon Round-Bottom Polypropylene Test Tubes With Cap | Fisher | 14-959-11B | 15 mL round bottom tube |
| Falcon Round-Bottom Polystyrene Test Tubes (5 mL) | Fisher | 14-959-5 | FACS tubes |
| FBS | Thermofisher | 10437-028 | |
| Ferric Nitrate Nonahydrate | Fisher | I110-100 | Mix III stock |
| Fisherbrand Delicate Dissecting Scissors | Fisher | 08-951-5 | Instruments used for harvest |
| Fisherbrand Disposable Inoculating Loops | Fisher | 22-363-602 | Inoculating loops |
| Fisherbrand Dissecting Tissue Forceps | Fisher | 13-812-38 | Forceps for harvest |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5 mL | Fisher | 05-408-137 | Micocentrifuge tubes |
| Fisherbrand Sterile Syringes for Single Use (10 mL) | Fisher | 14-955-459 | |
| Folic Acid | Fisher | AC216630500 | Vitamin stock |
| Gibco RPMI 1640 (ATCC) | Fisher | A1049101 | |
| Gibco DPBS, no calcium, no magnesium | Fisher | 14190250 | |
| Gibco HBSS, calcium, magnesium, no phenol red | Fisher | 14025134 | |
| Gibco MEM (Temin's modification) (2x), no phenol red | Fisher | 11-935-046 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher | 15-140-122 | |
| Gibco Trypan Blue Solution, 0.4% | Fisher | 15-250-061 | |
| Gibco Trypsin-EDTA (0.25%), phenol red | Fisher | 25-200-056 | |
| Glycerol (Certified ACS) | Fisher | G33-4 | |
| Glycine | Fisher | AA3643530 | Amino acid stock |
| Guanine | Fisher | AAA1202414 | Mix II stock |
| Invitrogen UltraComp eBeads Compensation Beads | Fisher | 50-112-9040 | |
| Iron (II) sulfate heptahydrate | Fisher | AAA1517836 | Mix III stock |
| L-Alanine | Fisher | AAJ6027918 | Amino acid stock |
| L-Arginine | Fisher | AAA1573814 | Amino acid stock |
| L-Asparagine | Fisher | AAB2147322 | Amino acid stock |
| L-Aspartic acid | Fisher | AAA1352022 | Amino acid stock |
| L-Cysteine | Fisher | AAA1043518 | Amino acid stock |
| L-Cysteine hydrochloride monohydrate | Fisher | AAA1038914 | Final supplement to CDM |
| L-Cystine | Fisher | AAA1376218 | Amino acid stock |
| L-Glutamic acid | Fisher | AC156211000 | Amino acid stock |
| L-Glutamine | Fisher | O2956-100 | Amino acid stock |
| L-Histidine | Fisher | AC166150250 | Amino acid stock |
| LIFE TECHNOLOGIES LIVE/DEAD Fixable Blue Dead Cell Stain Kit, for UV excitation | Invitrogen | 50-112-1524 | Clone: N/A DF 1:500 |
| L-Isoleucine | Fisher | AC166170250 | Amino acid stock |
| L-Leucine | Fisher | BP385-100 | Amino acid stock |
| L-Lysine | Fisher | AAJ6222514 | Amino acid stock |
| L-Methionine | Fisher | AAA1031822 | Amino acid stock |
| Low endotoxin BSA | Sigma Aldrich | A1470-10G | |
| L-Phenylalanine | Fisher | AAA1323814 | Amino acid stock |
| L-Proline | Fisher | AAA1019922 | Amino acid stock |
| L-Serine | Fisher | AC132660250 | Amino acid stock |
| L-Threonine | Fisher | AC138930250 | Amino acid stock |
| L-Tryptophan | Fisher | AAA1023014 | Amino acid stock |
| L-Valine | Fisher | AAA1272014 | Amino acid stock |
| Ly6C BV 605 | BD Bioscience | BDB563011 | Clone: AL-21 DF 1:300 |
| Ly6G AF 488 | Biolegend | NC1102120 | Clone: IA8, DF 1:300 |
| Madin-Darby Canine Kidney (MDCK) cells | American Type Culture Collection (ATCC) | CCL-34 | MDCK cell line for PFU analuysis |
| Magnesium Sulfate 7-Hydrate | Fisher | 60-019-68 | CDM starter stock |
| Manganese Sulfate | Fisher | M113-500 | Mix I stock |
| MilQ water | Ultra-pure water | ||
| Mouse Fc Block | BD Bioscience | BDB553142 | Clone: 2.4G2 DF 1:100 |
| MWI VETERINARY PURALUBE VET OINTMENT | Fisher | NC1886507 | Eye lubricant for infection |
| NCI-H292 mucoepidermoid carcinoma cell line | ATCC | CRL-1848 | H292 lung epithelial cell line for biofilm growth |
| Niacinamide | Fisher | 18-604-792 | Vitamin stock |
| NK 1.1 AF 700 | BD Bioscience | 50-112-4692 | Clone: PK136 DF 1:200 |
| Oxyrase For Broth 50Ml Bottle 1/Pk | Fisher | 50-200-5299 | To remove oxygen from liquid cultures |
| Paraformaldehyde 4% in PBS | Thermoscientific | J19932-K2 | |
| Pivetal Isoflurane | Patterson Veterinary | 07-893-8440 | Isoflurane for anesthesia during infection |
| Potassium Phosphate Dibasic | Fisher Chemical | P288-500 | Starter stock |
| Potassium Phosphate Monobasic | Fisher Chemical | P285-500 | Starter stock |
| Pyridoxal hydrochloride | Fisher | AC352710250 | Vitamin stock |
| Pyridoxamine dihydrochloride | Fisher | AAJ6267906 | Mix I stock |
| Riboflavin | Fisher | AC132350250 | Vitamin stock |
| Sodium Acetate | VWR | 0530-500G | Starter stock |
| Sodium Azide | Fisher Bioreagents | BP922I-500 | For FACS buffer |
| Sodium Bicarbonate | Fisher Chemical | S233-500 | Starter stock and final supplement to CDM |
| Sodium Phosphate Dibasic | Fisher Chemical | S374-500 | Starter stock |
| Sodium Phosphate Monobasic | Fisher Chemical | S369-500 | Starter stock |
| TCR APC | BD Bioscience | 50-112-8889 | Clone: GL-3 DF 1:200 |
| TCRβ APC-Cy7 | BD Pharmigen | BDB560656 | Clone: H57-597 DF 1:200 |
| Thermo Scientific Blood Agar with Gentamicin | Fisher | R01227 | Blood agar plates with the antibiotic gentamicin |
| Thermo Scientific Trypsin, TPCK Treated | Fisher | PI20233 | |
| Thiamine hydrochloride | Fisher | AC148991000 | Vitamin stock |
| TIGR4 | ATCC | BAA-334 | Streptococcus pneumoniae strain |
| Uracil | Fisher | AC157300250 | Mix II stock |
| Worthington Biochemical Corporation Collagenase, Type 2, 1 g | Fisher | NC9693955 |
References
- Kadioglu, A., Weiser, J. N., Paton, J. C., Andrew, P. W. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nature Reviews Microbiology. 6 (4), 288-301 (2008).
- Obaro, S., Adegbola, R. The pneumococcus: Carriage, disease and conjugate vaccines. Journal of Medical Microbiology. 51 (2), 98-104 (2002).
- Chong, C. P., Street, P. R. Pneumonia in the elderly: A review of the epidemiology, pathogenesis, microbiology, and clinical features. Southern Medical Journal. 101 (11), 1141-1145 (2008).
- Kadioglu, A., Andrew, P. W. Susceptibility and resistance to pneumococcal disease in mice. Briefings in Functional Genomics and Proteomics. 4 (3), 241-247 (2005).
- Ganie, F., et al. Structural, genetic, and serological elucidation of Streptococcus pneumoniae serogroup 24 serotypes: Discovery of a new serotype, 24C, with a variable capsule structure. Journal of Clinical Microbiology. 59 (7), 0054021 (2021).
- Centers for Disease Control and Prevention. Estimates of deaths associated with seasonal influenza --- United States. MMWR. Morbidity and Mortality Weekly Report. 59 (33), 1057-1062 (2010).
- Shrestha, S., et al. Identifying the interaction between influenza and pneumococcal pneumonia using incidence data. Science Translational Medicine. 5 (191), (2013).
- McCullers, J. A. Insights into the interaction between influenza virus and pneumococcus. Clinical Microbiology Reviews. 19 (3), 571-582 (2006).
- Pneumococcal Disease Global Pneumococcal Disease and Vaccine. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/pneumococcal/global.html (2018)
- Grudzinska, F. S., et al. Neutrophils in community-acquired pneumonia: Parallels in dysfunction at the extremes of age. Thorax. 75 (2), 164-171 (2020).
- Boe, D. M., Boule, L. A., Kovacs, E. J. Innate immune responses in the ageing lung. Clinical and Experimental Immunology. 187 (1), 16-25 (2017).
- Krone, C. L., van de Groep, K., Trzcinski, K., Sanders, E. A., Bogaert, D. Immunosenescence and pneumococcal disease: An imbalance in host-pathogen interactions. The Lancet Respiratory Medicine. 2 (2), 141-153 (2014).
- Cho, S. J., et al. Decreased NLRP3 inflammasome expression in aged lung may contribute to increased susceptibility to secondary Streptococcus pneumoniae infection. Experimental Gerontology. 105, 40-46 (2018).
- Disease Burden of Influenza. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/flu/about/burden/index.html (2018)
- McCullers, J. A. The co-pathogenesis of influenza viruses with bacteria in the lung. Nature Reviews Microbiology. 12 (4), 252-262 (2014).
- McCullers, J. A., Rehg, J. E. Lethal synergism between influenza virus and Streptococcus pneumoniae: Characterization of a mouse model and the role of platelet-activating factor receptor. The Journal of Infectious Diseases. 186 (3), 341-350 (2002).
- Metzger, D. W., Sun, K. Immune dysfunction and bacterial coinfections following influenza. Journal of Immunology. 191 (5), 2047-2052 (2013).
- Chao, Y., Marks, L. R., Pettigrew, M. M., Hakansson, A. P. Streptococcus pneumoniae biofilm formation and dispersion during colonization and disease. Frontiers in Cellular and Infection Microbiology. 4, 194 (2014).
- Bogaert, D., De Groot, R., Hermans, P. W. Streptococcus pneumoniae colonisation: The key to pneumococcal disease. The Lancet Infectious Diseases. 4 (3), 144-154 (2004).
- Simell, B., et al. The fundamental link between pneumococcal carriage and disease. Expert Review of Vaccines. 11 (7), 841-855 (2012).
- Marks, L. R., Davidson, B. A., Knight, P. R., Hakansson, A. P. Interkingdom signaling induces Streptococcus pneumoniae biofilm dispersion and transition from asymptomatic colonization to disease. mBio. 4 (4), 00438 (2013).
- Reddinger, R. M., Luke-Marshall, N. R., Sauberan, S. L., Hakansson, A. P., Campagnari, A. A. Streptococcus pneumoniae modulates Staphylococcus aureus biofilm dispersion and the transition from colonization to invasive disease. mBio. 9 (1), 02089 (2018).
- Joma, B. H., et al. A murine model for enhancement of Streptococcus pneumoniae pathogenicity upon viral infection and advanced age. Infection and Immunity. 89 (8), 0047120 (2021).
- Andersson, B., et al. Identification of an active disaccharide unit of a glycoconjugate receptor for pneumococci attaching to human pharyngeal epithelial cells. Journal of Experimental Medicine. 158 (2), 559-570 (1983).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. The Journal of Experimental Medicine. 79 (2), 137-158 (1944).
- Tettelin, H., et al. Complete genome sequence of a virulent isolate of Streptococcus pneumoniae. Science. 293 (5529), 498-506 (2001).
- Tothpal, A., Desobry, K., Joshi, S. S., Wyllie, A. L., Weinberger, D. M. Variation of growth characteristics of pneumococcus with environmental conditions. BMC Microbiology. 19 (1), 304 (2019).
- Bou Ghanem, E. N., et al. Extracellular adenosine protects against Streptococcus pneumoniae lung infection by regulating pulmonary neutrophil recruitment. PLoS Pathogens. 11 (8), 1005126 (2015).
- Bou Ghanem, E. N., et al. The alpha-tocopherol form of vitamin E boosts elastase activity of human PMNs and their ability to kill Streptococcus pneumoniae. Frontiers in Cellular and Infection Microbiology. 7, 161 (2017).
- Tait, A. R., Davidson, B. A., Johnson, K. J., Remick, D. G., Knight, P. R. Halothane inhibits the intraalveolar recruitment of neutrophils, lymphocytes, and macrophages in response to influenza virus infection in mice. Anesthesia & Analgesia. 76 (5), 1106-1113 (1993).
- Aaberge, I. S., Eng, J., Lermark, G., Lovik, M. Virulence of Streptococcus pneumoniae in mice: A standardized method for preparation and frozen storage of the experimental bacterial inoculum. Microbial Pathogenesis. 18 (2), 141-152 (1995).
- McCullers, J. A., Bartmess, K. C. Role of neuraminidase in lethal synergism between influenza virus and Streptococcus pneumoniae. The Journal of Infectious Diseases. 187 (6), 1000-1009 (2003).
- Smith, A. M., McCullers, J. A. Secondary bacterial infections in influenza virus infection pathogenesis. Current Topics in Microbiology and Immunology. 385, 327-356 (2014).
- Cundell, D. R., Gerard, N. P., Gerard, C., Idanpaan-Heikkila, I., Tuomanen, E. I. Streptococcus pneumoniae anchor to activated human cells by the receptor for platelet-activating factor. Nature. 377 (6548), 435-438 (1995).
- Ballinger, M. N., Standiford, T. J. Postinfluenza bacterial pneumonia: Host defenses gone awry. Journal of Interferon & Cytokine Research. 30 (9), 643-652 (2010).
- Sun, K., Metzger, D. W. Inhibition of pulmonary antibacterial defense by interferon-gamma during recovery from influenza infection. Nature Medicine. 14 (5), 558-564 (2008).
- Nakamura, S., Davis, K. M., Weiser, J. N. Synergistic stimulation of type I interferons during influenza virus coinfection promotes Streptococcus pneumoniae colonization in mice. Journal of Clinical Investigation. 121 (9), 3657-3665 (2011).
- Blanchette-Cain, K., et al. Streptococcus pneumoniae biofilm formation is strain dependent, multifactorial, and associated with reduced invasiveness and immunoreactivity during colonization. mBio. 4 (5), 00745 (2013).
- Rello, J., Pop-Vicas, A. Clinical review: Primary influenza viral pneumonia. Critical Care. 13 (6), 235 (2009).
- Torres, A., Loeches, I. M., Sligl, W., Lee, N. Severe flu management: A point of view. Intensive Care Medicine. 46 (2), 153-162 (2020).
- Bakaletz, L. O. Viral-bacterial co-infections in the respiratory tract. Current Opinion in Microbiology. 35, 30-35 (2017).
- Palacios, G., et al. Streptococcus pneumoniae coinfection is correlated with the severity of H1N1 pandemic influenza. PLoS One. 4 (12), 8540 (2009).
- Dhanoa, A., Fang, N. C., Hassan, S. S., Kaniappan, P., Rajasekaram, G. Epidemiology and clinical characteristics of hospitalized patients with pandemic influenza A (H1N1) 2009 infections: The effects of bacterial coinfection. Virology Journal. 8, 501 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved