Method Article
Streptococcus pneumoniae'nin Viral Ko-Enfeksiyon Üzerine Kolonizatörden Patojene Geçişi İçin Bir Fare Modeli, Yaşın Şiddetlendirdiği Hastalıkları Özetler
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu yazıda, viral enfeksiyon sırasında pnömokokların asemptomatik bir kolonizatörden hastalığa neden olan bir patojene geçişi için yeni bir fare modeli açıklanmaktadır. Bu model, hastalık progresyonunun farklı aşamalarında ve çeşitli konakçılarda polimikrobiyal ve konakçı-patojen etkileşimlerini incelemek için kolayca uyarlanabilir.
Özet
Streptococcus pneumoniae (pnömokok), çoğu bireyde nazofarenksin asemptomatik bir kolonizatörüdür, ancak influenza A virüsü (IAV) enfeksiyonu üzerine pulmoner ve sistemik bir patojene ilerleyebilir. İleri yaş, konakçının sekonder pnömokok pnömonisine duyarlılığını arttırır ve kötüleşen hastalık sonuçları ile ilişkilidir. Bu süreçleri yönlendiren konakçı faktörler, kısmen asemptomatik kolonizasyondan ciddi klinik hastalığa geçişi yeniden üreten hayvan modellerinin eksikliği nedeniyle iyi tanımlanmamıştır.
Bu yazıda, viral enfeksiyon üzerine pnömokokların asemptomatik taşıyıcılıktan hastalığa geçişini yeniden yaratan yeni bir fare modeli anlatılmaktadır. Bu modelde, fareler ilk önce asemptomatik taşıyıcılığı sağlamak için biyofilm ile yetiştirilen pnömokoklar ile intranazal olarak aşılanır, ardından hem nazofarenks hem de akciğerlerin IAV enfeksiyonu izlenir. Bu, akciğerlere bakteriyel yayılım, akciğer iltihabı ve ölümcüllüğe ilerleyebilecek belirgin hastalık belirtileri ile sonuçlanır. Hastalığın derecesi bakteri suşu ve konakçı faktörlere bağlıdır.
Önemli olarak, bu model yaşlanmanın duyarlılığını yeniden üretir, çünkü genç farelere kıyasla, yaşlı fareler daha ciddi klinik hastalık gösterir ve hastalığa daha sık yenik düşer. Taşıma ve hastalığı farklı adımlara ayırarak ve hem patojenin hem de konakçının genetik varyantlarını analiz etme fırsatı sağlayarak, bu S. pneumoniae / IAV ko-enfeksiyon modeli, önemli bir patobiyontun konakçı ile etkileşimlerinin hastalık progresyonunun farklı aşamalarında ayrıntılı olarak incelenmesine izin verir. Bu model aynı zamanda duyarlı konakçılarda sekonder pnömokok pnömonisine karşı potansiyel terapötik hedefleri belirlemek için önemli bir araç olarak da hizmet edebilir.
Giriş
Streptococcus pneumoniae (pnömokok), çoğu sağlıklı bireyin nazofarenksinde asemptomatik olarak bulunan Gram-pozitif bakterilerdir 1,2. Tamamen tanımlanmamış faktörler tarafından teşvik edilen pnömokoklar, nazofarenksin iyi huylu kolonizatörlerinden, diğer organlara yayılan patojenlere geçebilir ve bu da otitis media, pnömoni ve bakteriyemi3 dahil olmak üzere ciddi enfeksiyonlara neden olabilir. Pnömokok hastalığı prezentasyonu, kısmen, kapsüler polisakkaritlerin bileşimine dayanan serotip de dahil olmak üzere suşa özgü farklılıklara bağlıdır. Şimdiye kadar karakterize edilen 100'den fazla serotip vardır ve bazıları daha invaziv enfeksiyonlarla ilişkilidir 4,5. Diğer bazı faktörler pnömokok hastalığı riskini arttırır. Böyle bir faktör, pnömokok pnömonisi riskinin IAV 6,7 ile 100 kat arttığı viral enfeksiyondur. Tarihsel olarak, S. pneumoniae, influenza sonrası sekonder bakteriyel pnömoninin en yaygın nedenlerinden biridir ve daha kötü sonuçlarla ilişkilidir8. Bir diğer önemli risk faktörü ileri yaştır. Aslında, S. pneumoniae, 65 yaşın üzerindeki yaşlı bireylerde toplum kökenli bakteriyel pnömoninin önde gelen nedenidir 9,10. Yaşlı bireyler, pnömoni ve influenzaya bağlı ölümlerin çoğunluğunu (% >75) oluşturmaktadır, bu da iki risk faktörünün - yaşlanma ve IAV enfeksiyonu - sinerjik olarak hastalık duyarlılığını kötüleştirdiğini göstermektedir11,12,13,14. Bununla birlikte, viral enfeksiyonun pnömokokların asemptomatik kolonizatörden invaziv patojene geçişini tetiklediği mekanizmalar ve bunun konakçı faktörler tarafından nasıl şekillendirildiği tam olarak tanımlanmamıştır. Bu, büyük ölçüde, asemptomatik pnömokok kolonizasyonundan kritik klinik hastalığa geçişi özetleyen küçük bir hayvan modelinin yokluğundan kaynaklanmaktadır.
Ko-enfeksiyon çalışmaları klasik olarak, influenza enfeksiyonundan 7 gün sonra doğrudan akciğerlere pnömokoklarla aşılanmış farelerde modellenmiştir15,16. Bu, sekonder bakteriyel pnömoniye duyarlılığı yeniden üretir ve antiviral bağışıklık tepkilerinin antibakteriyel savunmayı nasıl bozduğunu incelemek için idealdir17. Bununla birlikte, insanlarda yapılan uzunlamasına çalışmalar, bakterilerin asemptomatik biyofilmler oluşturabildiği nazofarenkste pnömokok taşıyıcılığının18, invaziv hastalıklarla eşit şekilde ilişkili olduğunu göstermiştir19,20. Orta kulak, akciğer ve kan enfeksiyonlarından kaynaklanan bakteriyel izolatlar, nazofarenks20'de bulunanlarla genetik olarak aynıdır. Bu nedenle, IAV enfeksiyonunu takiben asemptomatik taşıyıcılıktan invaziv hastalığa geçişi incelemek için, farelere intranazal olarak biyofilm ile yetiştirilen pnömokokların uygulandığı ve ardından nazofarenksin IAV enfeksiyonunun uygulandığı bir model oluşturulmuştur21,22. Üst solunum yolunun viral enfeksiyonu, konakçı ortamda, pnömokokların biyofilmlerden dağılmasına ve alt solunum yollarına yayılmasına yol açan değişikliklere yol açmıştır21. Bu dağınık bakteriler, enfeksiyon için önemli olan virülans faktörlerinin ekspresyonunu yukarı regüle etmiş, onları kolonizatörlerden patojenlere dönüştürmüştür21. Bu gözlemler, virüs, konakçı ve bakteriler arasındaki karmaşık etkileşimi vurgulamakta ve viral enfeksiyon tarafından tetiklenen konakçıdaki değişikliklerin pnömokok davranışı üzerinde doğrudan bir etkiye sahip olduğunu ve bunun da bakteriyel enfeksiyonun seyrini değiştirdiğini göstermektedir. Bununla birlikte, bu model insanlarda gözlenen ciddi hastalık belirtilerini özetlemekte başarısız olur, çünkü muhtemelen virüs burun boşluğu ile sınırlıdır ve viral enfeksiyonun konakçı bağışıklığı ve akciğer hasarı üzerindeki sistemik etkileri özetlenmemiştir.
Son zamanlarda, konakçı ve patojenler arasındaki karmaşık etkileşimi içeren, aynı zamanda insanlarda gözlenen hastalık şiddetini daha yakından taklit eden bir model oluşturduk23. Bu modelde, fareler ilk önce asemptomatik taşıyıcılık oluşturmak için biyofilm ile yetiştirilen pnömokoklar ile intranazal olarak enfekte edilir, ardından hem nazofarenks hem de akciğerlerin IAV enfeksiyonu izlenir. Bu, akciğerlere bakteriyel yayılım, akciğer iltihabı ve genç farelerin bir kısmında ölümcüllüğe ilerleyen hastalıklarla sonuçlandı23. Bu önceki çalışma, hem viral hem de bakteriyel enfeksiyonun konak savunmasını değiştirdiğini göstermiştir: viral enfeksiyon bakteriyel yayılımı teşvik etti ve önceki bakteriyel kolonizasyon, konağın pulmoner IAV seviyelerini kontrol etme yeteneğini bozdu23. İmmün yanıtın incelenmesi, IAV enfeksiyonunun nötrofillerin antibakteriyel aktivitesini azalttığını, bakteriyel kolonizasyonun ise antiviral savunma için kritik olan tip I interferon yanıtını körelttiğini ortaya koymuştur23. Daha da önemlisi, bu model yaşlanmanın duyarlılığını yeniden üretti. Genç farelerle karşılaştırıldığında, yaşlı fareler daha erken hastalık belirtileri gösterdi, daha ciddi klinik hastalık gösterdi ve enfeksiyona daha sık yenik düştü23. Bu makalede sunulan çalışma, hastalığın derecesinin bakteriyel suşa da bağlı olduğunu göstermektedir, çünkü invaziv pnömokok suşları IAV enfeksiyonu üzerinde daha etkili yayılım gösterir, pulmoner inflamasyonun daha açık belirtilerini gösterir ve invaziv olmayan suşlara kıyasla daha hızlı hastalık oranlarına neden olur. Bu nedenle, bu S. pneumoniae / IAV ko-enfeksiyon modeli, hem patojen hem de konakçı faktörlerin ayrıntılı olarak incelenmesine izin verir ve hastalık progresyonunun farklı aşamalarında polimikrobiyal enfeksiyonlara karşı bağışıklık tepkilerini incelemek için çok uygundur.
Protokol
Tüm hayvan çalışmaları, Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'ndaki önerilere uygun olarak gerçekleştirilmiştir. Tüm prosedürler Buffalo Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır.
1. Kimyasal olarak tanımlanmış ortamın (CDM) hazırlanması
- Stokları aşağıdaki gibi hazırlayın:
- Karıştırırken Tablo 1'de listelenen karışım I bileşiklerini 100 mL ultra saf suda çözün. −20 °C'de 200 μL alikotlarda saklayın.
- Karıştırırken Tablo 1'de listelenen karışım II bileşiklerini 20 mL 0.1 M NaOH'da çözün. −20 °C'de 100 μL alikotta saklayın.
- Karıştırırken Tablo 1'de listelenen karışım III bileşiklerini 1 mL ultra saf suda çözün. 4 °C'de 10 μL aliquots'ta saklayın.
- Karıştırırken Tablo 1'de listelenen karışım IV bileşiğini 1 mL ultra saf suda çözün. −20 °C'de 10 μL alikotta saklayın.
- Karıştırırken Tablo 2'de listelenen bileşikleri başlangıçta 15 mL ultra saf suda çözün. Birkaç damla 0,1 M NaOH ile pH'ı 7,0'a ayarlayın ve ultra saf su kullanarak son hacmi 20 mL'ye ayarlayın. −20 °C'de 1 mL alikotta saklayın.
- Karıştırma sırasında Tablo 3'te listelenen bileşikleri 90 mL ultra saf suda 50 ° C'de bir sıcak plaka üzerinde çözün. PH'ı 0,1 M NaOH ile 7,0'a ayarlayın ve ardından ultra saf su kullanarak son ses seviyesini 100 mL'ye ayarlayın. −20 °C'de 5 mL alikotta saklayın.
- Karıştırırken Tablo 4'teki bileşikleri 70 mL ultra saf suda çözerek marş stoğunu her seferinde taze yapın.
- Taze başlangıç stoğuna aşağıdaki karışım stoklarını sırayla ekleyin: 200 μL Mix I stoğu (Tablo 1), 80 μL Mix II stoğu (Tablo 1), 10 μL Mix III stoğu (Tablo 1), 10 μL Mix IV stoğu (Tablo 2), 1 mL Vitamin stoğu (Tablo 3) ve 5 mL Amino Asit stoğu (Tablo 4).
- Stoklar eklendikten sonra, behere 30 mL ultra saf su ekleyerek son hacmi 100 mL'ye ayarlayın.
- CDM'yi Tablo 4'teki bileşiklerle destekleyin. İyice karıştırıldıktan sonra, filtre sterilize edin ve maksimum 2 hafta boyunca 4 ° C'de saklayın.
2. S. pneumoniae biyofilminin yetiştirilmesi
- RP-10 ortamını, 445 mL RPMI 1640'ı sırasıyla 10.000 U/mL ve 10.000 μg/mL'de 50 mL ısıyla inaktive edilmiş fetal sığır serumu (FBS) ve 5 mL penisilin/streptomisin ile karıştırarak hazırlayın.
- NCI-H292 (H292) mukoepidermoid karsinom hücre hattını büyütün. Satın alınan bir şişedeki hücreleri, T-25 doku kültürü ile muamele edilmiş bir şişede 5 mL RP-10 ortamına ekleyin. %100 birleşmeye ulaşmak için 37 °C/%5 CO2'de 3-5 gün boyunca inkübe edin.
- Akıcılığı değerlendirmek için 10x büyütme kullanarak hücreleri ışık mikroskobu altında kontrol edin.
NOT: Tüm hücreler diğer hücrelerle temas halinde olduğunda ve aralarında boşluk olmadığında, istenen %100 akıcılığa ulaşılır. - Hücreleri 5 mL oda sıcaklığında PBS'de 2 kat yıkayın. Bir sonraki adımda EDTA'nın şelatlamasını önlemek için tamponun kalsiyumsuz olduğundan emin olun.
- Şişeye 1 mL tripsin-EDTA ekleyin ve hücreler ayrılana kadar 5-10 dakika boyunca 37 ° C / % 5 CO2'de inkübe edin. 4 mL RP-10 ortamı ile nötralize edin. Yukarı ve aşağı pipetleyerek yavaşça karıştırın ve 50 mL'lik bir konik tüpe aktarın.
- Doku kültürü ile muamele edilmiş 24 delikli bir plakaya kuyucuk başına 500 μL hücre süspansiyonu ekleyin. Akıcı bir T-25 şişesinden, 2 × 10 6-4 × 106 hücre / mL bekleyin.
- Ertesi gün, adım 2.3'te olduğu gibi birleştiklerinden emin olmak için hücreleri ışık mikroskobu altında kontrol edin. Değilse, daha uzun süre inkübe edin.
- H292 hücreleri 24 delikli plakada% 100 birleştiğinde, antibiyotik veya döküntü içeren hiçbir ortamın kalmadığından emin olmak için hücreleri 1 mL oda sıcaklığında PBS ile 3 kat hafifçe yıkayın.
- Hücreleri yıkadıktan sonra, hücreleri sabitlemek için 250 μL / kuyucuk% 4 paraformaldehit ekleyin. Buz üzerinde 1 saat veya gece boyunca 4 ° C'de inkübe edin.
- Hücre fiksasyonundan önceki gece, S. pneumoniae suşunu kan agar plakalarına çizin ve gece boyunca 37 ° C / % 5 CO2'de inkübe edin.
NOT: Burada sunulan veriler, işbirlikçi değişim yoluyla elde edilen aşağıdaki S. pneumoniae suşları ile ilgilidir: serotip 19F otitis media izolatı EF3030 24, klasik serotip 2 Avery suşu D3925 ve serotip 4 bakteriyemi izolatıTIGR4 26. Suşlar, Malzeme Tablosunda atıfta bulunulan genel koleksiyonlardan da temin edilebilir. - 20 mL CDM'ye 100 μL oksiraz (30 U/mL) ekleyerek CDM artı oksiraz (0,15 U/mL) hazırlayın.
NOT: Oksiraz, sıvı kültürde S. pneumoniae'nin verimli büyümesini sağlamak için oksijeni ortadan kaldırmak için kullanılır27. - 1 mL CDM + oksiraz ekleyerek bakterileri plakadan yıkayarak ve 1 mL'lik bir pipet ucunun kenarını kullanarak bakteri kolonilerini hafifçe kaldırarak, agar'ı kazımamaya dikkat ederek bakterileri plakadan taze CDM + oksiraza aşılayın. Alternatif olarak, bakterileri kaldırmak ve bunları 1 mL CDM + oksiraz içeren bir tüpe aşılamak için bir aşılama döngüsü kullanın.
- CDM + oksirazdaki bakterileri 0.05'lik bir başlangıç OD600'üne seyreltin.
- Bakterileri, 0.2'lik bir OD600'e ulaşılana kadar 37 ° C / % 5 CO 2'de duran gevşek kapaklı 50 mL'lik bir konik tüpte büyütün (bu2-5 saat arasında herhangi bir yerde sürecektir). OD'nin 0,2'yi geçmediğinden emin olmak için OD600'ü saatte bir kontrol edin.
- OD 0.2'ye ulaştığında, bakteri kültürü tüpünü vorteks. Sabit H292 hücrelerine 0.5 mL bakteri tohumlayın ve kuyucuk başına 0.5 mL CDM + oksiraz ortamı ekleyin. Bakteri içermeyen kontrol kuyucuklarına 1 mL CDM + oksiraz ekleyin. Plakayı 34 °C/%5 CO2'de 48 saat inkübe edin.
NOT: 34 °C'de büyüme, nazofarenks21'deki düşük sıcaklığı daha yakından taklit etmek için kullanılır. - İlk tohumlamayı takiben her 12 saatte bir, ortamın 0.5 mL'sini yavaşça çıkarın ve 0.5 mL taze CDM + oksiraz ile doldurun. Oluşturan biyofilmi bozmamaya dikkat edin. Biyofilm için plakanın altını kontrol edin ve biyofilmin büyümesi nedeniyle zaman geçtikçe artan bulanıklığa bakın. Kirlenmeyi kontrol etmek için, kontrol kuyularının temiz kaldığından emin olmak için kuyuları bakteri içermeyen kontrol edin.
- Aşılamadan 48 saat sonra, süpernatantı çıkarın ve 1 mL PBS ile 2x çok nazikçe yıkayın. Biyofilmi kaldırmak için 1 mL taze CDM ve pipeti kuvvetlice yukarı ve aşağı doğru askıya alın. Her bakteri suşu için, bakterileri tüm kuyucuklardan 50 mL'lik bir konik tüpe toplayın. Sıkıca kapatılmış tüpü birkaç kez yukarı ve aşağı doğru hafifçe eğerek iyice karıştırın.
- 50 mL konik tüpe,% 20 gliserol nihai konsantrasyonuna sahip bir bakteri süspansiyonu elde etmek için CDM'de eşit hacimlerde% 40 gliserol ekleyin. 1 mL'yi mikrosantrifüj tüplerine alın, kuru buzda flaş dondurun ve -80 ° C'de tasarruf edin.
- Kullanmadan önce, buz üzerinde bir alikotu çözerek, tüpü 5 dakika boyunca 1.700 × g'da döndürerek, süpernatanı çıkararak, peleti 1 mL PBS'de yeniden askıya alarak ve seri seyreltmeleri kan agar plakaları28 üzerine kaplayarak bakterileri numaralandırın.
- Agar plakalarını gece boyunca 37 ° C / % 5 CO2'de büyütün ve koloni oluşturan birimlerde (CFU) / mL'de bakteri konsantrasyonunu elde etmek için kolonileri ilgili seyreltmelerde sayın.
NOT: İlk 24 saat içinde bakteri canlılığında bir düşüş olduğu için stoklardaki bakterilerin donmadan en az bir gün sonra veya daha sonra numaralandırılması önerilir. Saklanan dondurulmuş alikotlar, en fazla 2 ay boyunca farelerin sonraki enfeksiyonu için kullanılabilir.
3. Biyofilm ile yetiştirilen S. pneumoniae ile farelerin intranazal aşılaması
- Fareleri satın alın ve istediğiniz yaşta kullanın.
NOT: Genç konakçıları modellemek için 3-4 aylık fareler tercih edilir ve 29 yaş >65 yaş yaşlı bireyleri modellemek için21-24 aylık fareler kullanılabilir. Burada sunulan veriler C57BL/6 erkek farelere aittir. - Biyofilm tarafından yetiştirilen bakteriyel alikotları buz üzerinde çözün ve 5 dakika boyunca 1.700 × g'da döndürün. Peletleri bozmadan süpernatantı dikkatlice çıkarın ve atın, peleti 1 mL PBS'de yeniden askıya alarak bakterileri yıkayın ve 5 dakika boyunca 1.700 × g'da tekrar döndürün. Süpernatantı çıkarın ve peleti istenen konsantrasyona ulaşmak için gereken hacimde yeniden askıya alın (intranazal aşılama için 5 × 106 CFU / 10 μL'yi hedefleyin). Hazırlanan inokulumun 2.19. adımda olduğu gibi kan agar plakaları üzerine kaplanmasıyla uygulanan bakteri miktarlarını onaylayın.
- Seyreltilmiş inokulumun 5 μL'sini her bir narise pipetleyerek fareleri intranazal olarak 5 ×10 6 CFU ile aşılayın. Fareleri sıkıca tuttuğunuzdan emin olun, hacim solunana kadar kafayı stabilize edin (tipik olarak hacmi nares'e pipetledikten sonraki saniyeler içinde). İnokulumun pulmoner aspirasyonunu önlemek için anestezi yokluğunda bu adımı uygulayın.
4. İnfluenza A virüsü (IAV) ile viral enfeksiyon
- S. pneumoniae ile intranazal aşılamayı takiben 48 saatte, buz üzerinde ilgilenilen IAV suşunu çözün.
NOT: Burada sunulan veriler, işbirlikçi değişim 30 yoluyla elde edilen influenza A virüsü A / PR / 8/34 H1N1'in fareye uyarlanmış bir suşu ile ilgilidir. - Virüs çözüldükten sonra, PBS'deki virüsü istenen konsantrasyona seyreltin; intratrakeal enfeksiyon için 20 plak oluşturucu ünite (PFU)/50 μL ve intranazal enfeksiyon için 200 PFU/10 μL hedeflenmiştir. Alay ile enfekte olmuş ve yalnızca bakteri içeren gruplar için, fareleri aşılamak için PBS kullanın.
- Oftalmik kayganlaştırıcıyı anesteziden önce farelerin gözlerine yerleştirin. Fareleri% 5 izofluran kullanarak uyuşturun ve sıkı bir ayak parmağı sıkışmasıyla anesteziyi onaylayın.
- Hayvan uyuşturulduktan sonra, izofluran odasından çıkarın ve dili ağızdan çıkarmak ve sıvı hacmini trakeadan aşağı pipetlemek için künt cımbız kullanarak anestezi altındaki farelere derhal 50 μL (20 PFU) IAV intratrakeal olarak bulaştırın.
- Fareleri ayrı bir kafese yerleştirin ve tamamen iyileşene kadar izleyin (sternal yatmayı koruyabilirler [göğsün üzerine dik durabilirler]).
- İyileşmeyi takiben, adım 3.3'teki aşılama yöntemini kullanarak fareleri derhal intranazal olarak 10 μL (200 PFU) IAV ile aşılayın.
- Aynı enfeksiyon grubuyla tek veya çift bakteriyel ve viral enfeksiyon geçirmiş ev fareleri ve onları diğer gruplardan ayırır.
5. Farelerin hastalık belirtileri açısından izlenmesi
- Fareleri en az 10 gün boyunca günlük olarak izleyin ve aşağıdaki gibi hastalık belirtileri için körü körüne puan alın:
- Kilo kaybı için aşağıdaki gibi puan: 0 =% 5 veya daha az; 1 = %5-%10; 2 = %10-%15; 3 = %20 veya daha fazla. Kilo kaybı skoru 3 olduğunda CO2 inhalasyonu kullanarak fareleri ötenazi yapın.
- Etkinlik için aşağıdaki gibi puan: 0 = normal/aktif; 1 = hareketli ancak biraz azalmış; 2 = azalmış; 3 = ciddi şekilde azalmış / uyuşuk (sadece dokunulduğunda hareket eder), 4 = koma / hareketsiz. Aktivite puanı 3 olduğunda fareleri ötenazi yapın.
- Duruş için aşağıdaki gibi puan: 0 = önsezi yok (normal); 1 = hafif kambur duruş; 2 = şiddetli önsezi. Duruş skoru 2'de olduğunda fareleri ötenazi yapın.
- Gözler için aşağıdaki gibi puan: 0 = normal; 1 = çıkıntılı; 1 = batık; 1 = kapalı; 1 = deşarj. Bu bir kombinasyon olabilir. Son göz skoru için toplamları ekleyin.
- Nefes almak için aşağıdaki gibi puan: 0 = Normal solunum; 1 = düzensiz veya değiştirilmiş (daha yüksek/daha düşük oran); 2 = emek harcandı (abartılı çaba veya nefes alma). Solunum skoru 2'de olduğunda fareleri ötenazi yapın.
- Yukarıdaki kriterlere dayanarak, toplam sağlıklı (0) klinik skor için bireysel puanları aşırı hastaya (15) ekleyin. Toplam puanı 2'nin üzerinde gösteren herhangi bir farenin hasta olduğunu düşünün. Toplam puanı 9'un üzerinde veya her kriter için belirtilen puanları gösteren fareleri insancıl olarak ötenazi yapın ve hayatta kalma eğrisinde işaretleyin.
6. Bakteriyel numaralandırma için enfekte dokuların işlenmesi
- IAV enfeksiyonunu takiben 48 saatte, fareleri ötenazi yapın.
- Fareyi sırtüstü pozisyona getirin. % 70 etanol kullanarak, kürkü temizlemek için farenin göğsüne ve karnına püskürtün. Forseps kullanarak, kürkü ve cildi farenin ortasına sıkıştırın ve bölgeyi karaciğerden göğsüne kadar açığa çıkarmak için kürkü diseksiyon makaslarında 4.5 ile kesin.
- Kan alımı
- Diseksiyon makası kullanarak, karaciğeri açığa çıkarmak için periton boşluğuna yavaşça kesin. Forseps kullanarak, karaciğerin tepesindeki hepatik portal veni diyaframın yakınında açığa çıkarın. Diseksiyon makası kullanarak hepatik portal veni kesin. Kan periton boşluğunda birikmeye başladığında, bir mikropipet kullanarak 10 μL kan toplayın ve bakteri yükünü kaplamak için bir mikrosantrifüj tüpünde 90 μL antikoagülan çözeltisine (PBS'de 50 mM EDTA çözeltisi) yerleştirin.
- Kanın geri kalanını toplamak için bir P-1000 mikropipeti kullanın, bir kan toplama tüpüne yerleştirin ve serumu toplamak için 2 dakika boyunca 7.600 × g'da santrifüj yapın. İstenilen herhangi bir sitokin veya metabolitin daha sonraki analizi için serumu -80 ° C'de mikrosantrifüj tüplerinde saklayın.
- Akciğer koleksiyonu
- Diseksiyon makası kullanarak, açıkta kalan göğüs kafesinin kenarlarını kesin ve kalbi açığa çıkarmak için kaburgaları yavaşça farenin başına doğru çekin. PBS ile önceden doldurulmuş 10 mL'lik bir şırıngaya bağlı 25 G'lik bir iğneyi sağ ventriküle yerleştirin ve yavaşça karıştırmaya başlayın. Başarılı perfüzyonun bir göstergesi olarak akciğerlerin ağartılmasını arayın. Akciğer dokusunun kırılmasını önlemek için yavaşça yıkayın.
- Kalbi forseps ile kaldırın ve akciğerleri ve kalbi ayırmak için bir kesim yapın. Ayrıldıktan sonra, akciğerin tüm loblarını forseps ile toplayın ve kalan kanı çıkarmak için steril PBS içeren bir tabakta durulayın. Bir Petri kabında, akciğerleri küçük parçalara ayırın ve iyice karıştırın. Bakteriyel CFU veya viral PFU'nun belirlenmesi için akciğer karışımının yarısını çıkarın ve homojenizasyon için 0,5 mL PBS ile önceden doldurulmuş yuvarlak tabanlı 15 mL'lik bir tüpe yerleştirin.
NOT: Çeşitli değerlendirmeler için aynı akciğerin farklı loblarını almamak önemlidir. Bunun yerine, tüm loblar kıyılmalı, birlikte iyice karıştırılmalı ve farklı değerlendirmeler için eşit olarak ayrıştırılmalıdır. - Akciğerin diğer yarısını akış sitometrisi için çıkarın (aşağıdaki bölüm 7) ve her bir kuyucuk 0.5 mL RP-10 ile önceden doldurulmuş doku kültürü ile muamele edilmemiş 24 delikli bir plakaya yerleştirin. İşleme girene kadar oda sıcaklığında bırakın.
- Nazofarenks koleksiyonu
- Boyunda, kürkü kesmek için diseksiyon makasını kullanın ve ardından kası kesin ve trakeayı açığa çıkarın.
NOT: Trakea, kas altında bulunan tüp benzeri bir yapıdır. - Trakeanın altına, stabilize etmek için farenin çenesinden 1 cm mesafede küçük forsepsler yerleştirin. Diseksiyon makası kullanarak, trakeanın ön kısmında yavaşça 0.1 cm'lik bir yarık açın ve trakeayı tamamen kesmekten kaçının.
- 25 G iğneye bağlı 0,58 mm boru ile 0,5 mL PBS ile doldurulmuş 1 mL'lik bir şırınga hazırlayın. Tüpü nazofarenkse doğru yukarı doğru giden trakeaya sokarak burun yıkamayı toplayın. Burun boşluğuna direnç girildiği hissedildiğinde, buruna bir mikrosantrifüj tüpü yerleştirin ve burun lavajını toplamak için PBS'yi trakeadan yavaşça yıkayın.
- Fareyi yüzüstü bir konuma getirin. Farenin kafasını etanol ile püskürtün. Farenin kafa kemiğini ortaya çıkarmak için kürkü ve mistasyal pedi kesmek için diseksiyon makası kullanın.
- Diseksiyon makasını kullanarak, mandibulanın kenarlarını ve gözlerin arasını 1 cm kesin. Forseps kullanarak, burun boşluğunu ortaya çıkarmak için yüz kemiklerini yavaşça vücuttan çekin.
- Burun dokusunu nazikçe çıkarmak için forseps kullanın ve homojenizasyon için 0,5 mL PBS ile önceden doldurulmuş yuvarlak bir alt tüpe yerleştirin.
- Boyunda, kürkü kesmek için diseksiyon makasını kullanın ve ardından kası kesin ve trakeayı açığa çıkarın.
- Toplanan dokuyu homojenize etmek için, önce homojenizatör probunu %70 etanol içine koyarak ve homojenizatörü %60 güçte 30 sn boyunca açarak temizleyin. Adımı steril suda 10 saniye tekrarlayın. Her dokuyu 1 dakika boyunca homojenize edin. Homojenizatör probunu her numune arasında steril suda ve her organ ile numune grubu arasında %70 etanol içeren taze bir tüpte temizleyin.
- Bakteri sayılarının sayımı
- Tüm organlar toplandıktan ve homojenize edildikten sonra, kan agar plakaları üzerinde seri seyreltmeler yapın. Toplam CFU'yu hesaplamak için 10 μL kullanarak plaka kullanın ve her numune için mL cinsinden son hacmi not edin. Nazofarenks örneklerini, S. pneumoniae'nin büyümesini seçmek ve bu dokuyu kolonize eden diğer mikroorganizmaların büyümesini inhibe etmek için 3 μg / mL gentamisin ile desteklenmiş kan agar plakaları üzerine plakalayın. Gece boyunca 37 °C/%5 CO2'de inkübe edin.
- Akciğer ve nazofarenks için bakteriyel CFU'yu numaralandırmak için, önce kan agar plakalarındaki kolonileri sayın. Ardından, mL başına miktarı ve toplam sayıyı hesaplamak için denklem (1) ve denklem (2) kullanın.
mL başına miktar = 100 (1) × seyreltme faktörü × koloni sayısı
Toplam sayı = mL başına miktar × numune başına toplam hacim (2)
NOT: Denklem (1)'de, 10 μL kaplandığı için çarpmak için 100 kullanılır, bu da 1 mL'lik 100 katlı bir seyreltmedir. Denklem (2)'deki numune başına toplam hacim, organ başına 100 tespit sınırıyla sonuçlanan adım 6.7.1'den alınmıştır. - Bakteriyel CFU'yu numaralandırmak için Bakteriyemi için, önce kan agar plakalarındaki kolonileri sayın. Ardından, mL kan başına miktarı belirlemek için denklem (3) kullanın.
mL kan başına miktar = 100 × 10 × seyreltme faktörü × koloni sayısı (3)
NOT: Denklem (3)'te, 100, 1 mL'lik 100 kat seyreltme olan 10 μL kaplanırken kullanılır ve 10, antikoagülanda kanın 1:10 seyreltilmesini gösterir. Bu, 1.000/mL'lik algılama sınırıyla sonuçlanır.
7. Akciğer örneklerinin akış sitometrisi için işlenmesi
- Gerekli ortamı aşağıdaki gibi hazırlayın:
- RP-10'u adım 2.1'de açıklandığı gibi hazırlayın.
- RP-10'u 2 mg/mL kollajenaz ve 30 μL/mL DNaz I ile karıştırarak sindirim tamponu hazırlayın.
- 8.29 g NH4Cl, 1 g NaHCO3 ve 0.038 g EDTA'yı 1 LH2O içinde çözerek lizis tamponu hazırlayın.
- 450 mL HBSS'yi 50 mL ısı ile aktive FBS ve 5 g sodyum azid ile karıştırarak 10x FACS tamponu hazırlayın.
- 450 mL HBSS'de 50 mL 10x FACS tamponunu seyrelterek 1x FACS tamponu hazırlayın.
- Akciğer örneklerini adım 6.4.3'ten alın ve 24 delikli bir plakaya yerleştirin. Her bir oyuğa 500 μL sindirim tamponu ekleyin. 37 ° C /% 5 CO2'de 45 dakikadan 1 saate kadar inkübe edin.
- Her numune için 50 mL konik tüpleri 5 mL RP-10 ile önceden doldurun. Kuluçka bittiğinde, 50 mL konik tüpün üstüne 100 μm'lik bir filtre yerleştirin ve 1 mL RP-10 ile ıslatın.
- Bir P-1000 mikropipet kullanarak, sindirilmiş akciğerleri hareket ettirin ve filtreye yerleştirin. Organı ezmek için 3 mL'lik bir şırınganın pistonunu kullanın. Her seferinde 1 mL RP-10 ile 2 kat durulayın.
- Numuneleri 5 dakika boyunca 4 °C ve 327 × g'da döndürün. Süpernatantı aspire edin ve peleti 1 mL lizis tamponunda yeniden askıya alın. Kırmızı kan hücrelerinin parçalanmasına izin vermek için 3 dakika bekletin. 5 mL RP-10 ile nötralize edin.
- Numuneleri 5 dakika boyunca 4 °C ve 327 × g'da döndürün. Süpernatanı aspire edin, peletleri 1 mL RP-10'da yeniden askıya alın ve numuneleri saymak için 10 μL alın.
- Numuneleri 5 dakika boyunca 4 °C ve 327 × g'da döndürün. Süpernatantı aspire edin ve peleti RP-10'da 2 × 10 6-4 × 106 hücre / mL'de yeniden askıya alın. Adım 7.9, Tablo 5 ve Tablo 6'da listelenen istenen hücre tipleri23 için boyamak üzere 96 delikli bir plakaya her numuneden 60 μL ekleyin.
- Plakayı 5 dakika boyunca 4 ° C ve 327 × g'da döndürün.
- Bu arada, antikor ana karışımlarını, floresan eksi bir (FMO'lar) ve tek lekeli kontrolleri istenen antikorlarla hazırlayın. Polimorfonükleer lökositler (PMN'ler), makrofajlar, monositler, dendritik hücreler ve T hücreleri için boyama yapmak için, Tablo 5 ve Tablo 6'da listelenen antikorları ve son seyreltmeleri kullanın. Antikor karışımının toplam 100 μL/kuyucuk hacmini kullanın. Ana karışımın uygun hacmini ve gerekli bireysel antikorları belirlemek için tablolarda listelenen seyreltmeleri izleyin.
- Spin tamamlandığında (adım 7.8), süpernatanı boşaltın, topakları antikor karışımlarının, FMO'ların veya tek lekeli kontrollerin 100 μL'sinde yeniden askıya alın ve karanlıkta 30 dakika boyunca buz üzerinde inkübe edin.
- Kuyucuklara 150 μL FACS tamponu ekleyerek ve plakayı 4 ° C'de ve 327 × g'da 5 dakika boyunca döndürerek hücreleri 2 kat yıkayın.
- Spin tamamlandığında, süpernatanı boşaltın, peletleri 100 μL sabitleme tamponunda yeniden askıya alın ve 20 dakika boyunca buz üzerinde inkübe edin.
- Kuyucuklara 150 μL FACS tamponu ekleyerek ve plakayı 4 ° C'de ve 327 × g'da 5 dakika boyunca döndürerek hücreleri 2 kat yıkayın.
- 200 μL FACS tamponu ile etiketli FACS tüpleri hazırlayın. Peletleri 150 μL FACS tamponunda tekrar askıya alın. Her numuneyi 100 μm'lik bir filtre kullanarak karşılık gelen FACS tüpüne ayrı ayrı filtreleyin. Buz üzerinde veya 4 °C'de tutun ve analize hazır olana kadar ışıktan koruyun.
- Bir akış sitometresi kullanarak hücreleri analiz edin.
8. IAV'nin numaralandırılması için plak tahlili
- Gerekli ortamı aşağıdaki gibi hazırlayın:
- 2.5 g sığır serum albümini (BSA) 40 mL DMEM içinde çözerek ve çözünene kadar 10-20 dakika boyunca 37 ° C'de karıştırarak enfeksiyon ortamını hazırlayın. 460 mL DMEM'e filtre uygulayın-sterilize edin.
- 1.2 mg mikrokristalin selülozu sıvı ortamında 50 mLH2O. Otoklav içinde çözerek% 2.4 mikrokristalin selüloz hazırlayın ve oda sıcaklığında saklayın.
- 2.5 g BSA'yı 40 mL DMEM içinde çözerek ve 37°C'de 10-20 dakika karıştırarak %5 BSA DMEM hazırlayın. 50 mL'lik son hacim için kalan 10 mL DMEM'i ekleyin. Filtreleyin-sterilize edin ve 4 °C'de saklayın.
- 1 mL'lik %5'lik BSA DMEM'i 9 mL'lik 2x MEM ile karıştırarak 2x MEM/%0,5 BSA hazırlayın.
- 1:1 oranında %2,4 mikrokristalin selüloz ve 2x MEM/%0,5 BSA'yı 1 mg/mL TPCK (kimotripsin inhibitörü) tripsin ile karıştırarak düşük viskoziteli kaplama ortamı hazırlayın.
- 450 mL Eagle's Minimum Essential Medium (EMEM) ile 50 mL ısı ile inaktive FBS'yi karıştırarak EMEM/%10 FBS'yi hazırlayın.
- Madin-Darby köpek böbrek (MDCK) hücre hattını büyütün. Satın alınan bir şişedeki hücreleri, T-25 doku kültürü ile muamele edilmiş bir şişede 5 mL EMEM / % 10 FBS'ye ekleyin. Hücreler %100 birleşene kadar 37 °C/%5 CO2'de 3-5 gün inkübe edin. Adım 2.3'teki gibi akıcılığı kontrol edin.
- Kültür ortamını çıkarın ve atın ve 5 mL oda sıcaklığında PBS ile 2 kat durulayın. Şişeye 1 mL tripsin-EDTA ekleyin ve hücreler ayrılana kadar 10-15 dakika boyunca 37 °C / % 5 CO2'de inkübe edin. Kaldırıldıktan sonra, 2 × 105 hücre/mL'de bir hücre süspansiyonu elde etmek için 4mL EMEM / 10% FBS ile nötralize edin.
- Plak tahliline başlamadan 1 gün önce, MDCK hücrelerini 12 kuyucuklu doku kültürü ile muamele edilmiş bir plakada, kuyu başına 1 mL askıya alınmış hücre ekleyerek (2 × 105 hücre / kuyuda) tohumlayın.
NOT: Kullanmadan önce hücrelerin %100 akıcılığa ulaştığından emin olun ve akıcılığa ulaşmak için gerekirse daha uzun süre inkübe edin. - Standart olarak kullanmak için, adım 8.1.1'de listelenen enfeksiyon ortamında IAV stoğunun (bilinen bir titrenin) 10 kat seri seyreltmesini (106-10 1) yapın. Üçlü olarak test etmek için her seyreltmeden 1,2 mL yapın.
- Organ buz üzerinde homojenleşir. 2.000 × g'lık bir masa üstü santrifüj üzerinde döndürün ve berrak süpernatanı toplayın.
- Adım 8.5'i, ancak adım 8.6'daki örneklerdeki süpernatant ile yineleyin.
- Ortamı hücrelerden aspire edin ve tüm FBS'yi çıkarmak için 1 mL PBS ile 2 kat yıkayın.
- Her bir standart seyreltmeden 300 μL ekleyin veya seri olarak seyreltilmiş numuneyi, en yüksek seyreltmeden başlayarak en düşüğe kadar her bir kuyucuğun kenarına nazikçe ekleyin ve bunu üçlü olarak yapın.
- Plakaları inkübatöre 37 ° C / 5% CO2'de yerleştirin, plakayı her 10 dakikada bir toplam 50 dakika boyunca sallayın. Onları inkübatöre düz bir şekilde yerleştirdiğinizden ve istiflemediğinizden emin olun.
- 50 dakika sonra, hücreleri 1 mL PBS ile 2x yıkayın.
- En düşük seyreltmeli ve virüssüz kuyular hariç her bir kuyucuğa 2 mL düşük viskoziteli kaplama ortamı ekleyin; Bunlara enfeksiyon ortamı ve tripsin ekleyin.
- Çıplak gözle görselleştirilebilen plaklar elde etmek için plakayı 2-4 gün boyunca 37 ° C / % 5 CO2'de inkübatöre geri yerleştirin.
- Her bir kuyucuğa yandan hızlı bir şekilde 2 mL PBS ekleyerek plakaları yıkayın ve yerleşmiş düşük viskoziteli kaplama ortamını askıya almak için hafifçe çalkalayın.
- Ortamı yavaşça pipetleyerek kuyudaki tüm sıvı hacmini atın.
- Yıkamayı her bir oyuğa 2 mL PBS ile bir kez daha tekrarlayın ve ardından tüm sıvı hacmini nazik pipetleme ile atın.
- Plakları sabitlemek için, her bir oyuğa 500 μL% 4 paraformaldehit ekleyin, çalkalayın ve 30 dakika bekletin.
- 1 mL PBS ile yavaşça aşağı doğru yıkayın; Ardından, sıvıyı yavaşça atın.
- Hücre tek katmanını örtmek için her bir kuyucuğa 500 μL% 1 kristal menekşe (suda seyreltilmiş) ekleyin. 5 dakika boyunca inkübe edin.
- 1 mL musluk suyu ile yıkayın. Kuyucuktaki tüm sıvıyı nazik pipetleme ile attığınızdan emin olun. Plakayı gece boyunca kuruması için bir bebek bezi pedi üzerine baş aşağı yerleştirin.
- Plakları görsel olarak sayın ve görüntüleri mevcut herhangi bir görüntüleyiciye kaydedin.
Sonuçlar
Biyofilm ile yetiştirilen S. pneumoniae (Şekil 1A), anestezi yapılmamış farelere intranazal olarak verilen küçük bir 10 μL inokülum kullanılarak fareleri enfekte etmek için kullanıldı (Şekil 1B). Bu küçük hacimli inokulum, sistemik yayılımı önlerken (Şekil 2B, C, +sp grupları) nazofarenks (Şekil 2A, +sp grupları) ile sınırlı tutarlı pnömokok taşıyıcılığı ile sonuçlanır. İntranazal aşılamadan iki gün sonra, fareler, nazofarenks ve akciğerlere spesifik miktarların tutarlı bir şekilde verilmesini sağlamak için hem intranazal hem de intratrakeal olarak verilen murine uyarlanmış bir H1N1 influenza A virüsü A / PR / 8/34 (IAV) 22,30 ile enfekte edildi23.
Burada, model, bakteriyemiye ilerleyen pnömoni ile sonuçlanan invaziv suşlar olan TIGR4 ve D39 ve bir otitis media suşuolan EF3030 dahil olmak üzere farklı S. pneumoniae suşları ile intranazal olarak zorlanan farelerde viral enfeksiyonu takiben hastalığın seyrini karşılaştırmak için kullanılmıştır. S. pneumoniae/IAV ile birlikte enfekte olmuş farelerde hastalık prezentasyonu bakteriyel suşa bağlıydı (Şekil 2). Herhangi bir suş arasında nazofarenksin bakteri sayılarında anlamlı bir fark bulunmazken (Şekil 2A), S. pneumoniae TIGR4 ve D39, ancak EF3030 değil, IAV enfeksiyonundan 48 saat sonra akciğerlere yayılmıştır (Şekil 2B). S. pneumoniae TIGR4 ile intranazal olarak enfekte olmuş farelerin yüzde kırkı, akciğerlere bakteriyel yayılım gösterdi ve bunların yarısı, önceki bulgularla tutarlı olarak bakteriyemik hale geldi (Şekil2C) 23.
S. pneumoniae D39 ile intranazal olarak enfekte olmuş fareler daha etkili yayılma göstermiştir, çünkü birlikte enfekte olmuş farelerin% 100'ünde akciğerlere yayılma gözlenmiştir (Şekil 2B). S. pneumoniae TIGR4'e benzer şekilde, bunların yarısı bakteriyemi yaşadı (Şekil 2C). Genel sağkalımın izlenmesinde, bakteri suşundan bağımsız olarak, birlikte enfekte olmuş farelerin hayatta kalma oranı, test edilen tüm suşlar için tek başına S. pneumoniae ile tek başına meydan okunan farelerden önemli ölçüde daha düşüktü (Şekil 2D). Tek başına IAV ile mücadele eden kontrol fareleri ile karşılaştırıldığında, intranazal olarak S. pneumoniae TIGR4 ve D39 ile enfekte olmuş, ancak EF3030 ile enfekte olmayan fareler, hızlandırılmış hastalık oranları göstermiştir. IAV enfeksiyonu sonrası 2. günde, farelerin% 30'u (D39) ve% 20'si (TIGR4) yenik düşerken, sadece IAV'li kontrol grupları 5. güne kadar yenilmeye başlamadı (Şekil 2D). S. pneumoniae EF3030 ve IAV ile birlikte enfekte olan fareler, yalnızca IAV kontrollerine benzer şekilde semptomları geciktirmiştir (Şekil 2D). Bu bulgular, ko-enfeksiyon modelinin bakteriyel suşa bağımlı genç sağlıklı farelerde hastalığa neden olduğunu göstermektedir, bu da hastalığın ilerlemesinin her adımında gerekli olan bakteriyel faktörleri araştırmak için idealdir.
Bu model, farklı S. pneumoniae suşları ile intranazal olarak aşılanmış farelerde IAV enfeksiyonunu takiben akciğerlerde çeşitli bağışıklık hücrelerinin varlığını (Şekil 3'teki hücre tipleri ve geçit stratejisi) değerlendirmek için kullanılmıştır. IAV enfeksiyonunu takiben akciğerlere dağılan D39 ve TIGR4 bakteri suşları, nötrofiller (PMN'ler) ve monositler gibi dolaşımdan enflamatuar bağışıklık hücrelerinin akışında bazal çizginin üzerinde (enfekte olmayan) önemli bir artışa neden olurken, EF3030 bunu yapmadı (Şekil 4A-C). Tek başına IAV enfeksiyonu, NK hücreleri ve gama-delta T hücreleri gibi viral enfeksiyona karşı konak savunması için önemli olan bağışıklık hücrelerinin akışında taban çizgisinin üzerinde anlamlı bir artışa neden olmuştur (Şekil 4A-C). Bu antiviral yanıtlar, viral meydan okumadan önce intranazal olarak S. pneumoniae ile enfekte olmuş farelerde anlamlı derecede körelmiştir (Şekil 4A-C). Bu, S. pneumoniae taşıyıcısının tip I interferonların üretimini körelttiğini ve konağın akciğerlerdeki IAV yüklerini kontrol etme yeteneğini bozduğunu bulan sitokin yanıtlarını değerlendiren önceki çalışmalarla tutarlıdır23. Bu bulgular, ko-enfeksiyon modelinin, mono ve polimikrobiyal enfeksiyonlarda bağışıklık tepkilerinin nasıl değiştiğini incelemek için kullanılabileceğini göstermektedir.
Bu model aynı zamanda S. pneumoniae TIGR4 ile intranazal olarak enfekte olmuş farelerde yaşlanmanın IAV enfeksiyonunu takiben hastalığın seyri üzerindeki etkisini değerlendirmek için de kullanılmıştır. Tek başına enfekte olmuş farelerde, viral titreler genç ve yaşlı kohortlar arasında değişmedi (Şekil 5A)23. Önceki çalışmalardaolduğu gibi 23, yaşlı fareler, daha yüksek klinik skorların gösterdiği gibi, genç meslektaşlarına kıyasla daha erken ve önemli ölçüde daha şiddetli hastalık belirtileri göstermiştir (Şekil 5B). Hastalık semptomlarıyla tutarlı olarak, S. pneumoniae ile aşılanan yaşlı fareler, IAV enfeksiyonundan sonraki 24 saat içinde daha hızlı ölmeye başladı ve hepsi hastalığa yenik düşerken, genç kontroller enfeksiyondan anlamlı derecede yüksek (% 33) bir oranda kurtuldu (Şekil 5C). Bu bulgular, ko-enfeksiyon modelinin savunmasız konakçılarda daha şiddetli hastalıkları tespit etmek için kullanılabileceğini ve ko-enfeksiyona direnç veya duyarlılık kazandıran konakçı faktörlerini araştırmak için ideal olduğunu göstermektedir.
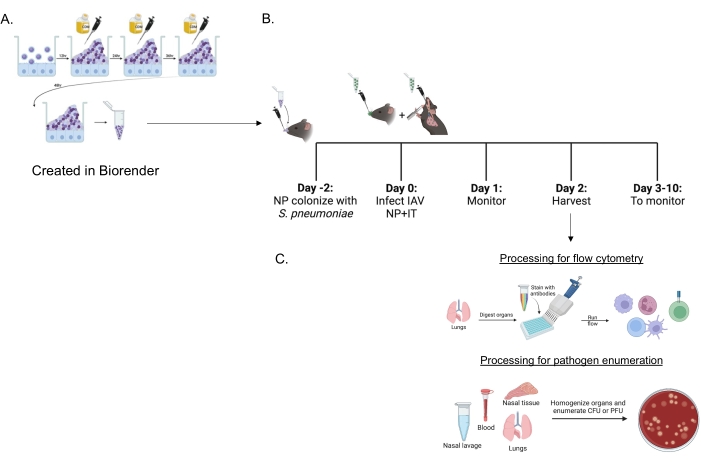
Şekil 1: İmmün hücre akışı ve patojen yükünün değerlendirilmesi için ko-enfeksiyon ve organ işlemenin zaman çizelgesi. (A) Streptococcus pneumoniae, biyofilmlerde yetiştirilir. (B) Fareler, nazofarengeal taşıyıcılık oluşturmak için belirtilen biyofilm tarafından yetiştirilen S. pneumoniae suşunun 5 × 106 CFU'su ile intranazal olarak aşılanır veya tedavi edilmeden bırakılır. Kırk sekiz saat sonra, fareler ya PBS ile taklit edilir ya da intranazal olarak 200 PFU influenza A virüsü PR8 ve intratrakeal olarak 20 PFU alırlar. Fareler klinik hastalık skorları ve sağkalım için zaman içinde izlenir. (C) IAV enfeksiyonundan sonraki 48 saatte, farklı organlarda bakteriyel CFU veya viral PFU veya akciğerlerdeki bağışıklık hücresi akışı değerlendirilir. Kısaltmalar: CFU = koloni oluşturan birimler; PFU = plak oluşturan birimler; IAV = influenza A virüsü PR8; IT = intratrakeal; NP = nazofaringeal. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
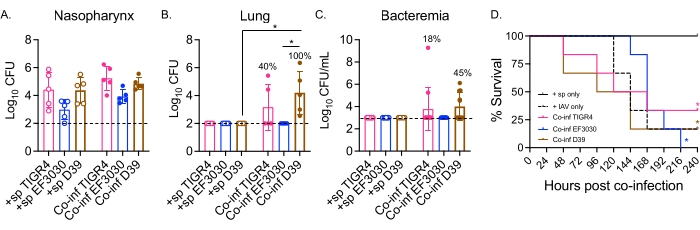
Şekil 2: S. pneumoniae ile aşılanmış farelerin ikili intranazal/intratrakeal IAV enfeksiyonu, bakteriyel yayılmaya ve bakteriyel suşa bağlı hastalığa yol açar. Genç (10-12 haftalık) erkek C57BL/6 (B6) fareler Şekil 1'deki gibi enfekte oldu. (A) nazofarenks, (B) akciğerler ve (C) kandaki bakteri sayıları, IAV enfeksiyonundan 48 saat sonra belirlendi. (B,C) Yüzdeler, yayılma gösteren farelerin fraksiyonunu gösterir. (D) Sağkalım IAV enfeksiyonundan sonraki 10 gün boyunca izlendi. Grup başına (A,B) n = 5, (C) n = 11 ve (D) n = 6 fareden toplanan veriler gösterilir. Her daire bir fareye karşılık gelir ve kesikli çizgiler algılama sınırını gösterir. (A-C) *, Kruskal-Wallis testi ile belirlenen belirtilen gruplar arasında anlamlı bir fark (p < 0.05) olduğunu gösterir. (D) *, log-rank (Mantel-Cox) testi ile belirlenen bakteri suşu başına +sp ve Co-inf fareler arasında anlamlı bir fark (p < 0.05) olduğunu gösterir. Kısaltmalar: +sp = sadece belirtilen suşu kullanarak intranazal olarak bakterilerle enfekte olmuş fareler; Co-inf = IAV ile enfekte olmuş bakteriyel enfekte fareler; IAV = influenza A virüsü alan fareler; CFU = koloni oluşturan birimler. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
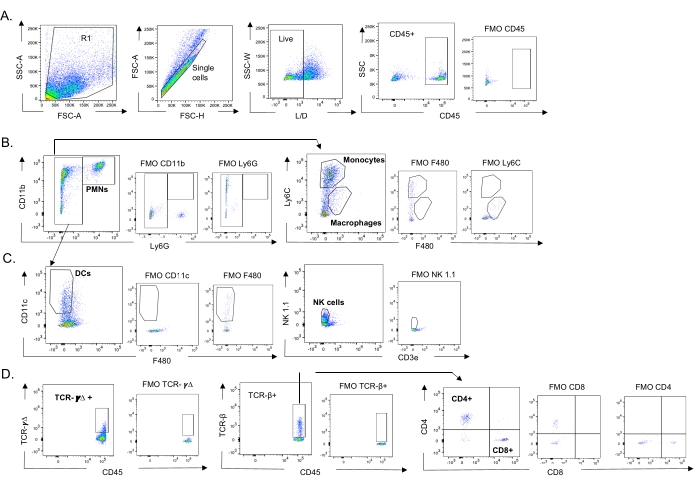
Şekil 3: İmmün hücre geçit stratejisi. Akciğerler toplandı ve bağışıklık hücresi akışı akış sitometrisi ile belirlendi. Farklı hücre tiplerinin temsili geçit stratejisi gösterilmiştir. (A) CD45+, canlı tek hücreler (B) PMN'ler (Ly6G+, CD11b+), makrofajlar (Ly6G-, Ly6C-, F480+) ve monositler (Ly6G-, Ly6C+), (C) DC'ler (Ly6G-, CD11c+) ve NK hücreleri (NK1.1+, CD3-), (D) TCR- γΔ ve CD8 (CD8+, TCRβ+) ve CD4 (CD4+, TCRβ+) yüzdeleri ve yüzdeleri ) T hücreleri belirlendi. Kısaltmalar: SSC-A = yan saçılma-tepe alanı; FSC-A = ileri saçılma-tepe alanı; FSC-H = ileri saçılma-tepe yüksekliği; SSC-W = yan dağılım-tepe genişliği; L/D = canlı/ölü; FMO = floresan eksi bir; NK = doğal katil; PMN = polimorfonükleer lökosit; DC = dendritik hücre; TCR = T hücre reseptörü. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
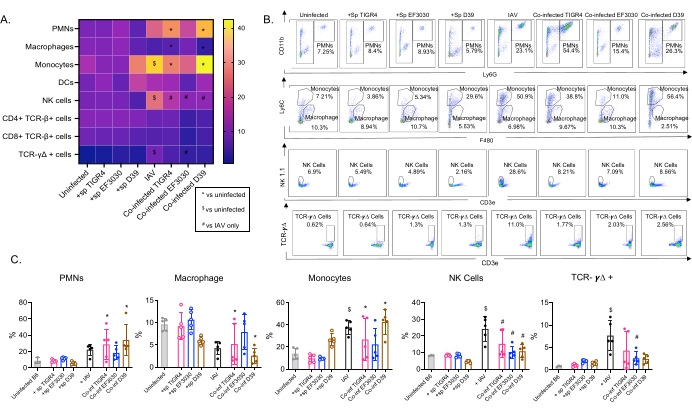
Şekil 4: Pulmoner immün yanıtlar bakteriyel suşa bağımlıdır. Genç (10-12 haftalık) C57BL/6 erkek fareler ya enfekte olmamış, belirtilen Streptococcus pneumoniae suşu (+sp) ile tek başına aşılanmış, IAV (IAV) ile tek başına mücadele etmiş ya da S. pneumoniae ve IAV (Co-inf) ile birlikte enfekte olmuştur. IAV enfeksiyonundan kırk sekiz saat sonra (Şekil 1'deki deneysel tasarıma bakınız), akciğerler toplandı ve bağışıklık hücresi akışı, Şekil 3'teki geçit stratejisini takip eden akış sitometrisi ile belirlendi. (A) CD45 kapısı içinde belirtilen her hücre tipinin ortalama yüzdeleri, ısı haritasındaki tüm tedavi grupları için görüntülenir. (B) Her fare grubu için tedaviler arasında önemli farklılıklar gösteren hücre tiplerinin temsili nokta grafikleri gösterilir. (C) Belirtilen bağışıklık hücresi tiplerinin yüzdeleri gösterilir. Her daire bir fareye karşılık gelir. (A,C) Grup başına n = 5 fareden toplanan veriler gösterilir. *, Co-inf ve enfekte olmamış arasında anlamlı bir fark (p < 0.05) gösterir; $, IAV ile enfekte olmamış arasında anlamlı bir değer olduğunu gösterir; #, tek başına Co-inf ve IAV arasında önemli bir fark olduğunu gösterir. Her hücre tipi için meydan okuma grupları arasındaki anlamlı farklılıklar ANOVA tarafından belirlendi ve ardından Tukey testi yapıldı. Kısaltmalar: NK = doğal katil; PMN = polimorfonükleer lökosit; DC = dendritik hücre; TCR = T hücre reseptörü; IAV = influenza A virüsü. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
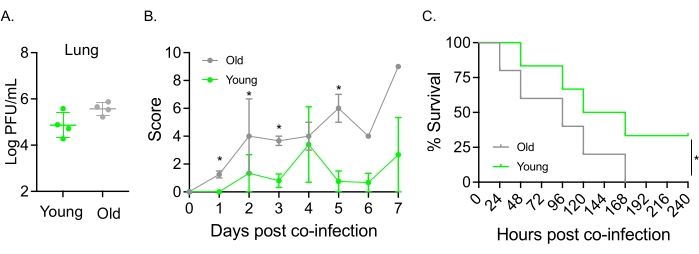
Şekil 5: Yaşlanma ve konakçının IAV/Streptococcus pneumoniae ko-enfeksiyonuna duyarlılığının artması. Genç (10-12 haftalık) ve yaşlı (21-22 aylık) C57BL/6 erkek fareler S. pneumoniae TIGR4 i.n. ve IAV i.n. ve i.t. (Şekil 1'de olduğu gibi) ile birlikte enfekte olmuş veya tek başına IAV ile tek başına mücadele etmiştir. (A) Viral titreler 48 saat sonra belirlendi. Yıldız işaretleri, Öğrencinin t-testi tarafından belirlenen istatistiksel anlamlılığı (p < 0.05) gösterir. Veriler, grup başına n = 4 fareden toplanır. (B) Klinik skor ve (C) sağkalım zaman içinde izlendi. (B) Grup başına n = 6 fareden toplanan ortalama ± SEM gösterilir. Yıldız işaretleri, Mann-Whitney testi tarafından belirlenen belirtilen zaman noktasında genç ve yaşlı fareler arasındaki istatistiksel anlamlılığı (p < 0.05) gösterir. (C) Veriler, grup başına n = 6 fareden toplanır. Yıldız işaretleri, log-rank (Mantel-Cox) testi ile belirlenen genç ve yaşlı fareler arasındaki istatistiksel anlamlılığı (p < 0.05) gösterir. Kısaltmalar: IAV = influenza A virüsü; i.n. = intranazal; i.t. = intratrakeal; SEM = ortalamanın standart hatası. Şekil 5A, Joma ve ark.23'ün izniyle yeniden basılmıştır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| CDM için Mix I stok | |
| Adenin | 0.1 gr |
| D-Alanin | 0.25 gr |
| CaCl2 Susuz | 0.025 gr |
| Manganez Sülfat | 0.03 gr |
| Siyanokobalamin | 100 μL 10 mg/mL stok |
| Para-Aminobenzoik Asit | 400 μL 5 mg/mL stok |
| Piridoksamin 2HCl | 100 μL 10 mg/mL stok |
| CDM için Mix II hisse senedi | |
| Arjantin | 0.05 gr |
| Urasil | 0.05 gr |
| CDM için Mix III hisse senedi | |
| Ferrik Nitrat 9H2O | 50 mg/mL |
| Ferrik Sülfat 7H2O | 10 mg/mL |
| CDM için IV stoğu karıştırın | |
| Beta-Nikotinamid adenin dinükleotid | 25 mg/mL |
Tablo 1: CDM için I, II, III ve IV stoklarını karıştırın. Kısaltma: CDM = kimyasal olarak tanımlanmış ortam.
| CDM için Vitamin Karışımı Stoğu | |
| Piridoksal Hidroklorür | 0.8 gr |
| Tiamin Cl2 | 0.4 gr |
| Riboflavin | 0.4 gr |
| Ca-pantotenat | 0.4 gr |
| Biotin | 0.04 gr |
| Folik Asit | 0.4 gr |
| Niacinamide | 0.4 gr |
Tablo 2: CDM için Vitamin Karışımı Stoğu. Kısaltma: CDM = kimyasal olarak tanımlanmış ortam.
| CDM için Amino Asit Stoğu | |
| L-Alanin | 0.480 gr |
| L-Arginin | 0.250 gr |
| L-Asparajin | 0.700 gr |
| L-Aspartik Asit | 0.600 gr |
| L-Sistein | 1.000 gr |
| L-Sistin | 0.100 gr |
| L-Glutamik Asit | 0.200 gr |
| L-Glutamin | 0.780 gr |
| L-Glisin | 0.350 gr |
| L-Histidin | 0.300 gr |
| L-İzolösin | 0.430 gr |
| L-Lösin | 0.950 gr |
| L-Lizin | 0.880 gr |
| L-Metiyonin | 0.250 gr |
| L-Fenilalanin | 0.550 gr |
| L-Prolin | 1.350 gr |
| L-Serin | 0.680 gr |
| L-Treonin | 0.450 gr |
| L-Triptofan | 0.100 gr |
| L-Valin | 0.650 gr |
Tablo 3: CDM için Amino Asit Stoğu. Kısaltma: CDM = kimyasal olarak tanımlanmış ortam.
| CDM için Başlangıç Stoğu | |
| Dekstroz | 1.0 gr |
| Magnezyum Sülfat-7-Hidrat | 0.070 gr |
| Potasyum Fosfat Dibazik | 0.02 gr |
| Potasyum Fosfat Monobazik | 0.1 gr |
| Sodyum Asetat Susuz | 0.45 gr |
| Sodyum Bikarbonat | 0.25 gr |
| Sodyum Fosfat Dibazik | 0.735 gr |
| Sodyum Fosfat Monobazik | 0.32 gr |
| CDM için Son Ekler | |
| Kolin Klorür | 0.1 gr |
| L-Sistein HCl | 0.075 gr |
| Sodyum Bikarbonat | 0.25 gr |
Tablo 4: CDM için başlangıç stoğu ve son takviyeler. Kısaltma: CDM = kimyasal olarak tanımlanmış ortam.
| Antikor/Florofor | Klon | Seyreltme Faktörü |
| UV uyarımı için L/D | YOK | 0.38888889 |
| Ly6G AF 488 | 1A8 | 0.25 |
| CD11b APC | M1/70 | 0.25 |
| CD11c PE | N418 | 0.18055556 |
| Mouse Fc Bloğu | 2.4G2 | 0.11111111 |
| F4/80 PE Cy7 | BM8 | 0.18055556 |
| Ly6C BV605 | AL-21 | 0.25 |
| CD103 BV 421 Serisi | M290 | 0.18055556 |
| CD45 APC-eF-780 | 30-F11 | 0.18055556 |
Tablo 5: Antikor paneli 1.
| Antikor/Florofor | Klon | Seyreltme Faktörü |
| UV uyarımı için L/D | YOK | 0.388888889 |
| TCR-β APC Cy7 | H57-597 | 0.180555556 |
| CD4 V450 (Pasifik Mavisi) | RM4-5 | 0.25 |
| CD8 BV650 | 53-6.7 | 0.180555556 |
| Mouse Fc Bloğu | 2.4G2 | 0.111111111 |
| CD45 PE | 30-F11 | 0.180555556 |
| CD3 AF488 | 145-2C11 | 0.180555556 |
| TCR- γΔ APC | GL-3 Serisi | 0.180555556 |
| NK1.1 AF 700 Serisi | PK136 | 0.180555556 |
Tablo 6: Antikor paneli 2.
Tartışmalar
Mevcut S. pneumoniae / IAV ko-enfeksiyon deneysel çalışmalarının çoğu, IAV ile önceden enfekte olmuş farelerin akciğerlerine bakteriyel iletime dayanmaktadır. Bu modeller, konakçıyı sekonder bakteriyel enfeksiyona duyarlı hale getiren pulmoner ortamdaki ve sistemik immün yanıttaki değişikliklerin belirlenmesine yardımcı olmuştur 15,16,17,32,33,34,35,36,37. Bununla birlikte, bu modeller S. pneumoniae'nin asemptomatik bir kolonizatörden ciddi akciğer ve sistemik enfeksiyonlara neden olabilen bir patojene geçişini taklit edememiştir. Ayrıca, bu modeller üst solunum yollarında enfeksiyona duyarlılığa katkıda bulunan konakçı faktörlerini ve konakçı-patojen etkileşimlerini incelemek için uygun değildir. İAv enfeksiyonundan sonra pnömokokların nazofarenksten akciğere hareketi için önceki bir model, nazofarenksin bakteriyel enfeksiyonuna ve ardından viral enfeksiyona dayanıyordu. Bununla birlikte, insan hastalarda gözlenen ciddi hastalık belirtilerini yeniden üretemedi21. Burada tarif edilen modifiye murin enfeksiyonu modeli, S. pneumoniae'nin asemptomatik taşıyıcılıktan ciddi klinik hastalığa neden olan bir patojene geçişini özetlemektedir.
Bu modelin kritik bir adımı, nazofarenkste S. pneumoniae enfeksiyonunun kurulmasıdır. Streptococcus pneumoniae, biyofilmler oluşturur ve nazofarenksi farklı verimliliklerde kolonize eder21,38. Tutarlı enfeksiyon oluşturmak için, şimdiye kadar test edilen biyofilm ile yetiştirilen bakteri suşlarının en az 5 × 106 CFU'su gereklidir23. Herhangi bir yeni bakteri suşunun viral enfeksiyondan önce nazofarenksin stabil enfeksiyonu için test edilmesi önerilir. Viral ko-enfeksiyon için, önceki çalışmalar, bakterilerin nazofarenksten dağılması için IAV ile intranazal enfeksiyonun gerekli olduğunu bulmuştur21,22,23. Önceki çalışmalarda, intranazal doğum için 500 PFU IAV kullanılırken, bu çalışmada nazofarenksteki bakteri sayılarını artırmak için 200 PFU yeterliydi. IAV enfeksiyonu üst solunum yolları ile sınırlı değildir ve akciğerlere yayılabilir39,40, bu da pulmoner ortamı bakteriyel enfeksiyon için daha izin verici hale getirmenin anahtarıdır15,16,41. IAV'nin akciğerlere verilmesi, intranazal doğum veya anestezi uygulanan farelerin intratrakeal yerleştirilmesi ile sağlanabilir. BALB / cByJ fareleri ile yapılan önceki çalışmalar, intranazal doğumun viral pnömoni ile sonuçlandığını bulmuştur21; Bununla birlikte, intranazal aşılamayı takiben inokulumun akciğerlere erişimi C57BL / 6 farelerde daha sınırlıdır. C57BL/6 farelerde, virüs23'ün tutarlı bir şekilde verilmesi için intratrakeal kurulum gereklidir. Bu modelde, önceki bakteriyel kolonizasyon, viral enfeksiyon sonrası hastalık semptomlarının ortaya çıkışını hızlandırmaktadır23. Viral enfeksiyonun kendisi kinetik potansiyel varyasyon ile hastalık semptomlarına neden olabileceğinden, önce test edilen herhangi bir yeni viral suş için bir dizi dozun test edilmesi ve birlikte enfekte konakçılarda hızlandırılmış kinetiği ortaya çıkaran bir doz seçilmesi önerilir.
Akciğerler, bu modelde hastalık değerlendirmesi için başka bir kritik okuma sağlar. Patojen yükünün ve bağışıklık hücresi akışının değerlendirilmesi için, aynı fareden bir akciğer kullanılabilir. Bununla birlikte, enfeksiyon ve inflamasyon şiddeti loblar arasında farklılık gösterebileceğinden, çeşitli değerlendirmeler için aynı akciğerin farklı loblarının alınmaması önerilir. Aksine, tüm loblar küçük parçalara ayrılabilir, birlikte iyice karıştırılabilir ve daha sonra farklı değerlendirmeler için eşit olarak ayrıştırılabilir. Benzer şekilde, nazofarenks, bakteriyel CFU veya viral PFU ve immün yanıtın sayımı için kullanılabilir. Bununla birlikte, yıkamalardan ve dokulardan elde edilen hücre sayısı, aynı gruptaki farelerden alınan örnekleri bir araya getirmeden akış sitometrisi yapmak için çok düşüktür. Alternatif olarak, nazofarenksteki inflamasyon histolojik olarak değerlendirilebilir23.
Bu modelin kritik bir özelliği, hastalarda görülen klinik hastalığı özetlemesidir. İnsanlarda, IAV enfeksiyonunu takiben sekonder pnömokok pnömonisi sıklıkla öksürük, nefes darlığı, ateş ve hastaneye yatışlara, solunum yetmezliğine ve hatta ölüme yol açabilecek kas ağrıları dahil olmak üzere belirgin hastalık belirtileri ile sonuçlanır 8,15,42,43. Bu model, insanlarda gözlenen ciddi klinik hastalık belirtilerini, fareler tarafından görüntülenen nefes almada zorluk (solunum skoruna yansıyan) ve genel halsizlik (duruş ve hareket skorlarına yansıyan) ve bazı sağlıklı genç kontrollerde ölüm açısından özetlemektedir. Birlikte enfekte olmuş farelerde şiddetlenen hastalık semptomları muhtemelen hem akciğerlere bakteriyel yayılımın hem de pnömokok taşıyıcısı23 olan farelerde bozulmuş viral klirensin bir sonucudur. Modelin bir sınırlaması, klinik hastalık insidansının ve nazofarenksten bakteriyel yayılımın fareler arasında değişmesi ve bakteriyel suş, konakçı yaş ve genotip21,22,23'ten etkilenmesidir. Bunu yansıtarak, invaziv suşlar için, lokalize enfeksiyondan (saptanabilir bakteriyemi olmadan) ölüme ilerleme 24 saat içinde gerçekleşebilir. Bu nedenle, sistemik yayılımın gerçek bir değerlendirmesi için, bakteriyemi daha kısa aralıklarla (her 6-12 saatte bir) takip edilmelidir. Benzer şekilde, hastalık skoru, özellikle ko-enfeksiyondan sonraki ilk 72 saat içinde hızla değişebilir. Bu nedenle, hastalık semptomlarını yakından izlemek için, IAV enfeksiyonundan sonraki 1-3 gün boyunca fareleri günde üç kez izlemeniz önerilir.
Özetle, bu model S. pneumoniae'nin nazofarenksin asemptomatik bir kolonizöründen, IAV enfeksiyonu üzerine pulmoner ve sistemik hastalığa neden olabilen bir patojene hareketini çoğaltır. Bu modelde IAV, nazofarenksteki bakteriyel davranışı değiştirerek, akciğere bakteriyel yayılımı artırarak ve antibakteriyel bağışıklığı değiştirerek S. pneumoniae'nin geçişini tetikler23. Benzer şekilde, bakteriyel taşıyıcılık antiviral immün yanıtları köreltir ve akciğerlerden IAV klirensini bozar23. Bu, bu modeli, tek ve polimikrobiyal enfeksiyonlarda bağışıklık yanıtlarındaki değişiklikleri ayrıştırmak için ideal kılar. Ek olarak, ko-enfeksiyonu takiben hastalığın seyri, kısmen, nazofarenkste bulunan pnömokokların suşuna bağlıdır. Bu nedenle, model S. pneumoniae'nin patojenik geçişine karşı asemptomatik kolonizasyon için gerekli bakteriyel faktörlerin diseksiyonu için uygundur. Son olarak, bu model yaşlanmanın ko-enfeksiyonlara duyarlılığını yeniden üretir ve bu burada test edilmemiş olmasına rağmen, konakçı arka planının hastalık seyri üzerindeki etkisini değerlendirmek için kolayca kullanılabilir. Sonuç olarak, taşıma ve hastalığın farklı adımlara ayrılması, hem patojenlerin hem de konakçının genetik varyantlarını analiz etme fırsatı sunarak, önemli bir patobiyonun konakçı ile etkileşimlerinin hastalık progresyonunun farklı aşamalarında ayrıntılı olarak incelenmesine olanak tanır. İleriye dönük olarak, bu model savunmasız konakçılar için tedavi seçeneklerini uyarlamak için kullanılabilir.
Açıklamalar
Yazarların açıklayacak çıkar çatışmaları yoktur.
Teşekkürler
Bu yazının eleştirel okuması ve düzenlenmesi için Nick Lenhard'a teşekkür ederiz. Ayrıca bakteri suşları için Andrew Camilli ve Anthony Campagnari'ye ve viral suşlar için Bruce Davidson'a teşekkür ederiz. Bu çalışma, J.L.'ye Ulusal Sağlık Enstitüsü Hibesi (R21AG071268-01) ve Ulusal Sağlık Hibeleri Enstitüsü (R21AI145370-01A1), (R01AG068568-01A1), (R21AG071268-01) tarafından E.N.B.G.'ye desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4-Aminobenzoic acid | Fisher | AAA1267318 | Mix I stock |
| 96-well round bottom plates | Greiner Bio-One | 650101 | |
| 100 µm Filters | Fisher | 07-201-432 | |
| Adenine | Fisher | AC147440250 | Mix I stock |
| Avicel | Fisher | 501785325 | Microcyrstalline cellulose |
| BD Cytofix Fixation Buffer | Fisher | BDB554655 | Fixation Buffer |
| BD Fortessa | Flow cytometer | ||
| BD Intramedic Polyethylene Tubing | Fisher | 427410 | Tubing for nasal lavage |
| BD Disposable Syringes with Luer-Lok Tips (1 mL) | Fisher | 14-823-30 | |
| BD Microtainer Capillary Blood Collector and BD Microgard Closure | Fisher | 02-675-185 | Blood collection tubes |
| Beta-Nicotinamide adenine dinucleotide | Fisher | AAJ6233703 | Mix IV stock |
| Biotin | Fisher | AC230090010 | Vitamin stock |
| C57BL/6J mice | The Jackson Laboratory | #000644 | Mice used in this study |
| Calcium Chloride Anhydrous | Fisher Chemical | C77-500 | Mix I stock |
| CD103 BV 421 | BD Bioscience | BDB562771 | Clone: M290 DF 1:200 |
| CD11b APC | Invitrogen | 50-112-9622 | Clone: M1/70, DF 1:300 |
| CD11c PE | BD Bioscience | BDB565592 | Clone: N418 DF 1:200 |
| CD3 AF 488 | BD Bioscience | OB153030 | Clone: 145-2C11 DF 1:200 |
| CD4 V450 | BD Horizon | BDB560470 | Clone: RM4.5 DF 1:300 |
| CD45 APC eF-780 | BD Bioscience | 50-112-9642 | Clone: 30-F11 DF 1:200 |
| CD45 PE | Invitrogen | 50-103-70 | Clone: 30-F11 DF 1:200 |
| CD8α BV 650 | BD Horizon | BDB563234 | Clone: 53-6.7 DF 1:200 |
| Choline chloride | Fisher | AC110290500 | Final supplement to CDM |
| Corning Disposable Vacuum Filter/Storage Systems | Fisher | 09-761-107 | Filter sterilzation apparatus |
| Corning Tissue Culture Treated T-25 Flasks | Fisher | 10-126-9 | |
| Corning Costar Clear Multiple Well Plates | Fisher | 07-201-590 | |
| Corning DMEM With L-Glutamine and 4.5 g/L Glucose; Without Sodium Pyruvate | Fisher | MT10017CM | |
| Cyanocobalamin | Fisher | AC405925000 | Mix I stock |
| D39 | National Collection of Type Culture (NCTC) | NCTC 7466 | Streptococcus pneumoniae strain |
| D-Alanine | Fisher | AAA1023114 | Mix I stock |
| D-Calcium pantothenate | Fisher | AC243301000 | Vitamin stock |
| Dextrose | Fisher Chemical | D16-500 | Starter stock |
| Dnase | Worthington Biochemical | LS002147 | |
| Eagles Minimum Essential Medium | ATCC | 30-2003 | |
| EDTA | VWR | BDH4616-500G | |
| EF3030 | Center for Disease Control and Prevention | Available via the isolate bank request | Streptococcus pneumoniae strain, request using strain name |
| F480 PE Cy7 | BD Bioscience | 50-112-9713 | Clone: BMB DF 1:200 |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | 50 mL round bottom tube |
| Falcon Round-Bottom Polypropylene Test Tubes With Cap | Fisher | 14-959-11B | 15 mL round bottom tube |
| Falcon Round-Bottom Polystyrene Test Tubes (5 mL) | Fisher | 14-959-5 | FACS tubes |
| FBS | Thermofisher | 10437-028 | |
| Ferric Nitrate Nonahydrate | Fisher | I110-100 | Mix III stock |
| Fisherbrand Delicate Dissecting Scissors | Fisher | 08-951-5 | Instruments used for harvest |
| Fisherbrand Disposable Inoculating Loops | Fisher | 22-363-602 | Inoculating loops |
| Fisherbrand Dissecting Tissue Forceps | Fisher | 13-812-38 | Forceps for harvest |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5 mL | Fisher | 05-408-137 | Micocentrifuge tubes |
| Fisherbrand Sterile Syringes for Single Use (10 mL) | Fisher | 14-955-459 | |
| Folic Acid | Fisher | AC216630500 | Vitamin stock |
| Gibco RPMI 1640 (ATCC) | Fisher | A1049101 | |
| Gibco DPBS, no calcium, no magnesium | Fisher | 14190250 | |
| Gibco HBSS, calcium, magnesium, no phenol red | Fisher | 14025134 | |
| Gibco MEM (Temin's modification) (2x), no phenol red | Fisher | 11-935-046 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher | 15-140-122 | |
| Gibco Trypan Blue Solution, 0.4% | Fisher | 15-250-061 | |
| Gibco Trypsin-EDTA (0.25%), phenol red | Fisher | 25-200-056 | |
| Glycerol (Certified ACS) | Fisher | G33-4 | |
| Glycine | Fisher | AA3643530 | Amino acid stock |
| Guanine | Fisher | AAA1202414 | Mix II stock |
| Invitrogen UltraComp eBeads Compensation Beads | Fisher | 50-112-9040 | |
| Iron (II) sulfate heptahydrate | Fisher | AAA1517836 | Mix III stock |
| L-Alanine | Fisher | AAJ6027918 | Amino acid stock |
| L-Arginine | Fisher | AAA1573814 | Amino acid stock |
| L-Asparagine | Fisher | AAB2147322 | Amino acid stock |
| L-Aspartic acid | Fisher | AAA1352022 | Amino acid stock |
| L-Cysteine | Fisher | AAA1043518 | Amino acid stock |
| L-Cysteine hydrochloride monohydrate | Fisher | AAA1038914 | Final supplement to CDM |
| L-Cystine | Fisher | AAA1376218 | Amino acid stock |
| L-Glutamic acid | Fisher | AC156211000 | Amino acid stock |
| L-Glutamine | Fisher | O2956-100 | Amino acid stock |
| L-Histidine | Fisher | AC166150250 | Amino acid stock |
| LIFE TECHNOLOGIES LIVE/DEAD Fixable Blue Dead Cell Stain Kit, for UV excitation | Invitrogen | 50-112-1524 | Clone: N/A DF 1:500 |
| L-Isoleucine | Fisher | AC166170250 | Amino acid stock |
| L-Leucine | Fisher | BP385-100 | Amino acid stock |
| L-Lysine | Fisher | AAJ6222514 | Amino acid stock |
| L-Methionine | Fisher | AAA1031822 | Amino acid stock |
| Low endotoxin BSA | Sigma Aldrich | A1470-10G | |
| L-Phenylalanine | Fisher | AAA1323814 | Amino acid stock |
| L-Proline | Fisher | AAA1019922 | Amino acid stock |
| L-Serine | Fisher | AC132660250 | Amino acid stock |
| L-Threonine | Fisher | AC138930250 | Amino acid stock |
| L-Tryptophan | Fisher | AAA1023014 | Amino acid stock |
| L-Valine | Fisher | AAA1272014 | Amino acid stock |
| Ly6C BV 605 | BD Bioscience | BDB563011 | Clone: AL-21 DF 1:300 |
| Ly6G AF 488 | Biolegend | NC1102120 | Clone: IA8, DF 1:300 |
| Madin-Darby Canine Kidney (MDCK) cells | American Type Culture Collection (ATCC) | CCL-34 | MDCK cell line for PFU analuysis |
| Magnesium Sulfate 7-Hydrate | Fisher | 60-019-68 | CDM starter stock |
| Manganese Sulfate | Fisher | M113-500 | Mix I stock |
| MilQ water | Ultra-pure water | ||
| Mouse Fc Block | BD Bioscience | BDB553142 | Clone: 2.4G2 DF 1:100 |
| MWI VETERINARY PURALUBE VET OINTMENT | Fisher | NC1886507 | Eye lubricant for infection |
| NCI-H292 mucoepidermoid carcinoma cell line | ATCC | CRL-1848 | H292 lung epithelial cell line for biofilm growth |
| Niacinamide | Fisher | 18-604-792 | Vitamin stock |
| NK 1.1 AF 700 | BD Bioscience | 50-112-4692 | Clone: PK136 DF 1:200 |
| Oxyrase For Broth 50Ml Bottle 1/Pk | Fisher | 50-200-5299 | To remove oxygen from liquid cultures |
| Paraformaldehyde 4% in PBS | Thermoscientific | J19932-K2 | |
| Pivetal Isoflurane | Patterson Veterinary | 07-893-8440 | Isoflurane for anesthesia during infection |
| Potassium Phosphate Dibasic | Fisher Chemical | P288-500 | Starter stock |
| Potassium Phosphate Monobasic | Fisher Chemical | P285-500 | Starter stock |
| Pyridoxal hydrochloride | Fisher | AC352710250 | Vitamin stock |
| Pyridoxamine dihydrochloride | Fisher | AAJ6267906 | Mix I stock |
| Riboflavin | Fisher | AC132350250 | Vitamin stock |
| Sodium Acetate | VWR | 0530-500G | Starter stock |
| Sodium Azide | Fisher Bioreagents | BP922I-500 | For FACS buffer |
| Sodium Bicarbonate | Fisher Chemical | S233-500 | Starter stock and final supplement to CDM |
| Sodium Phosphate Dibasic | Fisher Chemical | S374-500 | Starter stock |
| Sodium Phosphate Monobasic | Fisher Chemical | S369-500 | Starter stock |
| TCR APC | BD Bioscience | 50-112-8889 | Clone: GL-3 DF 1:200 |
| TCRβ APC-Cy7 | BD Pharmigen | BDB560656 | Clone: H57-597 DF 1:200 |
| Thermo Scientific Blood Agar with Gentamicin | Fisher | R01227 | Blood agar plates with the antibiotic gentamicin |
| Thermo Scientific Trypsin, TPCK Treated | Fisher | PI20233 | |
| Thiamine hydrochloride | Fisher | AC148991000 | Vitamin stock |
| TIGR4 | ATCC | BAA-334 | Streptococcus pneumoniae strain |
| Uracil | Fisher | AC157300250 | Mix II stock |
| Worthington Biochemical Corporation Collagenase, Type 2, 1 g | Fisher | NC9693955 |
Referanslar
- Kadioglu, A., Weiser, J. N., Paton, J. C., Andrew, P. W. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nature Reviews Microbiology. 6 (4), 288-301 (2008).
- Obaro, S., Adegbola, R. The pneumococcus: Carriage, disease and conjugate vaccines. Journal of Medical Microbiology. 51 (2), 98-104 (2002).
- Chong, C. P., Street, P. R. Pneumonia in the elderly: A review of the epidemiology, pathogenesis, microbiology, and clinical features. Southern Medical Journal. 101 (11), 1141-1145 (2008).
- Kadioglu, A., Andrew, P. W. Susceptibility and resistance to pneumococcal disease in mice. Briefings in Functional Genomics and Proteomics. 4 (3), 241-247 (2005).
- Ganie, F., et al. Structural, genetic, and serological elucidation of Streptococcus pneumoniae serogroup 24 serotypes: Discovery of a new serotype, 24C, with a variable capsule structure. Journal of Clinical Microbiology. 59 (7), 0054021 (2021).
- Centers for Disease Control and Prevention. Estimates of deaths associated with seasonal influenza --- United States. MMWR. Morbidity and Mortality Weekly Report. 59 (33), 1057-1062 (2010).
- Shrestha, S., et al. Identifying the interaction between influenza and pneumococcal pneumonia using incidence data. Science Translational Medicine. 5 (191), (2013).
- McCullers, J. A. Insights into the interaction between influenza virus and pneumococcus. Clinical Microbiology Reviews. 19 (3), 571-582 (2006).
- Pneumococcal Disease Global Pneumococcal Disease and Vaccine. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/pneumococcal/global.html (2018)
- Grudzinska, F. S., et al. Neutrophils in community-acquired pneumonia: Parallels in dysfunction at the extremes of age. Thorax. 75 (2), 164-171 (2020).
- Boe, D. M., Boule, L. A., Kovacs, E. J. Innate immune responses in the ageing lung. Clinical and Experimental Immunology. 187 (1), 16-25 (2017).
- Krone, C. L., van de Groep, K., Trzcinski, K., Sanders, E. A., Bogaert, D. Immunosenescence and pneumococcal disease: An imbalance in host-pathogen interactions. The Lancet Respiratory Medicine. 2 (2), 141-153 (2014).
- Cho, S. J., et al. Decreased NLRP3 inflammasome expression in aged lung may contribute to increased susceptibility to secondary Streptococcus pneumoniae infection. Experimental Gerontology. 105, 40-46 (2018).
- Disease Burden of Influenza. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/flu/about/burden/index.html (2018)
- McCullers, J. A. The co-pathogenesis of influenza viruses with bacteria in the lung. Nature Reviews Microbiology. 12 (4), 252-262 (2014).
- McCullers, J. A., Rehg, J. E. Lethal synergism between influenza virus and Streptococcus pneumoniae: Characterization of a mouse model and the role of platelet-activating factor receptor. The Journal of Infectious Diseases. 186 (3), 341-350 (2002).
- Metzger, D. W., Sun, K. Immune dysfunction and bacterial coinfections following influenza. Journal of Immunology. 191 (5), 2047-2052 (2013).
- Chao, Y., Marks, L. R., Pettigrew, M. M., Hakansson, A. P. Streptococcus pneumoniae biofilm formation and dispersion during colonization and disease. Frontiers in Cellular and Infection Microbiology. 4, 194 (2014).
- Bogaert, D., De Groot, R., Hermans, P. W. Streptococcus pneumoniae colonisation: The key to pneumococcal disease. The Lancet Infectious Diseases. 4 (3), 144-154 (2004).
- Simell, B., et al. The fundamental link between pneumococcal carriage and disease. Expert Review of Vaccines. 11 (7), 841-855 (2012).
- Marks, L. R., Davidson, B. A., Knight, P. R., Hakansson, A. P. Interkingdom signaling induces Streptococcus pneumoniae biofilm dispersion and transition from asymptomatic colonization to disease. mBio. 4 (4), 00438 (2013).
- Reddinger, R. M., Luke-Marshall, N. R., Sauberan, S. L., Hakansson, A. P., Campagnari, A. A. Streptococcus pneumoniae modulates Staphylococcus aureus biofilm dispersion and the transition from colonization to invasive disease. mBio. 9 (1), 02089 (2018).
- Joma, B. H., et al. A murine model for enhancement of Streptococcus pneumoniae pathogenicity upon viral infection and advanced age. Infection and Immunity. 89 (8), 0047120 (2021).
- Andersson, B., et al. Identification of an active disaccharide unit of a glycoconjugate receptor for pneumococci attaching to human pharyngeal epithelial cells. Journal of Experimental Medicine. 158 (2), 559-570 (1983).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. The Journal of Experimental Medicine. 79 (2), 137-158 (1944).
- Tettelin, H., et al. Complete genome sequence of a virulent isolate of Streptococcus pneumoniae. Science. 293 (5529), 498-506 (2001).
- Tothpal, A., Desobry, K., Joshi, S. S., Wyllie, A. L., Weinberger, D. M. Variation of growth characteristics of pneumococcus with environmental conditions. BMC Microbiology. 19 (1), 304 (2019).
- Bou Ghanem, E. N., et al. Extracellular adenosine protects against Streptococcus pneumoniae lung infection by regulating pulmonary neutrophil recruitment. PLoS Pathogens. 11 (8), 1005126 (2015).
- Bou Ghanem, E. N., et al. The alpha-tocopherol form of vitamin E boosts elastase activity of human PMNs and their ability to kill Streptococcus pneumoniae. Frontiers in Cellular and Infection Microbiology. 7, 161 (2017).
- Tait, A. R., Davidson, B. A., Johnson, K. J., Remick, D. G., Knight, P. R. Halothane inhibits the intraalveolar recruitment of neutrophils, lymphocytes, and macrophages in response to influenza virus infection in mice. Anesthesia & Analgesia. 76 (5), 1106-1113 (1993).
- Aaberge, I. S., Eng, J., Lermark, G., Lovik, M. Virulence of Streptococcus pneumoniae in mice: A standardized method for preparation and frozen storage of the experimental bacterial inoculum. Microbial Pathogenesis. 18 (2), 141-152 (1995).
- McCullers, J. A., Bartmess, K. C. Role of neuraminidase in lethal synergism between influenza virus and Streptococcus pneumoniae. The Journal of Infectious Diseases. 187 (6), 1000-1009 (2003).
- Smith, A. M., McCullers, J. A. Secondary bacterial infections in influenza virus infection pathogenesis. Current Topics in Microbiology and Immunology. 385, 327-356 (2014).
- Cundell, D. R., Gerard, N. P., Gerard, C., Idanpaan-Heikkila, I., Tuomanen, E. I. Streptococcus pneumoniae anchor to activated human cells by the receptor for platelet-activating factor. Nature. 377 (6548), 435-438 (1995).
- Ballinger, M. N., Standiford, T. J. Postinfluenza bacterial pneumonia: Host defenses gone awry. Journal of Interferon & Cytokine Research. 30 (9), 643-652 (2010).
- Sun, K., Metzger, D. W. Inhibition of pulmonary antibacterial defense by interferon-gamma during recovery from influenza infection. Nature Medicine. 14 (5), 558-564 (2008).
- Nakamura, S., Davis, K. M., Weiser, J. N. Synergistic stimulation of type I interferons during influenza virus coinfection promotes Streptococcus pneumoniae colonization in mice. Journal of Clinical Investigation. 121 (9), 3657-3665 (2011).
- Blanchette-Cain, K., et al. Streptococcus pneumoniae biofilm formation is strain dependent, multifactorial, and associated with reduced invasiveness and immunoreactivity during colonization. mBio. 4 (5), 00745 (2013).
- Rello, J., Pop-Vicas, A. Clinical review: Primary influenza viral pneumonia. Critical Care. 13 (6), 235 (2009).
- Torres, A., Loeches, I. M., Sligl, W., Lee, N. Severe flu management: A point of view. Intensive Care Medicine. 46 (2), 153-162 (2020).
- Bakaletz, L. O. Viral-bacterial co-infections in the respiratory tract. Current Opinion in Microbiology. 35, 30-35 (2017).
- Palacios, G., et al. Streptococcus pneumoniae coinfection is correlated with the severity of H1N1 pandemic influenza. PLoS One. 4 (12), 8540 (2009).
- Dhanoa, A., Fang, N. C., Hassan, S. S., Kaniappan, P., Rajasekaram, G. Epidemiology and clinical characteristics of hospitalized patients with pandemic influenza A (H1N1) 2009 infections: The effects of bacterial coinfection. Virology Journal. 8, 501 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır