Method Article
Ein Mausmodell für den Übergang von Streptococcus pneumoniae vom Kolonisator zum Krankheitserreger nach viraler Koinfektion rekapituliert altersbedingte Erkrankung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Diese Arbeit beschreibt ein neuartiges Mausmodell für den Übergang von Pneumokokken von einem asymptomatischen Kolonisator zu einem krankheitsverursachenden Erreger während einer Virusinfektion. Dieses Modell kann leicht angepasst werden, um polymikrobielle und Wirt-Pathogen-Interaktionen während der verschiedenen Phasen des Krankheitsverlaufs und über verschiedene Wirte hinweg zu untersuchen.
Zusammenfassung
Streptococcus pneumoniae (Pneumokokken) ist bei den meisten Menschen ein asymptomatischer Kolonisator des Nasen-Rachen-Raumes, kann sich aber bei einer Infektion mit dem Influenza-A-Virus (IAV) zu einem pulmonalen und systemischen Erreger entwickeln. Das fortgeschrittene Alter erhöht die Anfälligkeit des Wirts für sekundäre Pneumokokken-Pneumonien und ist mit einer Verschlechterung des Krankheitsverlaufs verbunden. Die Wirtsfaktoren, die diese Prozesse antreiben, sind nicht gut definiert, was zum Teil auf einen Mangel an Tiermodellen zurückzuführen ist, die den Übergang von einer asymptomatischen Kolonisierung zu einer schweren klinischen Erkrankung reproduzieren.
Diese Arbeit beschreibt ein neuartiges Mausmodell, das den Übergang von Pneumokokken von der asymptomatischen Übertragung zur Krankheit nach einer Virusinfektion nachbildet. In diesem Modell werden Mäuse zunächst intranasal mit im Biofilm gezüchteten Pneumokokken beimpft, um eine asymptomatische Übertragung zu erreichen, gefolgt von einer IAV-Infektion sowohl des Nasen-Rachenraums als auch der Lunge. Dies führt zu einer bakteriellen Ausbreitung in die Lunge, einer Lungenentzündung und offensichtlichen Krankheitsanzeichen, die bis zur Letalität führen können. Der Grad der Erkrankung ist abhängig vom Bakterienstamm und den Wirtsfaktoren.
Wichtig ist, dass dieses Modell die Anfälligkeit des Alterns reproduziert, denn im Vergleich zu jungen Mäusen zeigen alte Mäuse schwerere klinische Erkrankungen und erliegen häufiger der Krankheit. Durch die Aufteilung von Übertragung und Krankheit in verschiedene Schritte und die Möglichkeit, die genetischen Varianten sowohl des Erregers als auch des Wirts zu analysieren, ermöglicht dieses S. pneumoniae/IAV-Koinfektionsmodell die detaillierte Untersuchung der Interaktionen eines wichtigen Pathobolds mit dem Wirt in verschiedenen Phasen des Krankheitsverlaufs. Dieses Modell kann auch als wichtiges Werkzeug zur Identifizierung potenzieller therapeutischer Ziele gegen sekundäre Pneumokokken-Pneumonien bei empfänglichen Wirten dienen.
Einleitung
Streptococcus pneumoniae (Pneumokokken) sind grampositive Bakterien, die sich asymptomatisch im Nasen-Rachen-Raum der meisten gesunden Personen befinden 1,2. Begünstigt durch Faktoren, die nicht vollständig definiert sind, können Pneumokokken von gutartigen Kolonisatoren des Nasen-Rachen-Raums zu Krankheitserregern übergehen, die sich auf andere Organe ausbreiten und zu schweren Infektionen führen, einschließlich Mittelohrentzündung, Lungenentzündung und Bakteriämie3. Das Erscheinungsbild einer Pneumokokkenerkrankung hängt zum Teil von stammspezifischen Unterschieden ab, einschließlich des Serotyps, der auf der Zusammensetzung der Kapselpolysaccharide basiert. Bisher wurden über 100 Serotypen charakterisiert, von denen einige mit invasiveren Infektionen assoziiert sind 4,5. Mehrere andere Faktoren erhöhen das Risiko einer Pneumokokken-Erkrankung. Ein solcher Faktor ist die Virusinfektion, bei der das Risiko einer Pneumokokken-Pneumonie durch IAV um das 100-fache erhöht ist 6,7. Historisch gesehen ist S. pneumoniae eine der häufigsten Ursachen für sekundäre bakterielle Pneumonien nach Influenza und wird mit schlechteren Ergebnissen in Verbindung gebracht8. Ein weiterer großer Risikofaktor ist das fortgeschrittene Alter. Tatsächlich ist S. pneumoniae die Hauptursache für ambulant erworbene bakterielle Pneumonien bei älteren Menschen über 65 Jahren 9,10. Ältere Menschen machen die Mehrheit (>75%) der Todesfälle aufgrund von Lungenentzündung und Influenza aus, was darauf hindeutet, dass die beiden Risikofaktoren - Alterung und IAV-Infektion - die Krankheitsanfälligkeit synergistisch verschlechtern11,12,13,14. Die Mechanismen, durch die eine Virusinfektion den Übergang von Pneumokokken von asymptomatischen Kolonisatoren zu invasiven Erregern bewirkt, und wie dies durch Wirtsfaktoren beeinflusst wird, sind jedoch noch wenig geklärt. Dies ist vor allem auf das Fehlen eines Kleintiermodells zurückzuführen, das den Übergang von der asymptomatischen Pneumokokken-Besiedlung zur kritischen klinischen Erkrankung rekapituliert.
Koinfektionsstudien wurden klassischerweise an Mäusen durchgeführt, die 7 Tage nach einer Influenzainfektion mit Pneumokokken direkt in die Lunge inokuliert wurden15,16. Dies reproduziert die Anfälligkeit für sekundäre bakterielle Pneumonien und ist ideal, um zu untersuchen, wie antivirale Immunantworten die antibakterielle Abwehr beeinträchtigen17. Längsschnittstudien am Menschen haben jedoch gezeigt, dass der Pneumokokken-Transport im Nasopharynx, wo die Bakterien asymptomatische Biofilme bilden können18, einheitlich mit invasiven Erkrankungen assoziiert ist19,20. Bakterielle Isolate aus Infektionen des Mittelohrs, der Lunge und des Blutes sind genetisch identisch mit denen, die im Nasen-Rachen-Raum vorkommen20. Um den Übergang von einer asymptomatischen Trägerkrankheit zu einer invasiven Erkrankung nach einer IAV-Infektion zu untersuchen, wurde daher ein Modell etabliert, in dem Mäusen intranasal Biofilm-gewachsene Pneumokokken verabreicht wurden, gefolgt von einer IAV-Infektion des Nasopharynx21,22. Eine Virusinfektion der oberen Atemwege führte zu Veränderungen in der Wirtsumgebung, die zur Ausbreitung von Pneumokokken aus Biofilmen und deren Ausbreitung in die unteren Atemwege führten21. Diese dispergierten Bakterien wiesen eine hochregulierte Expression von Virulenzfaktoren auf, die für die Infektion wichtig sind, und wandelten sie von Kolonisatoren in Krankheitserreger um21. Diese Beobachtungen verdeutlichen die komplexe Interaktion zwischen Virus, Wirt und Bakterien und zeigen, dass die durch eine Virusinfektion ausgelösten Veränderungen des Wirts einen direkten Einfluss auf das Verhalten der Pneumokokken haben, was wiederum den Verlauf der bakteriellen Infektion verändert. Dieses Modell ist jedoch nicht in der Lage, die beim Menschen beobachteten schweren Krankheitszeichen zu rekapitulieren, wahrscheinlich weil das Virus auf die Nasenhöhle beschränkt ist und die systemischen Auswirkungen einer Virusinfektion auf die Immunität des Wirts und die Lungenschädigung nicht rekapituliert werden.
Wir haben kürzlich ein Modell entwickelt, das die komplexe Interaktion zwischen Wirt und Krankheitserregern berücksichtigt, aber auch die beim Menschen beobachtete Schwere der Krankheit genauer nachahmt23. In diesem Modell werden Mäuse zunächst intranasal mit im Biofilm gewachsenen Pneumokokken infiziert, um eine asymptomatische Übertragung zu erreichen, gefolgt von einer IAV-Infektion sowohl des Nasen-Rachenraums als auch der Lunge. Dies führte zu einer bakteriellen Ausbreitung in die Lunge, einer Lungenentzündung und einer Erkrankung, die bei einem Bruchteil der jungen Mäuse tödlich endete23. Diese frühere Studie zeigte, dass sowohl eine virale als auch eine bakterielle Infektion die Abwehr des Wirts veränderten: Die Virusinfektion förderte die bakterielle Verbreitung, und eine vorherige bakterielle Besiedlung beeinträchtigte die Fähigkeit des Wirts, den pulmonalen IAV-Spiegel zu kontrollieren23. Die Untersuchung der Immunantwort zeigte, dass eine IAV-Infektion die antibakterielle Aktivität der neutrophilen Granulozyten verringerte, während die bakterielle Besiedlung die für die antivirale Abwehr entscheidende Typ-I-Interferonantwort abstumpfte23. Wichtig ist, dass dieses Modell die Anfälligkeit des Alterns reproduziert. Im Vergleich zu jungen Mäusen zeigten alte Mäuse früher Krankheitsanzeichen, zeigten schwerere klinische Erkrankungen und erlagen häufiger einer Infektion23. Die in diesem Manuskript vorgestellte Arbeit zeigt, dass der Ausmaß der Erkrankung auch vom Bakterienstamm abhängt, da invasive Pneumokokkenstämme eine effizientere Ausbreitung bei IAV-Infektion zeigen, offenkundigere Anzeichen einer Lungenentzündung zeigen und im Vergleich zu nicht-invasiven Stämmen zu beschleunigten Krankheitsraten führen. Somit erlaubt dieses S. pneumoniae/IAV-Koinfektionsmodell die detaillierte Untersuchung sowohl von Erreger- als auch von Wirtsfaktoren und eignet sich gut für die Untersuchung von Immunantworten auf polymikrobielle Infektionen in den verschiedenen Phasen des Krankheitsverlaufs.
Protokoll
Alle Tierversuche wurden in Übereinstimmung mit den Empfehlungen des Leitfadens für die Pflege und Verwendung von Versuchstieren durchgeführt. Alle Verfahren wurden vom Institutional Animal Care and Use Committee der University at Buffalo genehmigt.
1. Herstellung chemisch definierter Medien (CDM)
- Bereiten Sie die Bestände wie folgt vor:
- Die in Tabelle 1 aufgeführten Mischungs-I-Verbindungen werden unter Rühren in 100 ml Reinstwasser gelöst. In 200-μl-Aliquoten bei −20 °C lagern.
- Die in Tabelle 1 aufgeführten Mischung-II-Verbindungen werden in 20 ml 0,1 M NaOH unter Rühren gelöst. In 100-μl-Aliquoten bei −20 °C lagern.
- Die in Tabelle 1 aufgeführten Mischungs-III-Verbindungen werden unter Rühren in 1 ml Reinstwasser gelöst. In 10-μl-Aliquoten bei 4 °C lagern.
- Lösen Sie die in Tabelle 1 aufgeführte Mischung IV-Verbindung unter Rühren in 1 ml Reinstwasser auf. In 10-μl-Aliquoten bei −20 °C lagern.
- Die in Tabelle 2 aufgeführten Verbindungen werden zunächst unter Rühren in 15 ml Reinstwasser gelöst. Stellen Sie den pH-Wert mit ein paar Tropfen 0,1 M NaOH auf 7,0 ein und stellen Sie das Endvolumen mit Reinstwasser auf 20 ml ein. In 1-ml-Aliquoten bei −20 °C lagern.
- Die in Tabelle 3 aufgeführten Verbindungen werden in 90 ml Reinstwasser auf einer Heizplatte bei 50 °C unter Rühren gelöst. Stellen Sie den pH-Wert mit 0,1 M NaOH auf 7,0 ein und stellen Sie dann das Endvolumen mit Reinstwasser auf 100 ml ein. In 5-ml-Aliquoten bei −20 °C lagern.
- Stellen Sie die Starterbrühe jedes Mal frisch her, indem Sie die Verbindungen in Tabelle 4 in 70 ml Reinstwasser unter Rühren auflösen.
- Fügen Sie dem frischen Startervorrat der Reihe nach die folgenden Mischvorräte hinzu: 200 μl Mix I-Vorrat (Tabelle 1), 80 μl Mix II-Vorrat (Tabelle 1), 10 μl Mix III-Vorrat (Tabelle 1), 10 μl Mix IV-Vorrat (Tabelle 2), 1 ml Vitaminvorrat (Tabelle 3) und 5 ml Aminosäurevorrat (Tabelle 4).
- Sobald die Brühen hinzugefügt wurden, stellen Sie das Endvolumen auf 100 ml ein, indem Sie 30 ml Reinstwasser in das Becherglas geben.
- Ergänzen Sie das CDM mit Verbindungen aus Tabelle 4. Nach gründlichem Mischen filtrieren-sterilisieren und bei 4 °C maximal 2 Wochen lagern.
2. Züchtung des Biofilms von S. pneumoniae
- Bereiten Sie RP-10-Medium vor, indem Sie 445 ml RPMI 1640 mit 50 ml hitzeinaktiviertem fötalem Kälberserum (FBS) und 5 ml Penicillin/Streptomycin bei 10.000 U/ml bzw. 10.000 μg/ml mischen.
- Züchten Sie die NCI-H292 (H292) Mukoepidermoidkarzinom-Zelllinie. Geben Sie die Zellen aus einem gekauften Fläschchen in 5 ml RP-10-Medium in einen T-25-Gewebekulturkolben. Bei 37 °C/5% CO2 für 3-5 Tage inkubieren, um eine 100%ige Konfluenz zu erreichen.
- Überprüfen Sie die Zellen unter einem Lichtmikroskop mit 10-facher Vergrößerung, um die Konfluenz zu beurteilen.
HINWEIS: Wenn alle Zellen mit anderen Zellen in Kontakt stehen und keine Lücken dazwischen vorhanden sind, ist die gewünschte 100%ige Konfluenz erreicht. - Waschen Sie die Zellen 2x in 5 ml PBS bei Raumtemperatur. Stellen Sie sicher, dass der Puffer kalziumfrei ist, um eine Chelatbildung des EDTA im folgenden Schritt zu vermeiden.
- 1 ml Trypsin-EDTA in den Kolben geben und bei 37 °C/5% CO2 5-10 min inkubieren, bis sich die Zellen lösen. Neutralisieren Sie mit 4 ml RP-10-Medium. Vorsichtig mischen, indem Sie auf und ab pipettieren und in ein konisches 50-ml-Röhrchen umfüllen.
- Geben Sie 500 μl der Zellsuspension pro Well in eine mit Gewebekulturen behandelte 24-Well-Platte. Von einem konfluenten T-25-Kolben erwarten Sie 2 × 10 6-4 × 106 Zellen/ml.
- Kontrollieren Sie die Zellen am nächsten Tag unter einem Lichtmikroskop, um sicherzustellen, dass sie konfluent sind, wie in Schritt 2.3 beschrieben. Wenn dies nicht der Fall ist, brüten Sie länger.
- Sobald die H292-Zellen in der 24-Well-Platte zu 100 % konfluent sind, waschen Sie die Zellen vorsichtig 3x mit 1 ml PBS bei Raumtemperatur, um sicherzustellen, dass kein Medium mit Antibiotika oder Schmutz zurückbleibt.
- Fügen Sie nach dem Waschen der Zellen 250 μL/Well 4% Paraformaldehyd hinzu, um die Zellen zu fixieren. Entweder 1 h auf Eis oder über Nacht bei 4 °C inkubieren.
- In der Nacht vor der Zellfixierung wird der interessierende S. pneumoniae-Stamm auf Blutagarplatten gestreift und über Nacht bei 37 °C/5 % CO2 inkubiert.
HINWEIS: Die hier vorgestellten Daten beziehen sich auf die folgenden S. pneumoniae-Stämme, die durch kollaborativen Austausch gewonnen wurden: Serotyp 19F Otitis media Isolat EF3030 24, klassischer Serotyp 2 Avery-Stamm D3925 und Serotyp 4 BakteriämieisolatTIGR4 26. Die Stämme sind auch in öffentlichen Sammlungen erhältlich, auf die in der Materialtabelle verwiesen wird. - Bereiten Sie CDM plus Oxyrase (0,15 U/ml) zu, indem Sie 100 μl Oxyrase (30 U/ml) zu 20 ml CDM hinzufügen.
HINWEIS: Oxyrase wird verwendet, um Sauerstoff zu eliminieren, um das effiziente Wachstum von S. pneumoniae in Flüssigkultur27 zu ermöglichen. - Beimpfen Sie die Bakterien von der Platte in frisches CDM + Oxyrase, indem Sie die Bakterien von der Platte waschen, indem Sie 1 ml CDM + Oxyrase hinzufügen und die Bakterienkolonien vorsichtig mit der Seite einer 1-ml-Pipettenspitze anheben, wobei Sie darauf achten, dass der Agar nicht abgekratzt wird. Alternativ können Sie eine Impfschleife verwenden, um die Bakterien anzuheben und sie in ein Röhrchen mit 1 ml CDM + Oxyrase zu impfen.
- Verdünnen Sie die Bakterien in CDM + Oxyrase auf einen Start-OD600 von 0,05.
- Die Bakterien werden in einem locker verschlossenen konischen 50-ml-Röhrchen bei 37 °C/5 % CO 2 gezüchtet, bis ein OD600 von 0,2 erreicht ist (dies dauert zwischen2 und 5 Stunden). Überprüfen Sie den Außendurchmesser600 stündlich, um sicherzustellen, dass der Außendurchmesser 0,2 nicht überschreitet.
- Sobald der OD 0,2 erreicht hat, wird das Bakterienkulturröhrchen vortexiert. Säen Sie 0,5 ml der Bakterien auf die fixierten H292-Zellen und fügen Sie weitere 0,5 ml CDM + Oxyrasemedium pro Vertiefung hinzu. Geben Sie 1 ml CDM + Oxyrase in die Kontrollvertiefungen ohne Bakterien. Die Platte wird 48 h lang bei 34 °C/5 % CO2 inkubiert.
HINWEIS: Das Wachstum bei 34 °C wird verwendet, um die niedrigere Temperatur im Nasopharynx besser nachzuahmen21. - Entfernen Sie alle 12 Stunden nach der ersten Aussaat vorsichtig 0,5 ml des Mediums und füllen Sie es mit 0,5 ml frischem CDM + Oxyrase auf. Achten Sie darauf, den sich bildenden Biofilm nicht zu stören. Überprüfen Sie die Unterseite der Platte auf Biofilm und achten Sie darauf, dass die Trübung im Laufe der Zeit aufgrund des Wachstums des Biofilms zunimmt. Um die Vertiefungen auf Verunreinigungen zu kontrollieren, überprüfen Sie die Vertiefungen ohne Bakterien, um sicherzustellen, dass die Vertiefungen frei bleiben.
- 48 h nach der Impfung den Überstand entfernen und 2x sehr schonend mit 1 ml PBS waschen. In 1 ml frischem CDM resuspendieren und kräftig auf und ab pipettieren, um den Biofilm anzuheben. Für jeden Bakterienstamm werden die Bakterien aus allen Vertiefungen in einem konischen 50-ml-Röhrchen zusammengefasst. Mischen Sie gut, indem Sie das fest verschlossene Röhrchen mehrmals vorsichtig auf und ab kippen.
- In das konische 50-ml-Röhrchen werden 40 % Glycerin in CDM in gleichen Mengen gegeben, um eine bakterielle Suspension mit einer Endkonzentration von 20 % Glycerin zu erhalten. 1 ml in Mikrozentrifugenröhrchen aliquotieren, auf Trockeneis schockgefrieren und bei −80 °C aufbewahren.
- Zählen Sie die Bakterien vor der Verwendung auf, indem Sie ein Aliquot auf Eis auftauen, das Röhrchen 5 Minuten lang bei 1.700 × g drehen, den Überstand entfernen, das Pellet in 1 ml PBS resuspendieren und serielle Verdünnungen auf Blutagarplatten28 plattieren.
- Die Agarplatten werden über Nacht bei 37 °C/5 % CO2 gezüchtet und die Kolonien bei entsprechenden Verdünnungen gezählt, um die Bakterienkonzentration in koloniebildenden Einheiten (KBE)/ml zu erhalten.
HINWEIS: Es wird empfohlen, die Bakterien in den Beständen mindestens einen Tag nach dem Einfrieren oder später zu zählen, da die Lebensfähigkeit der Bakterien innerhalb der ersten 24 Stunden abnimmt. Die eingelagerten gefrorenen Aliquots können für eine anschließende Infektion von Mäusen für maximal 2 Monate verwendet werden.
3. Intranasale Inokulation von Mäusen mit Biofilm-gezüchteten S. pneumoniae
- Kaufen Sie Mäuse und verwenden Sie sie im gewünschten Alter.
HINWEIS: Mäuse im Alter von 3-4 Monaten werden bevorzugt, um junge Wirte zu modellieren, und Mäuse im Alter von 21-24 Monaten können verwendet werden, um ältere Individuen >65 Jahren im Alter von29 Jahren zu modellieren. Die hier vorgestellten Daten beziehen sich auf männliche C57BL/6-Mäuse. - Tauen Sie die im Biofilm gewachsenen bakteriellen Aliquots auf Eis auf und schleudern Sie sie 5 Minuten lang bei 1.700 × g . Entfernen und entsorgen Sie den Überstand vorsichtig, ohne das Pellet zu beschädigen, waschen Sie die Bakterien, indem Sie das Pellet in 1 ml PBS resuspendieren, und schleudern Sie ihn erneut 5 Minuten lang bei 1.700 × g . Entfernen Sie den Überstand und resuspendieren Sie das Pellet in dem Volumen, das erforderlich ist, um die gewünschte Konzentration zu erreichen (5 × 106 KBE/10 μl für die intranasale Inokulation anstreben). Bestätigen Sie die verabreichten Bakterienmengen, indem Sie das vorbereitete Inokulum wie in Schritt 2.19 beschrieben auf Blutagarplatten plattieren.
- Die Mäuse werden intranasal mit 5 × 106 KBE beimpft, indem 5 μl des verdünnten Inokulums in jede Naris pipettiert werden. Achten Sie darauf, die Mäuse fest zu halten und den Kopf zu stabilisieren, bis das Volumen eingeatmet ist (normalerweise innerhalb von Sekunden nach dem Pipettieren des Volumens in die Nasenlöcher). Führen Sie diesen Schritt ohne Anästhesie durch, um eine pulmonale Aspiration des Inokulums zu verhindern.
4. Virusinfektion mit dem Influenza-A-Virus (IAV)
- 48 h nach intranasaler Inokulation mit S. pneumoniae wird der interessierende IAV-Stamm auf Eis aufgetaut.
HINWEIS: Die hier vorgestellten Daten beziehen sich auf einen an die Maus angepassten Stamm des Influenza-A-Virus A/PR/8/34 H1N1, der durch kollaborativen Austausch30 gewonnen wurde. - Sobald das Virus aufgetaut ist, verdünnen Sie das Virus in PBS auf die gewünschte Konzentration. Streben Sie 20 plaquebildende Einheiten (PFU)/50 μl für intratracheale Infektionen und 200 PFU/10 μl für intranasale Infektionen an. Verwenden Sie für Gruppen mit Scheininfektionen und reinen Bakterien PBS, um die Mäuse zu impfen.
- Tragen Sie vor der Narkose ophthalmisches Gleitmittel auf die Augen der Mäuse auf. Betäuben Sie die Mäuse mit 5% Isofluran und bestätigen Sie die Anästhesie durch eine feste Zehenklemme.
- Sobald das Tier betäubt ist, entfernen Sie es aus der Isoflurankammer und infizieren Sie die anästhesierten Mäuse sofort intratracheal mit 50 μl (20 PFU) IAV, wobei Sie eine stumpfe Pinzette verwenden, um die Zunge aus dem Maul zu ziehen und das Flüssigkeitsvolumen in die Luftröhre zu pipettieren.
- Setzen Sie die Mäuse in einen separaten Käfig und überwachen Sie sie, bis sie sich vollständig erholt haben (sie sind in der Lage, die Brustbeinlage beizubehalten [in der Lage, aufrecht auf der Brust zu liegen]).
- Nach der Genesung werden die Mäuse sofort intranasal mit 10 μL (200 PFU) IAV unter Verwendung der Inokulationsmethode in Schritt 3.3 inokuliert.
- Hausmäuse, die eine einzelne oder doppelte bakterielle und virale Infektion mit derselben Infektionsgruppe durchgemacht haben, trennen sie von den anderen Gruppen.
5. Überwachung der Mäuse auf Krankheitssymptome
- Überwachen Sie die Mäuse täglich für mindestens 10 Tage und bewerten Sie blind auf Anzeichen von Krankheit wie folgt:
- Bewerten Sie die Gewichtsabnahme wie folgt: 0 = 5 % oder weniger; 1 = 5%-10%; 2 = 10%-15%; 3 = 20 % oder mehr. Euthanasieren Sie die Mäuse durch CO2 - Inhalation, wenn der Gewichtsverlust bei 3 liegt.
- Bewerten Sie die Aktivität wie folgt: 0 = normal/aktiv; 1 = bewegt, aber leicht vermindert; 2 = vermindert; 3 = stark vermindert/lethargisch (bewegt sich nur bei Berührung), 4 = Koma/unbeweglich. Schläfern Sie die Mäuse ein, wenn der Aktivitätswert bei 3 liegt.
- Bewerten Sie die Körperhaltung wie folgt: 0 = keine Ahnung (normal); 1 = leicht gebeugte Haltung; 2 = starke Vermutung. Euthanasieren Sie die Mäuse, wenn der Haltungswert bei 2 liegt.
- Für die Augen wie folgt bewerten: 0 = normal; 1 = hervorstehend; 1 = versunken; 1 = geschlossen; 1 = Entladung. Es kann eine Kombination sein. Addieren Sie die Summen für den endgültigen Augenwert.
- Bewerten Sie die Atmung wie folgt: 0 = Normale Atmung; 1 = unregelmäßig oder verändert (höhere/niedrigere Rate); 2 = angestrengt (übertriebene Anstrengung oder Keuchen). Euthanasieren Sie die Mäuse, wenn der Atemwert bei 2 liegt.
- Addieren Sie auf der Grundlage der oben genannten Kriterien die Einzelwerte für einen klinischen Gesamtwert von gesund (0) bis extrem krank (15). Betrachten Sie jede Maus, die eine Gesamtpunktzahl über 2 anzeigt, als krank. Lassen Sie alle Mäuse, die eine Gesamtpunktzahl über 9 oder die angegebenen Werte für jedes Kriterium aufweisen, auf humane Weise einschläfern und markieren Sie sie auf der Überlebenskurve.
6. Aufbereitung von infiziertem Gewebe zur Bakterienzählung
- 48 Stunden nach der IAV-Infektion werden die Mäuse eingeschläfert.
- Legen Sie die Maus in Rückenlage. Besprühen Sie mit 70% Ethanol die Brust und den Bauch der Maus, um das Fell zu reinigen. Kneifen Sie das Fell und die Haut mit einer Pinzette in der Mitte der Maus zusammen und schneiden Sie das Fell mit einer 4,5-Zoll-Sezierschere ab, um den Bereich von der Leber bis zur Brust freizulegen.
- Blutentnahme
- Schneiden Sie mit einer Sezierschere vorsichtig in die Bauchhöhle, um die Leber freizulegen. Legen Sie mit einer Pinzette die Leberpfortader an der Oberseite der Leber in der Nähe des Zwerchfells frei. Trennen Sie die Leberpfortader mit der Präparierschere. Sobald sich das Blut in der Peritonealhöhle ansammelt, werden 10 μl Blut mit einer Mikropipette entnommen und in 90 μl gerinnungshemmende Lösung (50 mM EDTA-Lösung in PBS) in ein Mikrozentrifugenröhrchen gegeben, um die Bakterienbelastung zu untersuchen.
- Verwenden Sie eine P-1000-Mikropipette, um den Rest des Blutes zu sammeln, geben Sie es in ein Blutentnahmeröhrchen und zentrifugieren Sie 2 Minuten lang bei 7.600 × g , um das Serum zu gewinnen. Bewahren Sie die Seren in Mikrozentrifugenröhrchen bei −80 °C auf, um anschließend ein gewünschtes Zytokin oder einen gewünschten Metaboliten zu analysieren.
- Lungenentnahme
- Machen Sie mit einer Sezierschere einen Schnitt an den Seiten des freiliegenden Brustkorbs und ziehen Sie die Rippen vorsichtig nach oben in Richtung des Kopfes der Maus, um das Herz freizulegen. Führen Sie eine 25-G-Nadel, die an einer 10-ml-Spritze befestigt ist, die mit PBS vorgefüllt ist, in die rechte Herzkammer ein und beginnen Sie langsam mit der Perfurizierung. Achten Sie auf eine Bleiche der Lunge als Indikator für eine erfolgreiche Durchblutung. Spülen Sie langsam, um einen Bruch des Lungengewebes zu vermeiden.
- Heben Sie das Herz mit der Pinzette an und machen Sie einen Schnitt, um Lunge und Herz zu trennen. Nehmen Sie nach der Trennung alle Lungenlappen mit der Pinzette auf und spülen Sie sie in einer Schale mit sterilem PBS aus, um das restliche Blut zu entfernen. In einer Petrischale die Lunge in kleine Stücke schneiden und gut vermischen. Entfernen Sie die Hälfte der Lungenmischung zur Bestimmung der bakteriellen KBE oder des viralen PFU und legen Sie sie in ein 15-ml-Röhrchen mit rundem Boden, das zur Homogenisierung mit 0,5 ml PBS vorgefüllt ist.
HINWEIS: Es ist wichtig, nicht verschiedene Lappen desselben Lungenflügels für die verschiedenen Untersuchungen zu nehmen. Stattdessen sollten alle Lappen zerkleinert, gut miteinander vermischt und für die verschiedenen Bewertungen gleichmäßig analysiert werden. - Entfernen Sie die andere Hälfte der Lunge für die Durchflusszytometrie (Abschnitt 7 unten) und legen Sie sie in eine mit Nichtgewebekulturen behandelte 24-Well-Platte, wobei jede Vertiefung mit 0,5 ml RP-10 vorgefüllt ist. Bis zur Verarbeitung bei Raumtemperatur stehen lassen.
- Nasopharynx-Kollektion
- Schneiden Sie am Hals mit der Sezierschere das Fell ab, schneiden Sie dann den Muskel ab und legen Sie die Luftröhre frei.
HINWEIS: Die Luftröhre ist eine röhrenartige Struktur, die sich unter dem Muskel befindet. - Platzieren Sie eine kleine Pinzette unter der Luftröhre in einem Abstand von 1 cm vom Kiefer der Maus, um sie zu stabilisieren. Machen Sie mit einer Sezierschere vorsichtig einen 0,1 cm großen Schlitz auf dem vorderen Teil der Luftröhre, um zu vermeiden, dass die Luftröhre vollständig durchtrennt wird.
- Bereiten Sie eine 1-ml-Spritze vor, die mit 0,5 ml PBS gefüllt ist, mit einem 0,58-mm-Schlauch, der an einer 25-g-Nadel befestigt ist. Sammeln Sie die Nasenspülung, indem Sie den Schlauch in die Luftröhre einführen, die nach oben in Richtung Nasopharynx führt. Sobald ein Widerstand in die Nasenhöhle eindringt, platzieren Sie ein Mikrozentrifugenröhrchen an der Nase und spülen Sie das PBS langsam durch die Luftröhre, um die Nasenspülung aufzufangen.
- Platzieren Sie die Maus in Bauchlage. Besprühen Sie den Kopf der Maus mit Ethanol. Verwenden Sie eine Sezierschere, um das Fell zu schneiden, und ein Mystacial-Pad, um den Kopfknochen der Maus freizulegen.
- Machen Sie mit der Präparierschere einen 1 cm langen Schnitt an den Seiten des Unterkiefers und zwischen den Augen. Ziehen Sie die Gesichtsknochen mit einer Pinzette langsam vom Körper weg, um die Nasenhöhle freizulegen.
- Verwenden Sie eine Pinzette, um das Nasengewebe vorsichtig zu entfernen, und legen Sie es zur Homogenisierung in ein rundes Bodenröhrchen, das mit 0,5 ml PBS vorgefüllt ist.
- Schneiden Sie am Hals mit der Sezierschere das Fell ab, schneiden Sie dann den Muskel ab und legen Sie die Luftröhre frei.
- Um das gesammelte Gewebe zu homogenisieren, reinigen Sie zunächst die Homogenisatorsonde, indem Sie sie in 70 % Ethanol einlegen und den Homogenisator 30 s lang mit 60 % Leistung einschalten. Wiederholen Sie den Schritt in sterilem Wasser für 10 s. Homogenisieren Sie jedes Gewebe für 1 min. Reinigen Sie die Homogenisatorsonde zwischen jeder Probe in sterilem Wasser und in einem frischen Röhrchen mit 70%igem Ethanol zwischen jedem Organ und jeder Probengruppe.
- Zählung der Bakterienzahlen
- Sobald alle Organe entnommen und homogenisiert wurden, werden serielle Verdünnungen auf Blutagarplatten aufgetragen. Um die Gesamtkbe zu berechnen, verwenden Sie 10 μl zum Plattieren und notieren Sie das endgültige Volumen in ml für jede Probe. Die Nasopharynxproben werden auf Blutagarplatten plattiert, die mit 3 μg/ml Gentamicin angereichert sind, um das Wachstum von S. pneumoniae zu selektieren und gleichzeitig das Wachstum anderer Mikroorganismen zu hemmen, die dieses Gewebe besiedeln. Über Nacht bei 37 °C/5 % CO2 inkubieren.
- Um die bakterielle KBE für Lunge und Nasopharynx zu zählen, zählen Sie zunächst die Kolonien auf den Blutagarplatten. Verwenden Sie dann Gleichung (1) und Gleichung (2), um die Menge pro ml und die Gesamtzahl zu berechnen.
Menge pro ml = Anzahl der Kolonien × Verdünnungsfaktor × 100 (1)
Gesamtzahl = Menge pro ml × Gesamtvolumen pro Probe (2)
Anmerkungen: In Gleichung (1) wird 100 zur Multiplikation verwendet, da 10 μL plattiert sind, was einer 100-fachen Verdünnung von 1 ml entspricht. Das Gesamtvolumen pro Probe in Gleichung (2) stammt aus Schritt 6.7.1, woraus sich die Nachweisgrenze von 100 pro Organ ergibt. - Um die bakterielle KBE bei Bakteriämie zu zählen, zählen Sie zunächst die Kolonien auf den Blutagarplatten. Verwenden Sie dann Gleichung (3), um die Menge pro ml Blut zu bestimmen.
Menge pro ml Blut = Anzahl der Kolonien × Verdünnungsfaktor × 100 × 10 (3)
ANMERKUNG: In Gleichung (3) wird 100 verwendet, wenn 10 μL plattiert wird, was einer 100-fachen Verdünnung von 1 ml entspricht, und 10 bedeutet eine 1:10-Verdünnung des Blutes in Antikoagulans. Daraus ergibt sich die Nachweisgrenze von 1.000/ml.
7. Aufbereitung der Lungenproben für die Durchflusszytometrie
- Bereiten Sie die erforderlichen Medien wie folgt vor:
- Bereiten Sie RP-10 wie in Schritt 2.1 beschrieben vor.
- Bereiten Sie den Verdauungspuffer vor, indem Sie RP-10 mit 2 mg/ml Kollagenase und 30 μl/ml DNase I mischen.
- Herstellen von Lysepuffer durch Auflösen von 8,29 gNH4Cl, 1 g NaHCO3 und 0,038 g EDTA in 1 LH2O.
- Bereiten Sie 10x FACS-Puffer vor, indem Sie 450 ml HBSS mit 50 ml hitzeinaktiviertem FBS und 5 g Natriumazid mischen.
- Bereiten Sie 1x FACS-Puffer vor, indem Sie 50 ml 10x FACS-Puffer in 450 ml HBSS verdünnen.
- Die Lungenproben aus Schritt 6.4.3 werden entnommen und in eine 24-Well-Platte gegeben. Geben Sie 500 μl Aufschlusspuffer in jede Vertiefung. 45 min bis 1 h bei 37 °C/5% CO2 inkubieren.
- Füllen Sie konische 50-ml-Röhrchen für jede Probe mit 5 ml RP-10 vor. Wenn die Inkubation beendet ist, platzieren Sie einen 100-μm-Filter oben auf dem konischen 50-ml-Röhrchen und benetzen Sie es mit 1 ml RP-10.
- Bewegen Sie die verdaute Lunge mit einer P-1000-Mikropipette und legen Sie sie auf den Filter. Verwenden Sie den Kolben einer 3-ml-Spritze, um das Organ zu zerdrücken. Spülen Sie jedes Mal 2x mit 1 ml RP-10.
- Schleudern Sie die Proben bei 4 °C und 327 × g für 5 min. Saugen Sie den Überstand an und resuspendieren Sie das Pellet in 1 ml Lysepuffer. 3 Minuten einwirken lassen, damit die roten Blutkörperchen lysiert werden können. Mit 5 ml RP-10 neutralisieren.
- Schleudern Sie die Proben bei 4 °C und 327 × g für 5 min. Saugen Sie den Überstand an, resuspendieren Sie das Pellet in 1 ml RP-10 und entnehmen Sie 10 μl zum Zählen der Proben.
- Schleudern Sie die Proben bei 4 °C und 327 × g für 5 min. Saugen Sie den Überstand an und resuspendieren Sie das Pellet in RP-10 bei 2 × 106-4 × 106 Zellen/ml. Von jeder Probe werden 60 μl in eine 96-Well-Platte gegeben, um die gewünschten Zelltypen23 zu färben, die in Schritt 7.9, Tabelle 5 und Tabelle 6 aufgeführt sind.
- Den Teller bei 4 °C und 327 × g 5 min schleudern.
- Bereiten Sie in der Zwischenzeit die Antikörper-Mastermixe, die fluoreszierenden minus eins (FMOs) und die Einzelfärbungskontrollen mit den gewünschten Antikörpern vor. Für die Färbung von polymorphkernigen Leukozyten (PMNs), Makrophagen, Monozyten, dendritischen Zellen und T-Zellen werden die in Tabelle 5 und Tabelle 6 aufgeführten Antikörper und Endverdünnungen verwendet. Verwenden Sie ein Gesamtvolumen von 100 μl/Well der Antikörpermischung. Befolgen Sie die in den Tabellen aufgeführten Verdünnungen, um das geeignete Volumen des Mastermixes und die einzelnen erforderlichen Antikörper zu bestimmen.
- Wenn der Schleudergang beendet ist (Schritt 7.8), wird der Überstand umgefüllt, die Pellets in 100 μl der Antikörpermischungen, FMOs oder Einzelfärbungskontrollen resuspendiert und 30 Minuten lang im Dunkeln auf Eis inkubiert.
- Waschen Sie die Zellen 2x, indem Sie 150 μl FACS-Puffer in die Vertiefungen geben und die Platte 5 Minuten lang bei 4 °C und 327 × g schleudern.
- Wenn der Schleudergang beendet ist, wird der Überstand umgefüllt, die Pellets in 100 μl Fixierungspuffer resuspendiert und 20 Minuten auf Eis inkubiert.
- Waschen Sie die Zellen 2x, indem Sie 150 μl FACS-Puffer in die Vertiefungen geben und die Platte 5 Minuten lang bei 4 °C und 327 × g schleudern.
- Bereiten Sie markierte FACS-Röhrchen mit 200 μl FACS-Puffer vor. Resuspendieren Sie die Pellets in 150 μl FACS-Puffer. Filtern Sie jede Probe einzeln mit einem 100-μm-Filter in das entsprechende FACS-Röhrchen. Auf Eis oder bei 4 °C aufbewahren und bis zur Analyse vor Licht schützen.
- Analysieren Sie die Zellen mit einem Durchflusszytometer.
8. Plaque-Assay zur Zählung von IAV
- Bereiten Sie die erforderlichen Medien wie folgt vor:
- Bereiten Sie das Infektionsmedium vor, indem Sie 2,5 g Kälberserumalbumin (BSA) in 40 ml DMEM unter Rühren bei 37 °C für 10-20 Minuten auflösen, bis es sich aufgelöst hat. Filter-Sterilisation in 460 ml DMEM.
- Bereiten Sie 2,4 % mikrokristalline Cellulose vor, indem Sie 1,2 mg mikrokristalline Cellulose in 50 mlH2Oauflösen. Autoklavieren Sie es auf der Flüssigkeitseinstellung und lagern Sie es bei Raumtemperatur.
- Bereiten Sie 5 % BSA DMEM zu, indem Sie 2,5 g BSA in 40 ml DMEM unter Rühren bei 37 °C für 10-20 Minuten auflösen. Fügen Sie die restlichen 10 ml DMEM hinzu, um ein Endvolumen von 50 ml zu erhalten. Filtersterilisieren und bei 4 °C lagern.
- Bereiten Sie 2x MEM/0,5 % BSA vor, indem Sie 1 ml 5 % BSA DMEM mit 9 ml 2x MEM mischen.
- Herstellen eines niedrigviskosen Overlay-Mediums durch Mischen eines 1:1-Verhältnisses von 2,4 % mikrokristalliner Cellulose und 2x MEM/0,5 % BSA mit 1 mg/ml TPCK (Inhibitor von Chymotrypsin) Trypsin.
- Bereiten Sie EMEM/10 % FBS zu, indem Sie 450 ml Eagle's Minimum Essential Medium (EMEM) mit 50 ml hitzeinaktiviertem FBS mischen.
- Züchten Sie die Madin-Darby-Zelllinie der Hundeniere (MDCK). Geben Sie die Zellen aus einem gekauften Fläschchen in 5 ml EMEM/10 % FBS in einen mit T-25-Gewebekulturen behandelten Kolben. 3-5 Tage bei 37 °C/5% CO2 inkubieren, bis die Zellen 100% Konfluenz erreicht haben. Prüfen Sie, ob die Konfluenz wie in Schritt 2.3 beschrieben ist.
- Entfernen und entsorgen Sie das Nährmedium und spülen Sie es 2x mit 5 ml PBS bei Raumtemperatur aus. 1 ml Trypsin-EDTA in den Kolben geben und bei 37 °C/ 5% CO2 für 10-15 min inkubieren, bis sich die Zellen lösen. Nach dem Anheben mit 4 ml EMEM/10 % FBS neutralisieren, um eine Zellsuspension bei 2 × 105 Zellen/ml zu erhalten.
- Die MDCK-Zellen werden 1 Tag vor Beginn des Plaque-Assays in eine mit 12-Well-Gewebekulturen behandelte Platte eingestreut, indem 1 ml resuspendierte Zellen pro Well (bei 2 × 105 Zellen /Well) hinzugefügt werden.
HINWEIS: Stellen Sie sicher, dass die Zellen vor der Verwendung eine Konfluenz von 100 % erreichen, und inkubieren Sie bei Bedarf länger, um die Konfluenz zu erreichen. - Für die Verwendung als Standard sind 10-fache Reihenverdünnungen (106-10 1) des IAV-Stammes (eines bekannten Titers) in dem in Schritt 8.1.1 aufgeführten Infektionsmedium vorzunehmen. Stellen Sie 1,2 ml jeder Verdünnung her, um sie in dreifacher Ausführung zu testen.
- Tauen Sie die Organhomogenate auf Eis auf. Drehen Sie auf einer Tischzentrifuge mit 2.000 × g herunter und sammeln Sie den klaren Überstand auf.
- Wiederholen Sie Schritt 8.5, jedoch mit dem Überstand aus den Proben in Schritt 8.6.
- Saugen Sie das Medium aus den Zellen ab und waschen Sie es 2x mit 1 ml PBS, um alle FBS zu entfernen.
- Geben Sie 300 μl jeder Standardverdünnung oder seriell verdünnten Probe vorsichtig an der Seite jeder Vertiefung hinzu, beginnend bei der höchsten bis zur niedrigsten Verdünnung, und tun Sie dies in dreifacher Ausfertigung.
- Legen Sie die Platten bei 37 °C/5 % CO2 in den Inkubator und schütteln Sie die Platte alle 10 Minuten für insgesamt 50 Minuten. Achten Sie darauf, sie flach in den Inkubator zu legen und nicht zu stapeln.
- Nach den 50 Minuten waschen Sie die Zellen 2x mit 1 ml PBS.
- Geben Sie 2 ml des niedrigviskosen Overlay-Mediums in jede Vertiefung, mit Ausnahme der Vertiefungen mit der geringsten Verdünnung und der Vertiefungen ohne Viren. Fügen Sie dazu Infektionsmedium und Trypsin hinzu.
- Legen Sie die Platte für 2-4 Tage bei 37 °C/5% CO2 wieder in den Inkubator, um Plaques zu erhalten, die mit bloßem Auge sichtbar sind.
- Waschen Sie die Platten, indem Sie 2 ml PBS schnell von der Seite in jede Vertiefung geben und vorsichtig schütteln, um das abgesetzte, niedrigviskose Overlay-Medium zu suspendieren.
- Entsorgen Sie das gesamte Flüssigkeitsvolumen in der Vertiefung, indem Sie das Medium vorsichtig abpipettieren.
- Wiederholen Sie die Wäsche noch einmal mit 2 ml PBS in jeder Vertiefung und verwerfen Sie dann das gesamte Flüssigkeitsvolumen durch sanftes Pipettieren.
- Um die Plaques zu fixieren, geben Sie 500 μl 4%iges Paraformaldehyd in jede Vertiefung, schütteln Sie es und lassen Sie es 30 Minuten ruhen.
- Waschen Sie die Seite langsam mit 1 ml PBS herunter; Entsorgen Sie dann vorsichtig die Flüssigkeit.
- Geben Sie 500 μl 1% Kristallviolett (in Wasser verdünnt) in jede Vertiefung, um die Zellmonoschicht zu bedecken. 5 min inkubieren.
- Mit 1 ml Leitungswasser waschen. Achten Sie darauf, die gesamte Flüssigkeit in der Vertiefung durch vorsichtiges Pipettieren zu verwerfen. Legen Sie die Platte kopfüber auf eine Windelunterlage, um sie über Nacht zu trocknen.
- Zählen Sie die Plaketten visuell und speichern Sie die Bilder auf einem beliebigen verfügbaren Imager.
Ergebnisse
Biofilm-gezüchtete S. pneumoniae (Abbildung 1A) wurden verwendet, um Mäuse zu infizieren (Abbildung 1B) mit einem kleinen 10-μl-Inokulum, das intranasal an nicht betäubte Mäuse verabreicht wurde. Dieses kleinvolumige Inokulum führt zu einer konsistenten Pneumokokken-Übertragung, die auf den Nasopharynx beschränkt ist (Abbildung 2A, +sp-Gruppen) und gleichzeitig eine systemische Ausbreitung vermeidet (Abbildung 2B, C, +sp-Gruppen). Zwei Tage nach der intranasalen Inokulation wurden die Mäuse mit einem murin-adaptierten H1N1-Influenza-A-Virus A/PR/8/34 (IAV)22,30 infiziert, das sowohl intranasal als auch intratracheal verabreicht wurde, um eine konsistente Abgabe spezifischer Mengen an den Nasopharynx und die Lunge zu erreichen 23.
Hier wurde das Modell verwendet, um den Krankheitsverlauf nach einer Virusinfektion bei Mäusen zu vergleichen, die intranasal mit verschiedenen Stämmen von S. pneumoniae konfrontiert wurden, darunter TIGR4 und D39, invasive Stämme, die zu einer Lungenentzündung führen, die zu einer Bakteriämie fortschreitet, und EF3030, ein Mittelohrentzündungsstamm 21,24,25,26,31. Das Krankheitsbild bei S. pneumoniae/IAV-koinfizierten Mäusen war abhängig vom Bakterienstamm (Abbildung 2). Während es keinen signifikanten Unterschied in der Bakterienzahl des Nasopharynx (Abbildung 2A) zwischen den Stämmen gab, verbreiteten sich S. pneumoniae TIGR4 und D39, aber nicht EF3030, 48 Stunden nach der IAV-Infektion in die Lunge (Abbildung 2B). Vierzig Prozent der Mäuse, die intranasal mit S. pneumoniae TIGR4 infiziert waren, zeigten eine bakterielle Ausbreitung in die Lunge, und von diesen wurde die Hälfte bakteriämisch (Abbildung 2C), was mit früheren Befunden übereinstimmt23.
Mäuse, die intranasal mit S. pneumoniae D39 infiziert waren, zeigten eine effizientere Verbreitung, da bei 100% der koinfizierten Mäuse eine Ausbreitung in die Lunge beobachtet wurde (Abbildung 2B). Ähnlich wie bei S. pneumoniae TIGR4 erlitt die Hälfte von ihnen eine Bakteriämie (Abbildung 2C). Bei der Verfolgung des Gesamtüberlebens, unabhängig vom Bakterienstamm, war die Überlebensrate der koinfizierten Mäuse für alle getesteten Stämme signifikant niedriger als die der Mäuse, die einzeln mit S. pneumoniae allein konfrontiert wurden (Abbildung 2D). Im Vergleich zu den Kontrollmäusen, die nur mit IAV infiziert waren, zeigten die Mäuse, die intranasal mit S. pneumoniae TIGR4 und D39, aber nicht mit EF3030 infiziert waren, beschleunigte Krankheitsraten. Am Tag 2 nach der IAV-Infektion waren 30 % (D39) und 20 % (TIGR4) der Mäuse erlegen, während die reinen IAV-Kontrollgruppen erst am 5. Tag nach der Provokation zu erliegen begannen (Abbildung 2D). Die Mäuse, die gleichzeitig mit S. pneumoniae EF3030 und IAV infiziert waren, zeigten verzögerte Symptome, die eher den reinen IAV-Kontrollen ähnelten (Abbildung 2D). Diese Ergebnisse zeigen, dass das Koinfektionsmodell bei jungen, gesunden Mäusen zu einer Erkrankung führt, die vom Bakterienstamm abhängig ist, was es ideal für die Erforschung der bakteriellen Faktoren macht, die in jedem Schritt des Krankheitsverlaufs erforderlich sind.
Dieses Modell wurde verwendet, um das Vorhandensein verschiedener Immunzellen in der Lunge (Zelltypen und Gating-Strategie in Abbildung 3) nach einer IAV-Infektion bei Mäusen zu untersuchen, die intranasal mit verschiedenen Stämmen von S. pneumoniae inokuliert wurden. Die Bakterienstämme D39 und TIGR4, die sich nach einer IAV-Infektion in die Lunge ausbreiteten, führten zu einem signifikanten Anstieg des Einstroms von entzündlichen Immunzellen aus dem Blutkreislauf, wie z. B. Neutrophile (PMNs) und Monozyten, gegenüber dem Ausgangswert (nicht infiziert), während dies bei EF3030 nicht der Fall war (Abbildung 4A-C). Allein die IAV-Infektion führte zu einem signifikanten Anstieg des Einstroms von Immunzellen, die für die Wirtsabwehr gegen Virusinfektionen wichtig sind, wie z. B. NK-Zellen und gamma-delta T-Zellen (Abbildung 4A-C). Diese antiviralen Antworten waren bei Mäusen, die intranasal mit S. pneumoniae infiziert waren, vor der viralen Herausforderung signifikant abgeschwächt (Abbildung 4A-C). Dies steht im Einklang mit früheren Studien zur Bewertung von Zytokinantworten, die ergaben, dass der Transport von S. pneumoniae die Produktion von Typ-I-Interferonen abstumpft und die Fähigkeit des Wirts beeinträchtigt, die IAV-Belastung in der Lunge zu kontrollieren23. Diese Ergebnisse zeigen, dass das Koinfektionsmodell verwendet werden kann, um zu untersuchen, wie sich die Immunantwort bei mono- und polymikrobiellen Infektionen verändert.
Dieses Modell wurde auch verwendet, um den Einfluss des Alterns auf den Krankheitsverlauf nach IAV-Infektion bei Mäusen zu untersuchen, die intranasal mit S. pneumoniae TIGR4 infiziert waren. Bei einfach infizierten Mäusen variierten die Virustiter nicht zwischen der jungen und der älteren Kohorte (Abbildung 5A)23. Wie in früheren Studien23 zeigten alte Mäuse im Vergleich zu ihren jungen Artgenossen frühere und signifikant schwerere Krankheitsanzeichen, wie die höheren klinischen Werte zeigen (Abbildung 5B). In Übereinstimmung mit den Krankheitssymptomen begannen alte Mäuse, die mit S. pneumoniae geimpft wurden, innerhalb von 24 Stunden nach der IAV-Infektion schneller zu sterben, und alle erlagen der Krankheit, während die jungen Kontrollen die Infektion mit einer signifikant höheren Rate (33%) überlebten (Abbildung 5C). Diese Ergebnisse zeigen, dass das Koinfektionsmodell verwendet werden kann, um schwerere Erkrankungen in anfälligen Wirten zu erkennen, was es ideal für die Erforschung von Wirtsfaktoren macht, die Resistenz oder Anfälligkeit für Koinfektionen verleihen.
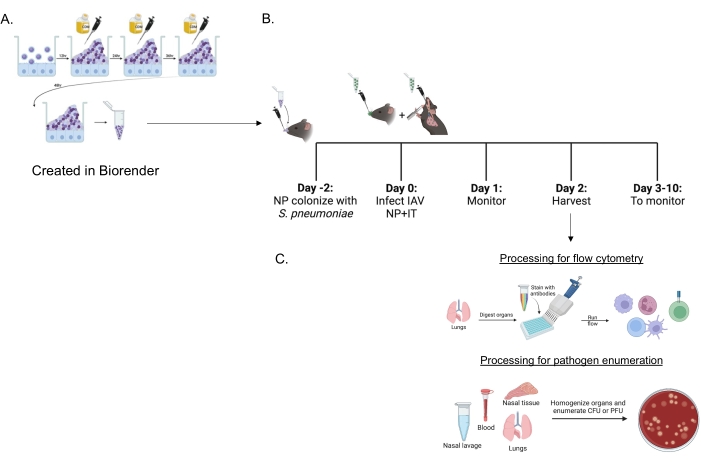
Abbildung 1: Zeitleiste der Koinfektion und Organprozessierung zur Beurteilung des Immunzelleinstroms und der Erregerlast . (A) Streptococcus pneumoniae werden in Biofilmen gezüchtet. (B) Mäuse werden intranasal mit 5 × 106 KBE des indizierten Biofilm-gezüchteten S. pneumoniae-Stammes inokuliert, um eine nasopharyngeale Trägerschaft zu etablieren, oder unbehandelt gelassen. Achtundvierzig Stunden später werden die Mäuse entweder mit PBS vorbehandelt oder erhalten intranasal 200 PFU des Influenza-A-Virus PR8 und intratracheal 20 PFU. Mäuse werden im Laufe der Zeit auf klinische Krankheitswerte und Überleben überwacht. (C) 48 h nach der IAV-Infektion werden bakterielle KBE oder virale PFU in den verschiedenen Organen oder der Einstrom von Immunzellen in die Lunge beurteilt. Abkürzungen: KBE = koloniebildende Einheiten; PFU = plaquebildende Einheiten; IAV = Influenza-A-Virus PR8; IT = intratracheal; NP = nasopharyngeal. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
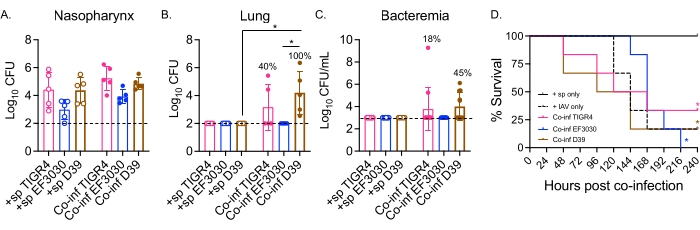
Abbildung 2: Eine duale intranasale/intratracheale IAV-Infektion von S. pneumoniae-inokulierten Mäusen führt zu bakterieller Ausbreitung und Erkrankung, die vom Bakterienstamm abhängig ist. Junge (10-12 Wochen alte) männliche C57BL/6 (B6) Mäuse wurden wie in Abbildung 1 infiziert. Die Bakterienzahlen in (A) Nasopharynx, (B) Lunge und (C) Blut wurden alle 48 h nach IAV-Infektion bestimmt. (B,C) Prozentsätze bezeichnen den Anteil der Mäuse, die eine Ausbreitung aufwiesen. (D) Das Überleben wurde 10 Tage nach der IAV-Infektion überwacht. Es werden gepoolte Daten von (A,B) n = 5, (C) n = 11 und (D) n = 6 Mäusen pro Gruppe angezeigt. Jeder Kreis entspricht einer Maus, und die gestrichelten Linien zeigen die Nachweisgrenze an. (A-C) *, zeigt einen signifikanten Unterschied (p < 0,05) zwischen den angegebenen Gruppen an, der durch den Kruskal-Wallis-Test bestimmt wurde. (D) *, zeigt einen signifikanten Unterschied (p < 0,05) zwischen +sp- und Co-inf-Mäusen pro Bakterienstamm an, der durch den Log-Rank-Test (Mantel-Cox) bestimmt wird. Abkürzungen: +sp = Mäuse, die intranasal nur mit dem angegebenen Stamm mit Bakterien infiziert wurden; Co-inf = bakteriell infizierte Mäuse, die mit IAV infiziert waren; IAV = Mäuse, die das Influenza-A-Virus erhalten haben; KBE = koloniebildende Einheiten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
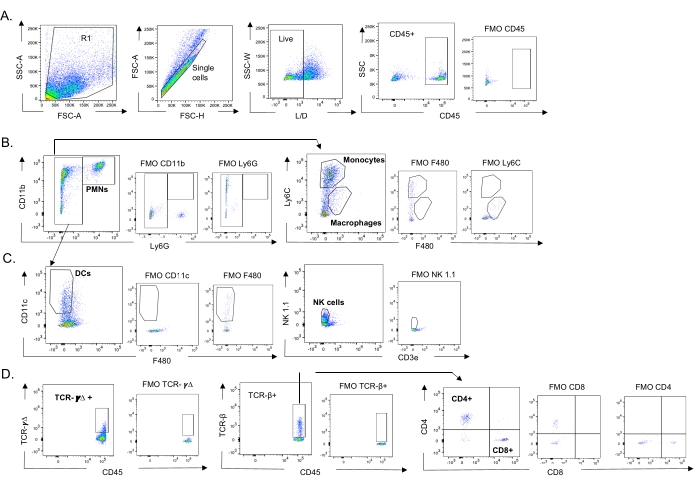
Abbildung 3: Gating-Strategie von Immunzellen. Die Lunge wurde entnommen und der Einstrom von Immunzellen mittels Durchflusszytometrie bestimmt. Die repräsentative Gating-Strategie der verschiedenen Zelltypen wird gezeigt. (A) CD45+, lebende Einzelzellen wurden angesteuert und die prozentualen Anteile von (B) PMNs (Ly6G+, CD11b+), Makrophagen (Ly6G-, Ly6C-, F480+) und Monozyten (Ly6G-, Ly6C+), (C) DCs (Ly6G-, CD11c+) und NK-Zellen (NK1.1+, CD3-), (D) TCR- γΔ und CD8 (CD8+, TCRβ+) und CD4 (CD4+, TCRβ+ ) T-Zellen bestimmt wurden. Abkürzungen: SSC-A = side scatter-peak area; FSC-A = Vorwärts-Streu-Peak-Fläche; FSC-H = Vorwärtsstreu-Peak-Höhe; SSC-W = Breite der seitlichen Streuspitze; L/D = lebend/tot; FMO = fluoreszierend minus eins; NK = natürlicher Killer; PMN = polymorphkernige Leukozyten; DC = dendritische Zelle; TCR = T-Zell-Rezeptor. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
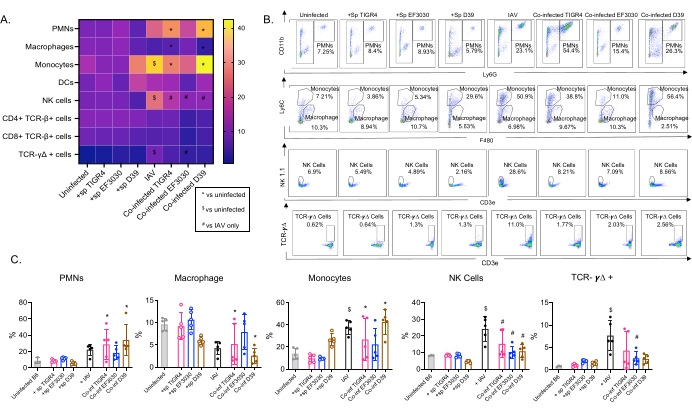
Abbildung 4: Pulmonale Immunantworten sind vom Bakterienstamm abhängig. Junge (10-12 Wochen alte) männliche C57BL/6-Mäuse wurden entweder nicht infiziert, einfach mit dem indizierten Streptococcus pneumoniae-Stamm (+sp) inokuliert, einfach mit IAV (IAV) herausgefordert oder mit S. pneumoniae und IAV (Co-inf) koinfiziert. Achtundvierzig Stunden nach der IAV-Infektion (siehe Versuchsplanung in Abbildung 1) wurde die Lunge entnommen und der Immunzelleinstrom wurde durch Durchflusszytometrie gemäß der Gating-Strategie in Abbildung 3 bestimmt. (A) Die durchschnittlichen Prozentsätze jedes angegebenen Zelltyps innerhalb des CD45-Gates werden für alle Behandlungsgruppen auf der Heatmap angezeigt. (B) Für jede Mausgruppe werden repräsentative Punktdiagramme von Zelltypen gezeigt, die signifikante Unterschiede zwischen den Behandlungen aufwiesen. (C) Die Prozentsätze der angegebenen Immunzelltypen werden angezeigt. Jeder Kreis entspricht einer Maus. (A,C) Es werden gepoolte Daten von n = 5 Mäusen pro Gruppe angezeigt. *, zeigt einen signifikanten Unterschied (p < 0,05) zwischen Co-inf und nicht infiziert an; $, gibt einen signifikanten Wert zwischen IAV und nicht infiziert an; #, zeigt einen signifikanten Unterschied zwischen Co-inf und IAV allein an. Signifikante Unterschiede zwischen den Challenge-Gruppen für jeden Zelltyp wurden durch ANOVA und anschließend durch den Tukey-Test bestimmt. Abkürzungen: NK = Natural Killer; PMN = polymorphkernige Leukozyten; DC = dendritische Zelle; TCR = T-Zell-Rezeptor; IAV = Influenza-A-Virus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
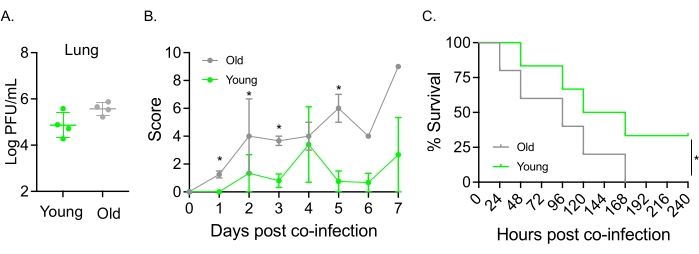
Abbildung 5: Alterung und erhöhte Empfänglichkeit des Wirts für eine Koinfektion mit IAV/Streptococcus pneumoniae . Junge (10-12 Wochen) und ältere (21-22 Monate) männliche C57BL/6-Mäuse wurden mit S. pneumoniae, TIGR4 i.n. und IAV i.n. und i.t. (wie in Abbildung 1) koinfiziert oder einzeln mit IAV allein herausgefordert. (A) Die Virustiter wurden 48 h später bestimmt. Sternchen zeigen die statistische Signifikanz (p < 0,05) an, die durch den t-Test des Schülers bestimmt wird. Die Daten werden von n = 4 Mäusen pro Gruppe gepoolt. (B) Der klinische Score und (C) das Überleben wurden über die Zeit überwacht. (B) Der Mittelwert ± SEM, gepoolt aus n = 6 Mäusen pro Gruppe, wird gezeigt. Sternchen zeigen die statistische Signifikanz (p < 0,05) zwischen den jungen und alten Mäusen zum angegebenen Zeitpunkt an, die durch den Mann-Whitney-Test bestimmt wurde. (C) Die Daten werden von n = 6 Mäusen pro Gruppe gepoolt. Sternchen zeigen die statistische Signifikanz (p < 0,05) zwischen den jungen und alten Mäusen an, die durch den Log-Rank-Test (Mantel-Cox) bestimmt wird. Abkürzungen: IAV = Influenza-A-Virus; i.n. = intranasal; i.t. = intratracheal; SEM = Standardfehler des Mittelwerts. Abbildung 5A wird mit Genehmigung von Joma et al.23 abgedruckt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Mix I Bestand für CDM | |
| Adenin | 0,1 g |
| D-Alanin | 0,25 g |
| CaCl2 wasserfrei | 0,025 g |
| Mangansulfat | 0,03 g |
| Cyanocobalamin | 100 μl von 10 mg/ml Vorrat |
| Para-Aminobenzoesäure | 400 μl von 5 mg/ml Vorrat |
| Pyridoxamin 2HCl | 100 μl von 10 mg/ml Vorrat |
| Mix II Bestand für CDM | |
| Guanin | 0,05 g |
| Uracil | 0,05 g |
| Mix III Schaft für CDM | |
| Eisen(III)-nitrat 9H2O | 50 mg/ml |
| Eisen(III)-sulfat 7H2O | 10 mg/ml |
| Mix IV-Bestand für CDM | |
| Beta-Nicotinamid-Adenin-Dinukleotid | 25 mg/ml |
Tabelle 1: Mix I-, II-, III- und IV-Bestände für CDM. Abkürzung: CDM = chemisch definierte Medien.
| Vitamin-Mix-Brühe für CDM | |
| Pyridoxalhydrochlorid | 0,8 g |
| Thiamin Cl2 | 0,4 g |
| Riboflavin | 0,4 g |
| Ca-Pantothenat | 0,4 g |
| Biotin | 0,04 g |
| Folsäure | 0,4 g |
| Niacinamid | 0,4 g |
Tabelle 2: Vitamin-Mix-Bestand für CDM. Abkürzung: CDM = chemisch definierte Medien.
| Aminosäurestock für CDM | |
| L-Alanin | 0,480 g |
| L-Arginin | 0,250 g |
| L-Asparagin | 0,700 g |
| L-Asparaginsäure | 0,600 g |
| L-Cystein | 1.000 g |
| L-Cystin | 0,100 g |
| L-Glutaminsäure | 0,200 g |
| L-Glutamin | 0,780 g |
| L-Glycin | 0.350 g |
| L-Histidin | 0.300 g |
| L-Isoleucin | 0,430 g |
| L-Leucin | 0,950 g |
| L-Lysin | 0,880 g |
| L-Methionin | 0,250 g |
| L-Phenylalanin | 0,550 g |
| L-Prolin | 1.350 g |
| L-Serin | 0,680 g |
| L-Threonin | 0,450 g |
| L-Tryptophan | 0,100 g |
| L-Valin | 0,650 g |
Tabelle 3: Aminosäurestock für CDM. Abkürzung: CDM = chemisch definierte Medien.
| Starter Stock für CDM | |
| Dextrose | 1,0 g |
| Magnesiumsulfat-7-Hydrat | 0,070 g |
| Kaliumphosphat dibasisch | 0,02 g |
| Kaliumphosphat monobasisch | 0,1 g |
| Natriumacetat wasserfrei | 0,45 g |
| Natriumbicarbonat | 0,25 g |
| Natriumphosphat dibasisch | 0,735 g |
| Natriumphosphat monobasisch | 0,32 g |
| Abschließende Ergänzungen für CDM | |
| Cholinchlorid | 0,1 g |
| L-Cystein HCl | 0,075 g |
| Natriumbicarbonat | 0,25 g |
Tabelle 4: Vorrat und Endnachträge für CDM. Abkürzung: CDM = chemisch definierte Medien.
| Antikörper/Fluorophor | Klonen | Verdünnungsfaktor |
| L/D für UV-Anregung | N/A | 0.38888889 |
| Ly6G AF 488 | 1A8 | 0.25 |
| CD11b Schützenpanzer | M1/70 | 0.25 |
| CD11c PE | N418 | 0.18055556 |
| Maus-Fc-Block | 2.4G2 | 0.11111111 |
| F4/80 PE Cy7 | BM8 | 0.18055556 |
| Ly6C BV605 | AL-21 | 0.25 |
| CD103 BV 421 | M290 | 0.18055556 |
| CD45 APC-eF-780 | 30-F11 | 0.18055556 |
Tabelle 5: Antikörper-Panel 1.
| Antikörper/Fluorophor | Klonen | Verdünnungsfaktor |
| L/D für UV-Anregung | N/A | 0.388888889 |
| TCR-β Schützenpanzer Cy7 | H57-597 | 0.180555556 |
| CD4 V450 (Pazifisch Blau) | RM4-5 | 0.25 |
| CD8 BV650 | 53-6.7 | 0.180555556 |
| Maus-Fc-Block | 2.4G2 | 0.111111111 |
| CD45 PE | 30-F11 | 0.180555556 |
| CD3 AF488 | 145-2C11 | 0.180555556 |
| TCR- γΔ APC | GL-3 | 0.180555556 |
| NK1.1 AF 700 | PK136 | 0.180555556 |
Tabelle 6: Antikörper-Panel 2.
Diskussion
Die meisten der existierenden experimentellen Studien zu S. pneumoniae/IAV-Koinfektionen beruhen auf der bakteriellen Abgabe in die Lunge von Mäusen, die bereits mit IAV infiziert waren. Diese Modelle haben dazu beigetragen, Veränderungen im Lungenmilieu und in der systemischen Immunantwort zu identifizieren, die den Wirt anfällig für sekundäre bakterielle Infektionen machen 15,16,17,32,33,34,35,36,37. Diese Modelle haben es jedoch nicht geschafft, den Übergang von S. pneumoniae von einem asymptomatischen Kolonisator zu einem Erreger nachzuahmen, der schwere Lungen- und systemische Infektionen verursachen kann. Darüber hinaus sind diese Modelle nicht geeignet, um die Wirtsfaktoren und Wirt-Pathogen-Interaktionen in den oberen Atemwegen zu untersuchen, die zur Anfälligkeit für Infektionen beitragen. Ein früheres Modell für die Bewegung von Pneumokokken vom Nasopharynx in die Lunge nach einer IAV-Infektion beruhte auf einer bakteriellen Infektion des Nasopharynx gefolgt von einer Virusinfektion. Die bei menschlichen Patienten beobachteten schweren Krankheitssymptome konnten jedoch nicht reproduziertwerden 21. Das hier beschriebene modifizierte murine Infektionsmodell rekapituliert den Übergang von S. pneumoniae von einer asymptomatischen Übertragung zu einem Erreger, der eine schwere klinische Erkrankung verursacht.
Ein wichtiger Schritt dieses Modells ist die Etablierung einer S. pneumoniae-Infektion im Nasen-Rachenraum. Streptococcus pneumoniae bilden Biofilme und besiedeln den Nasopharynx mit unterschiedlichen Wirkungsgraden21,38. Um eine konsistente Infektion herzustellen, sind mindestens 5 × 106 KBE der bisher getesteten Biofilm-gezüchteten Bakterienstämme erforderlich23. Es wird empfohlen, jeden neuen Bakterienstamm vor einer Virusinfektion auf eine stabile Infektion des Nasen-Rachen-Raums zu testen. Für die virale Koinfektion haben frühere Studien ergeben, dass eine intranasale Infektion mit IAV für die Ausbreitung der Bakterien aus dem Nasopharynx erforderlich ist21,22,23. In diesen früheren Studien wurden 500 PFU IAV für die intranasale Verabreichung verwendet, während in dieser Studie 200 PFU ausreichten, um die Bakterienzahl im Nasopharynx zu erhöhen. Die IAV-Infektion ist nicht auf die oberen Atemwege beschränkt und kann sich auf die Lunge ausbreiten39,40, was entscheidend ist, um das Lungenmilieu für bakterielle Infektionen durchlässiger zu machen15,16,41. Die Abgabe von IAV in die Lunge kann entweder durch intranasale Verabreichung oder intratracheale Implantation von anästhesierten Mäusen erfolgen. Frühere Arbeiten mit BALB/cByJ-Mäusen ergaben, dass die intranasale Verabreichung zu einer viralen Pneumonie führt21; Der Zugang des Inokulums zur Lunge nach intranasaler Inokulation ist bei C57BL/6-Mäusen jedoch eingeschränkter. Bei C57BL/6-Mäusen ist eine intratracheale Implantation für eine konsistente Abgabe des Virus erforderlich23. In diesem Modell beschleunigt eine vorherige bakterielle Besiedlung das Auftreten von Krankheitssymptomen nach Virusinfektion23. Da eine Virusinfektion selbst Krankheitssymptome mit potenzieller Variation der Kinetik verursachen kann, wird empfohlen, zunächst eine Reihe von Dosen für jeden neu getesteten Virusstamm zu testen und eine Dosis zu wählen, die eine beschleunigte Kinetik in koinfizierten Wirten zeigt.
Die Lunge liefert in diesem Modell einen weiteren wichtigen Messwert für die Bewertung von Krankheiten. Für die Abschätzung der Erregerlast und des Immunzelleinstroms kann eine Lunge derselben Maus verwendet werden. Da der Schweregrad der Infektion und der Entzündung jedoch zwischen den Lappen unterschiedlich sein können, wird empfohlen, für die verschiedenen Untersuchungen keine verschiedenen Lappen derselben Lunge zu verwenden. Vielmehr können alle Lappen in kleine Stücke zerkleinert, gut miteinander vermischt und dann für die verschiedenen Bewertungen gleichmäßig analysiert werden. In ähnlicher Weise kann der Nasopharynx für die Zählung von bakterieller KBE oder viraler PFU und der Immunantwort verwendet werden. Die Anzahl der Zellen, die aus den Waschungen und dem Gewebe gewonnen werden, ist jedoch zu gering, um eine Durchflusszytometrie durchzuführen, ohne die Proben von Mäusen innerhalb derselben Gruppe zusammenzufassen. Alternativ kann eine Entzündung im Nasen-Rachen-Raum histologisch beurteiltwerden 23.
Ein entscheidendes Merkmal dieses Modells ist, dass es die klinische Erkrankung, die bei Patienten beobachtet wurde, rekapituliert. Beim Menschen führt eine sekundäre Pneumokokken-Pneumonie nach einer IAV-Infektion häufig zu offensichtlichen Krankheitsanzeichen wie Husten, Dyspnoe, Fieber und Muskelschmerzen, die zu Krankenhausaufenthalten, Atemversagen und sogar zum Tod führen können 8,15,42,43. Dieses Modell rekapituliert die schweren Anzeichen klinischer Erkrankungen, die beim Menschen in Bezug auf Atembeschwerden (die sich im Atemwert widerspiegeln) und allgemeines Unwohlsein (spiegelt sich in den Haltungs- und Bewegungswerten wider) der Mäuse sowie den Tod bei einigen der gesunden jungen Kontrollen beobachtet haben. Die verschlimmerten Krankheitssymptome bei koinfizierten Mäusen sind wahrscheinlich sowohl auf die bakterielle Ausbreitung in die Lunge als auch auf eine gestörte Virusclearance bei Mäusen mit Pneumokokken-Trägerzurückzuführen 23. Eine Einschränkung des Modells besteht darin, dass die Inzidenz klinischer Erkrankungen und bakterieller Ausbreitung aus dem Nasopharynx zwischen Mäusen variiert und vom Bakterienstamm, dem Wirtsalter und dem Genotypbeeinflusst wird 21,22,23. Aus diesem Grund kann bei invasiven Stämmen das Fortschreiten von einer lokalisierten Infektion (ohne nachweisbare Bakteriämie) bis zum Tod innerhalb von 24 Stunden erfolgen. Um eine echte Beurteilung der systemischen Ausbreitung zu erhalten, sollte die Bakteriämie daher in kürzeren Intervallen (alle 6-12 Stunden) beobachtet werden. Ebenso kann sich der Krankheitsscore schnell ändern, insbesondere in den ersten 72 Stunden nach einer Koinfektion. Um die Krankheitssymptome genau zu verfolgen, ist es daher ratsam, die Mäuse dreimal täglich an den Tagen 1-3 nach der IAV-Infektion zu überwachen.
Zusammenfassend lässt sich sagen, dass dieses Modell die Bewegung von S. pneumoniae von einem asymptomatischen Kolonisator des Nasopharynx zu einem Erreger repliziert, der bei einer IAV-Infektion eine pulmonale und systemische Erkrankung verursachen kann. In diesem Modell löst IAV den Übergang von S. pneumoniae aus, indem es das bakterielle Verhalten im Nasopharynx modifiziert, die bakterielle Ausbreitung in die Lunge erhöht und die antibakterielle Immunität verändert23. In ähnlicher Weise stumpft die bakterielle Übertragung die antiviralen Immunantworten ab und beeinträchtigt die IAV-Clearance aus der Lunge23. Dies macht dieses Modell ideal für die Analyse von Veränderungen in der Immunantwort bei einzelnen und polymikrobiellen Infektionen. Darüber hinaus ist der Krankheitsverlauf nach einer Koinfektion zum Teil vom Pneumokokkenstamm im Nasen-Rachen-Raum abhängig. Daher eignet sich das Modell, um die bakteriellen Faktoren zu analysieren, die für die asymptomatische Besiedlung im Vergleich zur pathogenen Transition von S. pneumoniae erforderlich sind. Schließlich reproduziert dieses Modell die Anfälligkeit des Alterns für Koinfektionen, und obwohl dies hier nicht getestet wurde, kann es leicht verwendet werden, um den Einfluss des Wirtshintergrunds auf den Krankheitsverlauf zu beurteilen. Zusammenfassend lässt sich sagen, dass die Aufteilung von Übertragung und Krankheit in verschiedene Schritte die Möglichkeit bietet, die genetischen Varianten sowohl der Erreger als auch des Wirts zu analysieren, was eine detaillierte Untersuchung der Interaktionen eines wichtigen Pathobionten mit dem Wirt in verschiedenen Phasen des Krankheitsverlaufs ermöglicht. In Zukunft kann dieses Modell verwendet werden, um Behandlungsoptionen für gefährdete Wirte maßzuschneidern.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Wir danken Nick Lenhard für die kritische Lektüre und Bearbeitung dieses Manuskripts. Wir möchten uns auch bei Andrew Camilli und Anthony Campagnari für die Bakterienstämme und Bruce Davidson für die Virusstämme bedanken. Diese Arbeit wurde unterstützt durch das National Institute of Health Grant (R21AG071268-01) an J.L. und das National Institute of Health Grants (R21AI145370-01A1), (R01AG068568-01A1), (R21AG071268-01) an E.N.B.G.
Materialien
| Name | Company | Catalog Number | Comments |
| 4-Aminobenzoic acid | Fisher | AAA1267318 | Mix I stock |
| 96-well round bottom plates | Greiner Bio-One | 650101 | |
| 100 µm Filters | Fisher | 07-201-432 | |
| Adenine | Fisher | AC147440250 | Mix I stock |
| Avicel | Fisher | 501785325 | Microcyrstalline cellulose |
| BD Cytofix Fixation Buffer | Fisher | BDB554655 | Fixation Buffer |
| BD Fortessa | Flow cytometer | ||
| BD Intramedic Polyethylene Tubing | Fisher | 427410 | Tubing for nasal lavage |
| BD Disposable Syringes with Luer-Lok Tips (1 mL) | Fisher | 14-823-30 | |
| BD Microtainer Capillary Blood Collector and BD Microgard Closure | Fisher | 02-675-185 | Blood collection tubes |
| Beta-Nicotinamide adenine dinucleotide | Fisher | AAJ6233703 | Mix IV stock |
| Biotin | Fisher | AC230090010 | Vitamin stock |
| C57BL/6J mice | The Jackson Laboratory | #000644 | Mice used in this study |
| Calcium Chloride Anhydrous | Fisher Chemical | C77-500 | Mix I stock |
| CD103 BV 421 | BD Bioscience | BDB562771 | Clone: M290 DF 1:200 |
| CD11b APC | Invitrogen | 50-112-9622 | Clone: M1/70, DF 1:300 |
| CD11c PE | BD Bioscience | BDB565592 | Clone: N418 DF 1:200 |
| CD3 AF 488 | BD Bioscience | OB153030 | Clone: 145-2C11 DF 1:200 |
| CD4 V450 | BD Horizon | BDB560470 | Clone: RM4.5 DF 1:300 |
| CD45 APC eF-780 | BD Bioscience | 50-112-9642 | Clone: 30-F11 DF 1:200 |
| CD45 PE | Invitrogen | 50-103-70 | Clone: 30-F11 DF 1:200 |
| CD8α BV 650 | BD Horizon | BDB563234 | Clone: 53-6.7 DF 1:200 |
| Choline chloride | Fisher | AC110290500 | Final supplement to CDM |
| Corning Disposable Vacuum Filter/Storage Systems | Fisher | 09-761-107 | Filter sterilzation apparatus |
| Corning Tissue Culture Treated T-25 Flasks | Fisher | 10-126-9 | |
| Corning Costar Clear Multiple Well Plates | Fisher | 07-201-590 | |
| Corning DMEM With L-Glutamine and 4.5 g/L Glucose; Without Sodium Pyruvate | Fisher | MT10017CM | |
| Cyanocobalamin | Fisher | AC405925000 | Mix I stock |
| D39 | National Collection of Type Culture (NCTC) | NCTC 7466 | Streptococcus pneumoniae strain |
| D-Alanine | Fisher | AAA1023114 | Mix I stock |
| D-Calcium pantothenate | Fisher | AC243301000 | Vitamin stock |
| Dextrose | Fisher Chemical | D16-500 | Starter stock |
| Dnase | Worthington Biochemical | LS002147 | |
| Eagles Minimum Essential Medium | ATCC | 30-2003 | |
| EDTA | VWR | BDH4616-500G | |
| EF3030 | Center for Disease Control and Prevention | Available via the isolate bank request | Streptococcus pneumoniae strain, request using strain name |
| F480 PE Cy7 | BD Bioscience | 50-112-9713 | Clone: BMB DF 1:200 |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | 50 mL round bottom tube |
| Falcon Round-Bottom Polypropylene Test Tubes With Cap | Fisher | 14-959-11B | 15 mL round bottom tube |
| Falcon Round-Bottom Polystyrene Test Tubes (5 mL) | Fisher | 14-959-5 | FACS tubes |
| FBS | Thermofisher | 10437-028 | |
| Ferric Nitrate Nonahydrate | Fisher | I110-100 | Mix III stock |
| Fisherbrand Delicate Dissecting Scissors | Fisher | 08-951-5 | Instruments used for harvest |
| Fisherbrand Disposable Inoculating Loops | Fisher | 22-363-602 | Inoculating loops |
| Fisherbrand Dissecting Tissue Forceps | Fisher | 13-812-38 | Forceps for harvest |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5 mL | Fisher | 05-408-137 | Micocentrifuge tubes |
| Fisherbrand Sterile Syringes for Single Use (10 mL) | Fisher | 14-955-459 | |
| Folic Acid | Fisher | AC216630500 | Vitamin stock |
| Gibco RPMI 1640 (ATCC) | Fisher | A1049101 | |
| Gibco DPBS, no calcium, no magnesium | Fisher | 14190250 | |
| Gibco HBSS, calcium, magnesium, no phenol red | Fisher | 14025134 | |
| Gibco MEM (Temin's modification) (2x), no phenol red | Fisher | 11-935-046 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher | 15-140-122 | |
| Gibco Trypan Blue Solution, 0.4% | Fisher | 15-250-061 | |
| Gibco Trypsin-EDTA (0.25%), phenol red | Fisher | 25-200-056 | |
| Glycerol (Certified ACS) | Fisher | G33-4 | |
| Glycine | Fisher | AA3643530 | Amino acid stock |
| Guanine | Fisher | AAA1202414 | Mix II stock |
| Invitrogen UltraComp eBeads Compensation Beads | Fisher | 50-112-9040 | |
| Iron (II) sulfate heptahydrate | Fisher | AAA1517836 | Mix III stock |
| L-Alanine | Fisher | AAJ6027918 | Amino acid stock |
| L-Arginine | Fisher | AAA1573814 | Amino acid stock |
| L-Asparagine | Fisher | AAB2147322 | Amino acid stock |
| L-Aspartic acid | Fisher | AAA1352022 | Amino acid stock |
| L-Cysteine | Fisher | AAA1043518 | Amino acid stock |
| L-Cysteine hydrochloride monohydrate | Fisher | AAA1038914 | Final supplement to CDM |
| L-Cystine | Fisher | AAA1376218 | Amino acid stock |
| L-Glutamic acid | Fisher | AC156211000 | Amino acid stock |
| L-Glutamine | Fisher | O2956-100 | Amino acid stock |
| L-Histidine | Fisher | AC166150250 | Amino acid stock |
| LIFE TECHNOLOGIES LIVE/DEAD Fixable Blue Dead Cell Stain Kit, for UV excitation | Invitrogen | 50-112-1524 | Clone: N/A DF 1:500 |
| L-Isoleucine | Fisher | AC166170250 | Amino acid stock |
| L-Leucine | Fisher | BP385-100 | Amino acid stock |
| L-Lysine | Fisher | AAJ6222514 | Amino acid stock |
| L-Methionine | Fisher | AAA1031822 | Amino acid stock |
| Low endotoxin BSA | Sigma Aldrich | A1470-10G | |
| L-Phenylalanine | Fisher | AAA1323814 | Amino acid stock |
| L-Proline | Fisher | AAA1019922 | Amino acid stock |
| L-Serine | Fisher | AC132660250 | Amino acid stock |
| L-Threonine | Fisher | AC138930250 | Amino acid stock |
| L-Tryptophan | Fisher | AAA1023014 | Amino acid stock |
| L-Valine | Fisher | AAA1272014 | Amino acid stock |
| Ly6C BV 605 | BD Bioscience | BDB563011 | Clone: AL-21 DF 1:300 |
| Ly6G AF 488 | Biolegend | NC1102120 | Clone: IA8, DF 1:300 |
| Madin-Darby Canine Kidney (MDCK) cells | American Type Culture Collection (ATCC) | CCL-34 | MDCK cell line for PFU analuysis |
| Magnesium Sulfate 7-Hydrate | Fisher | 60-019-68 | CDM starter stock |
| Manganese Sulfate | Fisher | M113-500 | Mix I stock |
| MilQ water | Ultra-pure water | ||
| Mouse Fc Block | BD Bioscience | BDB553142 | Clone: 2.4G2 DF 1:100 |
| MWI VETERINARY PURALUBE VET OINTMENT | Fisher | NC1886507 | Eye lubricant for infection |
| NCI-H292 mucoepidermoid carcinoma cell line | ATCC | CRL-1848 | H292 lung epithelial cell line for biofilm growth |
| Niacinamide | Fisher | 18-604-792 | Vitamin stock |
| NK 1.1 AF 700 | BD Bioscience | 50-112-4692 | Clone: PK136 DF 1:200 |
| Oxyrase For Broth 50Ml Bottle 1/Pk | Fisher | 50-200-5299 | To remove oxygen from liquid cultures |
| Paraformaldehyde 4% in PBS | Thermoscientific | J19932-K2 | |
| Pivetal Isoflurane | Patterson Veterinary | 07-893-8440 | Isoflurane for anesthesia during infection |
| Potassium Phosphate Dibasic | Fisher Chemical | P288-500 | Starter stock |
| Potassium Phosphate Monobasic | Fisher Chemical | P285-500 | Starter stock |
| Pyridoxal hydrochloride | Fisher | AC352710250 | Vitamin stock |
| Pyridoxamine dihydrochloride | Fisher | AAJ6267906 | Mix I stock |
| Riboflavin | Fisher | AC132350250 | Vitamin stock |
| Sodium Acetate | VWR | 0530-500G | Starter stock |
| Sodium Azide | Fisher Bioreagents | BP922I-500 | For FACS buffer |
| Sodium Bicarbonate | Fisher Chemical | S233-500 | Starter stock and final supplement to CDM |
| Sodium Phosphate Dibasic | Fisher Chemical | S374-500 | Starter stock |
| Sodium Phosphate Monobasic | Fisher Chemical | S369-500 | Starter stock |
| TCR APC | BD Bioscience | 50-112-8889 | Clone: GL-3 DF 1:200 |
| TCRβ APC-Cy7 | BD Pharmigen | BDB560656 | Clone: H57-597 DF 1:200 |
| Thermo Scientific Blood Agar with Gentamicin | Fisher | R01227 | Blood agar plates with the antibiotic gentamicin |
| Thermo Scientific Trypsin, TPCK Treated | Fisher | PI20233 | |
| Thiamine hydrochloride | Fisher | AC148991000 | Vitamin stock |
| TIGR4 | ATCC | BAA-334 | Streptococcus pneumoniae strain |
| Uracil | Fisher | AC157300250 | Mix II stock |
| Worthington Biochemical Corporation Collagenase, Type 2, 1 g | Fisher | NC9693955 |
Referenzen
- Kadioglu, A., Weiser, J. N., Paton, J. C., Andrew, P. W. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nature Reviews Microbiology. 6 (4), 288-301 (2008).
- Obaro, S., Adegbola, R. The pneumococcus: Carriage, disease and conjugate vaccines. Journal of Medical Microbiology. 51 (2), 98-104 (2002).
- Chong, C. P., Street, P. R. Pneumonia in the elderly: A review of the epidemiology, pathogenesis, microbiology, and clinical features. Southern Medical Journal. 101 (11), 1141-1145 (2008).
- Kadioglu, A., Andrew, P. W. Susceptibility and resistance to pneumococcal disease in mice. Briefings in Functional Genomics and Proteomics. 4 (3), 241-247 (2005).
- Ganie, F., et al. Structural, genetic, and serological elucidation of Streptococcus pneumoniae serogroup 24 serotypes: Discovery of a new serotype, 24C, with a variable capsule structure. Journal of Clinical Microbiology. 59 (7), 0054021 (2021).
- Centers for Disease Control and Prevention. Estimates of deaths associated with seasonal influenza --- United States. MMWR. Morbidity and Mortality Weekly Report. 59 (33), 1057-1062 (2010).
- Shrestha, S., et al. Identifying the interaction between influenza and pneumococcal pneumonia using incidence data. Science Translational Medicine. 5 (191), (2013).
- McCullers, J. A. Insights into the interaction between influenza virus and pneumococcus. Clinical Microbiology Reviews. 19 (3), 571-582 (2006).
- Pneumococcal Disease Global Pneumococcal Disease and Vaccine. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/pneumococcal/global.html (2018)
- Grudzinska, F. S., et al. Neutrophils in community-acquired pneumonia: Parallels in dysfunction at the extremes of age. Thorax. 75 (2), 164-171 (2020).
- Boe, D. M., Boule, L. A., Kovacs, E. J. Innate immune responses in the ageing lung. Clinical and Experimental Immunology. 187 (1), 16-25 (2017).
- Krone, C. L., van de Groep, K., Trzcinski, K., Sanders, E. A., Bogaert, D. Immunosenescence and pneumococcal disease: An imbalance in host-pathogen interactions. The Lancet Respiratory Medicine. 2 (2), 141-153 (2014).
- Cho, S. J., et al. Decreased NLRP3 inflammasome expression in aged lung may contribute to increased susceptibility to secondary Streptococcus pneumoniae infection. Experimental Gerontology. 105, 40-46 (2018).
- Disease Burden of Influenza. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/flu/about/burden/index.html (2018)
- McCullers, J. A. The co-pathogenesis of influenza viruses with bacteria in the lung. Nature Reviews Microbiology. 12 (4), 252-262 (2014).
- McCullers, J. A., Rehg, J. E. Lethal synergism between influenza virus and Streptococcus pneumoniae: Characterization of a mouse model and the role of platelet-activating factor receptor. The Journal of Infectious Diseases. 186 (3), 341-350 (2002).
- Metzger, D. W., Sun, K. Immune dysfunction and bacterial coinfections following influenza. Journal of Immunology. 191 (5), 2047-2052 (2013).
- Chao, Y., Marks, L. R., Pettigrew, M. M., Hakansson, A. P. Streptococcus pneumoniae biofilm formation and dispersion during colonization and disease. Frontiers in Cellular and Infection Microbiology. 4, 194 (2014).
- Bogaert, D., De Groot, R., Hermans, P. W. Streptococcus pneumoniae colonisation: The key to pneumococcal disease. The Lancet Infectious Diseases. 4 (3), 144-154 (2004).
- Simell, B., et al. The fundamental link between pneumococcal carriage and disease. Expert Review of Vaccines. 11 (7), 841-855 (2012).
- Marks, L. R., Davidson, B. A., Knight, P. R., Hakansson, A. P. Interkingdom signaling induces Streptococcus pneumoniae biofilm dispersion and transition from asymptomatic colonization to disease. mBio. 4 (4), 00438 (2013).
- Reddinger, R. M., Luke-Marshall, N. R., Sauberan, S. L., Hakansson, A. P., Campagnari, A. A. Streptococcus pneumoniae modulates Staphylococcus aureus biofilm dispersion and the transition from colonization to invasive disease. mBio. 9 (1), 02089 (2018).
- Joma, B. H., et al. A murine model for enhancement of Streptococcus pneumoniae pathogenicity upon viral infection and advanced age. Infection and Immunity. 89 (8), 0047120 (2021).
- Andersson, B., et al. Identification of an active disaccharide unit of a glycoconjugate receptor for pneumococci attaching to human pharyngeal epithelial cells. Journal of Experimental Medicine. 158 (2), 559-570 (1983).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. The Journal of Experimental Medicine. 79 (2), 137-158 (1944).
- Tettelin, H., et al. Complete genome sequence of a virulent isolate of Streptococcus pneumoniae. Science. 293 (5529), 498-506 (2001).
- Tothpal, A., Desobry, K., Joshi, S. S., Wyllie, A. L., Weinberger, D. M. Variation of growth characteristics of pneumococcus with environmental conditions. BMC Microbiology. 19 (1), 304 (2019).
- Bou Ghanem, E. N., et al. Extracellular adenosine protects against Streptococcus pneumoniae lung infection by regulating pulmonary neutrophil recruitment. PLoS Pathogens. 11 (8), 1005126 (2015).
- Bou Ghanem, E. N., et al. The alpha-tocopherol form of vitamin E boosts elastase activity of human PMNs and their ability to kill Streptococcus pneumoniae. Frontiers in Cellular and Infection Microbiology. 7, 161 (2017).
- Tait, A. R., Davidson, B. A., Johnson, K. J., Remick, D. G., Knight, P. R. Halothane inhibits the intraalveolar recruitment of neutrophils, lymphocytes, and macrophages in response to influenza virus infection in mice. Anesthesia & Analgesia. 76 (5), 1106-1113 (1993).
- Aaberge, I. S., Eng, J., Lermark, G., Lovik, M. Virulence of Streptococcus pneumoniae in mice: A standardized method for preparation and frozen storage of the experimental bacterial inoculum. Microbial Pathogenesis. 18 (2), 141-152 (1995).
- McCullers, J. A., Bartmess, K. C. Role of neuraminidase in lethal synergism between influenza virus and Streptococcus pneumoniae. The Journal of Infectious Diseases. 187 (6), 1000-1009 (2003).
- Smith, A. M., McCullers, J. A. Secondary bacterial infections in influenza virus infection pathogenesis. Current Topics in Microbiology and Immunology. 385, 327-356 (2014).
- Cundell, D. R., Gerard, N. P., Gerard, C., Idanpaan-Heikkila, I., Tuomanen, E. I. Streptococcus pneumoniae anchor to activated human cells by the receptor for platelet-activating factor. Nature. 377 (6548), 435-438 (1995).
- Ballinger, M. N., Standiford, T. J. Postinfluenza bacterial pneumonia: Host defenses gone awry. Journal of Interferon & Cytokine Research. 30 (9), 643-652 (2010).
- Sun, K., Metzger, D. W. Inhibition of pulmonary antibacterial defense by interferon-gamma during recovery from influenza infection. Nature Medicine. 14 (5), 558-564 (2008).
- Nakamura, S., Davis, K. M., Weiser, J. N. Synergistic stimulation of type I interferons during influenza virus coinfection promotes Streptococcus pneumoniae colonization in mice. Journal of Clinical Investigation. 121 (9), 3657-3665 (2011).
- Blanchette-Cain, K., et al. Streptococcus pneumoniae biofilm formation is strain dependent, multifactorial, and associated with reduced invasiveness and immunoreactivity during colonization. mBio. 4 (5), 00745 (2013).
- Rello, J., Pop-Vicas, A. Clinical review: Primary influenza viral pneumonia. Critical Care. 13 (6), 235 (2009).
- Torres, A., Loeches, I. M., Sligl, W., Lee, N. Severe flu management: A point of view. Intensive Care Medicine. 46 (2), 153-162 (2020).
- Bakaletz, L. O. Viral-bacterial co-infections in the respiratory tract. Current Opinion in Microbiology. 35, 30-35 (2017).
- Palacios, G., et al. Streptococcus pneumoniae coinfection is correlated with the severity of H1N1 pandemic influenza. PLoS One. 4 (12), 8540 (2009).
- Dhanoa, A., Fang, N. C., Hassan, S. S., Kaniappan, P., Rajasekaram, G. Epidemiology and clinical characteristics of hospitalized patients with pandemic influenza A (H1N1) 2009 infections: The effects of bacterial coinfection. Virology Journal. 8, 501 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten