Method Article
Un modelo de ratón para la transición de Streptococcus pneumoniae de colonizador a patógeno tras la coinfección viral recapitula la enfermedad exacerbada por la edad
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo describe un nuevo modelo de ratón para la transición del neumococo de un colonizador asintomático a un patógeno causante de enfermedades durante la infección viral. Este modelo se puede adaptar fácilmente para estudiar las interacciones polimicrobianas y huésped-patógeno durante las diferentes fases de la progresión de la enfermedad y entre varios huéspedes.
Resumen
Streptococcus pneumoniae (neumococo) es un colonizador asintomático de la nasofaringe en la mayoría de los individuos, pero puede progresar a un patógeno pulmonar y sistémico tras la infección por el virus de la influenza A (IAV). La edad avanzada aumenta la susceptibilidad del huésped a la neumonía neumocócica secundaria y se asocia con peores resultados de la enfermedad. Los factores del huésped que impulsan esos procesos no están bien definidos, en parte debido a la falta de modelos animales que reproduzcan la transición de la colonización asintomática a la enfermedad clínica grave.
Este artículo describe un nuevo modelo de ratón que recrea la transición de los neumococos de transporte asintomático a enfermedad tras una infección viral. En este modelo, los ratones se inoculan primero intranasalmente con neumococos cultivados en biopelícula para establecer un transporte asintomático, seguido de una infección por IAV tanto de la nasofaringe como de los pulmones. Esto resulta en diseminación bacteriana a los pulmones, inflamación pulmonar y signos obvios de enfermedad que pueden progresar a letalidad. El grado de enfermedad depende de la cepa bacteriana y los factores del huésped.
Es importante destacar que este modelo reproduce la susceptibilidad del envejecimiento, porque en comparación con los ratones jóvenes, los ratones viejos muestran una enfermedad clínica más grave y sucumben a la enfermedad con mayor frecuencia. Al separar el transporte y la enfermedad en distintos pasos y brindar la oportunidad de analizar las variantes genéticas tanto del patógeno como del huésped, este modelo de coinfección por S. pneumoniae / IAV permite el examen detallado de las interacciones de un patobiológico importante con el huésped en diferentes fases de progresión de la enfermedad. Este modelo también puede servir como una herramienta importante para identificar posibles objetivos terapéuticos contra la neumonía neumocócica secundaria en huéspedes susceptibles.
Introducción
Streptococcus pneumoniae (neumococo) son bacterias Gram-positivas que residen asintomáticamente en la nasofaringe de la mayoría de los individuos sanos 1,2. Promovido por factores que no están completamente definidos, los neumococos pueden pasar de colonizadores benignos de la nasofaringe a patógenos que se diseminan a otros órganos, lo que resulta en infecciones graves, como otitis media, neumonía y bacteriemia3. La presentación de la enfermedad neumocócica depende, en parte, de las diferencias específicas de la cepa, incluido el serotipo, que se basa en la composición de los polisacáridos capsulares. Ha habido más de 100 serotipos caracterizados hasta ahora, y algunos están asociados con infecciones más invasivas 4,5. Varios otros factores aumentan el riesgo de enfermedad neumocócica. Uno de estos factores es la infección viral, donde el riesgo de neumonía neumocócica aumenta 100 veces por IAV 6,7. Históricamente, S. pneumoniae es una de las causas más comunes de neumonía bacteriana secundaria después de la influenza y se asocia con peores resultados8. Otro factor de riesgo importante es la edad avanzada. De hecho, S. pneumoniae es la principal causa de neumonía bacteriana adquirida en la comunidad en ancianos mayores de 65 años 9,10. Los ancianos representan la mayoría (>75%) de las muertes por neumonía e influenza, lo que indica que los dos factores de riesgo, el envejecimiento y la infección por IAV, empeoran sinérgicamente la susceptibilidad a la enfermedad11,12,13,14. Sin embargo, los mecanismos por los cuales la infección viral provoca la transición de neumococos de colonizador asintomático a patógeno invasivo y cómo esto es moldeado por los factores del huésped siguen estando mal definidos. Esto se debe en gran parte a la ausencia de un modelo animal pequeño que recapitule la transición de la colonización neumocócica asintomática a la enfermedad clínica crítica.
Los estudios de coinfección se han modelado clásicamente en ratones inoculados con neumococos directamente en los pulmones 7 días después de la infección por influenza15,16. Esto reproduce la susceptibilidad a la neumonía bacteriana secundaria y es ideal para estudiar cómo las respuestas inmunes antivirales perjudican las defensas antibacterianas17. Sin embargo, estudios longitudinales en humanos han demostrado que el transporte neumocócico en la nasofaringe, donde las bacterias pueden formar biofilms asintomáticos18, está uniformemente asociado con enfermedades invasivas 19,20. Los aislados bacterianos de infecciones del oído medio, pulmón y sangre son genéticamente idénticos a los que se encuentran en la nasofaringe20. Así, para estudiar la transición del transporte asintomático a la enfermedad invasiva después de la infección por IAV, se estableció un modelo en el que a los ratones se les administraron neumococos cultivados con biopelícula por vía intranasal seguidos de infección por IAV de la nasofaringe21,22. La infección viral de la vía aérea superior condujo a cambios en el ambiente del huésped que llevaron a la dispersión de neumococos de las biopelículas y su propagación a las vías aéreas inferiores21. Estas bacterias dispersas tenían una expresión regulada al alza de factores de virulencia importantes para la infección, convirtiéndolas de colonizadoras a patógenos21. Estas observaciones resaltan la compleja interacción entre el virus, el huésped y las bacterias y demuestran que los cambios en el huésped desencadenados por la infección viral tienen un impacto directo en el comportamiento neumocócico, que, a su vez, altera el curso de la infección bacteriana. Sin embargo, este modelo no logra recapitular los signos graves de enfermedad observados en humanos, probablemente porque el virus se limita a la cavidad nasal, y los efectos sistémicos de la infección viral sobre la inmunidad del huésped y el daño pulmonar no se recapitulan.
Recientemente establecimos un modelo que incorpora la compleja interacción entre el huésped y los patógenos, pero también imita más de cerca la gravedad de la enfermedad observada en humanos23. En este modelo, los ratones se infectan primero por vía intranasal con neumococos cultivados en biopelícula para establecer un transporte asintomático, seguido de la infección por IAV tanto de la nasofaringe como de los pulmones. Esto resultó en diseminación bacteriana a los pulmones, inflamación pulmonar y enfermedad que progresó a letalidad en una fracción de ratones jóvenes23. Este estudio previo demostró que tanto la infección viral como la bacteriana alteraron la defensa del huésped: la infección viral promovió la diseminación bacteriana, y la colonización bacteriana previa afectó la capacidad del huésped para controlar los niveles pulmonares de IAV23. El examen de la respuesta inmune reveló que la infección por IAV disminuyó la actividad antibacteriana de los neutrófilos, mientras que la colonización bacteriana embotó la respuesta de interferón tipo I crítica para la defensa antiviral23. Es importante destacar que este modelo reprodujo la susceptibilidad del envejecimiento. En comparación con los ratones jóvenes, los ratones viejos mostraron signos de enfermedad antes, mostraron una enfermedad clínica más grave y sucumbieron a la infección con mayor frecuencia23. El trabajo presentado en este manuscrito muestra que el grado de enfermedad también depende de la cepa bacteriana, porque las cepas neumocócicas invasivas muestran una diseminación más eficiente sobre la infección por IAV, muestran signos más evidentes de inflamación pulmonar y dan como resultado tasas aceleradas de enfermedad en comparación con las cepas no invasivas. Por lo tanto, este modelo de coinfección por S. pneumoniae / IAV permite el examen detallado de los factores patógenos y del huésped y es adecuado para estudiar las respuestas inmunes a las infecciones polimicrobianas en las diferentes fases de la progresión de la enfermedad.
Protocolo
Todos los estudios en animales se realizaron de acuerdo con las recomendaciones de la Guía para el cuidado y uso de animales de laboratorio. Todos los procedimientos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Buffalo.
1. Preparación de medios químicamente definidos (MDL)
- Preparar las existencias de la siguiente manera:
- Disuelva los compuestos de mezcla I enumerados en la Tabla 1 en 100 ml de agua ultrapura mientras se agita. Conservar en alícuotas de 200 μL a −20 °C.
- Disuelva los compuestos de mezcla II enumerados en la Tabla 1 en 20 mL de NaOH 0.1 M mientras se agita. Conservar en alícuotas de 100 μL a −20 °C.
- Disuelva los compuestos de mezcla III enumerados en la Tabla 1 en 1 ml de agua ultrapura mientras se agita. Conservar en alícuotas de 10 μL a 4 °C.
- Disuelva el compuesto de mezcla IV que figura en la Tabla 1 en 1 ml de agua ultrapura mientras se agita. Conservar en alícuotas de 10 μL a −20 °C.
- Disuelva los compuestos enumerados en la Tabla 2 inicialmente en 15 ml de agua ultrapura mientras se agita. Ajuste el pH a 7.0 con unas gotas de 0.1 M NaOH y ajuste el volumen final a 20 mL usando agua ultrapura. Conservar en alícuotas de 1 ml a −20 °C.
- Disuelva los compuestos enumerados en la Tabla 3 en 90 ml de agua ultrapura en una placa caliente a 50 °C mientras se agita. Ajuste el pH a 7.0 con NaOH 0.1 M y luego ajuste el volumen final a 100 ml con agua ultrapura. Conservar en alícuotas de 5 ml a −20 °C.
- Haga el caldo inicial fresco cada vez disolviendo los compuestos en la Tabla 4 en 70 ml de agua ultrapura mientras se agita.
- Al stock de inicio fresco, agregue los siguientes stocks de mezcla en orden: 200 μL de stock de Mix I (Tabla 1), 80 μL de stock de Mix II (Tabla 1), 10 μL de stock de Mix III (Tabla 1), 10 μL de stock de Mix IV (Tabla 2), 1 ml de stock de vitaminas (Tabla 3) y 5 ml de stock de aminoácidos (Tabla 4).
- Una vez que se hayan agregado las cepas, ajuste el volumen final a 100 ml agregando 30 ml de agua ultrapura al vaso de precipitados.
- Complementar el MDL con compuestos de la Tabla 4. Una vez mezclado bien, filtrar-esterilizar y almacenar a 4 °C durante un máximo de 2 semanas.
2. Cultivo de la biopelícula de S. pneumoniae
- Prepare el medio RP-10 mezclando 445 ml de RPMI 1640 con 50 ml de suero fetal bovino (FBS) inactivado por calor y 5 ml de penicilina/estreptomicina a 10,000 U/ml y 10,000 μg / ml, respectivamente.
- Cultivar la línea celular de carcinoma mucoepidermoide NCI-H292 (H292). Añadir las células de un vial comprado a 5 ml de medio RP-10 en un matraz tratado con cultivo de tejidos T-25. Incubar a 37 °C/5% deCO2 durante 3-5 días para alcanzar el 100% de confluencia.
- Verifique las células bajo un microscopio de luz usando un aumento de 10x para evaluar la confluencia.
NOTA: Cuando todas las células están en contacto con otras células y no hay espacios entre ellas, entonces se alcanza la confluencia deseada del 100%. - Lave las células 2 veces en 5 ml de PBS a temperatura ambiente. Asegúrese de que el tampón esté libre de calcio para evitar quelar el EDTA en el siguiente paso.
- Añadir 1 ml de tripsina-EDTA al matraz e incubar a 37 °C/5% deCO2 durante 5-10 min hasta que las células se desprendan. Neutralizar con 4 mL de medio RP-10. Mezclar suavemente pipeteando hacia arriba y hacia abajo y transferir a un tubo cónico de 50 ml.
- Agregue 500 μL de la suspensión celular por pocillo a una placa de 24 pocillos tratada con cultivo de tejidos. De un matraz T-25 confluente, esperar 2 × 10 6-4 × 106 células/ml.
- Al día siguiente, verifique las células bajo un microscopio óptico para asegurarse de que son confluentes, como en el paso 2.3. Si no lo son, incubar por más tiempo.
- Una vez que las células H292 estén 100% confluentes en la placa de 24 pocillos, lave suavemente las células 3 veces con 1 ml de PBS a temperatura ambiente para asegurarse de que no quede ningún medio que contenga antibióticos o desechos.
- Después de lavar las células, añadir 250 μL/pocillo de paraformaldehído al 4% para fijar las células. Incubar durante 1 h en hielo o durante la noche a 4 °C.
- La noche anterior a la fijación celular, rayar la cepa de interés de S. pneumoniae en placas de agar sangre e incubar durante la noche a 37 °C/5% deCO2.
NOTA: Los datos presentados aquí corresponden a las siguientes cepas de S. pneumoniae obtenidas mediante intercambio colaborativo: aislado de otitis media de serotipo 19F EF3030 24, cepa D3925 de Avery del serotipo 2 clásico y aislado de bacteriemia de serotipo 4 TIGR426. Las cepas también están disponibles en colecciones públicas a las que se hace referencia en la Tabla de materiales. - Prepare CDM más oxirasa (0.15 U/ml) agregando 100 μL de oxirasa (30 U/ml) a 20 ml de CDM.
NOTA: La oxirasa se utiliza para eliminar el oxígeno para permitir el crecimiento eficiente de S. pneumoniae en cultivo líquido27. - Inocular las bacterias de la placa en CDM fresco + oxirasa lavando las bacterias de la placa agregando 1 ml de CDM + oxirasa y levantando suavemente las colonias bacterianas usando el lado de una punta de pipeta de 1 ml, teniendo cuidado de no raspar el agar. Alternativamente, use un bucle inoculante para levantar las bacterias e inocularlas en un tubo que contenga 1 ml de CDM + oxirasa.
- Diluir las bacterias en CDM + oxirasa a un ODinicial 600 de 0.05.
- Cultive las bacterias en un tubo cónico de 50 ml con tapa suelta que esté a 37 °C / 5% deCO2 hasta que se alcance un OD600 de 0.2 (esto tomará entre 2-5 h). Compruebe el OD600 cada hora para asegurarse de que el OD no supere 0,2.
- Una vez que el OD haya alcanzado 0,2, vortex el tubo de cultivo bacteriano. Siembre 0.5 mL de la bacteria en las células H292 fijas y agregue otros 0.5 mL de medio CDM + oxirasa por pocillo. Añadir 1 mL de CDM + oxirasa a los pocillos de control sin bacterias. Incubar la placa durante 48 h a 34 °C/5% deCO2.
NOTA: El crecimiento a 34 °C se utiliza para imitar más de cerca la temperatura más baja en la nasofaringe21. - Cada 12 h después de la siembra inicial, retire suavemente 0,5 ml del medio y reponga con 0,5 ml de CDM fresco + oxirasa. Tenga cuidado de no interrumpir la biopelícula en formación. Revise la parte inferior de la placa en busca de biopelícula y busque un aumento de la nubosidad a medida que pasa el tiempo debido al crecimiento de la biopelícula. Para controlar la contaminación, verifique los pozos sin bacterias para asegurarse de que los pozos de control permanezcan limpios.
- A las 48 h después de la inoculación, retire el sobrenadante y lave 2 veces muy suavemente con 1 ml de PBS. Resuspender en 1 ml de MDL fresco y pipetear hacia arriba y hacia abajo vigorosamente para levantar la biopelícula. Para cada cepa bacteriana, agrupe las bacterias de todos los pocillos en un tubo cónico de 50 ml. Mezcle bien inclinando suavemente el tubo bien tapado hacia arriba y hacia abajo varias veces.
- Al tubo cónico de 50 mL, agregue glicerol al 40% en CDM a volúmenes iguales para lograr una suspensión bacteriana con una concentración final de 20% de glicerol. Alícuota 1 ml en tubos de microcentrífuga, congelar rápidamente en hielo seco y guardar a -80 °C.
- Antes de su uso, enumere las bacterias descongelando una alícuota en hielo, girando el tubo a 1.700 × g durante 5 minutos, eliminando el sobrenadante, resuspendiendo el pellet en 1 ml de PBS y colocando diluciones seriadas en placas de agar sangre28.
- Cultivar las placas de agar durante la noche a 37 °C/5% deCO2 y contar las colonias en diluciones relevantes para obtener la concentración bacteriana en unidades formadoras de colonias (UFC)/ml.
NOTA: Se recomienda enumerar las bacterias en las cepas al menos un día después de la congelación o más tarde, ya que hay una caída en la viabilidad bacteriana dentro de las primeras 24 h. Las alícuotas congeladas almacenadas se pueden utilizar para la infección posterior de ratones durante un máximo de 2 meses.
3. Inoculación intranasal de ratones con S. pneumoniae cultivada en biofilm
- Compre ratones y úselos a la edad deseada.
NOTA: Los ratones de 3-4 meses de edad son preferidos para modelar huéspedes jóvenes, y los ratones de 21-24 meses de edad se pueden utilizar para modelar individuos ancianos >65 años de edad29. Los datos presentados aquí son con ratones machos C57BL / 6. - Descongele las alícuotas bacterianas cultivadas en biopelícula en hielo y gire a 1.700 × g durante 5 min. Retire y deseche cuidadosamente el sobrenadante sin interrumpir el pellet, lave las bacterias resuspendiendo el pellet en 1 ml de PBS y vuelva a girar a 1,700 × g durante 5 min. Retirar el sobrenadante y resuspender el pellet en el volumen necesario para alcanzar la concentración deseada (objetivo de 5 × 106 UFC/10 μL para la inoculación intranasal). Confirmar las cantidades de bacterias administradas colocando el inóculo preparado en placas de agar sangre como en el paso 2.19.
- Inocular a los ratones por vía intranasal con 5 × 106 UFC pipeteando 5 μL del inóculo diluido en cada naris. Asegúrese de sostener a los ratones firmemente, estabilizando la cabeza, hasta que se inhale el volumen (generalmente a los pocos segundos de pipetear el volumen en las narinas). Realizar este paso en ausencia de anestesia para prevenir la aspiración pulmonar del inóculo.
4. Infección viral con el virus de la influenza A (IAV)
- A las 48 h siguientes a la inoculación intranasal con S. pneumoniae, descongelar la cepa IAV de interés en hielo.
NOTA: Los datos presentados aquí son con una cepa adaptada al ratón del virus de la influenza A A/PR/8/34 H1N1 que se obtuvo a través del intercambio colaborativo30. - Una vez que el virus se haya descongelado, diluya el virus en PBS a la concentración deseada; aspire a 20 unidades formadoras de placa (UFP)/50 μL para la infección intratraqueal y 200 UFP/10 μL para la infección intranasal. Para grupos infectados simulados y solo bacterias, use PBS para inocular a los ratones.
- Coloque lubricante oftálmico en los ojos de los ratones antes de la anestesia. Anestesiar a los ratones con isoflurano al 5% y confirmar la anestesia con un pellizco firme en el dedo del pie.
- Una vez que el animal esté anestesiado, retírelo de la cámara de isoflurano e infecte inmediatamente a los ratones anestesiados con 50 μL (20 UFP) de IAV por vía intratraqueal usando pinzas romas para sacar la lengua de la boca y pipetear el volumen de líquido por la tráquea.
- Coloque a los ratones en una jaula separada y monitoree hasta la recuperación completa (son capaces de mantener la decúbito esternal [capaces de acostarse erguidos sobre el pecho]).
- Después de la recuperación, inocular inmediatamente intranasal a los ratones con 10 μL (200 UFP) de IAV utilizando el método de inoculación en el paso 3.3.
- Ratones domésticos que han sufrido una o dos infecciones bacterianas y virales con el mismo grupo de infección y los separan de los otros grupos.
5. Monitoreo de los ratones para detectar síntomas de la enfermedad
- Controle a los ratones diariamente durante al menos 10 días y puntúe ciegamente para detectar signos de enfermedad de la siguiente manera:
- Puntuación de la siguiente manera para la pérdida de peso: 0 = 5% o menos; 1 = 5%-10%; 2 = 10%-15%; 3 = 20% o más. Eutanasia a los ratones usando inhalación deCO2 cuando la puntuación de pérdida de peso es de 3.
- Puntuación de la siguiente manera para la actividad: 0 = normal/activo; 1 = movimiento pero ligeramente disminuido; 2 = disminuida; 3 = severamente disminuido/letárgico (solo se mueve si se toca), 4 = coma/inmóvil. Eutanasia a los ratones cuando la puntuación de actividad sea de 3.
- Puntuación de la siguiente manera para la postura: 0 = sin corazonada (normal); 1 = postura ligeramente encorvada; 2 = corazonada grave. Eutanasia a los ratones cuando la puntuación de postura es de 2.
- Puntuación de la siguiente manera para los ojos: 0 = normal; 1 = sobresaliente; 1 = hundido; 1 = cerrado; 1 = alta. Puede ser una combinación. Suma los totales para la puntuación final del ojo.
- Puntuación de la siguiente manera para la respiración: 0 = Respiración normal; 1 = irregular o alterado (tasa mayor/menor); 2 = laborioso (esfuerzo exagerado o jadeo). Eutanasia a los ratones cuando la puntuación de respiración es de 2.
- Con base en los criterios anteriores, agregue las puntuaciones individuales para una puntuación clínica total de saludable (0) a extremadamente enfermo (15). Considere que cualquier ratón que muestre una puntuación total superior a 2 está enfermo. Sacrificar humanamente a cualquier ratón que muestre una puntuación total superior a 9 o las puntuaciones indicadas para cada criterio y marcarlos en la curva de supervivencia.
6. Procesamiento de tejidos infectados para enumeración bacteriana
- A las 48 h después de la infección por IAV, sacrificar a los ratones.
- Coloque el ratón en posición supina. Con etanol al 70%, rocíe el pecho y el abdomen del ratón para limpiar el pelaje. Usando fórceps, pellizque el pelaje y la piel en el centro del ratón y corte el pelaje con 4.5 en tijeras de disección para exponer el área desde el hígado hasta el pecho.
- Extracción de sangre
- Usando tijeras de disección, corte suavemente en la cavidad peritoneal para exponer el hígado. Usando fórceps, exponga la vena porta hepática en la parte superior del hígado cerca del diafragma. Corte la vena porta hepática con las tijeras de disección. Una vez que la sangre comience a acumularse en la cavidad peritoneal, recolectar 10 μL de sangre con una micropipeta y colocar en 90 μL de solución anticoagulante (solución de EDTA de 50 mM en PBS) en un tubo de microcentrífuga para el recubrimiento de la carga bacteriana.
- Use una micropipeta P-1000 para recolectar el resto de la sangre, colóquela en un tubo de recolección de sangre y centrifugar a 7,600 × g durante 2 minutos para recolectar el suero. Guardar los sueros en tubos de microcentrífuga a −80 °C para el análisis posterior de cualquier citocina o metabolito deseado.
- Colección pulmonar
- Usando tijeras de disección, haga un corte por los lados de la caja torácica expuesta y tire suavemente de las costillas hacia la cabeza del ratón para exponer el corazón. Inserte una aguja de 25 G conectada a una jeringa de 10 ml precargada con PBS en el ventrículo derecho y comience a perfundir lentamente. Busque el blanqueamiento de los pulmones como un indicador de perfusión exitosa. Enjuague lentamente para evitar romper el tejido pulmonar.
- Levante el corazón con los fórceps y haga un corte para separar los pulmones y el corazón. Una vez separados, recoger todos los lóbulos del pulmón con los fórceps y enjuagar en un plato con PBS estéril para eliminar cualquier sangre residual. En una placa de Petri, picar los pulmones en trozos pequeños y mezclar bien. Retire la mitad de la mezcla pulmonar para la determinación de la UFC bacteriana o PFU viral y colóquela en un tubo de fondo redondo de 15 ml precargado con 0,5 ml de PBS para homogeneización.
NOTA: Es importante no tomar diferentes lóbulos del mismo pulmón para las diversas evaluaciones. En cambio, todos los lóbulos deben ser picados, mezclados bien y analizados por igual para las diferentes evaluaciones. - Retire la otra mitad del pulmón para citometría de flujo (sección 7 a continuación) y colóquela en una placa de 24 pocillos no tratada con cultivo tisular con cada pocillo precargado con 0,5 ml de RP-10. Dejar a temperatura ambiente hasta el procesamiento.
- Colección Nasopharynx
- En el cuello, use las tijeras de disección para cortar el pelaje, y luego corte el músculo y exponga la tráquea.
NOTA: La tráquea es una estructura en forma de tubo ubicada debajo del músculo. - Coloque pequeñas pinzas debajo de la tráquea a una distancia de 1 cm de la mandíbula del ratón para estabilizarla. Usando tijeras de disección, haga suavemente una hendidura de 0,1 cm en la porción anterior de la tráquea, evitando cortar la tráquea por completo.
- Prepare una jeringa de 1 ml llena con 0,5 ml de PBS con un tubo de 0,58 mm conectado a una aguja de 25 G. Recoja el lavado nasal insertando el tubo en la tráquea que va hacia arriba hacia la nasofaringe. Una vez que se sienta resistencia al ingresar a la cavidad nasal, coloque un tubo de microcentrífuga en la nariz y enjuague lentamente el PBS a través de la tráquea para recoger el lavado nasal.
- Coloque el ratón en posición prona. Rocíe la cabeza del ratón con etanol. Use tijeras de disección para cortar el pelaje y almohadilla mistacial para exponer el hueso de la cabeza del ratón.
- Usando las tijeras de disección, haga un corte de 1 cm por los lados de la mandíbula y entre los ojos. Usando fórceps, retire lentamente los huesos faciales del cuerpo para exponer la cavidad nasal.
- Use fórceps para extraer suavemente el tejido nasal y colóquelo en un tubo inferior redondo precargado con 0,5 ml de PBS para homogeneización.
- En el cuello, use las tijeras de disección para cortar el pelaje, y luego corte el músculo y exponga la tráquea.
- Para homogeneizar el tejido recolectado, primero limpie la sonda homogeneizadora poniéndola en etanol al 70% y encendiendo el homogeneizador al 60% de potencia durante 30 s. Repita el paso en agua estéril durante 10 s. Homogeneizar cada tejido durante 1 min. Limpie la sonda homogeneizadora en agua estéril entre cada muestra y en un tubo nuevo de etanol al 70% entre cada órgano y grupo de muestra.
- Enumeración de números bacterianos
- Una vez que todos los órganos han sido cosechados y homogeneizados, diluciones seriadas en placa en placas de agar sangre. Para calcular la UFC total, use 10 μL para platear y anotar el volumen final en ml para cada muestra. Colocar en placa las muestras de nasofaringe en placas de agar sangre suplementadas con 3 μg/ml de gentamicina para seleccionar el crecimiento de S. pneumoniae mientras se inhibe el crecimiento de otros microorganismos que colonizan ese tejido. Incubar durante la noche a 37 °C/5% deCO2.
- Para enumerar la UFC bacteriana para el pulmón y la nasofaringe, primero cuente las colonias en las placas de agar sangre. Luego, use la ecuación (1) y la ecuación (2) para calcular la cantidad por ml y el número total.
Cantidad por ml = número de colonias × factor de dilución × 100 (1)
Número total = cantidad por ml × volumen total por muestra (2)
NOTA: En la ecuación (1), 100 se usa para multiplicar ya que 10 μL está plateado, que es una dilución de 100 veces de 1 ml. El volumen total por muestra en la ecuación (2) es del paso 6.7.1, que da como resultado el límite de detección de 100 por órgano. - Para enumerar la UFC bacteriana Para la bacteriemia, primero cuente las colonias en las placas de agar sangre. Luego, use la ecuación (3) para determinar la cantidad por ml de sangre.
Cantidad por ml de sangre = número de colonias × factor de dilución × 100 × 10 (3)
NOTA: En la ecuación (3), 100 se usa cuando 10 μL está plateado, que es una dilución de 100 veces de 1 ml, y 10 indica una dilución 1:10 de la sangre en anticoagulante. Esto da como resultado el límite de detección de 1.000/mL.
7. Procesamiento de las muestras pulmonares para citometría de flujo
- Prepare los medios necesarios de la siguiente manera:
- Prepare RP-10 como se describe en el paso 2.1.
- Preparar el tampón de digestión mezclando RP-10 con 2 mg/ml de colagenasa y 30 μL/ml de DNasa I.
- Preparar el tampón de lisis disolviendo 8,29 g de NH4Cl, 1 g de NaHCO3 y 0,038 g de EDTA en 1 L deH2O.
- Prepare 10x tampón FACS mezclando 450 ml de HBSS con 50 ml de FBS inactivado por calor y 5 g de azida de sodio.
- Prepare 1x tampón FACS diluyendo 50 ml de tampón 10x FACS en 450 ml de HBSS.
- Tomar las muestras de pulmón del paso 6.4.3 y colocarlas en una placa de 24 pocillos. Agregue 500 μL de tampón de digestión a cada pocillo. Incubar durante 45 min hasta 1 h a 37 °C/5% deCO2.
- Prellene 50 ml de tubos cónicos para cada muestra con 5 ml de RP-10. Cuando termine la incubación, coloque un filtro de 100 μm en la parte superior del tubo cónico de 50 ml y humedézcalo con 1 ml de RP-10.
- Con una micropipeta P-1000, mueva los pulmones digeridos y colóquelos en el filtro. Use el émbolo de una jeringa de 3 ml para triturar el órgano. Enjuague 2 veces con 1 ml de RP-10 cada vez.
- Girar las muestras a 4 °C y 327 × g durante 5 min. Aspirar el sobrenadante y resuspender el pellet en 1 mL de tampón de lisis. Dejar actuar durante 3 minutos para permitir la lisis de los glóbulos rojos. Neutralizar con 5 mL de RP-10.
- Girar las muestras a 4 °C y 327 × g durante 5 min. Aspirar el sobrenadante, resuspender el pellet en 1 mL de RP-10 y tomar 10 μL para contar las muestras.
- Girar las muestras a 4 °C y 327 × g durante 5 min. Aspirar el sobrenadante y resuspender el pellet en RP-10 a 2 × 10 6-4 × 106 células/ml. Agregue 60 μL de cada muestra en una placa de 96 pocillos para teñir los tipos de células deseados23 enumerados en el paso 7.9, Tabla 5 y Tabla 6.
- Girar la placa a 4 °C y 327 × g durante 5 min.
- Mientras tanto, prepare las mezclas maestras de anticuerpos, fluorescentes menos uno (FMO) y controles de tinción única con los anticuerpos deseados. Para teñir leucocitos polimorfonucleares (PMN), macrófagos, monocitos, células dendríticas y células T, use los anticuerpos y diluciones finales enumerados en la Tabla 5 y la Tabla 6. Utilizar un volumen total de 100 μL/pocillo de la mezcla de anticuerpos. Siga las diluciones enumeradas en las tablas para determinar el volumen apropiado de la mezcla maestra y los anticuerpos individuales requeridos.
- Cuando termine el centrifugado (paso 7.8), decantar el sobrenadante, resuspender los gránulos en 100 μL de las mezclas de anticuerpos, FMO o controles de tinción única, e incubar en hielo durante 30 minutos en la oscuridad.
- Lavar las células 2 veces añadiendo 150 μL de tampón FACS a los pocillos y girando la placa a 4 °C y 327 × g durante 5 min.
- Cuando termine el centrifugado, decantar el sobrenadante, resuspender los gránulos en 100 μL de tampón de fijación e incubar en hielo durante 20 min.
- Lavar las células 2 veces añadiendo 150 μL de tampón FACS a los pocillos y girando la placa a 4 °C y 327 × g durante 5 min.
- Prepare tubos FACS marcados con 200 μL de tampón FACS. Resuspender los pellets en 150 μL de tampón FACS. Filtrar individualmente cada muestra en su tubo FACS correspondiente utilizando un filtro de 100 μm. Mantener en hielo o a 4 °C y protegido de la luz hasta que esté listo para analizar.
- Analice las células usando un citómetro de flujo.
8. Ensayo de placa para enumerar IAV
- Prepare los medios necesarios de la siguiente manera:
- Preparar el medio de infección disolviendo 2,5 g de albúmina sérica bovina (BSA) en 40 ml de DMEM mientras agita a 37 °C durante 10-20 min hasta que se disuelva. Filtrar-esterilizar en 460 mL de DMEM.
- Preparar celulosa microcristalina al 2,4% disolviendo 1,2 mg de celulosa microcristalina en 50 ml deH2O. Autoclave en el ajuste líquido y almacenar a temperatura ambiente.
- Prepare el 5% de BSA DMEM disolviendo 2,5 g de BSA en 40 ml de DMEM mientras agita a 37 ° C durante 10-20 min. Agregue los 10 ml restantes de DMEM para un volumen final de 50 ml. Filtrar-esterilizar y conservar a 4 °C.
- Prepare 2x MEM/0.5% BSA mezclando 1 ml de 5% BSA DMEM con 9 mL de 2x MEM.
- Prepare un medio de superposición de baja viscosidad mezclando una proporción 1:1 de celulosa microcristalina al 2,4% y 2x MEM/0,5% BSA con tripsina TPCK (inhibidor de la quimotripsina) de 1 mg/ml.
- Prepare EMEM/10% FBS mezclando 450 ml de Medio Esencial Mínimo (EMEM) de Eagle con 50 ml de FBS inactivado por calor.
- Cultivar la línea celular de riñón canino Madin-Darby (MDCK). Agregue las células de un vial comprado a 5 ml de EMEM/FBS al 10% en un matraz tratado con cultivo de tejidos T-25. Incubar durante 3-5 días a 37 °C/5% deCO2 hasta que las células alcancen el 100% de confluencia. Compruebe la confluencia como en el paso 2.3.
- Retire y deseche el medio de cultivo y enjuague 2 veces con 5 ml de PBS a temperatura ambiente. Añadir 1 ml de tripsina-EDTA al matraz e incubar a 37 °C/ 5% deCO2 durante 10-15 min hasta que las células se desprendan. Una vez levantado, neutralizar con 4 mL de EMEM/10% FBS para obtener una suspensión celular a 2 × 105 células/mL.
- Sembrar las células MDCK en una placa tratada con cultivo de tejido de 12 pocillos agregando 1 ml de células resuspendidas por pocillo (a 2 × 105 células/pocillo) 1 día antes de comenzar el ensayo de placa.
NOTA: Asegúrese de que las células alcancen el 100% de confluencia antes de usarlas e incuben durante más tiempo si es necesario para alcanzar la confluencia. - Para su uso como estándar, efectuar diluciones seriadas de 10 veces (106-10 1) de la cepa IAV (de un título conocido) en el medio de infección enumerado en el paso 8.1.1. Hacer 1,2 ml de cada dilución para probar por triplicado.
- Descongelar el órgano homogeneiza en hielo. Girar sobre una centrífuga de mesa a 2.000 × g y recoger el sobrenadante transparente.
- Repita el paso 8.5 pero con el sobrenadante de las muestras del paso 8.6.
- Aspirar el medio de las células y lavar 2x con 1 ml de PBS para eliminar todo el FBS.
- Agregue 300 μL de cada dilución estándar o muestra diluida en serie suavemente a lo largo del lado de cada pocillo, comenzando desde la dilución más alta hasta la más baja, y hágalo por triplicado.
- Colocar las placas en la incubadora a 37 °C/5% deCO2, agitando la placa cada 10 min durante un total de 50 min. Asegúrese de colocarlos planos en la incubadora y no los apile.
- Después de los 50 minutos, lave las células 2 veces con 1 ml de PBS.
- Agregue 2 ml del medio de recubrimiento de baja viscosidad en cada pocillo, excepto en los pocillos de dilución más baja y sin virus; A esos, agregue medio de infección y tripsina.
- Coloque la placa de nuevo en la incubadora a 37 °C / 5% deCO2 durante 2-4 días para lograr placas que se puedan visualizar a simple vista.
- Lave las placas agregando 2 ml de PBS en cada pocillo rápidamente desde un lado y agite suavemente para suspender el medio de recubrimiento de baja viscosidad sedimentado.
- Deseche todo el volumen de líquido en el pozo pipeteando suavemente el medio.
- Repita el lavado una vez más con 2 ml de PBS en cada pocillo y luego deseche todo el volumen de líquido con un pipeteo suave.
- Para fijar las placas, agregue 500 μL de paraformaldehído al 4% en cada pocillo, agite y deje reposar durante 30 minutos.
- Lave lentamente el costado con 1 ml de PBS; Luego, deseche suavemente el líquido.
- Agregue 500 μL de violeta cristal al 1% (diluido en agua) a cada pocillo para cubrir la monocapa celular. Incubar durante 5 min.
- Lavar con 1 ml de agua del grifo. Asegúrese de desechar todo el líquido en el pozo mediante un pipeteo suave. Coloque el plato boca abajo en una almohadilla para pañales para que se seque durante la noche.
- Cuente las placas visualmente y guarde las imágenes en cualquier generador de imágenes disponible.
Resultados
Se utilizaron S. pneumoniae cultivadas con biopelícula (Figura 1A) para infectar ratones (Figura 1B) utilizando un pequeño inóculo de 10 μL administrado por vía intranasal a ratones no anestesiados. Este inóculo de pequeño volumen da como resultado un transporte neumocócico consistente restringido a la nasofaringe (Figura 2A, + grupos sp) al tiempo que evita la propagación sistémica (grupos Figura 2B, C, +sp). Dos días después de la inoculación intranasal, los ratones fueron infectados con un virus de la influenza A H1N1 adaptado a murina A/PR/8/34 (IAV)22,30 administrado tanto por vía intranasal como intratraqueal para lograr un suministro consistente de cantidades específicas a la nasofaringe y los pulmones 23.
Aquí, el modelo se utilizó para comparar el curso de la enfermedad después de la infección viral en ratones desafiados por vía intranasal con diferentes cepas de S. pneumoniae, incluyendo TIGR4 y D39, que son cepas invasivas que resultan en neumonía que progresa a bacteriemia, y EF3030, que es una cepa de otitis media 21,24,25,26,31. La presentación de la enfermedad en ratones coinfectados con S. pneumoniae/IAV dependió de la cepa bacteriana (Figura 2). Si bien no hubo diferencias significativas en el número bacteriano de nasofaringe (Figura 2A) entre ninguna de las cepas, S. pneumoniae TIGR4 y D39, pero no EF3030, se diseminaron a los pulmones 48 h después de la infección por IAV (Figura 2B). El cuarenta por ciento de los ratones infectados intranasalmente con S. pneumoniae TIGR4 mostraron diseminación bacteriana a los pulmones, y de ellos, la mitad de ellos se volvieron bacteriémicos (Figura 2C), consistente con hallazgos previos23.
Los ratones infectados por vía intranasal con S. pneumoniae D39 mostraron una diseminación más eficiente, porque se observó diseminación a los pulmones en el 100% de los ratones coinfectados (Figura 2B). Similar a S. pneumoniae TIGR4, la mitad de ellos experimentaron bacteriemia (Figura 2C). En el seguimiento de la supervivencia general, independientemente de la cepa bacteriana, la tasa de supervivencia de los ratones coinfectados fue significativamente menor que la de los ratones desafiados individualmente con S. pneumoniae sola para todas las cepas probadas (Figura 2D). En comparación con los ratones control desafiados con IAV solo, los ratones infectados intranasalmente con S. pneumoniae TIGR4 y D39, pero no EF3030, mostraron tasas aceleradas de enfermedad. Para el día 2 después de la infección por IAV, el 30% (D39) y el 20% (TIGR4) de los ratones habían sucumbido, mientras que los grupos de control solo de IAV no comenzaron a sucumbir hasta el día 5 después del desafío (Figura 2D). Los ratones coinfectados con S. pneumoniae EF3030 e IAV tenían síntomas retardados, más similares a los controles solo de IAV (Figura 2D). Estos hallazgos demuestran que el modelo de coinfección da como resultado la enfermedad en ratones jóvenes sanos que depende de la cepa bacteriana, lo que lo hace ideal para explorar los factores bacterianos requeridos en cada paso de la progresión de la enfermedad.
Este modelo se utilizó para evaluar la presencia de varias células inmunes en los pulmones (tipos de células y estrategia de compuerta en la Figura 3) después de la infección por IAV en ratones inoculados intranasalmente con diferentes cepas de S. pneumoniae. Las cepas bacterianas D39 y TIGR4, que se dispersaron en los pulmones después de la infección por IAV, provocaron un aumento significativo por encima de la línea de base (no infectadas) en la afluencia de células inmunes inflamatorias de la circulación, como neutrófilos (PMN) y monocitos, mientras que EF3030 no lo hizo (Figura 4A-C). La infección por IAV sola provocó un aumento significativo por encima de la línea de base en la afluencia de células inmunes importantes para la defensa del huésped contra la infección viral, como las células NK y las células T gamma-delta (Figura 4A-C). Estas respuestas antivirales se atenuaron significativamente en ratones infectados intranasalmente con S. pneumoniae antes del desafío viral (Figura 4A-C). Esto es consistente con estudios previos que evaluaron las respuestas de citoquinas que encontraron que el transporte de S. pneumoniae embotó la producción de interferones tipo I y deterioró la capacidad del huésped para controlar las cargas de IAV en los pulmones23. Estos hallazgos demuestran que el modelo de coinfección se puede utilizar para estudiar cómo cambian las respuestas inmunes en las infecciones mono versus polimicrobianas.
Este modelo también se utilizó para evaluar el efecto del envejecimiento en el curso de la enfermedad después de la infección por IAV en ratones infectados por vía intranasal con S. pneumoniae TIGR4. En ratones infectados individualmente, los títulos virales no variaron entre las cohortes jóvenes y envejecidas (Figura 5A)23. Al igual que en estudios anteriores23, los ratones viejos mostraron signos de enfermedad más tempranos y significativamente más graves en comparación con sus homólogos jóvenes, como lo demuestran las puntuaciones clínicas más altas (Figura 5B). De acuerdo con los síntomas de la enfermedad, los ratones viejos inoculados con S. pneumoniae comenzaron a morir más rápido dentro de las 24 h posteriores a la infección por IAV, y todos sucumbieron a la enfermedad, mientras que los controles jóvenes sobrevivieron a la infección a una tasa significativamente mayor (33%) (Figura 5C). Estos hallazgos demuestran que el modelo de coinfección se puede utilizar para detectar enfermedades más graves en huéspedes vulnerables, por lo que es ideal para explorar los factores del huésped que confieren resistencia o susceptibilidad a la coinfección.
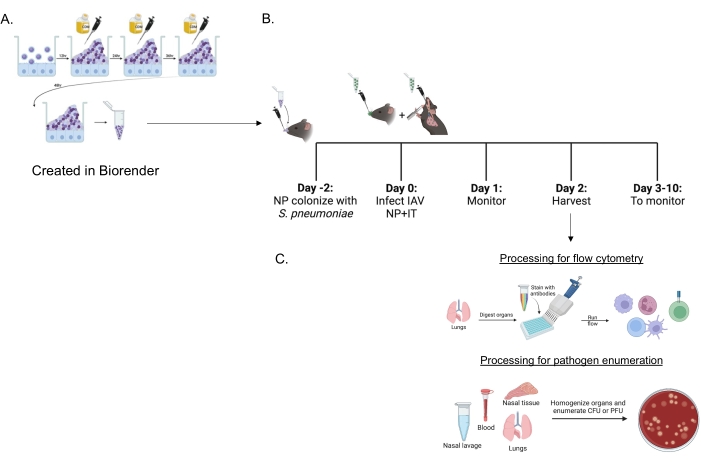
Figura 1: Cronología de la coinfección y el procesamiento de órganos para la evaluación de la afluencia de células inmunes y la carga de patógenos . (A) Streptococcus pneumoniae se cultivan en biopelículas. (B) Los ratones se inoculan por vía intranasal con 5 × 106 UFC de la cepa de S. pneumoniae cultivada en biopelícula indicada para establecer el transporte nasofaríngeo o no se tratan. Cuarenta y ocho horas después, los ratones son tratados simuladamente con PBS o reciben 200 PFU del virus de la influenza A PR8 por vía intranasal y 20 PFU por vía intratraqueal. Los ratones son monitoreados a lo largo del tiempo para las puntuaciones de la enfermedad clínica y la supervivencia. (C) A las 48 h después de la infección por IAV, se evalúan la UFC bacteriana o la UFP viral en los diferentes órganos o la afluencia de células inmunes en los pulmones. Abreviaturas: UFC = unidades formadoras de colonias; PFU = unidades formadoras de placa; IAV = influenza A virus PR8; IT = intratraqueal; NP = nasofaríngea. Haga clic aquí para ver una versión más grande de esta figura.
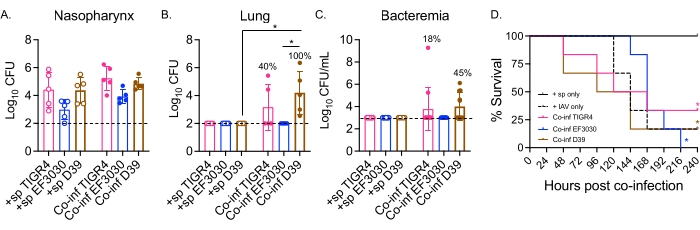
Figura 2: La infección intranasal / intratraqueal dual por IAV de ratones inoculados con S. pneumoniae conduce a la propagación bacteriana y a la enfermedad que depende de la cepa bacteriana. Los ratones machos C57BL/6 (B6) jóvenes (10-12 semanas de edad) fueron infectados como en la Figura 1. Los números bacterianos en la (A) nasofaringe, (B) pulmones y (C) sangre se determinaron a las 48 h después de la infección por IAV. (B,C) Los porcentajes denotan la fracción de ratones que exhibieron propagación. (D) La supervivencia se monitorizó durante 10 días después de la infección por IAV. Se muestran los datos agrupados de (A,B) n = 5, (C) n = 11 y (D) n = 6 ratones por grupo. Cada círculo corresponde a un ratón, y las líneas discontinuas indican el límite de detección. (A-C) *, indica una diferencia significativa (p < 0,05) entre los grupos indicados según lo determinado por la prueba de Kruskal-Wallis. (D) *, indica una diferencia significativa (p < 0,05) entre ratones +sp y Co-inf por cepa bacteriana según lo determinado por la prueba de rango logarítmico (Mantel-Cox). Abreviaturas: +sp = ratones infectados por vía intranasal con bacterias utilizando únicamente la cepa indicada; Co-inf = ratones infectados con bacterias que fueron infectados con IAV; IAV = ratones que recibieron el virus de la influenza A; UFC = unidades formadoras de colonias. Haga clic aquí para ver una versión más grande de esta figura.
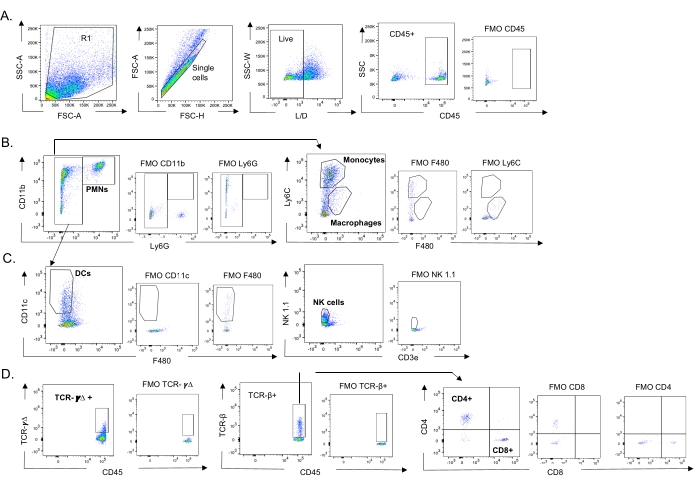
Figura 3: Estrategia de activación de células inmunes. Se cosecharon los pulmones y se determinó la afluencia de células inmunes mediante citometría de flujo. Se muestra la estrategia de compuerta representativa de los diferentes tipos de células. (A) CD45+, células individuales vivas fueron activadas y los porcentajes de (B) PMNs (Ly6G+, CD11b+), macrófagos (Ly6G-, Ly6C-, F480+), y monocitos (Ly6G-, Ly6C+), (C) DCs (Ly6G-, CD11c+) y células NK (NK1.1+, CD3-), (D) TCR- γΔ y CD8 (CD8+, TCRβ+) y CD4 (CD4+, TCRβ+ ) Se determinaron las células T. Abreviaturas: SSC-A = área de pico de dispersión lateral; FSC-A = área de pico de dispersión hacia adelante; FSC-H = altura del pico de dispersión hacia adelante; SSC-W = ancho de pico de dispersión lateral; L/D = vivo/muerto; FMO = fluorescente menos uno; NK = asesino natural; PMN = leucocito polimorfonuclear; DC = célula dendrítica; TCR = receptor de células T. Haga clic aquí para ver una versión más grande de esta figura.
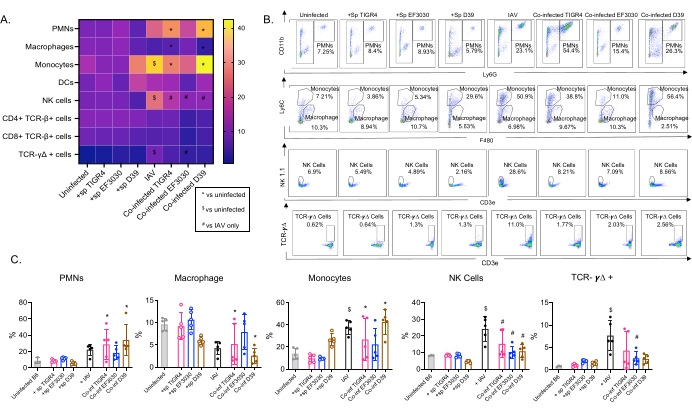
Figura 4: Las respuestas inmunes pulmonares dependen de la cepa bacteriana. Los ratones machos C57BL / 6 jóvenes (10-12 semanas de edad) no estaban infectados, se inocularon individualmente con la cepa indicada de Streptococcus pneumoniae (+sp), se desafiaron individualmente con IAV (IAV) o se coinfectaron con S. pneumoniae e IAV (Co-inf). Cuarenta y ocho horas después de la infección por IAV (ver el diseño experimental en la Figura 1), se recolectaron los pulmones y la afluencia de células inmunes se determinó mediante citometría de flujo siguiendo la estrategia de compuerta en la Figura 3. (A) Los porcentajes promedio de cada tipo de célula indicado dentro de la puerta CD45 se muestran para todos los grupos de tratamiento en el mapa de calor. (B) Se muestran diagramas de puntos representativos de tipos de células que mostraron diferencias significativas entre los tratamientos para cada grupo de ratones. (C) Se muestran los porcentajes de los tipos de células inmunes indicadas. Cada círculo corresponde a un ratón. (A,C) Se muestran los datos agrupados de n = 5 ratones por grupo. *, indica una diferencia significativa (p < 0,05) entre Co-inf y no infectados; $, indica un significativo entre IAV y no infectado; #, indica una diferencia significativa entre Co-inf e IAV solo. Las diferencias significativas entre los grupos de desafío para cada tipo de célula se determinaron mediante ANOVA seguido de la prueba de Tukey. Abreviaturas: NK = asesino natural; PMN = leucocito polimorfonuclear; DC = célula dendrítica; TCR = receptor de células T; IAV = virus de la influenza A. Haga clic aquí para ver una versión más grande de esta figura.
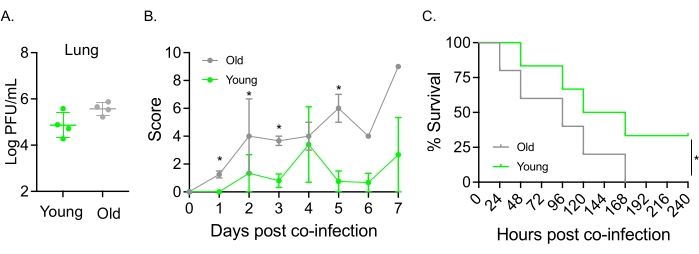
Figura 5: Envejecimiento y aumento de la susceptibilidad del huésped a la coinfección IAV/Streptococcus pneumoniae . Los ratones machos jóvenes (10-12 semanas) y envejecidos (21-22 meses) C57BL/6 fueron coinfectados con S. pneumoniae TIGR4 i.n. e IAV i.n. e i.t. (como en la Figura 1) o desafiados individualmente con IAV solo. (A) Los títulos virales se determinaron 48 h después. Los asteriscos indican significación estadística (p < 0,05) según lo determinado por la prueba t de Student. Los datos se agrupan a partir de n = 4 ratones por grupo. (B) La puntuación clínica y (C) la supervivencia fueron monitoreadas a lo largo del tiempo. (B) Se muestra la media ± SEM agrupada a partir de n = 6 ratones por grupo. Los asteriscos indican significación estadística (p < 0,05) entre los ratones jóvenes versus viejos en el punto de tiempo indicado según lo determinado por la prueba de Mann-Whitney. (C) Los datos se agrupan a partir de n = 6 ratones por grupo. Los asteriscos indican significación estadística (p < 0,05) entre los ratones jóvenes versus los viejos según lo determinado por la prueba de rango logarítmico (Mantel-Cox). Abreviaturas: IAV = virus de la influenza A; i.n. = intranasal; i.t. = intratraqueal; SEM = error estándar de la media. La figura 5A se reproduce con permiso de Joma et al.23. Haga clic aquí para ver una versión más grande de esta figura.
| Stock Mix I para MDL | |
| Adenina | 0,1 g |
| D-Alanina | 0,25 g |
| CaCl2 Anhidro | 0,025 g |
| Sulfato de manganeso | 0,03 g |
| Cianocobalamina | 100 μL de stock de 10 mg/ml |
| Ácido paraaminobenzoico | 400 μL de stock de 5 mg/ml |
| Piridoxamina 2HCl | 100 μL de stock de 10 mg/ml |
| Stock de Mix II para MDL | |
| Guanina | 0,05 g |
| Uracilo | 0,05 g |
| Stock Mix III para MDL | |
| Nitrato férrico 9H2O | 50 mg/ml |
| Sulfato Férrico 7H2O | 10 mg/ml |
| Stock mixto IV para MDL | |
| Dinucleótido de beta-nicotinamida adenina | 25 mg/ml |
Cuadro 1: Mezcla de existencias I, II, III y IV para el MDL. Abreviatura: CDM = medios químicamente definidos.
| Stock de mezcla de vitaminas para CDM | |
| Clorhidrato de piridoxal | 0,8 g |
| Tiamina Cl2 | 0,4 g |
| Riboflavina | 0,4 g |
| Ca-pantotenato | 0,4 g |
| Biotina | 0,04 g |
| Ácido fólico | 0,4 g |
| Niacinamida | 0,4 g |
Tabla 2: Stock de mezcla de vitaminas para CDM. Abreviatura: CDM = medios químicamente definidos.
| Stock de aminoácidos para CDM | |
| L-Alanina | 0,480 g |
| L-arginina | 0,250 g |
| L-Asparagina | 0,700 g |
| Ácido L-aspártico | 0,600 g |
| L-cisteína | 1.000 g |
| L-cistina | 0,100 g |
| Ácido L-glutámico | 0,200 g |
| L-Glutamina | 0,780 g |
| L-glicina | 0,350 g |
| L-histidina | 0,300 g |
| L-isoleucina | 0,430 g |
| L-Leucina | 0,950 g |
| L-lisina | 0,880 g |
| L-Metionina | 0,250 g |
| L-fenilalanina | 0,550 g |
| L-Prolina | 1.350 g |
| L-Serina | 0,680 g |
| L-treonina | 0,450 g |
| L-triptófano | 0,100 g |
| L-Valina | 0,650 g |
Tabla 3: Stock de aminoácidos para CDM. Abreviatura: CDM = medios químicamente definidos.
| Stock inicial para MDL | |
| Dextrosa | 1,0 g |
| Sulfato de magnesio-7-hidrato | 0,070 g |
| Fosfato de potasio dibásico | 0,02 g |
| Fosfato de potasio monobásico | 0,1 g |
| Acetato de sodio anhidro | 0,45 g |
| Bicarbonato de sodio | 0,25 g |
| Fosfato de sodio dibásico | 0,735 g |
| Fosfato de sodio monobásico | 0,32 g |
| Suplementos finales para el MDL | |
| Cloruro de colina | 0,1 g |
| L-cisteína HCl | 0,075 g |
| Bicarbonato de sodio | 0,25 g |
Cuadro 4: Existencias iniciales y suplementos finales para el MDL. Abreviatura: CDM = medios químicamente definidos.
| Anticuerpo/fluoróforo | Clon | Factor de dilución |
| L/D para excitación UV | N/A | 0.38888889 |
| Ly6G AF 488 | 1A8 | 0.25 |
| CD11b APC | M1/70 | 0.25 |
| CD11c PE | N418 | 0.18055556 |
| Bloque Fc del ratón | 2,4G2 | 0.11111111 |
| F4/80 PE Cy7 | BM8 | 0.18055556 |
| Ly6C BV605 | AL-21 | 0.25 |
| CD103 BV 421 | M290 | 0.18055556 |
| CD45 APC-eF-780 | 30-F11 | 0.18055556 |
Tabla 5: Panel de anticuerpos 1.
| Anticuerpo/fluoróforo | Clon | Factor de dilución |
| L/D para excitación UV | N/A | 0.388888889 |
| TCR-β APC Cy7 | H57-597 | 0.180555556 |
| CD4 V450 (azul Pacífico) | RM4-5 | 0.25 |
| CD8 BV650 | 53-6.7 | 0.180555556 |
| Bloque Fc del ratón | 2,4G2 | 0.111111111 |
| CD45 PE | 30-F11 | 0.180555556 |
| CD3 AF488 | 145-2C11 | 0.180555556 |
| TCR- γΔ APC | GL-3 | 0.180555556 |
| NK1.1 AF 700 | PK136 | 0.180555556 |
Tabla 6: Panel de anticuerpos 2.
Discusión
La mayoría de los estudios experimentales de coinfección por S. pneumoniae / IAV existentes se basan en la administración bacteriana en los pulmones de ratones preinfectados con IAV. Estos modelos han ayudado a identificar cambios en el ambiente pulmonar y la respuesta inmune sistémica que hacen que el huésped sea susceptible a la infección bacteriana secundaria 15,16,17,32,33,34,35,36,37. Sin embargo, estos modelos no han logrado imitar la transición de S. pneumoniae de un colonizador asintomático a un patógeno capaz de causar infecciones pulmonares y sistémicas graves. Además, estos modelos no son adecuados para estudiar los factores del huésped y las interacciones huésped-patógeno en el tracto respiratorio superior que contribuyen a la susceptibilidad a la infección. Un modelo previo para el movimiento de neumococos de la nasofaringe al pulmón después de la infección por IAV se basó en la infección bacteriana de la nasofaringe seguida de una infección viral. Sin embargo, no logró reproducir los signos graves de enfermedad observados en pacientes humanos21. El modelo modificado de infección murina descrito aquí recapitula la transición de S. pneumoniae de portador asintomático a un patógeno que causa enfermedad clínica grave.
Un paso crítico de este modelo es establecer la infección por S. pneumoniae en la nasofaringe. Streptococcus pneumoniae forma biofilms y coloniza la nasofaringe con diferentes eficiencias21,38. Para establecer una infección consistente, se requieren al menos 5 × 106 UFC de las cepas bacterianas cultivadas en biopelícula probadas hasta ahora23. Se recomienda que cualquier nueva cepa bacteriana sea probada para una infección estable de la nasofaringe antes de la infección viral. Para la coinfección viral, estudios previos han encontrado que la infección intranasal con IAV es necesaria para la dispersión de las bacterias de la nasofaringe21,22,23. En esos estudios previos, se utilizaron 500 PFU de IAV para la administración intranasal, mientras que en este estudio, 200 PFU fueron suficientes para aumentar el número de bacterias en la nasofaringe. La infección por IAV no se limita a las vías aéreas superiores y puede extenderse a los pulmones39,40, lo que es clave para hacer que el ambiente pulmonar sea más permisivo para la infección bacteriana15,16,41. La administración de IAV a los pulmones se puede lograr mediante administración intranasal o instalación intratraqueal de ratones anestesiados. Trabajos previos con ratones BALB/cByJ encontraron que la administración intranasal resulta en neumonía viral21; sin embargo, el acceso del inóculo a los pulmones después de la inoculación intranasal está más restringido en ratones C57BL/6. En ratones C57BL/6, se requiere una instalación intratraqueal para la administración consistente del virus23. En este modelo, la colonización bacteriana previa acelera la presentación de los síntomas de la enfermedad después de la infección viral23. Como la infección viral puede causar síntomas de enfermedad con una posible variación en la cinética, se recomienda probar primero un rango de dosis para cualquier nueva cepa viral probada y elegir una dosis que revele una cinética acelerada en huéspedes coinfectados.
Los pulmones proporcionan otra lectura crítica para la evaluación de la enfermedad en este modelo. Para la evaluación de la carga de patógenos y la afluencia de células inmunes, se puede utilizar un pulmón del mismo ratón. Sin embargo, como la gravedad de la infección y la inflamación pueden diferir entre los lóbulos, se recomienda no tomar diferentes lóbulos del mismo pulmón para las diversas evaluaciones. Más bien, todos los lóbulos se pueden picar en trozos pequeños, mezclarse bien y luego analizarse por igual para las diferentes evaluaciones. Del mismo modo, la nasofaringe se puede utilizar para la enumeración de UFC bacteriana o PFU viral y respuesta inmune. Sin embargo, el número de células obtenidas de los lavados y el tejido es demasiado bajo para realizar la citometría de flujo sin agrupar las muestras de ratones dentro del mismo grupo. Alternativamente, la inflamación en la nasofaringe puede ser evaluada histológicamente23.
Una característica crítica de este modelo es que recapitula la enfermedad clínica observada en los pacientes. En humanos, la neumonía neumocócica secundaria después de la infección por IAV a menudo resulta en signos obvios de enfermedad, incluyendo tos, disnea, fiebre y dolores musculares que pueden conducir a hospitalizaciones, insuficiencia respiratoria e incluso la muerte 8,15,42,43. Este modelo recapitula los signos graves de enfermedad clínica observados en humanos en términos de dificultad para respirar (reflejada en la puntuación respiratoria) y malestar general (reflejado en las puntuaciones de postura y movimiento) mostrados por los ratones, así como la muerte en algunos de los controles jóvenes sanos. Los síntomas exacerbados de la enfermedad en ratones coinfectados son probablemente el resultado tanto de la diseminación bacteriana a los pulmones como de la alteración de la depuración viral en ratones con porte neumocócico23. Una limitación del modelo es que la incidencia de enfermedad clínica y diseminación bacteriana de la nasofaringe varía entre ratones y está influenciada por la cepa bacteriana, la edad del huésped y el genotipo21,22,23. Reflejando esto, para cepas invasivas, la progresión de la infección localizada (sin bacteriemia detectable) a la muerte puede ocurrir dentro de las 24 h. Por lo tanto, para una verdadera evaluación de la propagación sistémica, la bacteriemia debe seguirse durante intervalos más cortos (cada 6-12 h). Del mismo modo, la puntuación de la enfermedad puede cambiar rápidamente, particularmente en las primeras 72 h después de la coinfección. Por lo tanto, para seguir de cerca los síntomas de la enfermedad, es aconsejable controlar a los ratones tres veces al día durante los días 1-3 posteriores a la infección por IAV.
En resumen, este modelo replica el movimiento de S. pneumoniae de un colonizador asintomático de la nasofaringe a un patógeno capaz de causar enfermedad pulmonar y sistémica tras la infección por IAV. En este modelo, el IAV desencadena la transición de S. pneumoniae a través de la modificación del comportamiento bacteriano en la nasofaringe, aumentando la diseminación bacteriana al pulmón y alterando la inmunidad antibacteriana23. Del mismo modo, el transporte bacteriano embota las respuestas inmunes antivirales y perjudica la eliminación del IAV de los pulmones23. Esto hace que este modelo sea ideal para analizar los cambios en las respuestas inmunes en infecciones únicas versus polimicrobianas. Además, el curso de la enfermedad después de la coinfección depende, en parte, de la cepa de neumococos presentes en la nasofaringe. Por lo tanto, el modelo es adecuado para diseccionar los factores bacterianos necesarios para la colonización asintomática versus la transición patógena de S. pneumoniae. Por último, este modelo reproduce la susceptibilidad del envejecimiento a las coinfecciones, y aunque esto no se probó aquí, se puede utilizar fácilmente para evaluar el impacto de los antecedentes del huésped en el curso de la enfermedad. En conclusión, separar el transporte y la enfermedad en distintos pasos brinda la oportunidad de analizar las variantes genéticas tanto de los patógenos como del huésped, lo que permite el examen detallado de las interacciones de un patobiológico importante con el huésped en diferentes fases de la progresión de la enfermedad. En el futuro, este modelo se puede utilizar para adaptar las opciones de tratamiento para los huéspedes vulnerables.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Nos gustaría agradecer a Nick Lenhard por la lectura crítica y edición de este manuscrito. También nos gustaría agradecer a Andrew Camilli y Anthony Campagnari por las cepas bacterianas y a Bruce Davidson por las cepas virales. Este trabajo fue apoyado por la Subvención del Instituto Nacional de Salud (R21AG071268-01) a J.L. y las Subvenciones del Instituto Nacional de Salud (R21AI145370-01A1), (R01AG068568-01A1), (R21AG071268-01) a E.N.B.G.
Materiales
| Name | Company | Catalog Number | Comments |
| 4-Aminobenzoic acid | Fisher | AAA1267318 | Mix I stock |
| 96-well round bottom plates | Greiner Bio-One | 650101 | |
| 100 µm Filters | Fisher | 07-201-432 | |
| Adenine | Fisher | AC147440250 | Mix I stock |
| Avicel | Fisher | 501785325 | Microcyrstalline cellulose |
| BD Cytofix Fixation Buffer | Fisher | BDB554655 | Fixation Buffer |
| BD Fortessa | Flow cytometer | ||
| BD Intramedic Polyethylene Tubing | Fisher | 427410 | Tubing for nasal lavage |
| BD Disposable Syringes with Luer-Lok Tips (1 mL) | Fisher | 14-823-30 | |
| BD Microtainer Capillary Blood Collector and BD Microgard Closure | Fisher | 02-675-185 | Blood collection tubes |
| Beta-Nicotinamide adenine dinucleotide | Fisher | AAJ6233703 | Mix IV stock |
| Biotin | Fisher | AC230090010 | Vitamin stock |
| C57BL/6J mice | The Jackson Laboratory | #000644 | Mice used in this study |
| Calcium Chloride Anhydrous | Fisher Chemical | C77-500 | Mix I stock |
| CD103 BV 421 | BD Bioscience | BDB562771 | Clone: M290 DF 1:200 |
| CD11b APC | Invitrogen | 50-112-9622 | Clone: M1/70, DF 1:300 |
| CD11c PE | BD Bioscience | BDB565592 | Clone: N418 DF 1:200 |
| CD3 AF 488 | BD Bioscience | OB153030 | Clone: 145-2C11 DF 1:200 |
| CD4 V450 | BD Horizon | BDB560470 | Clone: RM4.5 DF 1:300 |
| CD45 APC eF-780 | BD Bioscience | 50-112-9642 | Clone: 30-F11 DF 1:200 |
| CD45 PE | Invitrogen | 50-103-70 | Clone: 30-F11 DF 1:200 |
| CD8α BV 650 | BD Horizon | BDB563234 | Clone: 53-6.7 DF 1:200 |
| Choline chloride | Fisher | AC110290500 | Final supplement to CDM |
| Corning Disposable Vacuum Filter/Storage Systems | Fisher | 09-761-107 | Filter sterilzation apparatus |
| Corning Tissue Culture Treated T-25 Flasks | Fisher | 10-126-9 | |
| Corning Costar Clear Multiple Well Plates | Fisher | 07-201-590 | |
| Corning DMEM With L-Glutamine and 4.5 g/L Glucose; Without Sodium Pyruvate | Fisher | MT10017CM | |
| Cyanocobalamin | Fisher | AC405925000 | Mix I stock |
| D39 | National Collection of Type Culture (NCTC) | NCTC 7466 | Streptococcus pneumoniae strain |
| D-Alanine | Fisher | AAA1023114 | Mix I stock |
| D-Calcium pantothenate | Fisher | AC243301000 | Vitamin stock |
| Dextrose | Fisher Chemical | D16-500 | Starter stock |
| Dnase | Worthington Biochemical | LS002147 | |
| Eagles Minimum Essential Medium | ATCC | 30-2003 | |
| EDTA | VWR | BDH4616-500G | |
| EF3030 | Center for Disease Control and Prevention | Available via the isolate bank request | Streptococcus pneumoniae strain, request using strain name |
| F480 PE Cy7 | BD Bioscience | 50-112-9713 | Clone: BMB DF 1:200 |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | 50 mL round bottom tube |
| Falcon Round-Bottom Polypropylene Test Tubes With Cap | Fisher | 14-959-11B | 15 mL round bottom tube |
| Falcon Round-Bottom Polystyrene Test Tubes (5 mL) | Fisher | 14-959-5 | FACS tubes |
| FBS | Thermofisher | 10437-028 | |
| Ferric Nitrate Nonahydrate | Fisher | I110-100 | Mix III stock |
| Fisherbrand Delicate Dissecting Scissors | Fisher | 08-951-5 | Instruments used for harvest |
| Fisherbrand Disposable Inoculating Loops | Fisher | 22-363-602 | Inoculating loops |
| Fisherbrand Dissecting Tissue Forceps | Fisher | 13-812-38 | Forceps for harvest |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5 mL | Fisher | 05-408-137 | Micocentrifuge tubes |
| Fisherbrand Sterile Syringes for Single Use (10 mL) | Fisher | 14-955-459 | |
| Folic Acid | Fisher | AC216630500 | Vitamin stock |
| Gibco RPMI 1640 (ATCC) | Fisher | A1049101 | |
| Gibco DPBS, no calcium, no magnesium | Fisher | 14190250 | |
| Gibco HBSS, calcium, magnesium, no phenol red | Fisher | 14025134 | |
| Gibco MEM (Temin's modification) (2x), no phenol red | Fisher | 11-935-046 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher | 15-140-122 | |
| Gibco Trypan Blue Solution, 0.4% | Fisher | 15-250-061 | |
| Gibco Trypsin-EDTA (0.25%), phenol red | Fisher | 25-200-056 | |
| Glycerol (Certified ACS) | Fisher | G33-4 | |
| Glycine | Fisher | AA3643530 | Amino acid stock |
| Guanine | Fisher | AAA1202414 | Mix II stock |
| Invitrogen UltraComp eBeads Compensation Beads | Fisher | 50-112-9040 | |
| Iron (II) sulfate heptahydrate | Fisher | AAA1517836 | Mix III stock |
| L-Alanine | Fisher | AAJ6027918 | Amino acid stock |
| L-Arginine | Fisher | AAA1573814 | Amino acid stock |
| L-Asparagine | Fisher | AAB2147322 | Amino acid stock |
| L-Aspartic acid | Fisher | AAA1352022 | Amino acid stock |
| L-Cysteine | Fisher | AAA1043518 | Amino acid stock |
| L-Cysteine hydrochloride monohydrate | Fisher | AAA1038914 | Final supplement to CDM |
| L-Cystine | Fisher | AAA1376218 | Amino acid stock |
| L-Glutamic acid | Fisher | AC156211000 | Amino acid stock |
| L-Glutamine | Fisher | O2956-100 | Amino acid stock |
| L-Histidine | Fisher | AC166150250 | Amino acid stock |
| LIFE TECHNOLOGIES LIVE/DEAD Fixable Blue Dead Cell Stain Kit, for UV excitation | Invitrogen | 50-112-1524 | Clone: N/A DF 1:500 |
| L-Isoleucine | Fisher | AC166170250 | Amino acid stock |
| L-Leucine | Fisher | BP385-100 | Amino acid stock |
| L-Lysine | Fisher | AAJ6222514 | Amino acid stock |
| L-Methionine | Fisher | AAA1031822 | Amino acid stock |
| Low endotoxin BSA | Sigma Aldrich | A1470-10G | |
| L-Phenylalanine | Fisher | AAA1323814 | Amino acid stock |
| L-Proline | Fisher | AAA1019922 | Amino acid stock |
| L-Serine | Fisher | AC132660250 | Amino acid stock |
| L-Threonine | Fisher | AC138930250 | Amino acid stock |
| L-Tryptophan | Fisher | AAA1023014 | Amino acid stock |
| L-Valine | Fisher | AAA1272014 | Amino acid stock |
| Ly6C BV 605 | BD Bioscience | BDB563011 | Clone: AL-21 DF 1:300 |
| Ly6G AF 488 | Biolegend | NC1102120 | Clone: IA8, DF 1:300 |
| Madin-Darby Canine Kidney (MDCK) cells | American Type Culture Collection (ATCC) | CCL-34 | MDCK cell line for PFU analuysis |
| Magnesium Sulfate 7-Hydrate | Fisher | 60-019-68 | CDM starter stock |
| Manganese Sulfate | Fisher | M113-500 | Mix I stock |
| MilQ water | Ultra-pure water | ||
| Mouse Fc Block | BD Bioscience | BDB553142 | Clone: 2.4G2 DF 1:100 |
| MWI VETERINARY PURALUBE VET OINTMENT | Fisher | NC1886507 | Eye lubricant for infection |
| NCI-H292 mucoepidermoid carcinoma cell line | ATCC | CRL-1848 | H292 lung epithelial cell line for biofilm growth |
| Niacinamide | Fisher | 18-604-792 | Vitamin stock |
| NK 1.1 AF 700 | BD Bioscience | 50-112-4692 | Clone: PK136 DF 1:200 |
| Oxyrase For Broth 50Ml Bottle 1/Pk | Fisher | 50-200-5299 | To remove oxygen from liquid cultures |
| Paraformaldehyde 4% in PBS | Thermoscientific | J19932-K2 | |
| Pivetal Isoflurane | Patterson Veterinary | 07-893-8440 | Isoflurane for anesthesia during infection |
| Potassium Phosphate Dibasic | Fisher Chemical | P288-500 | Starter stock |
| Potassium Phosphate Monobasic | Fisher Chemical | P285-500 | Starter stock |
| Pyridoxal hydrochloride | Fisher | AC352710250 | Vitamin stock |
| Pyridoxamine dihydrochloride | Fisher | AAJ6267906 | Mix I stock |
| Riboflavin | Fisher | AC132350250 | Vitamin stock |
| Sodium Acetate | VWR | 0530-500G | Starter stock |
| Sodium Azide | Fisher Bioreagents | BP922I-500 | For FACS buffer |
| Sodium Bicarbonate | Fisher Chemical | S233-500 | Starter stock and final supplement to CDM |
| Sodium Phosphate Dibasic | Fisher Chemical | S374-500 | Starter stock |
| Sodium Phosphate Monobasic | Fisher Chemical | S369-500 | Starter stock |
| TCR APC | BD Bioscience | 50-112-8889 | Clone: GL-3 DF 1:200 |
| TCRβ APC-Cy7 | BD Pharmigen | BDB560656 | Clone: H57-597 DF 1:200 |
| Thermo Scientific Blood Agar with Gentamicin | Fisher | R01227 | Blood agar plates with the antibiotic gentamicin |
| Thermo Scientific Trypsin, TPCK Treated | Fisher | PI20233 | |
| Thiamine hydrochloride | Fisher | AC148991000 | Vitamin stock |
| TIGR4 | ATCC | BAA-334 | Streptococcus pneumoniae strain |
| Uracil | Fisher | AC157300250 | Mix II stock |
| Worthington Biochemical Corporation Collagenase, Type 2, 1 g | Fisher | NC9693955 |
Referencias
- Kadioglu, A., Weiser, J. N., Paton, J. C., Andrew, P. W. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nature Reviews Microbiology. 6 (4), 288-301 (2008).
- Obaro, S., Adegbola, R. The pneumococcus: Carriage, disease and conjugate vaccines. Journal of Medical Microbiology. 51 (2), 98-104 (2002).
- Chong, C. P., Street, P. R. Pneumonia in the elderly: A review of the epidemiology, pathogenesis, microbiology, and clinical features. Southern Medical Journal. 101 (11), 1141-1145 (2008).
- Kadioglu, A., Andrew, P. W. Susceptibility and resistance to pneumococcal disease in mice. Briefings in Functional Genomics and Proteomics. 4 (3), 241-247 (2005).
- Ganie, F., et al. Structural, genetic, and serological elucidation of Streptococcus pneumoniae serogroup 24 serotypes: Discovery of a new serotype, 24C, with a variable capsule structure. Journal of Clinical Microbiology. 59 (7), 0054021 (2021).
- Centers for Disease Control and Prevention. Estimates of deaths associated with seasonal influenza --- United States. MMWR. Morbidity and Mortality Weekly Report. 59 (33), 1057-1062 (2010).
- Shrestha, S., et al. Identifying the interaction between influenza and pneumococcal pneumonia using incidence data. Science Translational Medicine. 5 (191), (2013).
- McCullers, J. A. Insights into the interaction between influenza virus and pneumococcus. Clinical Microbiology Reviews. 19 (3), 571-582 (2006).
- Pneumococcal Disease Global Pneumococcal Disease and Vaccine. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/pneumococcal/global.html (2018)
- Grudzinska, F. S., et al. Neutrophils in community-acquired pneumonia: Parallels in dysfunction at the extremes of age. Thorax. 75 (2), 164-171 (2020).
- Boe, D. M., Boule, L. A., Kovacs, E. J. Innate immune responses in the ageing lung. Clinical and Experimental Immunology. 187 (1), 16-25 (2017).
- Krone, C. L., van de Groep, K., Trzcinski, K., Sanders, E. A., Bogaert, D. Immunosenescence and pneumococcal disease: An imbalance in host-pathogen interactions. The Lancet Respiratory Medicine. 2 (2), 141-153 (2014).
- Cho, S. J., et al. Decreased NLRP3 inflammasome expression in aged lung may contribute to increased susceptibility to secondary Streptococcus pneumoniae infection. Experimental Gerontology. 105, 40-46 (2018).
- Disease Burden of Influenza. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/flu/about/burden/index.html (2018)
- McCullers, J. A. The co-pathogenesis of influenza viruses with bacteria in the lung. Nature Reviews Microbiology. 12 (4), 252-262 (2014).
- McCullers, J. A., Rehg, J. E. Lethal synergism between influenza virus and Streptococcus pneumoniae: Characterization of a mouse model and the role of platelet-activating factor receptor. The Journal of Infectious Diseases. 186 (3), 341-350 (2002).
- Metzger, D. W., Sun, K. Immune dysfunction and bacterial coinfections following influenza. Journal of Immunology. 191 (5), 2047-2052 (2013).
- Chao, Y., Marks, L. R., Pettigrew, M. M., Hakansson, A. P. Streptococcus pneumoniae biofilm formation and dispersion during colonization and disease. Frontiers in Cellular and Infection Microbiology. 4, 194 (2014).
- Bogaert, D., De Groot, R., Hermans, P. W. Streptococcus pneumoniae colonisation: The key to pneumococcal disease. The Lancet Infectious Diseases. 4 (3), 144-154 (2004).
- Simell, B., et al. The fundamental link between pneumococcal carriage and disease. Expert Review of Vaccines. 11 (7), 841-855 (2012).
- Marks, L. R., Davidson, B. A., Knight, P. R., Hakansson, A. P. Interkingdom signaling induces Streptococcus pneumoniae biofilm dispersion and transition from asymptomatic colonization to disease. mBio. 4 (4), 00438 (2013).
- Reddinger, R. M., Luke-Marshall, N. R., Sauberan, S. L., Hakansson, A. P., Campagnari, A. A. Streptococcus pneumoniae modulates Staphylococcus aureus biofilm dispersion and the transition from colonization to invasive disease. mBio. 9 (1), 02089 (2018).
- Joma, B. H., et al. A murine model for enhancement of Streptococcus pneumoniae pathogenicity upon viral infection and advanced age. Infection and Immunity. 89 (8), 0047120 (2021).
- Andersson, B., et al. Identification of an active disaccharide unit of a glycoconjugate receptor for pneumococci attaching to human pharyngeal epithelial cells. Journal of Experimental Medicine. 158 (2), 559-570 (1983).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. The Journal of Experimental Medicine. 79 (2), 137-158 (1944).
- Tettelin, H., et al. Complete genome sequence of a virulent isolate of Streptococcus pneumoniae. Science. 293 (5529), 498-506 (2001).
- Tothpal, A., Desobry, K., Joshi, S. S., Wyllie, A. L., Weinberger, D. M. Variation of growth characteristics of pneumococcus with environmental conditions. BMC Microbiology. 19 (1), 304 (2019).
- Bou Ghanem, E. N., et al. Extracellular adenosine protects against Streptococcus pneumoniae lung infection by regulating pulmonary neutrophil recruitment. PLoS Pathogens. 11 (8), 1005126 (2015).
- Bou Ghanem, E. N., et al. The alpha-tocopherol form of vitamin E boosts elastase activity of human PMNs and their ability to kill Streptococcus pneumoniae. Frontiers in Cellular and Infection Microbiology. 7, 161 (2017).
- Tait, A. R., Davidson, B. A., Johnson, K. J., Remick, D. G., Knight, P. R. Halothane inhibits the intraalveolar recruitment of neutrophils, lymphocytes, and macrophages in response to influenza virus infection in mice. Anesthesia & Analgesia. 76 (5), 1106-1113 (1993).
- Aaberge, I. S., Eng, J., Lermark, G., Lovik, M. Virulence of Streptococcus pneumoniae in mice: A standardized method for preparation and frozen storage of the experimental bacterial inoculum. Microbial Pathogenesis. 18 (2), 141-152 (1995).
- McCullers, J. A., Bartmess, K. C. Role of neuraminidase in lethal synergism between influenza virus and Streptococcus pneumoniae. The Journal of Infectious Diseases. 187 (6), 1000-1009 (2003).
- Smith, A. M., McCullers, J. A. Secondary bacterial infections in influenza virus infection pathogenesis. Current Topics in Microbiology and Immunology. 385, 327-356 (2014).
- Cundell, D. R., Gerard, N. P., Gerard, C., Idanpaan-Heikkila, I., Tuomanen, E. I. Streptococcus pneumoniae anchor to activated human cells by the receptor for platelet-activating factor. Nature. 377 (6548), 435-438 (1995).
- Ballinger, M. N., Standiford, T. J. Postinfluenza bacterial pneumonia: Host defenses gone awry. Journal of Interferon & Cytokine Research. 30 (9), 643-652 (2010).
- Sun, K., Metzger, D. W. Inhibition of pulmonary antibacterial defense by interferon-gamma during recovery from influenza infection. Nature Medicine. 14 (5), 558-564 (2008).
- Nakamura, S., Davis, K. M., Weiser, J. N. Synergistic stimulation of type I interferons during influenza virus coinfection promotes Streptococcus pneumoniae colonization in mice. Journal of Clinical Investigation. 121 (9), 3657-3665 (2011).
- Blanchette-Cain, K., et al. Streptococcus pneumoniae biofilm formation is strain dependent, multifactorial, and associated with reduced invasiveness and immunoreactivity during colonization. mBio. 4 (5), 00745 (2013).
- Rello, J., Pop-Vicas, A. Clinical review: Primary influenza viral pneumonia. Critical Care. 13 (6), 235 (2009).
- Torres, A., Loeches, I. M., Sligl, W., Lee, N. Severe flu management: A point of view. Intensive Care Medicine. 46 (2), 153-162 (2020).
- Bakaletz, L. O. Viral-bacterial co-infections in the respiratory tract. Current Opinion in Microbiology. 35, 30-35 (2017).
- Palacios, G., et al. Streptococcus pneumoniae coinfection is correlated with the severity of H1N1 pandemic influenza. PLoS One. 4 (12), 8540 (2009).
- Dhanoa, A., Fang, N. C., Hassan, S. S., Kaniappan, P., Rajasekaram, G. Epidemiology and clinical characteristics of hospitalized patients with pandemic influenza A (H1N1) 2009 infections: The effects of bacterial coinfection. Virology Journal. 8, 501 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados