Method Article
病毒合并感染后 肺炎链球菌 从定植者转变为病原体的小鼠模型概括了年龄加重的疾病
* 这些作者具有相同的贡献
摘要
本文描述了一种新的小鼠模型,用于肺炎球菌在病毒感染期间从无症状定植者转变为致病病原体。该模型可以很容易地适应研究疾病进展不同阶段和各种宿主之间的多种微生物和宿主 - 病原体相互作用。
摘要
肺炎链球菌(肺炎球菌)是大多数人鼻咽的无症状定植者,但在感染甲型流感病毒 (IAV) 后可进展为肺部和全身病原体。高龄会增加宿主对继发性肺炎球菌肺炎的易感性,并与疾病结局恶化有关。驱动这些过程的宿主因素尚未明确,部分原因是缺乏重现从无症状定植到严重临床疾病的转变的动物模型。
本文描述了一种新的小鼠模型,该模型重现了肺炎球菌在病毒感染后从无症状携带到疾病的转变。在该模型中,首先用生物膜生长的肺炎球菌鼻内接种小鼠以建立无症状携带,然后鼻咽和肺部的IAV感染。这导致细菌向肺部传播、肺部炎症和可进展为致命的明显疾病迹象。疾病程度取决于细菌菌株和宿主因素。
重要的是,该模型再现了衰老的易感性,因为与年轻小鼠相比,老年小鼠表现出更严重的临床疾病并且更频繁地屈服于疾病。通过将携带和疾病分成不同的步骤,并提供分析病原体和宿主的遗传变异的机会,这种 肺炎链球菌/IAV合并感染模型允许详细检查重要病理在疾病进展的不同阶段与宿主的相互作用。该模型还可以作为确定易感宿主继发性肺炎球菌肺炎潜在治疗靶点的重要工具。
引言
肺炎链球菌(肺炎球菌)是革兰氏阳性细菌,无症状地存在于大多数健康个体的鼻咽中1,2。在尚未完全确定的因素的促进下,肺炎球菌可以从鼻咽的良性定植者转变为扩散到其他器官的病原体,从而导致严重感染,包括中耳炎、肺炎和菌血症3。肺炎球菌疾病的表现部分取决于菌株特异性差异,包括基于荚膜多糖组成的血清型。到目前为止,已经有100多种血清型被鉴定,其中一些与更具侵袭性的感染有关4,5。其他几个因素会增加肺炎球菌疾病的风险。其中一个因素是病毒感染,其中肺炎球菌肺炎的风险增加 100 倍 IAV6,7。从历史上看,肺炎链球菌是流感后继发性细菌性肺炎的最常见原因之一,并且与更差的结果有关8。另一个主要危险因素是高龄。事实上,肺炎链球菌是65岁以上老年人社区获得性细菌性肺炎的主要原因9,10。老年人占肺炎和流感死亡的大多数(>75%),表明衰老和IAV感染这两个危险因素协同恶化疾病易感性11,12,13,14。然而,病毒感染促使肺炎球菌从无症状定植者转变为侵袭性病原体的机制以及宿主因素如何塑造的机制仍然不清楚。这主要是由于缺乏一个小动物模型来概括从无症状肺炎球菌定植到危重临床疾病的转变。
在流感感染后 7 天直接将肺炎球菌接种到肺部的小鼠中,经典地模拟了合并感染研究15,16。这再现了对继发性细菌性肺炎的易感性,是研究抗病毒免疫反应如何损害抗菌防御的理想选择17。然而,对人类的纵向研究表明,鼻咽部肺炎球菌携带,细菌可以形成无症状的生物膜18,与侵袭性疾病19,20一致相关。来自中耳、肺和血液感染的细菌分离株在基因上与鼻咽20 中发现的细菌分离株相同。因此,为了研究IAV感染后从无症状携带到侵袭性疾病的转变,建立了一个模型,其中小鼠鼻内施用生物膜生长的肺炎球菌,然后鼻咽部IAV感染21,22。上呼吸道的病毒感染导致宿主环境发生变化,导致肺炎球菌从生物膜中扩散并扩散到下呼吸道21。这些分散的细菌上调了对感染很重要的毒力因子的表达,将它们从定植者转化为病原体21。这些观察结果突出了病毒、宿主和细菌之间的复杂相互作用,并表明病毒感染引发的宿主变化对肺炎球菌行为有直接影响,这反过来又改变了细菌感染的过程。然而,该模型未能概括在人类中观察到的严重疾病迹象,可能是因为病毒仅限于鼻腔,并且病毒感染对宿主免疫和肺损伤的全身影响没有被概括。
我们最近建立了一个模型,该模型结合了宿主和病原体之间的复杂相互作用,但也更贴近地模仿了在人类中观察到的疾病严重程度23。在该模型中,小鼠首先鼻内感染生物膜生长的肺炎球菌以建立无症状携带,然后鼻咽和肺部的IAV感染。这导致细菌传播到肺部,肺部炎症和疾病在一小部分年轻小鼠中发展为致死率23。先前的研究表明,病毒和细菌感染都改变了宿主的防御:病毒感染促进了细菌传播,先前的细菌定植损害了宿主控制肺部IAV水平的能力23。检查免疫反应显示,IAV感染降低了中性粒细胞的抗菌活性,而细菌定植削弱了对抗病毒防御至关重要的I型干扰素反应23。重要的是,该模型再现了衰老的易感性。与年轻小鼠相比,老年小鼠表现出更早的疾病迹象,表现出更严重的临床疾病,并且更频繁地死于感染23。本手稿中介绍的工作表明,疾病程度也取决于细菌菌株,因为与非侵入性菌株相比,侵袭性肺炎球菌菌株在IAV感染时显示出更有效的传播,显示出更明显的肺部炎症迹象,并导致疾病发病率加快。因此,这种 肺炎链球菌/IAV混合感染模型允许详细检查病原体和宿主因素,并且非常适合研究疾病进展不同阶段对多种微生物感染的免疫反应。
研究方案
所有动物研究均按照《实验动物护理和使用指南》中的建议进行。所有程序均由布法罗大学机构动物护理和使用委员会批准。
1. 制备化学成分明确的培养基 (CDM)
- 按如下方式准备库存:
- 搅拌时将 表1 中列出的混合物I化合物溶解在100 mL超纯水中。在-20°C下以200μL等分试样储存。
- 搅拌时,将表 1 中列出的混合物 II 化合物溶解在 20 mL 的 0.1 M NaOH 中。在-20°C下以100μL等分试样储存。
- 搅拌时将表 1 中列出的混合物 III 化合物溶解在 1 mL 超纯水中。在4°C下以10μL等分试样储存。
- 搅拌时,将表1中列出的混合物IV化合物溶解在 1 mL超纯水中。在-20°C下以10μL等分试样储存。
- 在搅拌的同时,将 表2 中列出的化合物最初溶解在15 mL超纯水中。用几滴 0.1 M NaOH 将 pH 值调节至 7.0,并使用超纯水将最终体积调节至 20 mL。在-20°C下以1mL等分试样储存。
- 搅拌时,将 表3 中列出的化合物溶解在50°C热板上的90mL超纯水中。用 0.1 M NaOH 将 pH 值调节至 7.0,然后使用超纯水将最终体积调节至 100 mL。在-20°C下以5mL等分试样储存。
- 每次将 表4 中的化合物溶解在70 mL超纯水中,同时搅拌,新鲜制作起始原料。
- 向新鲜的起始储备液中,按顺序添加以下混合储备液:200 μL 混合 I 储备液(表 1)、80 μL 混合 II 储备液(表 1)、10 μL 混合 III 储备液(表 1)、10 μL 混合液 IV 储备液(表 2)、1 mL 维生素储备液(表 3)和 5 mL 氨基酸储备液(表 4)。
- 加入储备液后,通过在烧杯中加入 30 mL 超纯水,将最终体积调整为 100 mL。
- 用 表4中的化合物补充清洁发展机制。一旦充分混合,过滤灭菌并在4°C下储存最多2周。
2. 培养 肺炎链球菌 生物膜
- 通过将 445 mL RPMI 1640 与 50 mL 热灭活胎牛血清 (FBS) 和 5 mL 青霉素/链霉素分别以 10,000 U/mL 和 10,000 μg/mL 混合来制备 RP-10 培养基。
- 培养NCI-H292(H292)粘液表皮样癌细胞系。将一个购买的小瓶中的细胞添加到 T-25 组织培养处理的烧瓶中的 5 mL RP-10 培养基中。在37°C / 5%CO2 下孵育3-5天以达到100%汇合。
- 使用10倍放大镜在光学显微镜下检查细胞以评估汇合度。
注意:当所有细胞都与其他细胞接触并且之间没有间隙时,则达到所需的100%汇合度。 - 在 5 mL 室温 PBS 中洗涤细胞 2 次。确保缓冲液不含钙,以避免在以下步骤中螯合EDTA。
- 向烧瓶中加入1mL胰蛋白酶-EDTA,并在37°C / 5%CO2 下孵育5-10分钟,直到细胞分离。用 4 mL RP-10 培养基中和。通过上下移液轻轻混合,然后转移到 50 mL 锥形管中。
- 每孔向组织培养处理的 24 孔板中加入 500 μL 细胞悬液。从汇合的T-25烧瓶中,预期2×106-4×106 细胞/ mL。
- 第二天,在光学显微镜下检查细胞以确保它们汇合,如步骤2.3所示。如果不是,则孵育更长时间。
- 一旦H 292细胞在24孔板中100%汇合,用1 mL室温PBS轻轻洗涤细胞3倍,以确保没有含有抗生素或碎片的培养基残留。
- 洗涤细胞后,加入 250 μL/孔的 4% 多聚甲醛以固定细胞。在冰上孵育1小时或在4°C下孵育过夜。
- 在细胞固定的前一天晚上,将感兴趣的 肺炎链球菌 菌株划线在血琼脂平板上,并在37°C / 5%CO2下孵育过夜。
注意:此处提供的数据是通过协作交换获得的以下肺炎链球菌菌株:血清型 19F 中耳炎培养基分离株 EF3030 24、经典血清型 2 艾弗里菌株 D3925 和血清型 4 菌血症分离株 TIGR426。这些菌株也可从材料表中引用的公共收藏中获得。 - 通过将 100 μL 氧化酶 (30 U/mL) 加入 20 mL CDM 来制备 CDM 加氧化酶 (0.15 U/mL)。
注意:氧化酶用于消除氧气,以使 肺炎链球菌 在液体培养物中有效生长27。 - 通过加入 1 mL CDM + 氧酶并从平板上洗去细菌,并使用 1 mL 移液器吸头的侧面轻轻提起细菌菌落,小心不要刮琼脂,将平板中的细菌接种到新鲜的 CDM + 氧化酶中。或者,使用接种环将细菌提升并接种到含有 1 mL CDM + 氧氧化物酶的管中。
- 将CDM +氧化酶中的细菌稀释至起始OD600 为0.05。
- 在松散盖的50mL锥形管中培养细菌,静置在37°C / 5%CO 2,直到达到OD600为0.2(这将需要2-5小时之间的任何地方)。每小时检查一次 OD600,确保 OD 不超过 0.2。
- 一旦OD达到0.2,涡旋细菌培养管。在固定的H 292细胞上接种0.5 mL细菌,每孔再加入0.5 mL CDM +氧化酶培养基。向无细菌的对照孔中加入 1 mL CDM + 氧化酶。将板在34°C / 5%CO2下孵育48小时。
注意:在34°C下生长用于更紧密地模拟鼻咽部较低的温度21。 - 初始接种后每 12 小时,轻轻取出 0.5 mL 培养基并补充 0.5 mL 新鲜 CDM + 氧氧化物酶。小心不要破坏形成的生物膜。检查板底部是否有生物膜,并寻找由于生物膜的生长而随着时间的推移而增加的混浊度。为了控制污染,请检查没有细菌的孔,以确保对照孔保持清洁。
- 接种后48小时,除去上清液并用1mL PBS非常温和地洗涤2次。重悬于1 mL新鲜CDM中,并用力上下移液以提起生物膜。对于每种细菌菌株,将所有孔中的细菌汇集到 50 mL 锥形管中。轻轻地上下倾斜紧密盖的管子几次,充分混合。
- 向 50 mL 锥形管中,以等体积在 CDM 中加入 40% 甘油,以获得终浓度为 20% 甘油的细菌悬浮液。将 1 mL 分装到微量离心管中,在干冰上快速冷冻,并在 −80 °C 下保存。
- 使用前,通过在冰上解冻一个等分试样,以 1,700 × g 旋转试管 5 分钟,除去上清液,将沉淀重悬于 1 mL PBS 中,并在血琼脂平板上连续稀释28。
- 将琼脂平板在37°C / 5%CO2 下生长过夜,并在相关稀释度下计数菌落以获得菌落形成单位(CFU)/ mL中的细菌浓度。
注意:建议在冷冻后至少一天或更晚计算库存中的细菌,因为在前 24 小时内细菌活力下降。储存的冷冻等分试样可用于小鼠的后续感染最多2个月。
3.用生物膜生长的肺炎链球菌鼻内接种小鼠
- 购买小鼠并在所需年龄使用。
注意:3-4个月大的小鼠优选模拟年轻宿主,21-24个月的小鼠可用于模拟29岁的老年人>65岁。这里提供的数据是C57BL / 6雄性小鼠。 - 将生物膜生长的细菌等分试样在冰上解冻,并以 1,700 × g 旋转 5 分钟。小心地除去并丢弃上清液而不破坏沉淀,通过将沉淀重悬于1mL PBS中来洗涤细菌,并以1,700× g 再次旋转5分钟。除去上清液并将沉淀重悬于达到所需浓度所需的体积中(目标是鼻内接种的5×106CFU / 10μL)。通过将制备的接种物接种在血琼脂平板上来确认施用的细菌量,如步骤2.19所示。
- 通过将 5 μL 稀释的接种物移液到每个鼻孔中,用 5 ×10 6 CFU 鼻内接种小鼠。确保牢牢握住小鼠,稳定头部,直到吸入体积(通常在将体积移入鼻孔后的几秒钟内)。在没有麻醉的情况下执行此步骤,以防止接种物的肺吸入。
4. 病毒感染甲型流感病毒
- 在鼻内接种 肺炎链球菌后48小时,在冰上解冻感兴趣的IAV菌株。
注意:此处提供的数据是通过协作交换30获得的小鼠适应甲型流感病毒A / PR / 8 / 34 H1N1株。 - 病毒解冻后,将PBS中的病毒稀释至所需浓度;气管内感染的目标是 20 个斑块形成单位 (PFU)/50 μL,鼻内感染的目标是 200 PFU/10 μL。对于模拟感染和仅细菌组,使用PBS接种小鼠。
- 麻醉前将眼用润滑剂放在小鼠的眼睛上。使用5%异氟醚麻醉小鼠,并通过用力捏住脚趾确认麻醉。
- 一旦动物被麻醉,将其从异氟烷室中取出,并立即用50μL(20PFU)IAV感染麻醉小鼠,气管内使用钝镊将舌头拉出口腔并将体积的液体移入气管。
- 将小鼠放在单独的笼子中并监测直到完全恢复(它们能够保持胸骨卧位[能够直立躺在胸部])。
- 恢复后,立即使用步骤3.3中的接种方法向小鼠鼻内接种10μL(200PFU)IAV。
- 将经历单或双重细菌和病毒感染的小鼠与同一感染组分开,并将其与其他组分开。
5.监测小鼠的疾病症状
- 每天监测小鼠至少10天,并盲目评分以下疾病迹象:
- 减肥得分如下:0 = 5%或更低;1 = 5%-10%;2 = 10%-15%;3 = 20% 或更多。当减肥评分为3时,使用CO2 吸入对小鼠实施安乐死。
- 活动的得分如下:0 = 正常/活动;1 = 移动但略有减少;2 = 减少;3 = 严重减弱/昏昏欲睡(仅在触摸时移动),4 = 昏迷/不动。当活动评分为3时对小鼠实施安乐死。
- 姿势得分如下:0 = 无预感(正常);1 = 略微驼背的姿势;2 = 严重的预感。当姿势评分为2时对小鼠实施安乐死。
- 眼睛得分如下:0 = 正常;1 = 突出;1 = 下沉;1 = 已关闭;1 = 放电。它可以是组合。将最终眼睛评分的总数相加。
- 呼吸得分如下:0 = 正常呼吸;1 = 不规则或改变(较高/较低比率);2 = 费力(夸张的努力或喘息)。当呼吸评分为2时对小鼠实施安乐死。
- 根据上述标准,将健康(0)到重病(15)的总临床评分的个体得分相加。考虑任何显示总分高于 2 的鼠标生病。人道地对任何显示总分高于 9 或每个标准指示分数的小鼠实施安乐死,并在存活曲线上标记它们。
6. 处理感染组织以进行细菌计数
- 在IAV感染后48小时,对小鼠实施安乐死。
- 将鼠标置于仰卧位。使用70%乙醇,喷洒小鼠的胸部和腹部以清洁皮毛。使用镊子,捏住小鼠中间的皮毛和皮肤,用4.5夹剪刀剪毛,将肝脏到胸部的区域暴露出来。
- 采血
- 使用解剖剪刀,轻轻切入腹膜腔以露出肝脏。使用镊子,暴露肝脏顶部靠近横膈膜的肝门静脉。使用解剖剪刀切割肝门静脉。一旦血液开始在腹膜腔中积聚,使用微量移液管收集 10 μL 血液,并将 90 μL 抗凝剂溶液(PBS 中的 50 mM EDTA 溶液)放入微量离心管中用于电镀细菌负荷。
- 使用P-1000微量移液器收集其余血液,将其放入采血管中,并以7,600 × g 离心2分钟以收集血清。将血清保存在-80°C的微量离心管中,以便随后分析任何所需的细胞因子或代谢物。
- 肺收集
- 使用解剖剪刀,切开暴露的肋骨的两侧,然后将肋骨轻轻向上拉向小鼠头部以露出心脏。将连接到预装有PBS的10 mL注射器的25 G针头插入右心室,并开始缓慢灌注。寻找肺部漂白作为成功灌注的指标。慢慢冲洗以避免破坏肺组织。
- 用镊子提起心脏,切开肺和心脏。分离后,用镊子拾起肺的所有肺叶,并在装有无菌PBS的培养皿中冲洗以去除任何残留的血液。在培养皿中,将肺切成小块并充分混合。取出一半的肺混合物以测定细菌 CFU 或病毒 PFU,并将其放入预填充有 0.5 mL PBS 的圆底 15 mL 管中进行匀浆。
注意:重要的是不要采取同一肺的不同叶进行各种评估。相反,所有的裂片都应该切碎,混合在一起,并平均解析出来以进行不同的评估。 - 取出另一半肺进行流式细胞术(下文第7节),并将其置于非组织培养处理的24孔板中,每个孔预填充0.5mL RP-10。在室温下放置直至加工。
- 鼻咽收集
- 在脖子处,用解剖剪刀剪掉皮毛,然后剪掉肌肉,露出气管。
注意:气管是位于肌肉下方的管状结构。 - 将小镊子放在气管下,距离小鼠的下巴1厘米以稳定它。使用夹层剪刀,在气管前部轻轻切开0.1厘米的缝隙,避免完全割断气管。
- 准备一个装有 0.5 mL PBS 的 1 mL 注射器,并将 0.58 mm 管连接到 25 G 针头上。通过将导管插入向上朝鼻咽的气管中来收集鼻腔冲洗液。一旦感觉到阻力进入鼻腔,将微量离心管放在鼻子处,然后通过气管缓慢冲洗PBS以收集鼻腔灌洗液。
- 将鼠标置于俯卧位置。用乙醇喷洒小鼠头部。用解剖剪刀剪掉皮毛,用神秘垫露出老鼠的头骨。
- 使用解剖剪刀,在下颌骨两侧和眼睛之间切下1厘米。用镊子慢慢地将面部骨骼从身体上拉开,露出鼻腔。
- 使用镊子轻轻取出鼻组织,并将其放入预装有 0.5 mL PBS 的圆底管中进行均质化。
- 在脖子处,用解剖剪刀剪掉皮毛,然后剪掉肌肉,露出气管。
- 为了使收集的组织均质化,首先将均质器探针放入70%乙醇中并以60%功率打开均质器30秒。在无菌水中重复该步骤10秒。将每个组织匀浆1分钟。在每个样品之间的无菌水中以及每个器官和样品组之间的70%乙醇新管中清洁均质器探针。
- 细菌数计数
- 一旦所有器官都被收获并匀浆,在血琼脂平板上连续稀释。要计算总 CFU,请使用 10 μL 进行平板,并记下每个样品的最终体积(以 mL 为单位)。将鼻咽样品铺在补充有 3 μg/mL 庆大霉素的琼脂平板上,以选择 肺炎链球菌 的生长,同时抑制定植该组织的其他微生物的生长。在37°C / 5%CO2下孵育过夜。
- 为了枚举肺和鼻咽的细菌CFU,首先计数血琼脂平板上的菌落。然后,使用公式(1)和公式(2)计算每毫升的量和总数。
每毫升量 = 菌落数 ×稀释因子 × 100 (1)
总数 = 每毫升量×每个样品的总体积 (2)
注意:在公式(1)中,由于接种了10μL,因此使用100乘法,这是1mL的100倍稀释。等式(2)中每个样品的总体积来自步骤6.7.1,其导致每个器官的检测限为100。 - 为了枚举细菌CFU对于菌血症,首先计数血琼脂平板上的菌落。然后,使用公式(3)确定每毫升血液的量。
每毫升血液的量 = 菌落数 ×稀释因子 × 100 × 10 (3)
注意:在公式(3)中,使用100作为10μL的电镀,这是1mL的100倍稀释,10表示血液在抗凝剂中的1:10稀释。这导致检测限为 1,000/mL。
7. 处理用于流式细胞术的肺部样本
- 按如下方式准备所需的介质:
- 按照步骤 2.1 中所述准备 RP-10。
- 通过将 RP-10 与 2 mg/mL 胶原酶和 30 μL/mL DNase I 混合来制备消化缓冲液。
- 通过将 8.29 g NH4Cl、1 g NaHCO3 和 0.038 g EDTA 溶解在 1 L H2O 中来制备裂解缓冲液。
- 通过将 450 mL HBSS 与 50 mL 热灭活 FBS 和 5 g 叠氮化钠混合来制备 10x FACS 缓冲液。
- 通过在 450 mL HBSS 中稀释 50 mL 的 10x FACS 缓冲液来制备 1x FACS 缓冲液。
- 从步骤6.4.3中取出肺样品并置于24孔板中。向每个孔中加入 500 μL 消化缓冲液。在37°C / 5%CO2下孵育45分钟至1小时。
- 用 5 mL RP-10 为每个样品预填充 50 mL 锥形管。孵育结束后,将 100 μm 过滤器放在 50 mL 锥形管的顶部,并用 1 mL RP-10 润湿。
- 使用P-1000微量移液器,移动消化的肺并将它们放在过滤器上。使用 3 mL 注射器的柱塞捣碎器官。每次用 1 mL RP-10 冲洗 2 次。
- 将样品在4°C和327× g 下旋转5分钟。吸出上清液并将沉淀重悬于1 mL裂解缓冲液中。静置3分钟,让红细胞裂解。用 5 mL RP-10 中和。
- 将样品在4°C和327× g 下旋转5分钟。吸出上清液,将沉淀重悬于 1 mL RP-10 中,并取 10 μL 计数样品。
- 将样品在4°C和327×g下旋转5分钟。吸出上清液并将沉淀重悬于RP-10中,浓度为2×106-4×106个细胞/ mL。将 60 μL 的每个样品加入 96 孔板中,以染色步骤 7.9、表 5 和表 6 中列出的所需细胞类型23。
- 将板在4°C和327× g 下旋转5分钟。
- 同时,用所需抗体制备抗体预混液、荧光减一(FMO)和单染色质控品。要对多形核白细胞 (PMN)、巨噬细胞、单核细胞、树突状细胞和 T 细胞进行染色,请使用表 5 和 表 6 中列出的抗体和最终稀释液。使用总体积为 100 μL/孔的抗体混合物。按照表中列出的稀释液确定适量的预混液和所需的单个抗体。
- 旋转完成后(步骤7.8),倒出上清液,将沉淀重悬于100μL抗体混合物,FMO或单染色对照中,并在冰上在黑暗中孵育30分钟。
- 通过向孔中加入 150 μL FACS 缓冲液并在 4 °C 和 327 × g 下旋转板 5 分钟来洗涤细胞 2 倍。
- 旋转完成后,倒出上清液,将沉淀重悬于100μL固定缓冲液中,并在冰上孵育20分钟。
- 通过将 150 μL FACS 缓冲液添加到孔中并在 4 °C 和 327 × g 下旋转板 5 分钟来洗涤细胞 2 倍。
- 用 200 μL FACS 缓冲液制备标记的 FACS 管。将沉淀重悬于 150 μL FACS 缓冲液中。使用100μm过滤器将每个样品单独过滤到相应的FACS管中。保持在冰上或4°C下,避光直到准备分析。
- 使用流式细胞仪分析细胞。
8. 用于枚举IAV的斑块测定
- 按如下方式准备所需的介质:
- 通过将2.5g牛血清白蛋白(BSA)溶解到40mL的DMEM中,同时在37°C搅拌10-20分钟直至溶解来制备感染培养基。过滤灭菌到 460 mL DMEM 中。
- 通过将1.2mg微晶纤维素溶解到50mL的H 2 O.高压灭菌器中制备2.4%微晶纤维素,并在室温下储存。
- 通过将 2.5 g BSA 溶解到 40 mL DMEM 中,同时在 37°C 下搅拌 10-20 分钟来制备 5% 的 BSA DMEM。加入剩余的 10 mL DMEM,最终体积为 50 mL。过滤灭菌并储存在4°C。
- 通过将 1 mL 5% BSA DMEM 与 9 mL 2x MEM 混合来制备 2x MEM/0.5% BSA。
- 通过将 2.4% 微晶纤维素和 2x MEM/0.5% BSA 的 1:1 比例与 1 mg/mL TPCK(胰凝乳蛋白酶抑制剂)胰蛋白酶混合来制备低粘度覆盖介质。
- 通过将 450 mL Eagle 最低必需培养基 (EMEM) 与 50 mL 热灭活 FBS 混合来制备 EMEM/10% FBS。
- 培养Madin-Darby犬肾(MDCK)细胞系。将一个购买的小瓶中的细胞添加到 T-25 组织培养处理烧瓶中的 5 mL EMEM/10% FBS 中。在37°C / 5%CO2 下孵育3-5天,直到细胞达到100%汇合。检查汇合度,如步骤 2.3 所示。
- 取出并丢弃培养基,并用 5 mL 室温 PBS 冲洗 2 次。向烧瓶中加入1mL胰蛋白酶-EDTA,并在37°C / 5%CO2 下孵育10-15分钟,直到细胞分离。提起后,用 4mL EMEM/10% FBS 中和以获得 2 × 105 个细胞/mL 的细胞悬液。
- 在开始斑块测定前 1 天,每孔(2 ×10 5 个细胞/孔)加入 1 mL 重悬细胞,将 MDCK 细胞接种在 12 孔组织培养处理的板中。
注意:确保细胞在使用前达到100%汇合度,如果需要达到汇合度,请孵育更长时间。 - 为了用作标准品,在步骤8.1.1中列出的感染培养基中对IAV原液(已知滴度)进行10倍连续稀释(106-10 1)。每次稀释液取 1.2 mL 以一式三份进行测试。
- 在冰上解冻器官匀浆。在台式离心机上以 2,000 × g 离心并收集澄清的上清液。
- 重复步骤8.5,但使用步骤8.6中样品中的上清液。
- 从细胞中吸出培养基,并用 1 mL PBS 洗涤 2 次以去除所有 FBS。
- 沿每个孔的侧面轻轻加入 300 μL 每种标准稀释液或连续稀释的样品,从最高稀释度开始到最低稀释度,一式三份。
- 将板置于37°C / 5%CO2的培养箱中,每10分钟摇动板共50分钟。确保将它们平放在培养箱中,不要堆叠它们。
- 50分钟后,用1mL PBS洗涤细胞2次。
- 向每个孔中加入 2 mL 低粘度覆盖介质,最低稀释度和无病毒孔除外;除此之外,加入感染培养基和胰蛋白酶。
- 将板放回37°C / 5%CO 2的培养箱中2-4 天,以获得肉眼可见的斑块。
- 通过从侧面快速向每个孔中加入 2 mL PBS 来洗涤板,并轻轻摇动以悬浮沉淀的低粘度覆盖介质。
- 通过轻轻移取培养基,将整个液体体积丢弃在孔中。
- 在每个孔中用 2 mL PBS 再次重复洗涤,然后轻轻移液丢弃整个液体体积。
- 为了固定斑块,向每个孔中加入 500 μL 4% 多聚甲醛,摇匀,静置 30 分钟。
- 用 1 mL PBS 慢慢清洗侧面;然后,轻轻丢弃液体。
- 向每个孔中加入 500 μL 1% 结晶紫(用水稀释)以覆盖细胞单层。孵育5分钟。
- 用 1 mL 自来水清洗。确保通过轻轻移液丢弃孔中的所有液体。将盘子倒置放在尿布垫上晾干过夜。
- 直观地计算斑块并将图像保存在任何可用的成像仪上。
结果
生物膜生长的肺炎链球菌(图1A)用于感染小鼠(图1B),使用鼻内递送给未麻醉小鼠的10μL小接种物。这种小体积接种物导致一致的肺炎球菌携带仅限于鼻咽(图2A,+ sp组),同时避免全身传播(图2B,C,+ sp组)。鼻内接种两天后,小鼠感染小鼠适应的甲型H1N1流感病毒A / PR / 8 / 34(IAV)22,30鼻内和气管内递送,以实现向鼻咽和肺部一致递送特定量的23。
在这里,该模型用于比较鼻内受到不同肺炎链球菌菌株攻击的小鼠病毒感染后的病程,包括TIGR4和D39,它们是导致肺炎进展为菌血症的侵袭菌株,以及EF3030,这是一种中耳炎菌株21,24,25,26,31。肺炎链球菌/IAV混合感染小鼠的疾病表现取决于细菌菌株(图2)。虽然任何菌株之间的鼻咽细菌数量(图2A)没有显着差异,但肺炎链球菌TIGR4和D39,但没有EF3030,在IAV感染后48小时播散到肺部(图2B)。鼻内感染肺炎链球菌TIGR4的小鼠中有40%显示出细菌向肺部的传播,其中一半变得菌血症(图2C),与先前的发现一致23。
鼻内感染 肺炎链球菌 D39的小鼠显示出更有效的播散,因为在100%的合并感染小鼠中观察到扩散到肺部(图2B)。与 肺炎链球菌 TIGR4类似,其中一半经历了菌血症(图2C)。在跟踪总生存期时,无论细菌菌株如何,对于所有测试的菌株,合并感染小鼠的存活率显着低于单独使用 肺炎链球菌 的小鼠(图2D)。与单独使用IAV的对照小鼠相比,鼻内感染 肺炎链球菌 TIGR4和D39但未感染EF3030的小鼠显示出加速的疾病发生率。到IAV感染后第2天,30%(D39)和20%(TIGR4)的小鼠已经死亡,而仅IAV对照组直到激发后第5天才开始屈服(图2D)。同时感染 肺炎链球菌 EF3030和IAV的小鼠具有延迟症状,更类似于仅IAV对照(图2D)。这些发现表明,混合感染模型导致年轻健康小鼠的细菌菌株依赖性疾病,这使其成为探索疾病进展每一步所需的细菌因素的理想选择。
该模型用于评估鼻内接种不同肺炎链球菌菌株的小鼠在IAV感染后肺部各种免疫细胞(图3中的细胞类型和门控策略)的存在。在IAV感染后分散到肺部的细菌菌株D39和TIGR4引起来自循环的炎症免疫细胞(如中性粒细胞(PMN)和单核细胞)的流入显着增加,高于基线(未感染),而EF3030则没有(图4A-C)。仅IAV感染就引起对宿主防御病毒感染很重要的免疫细胞(如NK细胞和γ-δT细胞)的流入量显着高于基线(图4A-C)。在病毒攻击之前鼻内感染肺炎链球菌的小鼠中,这些抗病毒反应显着减弱(图4A-C)。这与先前评估细胞因子反应的研究一致,这些研究发现肺炎链球菌携带钝化了I型干扰素的产生,并损害了宿主控制肺部IAV负荷的能力23。这些发现表明,混合感染模型可用于研究单一与多种微生物感染中的免疫应答如何变化。
该模型还用于评估鼻内感染 肺炎链球菌 TIGR4的小鼠IAV感染后衰老对病程的影响。在单次感染的小鼠中,年轻和老年队列之间的病毒滴度没有变化(图5A)23。与先前的研究23一样,与年轻小鼠相比,老年小鼠表现出更早且明显更严重的疾病迹象,如较高的临床评分所示(图5B)。与疾病症状一致,接种 肺炎链球菌 的老年小鼠在IAV感染后24小时内开始更快地死亡,并且它们都死于该疾病,而年轻对照组在感染中存活率显着更高(33%)(图5C)。这些发现表明,混合感染模型可用于检测脆弱宿主中更严重的疾病,使其成为探索赋予共同感染抵抗力或易感性的宿主因素的理想选择。
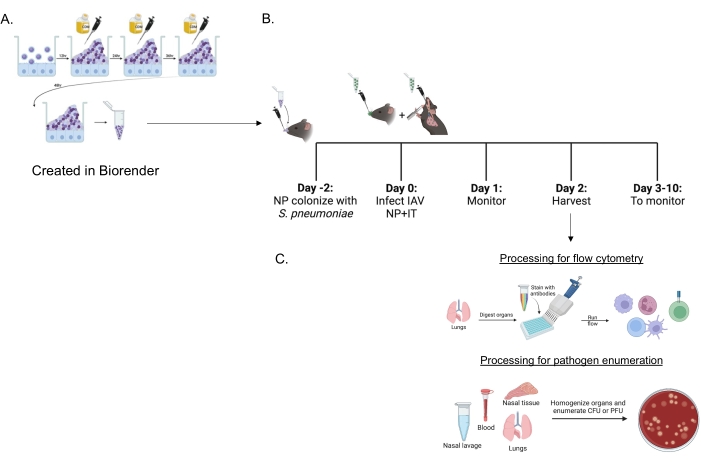
图1:用于评估免疫细胞流入和病原体负荷的混合感染和器官处理的时间表 。 (A) 肺炎链球菌 在生物膜中生长。(B)将小鼠鼻内接种5×106CFU 的指示生物膜生长的 肺炎链球菌 菌株以建立鼻咽携带或未经治疗。48小时后,小鼠要么用PBS模拟治疗,要么鼻内接受200 PFU的甲型流感病毒PR8和气管内20 PFU。随着时间的推移监测小鼠的临床疾病评分和存活率。(C)在IAV感染后48小时,评估不同器官中的细菌CFU或病毒PFU或肺部免疫细胞内流。缩写:CFU = 菌落形成单位;PFU = 斑块形成单位;IAV = 甲型流感病毒 PR8;IT = 气管内;NP = 鼻咽。 请点击此处查看此图的大图。
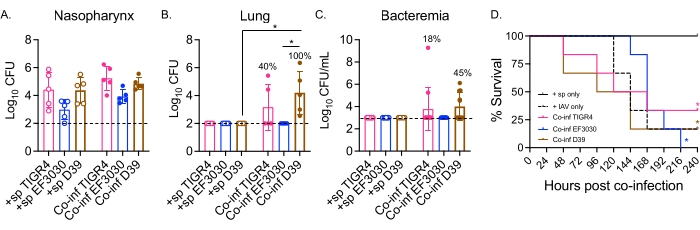
图2:接种肺炎链球菌的小鼠的鼻内/气管内双重IAV感染导致细菌传播和依赖于细菌菌株的疾病。 年轻(10-12周龄)雄性C57BL / 6(B6)小鼠感染如图1所示。(A)鼻咽,(B)肺和(C)血液中的细菌数量均在IAV感染后48小时测定。(乙,丙)百分比表示表现出传播的小鼠比例。(D)监测IAV感染后10天的生存率。显示来自(A,B)n = 5,(C)n = 11和(D)n = 6每组小鼠的合并数据。每个圆圈对应一个鼠标,虚线表示检测限制。(A-C) *,表示由克鲁斯卡尔-瓦利斯检验确定的指示组之间的显著差异(p < 0.05)。(D) *,表示通过对数秩(Mantel-Cox)测试确定的每种细菌菌株的+sp和Co-inf小鼠之间的显着差异(p < 0.05)。缩写:+sp =仅使用指定的菌株鼻内感染细菌的小鼠;Co-inf = 感染IAV的细菌感染小鼠;IAV = 接受甲型流感病毒的小鼠;CFU = 菌落形成单位。请点击此处查看此图的大图。
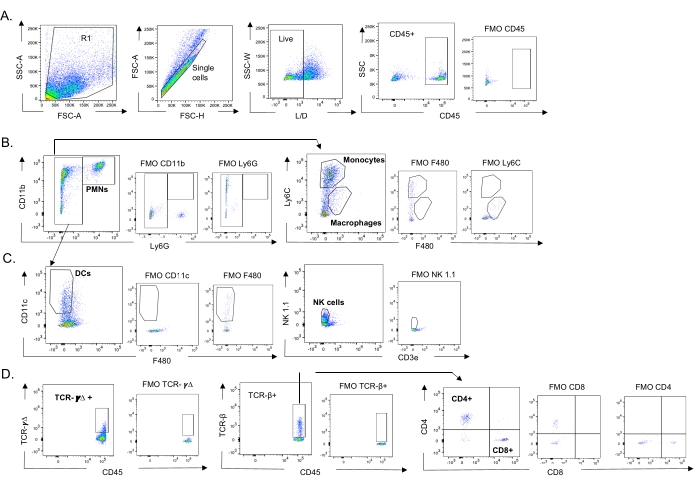
图 3:免疫细胞门控策略。收获肺,通过流式细胞术测定免疫细胞内流。显示了不同细胞类型的代表性门控策略。(A)CD45+,活单细胞门控和(B)PMN(Ly6G +,CD11b +),巨噬细胞(Ly6G-,Ly6C-,F480+)和单核细胞(Ly6G-,Ly6C +),(C)DCs(Ly6G-,CD11c +)和NK细胞(NK1.1+,CD3-),(D)TCR-γΔ和CD8(CD8+,TCRβ+)和CD4(CD4+,TCRβ+) 测定 T 细胞。缩写:SSC-A = 侧散射峰面积;FSC-A = 前向散射峰面积;FSC-H = 前向散射峰高度;SSC-W = 侧散射峰宽度;L/D = 活/死;FMO = 荧光减一;NK = 自然杀手;PMN = 多形核白细胞;DC = 树突状细胞;TCR = T细胞受体。请点击此处查看此图的大图。
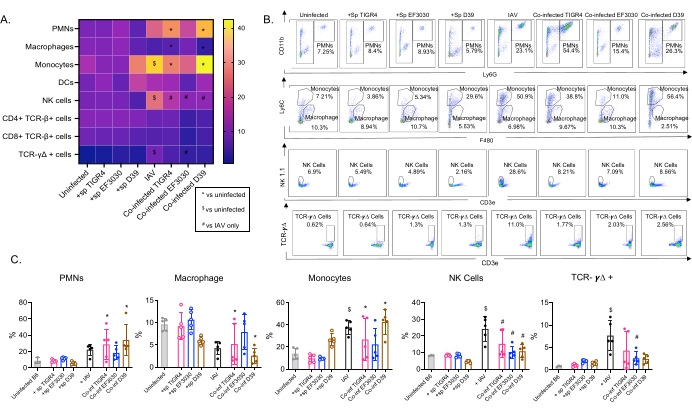
图4:肺部免疫反应依赖于细菌菌株。 年轻(10-12周龄)C57BL / 6雄性小鼠要么未感染,要么单独接种指定的 肺炎链球菌 菌株(+sp),单独攻击IAV(IAV),或同时感染 肺炎链球菌 和IAV(Co-inf)。IAV感染后48小时(见图 1中的实验设计),收获肺,按照 图3中的门控策略通过流式细胞术测定免疫细胞内流。(A)在热图上显示CD45门内每种指示细胞类型的平均百分比,用于所有治疗组。(B)显示每个小鼠组在处理之间显示显着差异的细胞类型的代表性点图。(C)显示了指示的免疫细胞类型的百分比。每个圆圈对应一个鼠标。(A,C)显示每组n = 5只小鼠的合并数据。*,表明Co-inf与未感染者之间存在显著差异(p < 0.05); $,表示 IAV 和未感染之间有显著差异;#,表示Co-inf和IAV单独存在显着差异。每种细胞类型的激发组之间的显着差异由方差分析确定,然后通过Tukey测试确定。缩写:NK = 自然杀手;PMN = 多形核白细胞;DC = 树突状细胞;TCR = T细胞受体;IAV = 甲型流感病毒。 请点击此处查看此图的大图。
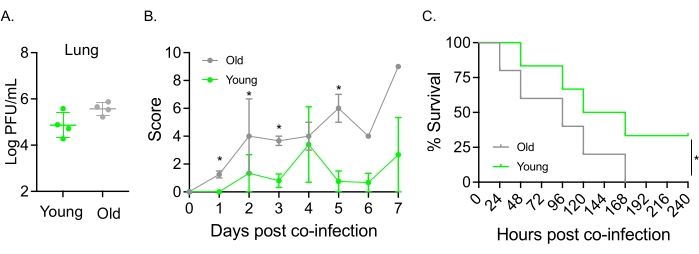
图5:老化和宿主对IAV /肺炎链球菌合并感染的易感性增加。年轻(10-12周)和年龄(21-22个月)C57BL / 6雄性小鼠同时感染肺炎链球菌TIGR4 i.n.和IAV i.n.和i.t.(如图1所示)或单独攻击IAV。(A)48小时后测定病毒滴度。星号表示由学生 t 检验确定的统计显著性 (p < 0.05)。数据从每组n = 4只小鼠合并。(B)随着时间的推移监测临床评分和(C)生存率。(B)显示每组n = 6只小鼠合并的平均±SEM。星号表示在由曼-惠特尼检验确定的指定时间点年轻小鼠与老年小鼠之间的统计学意义(p < 0.05)。(C)数据从每组n = 6只小鼠合并。星号表示由对数秩(Mantel-Cox)检验确定的年轻小鼠与老年小鼠之间的统计学意义(p < 0.05)。缩写:IAV = 甲型流感病毒;i.n. = 鼻内;I.T. = 气管内;SEM = 平均值的标准误差。图5A经Joma等人许可转载23。请点击此处查看此图的大图。
| 混合 I 用于 CDM 的库存 | |
| 腺嘌呤 | 0.1 克 |
| D-丙氨酸 | 0.25 克 |
| 无水氯化钙2 | 0.025 克 |
| 硫酸锰 | 0.03 克 |
| 氰钴胺素 | 100 μL 10 mg/mL 原液 |
| 对氨基苯甲酸 | 400 μL 5 mg/mL 原液 |
| 吡哆胺2盐酸盐 | 100 μL 10 mg/mL 原液 |
| 用于清洁发展机制的混合II库存 | |
| 鸟嘌呤 | 0.05 克 |
| 尿嘧啶 | 0.05 克 |
| 用于清洁发展机制的混合III库存 | |
| 硝酸铁 9H2O | 50毫克/毫升 |
| 硫酸铁 7H2O | 10毫克/毫升 |
| 用于清洁发展机制的混合静脉注射原液 | |
| β-烟酰胺腺嘌呤二核苷酸 | 25毫克/毫升 |
表1:清洁发展机制混合一、二、三和四库存。 缩写:CDM = 化学成分明确的介质。
| 用于清洁发展机制的维生素混合原料 | |
| 盐酸吡哆醛 | 0.8 克 |
| 硫胺素Cl 2 | 0.4 克 |
| 核黄素 | 0.4 克 |
| 钙泛酸 | 0.4 克 |
| 生物素 | 0.04 克 |
| 叶酸 | 0.4 克 |
| 烟酰胺 | 0.4 克 |
表2:用于清洁发展机制的维生素混合物原液。 缩写:CDM = 化学成分明确的介质。
| 用于清洁发展机制的氨基酸原液 | |
| L-丙氨酸 | 0.480 克 |
| L-精氨酸 | 0.250 克 |
| L-天冬酰胺 | 0.700 克 |
| L-天冬氨酸 | 0.600 克 |
| L-半胱氨酸 | 1.000 克 |
| L-胱氨酸 | 0.100 克 |
| L-谷氨酸 | 0.200 克 |
| L-谷氨酰胺 | 0.780 克 |
| L-甘氨酸 | 0.350 克 |
| L-组氨酸 | 0.300 克 |
| L-异亮氨酸 | 0.430 克 |
| L-亮氨酸 | 0.950 克 |
| L-赖氨酸 | 0.880 克 |
| L-蛋氨酸 | 0.250 克 |
| L-苯丙氨酸 | 0.550 克 |
| L-脯氨酸 | 1.350 克 |
| L-丝氨酸 | 0.680 克 |
| L-苏氨酸 | 0.450 克 |
| L-色氨酸 | 0.100 克 |
| L-缬氨酸 | 0.650 克 |
表3:清洁发展机制的氨基酸储备。 缩写:CDM = 化学成分明确的介质。
| 清洁发展机制的起始原料 | |
| 右旋糖 | 1.0 克 |
| 硫酸镁-7-水合物 | 0.070 克 |
| 磷酸二钾 | 0.02 克 |
| 磷酸钾一元 | 0.1 克 |
| 无水乙酸钠 | 0.45 克 |
| 碳酸氢钠 | 0.25 克 |
| 磷酸氢二钠 | 0.735 克 |
| 磷酸钠一元 | 0.32 克 |
| 清洁发展机制的最后补编 | |
| 氯化胆碱 | 0.1 克 |
| L-半胱氨酸盐酸盐 | 0.075 克 |
| 碳酸氢钠 | 0.25 克 |
表4:清洁发展机制的起始原料和最终补充。 缩写:CDM = 化学成分明确的介质。
| 抗体/荧光基团 | 克隆 | 稀释因子 |
| 用于紫外激发的 L/D | 不适用 | 0.38888889 |
| Ly6G AF 488 | 1A8 | 0.25 |
| CD11b APC | M1/70 | 0.25 |
| CD11c 聚乙烯 | N418 | 0.18055556 |
| 鼠标 Fc 块 | 2.4G2 | 0.11111111 |
| F4/80 PE Cy7 | BM8 | 0.18055556 |
| Ly6C BV605 | 铝-21 | 0.25 |
| CD103 BV 421 | M290 | 0.18055556 |
| CD45 APC-eF-780 | 30-F11 | 0.18055556 |
表 5:抗体组合 1。
| 抗体/荧光基团 | 克隆 | 稀释因子 |
| 用于紫外激发的 L/D | 不适用 | 0.388888889 |
| TCR-β APC Cy7 | H57-597 | 0.180555556 |
| CD4 V450 (太平洋蓝) | 马币4-5 | 0.25 |
| CD8 BV650 | 53-6.7 | 0.180555556 |
| 鼠标 Fc 块 | 2.4G2 | 0.111111111 |
| CD45 聚乙烯 | 30-F11 | 0.180555556 |
| CD3 AF488 | 145-2C11 | 0.180555556 |
| TCR- γΔ APC | GL-3 | 0.180555556 |
| NK1.1 AF 700 | PK136 | 0.180555556 |
表 6:抗体组合 2。
讨论
大多数现有的肺炎链球菌/IAV混合感染实验研究依赖于细菌递送到感染IAV的小鼠肺部。这些模型有助于识别肺部环境和全身免疫反应的变化,使宿主容易发生继发性细菌感染15,16,17,32,33,34,35,36,37。然而,这些模型未能模拟肺炎链球菌从无症状定植者转变为能够引起严重肺部和全身感染的病原体。此外,这些模型不适合研究上呼吸道中导致感染易感性的宿主因素和宿主-病原体相互作用。IAV感染后肺炎球菌从鼻咽移动到肺部的先前模型依赖于鼻咽细菌感染,然后是病毒感染。然而,它未能重现在人类患者中观察到的严重疾病迹象21。这里描述的改良鼠感染模型概括了肺炎链球菌从无症状携带到导致严重临床疾病的病原体的转变。
该模型的一个关键步骤是确定鼻咽部的肺炎链球菌感染。肺炎链球菌形成生物膜并以不同的效率定植鼻咽21,38。为了建立一致的感染,至少需要5 × 106 CFU的生物膜生长细菌菌株迄今为止测试23。建议在病毒感染之前检测任何新的细菌菌株是否稳定感染鼻咽。对于病毒合并感染,先前的研究发现,鼻内IAV感染是鼻咽细菌从鼻咽21,22,23传播所必需的。在之前的研究中,使用500 PFU的IAV用于鼻内输送,而在本研究中,200 PFU足以增加鼻咽中的细菌数量。IAV感染不仅限于上呼吸道,还可以扩散到肺部39,40,这是使肺部环境更易于细菌感染的关键15,16,41。IAV向肺部的递送可以通过鼻内递送或麻醉小鼠的气管内安装来实现。先前对BALB / cByJ小鼠的研究发现鼻内递送导致病毒性肺炎21;然而,在C57BL / 6小鼠中,鼻内接种后接种物进入肺部的途径受到更多限制。在C57BL / 6小鼠中,需要气管内安装以一致地传递病毒23。在该模型中,先前的细菌定植加速了病毒感染后疾病症状的呈现23。由于病毒感染本身可引起疾病症状,动力学可能发生变化,因此建议首先测试任何新病毒株的剂量范围,并选择揭示混合感染宿主中加速动力学的剂量。
在该模型中,肺为疾病评估提供了另一个关键读数。为了评估病原体负荷和免疫细胞内流,可以使用来自同一只小鼠的肺。但是,由于不同肺叶之间的感染和炎症严重程度可能不同,因此建议不要将同一肺的不同肺叶用于各种评估。相反,所有的裂片都可以切成小块,混合在一起,然后平均解析出来以进行不同的评估。同样,鼻咽可用于细菌CFU或病毒PFU的计数和免疫应答。然而,从洗涤液和组织中获得的细胞数量太少,无法在不汇集来自同一组小鼠的样品的情况下进行流式细胞术。或者,可以组织学评估鼻咽部炎症23。
该模型的一个关键特征是它概括了患者身上看到的临床疾病。在人类中,IAV 感染后的继发性肺炎球菌肺炎通常会导致明显的疾病体征,包括咳嗽、呼吸困难、发烧和肌肉酸痛,可导致住院、呼吸衰竭甚至死亡8,15,42,43。该模型概括了在人类中观察到的临床疾病的严重迹象,包括小鼠表现出的呼吸困难(反映在呼吸评分)和整体不适(反映在姿势和运动评分中),以及一些健康的年轻对照组的死亡。合并感染小鼠的疾病症状加重可能是细菌传播到肺部和肺炎球菌携带小鼠病毒清除受损的结果23。该模型的局限性在于,临床疾病和鼻咽细菌传播的发生率因小鼠而异,并受细菌菌株、宿主年龄和基因型21、22、23 的影响。反映这一点,对于侵袭性菌株,从局部感染(没有检测到的菌血症)到死亡的进展可以在24小时内发生。因此,为了真正评估全身传播,应在较短的时间间隔内(每6-12小时)随访菌血症。同样,疾病评分可以迅速变化,特别是在合并感染后的前 72 小时内。因此,为了密切跟踪疾病症状,建议在IAV感染后第1-3天每天监测小鼠三次。
总之,该模型复制了 肺炎链球菌 从鼻咽的无症状定植者到能够在IAV感染时引起肺部和全身疾病的病原体的移动。在该模型中,IAV通过改变鼻咽中的细菌行为,增加细菌向肺部的传播以及改变抗菌免疫力 来触发肺炎链球菌 的转变23。同样,细菌携带会减弱抗病毒免疫反应并损害肺部的IAV清除率23。这使得该模型非常适合分析单一感染与多种微生物感染中免疫反应的变化。此外,合并感染后的病程部分取决于鼻咽部存在的肺炎球菌菌株。因此,该模型适用于剖析 肺炎链球菌 无症状定植与致病性转化所需的细菌因素。最后,该模型再现了衰老对合并感染的易感性,尽管此处未对其进行测试,但它可以很容易地用于评估宿主背景对疾病过程的影响。总之,将携带和疾病分成不同的步骤提供了分析病原体和宿主的遗传变异的机会,从而可以详细检查重要病理剂在疾病进展不同阶段与宿主的相互作用。展望未来,该模型可用于为易受攻击的宿主量身定制治疗方案。
披露声明
作者没有利益冲突需要披露。
致谢
我们要感谢尼克·伦哈德对这份手稿的批判性阅读和编辑。我们还要感谢Andrew Camilli和Anthony Campagnari的细菌菌株和Bruce Davidson的病毒菌株。这项工作得到了国家卫生研究院对J.L.的拨款(R21AG071268-01)和国家卫生研究院对E.N.B.G.的资助(R21AI145370-01A1),(R01AG068568-01A1),(R21AG071268-01)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 4-Aminobenzoic acid | Fisher | AAA1267318 | Mix I stock |
| 96-well round bottom plates | Greiner Bio-One | 650101 | |
| 100 µm Filters | Fisher | 07-201-432 | |
| Adenine | Fisher | AC147440250 | Mix I stock |
| Avicel | Fisher | 501785325 | Microcyrstalline cellulose |
| BD Cytofix Fixation Buffer | Fisher | BDB554655 | Fixation Buffer |
| BD Fortessa | Flow cytometer | ||
| BD Intramedic Polyethylene Tubing | Fisher | 427410 | Tubing for nasal lavage |
| BD Disposable Syringes with Luer-Lok Tips (1 mL) | Fisher | 14-823-30 | |
| BD Microtainer Capillary Blood Collector and BD Microgard Closure | Fisher | 02-675-185 | Blood collection tubes |
| Beta-Nicotinamide adenine dinucleotide | Fisher | AAJ6233703 | Mix IV stock |
| Biotin | Fisher | AC230090010 | Vitamin stock |
| C57BL/6J mice | The Jackson Laboratory | #000644 | Mice used in this study |
| Calcium Chloride Anhydrous | Fisher Chemical | C77-500 | Mix I stock |
| CD103 BV 421 | BD Bioscience | BDB562771 | Clone: M290 DF 1:200 |
| CD11b APC | Invitrogen | 50-112-9622 | Clone: M1/70, DF 1:300 |
| CD11c PE | BD Bioscience | BDB565592 | Clone: N418 DF 1:200 |
| CD3 AF 488 | BD Bioscience | OB153030 | Clone: 145-2C11 DF 1:200 |
| CD4 V450 | BD Horizon | BDB560470 | Clone: RM4.5 DF 1:300 |
| CD45 APC eF-780 | BD Bioscience | 50-112-9642 | Clone: 30-F11 DF 1:200 |
| CD45 PE | Invitrogen | 50-103-70 | Clone: 30-F11 DF 1:200 |
| CD8α BV 650 | BD Horizon | BDB563234 | Clone: 53-6.7 DF 1:200 |
| Choline chloride | Fisher | AC110290500 | Final supplement to CDM |
| Corning Disposable Vacuum Filter/Storage Systems | Fisher | 09-761-107 | Filter sterilzation apparatus |
| Corning Tissue Culture Treated T-25 Flasks | Fisher | 10-126-9 | |
| Corning Costar Clear Multiple Well Plates | Fisher | 07-201-590 | |
| Corning DMEM With L-Glutamine and 4.5 g/L Glucose; Without Sodium Pyruvate | Fisher | MT10017CM | |
| Cyanocobalamin | Fisher | AC405925000 | Mix I stock |
| D39 | National Collection of Type Culture (NCTC) | NCTC 7466 | Streptococcus pneumoniae strain |
| D-Alanine | Fisher | AAA1023114 | Mix I stock |
| D-Calcium pantothenate | Fisher | AC243301000 | Vitamin stock |
| Dextrose | Fisher Chemical | D16-500 | Starter stock |
| Dnase | Worthington Biochemical | LS002147 | |
| Eagles Minimum Essential Medium | ATCC | 30-2003 | |
| EDTA | VWR | BDH4616-500G | |
| EF3030 | Center for Disease Control and Prevention | Available via the isolate bank request | Streptococcus pneumoniae strain, request using strain name |
| F480 PE Cy7 | BD Bioscience | 50-112-9713 | Clone: BMB DF 1:200 |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | 50 mL round bottom tube |
| Falcon Round-Bottom Polypropylene Test Tubes With Cap | Fisher | 14-959-11B | 15 mL round bottom tube |
| Falcon Round-Bottom Polystyrene Test Tubes (5 mL) | Fisher | 14-959-5 | FACS tubes |
| FBS | Thermofisher | 10437-028 | |
| Ferric Nitrate Nonahydrate | Fisher | I110-100 | Mix III stock |
| Fisherbrand Delicate Dissecting Scissors | Fisher | 08-951-5 | Instruments used for harvest |
| Fisherbrand Disposable Inoculating Loops | Fisher | 22-363-602 | Inoculating loops |
| Fisherbrand Dissecting Tissue Forceps | Fisher | 13-812-38 | Forceps for harvest |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5 mL | Fisher | 05-408-137 | Micocentrifuge tubes |
| Fisherbrand Sterile Syringes for Single Use (10 mL) | Fisher | 14-955-459 | |
| Folic Acid | Fisher | AC216630500 | Vitamin stock |
| Gibco RPMI 1640 (ATCC) | Fisher | A1049101 | |
| Gibco DPBS, no calcium, no magnesium | Fisher | 14190250 | |
| Gibco HBSS, calcium, magnesium, no phenol red | Fisher | 14025134 | |
| Gibco MEM (Temin's modification) (2x), no phenol red | Fisher | 11-935-046 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher | 15-140-122 | |
| Gibco Trypan Blue Solution, 0.4% | Fisher | 15-250-061 | |
| Gibco Trypsin-EDTA (0.25%), phenol red | Fisher | 25-200-056 | |
| Glycerol (Certified ACS) | Fisher | G33-4 | |
| Glycine | Fisher | AA3643530 | Amino acid stock |
| Guanine | Fisher | AAA1202414 | Mix II stock |
| Invitrogen UltraComp eBeads Compensation Beads | Fisher | 50-112-9040 | |
| Iron (II) sulfate heptahydrate | Fisher | AAA1517836 | Mix III stock |
| L-Alanine | Fisher | AAJ6027918 | Amino acid stock |
| L-Arginine | Fisher | AAA1573814 | Amino acid stock |
| L-Asparagine | Fisher | AAB2147322 | Amino acid stock |
| L-Aspartic acid | Fisher | AAA1352022 | Amino acid stock |
| L-Cysteine | Fisher | AAA1043518 | Amino acid stock |
| L-Cysteine hydrochloride monohydrate | Fisher | AAA1038914 | Final supplement to CDM |
| L-Cystine | Fisher | AAA1376218 | Amino acid stock |
| L-Glutamic acid | Fisher | AC156211000 | Amino acid stock |
| L-Glutamine | Fisher | O2956-100 | Amino acid stock |
| L-Histidine | Fisher | AC166150250 | Amino acid stock |
| LIFE TECHNOLOGIES LIVE/DEAD Fixable Blue Dead Cell Stain Kit, for UV excitation | Invitrogen | 50-112-1524 | Clone: N/A DF 1:500 |
| L-Isoleucine | Fisher | AC166170250 | Amino acid stock |
| L-Leucine | Fisher | BP385-100 | Amino acid stock |
| L-Lysine | Fisher | AAJ6222514 | Amino acid stock |
| L-Methionine | Fisher | AAA1031822 | Amino acid stock |
| Low endotoxin BSA | Sigma Aldrich | A1470-10G | |
| L-Phenylalanine | Fisher | AAA1323814 | Amino acid stock |
| L-Proline | Fisher | AAA1019922 | Amino acid stock |
| L-Serine | Fisher | AC132660250 | Amino acid stock |
| L-Threonine | Fisher | AC138930250 | Amino acid stock |
| L-Tryptophan | Fisher | AAA1023014 | Amino acid stock |
| L-Valine | Fisher | AAA1272014 | Amino acid stock |
| Ly6C BV 605 | BD Bioscience | BDB563011 | Clone: AL-21 DF 1:300 |
| Ly6G AF 488 | Biolegend | NC1102120 | Clone: IA8, DF 1:300 |
| Madin-Darby Canine Kidney (MDCK) cells | American Type Culture Collection (ATCC) | CCL-34 | MDCK cell line for PFU analuysis |
| Magnesium Sulfate 7-Hydrate | Fisher | 60-019-68 | CDM starter stock |
| Manganese Sulfate | Fisher | M113-500 | Mix I stock |
| MilQ water | Ultra-pure water | ||
| Mouse Fc Block | BD Bioscience | BDB553142 | Clone: 2.4G2 DF 1:100 |
| MWI VETERINARY PURALUBE VET OINTMENT | Fisher | NC1886507 | Eye lubricant for infection |
| NCI-H292 mucoepidermoid carcinoma cell line | ATCC | CRL-1848 | H292 lung epithelial cell line for biofilm growth |
| Niacinamide | Fisher | 18-604-792 | Vitamin stock |
| NK 1.1 AF 700 | BD Bioscience | 50-112-4692 | Clone: PK136 DF 1:200 |
| Oxyrase For Broth 50Ml Bottle 1/Pk | Fisher | 50-200-5299 | To remove oxygen from liquid cultures |
| Paraformaldehyde 4% in PBS | Thermoscientific | J19932-K2 | |
| Pivetal Isoflurane | Patterson Veterinary | 07-893-8440 | Isoflurane for anesthesia during infection |
| Potassium Phosphate Dibasic | Fisher Chemical | P288-500 | Starter stock |
| Potassium Phosphate Monobasic | Fisher Chemical | P285-500 | Starter stock |
| Pyridoxal hydrochloride | Fisher | AC352710250 | Vitamin stock |
| Pyridoxamine dihydrochloride | Fisher | AAJ6267906 | Mix I stock |
| Riboflavin | Fisher | AC132350250 | Vitamin stock |
| Sodium Acetate | VWR | 0530-500G | Starter stock |
| Sodium Azide | Fisher Bioreagents | BP922I-500 | For FACS buffer |
| Sodium Bicarbonate | Fisher Chemical | S233-500 | Starter stock and final supplement to CDM |
| Sodium Phosphate Dibasic | Fisher Chemical | S374-500 | Starter stock |
| Sodium Phosphate Monobasic | Fisher Chemical | S369-500 | Starter stock |
| TCR APC | BD Bioscience | 50-112-8889 | Clone: GL-3 DF 1:200 |
| TCRβ APC-Cy7 | BD Pharmigen | BDB560656 | Clone: H57-597 DF 1:200 |
| Thermo Scientific Blood Agar with Gentamicin | Fisher | R01227 | Blood agar plates with the antibiotic gentamicin |
| Thermo Scientific Trypsin, TPCK Treated | Fisher | PI20233 | |
| Thiamine hydrochloride | Fisher | AC148991000 | Vitamin stock |
| TIGR4 | ATCC | BAA-334 | Streptococcus pneumoniae strain |
| Uracil | Fisher | AC157300250 | Mix II stock |
| Worthington Biochemical Corporation Collagenase, Type 2, 1 g | Fisher | NC9693955 |
参考文献
- Kadioglu, A., Weiser, J. N., Paton, J. C., Andrew, P. W. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nature Reviews Microbiology. 6 (4), 288-301 (2008).
- Obaro, S., Adegbola, R. The pneumococcus: Carriage, disease and conjugate vaccines. Journal of Medical Microbiology. 51 (2), 98-104 (2002).
- Chong, C. P., Street, P. R. Pneumonia in the elderly: A review of the epidemiology, pathogenesis, microbiology, and clinical features. Southern Medical Journal. 101 (11), 1141-1145 (2008).
- Kadioglu, A., Andrew, P. W. Susceptibility and resistance to pneumococcal disease in mice. Briefings in Functional Genomics and Proteomics. 4 (3), 241-247 (2005).
- Ganie, F., et al. Structural, genetic, and serological elucidation of Streptococcus pneumoniae serogroup 24 serotypes: Discovery of a new serotype, 24C, with a variable capsule structure. Journal of Clinical Microbiology. 59 (7), 0054021 (2021).
- Centers for Disease Control and Prevention. Estimates of deaths associated with seasonal influenza --- United States. MMWR. Morbidity and Mortality Weekly Report. 59 (33), 1057-1062 (2010).
- Shrestha, S., et al. Identifying the interaction between influenza and pneumococcal pneumonia using incidence data. Science Translational Medicine. 5 (191), (2013).
- McCullers, J. A. Insights into the interaction between influenza virus and pneumococcus. Clinical Microbiology Reviews. 19 (3), 571-582 (2006).
- Pneumococcal Disease Global Pneumococcal Disease and Vaccine. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/pneumococcal/global.html (2018)
- Grudzinska, F. S., et al. Neutrophils in community-acquired pneumonia: Parallels in dysfunction at the extremes of age. Thorax. 75 (2), 164-171 (2020).
- Boe, D. M., Boule, L. A., Kovacs, E. J. Innate immune responses in the ageing lung. Clinical and Experimental Immunology. 187 (1), 16-25 (2017).
- Krone, C. L., van de Groep, K., Trzcinski, K., Sanders, E. A., Bogaert, D. Immunosenescence and pneumococcal disease: An imbalance in host-pathogen interactions. The Lancet Respiratory Medicine. 2 (2), 141-153 (2014).
- Cho, S. J., et al. Decreased NLRP3 inflammasome expression in aged lung may contribute to increased susceptibility to secondary Streptococcus pneumoniae infection. Experimental Gerontology. 105, 40-46 (2018).
- Disease Burden of Influenza. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/flu/about/burden/index.html (2018)
- McCullers, J. A. The co-pathogenesis of influenza viruses with bacteria in the lung. Nature Reviews Microbiology. 12 (4), 252-262 (2014).
- McCullers, J. A., Rehg, J. E. Lethal synergism between influenza virus and Streptococcus pneumoniae: Characterization of a mouse model and the role of platelet-activating factor receptor. The Journal of Infectious Diseases. 186 (3), 341-350 (2002).
- Metzger, D. W., Sun, K. Immune dysfunction and bacterial coinfections following influenza. Journal of Immunology. 191 (5), 2047-2052 (2013).
- Chao, Y., Marks, L. R., Pettigrew, M. M., Hakansson, A. P. Streptococcus pneumoniae biofilm formation and dispersion during colonization and disease. Frontiers in Cellular and Infection Microbiology. 4, 194 (2014).
- Bogaert, D., De Groot, R., Hermans, P. W. Streptococcus pneumoniae colonisation: The key to pneumococcal disease. The Lancet Infectious Diseases. 4 (3), 144-154 (2004).
- Simell, B., et al. The fundamental link between pneumococcal carriage and disease. Expert Review of Vaccines. 11 (7), 841-855 (2012).
- Marks, L. R., Davidson, B. A., Knight, P. R., Hakansson, A. P. Interkingdom signaling induces Streptococcus pneumoniae biofilm dispersion and transition from asymptomatic colonization to disease. mBio. 4 (4), 00438 (2013).
- Reddinger, R. M., Luke-Marshall, N. R., Sauberan, S. L., Hakansson, A. P., Campagnari, A. A. Streptococcus pneumoniae modulates Staphylococcus aureus biofilm dispersion and the transition from colonization to invasive disease. mBio. 9 (1), 02089 (2018).
- Joma, B. H., et al. A murine model for enhancement of Streptococcus pneumoniae pathogenicity upon viral infection and advanced age. Infection and Immunity. 89 (8), 0047120 (2021).
- Andersson, B., et al. Identification of an active disaccharide unit of a glycoconjugate receptor for pneumococci attaching to human pharyngeal epithelial cells. Journal of Experimental Medicine. 158 (2), 559-570 (1983).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. The Journal of Experimental Medicine. 79 (2), 137-158 (1944).
- Tettelin, H., et al. Complete genome sequence of a virulent isolate of Streptococcus pneumoniae. Science. 293 (5529), 498-506 (2001).
- Tothpal, A., Desobry, K., Joshi, S. S., Wyllie, A. L., Weinberger, D. M. Variation of growth characteristics of pneumococcus with environmental conditions. BMC Microbiology. 19 (1), 304 (2019).
- Bou Ghanem, E. N., et al. Extracellular adenosine protects against Streptococcus pneumoniae lung infection by regulating pulmonary neutrophil recruitment. PLoS Pathogens. 11 (8), 1005126 (2015).
- Bou Ghanem, E. N., et al. The alpha-tocopherol form of vitamin E boosts elastase activity of human PMNs and their ability to kill Streptococcus pneumoniae. Frontiers in Cellular and Infection Microbiology. 7, 161 (2017).
- Tait, A. R., Davidson, B. A., Johnson, K. J., Remick, D. G., Knight, P. R. Halothane inhibits the intraalveolar recruitment of neutrophils, lymphocytes, and macrophages in response to influenza virus infection in mice. Anesthesia & Analgesia. 76 (5), 1106-1113 (1993).
- Aaberge, I. S., Eng, J., Lermark, G., Lovik, M. Virulence of Streptococcus pneumoniae in mice: A standardized method for preparation and frozen storage of the experimental bacterial inoculum. Microbial Pathogenesis. 18 (2), 141-152 (1995).
- McCullers, J. A., Bartmess, K. C. Role of neuraminidase in lethal synergism between influenza virus and Streptococcus pneumoniae. The Journal of Infectious Diseases. 187 (6), 1000-1009 (2003).
- Smith, A. M., McCullers, J. A. Secondary bacterial infections in influenza virus infection pathogenesis. Current Topics in Microbiology and Immunology. 385, 327-356 (2014).
- Cundell, D. R., Gerard, N. P., Gerard, C., Idanpaan-Heikkila, I., Tuomanen, E. I. Streptococcus pneumoniae anchor to activated human cells by the receptor for platelet-activating factor. Nature. 377 (6548), 435-438 (1995).
- Ballinger, M. N., Standiford, T. J. Postinfluenza bacterial pneumonia: Host defenses gone awry. Journal of Interferon & Cytokine Research. 30 (9), 643-652 (2010).
- Sun, K., Metzger, D. W. Inhibition of pulmonary antibacterial defense by interferon-gamma during recovery from influenza infection. Nature Medicine. 14 (5), 558-564 (2008).
- Nakamura, S., Davis, K. M., Weiser, J. N. Synergistic stimulation of type I interferons during influenza virus coinfection promotes Streptococcus pneumoniae colonization in mice. Journal of Clinical Investigation. 121 (9), 3657-3665 (2011).
- Blanchette-Cain, K., et al. Streptococcus pneumoniae biofilm formation is strain dependent, multifactorial, and associated with reduced invasiveness and immunoreactivity during colonization. mBio. 4 (5), 00745 (2013).
- Rello, J., Pop-Vicas, A. Clinical review: Primary influenza viral pneumonia. Critical Care. 13 (6), 235 (2009).
- Torres, A., Loeches, I. M., Sligl, W., Lee, N. Severe flu management: A point of view. Intensive Care Medicine. 46 (2), 153-162 (2020).
- Bakaletz, L. O. Viral-bacterial co-infections in the respiratory tract. Current Opinion in Microbiology. 35, 30-35 (2017).
- Palacios, G., et al. Streptococcus pneumoniae coinfection is correlated with the severity of H1N1 pandemic influenza. PLoS One. 4 (12), 8540 (2009).
- Dhanoa, A., Fang, N. C., Hassan, S. S., Kaniappan, P., Rajasekaram, G. Epidemiology and clinical characteristics of hospitalized patients with pandemic influenza A (H1N1) 2009 infections: The effects of bacterial coinfection. Virology Journal. 8, 501 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。