Method Article
바이러스 동시 감염 시 콜로니자에서 병원체로 Streptococcus pneumoniae 의 전환을 위한 마우스 모델은 연령 악화 질병을 요약합니다.
* 이 저자들은 동등하게 기여했습니다
요약
이 논문은 바이러스 감염 동안 폐렴구균이 무증상 집락 상태에서 질병을 유발하는 병원체로 전환하기 위한 새로운 마우스 모델을 설명합니다. 이 모델은 질병 진행의 여러 단계 동안 다양한 숙주에서 다미생물 및 숙주-병원체 상호작용을 연구하는 데 쉽게 적용할 수 있습니다.
초록
폐렴 연쇄상 구균 (폐렴 구균)은 대부분의 개인에서 비 인두의 무증상 식민지 개척자이지만 인플루엔자 A 바이러스 (IAV) 감염시 폐 및 전신 병원체로 진행될 수 있습니다. 고령은 이차성 폐렴구균성 폐렴에 대한 숙주 감수성을 향상시키고 질병 결과를 악화시키는 것과 관련이 있습니다. 이러한 과정을 주도하는 숙주 요인은 부분적으로는 무증상 집락화에서 심각한 임상 질환으로의 전환을 재현하는 동물 모델이 부족하기 때문에 잘 정의되어 있지 않습니다.
이 논문은 바이러스 감염 시 폐렴구균이 무증상 보균에서 질병으로 전환되는 것을 재현하는 새로운 마우스 모델을 설명합니다. 이 모델에서, 마우스는 먼저 생물막 성장 폐렴 구균을 비강 내 접종하여 무증상 운반을 확립 한 다음, 비 인두와 폐 모두의 IAV 감염을 확립한다. 그 결과 폐로의 박테리아 전파, 폐 염증 및 치사율로 진행될 수 있는 질병의 명백한 징후가 나타납니다. 질병의 정도는 박테리아 균주 및 숙주 인자에 따라 다릅니다.
중요하게도, 이 모델은 젊은 생쥐에 비해 늙은 생쥐가 더 심각한 임상 질환을 나타내고 질병에 더 자주 굴복하기 때문에 노화의 감수성을 재현합니다. 운반과 질병을 별개의 단계로 분리하고 병원체와 숙주의 유전적 변이를 분석할 수 있는 기회를 제공함으로써 이 S. pneumoniae/IAV 동시 감염 모델은 질병 진행의 여러 단계에서 숙주와 중요한 병리의 상호 작용에 대한 자세한 검사를 허용합니다. 이 모델은 또한 감수성 숙주에서 이차성 폐렴구균성 폐렴에 대한 잠재적인 치료 표적을 식별하기 위한 중요한 도구 역할을 할 수 있습니다.
서문
폐렴구균(Streptococcus pneumoniae, 폐렴구균)은 그람 양성균으로 대부분의 건강한 사람의 비인두에 무증상으로 존재한다 1,2. 완전히 정의되지 않은 요인에 의해 촉진되는 폐렴구균은 비인두의 양성 집락 형성자에서 다른 장기로 퍼져 중이염, 폐렴, 균혈증 등 심각한 감염을 초래하는 병원체로 전환될 수 있다3. 폐렴구균성 질환 발현은 부분적으로 협막 다당류의 조성에 기초하는 혈청형을 포함한 균주 특이적 차이에 의존합니다. 지금까지 100가지 이상의 혈청형이 특징지어졌으며 일부는 보다 침습적인 감염과 관련이 있습니다 4,5. 몇 가지 다른 요인들이 폐렴 구균 성 질환의 위험을 증가시킵니다. 그러한 요인 중 하나는 폐렴 구균 성 폐렴의 위험이 IAV 6,7에 의해 100 배 증가하는 바이러스 감염입니다. 역사적으로 S. pneumoniae는 인플루엔자 이후 이차성 세균성 폐렴의 가장 흔한 원인 중 하나이며, 더 나쁜 결과와 관련이 있다8. 또 다른 주요 위험 요소는 고령입니다. 사실, S. pneumoniae는 65세 이상의 노인에서 지역사회 획득 세균성 폐렴의 주요 원인입니다 9,10. 노인은 폐렴 및 인플루엔자로 인한 사망의 대부분(>75%)을 차지하며, 이는 노화와 IAV 감염의 두 가지 위험 요소가 질병 감수성을 상승적으로 악화시킨다는 것을 나타낸다11,12,13,14. 그러나 바이러스 감염이 폐렴구균을 무증상 집락 형성자에서 침습성 병원체로 전환하도록 유도하는 메커니즘과 이것이 숙주 요인에 의해 형성되는 방식은 아직 잘 정의되어 있지 않습니다. 이것은 주로 무증상 폐렴구균 집락화에서 중대한 임상 질환으로의 전환을 요약하는 작은 동물 모델이 없기 때문입니다.
동시 감염 연구는 인플루엔자 감염 후 7일 후에 폐렴구균을 폐에 직접 접종한 마우스에서 고전적으로 모델링되었습니다15,16. 이는 이차성 세균성 폐렴에 대한 감수성을 재현하며, 항바이러스 면역 반응이 어떻게 항균 방어를 손상시키는지를 연구하는 데 이상적이다17. 그러나, 인간을 대상으로 한 종단적 연구는 박테리아가 무증상 생물막을 형성할 수 있는 비인두의 폐렴구균 운반(pneumococcal carriage)이 침습성 질병(invasive diseases)과 균일하게 연관되어 있음이 입증되었다19,20. 중이, 폐 및 혈액의 감염으로부터 분리된 박테리아는 비인두에서 발견되는 것과 유전적으로 동일하다20. 따라서, IAV 감염 후 무증상 운반에서 침습성 질환으로의 전환을 연구하기 위해, 마우스를 비강 내 투여한 후 비인두의 IAV 감염을 초래하는 모델을 확립하였다21,22. 상기도의 바이러스 감염은 숙주 환경의 변화로 이어져 생물막에서 폐렴구균이 분산되고 하부 기도로 퍼졌다21. 이 분산된 박테리아는 감염에 중요한 독성 인자의 발현을 상향 조절하여 식민지 개척자에서 병원체로 전환시켰다21. 이러한 관찰은 바이러스, 숙주 및 박테리아 사이의 복잡한 상호 작용을 강조하고 바이러스 감염에 의해 유발된 숙주의 변화가 폐렴구균 행동에 직접적인 영향을 미치며, 이는 차례로 박테리아 감염 과정을 변화시킨다는 것을 보여줍니다. 그러나 이 모델은 바이러스가 비강에 국한되어 있고 숙주 면역 및 폐 손상에 대한 바이러스 감염의 전신 효과가 요약되지 않기 때문에 인간에서 관찰되는 질병의 심각한 징후를 요약하지 못합니다.
우리는 최근에 숙주와 병원체 사이의 복잡한 상호 작용을 통합하지만 인간에서 관찰되는 질병 중증도를 더 가깝게 모방하는 모델을 구축했습니다23. 이 모델에서, 마우스는 먼저 생물막 성장 폐렴 구균에 비강 내 감염되어 무증상 운반을 확립한 다음, 비인두와 폐 모두의 IAV 감염이 뒤따른다. 그 결과 폐에 박테리아가 전파되고, 폐 염증이 발생했으며, 어린 생쥐의 일부에서 치사율로 진행된 질병이 발생했다23. 이 이전 연구는 바이러스 및 박테리아 감염 모두 숙주 방어를 변경했음을 입증했습니다: 바이러스 감염은 박테리아 전파를 촉진하고 이전의 박테리아 집락화는 폐 IAV 수준을 제어하는 숙주의 능력을 손상시켰습니다23. 면역 반응을 조사한 결과, IAV 감염은 호중구의 항균 활성을 감소시키는 반면, 박테리아 집락화는 항바이러스 방어에 중요한 I형 인터페론 반응을 둔화시키는 것으로 나타났다23. 중요한 것은 이 모델이 노화의 감수성을 재현했다는 것입니다. 어린 생쥐에 비해 늙은 생쥐는 질병의 징후를 더 일찍 보였고, 더 심각한 임상적 질병을 보였으며, 감염에 더 자주 굴복했다23. 이 원고에 제시된 연구는 침습성 폐렴구균 균주가 IAV 감염 시 더 효율적인 전파를 나타내고, 폐 염증의 더 명백한 징후를 보여주며, 비침습적 균주에 비해 질병의 속도를 가속화하기 때문에 질병의 정도도 박테리아 균주에 의존한다는 것을 보여줍니다. 따라서 이 S. pneumoniae/IAV 동시 감염 모델은 병원체와 숙주 인자 모두에 대한 자세한 검사를 허용하며 질병 진행의 여러 단계에서 다미생물 감염에 대한 면역 반응을 연구하는 데 매우 적합합니다.
프로토콜
모든 동물 연구는 실험실 동물의 관리 및 사용 가이드의 권장 사항에 따라 수행되었습니다. 모든 절차는 University at Buffalo Institutional Animal Care and Use Committee의 승인을 받았습니다.
1. 화학적으로 정의된 매체(CDM) 준비
- 다음과 같이 주식을 준비하십시오.
- 표 1에 열거된 혼합물 I 화합물을 교반하면서 초순수 100mL에 녹인다. -20 °C에서 200 μL 분취량으로 보관하십시오.
- 표 1에 열거된 혼합물 II 화합물을 교반하면서 0.1 M NaOH 중 20 mL에 용해시킨다. -20 °C에서 100 μL 분취량으로 보관하십시오.
- 표 1에 열거된 혼합물 III 화합물을 교반하면서 초순수 1mL에 녹입니다. 4 °C에서 10 μL 분취량으로 보관하십시오.
- 표 1에 열거된 혼합 IV 화합물을 교반하면서 초순수 1 mL에 녹인다. -20°C에서 10μL 분취량으로 보관하십시오.
- 교반하면서 처음에 표 2 에 나열된 화합물을 초순수 15mL에 녹입니다. 0.1M NaOH 몇 방울로 pH를 7.0으로 조정하고 초순수를 사용하여 최종 부피를 20mL로 조정합니다. -20 °C에서 1 mL 분취량에 보관하십시오.
- 표 3에 열거된 화합물을 교반하면서 50°C의 핫 플레이트 상의 초순수 90 mL에 녹인다. 0.1M NaOH로 pH를 7.0으로 조정한 후 초순수를 사용하여 최종 부피를 100mL로 조정합니다. -20 °C에서 5 mL 분취량으로 보관하십시오.
- 교반하면서 표 4의 화합물을 초순수 70 mL에 용해시켜 매번 스타터 스톡을 신선하게 만든다.
- 200 μL의 Mix I 스톡(표 1), 80 μL의 Mix II 스톡(표 1), 10 μL의 Mix III 스톡(표 1), 10 μL의 Mix IV 스톡(표 2), 1 mL의 비타민 스톡(표 3) 및 5 mL의 아미노산 스톡(표 4)을 순서대로 추가합니다.
- 스톡이 추가되면 비커에 100mL의 초순수를 추가하여 최종 부피를 30mL로 조정합니다.
- 표 4의 화합물로 CDM을 보충한다. 완전히 혼합되면 필터 멸균하고 최대 4주 동안 4°C에서 보관합니다.
2. S. pneumoniae 생물막 성장
- RPMI 1640 445mL와 열 불활성화 소 태아 혈청(FBS) 50mL 및 페니실린/스트렙토마이신 5mL를 각각 10,000U/mL 및 10,000μg/mL로 혼합하여 RP-10 배지를 준비합니다.
- NCI-H292(H292) 점막표피양 암종 세포주를 성장시킵니다. 구입한 바이알 1개에서 세포를 T-25 조직 배양 처리된 플라스크의 RP-10 배지 5mL에 넣습니다. 37°C/5%CO2 에서 3-5일 동안 배양하여 100% 합류점에 도달합니다.
- 밀도를 평가하기 위해 10x 배율을 사용하여 광학 현미경으로 세포를 확인합니다.
참고: 모든 셀이 다른 셀과 접촉하고 그 사이에 간격이 없으면 원하는 100% 밀도에 도달합니다. - 세포를 실온의 PBS 5mL로 2배 세척합니다. 다음 단계에서 EDTA가 킬레이트화되는 것을 방지하기 위해 완충액에 칼슘이 없는지 확인하십시오.
- 플라스크에 트립신-EDTA 1mL를 넣고 세포가 분리될 때까지 37°C/5% CO2 에서 5-10분 동안 배양합니다. 4mL의 RP-10 배지로 중화합니다. 위아래로 피펫팅하여 부드럽게 혼합하고 50mL 코니컬 튜브에 옮깁니다.
- 웰 당 500 μL의 세포 현탁액을 조직 배양 처리된 24-웰 플레이트에 첨가한다. 합류 T-25 플라스크에서 2 × 10 6-4 × 106 cells/mL를 예상합니다.
- 다음 날, 2.3단계에서와 같이 광학 현미경으로 세포를 검사하여 세포가 합류하는지 확인합니다. 그렇지 않은 경우 더 오래 배양하십시오.
- H292 세포가 24웰 플레이트에서 100% 합류하면 항생제나 파편이 포함된 배지가 남지 않도록 실온 PBS 1mL로 세포를 3배 부드럽게 세척합니다.
- 세포를 세척한 후 250μL/웰의 4% 파라포름알데히드를 추가하여 세포를 고정합니다. 얼음에서 1시간 동안 또는 4°C에서 하룻밤 동안 배양합니다.
- 세포 고정 전날 밤, 혈액 한천 플레이트에 관심 있는 S. pneumoniae 균주를 줄무늬로 만들고 37°C/5%CO2에서 밤새 배양합니다.
참고: 여기에 제시된 데이터는 협력 교환을 통해 얻은 다음 S. pneumoniae 균주와 함께 제공됩니다: 혈청형 19F 중이염 분리 EF3030 24, 고전적 혈청형 2 Avery 균주 D3925 및 혈청형 4 균혈증 분리TIGR4 26. 균주는 재료 표에 참조된 공개 컬렉션에서도 사용할 수 있습니다. - 20mL의 CDM에 100μL의 옥시라제(30U/mL)를 추가하여 CDM과 옥시라제(0.15U/mL)를 준비합니다.
참고: 옥시라제는 액체 배양에서 S. pneumoniae 의 효율적인 성장을 허용하기 위해 산소를 제거하는 데 사용된다27. - CDM + 옥시라제 1mL를 첨가하여 플레이트에서 박테리아를 세척하고 한천이 긁히지 않도록 주의하면서 1mL 피펫 팁의 측면을 사용하여 박테리아 콜로니를 부드럽게 들어 올려 플레이트에서 박테리아를 신선한 CDM + 옥시라제로 접종합니다. 또는 접종 루프를 사용하여 박테리아를 들어 올리고 CDM + 옥시라제 1mL가 들어 있는 튜브에 접종합니다.
- 박테리아를 CDM+ 옥시라제에서 0.05의 출발OD600 으로 희석한다.
- OD50의 OD 37에 도달할 때까지 5°C/5% CO 2에서 느슨하게 캡을 씌운 0.2mL 원추형 튜브에서 박테리아를 성장시킵니다(2-5시간 소요). OD600이 0.2를 초과하지 않는지 매시간 확인하십시오.
- OD가 0.2에 도달하면 박테리아 배양 튜브를 소용돌이칩니다. 고정된 H292 세포에 0.5 mL의 박테리아를 시딩하고, 웰 당 또 다른 0.5 mL의 CDM+ 옥시라제 배지를 첨가한다. 박테리아가 없는 대조군 웰에 1mL의 CDM + 옥시라제를 추가합니다. 플레이트를 34°C/5%CO2에서 48시간 동안 배양합니다.
참고: 34°C에서의 성장은 비인두의 낮은 온도를 보다 가깝게 모방하는 데 사용됩니다21. - 초기 파종 후 12시간마다 0.5mL의 배지를 부드럽게 제거하고 0.5mL의 신선한 CDM + 옥시라아제를 보충합니다. 형성되는 생물막을 방해하지 않도록 주의하십시오. 플레이트 바닥에 생물막이 있는지 확인하고 생물막의 성장으로 인해 시간이 지남에 따라 흐림이 증가하는 것을 확인합니다. 오염을 제어하려면 박테리아가 없는 웰을 확인하여 제어 웰이 깨끗하게 유지되는지 확인합니다.
- 접종 후 48시간에 상층액을 제거하고 PBS 1mL로 2배 부드럽게 세척합니다. 신선한 CDM 1mL에 재현탁하고 위아래로 세게 피펫하여 생물막을 들어 올립니다. 각 박테리아 균주에 대해 모든 웰의 박테리아를 50mL 원뿔형 튜브에 모읍니다. 단단히 덮인 튜브를 위아래로 여러 번 부드럽게 기울여 잘 섞습니다.
- 50mL 원뿔형 튜브에 CDM에 40% 글리세롤을 동일한 부피로 첨가하여 최종 농도가 20% 글리세롤인 박테리아 현탁액을 만듭니다. 1mL를 미세 원심분리기 튜브에 분취하여 드라이아이스에서 급속 동결하고 -80°C에서 저장합니다.
- 사용하기 전에, 1개의 분취액을 얼음 위에서 해동하고, 튜브를 1,700 × g 에서 5분 동안 회전시키고, 상층액을 제거하고, 펠릿을 PBS 1 mL에 재현탁시키고, 혈액 한천 플레이트28에 연속 희석액을 도금하여 박테리아를 열거한다.
- 한천 플레이트를 37°C/5% CO2 에서 밤새 성장시키고 관련 희석액에서 콜로니를 계수하여 콜로니 형성 단위(CFU)/mL의 박테리아 농도를 얻습니다.
참고: 처음 24시간 이내에 박테리아 생존력이 떨어지므로 냉동 후 최소 하루 또는 그 이후에 주식에 있는 박테리아를 열거하는 것이 좋습니다. 저장된 냉동 분취량은 최대 2 개월 동안 마우스의 후속 감염에 사용할 수 있습니다.
3. 생쥐의 비강 내 접종 생물막 성장 S. pneumoniae;
- 마우스를 구입하여 원하는 나이에 사용하십시오.
참고: 생후 3-4개월령 마우스는 어린 숙주를 모델링하는 데 선호되며, 생후 21-24개월령 마우스는29세>65세의 노인 개체를 모델링하는 데 사용할 수 있습니다. 여기에 제시된 데이터는 C57BL/6 수컷 마우스에 대한 것입니다. - 생물막에서 성장한 박테리아 분취량을 얼음에서 해동하고 1,700× g 에서 5분 동안 회전합니다. 펠릿을 방해하지 않고 상청액을 조심스럽게 제거하고 버리고, 펠릿을 PBS 1mL에 재현탁하여 박테리아를 세척하고, 1,700× g 에서 5분 동안 다시 회전시킵니다. 상층액을 제거하고 원하는 농도에 도달하는 데 필요한 부피로 펠릿을 다시 현탁합니다(비강 내 접종을 위해 5 × 106 CFU/10 μL 목표). 단계 2.19에서와 같이 제조된 접종물을 혈액 한천 플레이트에 플레이팅하여 투여된 균의 양을 확인한다.
- 희석된 접종물 5μL를 각 나리스에 피펫팅하여 5 ×10 6 CFU로 마우스를 비강 내 접종합니다. 부피가 흡입될 때까지 마우스를 단단히 잡고 머리를 안정시키십시오(일반적으로 부피를 콧구멍에 피펫팅한 후 몇 초 이내). 접종 물의 폐 흡인을 방지하기 위해 마취가 없을 때이 단계를 수행하십시오.
4. 인플루엔자 A 바이러스(IAV)에 의한 바이러스 감염
- S. pneumoniae로 비강내 접종 후 48시간에 관심 있는 IAV 균주를 얼음 위에서 해동합니다.
참고: 여기에 제시된 데이터는 협력 교환 30을 통해 얻은 인플루엔자 A 바이러스 A/PR/8/34 H1N1의 마우스 적응 균주입니다. - 바이러스가 해동되면 PBS에서 원하는 농도로 바이러스를 희석합니다. 기관내 감염의 경우 20 플라크 형성 단위(PFU)/50 μL, 비강내 감염의 경우 200 PFU/10 μL을 목표로 합니다. 모의 감염 및 박테리아 전용 그룹의 경우 PBS를 사용하여 마우스를 접종합니다.
- 마취 전에 생쥐의 눈에 안과 윤활제를 바르십시오. 5 % 이소 플루 란을 사용하여 마우스를 마취시키고 단단한 발가락 핀치로 마취를 확인합니다.
- 동물이 마취되면 이소플루란 챔버에서 제거하고 마취된 마우스에 50μL(20PFU)의 IAV를 기관 내로 즉시 감염시켜 무딘 핀셋을 사용하여 혀를 입 밖으로 빼내고 액체의 양을 기관 아래로 피펫팅합니다.
- 마우스를 별도의 케이지에 넣고 완전히 회복 될 때까지 모니터링합니다 (흉골 누운 자세를 유지할 수 있습니다 [가슴에 똑바로 눕힐 수 있음]).
- 회수 후, 3.3 단계의 접종 방법을 사용하여 마우스에 10 μL (200 PFU)의 IAV를 즉시 비강 내 접종한다.
- 동일한 감염 그룹으로 단일 또는 이중 박테리아 및 바이러스 감염을 겪은 집 마우스를 다른 그룹과 분리합니다.
5. 질병 증상에 대한 마우스 모니터링
- 최소 10 일 동안 매일 마우스를 모니터링하고 다음과 같이 질병의 징후에 대해 맹목적으로 점수를 매깁니다.
- 체중 감소에 대한 점수는 다음과 같습니다: 0 = 5% 이하; 1 = 5%-10%; 2 = 10%-15%; 3 = 20% 이상. 체중 감량 점수가 3일 때 CO2 흡입을 사용하여 마우스를 안락사시킵니다.
- 활동에 대한 점수는 다음과 같습니다: 0 = 정상/활성; 1 = 움직이지만 약간 감소; 2 = 감소; 3 = 심하게 감소/무기력(만져야만 움직임), 4 = 혼수상태/움직이지 않음. 활동 점수가 3일 때 마우스를 안락사시킵니다.
- 자세에 대한 점수는 다음과 같습니다: 0 = 직감 없음(정상); 1 = 약간 구부러진 자세; 2 = 심한 직감. 자세 점수가 2일 때 마우스를 안락사시킵니다.
- 눈에 대한 점수는 다음과 같습니다: 0 = 정상; 1 = 돌출; 1 = 침몰; 1 = 닫힘; 1 = 방전. 조합이 될 수 있습니다. 최종 시력 점수의 합계를 더합니다.
- 호흡에 대한 점수는 다음과 같습니다: 0 = 정상 호흡; 1 = 불규칙하거나 변경됨(높은/낮은 비율); 2 = 수고(과장된 노력 또는 헐떡임). 호흡 점수가 2일 때 마우스를 안락사시킵니다.
- 위의 기준에 따라 건강(0)에서 중증(15)의 총 임상 점수에 대한 개별 점수를 더합니다. 총점이 2 이상인 마우스는 아픈 것으로 간주합니다. 총 점수가 9점 이상이거나 각 기준에 대해 표시된 점수를 나타내는 마우스를 인도적으로 안락사시키고 생존 곡선에 표시하십시오.
6. 박테리아 계수를 위한 감염된 조직 처리
- IAV 감염 후 48시간에, 마우스를 안락사시킨다.
- 마우스를 앙와위 자세로 놓습니다. 70 % 에탄올을 사용하여 마우스의 가슴과 복부에 스프레이하여 모피를 청소하십시오. 집게를 사용하여 마우스 중앙의 털과 피부를 꼬집고 4.5 절개 가위로 털을 잘라 간에서 가슴까지 해당 부위를 노출시킵니다.
- 채혈
- 해부 가위를 사용하여 복강을 부드럽게 잘라 간을 노출시킵니다. 집게를 사용하여 횡격막 근처의 간 상단에있는 간문맥을 노출시킵니다. 해부 가위를 사용하여 간문맥을 자릅니다. 혈액이 복강에 고이기 시작하면 마이크로피펫을 사용하여 혈액 10μL를 수집하고 박테리아 부담을 위한 도금용 미세 원심분리기 튜브에 항응고제 용액 90μL(PBS의 50mM EDTA 용액)에 넣습니다.
- P-1000 마이크로피펫을 사용하여 나머지 혈액을 채취하여 채혈관에 넣고 7,600× g 에서 2분 동안 원심분리하여 혈청을 채취합니다. 원하는 사이토카인 또는 대사산물의 후속 분석을 위해 -80°C의 미세 원심분리 튜브에 혈청을 저장합니다.
- 폐 수집
- 해부 가위를 사용하여 노출된 흉곽의 측면을 잘라내고 갈비뼈를 마우스 머리 쪽으로 부드럽게 당겨 심장을 노출시킵니다. PBS로 미리 채워진 10mL 주사기에 부착된 25G 바늘을 우심실에 삽입하고 천천히 관류를 시작합니다. 성공적인 관류의 지표로 폐 표백을 찾으십시오. 폐 조직이 부러지지 않도록 천천히 씻어 내십시오.
- 집게로 심장을 들어 올리고 폐와 심장을 분리하기 위해 절개하십시오. 분리되면 집게로 폐의 모든 엽을 집어 들고 멸균 PBS가 든 접시에 헹구어 잔류 혈액을 제거합니다. 페트리 접시에 폐를 작은 조각으로 다지고 잘 섞는다. 박테리아 CFU 또는 바이러스 PFU를 측정하기 위해 폐 혼합물의 절반을 제거하고 균질화를 위해 0.5mL의 PBS로 미리 채워진 둥근 바닥 15mL 튜브에 넣습니다.
참고: 다양한 평가를 위해 동일한 폐의 다른 엽을 사용하지 않는 것이 중요합니다. 대신, 모든 로브를 다지고, 잘 혼합하고, 다른 평가를 위해 동등하게 구문 분석해야 합니다. - 유세포 분석을 위해 폐의 나머지 절반을 제거하고(아래 섹션 7) 각 웰에 0.5mL의 RP-10이 미리 채워진 비조직 배양 처리된 24웰 플레이트에 넣습니다. 처리 될 때까지 실온에서 방치하십시오.
- 비 인두 수집
- 목에서 해부 가위를 사용하여 털을 잘라낸 다음 근육을 잘라내어 기관을 노출시킵니다.
참고: 기관은 근육 아래에 위치한 튜브 모양의 구조입니다. - 마우스의 턱에서 1cm 떨어진 기관 아래에 작은 집게를 놓아 안정화시킵니다. 해부 가위를 사용하여 기관을 완전히 절단하지 않고 기관 앞부분에 0.1cm 슬릿을 부드럽게 만듭니다.
- 25G 바늘에 부착된 0.58mm 튜브가 있는 0.5mL의 PBS로 채워진 1mL 주사기를 준비합니다. 튜브를 비인두를 향해 위쪽으로 가는 기관에 삽입하여 비강 세척액을 수집합니다. 저항이 비강으로 들어가는 것이 느껴지면 미세 원심 분리기 튜브를 코에 놓고 기관을 통해 PBS를 천천히 씻어내어 비강 세척을 수집합니다.
- 마우스를 엎드린 자세로 놓습니다. 마우스의 머리에 에탄올을 뿌립니다. 해부 가위를 사용하여 털을 자르고 신비한 패드를 사용하여 마우스의 머리 뼈를 노출시킵니다.
- 해부 가위를 사용하여 하악의 측면과 눈 사이를 1cm 자릅니다. 집게를 사용하여 얼굴 뼈를 몸에서 천천히 당겨 비강을 노출시킵니다.
- 집게를 사용하여 비강 조직을 부드럽게 제거하고 균질화를 위해 0.5mL의 PBS로 미리 채워진 둥근 바닥 튜브에 넣습니다.
- 목에서 해부 가위를 사용하여 털을 잘라낸 다음 근육을 잘라내어 기관을 노출시킵니다.
- 수집된 조직을 균질화하려면 먼저 70% 에탄올에 넣고 60% 전력으로 30초 동안 균질기를 켜서 균질화 프로브를 세척합니다. 멸균 된 물에서 10 초 동안 단계를 반복하십시오. 각 조직을 1분 동안 균질화합니다. 균질화기 프로브를 멸균수로 세척합니다.amp각 s와 각 기관 사이의 70% 에탄올이 함유된 신선한 튜브에서amp르 그룹.
- 박테리아 수의 열거
- 모든 장기가 적출되고 균질화되면 혈액 한천 플레이트에 연속 희석액을 플레이트합니다. 총 CFU를 계산하려면 10μL를 사용하여 각 샘플의 최종 부피(mL)를 플레이트에 기록하고 기록합니다. 3μg/mL 겐타마이신이 보충된 혈액 한천 플레이트에 비인두 샘플을 플레이트하여 해당 조직에 서식하는 다른 미생물의 성장을 억제하면서 S. pneumoniae 의 성장을 선택합니다. 37°C/5%CO2에서 하룻밤 동안 배양합니다.
- 폐와 비 인두에 대한 박테리아 CFU를 열거하려면 먼저 혈액 한천 플레이트의 콜로니를 세십시오. 그런 다음 방정식 (1)과 방정식 (2)를 사용하여 mL당 양과 총 수를 계산합니다.
mL당 양 = 콜로니 수 × 희석 계수 × 100 (1)
총 수 = mL당 양 × 샘플당 총 부피(2)
참고: 방정식 (1)에서 100은 10μL가 도금되기 때문에 곱하는 데 사용되며, 이는 1mL의 100배 희석입니다. 식 (2)의 샘플 당 총 부피는 6.7.1 단계로부터이며, 이는 기관 당 100의 검출 한계를 초래합니다. - 박테리아 CFU를 열거하려면 균혈증의 경우 먼저 혈액 한천 플레이트의 콜로니를 세십시오. 그런 다음 방정식 (3)을 사용하여 혈액 mL당 양을 결정합니다.
혈액 mL당 양 = 집락 수 × 희석 계수 × 100 × 10 (3)
참고: 식 (3)에서 100은 10μL를 도말로 사용하며, 이는 1mL의 100배 희석이며, 10은 항응고제에서 혈액의 1:10 희석을 나타냅니다. 그 결과 검출 한계는 1,000/mL입니다.
7. 유세포 분석을 위한 폐 샘플 처리
- 다음과 같이 필요한 미디어를 준비합니다.
- 2.1단계에서 설명한 대로 RP-10을 준비합니다.
- RP-10을 2mg/mL 콜라게나제 및 30μL/mL DNase I과 혼합하여 분해 완충액을 준비합니다.
- 1L의H2O에 8.29g의NH4Cl, 1g의NaHCO3 및 0.038g의 EDTA를 용해시켜 용해 완충액을 제조한다.
- HBSS 450mL와 열 비활성화 FBS 50mL 및 아지드화나트륨 5g을 혼합하여 10x FACS 완충액을 준비합니다.
- 450mL의 HBSS에 50mL의 10x FACS 완충액을 희석하여 1x FACS 완충액을 준비합니다.
- 6.4.3 단계에서 폐 샘플을 채취하여 24웰 플레이트에 넣습니다. 500 μL의 소화 완충액을 각 웰에 첨가한다. 37°C/5%CO2에서 45분, 최대 1시간 동안 배양합니다.
- 각 샘플에 대해 50mL의 원뿔형 튜브를 5mL의 RP-10으로 미리 채웁니다. 배양이 끝나면 50mL 원뿔형 튜브 상단에 100μm 필터를 놓고 1mL의 RP-10으로 적십니다.
- P-1000 마이크로피펫을 사용하여 소화된 폐를 움직여 필터에 올려 놓습니다. 3mL 주사기의 플런저를 사용하여 장기를 으깬다. 매번 RP-10 1mL로 2회 헹굽니다.
- 샘플을 4°C 및 327× g 에서 5분 동안 회전시킵니다. 상층액을 흡인하고 펠릿을 용해 완충액 1mL에 재현탁합니다. 적혈구가 용해될 수 있도록 3분 동안 그대로 두십시오. 5mL의 RP-10으로 중화합니다.
- 샘플을 4°C 및 327× g 에서 5분 동안 회전시킵니다. 상층액을 흡인하고, RP-10 1mL에 펠렛을 재현탁하고, 샘플 계수를 위해 10 μL를 취한다.
- 샘플을 4°C 및 327×g에서 5분 동안 회전시킵니다. 상층액을 흡인하고 2 ×10 6-4 × 106 cells/mL에서 RP-10의 펠릿을 다시 현탁합니다. 각 샘플 60 μL를 96-웰 플레이트에 추가하여 단계 7.9, 표 5 및 표 6에 나열된 원하는 세포 유형23에 대해 염색합니다.
- 플레이트를 4°C 및 327× g 에서 5분 동안 회전시킵니다.
- 한편, 원하는 항체로 항체 마스터 믹스, 형광 마이너스 원(FMO) 및 단일 염색 대조군을 준비합니다. 다형핵 백혈구(PMN), 대식세포, 단핵구, 수지상 세포 및 T 세포를 염색하려면 표 5 및 표 6에 나열된 항체 및 최종 희석액을 사용하십시오. 항체 혼합물의 총 부피 100μL/웰을 사용합니다. 마스터 믹스의 적절한 부피와 필요한 개별 항체를 결정하기 위해 표에 나열된 희석액을 따르십시오.
- 스핀이 완료되면(단계 7.8), 상청액을 경사로 처리하고, 항체 혼합물, FMO 또는 단일 염색 대조군 100μL에 펠릿을 재현탁하고, 어둠 속에서 30분 동안 얼음 위에서 배양합니다.
- 150 μL의 FACS 완충액을 웰에 첨가하고, 플레이트를 4°C 및 327 × g 에서 5분 동안 회전시켜 세포를 2x 세척하였다.
- 스핀이 완료되면 상층액을 경사 조절하고 펠릿을 100μL의 고정 완충액에 재현탁하고 얼음에서 20분 동안 배양합니다.
- 150 μL의 FACS 완충액을 웰에 첨가하고, 플레이트를 4°C 및 327 × g 에서 5분 동안 회전시켜 세포를 2배 세척하였다.
- 200μL의 FACS 버퍼로 표지된 FACS 튜브를 준비합니다. 펠릿을 150μL의 FACS 완충액에 재현탁합니다. 100μm 필터를 사용하여 각 샘플을 해당 FACS 튜브로 개별적으로 필터링합니다. 얼음 위 또는 4°C에서 보관하고 분석할 준비가 될 때까지 빛으로부터 보호하십시오.
- 유세포 분석기를 이용하여 세포를 분석한다.
8. IAV 열거를 위한 플라크 분석
- 다음과 같이 필요한 미디어를 준비합니다.
- 소혈청알부민(BSA) 2.5g을 DMEM 40mL에 용해시켜 감염배지를 준비하고, 용해될 때까지 37°C에서 10-20분 동안 교반한다. 460mL의 DMEM으로 필터 멸균합니다.
- 1.2mg의 미결정셀룰로오스를 50mL의H2O에 용해시켜 2.4% 미결정셀룰로오스를 제조한다.
- 37°C에서 10-20분 동안 교반하면서 BSA 2.5g을 DMEM 40mL에 용해시켜 BSA DMEM 5%를 준비합니다. 나머지 10mL의 DMEM을 추가하여 최종 부피가 50mL가 되도록 합니다. 필터 멸균 및 4 °C에서 보관하십시오.
- 5% BSA DMEM 1mL와 2x MEM 9mL를 혼합하여 2x MEM/0.5% BSA를 준비합니다.
- 2.4% 미세결정성 셀룰로오스와 2x MEM/0.5% BSA를 1mg/mL TPCK(키모트립신 억제제) 트립신과 1:1 비율로 혼합하여 저점도 오버레이 배지를 준비합니다.
- 10mL의 EMEM(Eagle's Minimum Essential Medium)과 450mL의 열 비활성화 FBS를 혼합하여 EMEM/50% FBS를 준비합니다.
- Madin-Darby 개 신장(MDCK) 세포주를 성장시킵니다. 구입한 바이알 1개에서 세포를 T-25 조직 배양 처리 플라스크의 EMEM/10% FBS 5mL에 추가합니다. 세포가 100% 합류에 도달할 때까지 37°C/5% CO2 에서 3-5일 동안 배양합니다. 2.3단계에서와 같이 밀도를 확인합니다.
- 배양 배지를 제거하고 버리고 5mL의 실온 PBS로 2x 헹굽니다. 플라스크에 트립신-EDTA 1mL를 넣고 세포가 분리될 때까지 37°C/5% CO2 에서 10-15분 동안 배양합니다. 들어 올리면 4mL의 EMEM/10% FBS로 중화하여 2 ×10 5 cells/mL의 세포 현탁액을 얻습니다.
- 플라크 분석을 시작하기 1일 전에 웰당 1mL의 재현탁 세포(2 × 105 cells/well)를 추가하여 MDCK 세포를 12웰 조직 배양 처리된 플레이트에 시드합니다.
알림: 사용하기 전에 세포가 100% 밀도에 도달했는지 확인하고 밀도에 도달하기 위해 필요한 경우 더 오래 배양하십시오. - 표준으로 사용하려면 10 단계에 나열된 감염 배지에서 IAV 스톡 (알려진 역가의)을 10 배 연속 희석 (6-10-8.1.1)하십시오. 각 희석액 1.2mL를 만들어 세 번 테스트합니다.
- 장기 균질액을 얼음에서 해동하십시오. 2,000 × g 의 탁상용 원심분리기에서 회전하여 투명한 상층액을 수집합니다.
- 8.5 단계를 반복하되 8.6 단계의 샘플에서 상청액을 사용합니다.
- 세포로부터 배지를 흡인하고 1 mL의 PBS로 2x 세척하여 모든 FBS를 제거하였다.
- 각 표준 희석액 또는 연속 희석된 샘플 300μL를 각 웰의 측면을 따라 가장 높은 희석액부터 가장 낮은 희석액까지 부드럽게 추가하고 이를 세 번 수행합니다.
- 플레이트를 37°C/5%CO2의 인큐베이터에 넣고 총 50분 동안 10분마다 플레이트를 흔들었습니다. 인큐베이터에 평평하게 놓고 쌓지 마십시오.
- 50분 후, 세포를 1 mL의 PBS로 2x 세척하였다.
- 저점도 오버레이 배지 2mL를 가장 희석이 적고 바이러스가 없는 웰을 제외한 각 웰에 추가합니다. 여기에 감염 배지와 트립신을 첨가하십시오.
- 플레이트를 37°C/5%CO2 의 인큐베이터에 2-4일 동안 다시 넣어 육안으로 시각화할 수 있는 플라크를 얻습니다.
- 플레이트를 측면으로부터 빠르게 각 웰에 2 mL의 PBS를 첨가하여 세척하고, 침전된 저점도 오버레이 배지를 현탁시키기 위해 부드럽게 흔들었다.
- 배지를 부드럽게 피펫팅하여 웰의 전체 액체 부피를 버립니다.
- 각 웰에 PBS 2mL로 세척을 한 번 더 반복한 다음 부드러운 피펫팅으로 전체 액체 부피를 버립니다.
- 플라크를 고정하려면 500μL의 4% 파라포름알데히드를 각 웰에 넣고 흔들고 30분 동안 그대로 두십시오.
- PBS 1mL로 측면을 천천히 씻으십시오. 그런 다음 액체를 부드럽게 버리십시오.
- 500 μL의 1 % 크리스탈 바이올렛 (물에 희석)을 각 웰에 첨가하여 세포 단층을 덮습니다. 5분 동안 배양합니다.
- 수돗물 1mL로 씻으십시오. 부드러운 피펫팅으로 우물에 있는 모든 액체를 버리십시오. 기저귀 패드에 접시를 거꾸로 놓고 밤새 건조시킵니다.
- 플라크를 시각적으로 계산하고 사용 가능한 이미저에 이미지를 저장합니다.
결과
생물막 성장 S. pneumoniae(그림 1A)는 마취되지 않은 마우스에 비강 내로 전달된 작은 10μL 접종물을 사용하여 마우스(그림 1B)를 감염시키는 데 사용되었습니다. 이 소량 접종물은 전신 확산을 피하면서 비인두로 제한되는 일관된 폐렴구균 운반을 초래합니다(그림 2A, +sp 그룹). 비강내 접종 이틀 후, 마우스는 비인두와 폐에 특정 양을 일관되게 전달하기 위해 비강내 및 기관내로 전달되는 쥐 적응 H1N1 인플루엔자 A 바이러스 A/PR/8/34 (IAV)22,30에 감염되었다 23.
여기서, 이 모델은 균혈증으로 진행되는 폐렴을 유발하는 침습성 균주인 TIGR4 및 D39와 중이염 균주인 EF3030을 포함하여 S. pneumoniae의다른 균주로 비강 내 도전된 마우스에서 바이러스 감염 후 질병 경과를 비교하는 데 사용되었습니다. S. pneumoniae/IAV 동시 감염 마우스의 질병 발현은 박테리아 균주에 의존적이었습니다(그림 2). 모든 균주 중에서 비인두의 박테리아 수에는 유의미한 차이가 없었지만(그림 2A), S. pneumoniae TIGR4 및 D39(EF3030은 아님)는 IAV 감염 후 48시간까지 폐로 전파되었습니다(그림 2B). S. pneumoniae TIGR4에 비강 내 감염된 마우스의 40%가 폐로 박테리아 전파를 나타냈고, 그 중 절반은 균혈증이 되었으며(그림 2C), 이는 이전 연구 결과와 일치합니다23.
S. pneumoniae D39로 비강내 감염된 마우스는 동시 감염된 마우스의 100%에서 폐로의 확산이 관찰되었기 때문에 보다 효율적인 파종을 보였다(도 2B). S. pneumoniae TIGR4와 유사하게, 그 중 절반이 균혈증을 경험했습니다(그림 2C). 박테리아 균주에 관계없이 전체 생존율을 추적함에 있어서, 동시 감염된 마우스의 생존율은 테스트된 모든 균주에 대해 S. pneumoniae만 단독으로 챌린지된 마우스보다 유의하게 낮았다(그림 2D). IAV 단독으로 챌린지된 대조군 마우스와 비교하여, EF3030이 아닌 S. pneumoniae TIGR4 및 D39에 비강내 감염된 마우스는 가속화된 질병 비율을 나타냈다. IAV 감염 후 2일째까지 마우스의 30%(D39) 및 20%(TIGR4)가 굴복한 반면, IAV 전용 대조군은 챌린지 후 5일까지 굴복하기 시작하지 않았습니다(그림 2D). S. pneumoniae EF3030 및 IAV에 동시 감염된 마우스는 IAV 전용 대조군과 더 유사한 지연 증상을 보였다(그림 2D). 이러한 발견은 동시 감염 모델이 박테리아 균주에 의존하는 젊은 건강한 마우스에서 질병을 초래한다는 것을 보여주며, 이는 질병 진행의 각 단계에서 필요한 박테리아 요인을 탐색하는 데 이상적입니다.
이 모델은 S. pneumoniae 의 다른 균주를 비강 내 접종한 마우스에서 IAV 감염 후 폐에 있는 다양한 면역 세포의 존재를 평가하는 데 사용되었습니다(그림 3의 세포 유형 및 게이팅 전략). IAV 감염 후 폐로 분산된 박테리아 균주 D39 및 TIGR4는 호중구(PMN) 및 단핵구와 같은 순환계에서 염증성 면역 세포의 유입이 기준선(감염되지 않은) 이상으로 크게 증가한 반면 EF3030은 그렇지 않았습니다(그림 4A-C). IAV 감염 단독은 NK 세포 및 감마-델타 T 세포와 같은 바이러스 감염에 대한 숙주 방어에 중요한 면역 세포의 유입에서 기준선보다 유의한 증가를 유도했습니다(그림 4A-C). 이러한 항바이러스 반응은 바이러스 챌린지 전에 S. pneumoniae에 비강내 감염된 마우스에서 유의하게 둔화되었습니다(그림 4A-C). 이는 사이토카인 반응을 평가한 선행 연구에서 S. pneumoniae가 I형 인터페론의 생성을 둔화시키고 폐에서 IAV 부하를 조절하는 숙주의 능력을 손상시킨다는 것을 발견했다23. 이러한 발견은 동시 감염 모델이 단일 대 다미생물 감염에서 면역 반응이 어떻게 변하는지 연구하는 데 사용될 수 있음을 보여줍니다.
이 모델은 또한 S. pneumoniae 에 비강내 감염된 마우스에서 IAV 감염 후 질병 경과에 대한 노화의 영향을 평가하기 위해 사용되었습니다. 단독으로 감염된 마우스에서 바이러스 역가는 젊은 코호트와 노인 코호트 간에 변하지 않았습니다(그림 5A)23. 이전 연구(23)에서와 같이, 늙은 쥐는 더 높은 임상 점수에 의해 입증된 바와 같이 젊은 쥐에 비해 더 일찍 그리고 훨씬 더 심각한 질병 징후를 나타냈다(그림 5B). 질병 증상과 일치하게, S. pneumoniae 를 접종한 늙은 쥐는 IAV 감염 후 24시간 이내에 더 빨리 죽기 시작했고, 모두 질병에 굴복한 반면, 젊은 대조군은 감염에서 유의하게 더 높은(33%) 비율로 생존했습니다(그림 5C). 이러한 발견은 동시 감염 모델이 취약한 숙주에서 더 심각한 질병을 감지하는 데 사용될 수 있음을 보여주며, 동시 감염에 대한 내성 또는 감수성을 부여하는 숙주 인자를 탐색하는 데 이상적입니다.
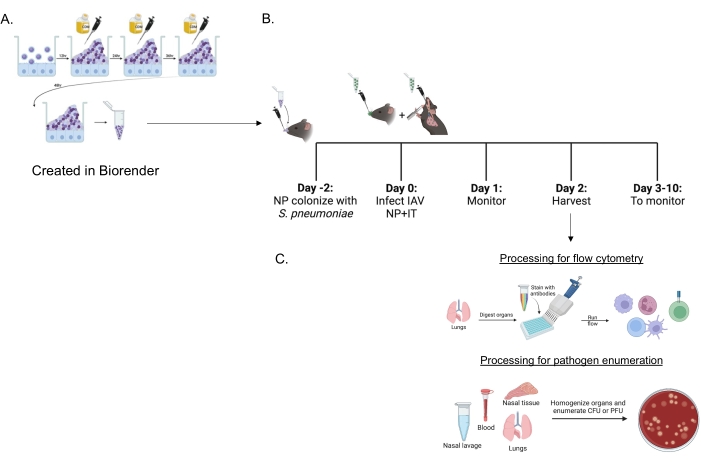
그림 1: 면역 세포 유입 및 병원체 부담 평가를 위한 동시 감염 및 장기 처리 일정. (A) 폐렴 연쇄상 구균은 생물막에서 자랍니다. (B) 마우스에 표시된 생물막 성장 S. pneumoniae 균주의 5 ×10 6 CFU를 비강 내 접종하여 비인두 운반을 확립하거나 치료하지 않은 채로 둡니다. 48시간 후, 마우스를 PBS로 모의 처리하거나 비강내 인플루엔자 A 바이러스 PR8 200PFU 및 기관내 20PFU를 투여받습니다. 마우스는 임상 질병 점수 및 생존에 대해 시간 경과에 따라 모니터링됩니다. (C) IAV 감염 후 48시간에, 다른 장기의 박테리아 CFU 또는 바이러스 PFU 또는 폐의 면역 세포 유입을 평가합니다. 약어: CFU = 집락 형성 단위; PFU = 플라크 형성 단위; IAV = 인플루엔자 A 바이러스 PR8; IT = 기관 내; NP = 비인두. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
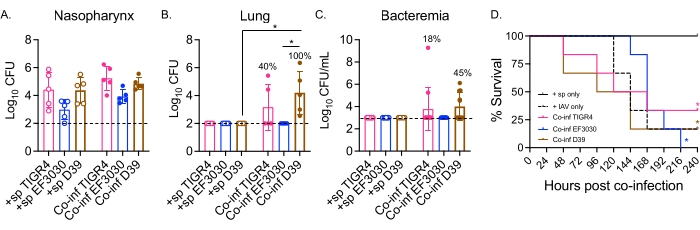
그림 2: S. pneumoniae 접종 마우스의 이중 비강내/기관내 IAV 감염은 박테리아 확산 및 박테리아 균주에 의존하는 질병을 유발합니다. 어린(10-12주령) 수컷 C57BL/6(B6) 마우스가 도 1에서와 같이 감염되었다. (A) 비인두, (B) 폐 및 (C) 혈액의 박테리아 수는 모두 IAV 감염 후 48시간에 결정되었습니다. (나,씨) 백분율은 확산을 보인 마우스의 비율을 나타냅니다. (D) IAV 감염 후 10일 동안 생존율을 모니터링하였다. 그룹당 (A,B) n = 5, (C) n = 11 및 (D) n = 6 마우스의 풀링된 데이터가 표시됩니다. 각 원은 하나의 마우스에 해당하며 점선은 감지 한계를 나타냅니다. (A-C)*는 Kruskal-Wallis 검정에 의해 결정된 바와 같이 지시된 그룹들 사이에 유의한 차이(p < 0.05)를 나타낸다. (d)*는 로그-랭크 (Mantel-Cox) 시험에 의해 결정된 바와 같이 박테리아 균주 당 +sp 및 Co-inf 마우스 사이에 유의한 차이 (p < 0.05)를 나타낸다. 약어: +sp = 표시된 균주만을 사용하여 박테리아로 비강 내 감염된 마우스; Co-inf = IAV에 감염된 박테리아 감염 마우스; IAV = 인플루엔자 A 바이러스를 투여받은 마우스; CFU = 집락 형성 단위. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
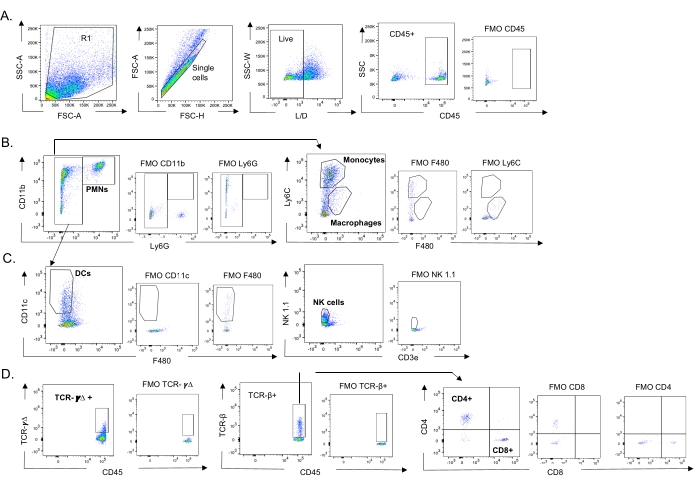
그림 3: 면역 세포 게이팅 전략. 폐를 채취하고, 면역 세포 유입을 유세포 분석에 의해 측정하였다. 상이한 세포 유형의 대표적인 게이팅 전략이 보여진다. (A) CD45+, 살아있는 단세포에 게이팅을 하고, (B) PMN(Ly6G+, CD11b+), 대식세포(Ly6G-, Ly6C-, F480+) 및 단핵구(Ly6G-, Ly6C+), (C) DC(Ly6G-, CD11c+) 및 NK 세포(NK1.1+, CD3-), (D) TCR-γΔ 및 CD8(CD8+, TCRβ+) 및 CD4(CD4+, TCRβ+ ) T 세포를 결정하였다. 약어: SSC-A = 측면 산란-피크 면적; FSC-A = 전방 산란-피크 면적; FSC-H = 전방 산란-피크 높이; SSC-W = 측면 산란 피크 폭; L/D = 살아 있는/죽은 것; FMO = 형광 마이너스 1; NK = 자연 살해; PMN = 다형핵 백혈구; DC = 수지상 세포; TCR = T 세포 수용체. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
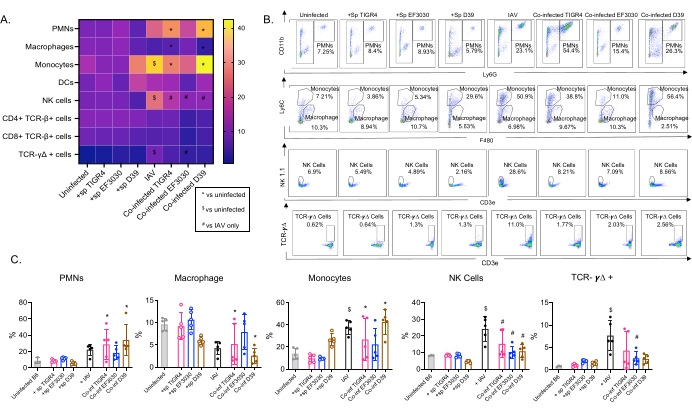
그림 4: 폐 면역 반응은 박테리아 균주에 따라 다릅니다. 어린(10-12주령) C57BL/6 수컷 마우스는 감염되지 않았거나, 표시된 폐렴구균 균 주(+sp)를 단독으로 접종하거나, IAV(IAV)로 단독으로 접종하거나, S. pneumoniae 와 IAV(Co-inf)에 동시 감염되었습니다. IAV 감염 후 48시간 후(그림 1의 실험 설계 참조), 폐를 채취하고, 면역 세포 유입을 그림 3의 게이팅 전략에 따라 유세포 분석에 의해 측정했습니다. (A) CD45 게이트 내에서 표시된 각 세포 유형의 평균 백분율은 히트 맵의 모든 치료 그룹에 대해 표시됩니다. (B) 처리 간에 유의한 차이를 보인 세포 유형의 대표적인 도트 플롯이 각 마우스 그룹에 대해 표시됩니다. (C) 표시된 면역 세포 유형의 백분율이 표시됩니다. 각 원은 하나의 마우스에 해당합니다. (ᄀ,ᄃ) 그룹당 n=5마리 마우스로부터의 풀링된 데이터가 도시되어 있다. *, Co-inf와 감염되지 않은 사람 사이에 유의한 차이(p < 0.05)를 나타내고; $는 IAV와 감염되지 않은 것 사이의 유의성을 나타내고; #는 Co-inf와 IAV 단독의 유의한 차이를 나타낸다. 각 세포 유형에 대한 챌린지 그룹 간의 유의미한 차이는 ANOVA에 이어 Tukey 테스트에 의해 결정되었습니다. 약어: NK = 자연 살해; PMN = 다형핵 백혈구; DC = 수지상 세포; TCR = T 세포 수용체; IAV = 인플루엔자 A 바이러스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
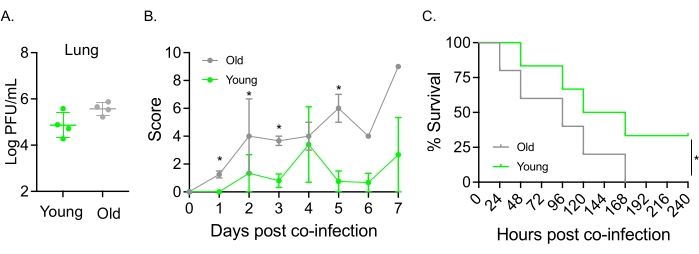
그림 5: 노화 및 IAV/Streptococcus pneumoniae 동시 감염에 대한 숙주 감수성 증가. 젊은(10-12주) 및 노화된(21-22개월) C57BL/6 수컷 마우스는 S. pneumoniae TIGR4 i.n. 및 IAV i.n. 및 i.t. (그림 1에서와 같이) 또는 IAV 단독으로 단독으로 챌린지되었습니다. (A) 바이러스 역가는 48시간 후에 결정되었습니다. 별표는 스튜던트 t-검정에 의해 결정된 통계적 유의성(p < 0.05)을 나타냅니다. 데이터는 그룹당 n = 4마리의 마우스에서 풀링됩니다. (B) 임상 점수 및 (C) 생존율을 시간 경과에 따라 모니터링하였다. (B) 그룹당 n=6 마우스로부터 풀링된 평균 SEM ± 나타내었다. 별표는 Mann-Whitney 테스트에 의해 결정된 바와 같이 표시된 시점에서 어린 마우스와 늙은 마우스 사이의 통계적 유의성(p < 0.05)을 나타냅니다. (C) 데이터는 그룹당 n=6마리의 마우스로부터 풀링된다. 별표는 로그-랭크(Mantel-Cox) 검정에 의해 결정된 바와 같이 어린 마우스와 늙은 마우스 사이의 통계적 유의성(p < 0.05)을 나타낸다. 약어: IAV = 인플루엔자 A 바이러스; i.n. = 비강내; i.t. = 기관내; SEM = 평균의 표준 오차. 그림 5A는 Joma et al.23의 허가를 받아 재인쇄되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| CDM용 믹스 I 재고 | |
| 아데닌 | 0.1 그램 |
| D-알라닌 | 0.25 그램 |
| CaCl2 무수 | 0.025 그램 |
| 황산망간 | 0.03 그램 |
| 시아노코발라민 | 10 μL의 10 mg/mL 스톡 |
| 파라-아미노벤조산 | 400 μL의 5 mg/mL 스톡 |
| 피리독사민 2HCl | 10 μL의 10 mg/mL 스톡 |
| CDM용 Mix II 주식 | |
| 구아닌 | 0.05 그램 |
| 우라실 | 0.05 그램 |
| CDM용 Mix III 주식 | |
| 질산철 9H2O | 50 밀리그램/mL |
| 황산 제이철 7H2O | 10 밀리그램/mL |
| CDM용 Mix IV 스톡 | |
| 베타-니코틴아미드 아데닌 디뉴클레오티드 | 25 밀리그램/mL |
표 1: CDM에 대한 믹스 I, II, III 및 IV 주식. 약어: CDM = 화학적으로 정의된 매체.
| CDM용 비타민 믹스 스톡 | |
| 피리독살 염산염 | 0.8 그램 |
| 티아민 Cl2 | 0.4 그램 |
| 리보플라빈 | 0.4 그램 |
| Ca-판토텐산염 | 0.4 그램 |
| 비오 틴 | 0.04 그램 |
| 엽산(Folic Acid) | 0.4 그램 |
| 나이아신아마이드 | 0.4 그램 |
표 2: CDM용 비타민 믹스 스톡. 약어: CDM = 화학적으로 정의된 매체.
| CDM용 아미노산 스톡 | |
| L-알라닌 | 0.480 그램 |
| L-아르기닌 | 0.250 그램 |
| L-아스파라긴 | 0.700 그램 |
| L-아스파르트산 | 0.600 그램 |
| L-시스테인 | 1.000 그램 |
| L-시스틴 | 0.100 그램 |
| L-글루탐산 | 0.200 그램 |
| L-글루타민 | 0.780 그램 |
| L-글리신 | 0.350 그램 |
| L-히스티딘 | 0.300 그램 |
| L-이소류신 | 0.430 그램 |
| L-류신 | 0.950 그램 |
| L-라이신 | 0.880 그램 |
| L-메티오닌 | 0.250 그램 |
| L-페닐알라닌 | 0.550 그램 |
| L-프롤린 | 1.350 그램 |
| L-세린 | 0.680 그램 |
| L-트레오닌 | 0.450 그램 |
| L-트립토판 | 0.100 그램 |
| L-발린 | 0.650 그램 |
표 3: CDM에 대한 아미노산 스톡. 약어: CDM = 화학적으로 정의된 매체.
| CDM용 스타터 스톡 | |
| 포도당 | 1.0 그램 |
| 황산마그네슘-7-하이드레이트 | 0.070 그램 |
| 이염기성 인산칼륨 | 0.02 그램 |
| 인산 칼륨 Monobasic | 0.1 그램 |
| 소듐 아세테이트 무수 | 0.45 그램 |
| 중탄산나트륨 | 0.25 그램 |
| 소듐 포스페이트 디베이직 | 0.735 그램 |
| 인산 나트륨 Monobasic | 0.32 그램 |
| CDM에 대한 최종 보충 교재 | |
| 콜린 염화 물 | 0.1 그램 |
| L-시스테인 HCl | 0.075 그램 |
| 중탄산나트륨 | 0.25 그램 |
표 4 : CDM에 대한 스타터 재고 및 최종 보충제. 약어: CDM = 화학적으로 정의된 매체.
| 항체/형광단 | 클론 | 희석 계수 |
| UV 여기를 위한 L/D | 해당 사항 없음 | 0.38888889 |
| Ly6G AF 488 시리즈 | 1A8 | 0.25 |
| CD11b APC | M1/70 시리즈 | 0.25 |
| CD11c PE | N418 | 0.18055556 |
| 마우스 Fc 블록 | 2.4지2 | 0.11111111 |
| F4/80 PE Cy7 | 비엠8 | 0.18055556 |
| 리6C BV605 | 알-21 | 0.25 |
| CD103 BV 421 (영어) | M290 시리즈 | 0.18055556 |
| CD45 APC-eF-780 | 30-F11 | 0.18055556 |
표 5: 항체 패널 1.
| 항체/형광단 | 클론 | 희석 계수 |
| UV 여기를 위한 L/D | 해당 사항 없음 | 0.388888889 |
| TCR-β APC Cy7 | H57-597 | 0.180555556 |
| CD4 V450 (퍼시픽 블루) | RM4-5 (위안 4-5) | 0.25 |
| CD8 BV650 | 53-6.7 | 0.180555556 |
| 마우스 Fc 블록 | 2.4지2 | 0.111111111 |
| CD45 PE | 30-F11 | 0.180555556 |
| CD3 AF488 | 145-2C11 | 0.180555556 |
| TCR- γΔ APC | GL-3 시리즈 | 0.180555556 |
| NK1.1 AF 700 시리즈 | PK136 시리즈 | 0.180555556 |
표 6: 항체 패널 2.
토론
기존의 S. pneumoniae/IAV 동시 감염 실험 연구의 대부분은 IAV에 사전 감염된 마우스의 폐로의 박테리아 전달에 의존합니다. 이러한 모델은 숙주를 2차 세균 감염에 취약하게 만드는 폐 환경 및 전신 면역 반응의 변화를 식별하는 데 도움이 되었습니다 15,16,17,32,33,34,35,36,37. 그러나 이러한 모델은 S. pneumoniae가 무증상 식민지 개척자에서 심각한 폐 및 전신 감염을 일으킬 수 있는 병원체로의 전환을 모방하는 데 실패했습니다. 또한, 이들 모델은 감염에 대한 감수성에 기여하는 상부 호흡기에서 숙주 인자 및 숙주-병원체 상호작용을 연구하는 데 적합하지 않습니다. IAV 감염 후 비인두에서 폐로 폐렴구균의 이동에 대한 이전 모델은 비인두의 세균 감염에 이어 바이러스 감염에 의존했습니다. 그러나, 인간 환자에서 관찰된 심각한 질환 징후를 재현하지 못했다21. 여기에 설명된 변형된 쥐 감염 모델은 S. pneumoniae가 무증상 보균에서 심각한 임상 질환을 유발하는 병원체로의 전환을 요약합니다.
이 모델의 중요한 단계는 비인두에서 S. pneumoniae 감염을 확립하는 것입니다. Streptococcus pneumoniae는 생물막을 형성하고 다른 효율로 비 인두를 식민지화합니다21,38. 지속적인 감염을 확립하기 위해서는 지금까지 시험한 생물막 성장 박테리아 균주 중 최소 5 ×10 6 CFU가 필요하다23. 새로운 박테리아 균주는 바이러스 감염 전에 비 인두의 안정적인 감염에 대해 테스트하는 것이 좋습니다. 바이러스 동시 감염의 경우, 이전 연구에서는 비 인두에서 박테리아의 분산을 위해 IAV에 의한 비강 내 감염이 필요하다는 것을 발견했습니다21,22,23. 이전 연구에서는 비강 내 전달을 위해 500 PFU의 IAV가 사용되었지만 이 연구에서는 200 PFU가 비인두의 박테리아 수를 증가시키기에 충분했습니다. IAV 감염은 상기도에 국한되지 않고 폐로 퍼질 수 있으며(39,40), 이는 폐 환경을 세균 감염에 대해 더 관대하게 만드는 데 핵심이다(15,16,41). IAV의 폐로의 전달은 마취된 마우스의 비강내 전달 또는 기관내 설치에 의해 달성될 수 있다. BALB/cByJ 마우스를 사용한 이전 연구에서 비강 내 전달이 바이러스성 폐렴을 유발한다는 사실이 밝혀졌습니다21; 그러나 비강 내 접종 후 폐에 대한 접종물의 접근은 C57BL/6 마우스에서 더 제한적입니다. C57BL/6 마우스에서는 바이러스의 일관된 전달을 위해 기관 내 설치가 필요하다23. 이 모델에서, 이전의 박테리아 집락화는 바이러스 감염 후 질병 증상의 발현을 가속화한다23. 바이러스 감염 자체가 동역학의 잠재적인 변화와 함께 질병 증상을 유발할 수 있으므로 먼저 테스트된 새로운 바이러스 균주에 대해 다양한 용량을 테스트하고 동시 감염된 숙주에서 가속화된 동역학을 나타내는 용량을 선택하는 것이 좋습니다.
폐는 이 모델에서 질병 평가를 위한 또 다른 중요한 판독값을 제공합니다. 병원균 부담 및 면역 세포 유입을 평가하기 위해 동일한 마우스의 폐를 사용할 수 있습니다. 그러나 감염과 염증의 중증도는 엽마다 다를 수 있으므로 다양한 평가를 위해 동일한 폐의 다른 엽을 복용하지 않는 것이 좋습니다. 오히려, 모든 로브는 작은 조각으로 다져지고, 함께 잘 섞인 다음, 다른 평가를 위해 동등하게 구문 분석 될 수 있습니다. 유사하게, 비 인두는 박테리아 CFU 또는 바이러스 PFU 및 면역 반응의 열거에 사용될 수 있습니다. 그러나, 세척 및 조직으로부터 얻어진 세포의 수가 너무 적기 때문에 동일한 그룹 내의 마우스로부터 샘플을 풀링하지 않고 유세포 분석을 수행할 수 없다. 대안적으로, 비인두의 염증은 조직학적으로 평가될 수 있다23.
이 모델의 중요한 특징은 환자에서 볼 수 있는 임상 질병을 요약한다는 것입니다. 인간의 경우, IAV 감염 후 이차성 폐렴구균성 폐렴은 종종 입원, 호흡 부전, 심지어 사망으로 이어질 수 있는 기침, 호흡곤란, 발열 및 근육통을 포함한 명백한 질병의 징후를 초래한다 8,15,42,43. 이 모델은 생쥐가 보여주는 호흡 곤란(호흡 점수에 반영됨) 및 전반적인 불쾌감(자세 및 움직임 점수에 반영됨) 측면에서 인간에서 관찰되는 임상 질병의 심각한 징후와 일부 건강한 젊은 대조군의 사망을 요약합니다. 동시 감염된 마우스에서 악화된 질병 증상은 폐에 박테리아가 전파되고 폐렴구균 운반이 있는 마우스에서 바이러스 제거가 손상된 결과일 가능성이 높다23. 모델의 한계는 비인두에서 임상 질환 및 박테리아 전파의 발생률이 마우스마다 다르며 박테리아 균주, 숙주 연령 및 유전자형의 영향을 받는다는 것입니다21,22,23. 이를 반영하여 침습성 균주의 경우 국소 감염(검출 가능한 균혈증 없음)에서 사망으로의 진행이 24시간 이내에 발생할 수 있습니다. 따라서 전신 확산에 대한 진정한 평가를 위해서는 더 짧은 간격 (6-12 시간마다)에 걸쳐 균혈증을 추적해야합니다. 유사하게, 질병 점수는 특히 동시 감염 후 처음 72시간 동안 빠르게 변할 수 있습니다. 따라서 질병 증상을 면밀히 추적하려면 IAV 감염 후 1-3 일 동안 하루에 세 번 마우스를 모니터링하는 것이 좋습니다.
요약하면, 이 모델은 비인두의 무증상 집락자에서 IAV 감염 시 폐 및 전신 질환을 유발할 수 있는 병원체로 S. pneumoniae 의 이동을 복제합니다. 이 모델에서 IAV는 비인두의 박테리아 행동을 수정하고, 폐로의 박테리아 확산을 증가시키고, 항균 면역을 변경하여 S. pneumoniae 의 전이를 유발합니다23. 유사하게, 박테리아 운반은 항바이러스 면역 반응을 둔화시키고 폐에서 IAV 제거를 손상시킨다23. 따라서 이 모델은 단일 대 다미생물 감염에서 면역 반응의 변화를 분석하는 데 이상적입니다. 또한, 동시 감염 후 질병의 경과는 부분적으로 비인두에 존재하는 폐렴구균의 균주에 의존합니다. 따라서 이 모델은 S. pneumoniae 의 무증상 집락화 대 병원성 전이에 필요한 박테리아 인자를 해부하는 데 적합합니다. 마지막으로, 이 모델은 동시 감염에 대한 노화의 감수성을 재현하며, 여기에서 테스트되지는 않았지만 숙주 배경이 질병 경과에 미치는 영향을 평가하는 데 쉽게 사용할 수 있습니다. 결론적으로, 운반과 질병을 별개의 단계로 분리하면 병원체와 숙주의 유전적 변이를 분석할 수 있는 기회가 제공되어 질병 진행의 여러 단계에서 중요한 병리와 숙주의 상호 작용을 자세히 검사할 수 있습니다. 앞으로 이 모델은 취약한 호스트에 대한 치료 옵션을 맞춤화하는 데 사용할 수 있습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 원고를 비판적으로 읽고 편집해 주신 Nick Lenhard에게 감사드립니다. 또한 박테리아 균주에 대해 Andrew Camilli와 Anthony Campagnari에게, 바이러스 균주에 대해 Bruce Davidson에게 감사드립니다. 이 작업은 국립 보건원 보조금(R21AG071268-01)에서 JL로, 국립 보건원 보조금(R21AI145370-01A1), (R01AG068568-01A1), (R21AG071268-01)에서 E.N.B.G.로 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 4-Aminobenzoic acid | Fisher | AAA1267318 | Mix I stock |
| 96-well round bottom plates | Greiner Bio-One | 650101 | |
| 100 µm Filters | Fisher | 07-201-432 | |
| Adenine | Fisher | AC147440250 | Mix I stock |
| Avicel | Fisher | 501785325 | Microcyrstalline cellulose |
| BD Cytofix Fixation Buffer | Fisher | BDB554655 | Fixation Buffer |
| BD Fortessa | Flow cytometer | ||
| BD Intramedic Polyethylene Tubing | Fisher | 427410 | Tubing for nasal lavage |
| BD Disposable Syringes with Luer-Lok Tips (1 mL) | Fisher | 14-823-30 | |
| BD Microtainer Capillary Blood Collector and BD Microgard Closure | Fisher | 02-675-185 | Blood collection tubes |
| Beta-Nicotinamide adenine dinucleotide | Fisher | AAJ6233703 | Mix IV stock |
| Biotin | Fisher | AC230090010 | Vitamin stock |
| C57BL/6J mice | The Jackson Laboratory | #000644 | Mice used in this study |
| Calcium Chloride Anhydrous | Fisher Chemical | C77-500 | Mix I stock |
| CD103 BV 421 | BD Bioscience | BDB562771 | Clone: M290 DF 1:200 |
| CD11b APC | Invitrogen | 50-112-9622 | Clone: M1/70, DF 1:300 |
| CD11c PE | BD Bioscience | BDB565592 | Clone: N418 DF 1:200 |
| CD3 AF 488 | BD Bioscience | OB153030 | Clone: 145-2C11 DF 1:200 |
| CD4 V450 | BD Horizon | BDB560470 | Clone: RM4.5 DF 1:300 |
| CD45 APC eF-780 | BD Bioscience | 50-112-9642 | Clone: 30-F11 DF 1:200 |
| CD45 PE | Invitrogen | 50-103-70 | Clone: 30-F11 DF 1:200 |
| CD8α BV 650 | BD Horizon | BDB563234 | Clone: 53-6.7 DF 1:200 |
| Choline chloride | Fisher | AC110290500 | Final supplement to CDM |
| Corning Disposable Vacuum Filter/Storage Systems | Fisher | 09-761-107 | Filter sterilzation apparatus |
| Corning Tissue Culture Treated T-25 Flasks | Fisher | 10-126-9 | |
| Corning Costar Clear Multiple Well Plates | Fisher | 07-201-590 | |
| Corning DMEM With L-Glutamine and 4.5 g/L Glucose; Without Sodium Pyruvate | Fisher | MT10017CM | |
| Cyanocobalamin | Fisher | AC405925000 | Mix I stock |
| D39 | National Collection of Type Culture (NCTC) | NCTC 7466 | Streptococcus pneumoniae strain |
| D-Alanine | Fisher | AAA1023114 | Mix I stock |
| D-Calcium pantothenate | Fisher | AC243301000 | Vitamin stock |
| Dextrose | Fisher Chemical | D16-500 | Starter stock |
| Dnase | Worthington Biochemical | LS002147 | |
| Eagles Minimum Essential Medium | ATCC | 30-2003 | |
| EDTA | VWR | BDH4616-500G | |
| EF3030 | Center for Disease Control and Prevention | Available via the isolate bank request | Streptococcus pneumoniae strain, request using strain name |
| F480 PE Cy7 | BD Bioscience | 50-112-9713 | Clone: BMB DF 1:200 |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | 50 mL round bottom tube |
| Falcon Round-Bottom Polypropylene Test Tubes With Cap | Fisher | 14-959-11B | 15 mL round bottom tube |
| Falcon Round-Bottom Polystyrene Test Tubes (5 mL) | Fisher | 14-959-5 | FACS tubes |
| FBS | Thermofisher | 10437-028 | |
| Ferric Nitrate Nonahydrate | Fisher | I110-100 | Mix III stock |
| Fisherbrand Delicate Dissecting Scissors | Fisher | 08-951-5 | Instruments used for harvest |
| Fisherbrand Disposable Inoculating Loops | Fisher | 22-363-602 | Inoculating loops |
| Fisherbrand Dissecting Tissue Forceps | Fisher | 13-812-38 | Forceps for harvest |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5 mL | Fisher | 05-408-137 | Micocentrifuge tubes |
| Fisherbrand Sterile Syringes for Single Use (10 mL) | Fisher | 14-955-459 | |
| Folic Acid | Fisher | AC216630500 | Vitamin stock |
| Gibco RPMI 1640 (ATCC) | Fisher | A1049101 | |
| Gibco DPBS, no calcium, no magnesium | Fisher | 14190250 | |
| Gibco HBSS, calcium, magnesium, no phenol red | Fisher | 14025134 | |
| Gibco MEM (Temin's modification) (2x), no phenol red | Fisher | 11-935-046 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher | 15-140-122 | |
| Gibco Trypan Blue Solution, 0.4% | Fisher | 15-250-061 | |
| Gibco Trypsin-EDTA (0.25%), phenol red | Fisher | 25-200-056 | |
| Glycerol (Certified ACS) | Fisher | G33-4 | |
| Glycine | Fisher | AA3643530 | Amino acid stock |
| Guanine | Fisher | AAA1202414 | Mix II stock |
| Invitrogen UltraComp eBeads Compensation Beads | Fisher | 50-112-9040 | |
| Iron (II) sulfate heptahydrate | Fisher | AAA1517836 | Mix III stock |
| L-Alanine | Fisher | AAJ6027918 | Amino acid stock |
| L-Arginine | Fisher | AAA1573814 | Amino acid stock |
| L-Asparagine | Fisher | AAB2147322 | Amino acid stock |
| L-Aspartic acid | Fisher | AAA1352022 | Amino acid stock |
| L-Cysteine | Fisher | AAA1043518 | Amino acid stock |
| L-Cysteine hydrochloride monohydrate | Fisher | AAA1038914 | Final supplement to CDM |
| L-Cystine | Fisher | AAA1376218 | Amino acid stock |
| L-Glutamic acid | Fisher | AC156211000 | Amino acid stock |
| L-Glutamine | Fisher | O2956-100 | Amino acid stock |
| L-Histidine | Fisher | AC166150250 | Amino acid stock |
| LIFE TECHNOLOGIES LIVE/DEAD Fixable Blue Dead Cell Stain Kit, for UV excitation | Invitrogen | 50-112-1524 | Clone: N/A DF 1:500 |
| L-Isoleucine | Fisher | AC166170250 | Amino acid stock |
| L-Leucine | Fisher | BP385-100 | Amino acid stock |
| L-Lysine | Fisher | AAJ6222514 | Amino acid stock |
| L-Methionine | Fisher | AAA1031822 | Amino acid stock |
| Low endotoxin BSA | Sigma Aldrich | A1470-10G | |
| L-Phenylalanine | Fisher | AAA1323814 | Amino acid stock |
| L-Proline | Fisher | AAA1019922 | Amino acid stock |
| L-Serine | Fisher | AC132660250 | Amino acid stock |
| L-Threonine | Fisher | AC138930250 | Amino acid stock |
| L-Tryptophan | Fisher | AAA1023014 | Amino acid stock |
| L-Valine | Fisher | AAA1272014 | Amino acid stock |
| Ly6C BV 605 | BD Bioscience | BDB563011 | Clone: AL-21 DF 1:300 |
| Ly6G AF 488 | Biolegend | NC1102120 | Clone: IA8, DF 1:300 |
| Madin-Darby Canine Kidney (MDCK) cells | American Type Culture Collection (ATCC) | CCL-34 | MDCK cell line for PFU analuysis |
| Magnesium Sulfate 7-Hydrate | Fisher | 60-019-68 | CDM starter stock |
| Manganese Sulfate | Fisher | M113-500 | Mix I stock |
| MilQ water | Ultra-pure water | ||
| Mouse Fc Block | BD Bioscience | BDB553142 | Clone: 2.4G2 DF 1:100 |
| MWI VETERINARY PURALUBE VET OINTMENT | Fisher | NC1886507 | Eye lubricant for infection |
| NCI-H292 mucoepidermoid carcinoma cell line | ATCC | CRL-1848 | H292 lung epithelial cell line for biofilm growth |
| Niacinamide | Fisher | 18-604-792 | Vitamin stock |
| NK 1.1 AF 700 | BD Bioscience | 50-112-4692 | Clone: PK136 DF 1:200 |
| Oxyrase For Broth 50Ml Bottle 1/Pk | Fisher | 50-200-5299 | To remove oxygen from liquid cultures |
| Paraformaldehyde 4% in PBS | Thermoscientific | J19932-K2 | |
| Pivetal Isoflurane | Patterson Veterinary | 07-893-8440 | Isoflurane for anesthesia during infection |
| Potassium Phosphate Dibasic | Fisher Chemical | P288-500 | Starter stock |
| Potassium Phosphate Monobasic | Fisher Chemical | P285-500 | Starter stock |
| Pyridoxal hydrochloride | Fisher | AC352710250 | Vitamin stock |
| Pyridoxamine dihydrochloride | Fisher | AAJ6267906 | Mix I stock |
| Riboflavin | Fisher | AC132350250 | Vitamin stock |
| Sodium Acetate | VWR | 0530-500G | Starter stock |
| Sodium Azide | Fisher Bioreagents | BP922I-500 | For FACS buffer |
| Sodium Bicarbonate | Fisher Chemical | S233-500 | Starter stock and final supplement to CDM |
| Sodium Phosphate Dibasic | Fisher Chemical | S374-500 | Starter stock |
| Sodium Phosphate Monobasic | Fisher Chemical | S369-500 | Starter stock |
| TCR APC | BD Bioscience | 50-112-8889 | Clone: GL-3 DF 1:200 |
| TCRβ APC-Cy7 | BD Pharmigen | BDB560656 | Clone: H57-597 DF 1:200 |
| Thermo Scientific Blood Agar with Gentamicin | Fisher | R01227 | Blood agar plates with the antibiotic gentamicin |
| Thermo Scientific Trypsin, TPCK Treated | Fisher | PI20233 | |
| Thiamine hydrochloride | Fisher | AC148991000 | Vitamin stock |
| TIGR4 | ATCC | BAA-334 | Streptococcus pneumoniae strain |
| Uracil | Fisher | AC157300250 | Mix II stock |
| Worthington Biochemical Corporation Collagenase, Type 2, 1 g | Fisher | NC9693955 |
참고문헌
- Kadioglu, A., Weiser, J. N., Paton, J. C., Andrew, P. W. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nature Reviews Microbiology. 6 (4), 288-301 (2008).
- Obaro, S., Adegbola, R. The pneumococcus: Carriage, disease and conjugate vaccines. Journal of Medical Microbiology. 51 (2), 98-104 (2002).
- Chong, C. P., Street, P. R. Pneumonia in the elderly: A review of the epidemiology, pathogenesis, microbiology, and clinical features. Southern Medical Journal. 101 (11), 1141-1145 (2008).
- Kadioglu, A., Andrew, P. W. Susceptibility and resistance to pneumococcal disease in mice. Briefings in Functional Genomics and Proteomics. 4 (3), 241-247 (2005).
- Ganie, F., et al. Structural, genetic, and serological elucidation of Streptococcus pneumoniae serogroup 24 serotypes: Discovery of a new serotype, 24C, with a variable capsule structure. Journal of Clinical Microbiology. 59 (7), 0054021 (2021).
- Centers for Disease Control and Prevention. Estimates of deaths associated with seasonal influenza --- United States. MMWR. Morbidity and Mortality Weekly Report. 59 (33), 1057-1062 (2010).
- Shrestha, S., et al. Identifying the interaction between influenza and pneumococcal pneumonia using incidence data. Science Translational Medicine. 5 (191), (2013).
- McCullers, J. A. Insights into the interaction between influenza virus and pneumococcus. Clinical Microbiology Reviews. 19 (3), 571-582 (2006).
- Pneumococcal Disease Global Pneumococcal Disease and Vaccine. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/pneumococcal/global.html (2018)
- Grudzinska, F. S., et al. Neutrophils in community-acquired pneumonia: Parallels in dysfunction at the extremes of age. Thorax. 75 (2), 164-171 (2020).
- Boe, D. M., Boule, L. A., Kovacs, E. J. Innate immune responses in the ageing lung. Clinical and Experimental Immunology. 187 (1), 16-25 (2017).
- Krone, C. L., van de Groep, K., Trzcinski, K., Sanders, E. A., Bogaert, D. Immunosenescence and pneumococcal disease: An imbalance in host-pathogen interactions. The Lancet Respiratory Medicine. 2 (2), 141-153 (2014).
- Cho, S. J., et al. Decreased NLRP3 inflammasome expression in aged lung may contribute to increased susceptibility to secondary Streptococcus pneumoniae infection. Experimental Gerontology. 105, 40-46 (2018).
- Disease Burden of Influenza. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/flu/about/burden/index.html (2018)
- McCullers, J. A. The co-pathogenesis of influenza viruses with bacteria in the lung. Nature Reviews Microbiology. 12 (4), 252-262 (2014).
- McCullers, J. A., Rehg, J. E. Lethal synergism between influenza virus and Streptococcus pneumoniae: Characterization of a mouse model and the role of platelet-activating factor receptor. The Journal of Infectious Diseases. 186 (3), 341-350 (2002).
- Metzger, D. W., Sun, K. Immune dysfunction and bacterial coinfections following influenza. Journal of Immunology. 191 (5), 2047-2052 (2013).
- Chao, Y., Marks, L. R., Pettigrew, M. M., Hakansson, A. P. Streptococcus pneumoniae biofilm formation and dispersion during colonization and disease. Frontiers in Cellular and Infection Microbiology. 4, 194 (2014).
- Bogaert, D., De Groot, R., Hermans, P. W. Streptococcus pneumoniae colonisation: The key to pneumococcal disease. The Lancet Infectious Diseases. 4 (3), 144-154 (2004).
- Simell, B., et al. The fundamental link between pneumococcal carriage and disease. Expert Review of Vaccines. 11 (7), 841-855 (2012).
- Marks, L. R., Davidson, B. A., Knight, P. R., Hakansson, A. P. Interkingdom signaling induces Streptococcus pneumoniae biofilm dispersion and transition from asymptomatic colonization to disease. mBio. 4 (4), 00438 (2013).
- Reddinger, R. M., Luke-Marshall, N. R., Sauberan, S. L., Hakansson, A. P., Campagnari, A. A. Streptococcus pneumoniae modulates Staphylococcus aureus biofilm dispersion and the transition from colonization to invasive disease. mBio. 9 (1), 02089 (2018).
- Joma, B. H., et al. A murine model for enhancement of Streptococcus pneumoniae pathogenicity upon viral infection and advanced age. Infection and Immunity. 89 (8), 0047120 (2021).
- Andersson, B., et al. Identification of an active disaccharide unit of a glycoconjugate receptor for pneumococci attaching to human pharyngeal epithelial cells. Journal of Experimental Medicine. 158 (2), 559-570 (1983).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. The Journal of Experimental Medicine. 79 (2), 137-158 (1944).
- Tettelin, H., et al. Complete genome sequence of a virulent isolate of Streptococcus pneumoniae. Science. 293 (5529), 498-506 (2001).
- Tothpal, A., Desobry, K., Joshi, S. S., Wyllie, A. L., Weinberger, D. M. Variation of growth characteristics of pneumococcus with environmental conditions. BMC Microbiology. 19 (1), 304 (2019).
- Bou Ghanem, E. N., et al. Extracellular adenosine protects against Streptococcus pneumoniae lung infection by regulating pulmonary neutrophil recruitment. PLoS Pathogens. 11 (8), 1005126 (2015).
- Bou Ghanem, E. N., et al. The alpha-tocopherol form of vitamin E boosts elastase activity of human PMNs and their ability to kill Streptococcus pneumoniae. Frontiers in Cellular and Infection Microbiology. 7, 161 (2017).
- Tait, A. R., Davidson, B. A., Johnson, K. J., Remick, D. G., Knight, P. R. Halothane inhibits the intraalveolar recruitment of neutrophils, lymphocytes, and macrophages in response to influenza virus infection in mice. Anesthesia & Analgesia. 76 (5), 1106-1113 (1993).
- Aaberge, I. S., Eng, J., Lermark, G., Lovik, M. Virulence of Streptococcus pneumoniae in mice: A standardized method for preparation and frozen storage of the experimental bacterial inoculum. Microbial Pathogenesis. 18 (2), 141-152 (1995).
- McCullers, J. A., Bartmess, K. C. Role of neuraminidase in lethal synergism between influenza virus and Streptococcus pneumoniae. The Journal of Infectious Diseases. 187 (6), 1000-1009 (2003).
- Smith, A. M., McCullers, J. A. Secondary bacterial infections in influenza virus infection pathogenesis. Current Topics in Microbiology and Immunology. 385, 327-356 (2014).
- Cundell, D. R., Gerard, N. P., Gerard, C., Idanpaan-Heikkila, I., Tuomanen, E. I. Streptococcus pneumoniae anchor to activated human cells by the receptor for platelet-activating factor. Nature. 377 (6548), 435-438 (1995).
- Ballinger, M. N., Standiford, T. J. Postinfluenza bacterial pneumonia: Host defenses gone awry. Journal of Interferon & Cytokine Research. 30 (9), 643-652 (2010).
- Sun, K., Metzger, D. W. Inhibition of pulmonary antibacterial defense by interferon-gamma during recovery from influenza infection. Nature Medicine. 14 (5), 558-564 (2008).
- Nakamura, S., Davis, K. M., Weiser, J. N. Synergistic stimulation of type I interferons during influenza virus coinfection promotes Streptococcus pneumoniae colonization in mice. Journal of Clinical Investigation. 121 (9), 3657-3665 (2011).
- Blanchette-Cain, K., et al. Streptococcus pneumoniae biofilm formation is strain dependent, multifactorial, and associated with reduced invasiveness and immunoreactivity during colonization. mBio. 4 (5), 00745 (2013).
- Rello, J., Pop-Vicas, A. Clinical review: Primary influenza viral pneumonia. Critical Care. 13 (6), 235 (2009).
- Torres, A., Loeches, I. M., Sligl, W., Lee, N. Severe flu management: A point of view. Intensive Care Medicine. 46 (2), 153-162 (2020).
- Bakaletz, L. O. Viral-bacterial co-infections in the respiratory tract. Current Opinion in Microbiology. 35, 30-35 (2017).
- Palacios, G., et al. Streptococcus pneumoniae coinfection is correlated with the severity of H1N1 pandemic influenza. PLoS One. 4 (12), 8540 (2009).
- Dhanoa, A., Fang, N. C., Hassan, S. S., Kaniappan, P., Rajasekaram, G. Epidemiology and clinical characteristics of hospitalized patients with pandemic influenza A (H1N1) 2009 infections: The effects of bacterial coinfection. Virology Journal. 8, 501 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유