Method Article
تقييم علاج تعديل انقباض القلب في خلايا عضلة القلب المشتقة من الخلايا الجذعية البشرية 2D
In This Article
Summary
هنا ، نعرض طريقة تقييم انقباض الأجهزة الطبية القلبية غير الغازية باستخدام أحاديات الطبقة العضلية القلبية المشتقة من الخلايا الجذعية البشرية 2D (hiPSC-CM) ، المطلية على ركيزة مرنة ، إلى جانب الفحص المجهري القائم على الفيديو. ستكون هذه الأداة مفيدة للتقييم في المختبر للخصائص المقلصة لأجهزة الفيزيولوجيا الكهربية للقلب.
Abstract
يتم حاليا استكشاف الخلايا العضلية القلبية المشتقة من الخلايا الجذعية البشرية (hiPSC-CMs) للعديد من التطبيقات المختبرية وقد تم استخدامها في التقديمات التنظيمية. هنا ، نوسع استخدامها ليشمل سلامة الأجهزة الطبية القلبية أو تقييمات الأداء. لقد طورنا طريقة جديدة لتقييم خصائص انقباض الأجهزة الطبية القلبية في أحادي الطبقات 2D hiPSC-CMs التعاقدية بقوة على ركيزة هيدروجيل مرنة قائمة على مصفوفة خارج الخلية (ECM). تتيح هذه الأداة القياس الكمي لتأثيرات إشارات جهاز الفيزيولوجيا الكهربية للقلب على وظيفة القلب البشري (على سبيل المثال ، خصائص الانقباض) باستخدام معدات المختبرات القياسية. تم استزراع الطبقات الأحادية 2D hiPSC-CM لمدة 2-4 أيام على ركيزة هيدروجيل مرنة بتنسيق 48 بئرا.
تعرضت hiPSC-CMs للإشارات الكهربائية للأجهزة الطبية القياسية لتعديل انقباض القلب (CCM) ومقارنة بالتحكم (أي السرعة فقط) hiPSC-CMs. تم تحديد خصائص انقباض خط الأساس ل 2D hiPSC-CMs من خلال تحليل الكشف القائم على الفيديو بناء على إزاحة البكسل. أظهرت 2D hiPSC-CMs المحفزة ب CCM المطلية على ركيزة الهيدروجيل المرنة خصائص انقباض محسنة بشكل كبير بالنسبة لخط الأساس (أي قبل تحفيز CCM) ، بما في ذلك زيادة سعة انكماش الذروة وحركية الانكماش والاسترخاء المتسارعة. علاوة على ذلك ، فإن استخدام ركيزة الهيدروجيل المرنة يتيح تعدد إرسال قراءات اقتران انكماش القلب والإثارة القائمة على الفيديو (أي الفيزيولوجيا الكهربية ، ومعالجة الكالسيوم ، والانكماش) في hiPSC-CMs الصحية والمريضة. يعد الكشف الدقيق والقياس الكمي لتأثيرات الإشارات الفيزيولوجية الكهربية للقلب على تقلص القلب البشري أمرا حيويا لتطوير الأجهزة الطبية القلبية وتحسينها وإزالة المخاطر. تتيح هذه الطريقة التصور القوي والقياس الكمي للخصائص المقلصة للمخلوي القلبي ، والتي يجب أن تكون ذات قيمة لاختبار سلامة الأجهزة الطبية القلبية غير السريرية أو فعاليتها. تصف هذه الورقة ، بالتفصيل ، منهجية توليد طبقة أحادية الطبقة من الركيزة هيدروجيل 2D hiPSC-CM.
Introduction
مع تقدم سكان الولايات المتحدة في العمر ، يستمر عدد مرضى قصور القلب في الارتفاع ، إلى جانب التكاليف الطبية المباشرة 1,2. هناك حاجة ماسة لتطوير علاجات جديدة لعلاج قصور القلب ومنهجيات غير سريرية مبتكرة لاختبار مثل هذه العلاجات. تم اقتراح الخلايا العضلية القلبية المشتقة من الخلايا الجذعية البشرية (hiPSC-CMs) كأداة في المختبر للمساعدة في عملية التطوير العلاجي وتم استخدامها في التقديمات التنظيمية 3,4. ومع ذلك ، فقد كان استخدامها على نطاق واسع محدودا لدراسات الانقباض بسبب عدم وجود خصائص انقباض قوية عند طلائها في ظروف الثقافة 2D الصلبة القياسية (أي البلاستيك أو الزجاج زراعة الأنسجة التقليدية)5،6،7،8. لقد أثبتنا سابقا فائدة طلاء hiPSC-CMs المفردة المعزولة على ركيزة هيدروجيل مرنة لتوليد خصائص انقباض مرئية قوية9. لقد أظهرنا أن hiPSC-CMs المعزولة لها خصائص انقباضية مماثلة لتلك الموجودة في خلايا عضلة القلب البطينية للأرانب البالغة المعزولة حديثا. علاوة على ذلك ، أظهرنا فائدة هذه الطريقة لتقييم الاستجابات المقلصة للعوامل الدوائية7. علاوة على ذلك ، طبقت دراسات أخرى هذه التكنولوجيا على التقييمات الميكانيكية للعلوم الأساسية ونمذجة الأمراض10،11،12. هنا ، تم توسيع هذه المنهجية لتشمل أحاديات الطبقة 2D hiPSC-CM ، وتم إثبات فائدتها في تقييم الإشارات الكهربائية للأجهزة الطبية ذات الصلة من الناحية الفسيولوجية (CCM) في المختبر.
CCM هو علاج قصور القلب داخل القلب حيث يتم توصيل الإشارات الكهربية غير المثيرة إلى عضلة القلب خلال فترة المقاومة المطلقة للدورة القلبية13,14. لا توجد طرق قابلة للتكرار لتقييم CCM في نماذج خلايا القلب البشرية. استخدمت الأعمال السابقة نماذج مختلفة لخلايا القلب لتقييم استجابة انقباض CCM. لقد أثبتنا في المختبر أن خلايا عضلة القلب البطينية الأرنب المعزولة حديثا تستجيب لتحفيز CCM من خلال زيادة عابرة في الكالسيوم وسعةالانكماش 15. أظهرت دراسة أخرى أجريت على خلايا عضلة القلب البطينية المعزولة للكلاب تعزيزا مستحثا ب CCM لسعة الكالسيوم العابرة داخل الخلايا16. ومع ذلك ، فقد استخدمت غالبية دراسات CCM المستحضرات الحيوانية خارج الجسم الحي وفي الجسم الحي. يصعب ربط هذه الدراسات مع بعضها البعض لأنها تطبق مجموعة متنوعة من معلمات نبض CCM والأنواع17. كشفت إحدى الدراسات في نموذج حليمي معزول للأرنب عن زيادة الانقباض الناجم عن CCM8،18 ، وأظهرت مجموعة من دراسات القلب كله تعزيزا مستحثا ب CCM لوظيفة الانقباض19،20،21. قدمت هذه الدراسات رؤية ميكانيكية مهمة. ومع ذلك ، هناك نقص في النماذج البشرية القابلة للتكرار لدراسات انقباض EP للقلب في المختبر بما في ذلك CCM. تحقيقا لهذه الغاية ، قمنا بتطوير العديد من نماذج 2D و 3D hiPSC وأظهرنا التحسين الناجم عن CCM للخصائص المقلصة بطريقة تعتمد على المعلمات. علاوة على ذلك ، تم العثور على تأثيرات مؤثر في التقلص العضلي التي يسببها CCM جزئيا بوساطة المدخلات العصبية وإشارات β الأدرينالية8،17،22. ومع ذلك ، يجب معرفة المزيد عن آليات العلاج بالتشوهات الكهفية الدماغية ، ويمكن أن يساعد استخدام خلايا عضلة القلب البشرية المتقلصة في تحقيق هذه النتيجة. على هذا النحو ، هناك حاجة كبيرة لتطوير أدوات بشرية غير سريرية لتقييم أجهزة وإشارات CCM الجديدة ، وتسريع العملية التنظيمية ، وتقليل العبء على النماذج الحيوانية ، والمساعدة في اتخاذ قرارات مطوري الأجهزة8،17،23،24. من المهم تطوير بروتوكولات سهلة افعلها بنفسك يمكن نقلها إلى أي مختبر وتستخدم معدات قياسية ومتطلبات خلايا منخفضة لتقليل التكاليف. توضح هذه الطريقة آثار تحفيز CCM على وظيفة خلايا عضلة القلب البشرية وتوفر رؤى مهمة حول سلامة أو فعالية CCM17. هنا ، نصف طريقة توليد أحاديات الطبقة 2D hiPSC-CM على ركيزة هيدروجيل مرنة لإنتاج أداة غير سريرية موحدة لتحديد الاستجابات الطبية للفيزيولوجيا الكهربية للقلب الحاد (أي CCM) في الصحة والمرض.
Protocol
1. إعداد اللوحات والوسائط
ملاحظة: السمة الهيدروجيلية النموذجية القائمة على المصفوفة خارج الخلية (ECM) هي ~ 200 ميكرولتر في أنبوب معقم سعة 1.5 مل مخزن عند -20 درجة مئوية.
- في غطاء زراعة الأنسجة المعقمة ، قم بإعداد صفيحة معقمة من 6 آبار عن طريق نقل 2 مل من الجيلاتين 0.1٪ (جدول المواد) إلى كل بئر. ضع الغطاء على اللوحة المكونة من 6 آبار ، واترك اللوحة المطلية تحضن عند 37 درجة مئوية لمدة لا تقل عن 1 ساعة.
- قبل يوم واحد من بذر hiPSC-CMs على ركيزة هيدروجيل مرنة ، قم بإذابة قسامة هيدروجيل (جدول المواد) في الثلاجة على الجليد.
- تحضير وسط عضلة القلب (جدول المواد) عن طريق خلط 500 مل من RPMI 1640 ، و 10 مل من 50x B-27 الملحق ، و 5 مل من البنسلين الستربتومايسين9.
2. بذر hiPSC-CMs المحفوظة بالتبريد
- قبل يومين من بذر hiPSC-CMs على ركيزة هيدروجيل مرنة ، قم بطلاء hiPSC-CMs مسبقا على ألواح معقمة ذات 6 آبار مغلفة بالجيلاتين بنسبة 0.1٪. قم بإذابة hiPSC-CMs باستخدام بروتوكول ذوبان قياسي 9,25.
- بعد ذلك ، قم بلوحة 1,500,000 إجمالي hiPSC-CMs (جدول المواد) لكل بئر وفقا لتعليمات الشركة المصنعة (الشكل 1A)26.
- استزرع hiPSC-CMs في وسط عضلة القلب القياسي لمدة 2-4 أيام للسماح ل hiPSC-CMs بالتعافي من الحفظ بالتبريد عند 37 درجة مئوية و 5٪ CO2. قم بتحديث الوسط المستهلك بوسط خلايا عضلة القلب بنسبة 100٪ كل 48 ساعة.
3. تفكك وعد hiPSC-CMs المطلية مسبقا
- تحقق من حالة hiPSC-CMs قبل التفكك. تقييم صحة hiPSC-CMs ، وضمان الجدوى والضرب المستقر.
ملاحظة: نقاء السكان hiPSC-CM مهم (على سبيل المثال ، >90٪ تروبونين القلب T)7. يوصى باستخدام طريقة اختيار عضلة القلب (على سبيل المثال ، الانتقاء الأيضي أو الفرز) لتقليل اضطراب ركيزة الهيدروجيل بواسطة الخلايا غير القلبية25,26. - اغسل hiPSC-CMs 2x ب 4 مل لكل بئر من D-PBS بدون CaCl 2 أو MgCl2 (جدول المواد). قم بنضح D-PBS ، وأضف 1 مل من كاشف تفكك درجة حرارة الغرفة إلى كل بئر ، ثم احتضانه لمدة 15 دقيقة عند 37 درجة مئوية.
- أضف 10 مل من وسط عضلة القلب إلى أنبوب مخروطي معقم سعة 15 مل.
- افصل hiPSC-CMs عن اللوحة ذات 6 آبار باستخدام ماصة 1000 ميكرولتر (الشكل 1 ب). أضف معلق الخلية إلى الأنبوب المخروطي سعة 15 مل26.
- اشطف البئر ب 1 مل من وسط عضلة القلب الطازج لجمع أي بقايا hiPSC-CMs ، وأضفها إلى الأنبوب المخروطي سعة 15 مل. اجعل الحجم النهائي للأنبوب المخروطي يساوي 15 mL.
- جهاز طرد مركزي لمدة 5 دقائق (200 × جم). قم بإزالة المادة الطافية حتى علامة 1 مل. إعادة تعليق الخلايا في وسط عضلة القلب إلى الحجم النهائي من 5 مل.
- عد hiPSC-CMs باستخدام عداد خلايا يدوي أو آلي.
- احتضان تعليق hiPSC-CM في درجة حرارة الغرفة أثناء تحضير ركائز الهيدروجيل المرنة (30 دقيقة كحد أقصى).
4. إعداد ركائز هيدروجيل مرنة
- قم بإعداد ماصة سعة 20 ميكرولتر عند 1 ميكرولتر ، وأطراف ماصة 20 ميكرولتر (على سبيل المثال ، 20 ميكرولتر) ، ولوحة سفلية زجاجية معقمة من 48 بئرا. تأكد من أن ساعة الإيقاف / المؤقت جاهزة قبل صنع ركائز الهيدروجيل.
- في غطاء زراعة الأنسجة المعقم ، امزج ركيزة الهيدروجيل القائمة على ECM عن طريق النقر برفق على الأنبوب ، ثم ضعها على الفور مرة أخرى على الجليد.
- بعد ذلك ، ابدأ ساعة الإيقاف / المؤقت مباشرة قبل طلاء ركيزة الهيدروجيل الأولى - هذا هو الوقت صفر.
- ماصة 1 ميكرولتر من ركيزة هيدروجيل لأعلى ولأسفل ~ 3x لتبريد طرف الماصة. ضع ~ 1 ميكرولتر من ركيزة الهيدروجيل غير المخففة أفقيا على قاع كل بئر من لوحة 48 بئرا (الشكل 1C والشكل 2A والشكل 3A) ، مع تثبيت الماصة بزاوية 45 درجة. ضع جميع ركائز الهيدروجيل في نفس الاتجاه في كل بئر (الشكل 2 والشكل 3) للمساعدة في تحديد الركيزة عند إجراء التجارب عند تكبير 40x7،9،17،27.
ملاحظة: كل خط ~ 1 ميكرولتر هو ركيزة هيدروجيل واحدة (الشكل 3). عادة ، يستغرق ~ 5 دقائق لإعداد 48 بئرا. قد يتيح استخدام حامل الصفيحة الدقيقة المائل أفقيا (على سبيل المثال ، 30 درجة) رؤية أفضل لقاع البئر وركيزة الهيدروجيل. تأكد من الذهاب بطول البئر بالكامل (أي من اليسار إلى اليمين). قد تكون ركائز هيدروجيل القصيرة سميكة جدا ، مما يقلل من استقرار الركيزة. لا تدع ركيزة هيدروجيل تجف في طرف الماصة. في حالة حدوث ذلك ، قم بالتبديل بسرعة إلى نصيحة جديدة ، وتابع على الفور. بدلا من ذلك ، يمكن استخدام أطراف الماصة المبردة. قد تتبلمر ركيزة الهيدروجيل القائمة على ECM بسرعة عندما لا تكون على الجليد. يقترح إعداد عدة آبار في وقت واحد (على سبيل المثال ، 10). بالإضافة إلى ذلك ، يوصى بالتدرب على لوحة وهمية مكونة من 48 بئرا. - ضع الغطاء على لوحة 48 بئرا ، واترك ركائز الهيدروجيل تحضن لمدة 8-10 دقائق في درجة حرارة الغرفة في غطاء زراعة الأنسجة المعقمة قبل إضافة الخلايا (الشكل 2 ب).
ملاحظة: من المهم الالتزام بأوقات الحضانة المقترحة. سيؤدي وقت الحضانة لأكثر من 10 دقائق إلى ركائز هيدروجيل صلبة وعدم وجود تقلصات مرئية. قد يؤدي وقت الحضانة الذي يقل عن 8 دقائق إلى انهيار ركائز. - قم على الفور بزرع hiPSC-CMs بالتنقيط مباشرة على ركائز الهيدروجيل ، مع ~ 30000 hiPSC-CMs قابلة للحياة لكل بئر في حجم متوسط منخفض يبلغ ~ 200 ميكرولتر من وسط عضلة القلب ، باستخدام ماصة 1000 ميكرولتر (الشكل 2B والشكل 3B).
ملاحظة: توقف هذه العملية بلمرة ركيزة الهيدروجيل وتضمن وجود hiPSC-CMs على الركيزة7،9،17،27. - ضع الغطاء على الطبق ، واترك hiPSC-CMs تحضن دون عائق لمدة 10-15 دقيقة في درجة حرارة الغرفة (الشكل 2C) في غطاء زراعة الأنسجة المعقمة لتمكين hiPSC-CMs من الالتصاق بركيزة الهيدروجيل.
- أضف بلطف ~ 100 ميكرولتر من وسط عضلة القلب الطازج إلى كل بئر (الحجم النهائي: ~ 300 ميكرولتر لكل بئر). ضع الغطاء على اللوحة ، وانقله إلى حاضنة عند 37 درجة مئوية ، 5٪ CO 2 لمدة2-4 أيام. قم بتحديث الوسط بنسبة 100٪ كل 24 ساعة قبل إجراء تجارب الانكماش.
ملاحظة: فحص بصريا hiPSC-CMs للتشكل الصحيح ؛ مباشرة بعد الطلاء ، يجب أن تظهر hiPSC-CMs مستديرة (الشكل 3B). بحلول اليوم الثاني بعد البذر ، سيتم ملاحظة سيلسيتيوم أحادي الطبقة ثنائي الأبعاد hiPSC-CM (الشكل 3C) (الفيديو التكميلي S1) مع تقلص مرئي قوي (الفيديو التكميلي S2).
5. تسجيل وتحليل الانكماش
- تحضير وسط مقايسة CCM ، وهو محلول Tyrode الذي يحتوي على ما يلي (بالمليمول / لتر): CaCl 2 0.5 ، NaCl 134 ، KCl 5.4 ، MgCl2 1 ، الجلوكوز 10 ، و HEPES 10 ، مع تعديل الرقم الهيدروجيني إلى 7.4 مع NaOH ، والتوازن إلى 37 درجة مئوية في حمام مائي.
ملاحظة: يستخدم الكالسيوم خارج الخلية دون الحد الأقصى (0.5 مللي مول) لتعزيز نافذة فحص CCM. - قم بتشغيل المجهر وغرفة التحكم البيئي لتحقيق التوازن إلى 37 درجة مئوية و 5٪ CO2.
- قم بإزالة وسط عضلة القلب من اللوحة المكونة من 48 بئرا ، وشطف كل بئر برفق مرتين باستخدام 600 ميكرولتر من وسط فحص CCM.
- أضف 300 ميكرولتر من وسط فحص CCM لكل بئر ، وضع لوحة 48 بئرا على المجهر في غرفة التحكم البيئي. أدخل الأقطاب الكهربائية ، وقم بموازنة الخلايا لمدة 5 دقائق.
- استخدم الفحص المجهري المستند إلى الفيديو لتسجيل مقاطع فيديو الانكماش. افتح برنامج تسجيل الفيديو ، واضبط معدل إطارات 100 إطار / ثانية. حدد منطقة الاهتمام (ROI) بالقرب من مركز الطبقة الأحادية hiPSC-CM.
ملاحظة: لا تحدد عائد استثمار بالقرب من حافة الطبقات الأحادية hiPSC-CM لأن هذا قد يكون غير مستقر للتسجيلات المقلصة. - بعد ذلك ، يحفز الحقل الخلايا باستخدام مولد نبض تجاري (جدول المواد) لتسريع الطبقة الأحادية 2D hiPSC-CM كهربائيا. قم بتسريع hiPSC-CMs عند عتبة 1.5x عند 1 هرتز مع معلمات نبضة خط الأساس (على سبيل المثال ، نبضات سرعة الموجة المربعة أحادية الطور مع مدة نبضة تحفيز 2 مللي ثانية ~ 14 فولت / سم) 17.
- سجل خط الأساس ، والسرعة فقط (أي قبل CCM) (الشكل 1D) فيديو الانكماش لمدة لا تقل عن خمس نبضات17,28.
- بعد ذلك ، قم بتحفيز الطبقة الأحادية hiPSC-CM بإشارة كهربائية تجريبية (الشكل 1D). لاتباع هذا البروتوكول ، استخدم معلمات تحفيز CCM القياسية: نبضتان متماثلتان ثنائية الطور لمدة طور 5.14 مللي ثانية (المدة الإجمالية 20.56 مللي ثانية) ، ~ 28 فولت / سم (سعة الطور) ، فاصل زمني بين الطور صفري ، وتأخير 30 مللي ثانية (أي الوقت من نهاية نبضة السرعة إلى بداية نبضة CCM) (الشكل 1D)29,30 ، وسجل فيديو الانكماش الناجم عن CCM لمدة لا تقل عن خمس نبضات.
- قم بإيقاف تشغيل إشارة CCM ، والتحفيز بنبض سرعة خط الأساس ، وتسجيل فيديو انكماش لفترة الاسترداد (أي بعد CCM) لمدة لا تقل عن خمس نبضات.
- استخدم برنامج الانكماش القياسي لتحليل مقاطع فيديو الانكماش تلقائيا وتحديد خصائص الانقباض الرئيسية (على سبيل المثال ، سعة الانكماش ، ومنحدر الانكماش ، ومنحدر الاسترخاء ، والوقت حتى الذروة ، والوقت حتى خط الأساس 90٪ ، ومدة الانكماش 50٪) 7،17،31،32.
- استخدم 2D hiPSC-CMs على ركيزة هيدروجيل مرنة للتجارب المقلصة من الأيام 2-14 بعد الطلاء على الركيزة.
النتائج
الموصوف في هذا البروتوكول هو أداة بسيطة وقوية لتوليد أحادي الطبقات 2D hiPSC-CM التعاقد بشكل واضح على ركيزة هيدروجيل مرنة. يتم قياس خصائص الانقباض باستخدام التسجيل القائم على الفيديو إلى جانب برنامج تحليل الانقباض. يتيح ذلك تحديد المعلمات الرئيسية لانقباض خلايا عضلة القلب ، بما في ذلك سعة الانكماش ، ومنحدر الانكماش ، ومنحدر الاسترخاء ، والوقت حتى الذروة ، والوقت حتى خط الأساس 90٪ ، ومدة الانكماش 50٪. يستخدم النموذج لتوصيف الخصائص الأساسية للانقباض ل hiPSC-CMs (الشكل 4) من مختلف الجهات المانحة "الصحية" ويمكن توسيعه ليشمل تقييم إشارات الأجهزة الطبية الفيزيولوجيا الكهربية للقلب (أي CCM). أدى تطبيق معلمات تحفيز CCM القياسية (الشكل 1D)29,30 إلى تحسين خصائص الانقباض في المختبر (الشكل 5 والجدول 1)17.
لقد أثبتنا كذلك أنه يمكن استخدام هذه الطريقة لتقييم آثار تعديل تركيزات الكالسيوم خارج الخلية على خصائص انقباض الإنسان مع وبدون تحفيز CCM (الشكل 6)17. لوحظ اعتماد خط الأساس المتوقع للكالسيوم للانكماش 7,17 ، بالإضافة إلى زيادة مستحثة ب CCM في حساسية الكالسيوم على مستوى الطبقة الأحادية للخلايا العضلية القلبية. بالإضافة إلى ذلك ، كشف الاستجواب الدوائي لمسار الإشارات الأدرينالية β (الشكل 7) أن تأثيرات التقلص العضلي التي يسببها CCM كانت جزئيا بوساطة الإشارات الأدريناليةβ 17. علاوة على ذلك ، يمكن توسيع هذه الأداة لتشمل خلايا عضلة القلب الخاصة بالمريض ، بما في ذلك اعتلال عضلة القلب التوسعي (DCM)33،34،35 (الشكل 8) ، لفهم تأثير CCM في سياق حالات المرض ؛ في الواقع ، لوحظت سعة انقباض معززة وحركية انكماش وانحلال متسارعة عند "جرعة" CCM التي تم اختبارها هنا (الشكل 8). على الرغم من أن لدينا جهاز محاكاة CCM في مختبرنا ، فإن المنهجية المستخدمة هنا ليست خاصة بهذا النظام ويمكن تطبيقها على أجهزة الفيزيولوجيا الكهربية القلبية الأخرى.
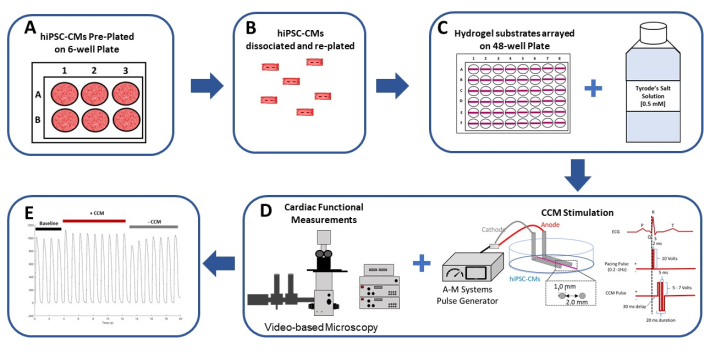
الشكل 1: ملخص تخطيطي لنموذج 2D hiPSC-CM في المختبر CCM. (أ) يتم طلاء hiPSC-CMs مسبقا بتنسيق أحادي الطبقة على ألواح 6 آبار مطلية بالجيلاتين (0.1٪). (ب) بعد 2 أيام في الثقافة ، يتم فصل hiPSC-CMs وإعدادها للطلاء على ركيزة هيدروجيل مرنة. (C) يتم طلاء hiPSC-CMs المعزولة بكثافة عالية على ركائز هيدروجيل مصفوفة بتنسيق 48 بئرا (يسار) ويتم فحصها في محلول Tyrode للكالسيوم خارج الخلية (0.5 mM) (يمين). (د) يتم استخدام مولد نبض تجاري ومعلمات نبضات CCM السريريةالقياسية 29,30 (يمين) لتحفيز hiPSC-CMs ؛ يتم تقييم وظيفة القلب عن طريق التحليل القائم على الفيديو (يسار). (ه) تسجيلات الانكماش التمثيلي قبل CCM (خط الأساس: 5 فولت) ، أثناء CCM (CCM: 10 V) ، وبعد CCM (الاسترداد: 5 V). أعيد طبع هذا الرقم من Feaster et al.17. الاختصارات: hiPSC-CM = الخلايا العضلية القلبية المشتقة من الخلايا الجذعية البشرية المستحثة ؛ CCM = تعديل انقباض القلب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
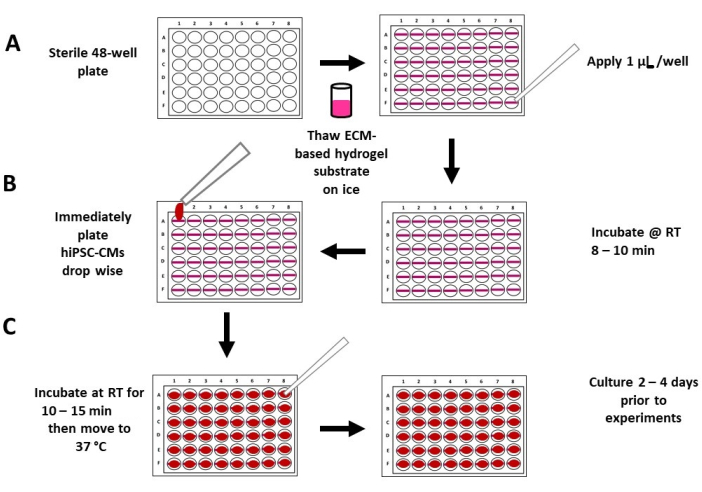
الشكل 2: رسم تخطيطي لطلاء الركيزة الهيدروجيل المرنة والبذر. (أ) يتم تطبيق ركيزة هيدروجيل مذابة تماما وغير مخففة تعتمد على ECM على صفيحة معقمة من 48 بئرا (اللوحة اليسرى) ، مع 1 ميكرولتر من ركيزة هيدروجيل لكل بئر (اللوحة اليمنى). (ب) يسمح لركيزة الهيدروجيل بالاحتضان في درجة حرارة الغرفة لمدة 8-10 دقائق (اللوحة اليمنى) ، متبوعة بطلاء hiPSC-CMs عالية الكثافة في حجم متوسط منخفض (~ 200 ميكرولتر) (اللوحة اليسرى). (ج) بعد 10-15 دقيقة من الحضانة ، يضاف الوسط إلى كل بئر (اللوحة اليسرى) ، ويتم نقل الألواح إلى حاضنة زراعة الأنسجة القياسية (اللوحة اليمنى). الاختصارات: ECM = مصفوفة خارج الخلية ، hiPSC-CM = خلية عضلية قلبية مشتقة من الخلايا الجذعية البشرية متعددة القدرات ؛ RT = درجة حرارة الغرفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
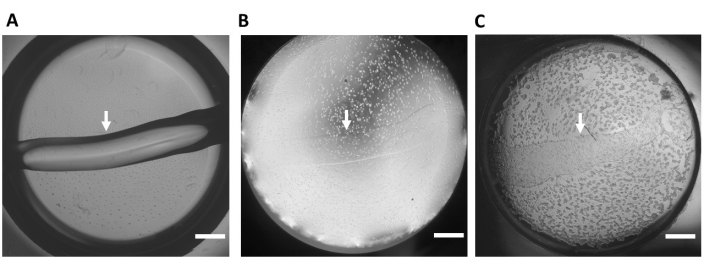
الشكل 3: ركيزة هيدروجيل خارج الخلية . (أ) ركيزة هيدروجيل تمثيلية (بدون خلايا) في بئر واحدة من صفيحة سفلية زجاجية مكونة من 48 بئرا مباشرة بعد وضع الركيزة على البئر. (ب) الوقت 0 بعد بذر hiPSC-CMs. (ج) الوقت 24 ساعة بعد بذر hiPSC-CMs. أعيد طبع هذه اللوحة من Feaster et al.17. تشير الأسهم البيضاء إلى حافة ركيزة هيدروجيل ، تكبير 4x. شريط المقياس = 1 مم. اختصار: hiPSC-CM = خلية عضلية قلبية مشتقة من الخلايا الجذعية البشرية متعددة القدرات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
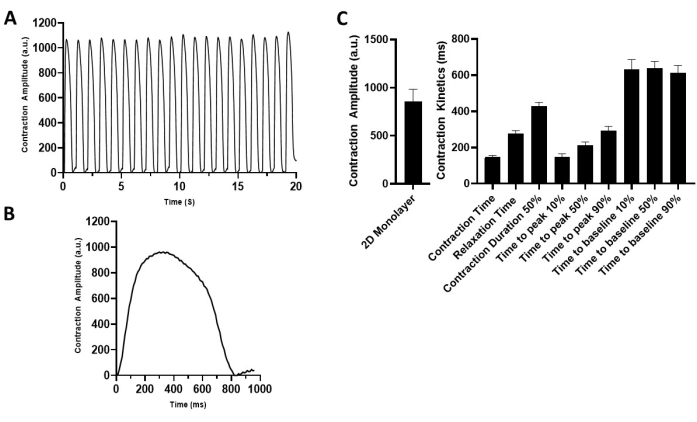
الشكل 4: توصيف خصائص انقباض 2D hiPSC-CM أحادية الطبقة. (أ) تسجيل انكماش تمثيلي ل 2D hiPSC-CMs بوتيرة 1 هرتز (5 فولت). (ب) آثار انكماش تمثيلية تصور دورة انكماش واحدة. (ج) التمثيل البياني الشريطي الموجز. البيانات تعني ± SEM. n = 18. اختصار: hiPSC-CM = خلية عضلية قلبية مشتقة من الخلايا الجذعية البشرية متعددة القدرات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
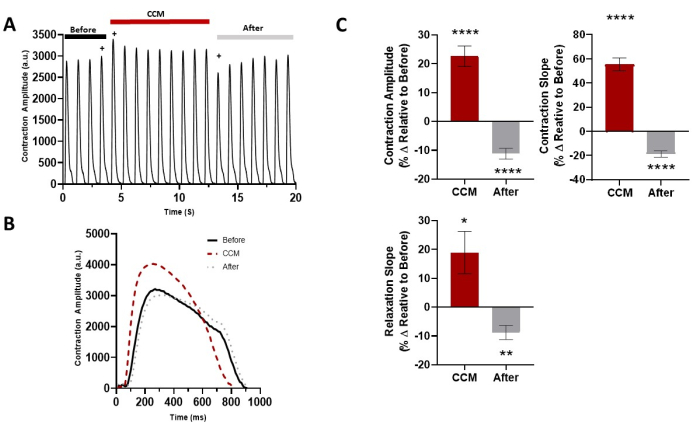
الشكل 5: التأثير الحاد ل CCM على خصائص انقباض 2D hiPSC-CM. (أ) تسجيل الانكماش التمثيلي قبل CCM (5 فولت) ، أثناء CCM (10 فولت) ، وبعد CCM (5 فولت). (ب) آثار الانكماش التمثيلية للتأثيرات المباشرة (أي آخر نبضة قبل CCM ، وأول نبضة CCM ، وأول نبضة بعد CCM ، يشار إليها ب +). (ج) الرسوم البيانية الشريطية الموجزة للتأثيرات الفورية. النسبة المئوية للتغيير ، البيانات تعني ± SEM. n = 23. * p < 0.05 ، ** p < 0.01 ، ***p < 0.001 ، ****p < 0.0001. أعيد طبع هذا الرقم من Feaster et al.17. الاختصارات: hiPSC-CM = الخلايا العضلية القلبية المشتقة من الخلايا الجذعية البشرية المستحثة ؛ CCM = تعديل انقباض القلب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
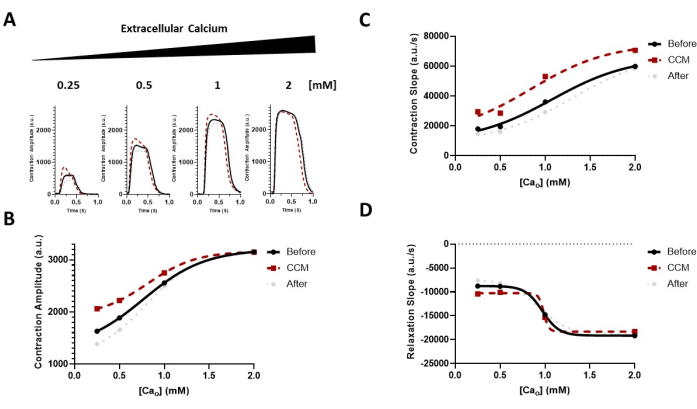
الشكل 6: تأثير تعديل الكالسيوم خارج الخلية على استجابة CCM. (أ) آثار انكماش تمثيلية للتأثيرات المباشرة لكل مجموعة قبل CCM (5 V) ، أثناء CCM (10 V) ، وبعد CCM (5 V) ؛ تعرضت hiPSC-CMs لتركيزات متزايدة من الكالسيوم خارج الخلية (Cao) من 0.25-2 mM. (ب-د) البيانات المحولة (السيني) لتوجيه العين مما يدل على تأثير CCM على حساسية الكالسيوم لخصائص الانقباض (أي السعة والحركية) (منحدر التل = 1.0). ن = 6-8 لكل مجموعة. أعيد طبع هذا الرقم من Feaster et al.17. الاختصارات: hiPSC-CM = الخلايا العضلية القلبية المشتقة من الخلايا الجذعية البشرية المستحثة ؛ CCM = تعديل انقباض القلب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
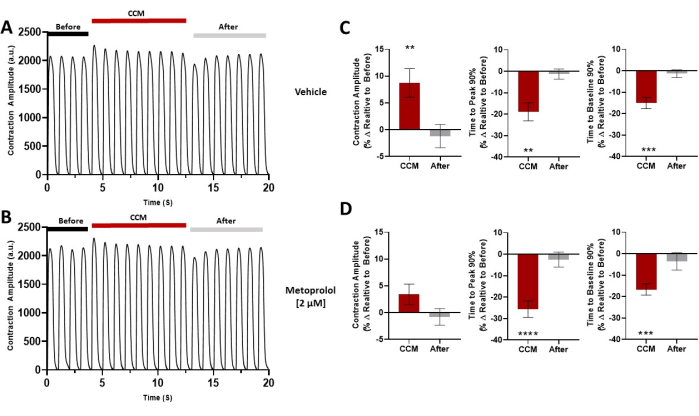
الشكل 7: التحدي الدوائي. آثار الانكماش التمثيلية لكل مجموعة قبل CCM (5 V) ، أثناء CCM (10 V) ، وبعد CCM (5V) ؛ تمت معالجة hiPSC-CMs مسبقا بمركبة (A) أو (B) ميتوبرولول (2 ميكرومتر). (ج، د) الرسوم البيانية الشريطية الموجزة لكل شرط. النسبة المئوية للتغيير ، البيانات تعني ± SEM. n = 10 لكل مجموعة. * p < 0.05 ، ** p < 0.01 ، ***p < 0.001 ، ****p < 0.0001. أعيد طبع هذا الرقم من Feaster et al.17. الاختصارات: hiPSC-CM = الخلايا العضلية القلبية المشتقة من الخلايا الجذعية البشرية المستحثة ؛ CCM = تعديل انقباض القلب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
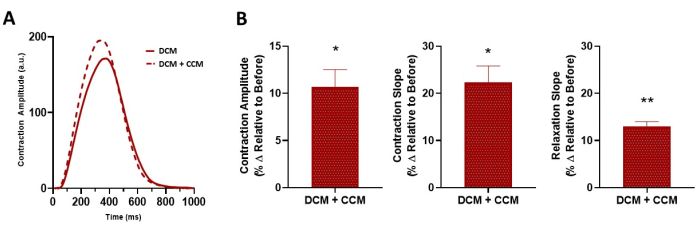
الشكل 8: التأثير الحاد ل CCM على الخواص المقلصة ل 2D hiPSC-CMs المريضة. (أ) تتبع الانكماش التمثيلي ل DCM L35P ، خط أساس التحكم (قبل ، 6 فولت) ، و DCM L35P بالإضافة إلى CCM (10 فولت). (ب) التمثيل البياني الشريطي الموجز. النسبة المئوية للتغيير ، البيانات تعني ± SEM. n = 3. * p < 0.05 ، ** p < 0.01. الاختصارات: hiPSC-CM = الخلايا العضلية القلبية المشتقة من الخلايا الجذعية البشرية المستحثة ؛ CCM = تعديل انقباض القلب. DCM = اعتلال عضلة القلب التوسعي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الفيديو التكميلي S1: الفاصل الزمني ل hiPSC-CMs على هيدروجيل قائم على المصفوفة خارج الخلية. hiPSC-CMs ثنائية الأبعاد مطلية على ركيزة هيدروجيل مرنة ؛ الوقت: 0-90 ساعة ؛ بئر واحد من صفيحة سفلية زجاجية مكونة من 48 بئرا ؛ تكبير 4x. تشكل hiPSC-CMs خلية سينكتيوم أحادية الطبقة أفقية (أي من اليسار إلى اليمين). شريط المقياس = 1 مم. الرجاء النقر هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S2: hiPSC-CMs على هيدروجيل قائم على المصفوفة خارج الخلية. hiPSC-CMs ثنائية الأبعاد مطلية على ركيزة هيدروجيل مرنة ؛ الوقت: ~ 24 ساعة ؛ بئر واحد من صفيحة سفلية زجاجية مكونة من 48 بئرا ؛ تكبير 4x. تشكل hiPSC-CMs مورفولوجيا أحادية الطبقة وتظهر انكماشا قويا عند ~ 24 ساعة بعد الطلاء. شريط المقياس = 1 مم. هذا الفيديو من Feaster et al.17. الرجاء الضغط هنا لتنزيل هذا الفيديو.
| البارامتر | سي سي إم | بعد |
| السعه | 16 ± 4٪** | 4 ± 5٪ |
| الوقت حتى الذروة 50٪ | -20 ± 9٪* | 7 ± 5٪ |
| الوقت حتى الذروة 90٪ | -22 ± 8٪* | 6 ± 5٪ |
| الوقت حتى خط الأساس 50٪ | -8 ± 5٪ | 4 ± 4٪ |
| الوقت حتى خط الأساس 90٪ | -12 ± 6٪* | 5 ± 5٪ |
| مدة الانكماش 10٪ | -13 ± 6٪ | 3 ± 5٪ |
| مدة الانكماش 50٪ | -6 ± 5 ٪ | 3 ± 5٪ |
| مدة الانكماش 90٪ | 0 ± 5٪ | 3 ± 4٪ |
| N | 23 | 23 |
الجدول 1: خواص انقباض. النسبة المئوية للتغير بالنسبة إلى ما قبل CCM (5 فولت) ؛ البيانات هي متوسط ± SEM لجميع النبضات في كل مجموعة خلال CCM (10 V) وبعد CCM (5 V). ن = 23. * p < 0.05 ، ** p < 0.01 ، ***p < 0.001 ، ****p < 0.0001. أعيد طبع هذا الجدول من Feaster et al.17.
Discussion
يصف البروتوكول الموضح هنا طريقة لتوليد أحاديات الطبقات 2D hiPSC-CM التعاقدية بقوة على ركيزة هيدروجيل مرنة خارج الخلية (ECM) مع الكواشف التجارية 7,17. تظل hiPSC-CMs المصنفة على ركيزة الهيدروجيل المرنة قابلة للحياة ولها خصائص انقباض محسنة7. تعتمد هذه التقنية على معدات وقدرات المختبرات القياسية7. هناك العديد من الخطوات الحاسمة في البروتوكول ، بما في ذلك ما يتعلق بالعمل مع ركيزة هيدروجيل القائمة على ECM ، والتي تتطلب اهتماما دقيقا بالتفاصيل. إحدى المشكلات المحتملة هي وجود المصل في الوسط. قد يؤدي ذلك إلى تشكيل شبكات hiPSC-CMs (على سبيل المثال ، الشبكات البطانية / الوعائية) بدلا من ورقة أحادية الطبقة متقاربة. وبالتالي ، يوصى باستخدام وسط خال من المصل أثناء إنشاء أحادي الطبقة المرنة من هيدروجيل hiPSC-CM (أي من اليوم 0 إلى اليوم 4). وبالمثل ، قد يؤدي تحضير عدد كبير جدا من ركائز الهيدروجيل في وقت واحد إلى ركائز رديئة أو غير متساوية بسبب إجهاد المشغل. في حين أنه من المهم العمل بسرعة ، فإن سلامة كل ركيزة هيدروجيل أمر بالغ الأهمية. وبالمثل ، ينبغي للمرء أن يزرع بعناية hiPSC-CMs وتغيير الوسيط. لا ينبغي القيام بذلك بالقوة. عند تغيير الوسط ، يجب إضافته برفق من الحافة العلوية للبئر حتى لا يعطل ركيزة الهيدروجيل أو الخلايا. كما هو الحال مع مزارع 2D hiPSC-CM القياسية (أي البلاستيك أو الزجاج التقليدي لزراعة الأنسجة) ، فإن الطلاء بكثافة منخفضة سيؤدي إلى تكوين أحادي الطبقة غير مكتمل. من المهم فحص hiPSC-CMs بصريا للتأكد من أنها على ركيزة هيدروجيل واستخدام مؤقت لضمان التوقيت الدقيق. علاوة على ذلك ، قد يؤدي استزراع الطبقة الأحادية 2D hiPSC-CM لأكثر من 14 يوما على ركيزة الهيدروجيل إلى تعطيل أحادي الطبقة ، بناء على خصائص ECM وتعليمات الشركة المصنعة للركيزة.
هناك العديد من القيود على الطريقة الحالية التي يجب مراعاتها. أولا ، كانت الخلايا المستخدمة في هذا البروتوكول من مزود hiPSC-CMs تجاري ، وتشكل هذه الخلايا خلية اصطناعية من الخلايا المقترنة كهربائيا. يحتوي المخلوي على مزيج من hiPSC-CMs من جميع الأنواع الفرعية القلبية الثلاثة (أي البطين والأذيني والعقدي)17. قد تستفيد الدراسات من مجموعة hiPSC-CM الحصرية من النوع الفرعي (أي 100٪ بطين أو 100٪ أذين). ثانيا ، تستخدم هذه الطريقة فقط hiPSC-CMs ، في حين أن الخلايا غير العضلية ، بما في ذلك الخلايا الليفية القلبية والخلايا البطانية والخلايا العصبية ، قد تعزز وظائف hiPSC-CM22,36. ثالثا ، تعرض 2D hiPSC-CMs العديد من ميزات خلايا عضلة القلب غير الناضجة نسبيا ، بما في ذلك الضرب التلقائي ، والتشكل غير المتبلور ، وعدم وجود استجابة مؤثرة في التقلص العضلي 8,37. رابعا ، في حين أن هذا البروتوكول ينتج أحادي الطبقة 2D hiPSC-CM المتقلص بقوة ، فمن المحتمل أن نماذج 3D hiPSC-CM المحسنة وظيفيا مثل أنسجة القلب المهندسة (ECTs) ستؤدي إلى استجابة انقباضية محسنة مستحثة ب CCM تحت تركيزات الكالسيوم الفسيولوجية 8,38. أخيرا ، تم تصميم البروتوكول الموضح هنا لتنسيق 48 بئرا. ومع ذلك ، مع التحسين وإدراج الأتمتة ، يمكن تحجيم هذا إلى تنسيق عالي الإنتاجية (على سبيل المثال ، لوحات 96 بئرا أو 384 بئرا).
المعيار الذهبي الحالي لدراسات hiPSC-CM هو ظروف ثقافة 2D جامدة تقليدية (أي ، بلاستيك أو زجاج زراعة الأنسجة). في حين أن المنهجية التقليدية مفيدة لدراسات الفيزيولوجيا الكهربية3 ومعالجة الكالسيوم39 ، إلا أن المنهجية التقليدية تؤدي إلى الحد الأدنى من خصائص الانقباض5،6،7. ونتيجة لذلك ، فإن ظروف الثقافة 2D الصلبة التقليدية غير قابلة لتقييم تأثيرات انقباض CCM8. تعد طرق 3D hiPSC-CM ECT المحسنة وظيفيا38 صعبة تقنيا وتستغرق وقتا طويلا وتتطلب معدات متطورة غير متوفرة بسهولة في كل مختبر. في هذا البروتوكول ، نصف منهجية بسيطة لتوليد أحاديات 2D hiPSC-CM التعاقدية بقوة في إطار زمني أقصر من طرق 3D ECT أو طرق 2D التقليدية طويلة الأجل7،40،41. علاوة على ذلك ، فإن الكواشف المستخدمة هنا متاحة تجاريا ، بما في ذلك ركيزة الهيدروجيل و hiPSC-CMs ، وكلاهما يتمتع بتناسق كبير من الكثير إلى الكثير. بينما استخدمنا أقطاب الأسلاك البلاتينية القابلة للإزالة (المسافة بين الأقطاب الكهربائية: 2.0 مم ، العرض: 1.0 مم) ، فإن مواد وتكوينات الأقطاب الكهربائية المختلفة قابلة للتقييم المقلص CCM في المختبر8،15،17،18،22. وبالمثل ، هناك العديد من البرامج الآلية المتاحة التي تمكن من تحليل مقاطع فيديو الانكماش7،31،32.
تعتمد غالبية الطرق غير السريرية لتقييم انقباض الأجهزة الطبية القلبية إلى حد كبير على النماذج الحيوانية المكلفة في الجسم الحي (مثل الكلاب أو الخنازير) وشرائط العضلات الحليمية الصعبة تقنيا (مثل الأرانب)18. وصفت هذه الورقة نموذجا بشريا في المختبر لتقييم آثار إشارات الجهاز الطبي الفيزيولوجيا الكهربية للقلب على الانقباض. يمكن أن تقلل هذه الأداة من الاعتماد على الدراسات على الحيوانات وتكون مفيدة للتقييم في المختبر للخصائص المقلصة لأجهزة الفيزيولوجيا الكهربية للقلب.
Disclosures
تعكس هذه المقالة آراء المؤلفين ولا ينبغي تفسيرها على أنها تمثل آراء أو سياسات إدارة الغذاء والدواء الأمريكية. لا ينبغي تفسير ذكر المنتجات التجارية أو مصادرها أو استخدامها فيما يتعلق بالمواد المذكورة هنا على أنه تأييد فعلي أو ضمني لهذه المنتجات من قبل وزارة الصحة والخدمات الإنسانية. يعلن المؤلفون عدم وجود مصالح متنافسة لهذا العمل.
Acknowledgements
تم دعم هذا العمل جزئيا من خلال تعيين في برنامج المشاركة البحثية في مركز الأجهزة والصحة الإشعاعية الذي يديره معهد أوك ريدج للعلوم والتعليم من خلال اتفاقية مشتركة بين الوكالات بين وزارة الطاقة الأمريكية وإدارة الغذاء والدواء الأمريكية. يشكر المؤلفون ريتشارد جراي وترينت روبرتسون وآنا أفيلا على اقتراحاتهم ومساعدتهم الفنية. تم تمويل الدراسة من خلال إدارة الغذاء والدواء الأمريكية ، مكتب مختبرات العلوم والهندسة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.1% Gelatin | STEMCELL Technologies | 7903 | Pre-plating Culture Substrate |
| 48-well Plate | MatTek | P48G-1.5-6-F | Hydrogel Substrate hiPSC-CM Culture, Glass |
| 6-well Plate | Thermofisher | 140675 | hiPSC-CM Culture, Plastic |
| B-27 Supplement, with insulin | Invitrogen | 17504-044 | Cardiomyocyte Media |
| Calcium Chloride dihydrate (CaCl2) | Fisher Scientific | c70-500 | Tyrode’s solution |
| CellOPTIQ Platform and Software | Clyde Biosciences | Contraction Recording and Analysis | |
| Conical tube 15 mL | Corning | 352099 | hiPSC-CM Dissociation |
| Digital CMOS Camera | Hamamatsu | C11440-42U30 | Contraction Video Recording |
| D-PBS | Life Technologies | 14190-144 | Cell Wash |
| Environmental Control Chamber | OKOLAB INC | H201-K-FRAME | Environmental Regulation |
| Glucose | Sigma-Aldrich | G8270-1kg | Tyrode’s solution |
| Hemocytometer | Fisher Scientific | 22-600-107 | hiPSC-CM Counting |
| HEPES | Sigma-Aldrich | H3375 | Tyrode’s solution |
| iCell Cardiomyocytes Plating Medium | Fujifilm Cellular Dynamic, Inc. | M1001 | hiPSC-CM Plating Media |
| iCell Cardiomyocytes2, 01434 | Fujifilm Cellular Dynamic, Inc. | R1017 | hiPSC-CMs |
| Incubator (37 °C, 5% CO2) | Thermofisher | 50116047 | Maintain hiPSC-CMs |
| Inverted Microscope | Olympus | IX73 | Imaging hiPSC-CMs |
| Magnesium Chloride hexahydrate (MgCl2) | Fisher Scientific | m33-500 | Tyrode’s solution |
| Matrigel Growth Factor Reduced Basement Membrane Matrix | Corning | 356230 | Flexible Hydrogel Substrate |
| Microcentrifuge tubes 1.5 ml | Fisher Scientific | 05-408-129 | Hydrogel Substrate Aliquot |
| Model 4100 Isolated High Power Stimulator | AM-Systems | Model 4100 | Pulse Generator |
| MyCell Cardiomyocytes DCM LMNA L35P, 01016 | Fujifilm Cellular Dynamic, Inc. | R1153 | DCM hiPSC-CMs |
| Pen-Strep | Invitrogen | 15140-122 | Cardiomyocyte Media |
| Pipette L-20 | Rainin | 17014392 | Plating Hydrogel Substrate |
| Pipette P1000 | Fisher Scientific | F123602G | |
| Pipette tips, 1000 ul | Fisher Scientific | 02-707-509 | |
| Pipette tips, 20 ul | Rainin | GPS-L10S | Making Hydrogel Substrate |
| Potassium Chloride (KCl) | Fisher Scientific | P330-500 | Tyrode’s solution |
| RPMI 1640, with glucose | Invitrogen | 11875 | Cardiomyocyte Media |
| Sodium Chloride (NaCl) | Fisher Scientific | s641-212 | Tyrode’s solution |
| Sodium Hydroxide (NaOH) | Sigma-Aldrich | 221465 | Tyrode’s solution |
| Stimulation Electrodes | Pacing and CCM Stimulation | ||
| Stopwatch/Timer | Fisher Scientific | 02-261-840 | Plating Hydrogel Substrate |
| Trypan Blue Stain | Life Technologies | T10282 | hiPSC-CM Counting |
| TrypLE Express | Life Technologies | 12605-010 | hiPSC-CM Dissociation |
References
- Jackson, S. L., et al. National burden of heart failure events in the United States, 2006 to 2014. Circulation: Heart Failure. 11 (12), 004873 (2018).
- Cook, C., Cole, G., Asaria, P., Jabbour, R., Francis, D. P. The annual global economic burden of heart failure. International Journal of Cardiology. 171 (3), 368-376 (2014).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Yang, X., Ribeiro, A. J. S., Pang, L., Strauss, D. G. Use of human iPSC-CMs in nonclinical regulatory studies for cardiac safety assessment. Toxicology Sciences. 190 (2), 117-126 (2022).
- Zuppinger, C. 3D cardiac cell culture: A critical review of current technologies and applications. Frontiers in Cardiovascular Medicine. 6, 87 (2019).
- Huethorst, E., et al. Conventional rigid 2D substrates cause complex contractile signals in monolayers of human induced pluripotent stem cell-derived cardiomyocytes. The Journal of Physiology. 600 (3), 483-507 (2022).
- Feaster, T. K., et al. Matrigel mattress: A method for the generation of single contracting human-induced pluripotent stem cell-derived cardiomyocytes. Circulation Research. 117 (12), 995-1000 (2015).
- Feaster, T. K., et al. Acute effects of cardiac contractility modulation stimulation in conventional 2D and 3D human induced pluripotent stem cell-derived cardiomyocyte models. Frontiers in Physiology. 13, 1023563 (2022).
- Feaster, T. K. . Implementation of human-induced pluripotent stem cell-derived cardiomyocyte to model excitation-contraction coupling in health and disease. , (2015).
- Cadar, A. G., et al. Real-time visualization of titin dynamics reveals extensive reversible photobleaching in human induced pluripotent stem cell-derived cardiomyocytes. American Journal of Physiology-Cell Physiology. 318 (1), 163-173 (2020).
- Parikh, S. S., et al. Thyroid and glucocorticoid hormones promote functional T-tubule development in human-induced pluripotent stem cell-derived cardiomyocytes. Circulation Research. 121 (12), 1323-1330 (2017).
- Wang, L., et al. Hypertrophic cardiomyopathy-linked mutation in troponin T causes myofibrillar disarray and pro-arrhythmic action potential changes in human iPSC cardiomyocytes. Journal of Molecular and Cellular Cardiology. 114, 320-327 (2018).
- Campbell, C. M., Kahwash, R., Abraham, W. T. Optimizer Smart in the treatment of moderate-to-severe chronic heart failure. Future Cardiology. 16 (1), 13-25 (2020).
- PMA P180036. FDA Summary of Safety and Effectiveness Data. Food and Drug Administration Available from: https://www.accessdata.fda.gov/cdrh_docs/pdf18/P180036B.pdf (2019)
- Blinova, K., et al. Acute effects of nonexcitatory electrical stimulation during systole in isolated cardiac myocytes and perfused heart. Physiological Reports. 2 (8), 12106 (2014).
- Sabbah, H. N., et al. Cardiac contractility modulation with the impulse dynamics signal: Studies in dogs with chronic heart failure. Heart Failure Reviews. 6 (1), 45-53 (2001).
- Feaster, T. K., Casciola, M., Narkar, A., Blinova, K. Acute effects of cardiac contractility modulation on human induced pluripotent stem cell-derived cardiomyocytes. Physiological Reports. 9 (21), 15085 (2021).
- Brunckhorst, C. B., Shemer, I., Mika, Y., Ben-Haim, S. A., Burkhoff, D. Cardiac contractility modulation by non-excitatory currents: Studies in isolated cardiac muscle. European Journal of Heart Failure. 8 (1), 7-15 (2006).
- Mohri, S., et al. Cardiac contractility modulation by electric currents applied during the refractory period. American Journal of Physiology-Heart and Circulatory Physiology. 282 (5), 1642-1647 (2002).
- Mohri, S., et al. Electric currents applied during refractory period enhance contractility and systolic calcium in the ferret heart. American Journal of Physiology-Heart and Circulatory Physiology. 284 (4), 1119-1123 (2003).
- Burkhoff, D., et al. Electric currents applied during the refractory period can modulate cardiac contractility in vitro and in vivo. Heart Failure Reviews. 6 (1), 27-34 (2001).
- Narkar, A., Feaster, T. K., Casciola, M., Blinova, K. Human in vitro neurocardiac coculture (ivNCC) assay development for evaluating cardiac contractility modulation. Physiological Reports. 10 (21), 15498 (2022).
- Harris, K., et al. Comparison of electrophysiological data from human-induced pluripotent stem cell-derived cardiomyocytes to functional preclinical safety assays. Toxicological Sciences. 134 (2), 412-426 (2013).
- Blinova, K., et al. Comprehensive translational assessment of human-induced pluripotent stem cell derived cardiomyocytes for evaluating drug-induced arrhythmias. Toxicological Sciences. 155 (1), 234-247 (2017).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), 2006-2017 (2011).
- Burridge, P. W., Holmstrom, A., Wu, J. C. Chemically defined culture and cardiomyocyte differentiation of human pluripotent stem cells. Current Protocols in Human Genetics. 87, 1-15 (2015).
- Cadar, A. G., Feaster, T. K., Durbin, M. D., Hong, C. C. Production of single contracting human induced pluripotent stem cell-derived cardiomyocytes: Matrigel mattress technique. Current Protocols in Stem Cell Biology. 42, 1-7 (2017).
- Narkar, A., Willard, J. M., Blinova, K. Chronic cardiotoxicity assays using human induced pluripotent stem cell-derived cardiomyocytes (hiPSC-CMs). International Journal of Molecular Sciences. 23 (6), 3199 (2022).
- OPTIMIZER® Smart Implantable Pulse Generator INSTRUCTIONS FOR USE. ImpulseDynamics Available from: https://impulse-dynamics.com/wp-content/uploads/2020/05/13-290-008-01-US-Rev-01-OPT-Smart-IPG-IFU.pdf (2018)
- OPTIMIZER™ Smart Mini Implantable Pulse Generator INSTRUCTIONS FOR USE. ImpulseDynamics Available from: https://impulse-dynamics.com/wp-content/uploads/2021/02/13-290-011-EU-Rev-00-OPTIMIZER-Smart-Mini-IPG-IFU-EU.pdf (2019)
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), 5-16 (2018).
- Grune, T., Ott, C., Haseli, S., Hohn, A., Jung, T. The "MYOCYTER" - Convert cellular and cardiac contractions into numbers with ImageJ. Scientific Reports. 9, 15112 (2019).
- Masarone, D., et al. Use of cardiac contractility modulation as bridge to transplant in an obese patient with advanced heart failure: A case report. Frontiers in Cardiovascular Medicine. 9, 833143 (2022).
- Nadeem, M., Tariq, E. F., Aslam, H. M., Illahi, Y., Shah, R. All-cause mortality outcomes of usage of cardiac contractility modulation in patients with dilated cardiomyopathy ineligible for cardiac re-synchronization therapy: An updated meta-analysis of randomized controlled trials. Cureus. 12 (9), 10627 (2020).
- Manganelli, G., et al. Use of cardiac contractility modulation in an older patient with non-ischemic dilated cardiomyopathy: A case report. Clinics and Practice. 11 (4), 835-840 (2021).
- Mannhardt, I., et al. Automated contraction analysis of human engineered heart tissue for cardiac drug safety screening. Journal of Visualized Experiments. (122), e55461 (2017).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756 (2020).
- Feric, N. T., et al. Engineered cardiac tissues generated in the Biowire™ II: A platform for human-based drug discovery. Toxicology Sciences. 172 (1), 89-97 (2019).
- Hwang, H. S., et al. Human induced pluripotent stem cell (hiPSC) derived cardiomyocytes to understand and test cardiac calcium handling: A glass half full. Journal of Molecular and Cellular Cardiology. 89, 379-380 (2015).
- Lundy, S. D., Zhu, W. Z., Regnier, M., Laflamme, M. A. Structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Stem Cells and Development. 22 (14), 1991-2002 (2013).
- Stoehr, A., et al. Automated analysis of contractile force and Ca2+ transients in engineered heart tissue. American Journal of Physiology-Heart and Circulatory Physiology. 306 (9), 1353-1363 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved