Method Article
Evaluierung der kardialen Kontraktilitätsmodulationstherapie in 2D-Kardiomyozyten aus humanen Stammzellen
In diesem Artikel
Zusammenfassung
Hier demonstrieren wir eine nicht-invasive Methode zur Bewertung der Kontraktilität von Herzmedizinprodukten unter Verwendung von 2D-Monoschichten aus humanen pluripotenten Stammzellen (hiPSC-CM), die auf einem flexiblen Substrat plattiert und mit videobasierter Mikroskopie gekoppelt sind. Dieses Tool wird für die In-vitro-Bewertung der kontraktilen Eigenschaften von kardialen Elektrophysiologiegeräten nützlich sein.
Zusammenfassung
Humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten (hiPSC-CMs) werden derzeit für mehrere In-vitro-Anwendungen erforscht und wurden in Zulassungsanträgen verwendet. Hier erweitern wir ihren Einsatz auf die Sicherheits- oder Leistungsbewertung von Herzmedizinprodukten. Wir haben eine neuartige Methode entwickelt, um die kontraktilen Eigenschaften von Herzmedizinprodukten in robust kontrahierenden 2D-hiPSC-CMs-Monoschichten zu bewerten, die auf einem flexiblen Hydrogelsubstrat auf Basis der extrazellulären Matrix (ECM) plattiert sind. Dieses Tool ermöglicht die Quantifizierung der Auswirkungen von Signalen kardialer elektrophysiologischer Geräte auf die menschliche Herzfunktion (z. B. kontraktile Eigenschaften) mit Standard-Laborgeräten. Die 2D-hiPSC-CM-Monoschichten wurden 2-4 Tage lang auf einem flexiblen Hydrogelsubstrat im 48-Well-Format kultiviert.
Die hiPSC-CMs wurden mit elektrischen Standardsignalen der kardialen Kontraktilitätsmodulation (CCM) von Medizinprodukten exponiert und mit Kontroll-hiPSC-CMs (d. h. nur Stimulation) verglichen. Die kontraktilen Eigenschaften der 2D-hiPSC-CMs wurden durch videobasierte Detektionsanalyse auf der Grundlage der Pixelverschiebung quantifiziert. Die CCM-stimulierten 2D-hiPSC-CMs, die auf dem flexiblen Hydrogelsubstrat plattiert waren, zeigten signifikant verbesserte kontraktile Eigenschaften im Vergleich zum Ausgangswert (d.h. vor der CCM-Stimulation), einschließlich einer erhöhten maximalen Kontraktionsamplitude und einer beschleunigten Kontraktions- und Relaxationskinetik. Darüber hinaus ermöglicht die Verwendung des flexiblen Hydrogelsubstrats das Multiplexen der videobasierten kardialen Erregungskontraktionskopplungs-Readouts (d.h. Elektrophysiologie, Calcium-Handling und Kontraktion) in gesunden und erkrankten hiPSC-CMs. Die genaue Erkennung und Quantifizierung der Auswirkungen kardialer elektrophysiologischer Signale auf die menschliche Herzkontraktion ist für die Entwicklung, Optimierung und Risikominderung von Herzmedizinprodukten von entscheidender Bedeutung. Diese Methode ermöglicht die robuste Visualisierung und Quantifizierung der kontraktilen Eigenschaften des kardialen Synzytiums, die für die nichtklinische Sicherheits- oder Wirksamkeitsprüfung von Herzmedizinprodukten wertvoll sein sollten. In diesem Artikel wird die Methodik zur Erzeugung von 2D-hiPSC-CM-Hydrogel-Substrat-Monoschichten ausführlich beschrieben.
Einleitung
Mit zunehmendem Alter der Bevölkerung in den Vereinigten Staaten steigt die Zahl der Patienten mit Herzinsuffizienz weiter an, zusammen mit den direkten medizinischen Kosten 1,2. Es besteht ein dringender Bedarf, neuartige Therapien zur Behandlung von Herzinsuffizienz und innovative nichtklinische Methoden zur Erprobung solcher Therapien zu entwickeln. Humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten (hiPSC-CMs) wurden als In-vitro-Instrument zur Unterstützung des therapeutischen Entwicklungsprozesses vorgeschlagen und in Zulassungsanträgen verwendet 3,4. Ihre weit verbreitete Verwendung für Kontraktilitätsstudien war jedoch aufgrund des Fehlens robuster kontraktiler Eigenschaften begrenzt, wenn sie unter starren Standard-2D-Kulturbedingungen (d. h. herkömmlichem Gewebekulturkunststoff oder Glas) plattiert wurden5,6,7,8. Wir haben bereits gezeigt, wie nützlich es ist, isolierte einzelne hiPSC-CMs auf einem flexiblen Hydrogelsubstrat zu plattieren, um robuste sichtbare kontraktile Eigenschaften zu erzeugen9. Wir zeigten, dass isolierte hiPSC-CMs vergleichbare kontraktile Eigenschaften aufweisen wie frisch isolierte ventrikuläre Kardiomyozyten von adulten Kaninchen. Darüber hinaus haben wir die Nützlichkeit dieser Methode zur Beurteilung der kontraktilen Reaktionen auf pharmakologische Wirkstoffe7 demonstriert. Darüber hinaus haben andere Studien diese Technologie auf mechanistische Bewertungen für die Grundlagenforschung und die Krankheitsmodellierung angewendet10,11,12. Hier wurde diese Methodik auf 2D-hiPSC-CM-Monoschichten ausgeweitet und ihre Nützlichkeit bei der Bewertung physiologisch relevanter elektrischer Signale von Medizinprodukten mit kardialer Kontraktilitätsmodulation (CCM) in vitro demonstriert.
CCM ist eine intrakardiale Herzinsuffizienz-Therapie, bei der nicht-exzitatorische elektrophysiologische Signale während der absoluten Refraktärperiode des Herzzyklus an das Myokard abgegeben werden13,14. Reproduzierbare Methoden zur Bewertung von CCM in menschlichen Herzzellmodellen fehlen. In früheren Arbeiten wurden verschiedene Herzzellmodelle verwendet, um die kontraktile Reaktion des CCM zu bewerten. Wir haben in vitro gezeigt, dass frisch isolierte ventrikuläre Kardiomyozyten von Kaninchen auf die CCM-Stimulation mit einem vorübergehenden Anstieg des Kalziums und der Kontraktionsamplitude15 reagieren. Eine weitere Studie an isolierten ventrikulären Kardiomyozyten des Hundes zeigte eine CCM-induzierte Verstärkung der intrazellulären transienten Calciumamplitude16. In der Mehrzahl der CCM-Studien wurden jedoch Ex-vivo- und In-vivo-Tierpräparate verwendet. Diese Studien sind schwer miteinander zu korrelieren, da sie eine Vielzahl von CCM-Pulsparametern und Speziesanwenden 17. Eine Studie in einem isolierten papillären Kaninchenmodell ergab eine erhöhte CCM-induzierte Kontraktilität8,18, und eine Reihe von Ganzherzstudien haben eine CCM-induzierte Verbesserung der kontraktilen Funktion gezeigt19,20,21. Diese Studien haben wichtige mechanistische Erkenntnisse geliefert. Es fehlt jedoch an reproduzierbaren Humanmodellen für in-vitro-kardiale EP-kontraktile Studien einschließlich CCM. Zu diesem Zweck haben wir mehrere 2D- und 3D-hiPSC-Modelle entwickelt und eine CCM-induzierte Verbesserung der kontraktilen Eigenschaften in einer parameterabhängigen Weise demonstriert. Darüber hinaus wurde festgestellt, dass die CCM-induzierten inotropen Effekte teilweise durch neuronalen Input und β-adrenerge Signalübertragung vermittelt werden 8,17,22. Dennoch muss mehr über die Mechanismen der CCM-Therapie bekannt sein, und die Verwendung von kontrahierenden menschlichen Kardiomyozyten kann dazu beitragen, dieses Ergebnis zu erzielen. Daher besteht ein erheblicher Bedarf an der Entwicklung nichtklinischer Instrumente für den Menschen, um neuartige CCM-Geräte und -Signale zu bewerten, den Regulierungsprozess zu beschleunigen, die Belastung von Tiermodellen zu verringern und die Entscheidungsfindung von Geräteentwicklern zu unterstützen 8,17,23,24. Es ist wichtig, einfache Do-it-yourself-Protokolle zu entwickeln, die auf jedes Labor übertragen werden können und die Standardausrüstung und geringe Zellanforderungen verwenden, um die Kosten zu senken. Diese Methode klärt die Auswirkungen der CCM-Stimulation auf die Funktion der menschlichen Kardiomyozyten auf und liefert wichtige Erkenntnisse über die Sicherheit oder Wirksamkeit von CCM17. Hier beschreiben wir die Methode zur Erzeugung von 2D-hiPSC-CM-Monoschichten auf einem flexiblen Hydrogelsubstrat, um ein standardisiertes nichtklinisches Werkzeug zur Quantifizierung der kontraktilen Reaktionen von akuten kardialen elektrophysiologischen Medizinprodukten (d.h. CCM) bei Gesundheit und Krankheit herzustellen.
Protokoll
1. Vorbereitung der Platten und Medien
HINWEIS: Ein typisches Hydrogel-Aliquot auf Basis der extrazellulären Matrix (ECM) beträgt ~200 μl in einem sterilen 1,5-ml-Röhrchen, das bei -20 °C gelagert wird.
- Bereiten Sie in einer sterilen Gewebekulturhaube eine sterile 6-Well-Platte vor, indem Sie 2 ml 0,1% ige Gelatine (Materialtabelle) in jede Vertiefung geben. Setzen Sie den Deckel auf die 6-Well-Platte und lassen Sie die beschichtete Platte mindestens 1 Stunde lang bei 37 °C inkubieren.
- Einen Tag vor der Aussaat der hiPSC-CMs auf dem flexiblen Hydrogelsubstrat wird ein Hydrogel (Table of Materials) aliquot im Kühlschrank auf Eis aufgetaut.
- Bereiten Sie das Kardiomyozytenmedium (Materialtabelle) vor, indem Sie 500 ml RPMI 1640, 10 ml 50x B-27-Ergänzung und 5 ml Penicillin-Streptomycin9 mischen.
2. Aussaat von kryokonservierten hiPSC-CMs
- Zwei Tage vor der Aussaat der hiPSC-CMs auf dem flexiblen Hydrogelsubstrat werden die hiPSC-CMs auf 0,1 % gelatinebeschichteten sterilen 6-Well-Platten vorplattiert. Tauen Sie die hiPSC-CMs mit einem Standard-Auftauprotokoll 9,25 auf.
- Anschließend werden insgesamt 1.500.000 hiPSC-CMs (Table of Materials) pro Vertiefung gemäß den Anweisungen des Herstellers (Abbildung 1A)26 plattiert.
- Die hiPSC-CMs werden 2-4 Tage lang in Standard-Kardiomyozytenmedium kultiviert, damit sich die hiPSC-CMs bei 37 °C und 5 % CO2 von der Kryokonservierung erholen können. Erfrischen Sie das verbrauchte Medium alle 48 Stunden mit 100% Kardiomyozytenmedium.
3. Dissoziation und Zählung der vorplattierten hiPSC-CMs
- Überprüfen Sie den Status der hiPSC-CMs vor der Dissoziation. Bewerten Sie den Zustand der hiPSC-CMs, um die Lebensfähigkeit und das stabile Schlagen sicherzustellen.
HINWEIS: Die Reinheit der hiPSC-CM-Population ist wichtig (z. B. >90% kardiales Troponin T)7. Eine Kardiomyozyten-Selektionsmethode (z. B. metabolische Selektion oder Sortierung) wird empfohlen, um die Störung des Hydrogelsubstrats durch Nicht-Kardiomyozytenzellenzu reduzieren 25,26. - Waschen Sie die hiPSC-CMs 2x mit 4 mL pro Vertiefung D-PBS ohne CaCl 2 oder MgCl2 (Materialtabelle). Aspirieren Sie das D-PBS, geben Sie 1 ml Dissoziationsreagenz bei Raumtemperatur in jede Vertiefung und inkubieren Sie es dann 15 Minuten lang bei 37 °C.
- Geben Sie 10 ml Kardiomyozytenmedium in ein steriles konisches 15-ml-Röhrchen.
- Dissoziieren Sie die hiPSC-CMs mit einer 1.000-μl-Pipette von der 6-Well-Platte (Abbildung 1B). Geben Sie die Zellsuspension in das konische 15-ml-Röhrchen26.
- Spülen Sie den Brunnen mit 1 ml frischem Kardiomyozytenmedium aus, um alle verbleibenden hiPSC-CMs aufzufangen, und geben Sie sie in das konische 15-ml-Röhrchen. Bringen Sie das Endvolumen des konischen Röhrchens auf 15 ml.
- 5 min zentrifugieren (200 × g). Entfernen Sie den Überstand bis zur 1-ml-Marke. Resuspendieren Sie die Zellen in Kardiomyozytenmedium auf ein Endvolumen von 5 ml.
- Zählen Sie die hiPSC-CMs mit einem manuellen oder automatisierten Zellzähler.
- Inkubieren Sie die hiPSC-CM-Suspension bei Raumtemperatur, während die flexiblen Hydrogelsubstrate vorbereitet werden (maximal 30 Minuten).
4. Vorbereitung der flexiblen Hydrogel-Substrate
- Bereiten Sie ein 20-μl-Pipettenset mit 1 μl, 20 μl-Pipettenspitzen (z. B. 20 μl) und eine sterile 48-Well-Glasbodenplatte vor. Stellen Sie sicher, dass eine Stoppuhr/ein Timer bereit ist, bevor Sie die Hydrogelsubstrate herstellen.
- Mischen Sie in der sterilen Gewebekulturhaube das Hydrogelsubstrat auf ECM-Basis, indem Sie vorsichtig auf das Röhrchen klopfen, und legen Sie es sofort wieder auf Eis.
- Starten Sie dann die Stoppuhr/den Timer unmittelbar vor dem Plattieren des ersten Hydrogelsubstrats - dies ist die Zeit Null.
- Pipettieren Sie 1 μl des Hydrogelsubstrats ~3x auf und ab, um die Pipettenspitze zu kühlen. Tragen Sie ~1 μl des unverdünnten Hydrogelsubstrats horizontal auf den Boden jeder Vertiefung der 48-Well-Platte auf (Abbildung 1C, Abbildung 2A und Abbildung 3A) auf und halten Sie die Pipette in einem Winkel von 45°. Platten Sie alle Hydrogelsubstrate in jeder Vertiefung in der gleichen Ausrichtung (Abbildung 2 und Abbildung 3), um das Substrat bei der Durchführung der Experimente bei 40-facher Vergrößerung 7,9,17,27 zu identifizieren.
HINWEIS: Jede ~1 μl-Linie ist ein Hydrogelsubstrat (Abbildung 3). Normalerweise dauert es ~5 Minuten, um 48 Vertiefungen vorzubereiten. Die Verwendung eines horizontal geneigten Mikroplattenständers (z. B. 30°) kann eine bessere Sicht auf den Boden des Wells und das Hydrogelsubstrat ermöglichen. Achten Sie darauf, die gesamte Länge des Brunnens zu durchlaufen (dh von links nach rechts). Kurze Hydrogel-Substrate können zu dick sein, wodurch die Substratstabilität verringert wird. Lassen Sie das Hydrogelsubstrat in der Pipettenspitze nicht trocknen. Wechseln Sie in diesem Fall schnell zu einem neuen Tipp und fahren Sie sofort fort. Alternativ können gekühlte Pipettenspitzen verwendet werden. Das Hydrogelsubstrat auf ECM-Basis kann schnell polymerisieren, wenn es sich nicht auf Eis befindet. Es wird empfohlen, mehrere Brunnen gleichzeitig vorzubereiten (z. B. 10). Zusätzlich wird empfohlen, in einer simulierten 48-Well-Platte zu üben. - Setzen Sie den Deckel auf die 48-Well-Platte und lassen Sie die Hydrogelsubstrate 8-10 Minuten bei Raumtemperatur in der sterilen Gewebekulturhaube inkubieren, bevor Sie die Zellen hinzufügen (Abbildung 2B).
HINWEIS: Es ist wichtig, die empfohlenen Inkubationszeiten einzuhalten. Eine Inkubationszeit von mehr als 10 Minuten führt zu steifen Hydrogelsubstraten und keinen sichtbaren Kontraktionen. Eine Inkubationszeit von weniger als 8 Minuten kann dazu führen, dass Substrate kollabieren. - Die hiPSC-CMs werden sofort mit ~30.000 lebensfähigen hiPSC-CMs pro Vertiefung in einem niedrigen mittleren Volumen von ~200 μl Kardiomyozytenmedium mit einer 1.000-μl-Pipette tropfenweise direkt auf die Hydrogelsubstrate gesät (Abbildung 2B und Abbildung 3B).
HINWEIS: Dieser Prozess stoppt die Hydrogelsubstratpolymerisation und stellt sicher, dass sich die hiPSC-CMs auf dem Substrat 7,9,17,27 befinden. - Setzen Sie den Deckel auf die Platte und lassen Sie die hiPSC-CMs 10-15 Minuten lang ungestört bei Raumtemperatur (Abbildung 2C) in der sterilen Gewebekulturhaube inkubieren, damit die hiPSC-CMs am Hydrogelsubstrat haften können.
- Geben Sie vorsichtig ~100 μl frisches Kardiomyozytenmedium in jede Vertiefung (Endvolumen: ~300 μl pro Vertiefung). Setzen Sie den Deckel auf den Teller und geben Sie ihn für 2-4 Tage bei 37 °C, 5% CO2 in einen Inkubator. Erfrischen Sie das 100%ige Medium alle 24 Stunden, bevor die Kontraktionsexperimente durchgeführt werden.
HINWEIS: Überprüfen Sie die hiPSC-CMs visuell auf die richtige Morphologie. Unmittelbar nach dem Plattieren sollten die hiPSC-CMs rund erscheinen (Abbildung 3B). Am Tag 2 nach der Aussaat wird ein konfluentes 2D-hiPSC-CM-Monolayer-Syncytium beobachtet (Abbildung 3C) (Supplemental Video S1) mit robuster sichtbarer Kontraktion (Supplemental Video S2).
5. Kontraktionsaufzeichnung und -analyse
- Bereiten Sie das CCM-Assaymedium vor, bei dem es sich um die Tyrode-Lösung handelt, die Folgendes enthält (in mmol/l): CaCl 2 0,5, NaCl 134, KCl 5,4, MgCl2 1, Glucose 10 und HEPES 10, wobei der pH-Wert mit NaOH auf 7,4 eingestellt und in einem Wasserbad auf 37 °C äquilibriert wird.
HINWEIS: Submaximales extrazelluläres Calcium (0,5 mM) wird verwendet, um das CCM-Assay-Fenster zu erweitern. - Schalten Sie das Mikroskop und die Umgebungskontrollkammer ein, um sich auf 37 °C und 5 % CO2 zu äquilibrieren.
- Entfernen Sie das Kardiomyozytenmedium von der 48-Well-Platte und spülen Sie jede Vertiefung zweimal vorsichtig mit 600 μl CCM-Assaymedium aus.
- Fügen Sie 300 μl CCM-Assaymedium pro Well hinzu und legen Sie die 48-Well-Platte auf das Mikroskop in der Umgebungskontrollkammer. Führen Sie die Elektroden ein und balancieren Sie die Zellen 5 Minuten lang aus.
- Verwenden Sie videobasierte Mikroskopie, um die Kontraktionsvideos aufzuzeichnen. Öffnen Sie die Videoaufzeichnungssoftware und stellen Sie eine Bildrate von 100 Bildern/s ein. Wählen Sie eine Region of Interest (ROI) in der Nähe der Mitte der hiPSC-CM-Monoschicht aus.
HINWEIS: Wählen Sie keinen ROI in der Nähe des Randes der hiPSC-CM-Monolayer, da dies bei kontraktilen Aufnahmen instabil sein kann. - Anschließend stimulieren Sie die Zellen mit einem kommerziellen Pulsgenerator (Table of Materials), um die 2D-hiPSC-CM-Monoschichten elektrisch zu beschleunigen. Beschleunigen Sie die hiPSC-CMs mit dem 1,5-fachen Schwellenwert bei 1 Hz mit Basisimpulsparametern (z. B. monophasische Rechteckwellen-Stimulationsimpulse mit einer Stimuluspulsdauer von ~14 V/cm von 2 ms)17.
- Zeichnen Sie das Basislinien-Pacing-Video (d. h. vor dem CCM) (Abbildung 1D) für mindestens fünf Schläge auf17,28.
- Anschließend wird die hiPSC-CM-Monoschicht mit einem experimentellen elektrischen Signal stimuliert (Abbildung 1D). Um diesem Protokoll zu folgen, verwenden Sie die Standard-CCM-Stimulationsparameter: zwei symmetrische zweiphasige Impulse mit einer Phasendauer von 5,14 ms (Gesamtdauer von 20,56 ms), ~28 V/cm (Phasenamplitude), einem Interphasenintervall von Null und einer Verzögerung von 30 ms (d. h. Zeit vom Ende des Schrittimpulses bis zum Beginn des CCM-Impulses) (Abbildung 1D)29,30 und nehmen Sie das CCM-induzierte Kontraktionsvideo für mindestens fünf Schläge auf.
- Schalten Sie das CCM-Signal aus, stimulieren Sie mit einem Basis-Pacing-Impuls und nehmen Sie ein Kontraktionsvideo der Erholungsphase (d. h. nach dem CCM) für mindestens fünf Schläge auf.
- Verwenden Sie eine Standard-Kontraktionssoftware, um die Kontraktionsvideos automatisch zu analysieren und die wichtigsten kontraktilen Eigenschaften zu quantifizieren (z. B. Kontraktionsamplitude, Kontraktionssteigung, Relaxationssteigung, Zeit bis zur Spitze, Zeit bis zum Ausgangswert 90% und Kontraktionsdauer 50%)7,17,31,32.
- Verwenden Sie die 2D-hiPSC-CMs auf dem flexiblen Hydrogel-Substrat für kontraktile Experimente von den Tagen 2-14 nach dem Aufplattieren auf dem Substrat.
Ergebnisse
In diesem Protokoll wird ein einfaches, robustes Werkzeug beschrieben, um sichtbar kontrahierende 2D-hiPSC-CM-Monoschichten auf einem flexiblen Hydrogelsubstrat zu erzeugen. Die Messung der kontraktilen Eigenschaften erfolgt mit einer videobasierten Aufzeichnung in Verbindung mit einer Software zur Kontraktilitätsanalyse. Dies ermöglicht die Quantifizierung von Schlüsselparametern der Kontraktilität von Kardiomyozyten, einschließlich der Kontraktionsamplitude, der Kontraktionssteigung, der Relaxationssteigung, der Zeit bis zum Höhepunkt, der Zeit bis zum Ausgangswert von 90% und der Kontraktionsdauer von 50%. Das Modell wird verwendet, um die kontraktilen Basiseigenschaften von hiPSC-CMs (Abbildung 4) von verschiedenen "gesunden" Spendern zu charakterisieren und kann auf die Auswertung von kardialen elektrophysiologischen Signalen von Medizinprodukten (d.h. CCM) erweitert werden. Die Anwendung der Standard-CCM-Stimulationsparameter (Abbildung 1D)29,30 führte in vitro zu verbesserten kontraktilen Eigenschaften (Abbildung 5 und Tabelle 1)17.
Wir haben außerdem gezeigt, dass diese Methode verwendet werden kann, um die Auswirkungen der Modulation extrazellulärer Calciumkonzentrationen auf die kontraktilen Eigenschaften des Menschen mit und ohne CCM-Stimulation zu bewerten (Abbildung 6)17. Die erwartete Calciumabhängigkeit der Kontraktion zu Studienbeginn wurdebeobachtet 7,17 sowie ein CCM-induzierter Anstieg der Calciumsensitivität auf der Ebene der Kardiomyozytenmonoschicht. Darüber hinaus ergab die pharmakologische Untersuchung des β-adrenergen Signalwegs (Abbildung 7), dass die CCM-induzierten inotropen Effekte teilweise durch β-adrenerge Signalübertragung vermittelt wurden17. Darüber hinaus kann dieses Instrument auf patientenspezifische Krankheitskardiomyozyten ausgeweitet werden, einschließlich derjenigen der dilatativen Kardiomyopathie (DCM)33,34,35 (Abbildung 8), um die Wirkung von CCM im Kontext von Krankheitszuständen zu verstehen; Tatsächlich wurden bei der hier getesteten CCM-"Dosis" eine erhöhte kontraktile Amplitude und eine beschleunigte Kontraktions- und Relaxationskinetik beobachtet (Abbildung 8). Obwohl wir ein CCM-imitierendes Gerät in unserem Labor haben, ist die hier verwendete Methodik nicht spezifisch für dieses System und könnte auf andere kardiale elektrophysiologische Geräte angewendet werden.
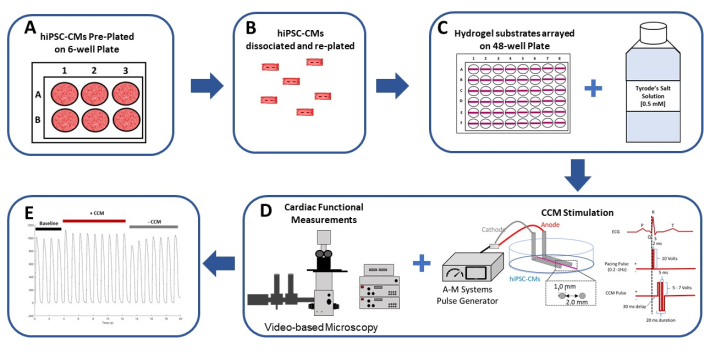
Abbildung 1: Schematische Zusammenfassung des 2D-hiPSC-CM-In-vitro-CCM-Modells. (A) Die hiPSC-CMs sind im Monolayer-Format auf Gelatine (0,1%)-beschichteten 6-Well-Platten vorplattiert. (B) Nach 2 Tagen in Kultur werden die hiPSC-CMs dissoziiert und für die Beschichtung auf einem flexiblen Hydrogelsubstrat vorbereitet. (C) Die isolierten hiPSC-CMs werden mit hoher Dichte auf Hydrogelsubstraten plattiert, die in einem 48-Well-Format angeordnet sind (links) und in (0,5 mM) extrazellulärer Calcium-Tyrode-Lösung (rechts) untersucht. (D) Zur Stimulation der hiPSC-CMs werden ein handelsüblicher Pulsgenerator und die klinischen Standard-CCM-Pulsparameter29,30 (rechts) verwendet. Die Herzfunktion wird mittels videobasierter Analyse beurteilt (links). (E) Repräsentative Kontraktionsaufzeichnungen vor CCM (Basislinie: 5 V), während CCM (CCM: 10 V) und nach CCM (Wiederherstellung: 5 V). Diese Abbildung wurde von Feaster et al.17 nachgedruckt. Abkürzungen: hiPSC-CM = humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten; CCM = kardiale Kontraktilitätsmodulation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
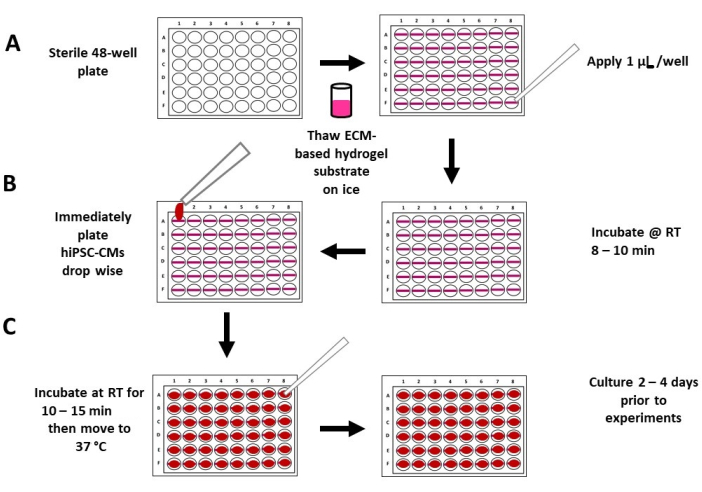
Abbildung 2: Schematische Darstellung der flexiblen Hydrogel-Substratbeschichtung und -Aussaat . (A) Vollständig aufgetautes, unverdünntes Hydrogelsubstrat auf ECM-Basis wird auf eine sterile 48-Well-Platte (linkes Feld) mit 1 μl Hydrogelsubstrat pro Well (rechtes Feld) aufgetragen. (B) Das Hydrogelsubstrat wird 8-10 Minuten lang bei Raumtemperatur inkubieren gelassen (rechtes Bild), gefolgt von einer Beschichtung der hiPSC-CMs mit hoher Dichte in einem niedrigen mittleren Volumen (~200 μl) (linkes Bild). (C) Nach 10-15 Minuten Inkubation wird Medium in jede Vertiefung gegeben (linkes Feld) und die Platten werden in einen Standard-Gewebekultur-Inkubator (rechtes Feld) gebracht. Abkürzungen: ECM = extrazelluläre Matrix, hiPSC-CM = humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten; RT = Raumtemperatur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
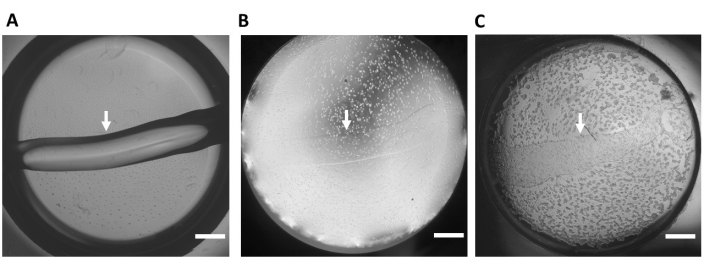
Abbildung 3: Hydrogelsubstrat auf Basis extrazellulärer Matrix . (A) Repräsentatives Hydrogelsubstrat (keine Zellen) in einer Vertiefung einer 48-Well-Glasbodenplatte unmittelbar nach dem Aufbringen des Substrats auf die Vertiefung. (B) Zeit 0 nach dem Aussäen der hiPSC-CMs. (C) Zeit 24 Stunden nach der Aussaat der hiPSC-CMs. Diese Tafel wurde aus Feaster et al.17 nachgedruckt. Die weißen Pfeile zeigen den Rand des Hydrogelsubstrats an, 4-fache Vergrößerung. Maßstabsleiste = 1 mm. Abkürzung: hiPSC-CM = humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
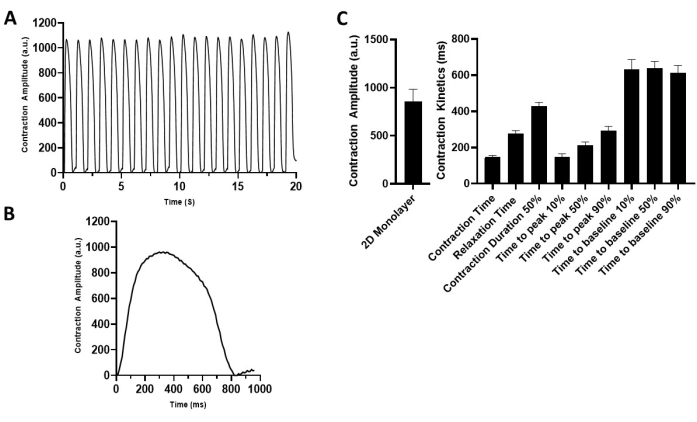
Abbildung 4: Charakterisierung der kontraktilen Eigenschaften der 2D-hiPSC-CM-Monoschicht. (A) Repräsentative Kontraktionsaufzeichnung der 2D-hiPSC-CMs im Tempo von 1 Hz (5 V). (B) Repräsentative Kontraktionsspuren, die einen Kontraktionszyklus darstellen. (C) Zusammenfassende Balkendiagramme. Die Daten sind Mittelwert ± SEM. n = 18. Abkürzung: hiPSC-CM = humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
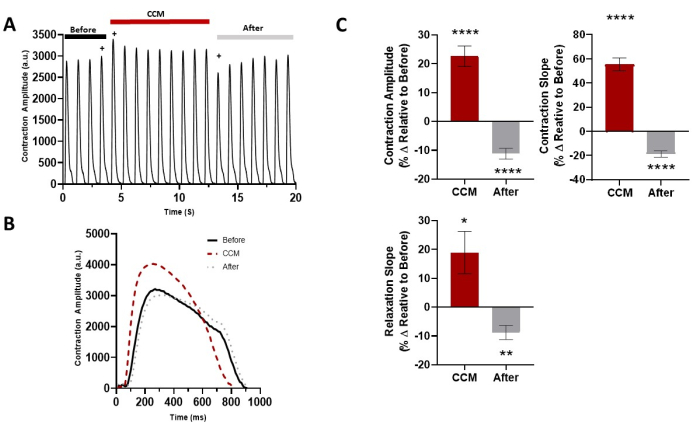
Abbildung 5: Akuter Effekt von CCM auf die kontraktilen Eigenschaften von 2D hiPSC-CM. (A) Repräsentative Kontraktionsaufzeichnung für vor CCM (5 V), während CCM (10 V) und nach CCM (5 V). (B) Repräsentative Kontraktionsspuren der unmittelbaren Auswirkungen (d. h. letzter Auftritt vor dem CCM-Takt, erster CCM-Takt und erster Stoß nach dem CCM-Takt, gekennzeichnet durch +). (C) Zusammenfassende Balkendiagramme der unmittelbaren Auswirkungen. Prozentuale Veränderung, Daten sind Mittelwert ± SEM. n = 23. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001. Diese Abbildung wurde von Feaster et al.17 nachgedruckt. Abkürzungen: hiPSC-CM = humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten; CCM = kardiale Kontraktilitätsmodulation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
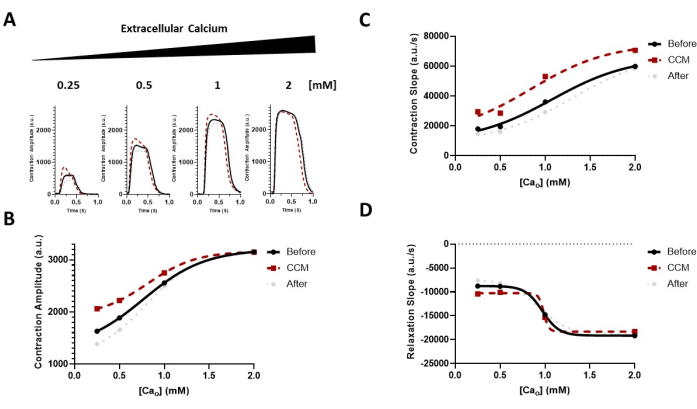
Abbildung 6: Einfluss der extrazellulären Calciummodulation auf die CCM-Antwort. (A) Repräsentative Kontraktionsspuren der unmittelbaren Auswirkungen für jede Gruppe vor CCM (5 V), während CCM (10 V) und nach CCM (5 V); Die hiPSC-CMs wurden steigenden Konzentrationen von extrazellulärem Calcium (Cao) von 0,25-2 mM ausgesetzt. (B-D) Transformierte Daten (sigmoidal) zur Führung des Auges, die die Wirkung von CCM auf die Calciumsensitivität der kontraktilen Eigenschaften (d.h. Amplitude und Kinetik) demonstrieren (Hügelneigung = 1,0). n = 6-8 pro Gruppe. Diese Abbildung wurde von Feaster et al.17 nachgedruckt. Abkürzungen: hiPSC-CM = humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten; CCM = kardiale Kontraktilitätsmodulation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
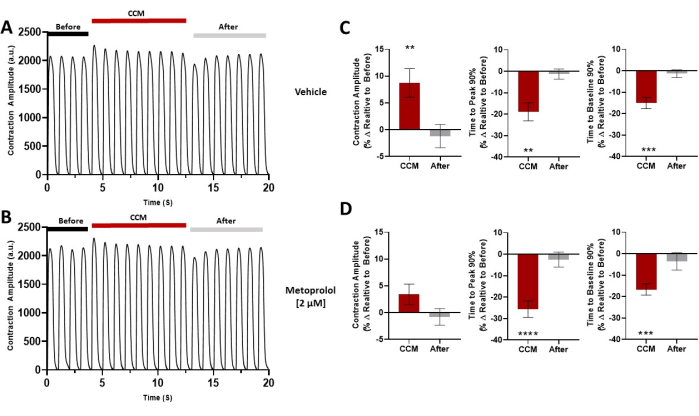
Abbildung 7: Pharmakologische Herausforderung. Repräsentative Kontraktionsspuren für jede Gruppe vor CCM (5 V), während CCM (10 V) und nach CCM (5V); Die hiPSC-CMs wurden mit (A) Vehikel oder (B) Metoprolol (2 μM) vorbehandelt. (C,D) Zusammenfassende Balkendiagramme für jede Bedingung. Prozentuale Veränderung, Daten sind Mittelwert ± SEM. n = 10 pro Gruppe. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001. Diese Abbildung wurde von Feaster et al.17 nachgedruckt. Abkürzungen: hiPSC-CM = humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten; CCM = kardiale Kontraktilitätsmodulation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
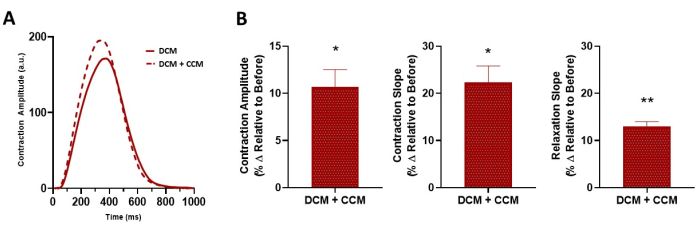
Abbildung 8: Akute Wirkung von CCM auf die kontraktilen Eigenschaften von erkrankten 2D-hiPSC-CMs. (A) Repräsentative Kontraktionsspur für DCM L35P, Kontrollbaseline (vorher, 6 V) und DCM L35P plus CCM (10 V). (B) Zusammenfassende Balkendiagramme. Prozentuale Veränderung, Daten sind Mittelwert ± SEM. n = 3. *p < 0,05, **p < 0,01. Abkürzungen: hiPSC-CM = humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten; CCM = Modulation der kardialen Kontraktilität; DCM = dilatative Kardiomyopathie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzendes Video S1: Zeitraffer der hiPSC-CMs auf dem extrazellulären Matrix-basierten Hydrogel. Zweidimensionale hiPSC-CMs, die auf dem flexiblen Hydrogelsubstrat plattiert sind; Dauer: 0-90 h; eine Vertiefung einer 48-Well-Glasbodenplatte; 4-fache Vergrößerung. Die hiPSC-CMs bilden ein horizontales Monolayer-Syncytium (d.h. von links nach rechts). Maßstabsleiste = 1 mm. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S2: hiPSC-CMs auf dem Hydrogel auf Basis der extrazellulären Matrix. Zweidimensionale hiPSC-CMs, die auf dem flexiblen Hydrogelsubstrat plattiert sind; Dauer: ~24 h; eine Vertiefung einer 48-Well-Glasbodenplatte; 4-fache Vergrößerung. Die hiPSC-CMs bilden eine Monolayer-Morphologie und zeigen eine robuste Kontraktion ~24 h nach der Plattierung. Maßstabsleiste = 1 mm. Dieses Video stammt von Feaster et al.17. Bitte klicken Sie hier, um dieses Video herunterzuladen.
| Parameter | CCM (Begriffsklärung | Nach |
| Amplitude | 16 ± 4%** | 4 ± 5% |
| Zeit bis zum Höhepunkt 50% | -20 ± 9%* | 7 ± 5% |
| Zeit bis zum Höhepunkt 90% | -22 ± 8%* | 6 ± 5% |
| Zeit bis zum Ausgangswert 50% | -8 ± 5% | 4 ± 4% |
| Zeit bis zum Ausgangswert 90% | -12 ± 6%* | 5 ± 5% |
| Kontraktionsdauer 10% | -13 ± 6% | 3 ± 5% |
| Kontraktionsdauer 50% | -6 ± 5 % | 3 ± 5% |
| Kontraktionsdauer 90% | 0 ± 5% | 3 ± 4% |
| N | 23 | 23 |
Tabelle 1: Kontraktile Eigenschaften. Prozentuale Änderung gegenüber vor CCM (5 V); Die Daten sind Mittelwerte ± REM für alle Schläge in jeder Gruppe während CCM (10 V) und nach CCM (5 V). n = 23. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001. Diese Tabelle wurde von Feaster et al.17 nachgedruckt.
Diskussion
Das hierin beschriebene Protokoll beschreibt ein Verfahren zur Erzeugung von robust kontrahierenden 2D-hiPSC-CM-Monoschichten auf einem Hydrogelsubstrat auf Basis flexibler extrazellulärer Matrix (ECM) mit kommerziellen Reagenzien 7,17. Die hiPSC-CMs, die auf das flexible Hydrogelsubstrat gesät werden, bleiben lebensfähig und weisen verbesserte kontraktile Eigenschaftenauf 7. Diese Technik stützt sich auf Standard-Laborgeräte und -fähigkeiten7. Es gibt mehrere kritische Schritte im Protokoll, auch in Bezug auf die Arbeit mit dem ECM-basierten Hydrogelsubstrat, die eine sorgfältige Detailgenauigkeit erfordern. Ein potenzielles Problem ist das Vorhandensein von Serum im Medium. Dies kann dazu führen, dass die hiPSC-CMs Netzwerke (z. B. endotheliale/vaskuläre Netzwerke) anstelle einer konfluenten Monolayer-Schicht bilden. Daher wird ein serumfreies Medium während der Etablierung der flexiblen Hydrogel-hiPSC-CM-Monoschichten (d. h. Tag 0 bis Tag 4) empfohlen. Ebenso kann die gleichzeitige Herstellung von zu vielen Hydrogelsubstraten aufgrund von Ermüdung des Bedieners zu schlechten oder unebenen Substraten führen. Während es wichtig ist, schnell zu arbeiten, ist die Integrität jedes Hydrogelsubstrats von entscheidender Bedeutung. Ebenso sollte man die hiPSC-CMs vorsichtig säen und das Medium wechseln; Dies sollte nicht mit Gewalt geschehen. Beim Wechsel des Mediums sollte es vorsichtig von der Oberkante der Vertiefung zugegeben werden, um das Hydrogelsubstrat oder die Zellen nicht zu stören. Wie bei Standard-2D-hiPSC-CM-Kulturen (d. h. herkömmlichem Gewebekulturkunststoff oder Glas) führt die Beschichtung mit geringer Dichte zu einer unvollständigen Monoschichtbildung. Es ist wichtig, die hiPSC-CMs visuell zu inspizieren, um zu bestätigen, dass sie sich auf dem Hydrogelsubstrat befinden, und einen Timer zu verwenden, um ein genaues Timing zu gewährleisten. Darüber hinaus kann die Kultivierung der 2D-hiPSC-CM-Monoschichten für mehr als 14 Tage auf dem Hydrogelsubstrat zu einem Aufschluss der Monoschicht führen, basierend auf den ECM-Eigenschaften und den Anweisungen des Herstellers des Substrats.
Es gibt mehrere Einschränkungen der aktuellen Methode, die berücksichtigt werden müssen. Erstens stammten die in diesem Protokoll verwendeten Zellen von einem kommerziellen hiPSC-CMs-Anbieter, und diese Zellen bilden ein Synzytium aus elektrisch gekoppelten Zellen. Das Syncytium enthält eine Mischung aus hiPSC-CMs aus allen drei kardialen Subtypen (d. h. ventrikulär, atriale und nodale)17. Studien können von einer Subtyp-exklusiven hiPSC-CM-Population (d. h. 100 % ventrikulär oder 100 % atrial) profitieren. Zweitens wurden bei dieser Methode nur hiPSC-CMs verwendet, während Nicht-Myozyten, einschließlich kardialer Fibroblasten, Endothelzellen und Neuronen, die hiPSC-CM-Funktionalität verbessern können22,36. Drittens weisen 2D-hiPSC-CMs mehrere Merkmale relativ unreifer Kardiomyozyten auf, darunter spontanes Schlagen, amorphe Morphologie und das Fehlen einer inotropen Reaktion 8,37. Viertens: Während dieses Protokoll robust kontrahierende 2D-hiPSC-CM-Monoschichten erzeugt, ist es wahrscheinlich, dass funktionell verbesserte 3D-hiPSC-CM-Modelle wie künstlich hergestelltes Herzgewebe (ECTs) unter physiologischen Calciumkonzentrationen zu einer verstärkten CCM-induzierten kontraktilen Reaktion führen 8,38. Schließlich ist das hier beschriebene Protokoll für ein 48-Well-Format ausgelegt. Mit der Optimierung und der Einbeziehung der Automatisierung kann dies jedoch auf ein Hochdurchsatzformat skaliert werden (z. B. 96-Well- oder 384-Well-Platten).
Der aktuelle Goldstandard für hiPSC-CM-Studien sind konventionelle starre 2D-Kulturbedingungen (d. h. Gewebekultur, Kunststoff oder Glas). Die konventionelle Methodik ist zwar für Studien zur Elektrophysiologie3 und zum Umgang mit Kalzium39 nützlich, führt jedoch zu minimalen kontraktilen Eigenschaften 5,6,7. Infolgedessen sind konventionelle starre 2D-Kulturbedingungen für die Bewertung von CCM-kontraktilen Effekten nicht geeignet8. Funktionell verbesserte 3D-hiPSC-CM-ECT-Methoden38 sind technisch anspruchsvoll, zeitaufwändig und erfordern eine ausgeklügelte Ausstattung, die nicht in jedem Labor ohne weiteres verfügbar ist. In diesem Protokoll beschreiben wir eine einfache Methodik zur Erzeugung von robust kontrahierenden 2D-hiPSC-CM-Monoschichten in einem kürzeren Zeitrahmen als 3D-ECT-Methoden oder langfristige, konventionelle 2D-Methoden 7,40,41. Darüber hinaus sind die hier verwendeten Reagenzien kommerziell erhältlich, einschließlich des Hydrogelsubstrats und der hiPSC-CMs, und beide weisen eine beträchtliche Chargenkonsistenz auf. Während wir abnehmbare Platindrahtelektroden (Zwischenelektrodenabstand: 2,0 mm, Breite: 1,0 mm) verwendet haben, sind verschiedene Elektrodenmaterialien und -konfigurationen für CCM-kontraktile Bewertungen in vitrogeeignet 8,15,17,18,22. Ebenso stehen mehrere automatisierte Software zur Verfügung, die die Analyse von Kontraktionsvideos 7,31,32 ermöglicht.
Die Mehrzahl der nichtklinischen Methoden zur Bewertung der Kontraktilität von Herzmedizinprodukten beruht weitgehend auf kostspieligen In-vivo-Tiermodellen (z. B. Hunden oder Schweinen) und technisch anspruchsvollen papillären Muskelstreifen (z. B. Kaninchen)18. In dieser Arbeit wurde ein menschliches In-vitro-Modell beschrieben, um die Auswirkungen von Signalen von medizinischen Geräten der kardialen Elektrophysiologie auf die Kontraktilität zu bewerten. Dieses Instrument könnte die Abhängigkeit von Tierversuchen verringern und für die In-vitro-Bewertung der kontraktilen Eigenschaften von kardialen Elektrophysiologiegeräten nützlich sein.
Offenlegungen
Dieser Artikel spiegelt die Ansichten der Autoren wider und sollte nicht so ausgelegt werden, dass er die Ansichten oder Richtlinien der US-amerikanischen Food and Drug Administration darstellt. Die Erwähnung kommerzieller Produkte, ihrer Quellen oder ihrer Verwendung in Verbindung mit dem hierin berichteten Material ist weder als tatsächliche noch stillschweigende Billigung solcher Produkte durch das Department of Health and Human Services auszulegen. Die Autoren erklären keine Interessenkonflikte für diese Arbeit.
Danksagungen
Diese Arbeit wurde zum Teil durch eine Ernennung zum Research Participation Program am Center for Devices and Radiological Health unterstützt, das vom Oak Ridge Institute for Science and Education im Rahmen einer behördenübergreifenden Vereinbarung zwischen dem US-Energieministerium und der US-amerikanischen Food and Drug Administration verwaltet wird. Die Autoren danken Richard Gray, Trent Robertson und Anna Avila für ihre Anregungen und ihre technische Unterstützung. Die Studie wurde von der U.S. Food and Drug Administration, Office of Science and Engineering Laboratories, finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.1% Gelatin | STEMCELL Technologies | 7903 | Pre-plating Culture Substrate |
| 48-well Plate | MatTek | P48G-1.5-6-F | Hydrogel Substrate hiPSC-CM Culture, Glass |
| 6-well Plate | Thermofisher | 140675 | hiPSC-CM Culture, Plastic |
| B-27 Supplement, with insulin | Invitrogen | 17504-044 | Cardiomyocyte Media |
| Calcium Chloride dihydrate (CaCl2) | Fisher Scientific | c70-500 | Tyrode’s solution |
| CellOPTIQ Platform and Software | Clyde Biosciences | Contraction Recording and Analysis | |
| Conical tube 15 mL | Corning | 352099 | hiPSC-CM Dissociation |
| Digital CMOS Camera | Hamamatsu | C11440-42U30 | Contraction Video Recording |
| D-PBS | Life Technologies | 14190-144 | Cell Wash |
| Environmental Control Chamber | OKOLAB INC | H201-K-FRAME | Environmental Regulation |
| Glucose | Sigma-Aldrich | G8270-1kg | Tyrode’s solution |
| Hemocytometer | Fisher Scientific | 22-600-107 | hiPSC-CM Counting |
| HEPES | Sigma-Aldrich | H3375 | Tyrode’s solution |
| iCell Cardiomyocytes Plating Medium | Fujifilm Cellular Dynamic, Inc. | M1001 | hiPSC-CM Plating Media |
| iCell Cardiomyocytes2, 01434 | Fujifilm Cellular Dynamic, Inc. | R1017 | hiPSC-CMs |
| Incubator (37 °C, 5% CO2) | Thermofisher | 50116047 | Maintain hiPSC-CMs |
| Inverted Microscope | Olympus | IX73 | Imaging hiPSC-CMs |
| Magnesium Chloride hexahydrate (MgCl2) | Fisher Scientific | m33-500 | Tyrode’s solution |
| Matrigel Growth Factor Reduced Basement Membrane Matrix | Corning | 356230 | Flexible Hydrogel Substrate |
| Microcentrifuge tubes 1.5 ml | Fisher Scientific | 05-408-129 | Hydrogel Substrate Aliquot |
| Model 4100 Isolated High Power Stimulator | AM-Systems | Model 4100 | Pulse Generator |
| MyCell Cardiomyocytes DCM LMNA L35P, 01016 | Fujifilm Cellular Dynamic, Inc. | R1153 | DCM hiPSC-CMs |
| Pen-Strep | Invitrogen | 15140-122 | Cardiomyocyte Media |
| Pipette L-20 | Rainin | 17014392 | Plating Hydrogel Substrate |
| Pipette P1000 | Fisher Scientific | F123602G | |
| Pipette tips, 1000 ul | Fisher Scientific | 02-707-509 | |
| Pipette tips, 20 ul | Rainin | GPS-L10S | Making Hydrogel Substrate |
| Potassium Chloride (KCl) | Fisher Scientific | P330-500 | Tyrode’s solution |
| RPMI 1640, with glucose | Invitrogen | 11875 | Cardiomyocyte Media |
| Sodium Chloride (NaCl) | Fisher Scientific | s641-212 | Tyrode’s solution |
| Sodium Hydroxide (NaOH) | Sigma-Aldrich | 221465 | Tyrode’s solution |
| Stimulation Electrodes | Pacing and CCM Stimulation | ||
| Stopwatch/Timer | Fisher Scientific | 02-261-840 | Plating Hydrogel Substrate |
| Trypan Blue Stain | Life Technologies | T10282 | hiPSC-CM Counting |
| TrypLE Express | Life Technologies | 12605-010 | hiPSC-CM Dissociation |
Referenzen
- Jackson, S. L., et al. National burden of heart failure events in the United States, 2006 to 2014. Circulation: Heart Failure. 11 (12), 004873 (2018).
- Cook, C., Cole, G., Asaria, P., Jabbour, R., Francis, D. P. The annual global economic burden of heart failure. International Journal of Cardiology. 171 (3), 368-376 (2014).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Yang, X., Ribeiro, A. J. S., Pang, L., Strauss, D. G. Use of human iPSC-CMs in nonclinical regulatory studies for cardiac safety assessment. Toxicology Sciences. 190 (2), 117-126 (2022).
- Zuppinger, C. 3D cardiac cell culture: A critical review of current technologies and applications. Frontiers in Cardiovascular Medicine. 6, 87 (2019).
- Huethorst, E., et al. Conventional rigid 2D substrates cause complex contractile signals in monolayers of human induced pluripotent stem cell-derived cardiomyocytes. The Journal of Physiology. 600 (3), 483-507 (2022).
- Feaster, T. K., et al. Matrigel mattress: A method for the generation of single contracting human-induced pluripotent stem cell-derived cardiomyocytes. Circulation Research. 117 (12), 995-1000 (2015).
- Feaster, T. K., et al. Acute effects of cardiac contractility modulation stimulation in conventional 2D and 3D human induced pluripotent stem cell-derived cardiomyocyte models. Frontiers in Physiology. 13, 1023563 (2022).
- Feaster, T. K. . Implementation of human-induced pluripotent stem cell-derived cardiomyocyte to model excitation-contraction coupling in health and disease. , (2015).
- Cadar, A. G., et al. Real-time visualization of titin dynamics reveals extensive reversible photobleaching in human induced pluripotent stem cell-derived cardiomyocytes. American Journal of Physiology-Cell Physiology. 318 (1), 163-173 (2020).
- Parikh, S. S., et al. Thyroid and glucocorticoid hormones promote functional T-tubule development in human-induced pluripotent stem cell-derived cardiomyocytes. Circulation Research. 121 (12), 1323-1330 (2017).
- Wang, L., et al. Hypertrophic cardiomyopathy-linked mutation in troponin T causes myofibrillar disarray and pro-arrhythmic action potential changes in human iPSC cardiomyocytes. Journal of Molecular and Cellular Cardiology. 114, 320-327 (2018).
- Campbell, C. M., Kahwash, R., Abraham, W. T. Optimizer Smart in the treatment of moderate-to-severe chronic heart failure. Future Cardiology. 16 (1), 13-25 (2020).
- PMA P180036. FDA Summary of Safety and Effectiveness Data. Food and Drug Administration Available from: https://www.accessdata.fda.gov/cdrh_docs/pdf18/P180036B.pdf (2019)
- Blinova, K., et al. Acute effects of nonexcitatory electrical stimulation during systole in isolated cardiac myocytes and perfused heart. Physiological Reports. 2 (8), 12106 (2014).
- Sabbah, H. N., et al. Cardiac contractility modulation with the impulse dynamics signal: Studies in dogs with chronic heart failure. Heart Failure Reviews. 6 (1), 45-53 (2001).
- Feaster, T. K., Casciola, M., Narkar, A., Blinova, K. Acute effects of cardiac contractility modulation on human induced pluripotent stem cell-derived cardiomyocytes. Physiological Reports. 9 (21), 15085 (2021).
- Brunckhorst, C. B., Shemer, I., Mika, Y., Ben-Haim, S. A., Burkhoff, D. Cardiac contractility modulation by non-excitatory currents: Studies in isolated cardiac muscle. European Journal of Heart Failure. 8 (1), 7-15 (2006).
- Mohri, S., et al. Cardiac contractility modulation by electric currents applied during the refractory period. American Journal of Physiology-Heart and Circulatory Physiology. 282 (5), 1642-1647 (2002).
- Mohri, S., et al. Electric currents applied during refractory period enhance contractility and systolic calcium in the ferret heart. American Journal of Physiology-Heart and Circulatory Physiology. 284 (4), 1119-1123 (2003).
- Burkhoff, D., et al. Electric currents applied during the refractory period can modulate cardiac contractility in vitro and in vivo. Heart Failure Reviews. 6 (1), 27-34 (2001).
- Narkar, A., Feaster, T. K., Casciola, M., Blinova, K. Human in vitro neurocardiac coculture (ivNCC) assay development for evaluating cardiac contractility modulation. Physiological Reports. 10 (21), 15498 (2022).
- Harris, K., et al. Comparison of electrophysiological data from human-induced pluripotent stem cell-derived cardiomyocytes to functional preclinical safety assays. Toxicological Sciences. 134 (2), 412-426 (2013).
- Blinova, K., et al. Comprehensive translational assessment of human-induced pluripotent stem cell derived cardiomyocytes for evaluating drug-induced arrhythmias. Toxicological Sciences. 155 (1), 234-247 (2017).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), 2006-2017 (2011).
- Burridge, P. W., Holmstrom, A., Wu, J. C. Chemically defined culture and cardiomyocyte differentiation of human pluripotent stem cells. Current Protocols in Human Genetics. 87, 1-15 (2015).
- Cadar, A. G., Feaster, T. K., Durbin, M. D., Hong, C. C. Production of single contracting human induced pluripotent stem cell-derived cardiomyocytes: Matrigel mattress technique. Current Protocols in Stem Cell Biology. 42, 1-7 (2017).
- Narkar, A., Willard, J. M., Blinova, K. Chronic cardiotoxicity assays using human induced pluripotent stem cell-derived cardiomyocytes (hiPSC-CMs). International Journal of Molecular Sciences. 23 (6), 3199 (2022).
- OPTIMIZER® Smart Implantable Pulse Generator INSTRUCTIONS FOR USE. ImpulseDynamics Available from: https://impulse-dynamics.com/wp-content/uploads/2020/05/13-290-008-01-US-Rev-01-OPT-Smart-IPG-IFU.pdf (2018)
- OPTIMIZER™ Smart Mini Implantable Pulse Generator INSTRUCTIONS FOR USE. ImpulseDynamics Available from: https://impulse-dynamics.com/wp-content/uploads/2021/02/13-290-011-EU-Rev-00-OPTIMIZER-Smart-Mini-IPG-IFU-EU.pdf (2019)
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), 5-16 (2018).
- Grune, T., Ott, C., Haseli, S., Hohn, A., Jung, T. The "MYOCYTER" - Convert cellular and cardiac contractions into numbers with ImageJ. Scientific Reports. 9, 15112 (2019).
- Masarone, D., et al. Use of cardiac contractility modulation as bridge to transplant in an obese patient with advanced heart failure: A case report. Frontiers in Cardiovascular Medicine. 9, 833143 (2022).
- Nadeem, M., Tariq, E. F., Aslam, H. M., Illahi, Y., Shah, R. All-cause mortality outcomes of usage of cardiac contractility modulation in patients with dilated cardiomyopathy ineligible for cardiac re-synchronization therapy: An updated meta-analysis of randomized controlled trials. Cureus. 12 (9), 10627 (2020).
- Manganelli, G., et al. Use of cardiac contractility modulation in an older patient with non-ischemic dilated cardiomyopathy: A case report. Clinics and Practice. 11 (4), 835-840 (2021).
- Mannhardt, I., et al. Automated contraction analysis of human engineered heart tissue for cardiac drug safety screening. Journal of Visualized Experiments. (122), e55461 (2017).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756 (2020).
- Feric, N. T., et al. Engineered cardiac tissues generated in the Biowire™ II: A platform for human-based drug discovery. Toxicology Sciences. 172 (1), 89-97 (2019).
- Hwang, H. S., et al. Human induced pluripotent stem cell (hiPSC) derived cardiomyocytes to understand and test cardiac calcium handling: A glass half full. Journal of Molecular and Cellular Cardiology. 89, 379-380 (2015).
- Lundy, S. D., Zhu, W. Z., Regnier, M., Laflamme, M. A. Structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Stem Cells and Development. 22 (14), 1991-2002 (2013).
- Stoehr, A., et al. Automated analysis of contractile force and Ca2+ transients in engineered heart tissue. American Journal of Physiology-Heart and Circulatory Physiology. 306 (9), 1353-1363 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten