Method Article
Valutazione della terapia di modulazione della contrattilità cardiaca in cardiomiociti 2D derivati da cellule staminali umane
In questo articolo
Riepilogo
Qui, dimostriamo un metodo di valutazione della contrattilità dei dispositivi medici cardiaci non invasivi utilizzando monostrati 2D di cardiomiociti derivati da cellule staminali pluripotenti indotte umane (hiPSC-CM), placcati su un substrato flessibile, accoppiati con microscopia basata su video. Questo strumento sarà utile per la valutazione in vitro delle proprietà contrattili dei dispositivi di elettrofisiologia cardiaca.
Abstract
I cardiomiociti derivati da cellule staminali pluripotenti indotte umane (hiPSC-CM) sono attualmente in fase di studio per molteplici applicazioni in vitro e sono stati utilizzati nelle richieste normative. Qui estendiamo il loro uso alla sicurezza dei dispositivi medici cardiaci o alle valutazioni delle prestazioni. Abbiamo sviluppato un nuovo metodo per valutare le proprietà contrattili dei dispositivi medici cardiaci in monostrati hiPSC-CM 2D robustamente contratti placcati su un substrato di idrogel a matrice extracellulare flessibile (ECM). Questo strumento consente la quantificazione degli effetti dei segnali dei dispositivi di elettrofisiologia cardiaca sulla funzione cardiaca umana (ad esempio, proprietà contrattili) con apparecchiature di laboratorio standard. I monostrati 2D hiPSC-CM sono stati coltivati per 2-4 giorni su un substrato flessibile di idrogel in un formato a 48 pozzetti.
Gli hiPSC-CM sono stati esposti a segnali elettrici standard di modulazione della contrattilità cardiaca (CCM) dei dispositivi medici e confrontati con i controlli (cioè solo la stimolazione) degli hiPSC-CM. Le proprietà contrattili di base degli hiPSC-CM 2D sono state quantificate mediante analisi di rilevamento basate su video basate sullo spostamento dei pixel. Gli hiPSC-CM 2D stimolati dal CCM placcati sul substrato flessibile di idrogel hanno mostrato proprietà contrattili significativamente migliorate rispetto al basale (cioè prima della stimolazione CCM), tra cui una maggiore ampiezza di contrazione di picco e una cinetica accelerata di contrazione e rilassamento. Inoltre, l'utilizzo del substrato flessibile di idrogel consente il multiplexing delle letture dell'accoppiamento di contrazione di eccitazione cardiaca basate su video (cioè elettrofisiologia, manipolazione e contrazione del calcio) in hiPSC-CM sani e malati. Il rilevamento accurato e la quantificazione degli effetti dei segnali elettrofisiologici cardiaci sulla contrazione cardiaca umana sono fondamentali per lo sviluppo, l'ottimizzazione e la riduzione del rischio dei dispositivi medici cardiaci. Questo metodo consente la visualizzazione e la quantificazione robuste delle proprietà contrattili del sincizio cardiaco, che dovrebbero essere preziose per la sicurezza o l'efficacia dei dispositivi medici cardiaci non clinici. Questo articolo descrive, in dettaglio, la metodologia per generare monostrati di substrato idrogel hiPSC-CM 2D.
Introduzione
Con l'invecchiamento della popolazione degli Stati Uniti, il numero di pazienti con insufficienza cardiaca continua ad aumentare, insieme ai costi medici diretti 1,2. Vi è una necessità critica di sviluppare nuove terapie per il trattamento dell'insufficienza cardiaca e metodologie non cliniche innovative per testare tali terapie. I cardiomiociti derivati da cellule staminali pluripotenti indotte umane (hiPSC-CMs) sono stati proposti come strumento in vitro per aiutare il processo di sviluppo terapeutico e sono stati utilizzati nelle richieste regolatorie 3,4. Tuttavia, il loro uso diffuso è stato limitato per gli studi di contrattilità a causa della mancanza di proprietà contrattili robuste quando placcati in condizioni di coltura 2D rigida standard (ad esempio, plastica o vetro convenzionali per colture tissutali)5,6,7,8. In precedenza abbiamo dimostrato l'utilità di placcare singoli hiPSC-CM isolati su un substrato flessibile di idrogel per generare robuste proprietà contrattili visibili9. Abbiamo dimostrato che gli hiPSC-CM isolati hanno proprietà contrattili comparabili a quelle dei cardiomiociti ventricolari di coniglio adulto appena isolati. Inoltre, abbiamo dimostrato l'utilità di questo metodo per valutare le risposte contrattili agli agenti farmacologici7. Inoltre, altri studi hanno applicato questa tecnologia alle valutazioni meccanicistiche per la scienza di base e la modellazione delle malattie10,11,12. Qui, questa metodologia è stata estesa ai monostrati 2D hiPSC-CM e viene dimostrata la sua utilità nella valutazione dei segnali elettrici dei dispositivi medici di modulazione della contrattilità cardiaca (CCM) fisiologicamente rilevanti (CCM) in vitro.
La CCM è una terapia intracardiaca per l'insufficienza cardiaca in cui segnali elettrofisiologici non eccitatori vengono erogati al miocardio durante il periodo refrattario assoluto del ciclo cardiaco13,14. Mancano metodi riproducibili per valutare la CCM in modelli di cellule cardiache umane. Il lavoro precedente ha impiegato vari modelli di cellule cardiache per valutare la risposta contrattile CCM. Abbiamo dimostrato in vitro che i cardiomiociti ventricolari di coniglio appena isolati rispondono alla stimolazione CCM con un aumento transitorio del calcio e dell'ampiezza di contrazione15. Un altro studio su cardiomiociti ventricolari canini isolati ha dimostrato il potenziamento indotto da CCM dell'ampiezza transitoria del calcio intracellulare16. Tuttavia, la maggior parte degli studi CCM ha utilizzato preparati animali ex vivo e in vivo. Questi studi sono difficili da correlare tra loro perché applicano una varietà di parametri di impulso CCM e specie17. Uno studio in un modello papillare di coniglio isolato ha rivelato un aumento della contrattilità indotta da CCM 8,18 e una serie di studi sull'intero cuore hanno dimostrato un miglioramento della funzione contrattile indotto da CCM19,20,21. Questi studi hanno fornito importanti intuizioni meccanicistiche. Tuttavia, vi è una mancanza di modelli umani riproducibili per gli studi in vitro sulla CPE contrattile cardiaca, incluso il CCM. A tal fine, abbiamo sviluppato diversi modelli hiPSC 2D e 3D e dimostrato il miglioramento indotto da CCM delle proprietà contrattili in modo dipendente dai parametri. Inoltre, gli effetti inotropi indotti da CCM sono risultati essere in parte mediati dall'input neuronale e dalla segnalazione β-adrenergica 8,17,22. Tuttavia, è necessario conoscere di più sui meccanismi della terapia CCM e l'utilizzo di cardiomiociti umani in contrazione può aiutare a raggiungere questo risultato. Pertanto, vi è una significativa necessità di sviluppare strumenti umani non clinici per valutare nuovi dispositivi e segnali CCM, accelerare il processo normativo, ridurre l'onere sui modelli animali e aiutare gli sviluppatori di dispositivi decisionali 8,17,23,24. È importante sviluppare protocolli semplici e fai-da-te che possano essere trasferiti a qualsiasi laboratorio e che utilizzino attrezzature standard e bassi requisiti di celle per ridurre i costi. Questo metodo chiarisce gli effetti della stimolazione CCM sulla funzione dei cardiomiociti umani e fornisce importanti informazioni sulla sicurezza o l'efficacia del CCM17. Qui, descriviamo il metodo per generare monostrati 2D hiPSC-CM su un substrato flessibile di idrogel per produrre uno strumento non clinico standardizzato per quantificare le risposte contrattili dei dispositivi medici di elettrofisiologia cardiaca acuta (cioè CCM) in salute e malattia.
Protocollo
1. Preparazione delle lastre e dei supporti
NOTA: Una tipica aliquota idrogel basata su matrice extracellulare (ECM) è ~200 μL in un tubo sterile da 1,5 mL conservato a -20 °C.
- In una cappa di coltura di tessuto sterile, preparare una piastra sterile a 6 pozzetti trasferendo 2 ml di gelatina allo 0,1% (Table of Materials) a ciascun pozzetto. Posizionare il coperchio sulla piastra a 6 pozzetti e lasciare che la piastra rivestita incubi a 37 °C per almeno 1 ora.
- Un giorno prima di seminare gli hiPSC-CM sul substrato flessibile dell'idrogel, scongelare un'aliquota di idrogel (Table of Materials) in frigorifero su ghiaccio.
- Preparare il mezzo cardiomiocitario (Tabella dei materiali) mescolando 500 ml di RPMI 1640, 10 ml di 50x B-27 Supplemento, e 5 ml di penicillina-streptomicina9.
2. Semina di hiPSC-CMs crioconservate
- Due giorni prima di seminare gli hiPSC-CM sul substrato flessibile di idrogel, pre-placcare gli hiPSC-CMs su piastre sterili a 6 pozzetti rivestite di gelatina allo 0,1%. Scongelare gli hiPSC-CM utilizzando un protocollo di scongelamento standard 9,25.
- Quindi, piastra 1.500.000 hiPSC-CM totali (Table of Materials) per pozzetto secondo le istruzioni del produttore (Figura 1A) 26.
- Coltura delle hiPSC-CM in mezzo cardiomiocitario standard per 2-4 giorni per consentire alle hiPSC-CMs di riprendersi dalla crioconservazione a 37 °C e 5% di CO2. Rinfrescare il mezzo esaurito con mezzo cardiomiocitario al 100% ogni 48 ore.
3. Dissociazione e conteggio delle hiPSC-CM preplaccate
- Controllare lo stato degli hiPSC-CM prima della dissociazione. Valutare la salute degli hiPSC-CM, garantendo vitalità e battitura stabile.
NOTA: La purezza della popolazione hiPSC-CM è importante (ad esempio, >90% troponina cardiaca T)7. Si raccomanda un metodo di selezione dei cardiomiociti (ad esempio, selezione metabolica o selezione) per ridurre la rottura del substrato idrogel da parte delle cellule non cardiomiocitarie25,26. - Lavare gli hiPSC-CMs 2x con 4 mL per pozzetto di D-PBS senza CaCl 2 o MgCl2 (Tabella dei materiali). Aspirare il D-PBS, aggiungere 1 mL di reagente di dissociazione a temperatura ambiente a ciascun pozzetto, quindi incubare per 15 minuti a 37 °C.
- Aggiungere 10 ml di mezzo cardiomiocitario a un tubo conico sterile da 15 ml.
- Dissociare gli hiPSC-CM dalla piastra a 6 pozzetti con una pipetta da 1.000 μL (Figura 1B). Aggiungere la sospensione cellulare al tubo conico26 da 15 ml.
- Risciacquare il pozzetto con 1 mL di mezzo cardiomiocitario fresco per raccogliere eventuali residui di hiPSC-CM e aggiungerli al tubo conico da 15 ml. Portare il volume finale del tubo conico a 15 ml.
- Centrifugare per 5 min (200 × g). Rimuovere il surnatante fino al segno di 1 ml. Risospendere le cellule nel mezzo cardiomiocitario ad un volume finale di 5 ml.
- Contare gli hiPSC-CM con un contatore di celle manuale o automatico.
- Incubare la sospensione hiPSC-CM a temperatura ambiente mentre i substrati flessibili di idrogel sono in fase di preparazione (massimo 30 minuti).
4. Preparazione dei substrati flessibili di idrogel
- Preparare un set di pipette da 20 μL da 1 μL, punte per pipette da 20 μL (ad es. 20 μL) e una piastra di vetro sterile da 48 pozzetti. Assicurarsi che un cronometro/timer sia pronto prima di realizzare i substrati di idrogel.
- Nella cappa di coltura di tessuto sterile, mescolare il substrato di idrogel a base di ECM picchiettando delicatamente il tubo e riposizionarlo immediatamente sul ghiaccio.
- Quindi, avviare il cronometro / timer immediatamente prima che il primo substrato di idrogel sia placcato: questo è il tempo zero.
- Pipettare 1 μL del substrato di idrogel su e giù ~3x per raffreddare la punta della pipetta. Applicare ~1 μL del substrato di idrogel non diluito orizzontalmente sul fondo di ciascun pozzetto della piastra a 48 pozzetti (Figura 1C, Figura 2A e Figura 3A), tenendo la pipetta con un angolo di 45°. Placcare tutti i substrati di idrogel con lo stesso orientamento in ciascun pozzetto (Figura 2 e Figura 3) per aiutare a identificare il substrato quando si eseguono gli esperimenti con ingrandimento 40x 7,9,17,27.
NOTA: Ogni linea ~1 μL è un substrato di idrogel (Figura 3). In genere, ci vogliono ~ 5 minuti per preparare 48 pozzi. L'uso di un supporto per micropiastre inclinato orizzontalmente (ad esempio, 30°) può consentire una migliore visione del fondo del pozzo e del substrato di idrogel. Assicurati di percorrere l'intera lunghezza del pozzo (cioè da sinistra a destra). I substrati corti di idrogel possono essere troppo spessi, riducendo così la stabilità del substrato. Non lasciare asciugare il substrato di idrogel nella punta della pipetta. In questo caso, passare rapidamente a un nuovo suggerimento e continuare immediatamente. In alternativa, è possibile utilizzare punte per pipette refrigerate. Il substrato idrogel a base di ECM può polimerizzare rapidamente quando non è sul ghiaccio. Si suggerisce la preparazione di più pozzi alla volta (ad esempio, 10). Inoltre, si consiglia di esercitarsi in una finta piastra a 48 pozzetti. - Posizionare il coperchio sulla piastra a 48 pozzetti e lasciare che i substrati di idrogel incubano per 8-10 minuti a temperatura ambiente nella cappa di coltura di tessuto sterile prima di aggiungere le cellule (Figura 2B).
NOTA: È importante rispettare i tempi di incubazione suggeriti. Un tempo di incubazione di oltre 10 minuti porterà a substrati di idrogel rigidi e nessuna contrazione visibile. Un tempo di incubazione inferiore a 8 minuti può portare a substrati che collassano. - Seminare immediatamente gli hiPSC-CMs goccia a goccia direttamente sui substrati di idrogel, con ~30.000 hiPSC-CMs vitali per pozzetto in un volume medio basso di ~200 μL di mezzo cardiomiocitario, utilizzando una pipetta da 1.000 μL (Figura 2B e Figura 3B).
NOTA: Questo processo arresta la polimerizzazione del substrato di idrogel e assicura che gli hiPSC-CM siano sul substrato 7,9,17,27. - Posizionare il coperchio sulla piastra e lasciare che gli hiPSC-CM incubano indisturbati per 10-15 minuti a temperatura ambiente (Figura 2C) nella cappa di coltura di tessuto sterile per consentire agli hiPSC-CM di aderire al substrato di idrogel.
- Aggiungere delicatamente ~100 μL di mezzo cardiomiocitario fresco a ciascun pozzetto (volume finale: ~300 μL per pozzetto). Posizionare il coperchio sulla piastra e trasferire in un'incubatrice a 37 °C, 5% CO 2 per2-4 giorni. Aggiornare il mezzo al 100% ogni 24 ore prima di eseguire gli esperimenti di contrazione.
NOTA: Ispezionare visivamente gli hiPSC-CM per la morfologia corretta; immediatamente dopo la placcatura, gli hiPSC-CM dovrebbero apparire rotondi (Figura 3B). Entro il giorno 2 dopo la semina, verrà osservato un sincizio monostrato 2D hiPSC-CM confluente (Figura 3C) (Video supplementare S1) con robusta contrazione visibile (Video supplementare S2).
5. Registrazione e analisi delle contrazioni
- Preparare il mezzo di analisi CCM, che è la soluzione di Tyrode contenente quanto segue (in mmol / L): CaCl 2 0,5, NaCl 134, KCl 5,4, MgCl2 1, glucosio 10 e HEPES 10, con il pH regolato a 7,4 con NaOH ed equilibrare a 37 ° C a bagnomaria.
NOTA: Il calcio extracellulare submassimale (0,5 mM) viene utilizzato per migliorare la finestra del test CCM. - Accendere il microscopio e la camera di controllo ambientale per equilibrare a 37 °C e al 5% di CO2.
- Rimuovere il mezzo cardiomiocitario dalla piastra a 48 pozzetti e sciacquare delicatamente ogni pozzetto due volte con 600 μL di terreno di analisi CCM.
- Aggiungere 300 μL di terreno di analisi CCM per pozzetto e posizionare la piastra a 48 pozzetti sul microscopio nella camera di controllo ambientale. Inserire gli elettrodi ed equilibrare le celle per 5 minuti.
- Utilizzare la microscopia basata su video per registrare i video di contrazione. Aprire il software di registrazione video e impostare un frame rate di 100 fotogrammi/s. Selezionare una regione di interesse (ROI) vicino al centro del monostrato hiPSC-CM.
NOTA: non selezionare un ROI vicino al bordo dei monostrati hiPSC-CM poiché potrebbe essere instabile per le registrazioni contrattili. - Quindi, stimolare le cellule con un generatore di impulsi commerciale (Table of Materials) per accelerare elettricamente i monostrati 2D hiPSC-CM. Accelerare gli hiPSC-CM a una soglia di 1,5x a 1 Hz con parametri di impulso basali (ad esempio, impulsi di stimolazione monofasica ad onda quadra con una durata dell'impulso di stimolo di 2 ms di ~14 V / cm)17.
- Registra il video di contrazione della linea di base, solo pacing (cioè prima del CCM) (Figura 1D) per un minimo di cinque battiti17,28.
- Quindi, stimolare il monostrato hiPSC-CM con un segnale elettrico sperimentale (Figura 1D). Per seguire questo protocollo, utilizzare i parametri standard di stimolazione CCM: due impulsi bifasici simmetrici della durata di fase di 5,14 ms (durata totale 20,56 ms), ~ 28 V / cm (ampiezza di fase), intervallo di interfase zero e un ritardo di 30 ms (cioè tempo dalla fine dell'impulso di stimolazione all'inizio dell'impulso CCM) (Figura 1D)29,30 e registrare il video di contrazione indotta dal CCM per un minimo di cinque battiti.
- Disattiva il segnale CCM, stimola con un impulso di stimolazione basale e registra un video di contrazione del periodo di recupero (cioè dopo il CCM) per un minimo di cinque battiti.
- Utilizzare un software di contrazione standard per analizzare automaticamente i video di contrazione e quantificare le proprietà contrattili chiave (ad esempio, l'ampiezza della contrazione, la pendenza della contrazione, la pendenza di rilassamento, il tempo al picco, il tempo al basale del 90% e la durata della contrazione del 50%)7,17,31,32.
- Utilizzare gli hiPSC-CM 2D sul substrato flessibile di idrogel per esperimenti contrattili dai giorni 2 a 14 dopo la placcatura sul substrato.
Risultati
Descritto in questo protocollo è uno strumento semplice e robusto per generare monostrati 2D hiPSC-CM visibilmente contraenti su un substrato flessibile di idrogel. La misurazione delle proprietà contrattili viene effettuata con registrazione basata su video accoppiata con software di analisi della contrattilità. Ciò consente la quantificazione dei parametri chiave della contrattilità dei cardiomiociti, tra cui l'ampiezza della contrazione, la pendenza di contrazione, la pendenza di rilassamento, il tempo al picco, il tempo al basale del 90% e la durata della contrazione del 50%. Il modello viene utilizzato per caratterizzare le proprietà contrattili basali di hiPSC-CMs (Figura 4) da vari donatori "sani" e può essere esteso alla valutazione dei segnali dei dispositivi medici di elettrofisiologia cardiaca (cioè CCM). L'applicazione dei parametri standard di stimolazione CCM (Figura 1D)29,30 ha migliorato le proprietà contrattili in vitro (Figura 5 e Tabella 1)17.
Abbiamo inoltre dimostrato che questo metodo può essere utilizzato per valutare gli effetti della modulazione delle concentrazioni extracellulari di calcio sulle proprietà contrattili umane con e senza stimolazione CCM (Figura 6)17. La dipendenza da calcio attesa al basale della contrazione è stata osservata 7,17, così come un aumento indotto da CCM della sensibilità al calcio a livello del monostrato cardiomiocitario. Inoltre, l'interrogazione farmacologica della via di segnalazione β-adrenergica (Figura 7) ha rivelato che gli effetti inotropi indotti da CCM erano in parte mediati dalla segnalazione β-adrenergica17. Inoltre, questo strumento può essere esteso ai cardiomiociti patologici specifici del paziente, compresi quelli della cardiomiopatia dilatativa (DCM)33,34,35 (Figura 8), per comprendere l'effetto del CCM nel contesto degli stati patologici; infatti, una maggiore ampiezza contrattile e una cinetica accelerata di contrazione e rilassamento sono state osservate alla "dose" CCM qui testata (Figura 8). Mentre abbiamo un dispositivo che imita CCM nel nostro laboratorio, la metodologia utilizzata qui non è specifica per quel sistema e potrebbe essere applicata ad altri dispositivi di elettrofisiologia cardiaca.
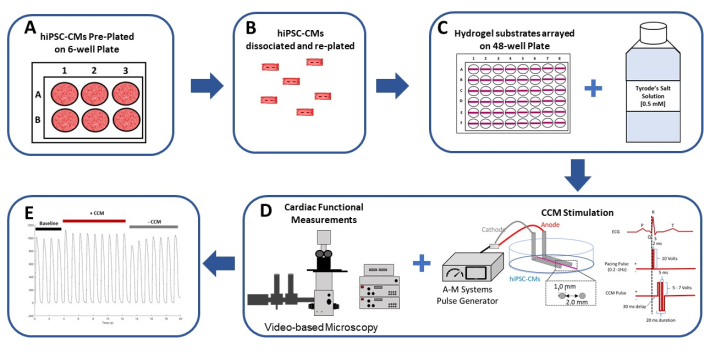
Figura 1: Riassunto schematico del modello 2D hiPSC-CM in vitro CCM. (A) Gli hiPSC-CM sono preplaccati in formato monostrato su piastre a 6 pozzetti rivestite di gelatina (0,1%). (B) Dopo 2 giorni di coltura, gli hiPSC-CM vengono dissociati e preparati per la placcatura su un substrato flessibile di idrogel. (C) Gli hiPSC-CM isolati sono placcati ad alta densità su substrati di idrogel disposti in un formato a 48 pozzetti (a sinistra) e sono saggiati in (0,5 mM) soluzione extracellulare di calcio di Tyrode (a destra). (D) Un generatore di impulsi commerciale e parametri di impulso CCM clinici standard29,30 (a destra) sono utilizzati per stimolare gli hiPSC-CM; La funzione cardiaca viene valutata mediante analisi video (a sinistra). (E) Registrazioni di contrazione rappresentative prima del CCM (basale: 5 V), durante il CCM (CCM: 10 V) e dopo il CCM (recupero: 5 V). Questa figura è stata ristampata da Feaster et al.17. Abbreviazioni: hiPSC-CM = cardiomiocita derivato da cellule staminali pluripotenti indotte umane; CCM = modulazione della contrattilità cardiaca. Fare clic qui per visualizzare una versione ingrandita di questa figura.
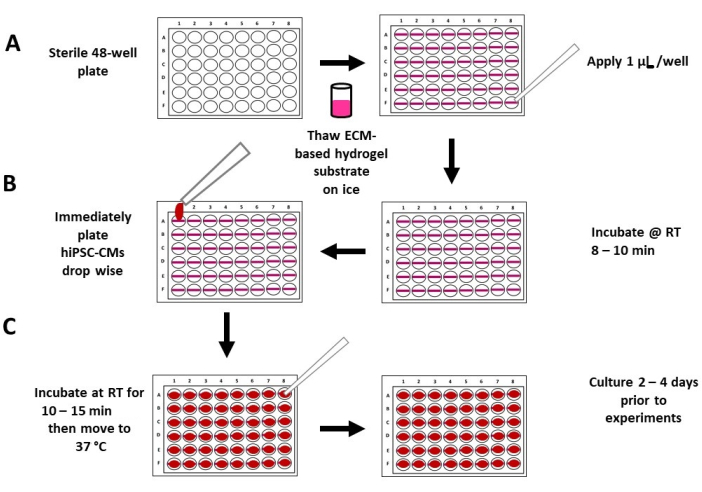
Figura 2: Schema della placcatura e della semina del substrato flessibile di idrogel. (A) Il substrato di idrogel a base di ECM completamente scongelato e non diluito viene applicato su una piastra sterile a 48 pozzetti (pannello di sinistra), con 1 μL di substrato di idrogel per pozzetto (pannello di destra). (B) Il substrato di idrogel viene lasciato incubare a temperatura ambiente per 8-10 minuti (pannello di destra), seguito dalla placcatura degli hiPSC-CM ad alta densità in un volume medio basso (~ 200 μL) (pannello di sinistra). (C) Dopo 10-15 minuti di incubazione, il terreno viene aggiunto a ciascun pozzetto (pannello sinistro) e le piastre vengono spostate in un incubatore di coltura tissutale standard (pannello destro). Abbreviazioni: ECM = matrice extracellulare, hiPSC-CM = cardiomiocita derivato da cellule staminali pluripotenti indotte umane; RT = temperatura ambiente. Fare clic qui per visualizzare una versione ingrandita di questa figura.
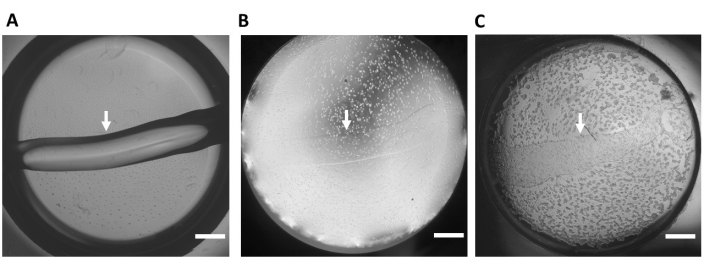
Figura 3: Substrato idrogel a base di matrice extracellulare. (A) Substrato idrogel rappresentativo (senza celle) in un pozzetto di una piastra inferiore di vetro a 48 pozzetti immediatamente dopo che il substrato è stato applicato al pozzetto. (B) Tempo 0 dopo che gli hiPSC-CM sono seminati. (C) Tempo 24 ore dopo la semina degli hiPSC-CM. Questo pannello è stato ristampato da Feaster et al.17. Le frecce bianche indicano il bordo del substrato di idrogel, ingrandimento 4x. Barra di scala = 1 mm. Abbreviazione: hiPSC-CM = cardiomiocita derivato da cellule staminali pluripotenti indotte umane. Fare clic qui per visualizzare una versione ingrandita di questa figura.
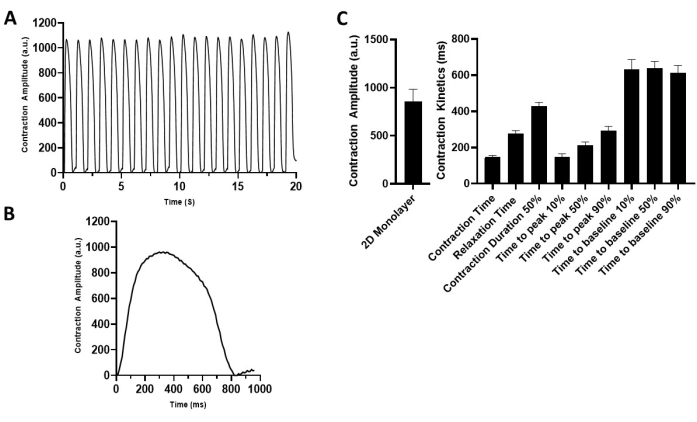
Figura 4: Caratterizzazione delle proprietà contrattili monostrato 2D hiPSC-CM. (A) Registrazione rappresentativa della contrazione degli hiPSC-CM 2D a ritmo di 1 Hz (5 V). (B) Tracce di contrazione rappresentative raffiguranti un ciclo di contrazione. (C) Grafici a barre riepilogativi. I dati sono medi ± SEM. n = 18. Abbreviazione: hiPSC-CM = cardiomiocita derivato da cellule staminali pluripotenti indotte umane. Fare clic qui per visualizzare una versione ingrandita di questa figura.
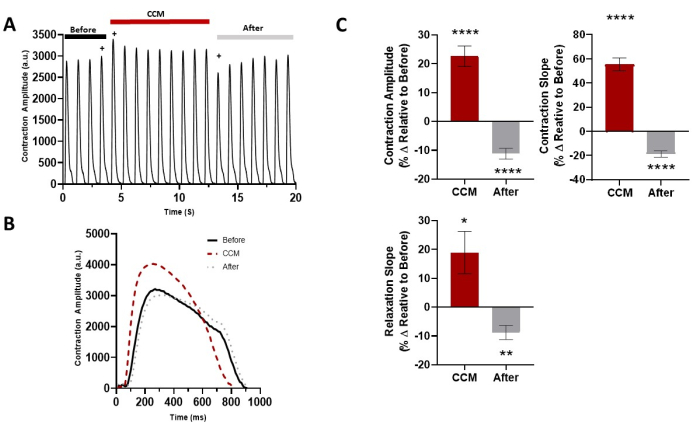
Figura 5: Effetto acuto del CCM sulle proprietà contrattili 2D hiPSC-CM. (A) Registrazione rappresentativa della contrazione per prima della CCM (5 V), durante la CCM (10 V) e dopo la CCM (5 V). (B) Tracce di contrazione rappresentative degli effetti immediati (cioè, ultimo battito prima del CCM, primo battito CCM e primo battito post-CCM, indicato da +). (C) Grafici a barre riassuntivi degli effetti immediati. Variazione percentuale, i dati sono medi ± SEM. n = 23. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001. Questa figura è stata ristampata da Feaster et al.17. Abbreviazioni: hiPSC-CM = cardiomiocita derivato da cellule staminali pluripotenti indotte umane; CCM = modulazione della contrattilità cardiaca. Fare clic qui per visualizzare una versione ingrandita di questa figura.
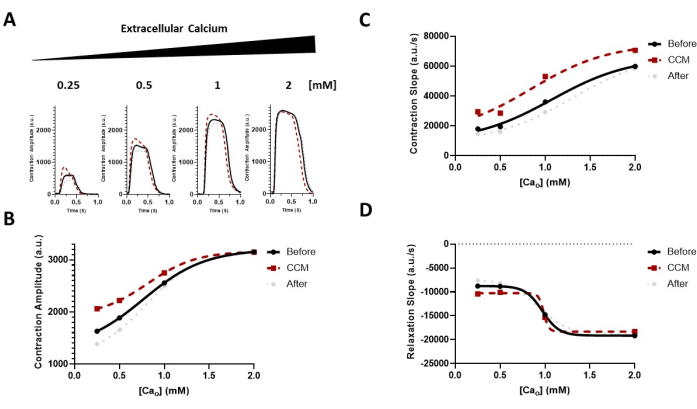
Figura 6: Effetto della modulazione extracellulare del calcio sulla risposta CCM. (A) tracce di contrazione rappresentative degli effetti immediati per ciascun gruppo prima della CCM (5 V), durante la CCM (10 V) e dopo la CCM (5 V); le hiPSC-CMs sono state esposte a concentrazioni crescenti di calcio extracellulare (Cao) di 0,25-2 mM. (B-D) Dati trasformati (sigmoidali) per guidare l'occhio dimostrando l'effetto del CCM sulla sensibilità al calcio delle proprietà contrattili (cioè l'ampiezza e la cinetica) (pendenza collinare = 1,0). n = 6-8 per gruppo. Questa figura è stata ristampata da Feaster et al.17. Abbreviazioni: hiPSC-CM = cardiomiocita derivato da cellule staminali pluripotenti indotte umane; CCM = modulazione della contrattilità cardiaca. Fare clic qui per visualizzare una versione ingrandita di questa figura.
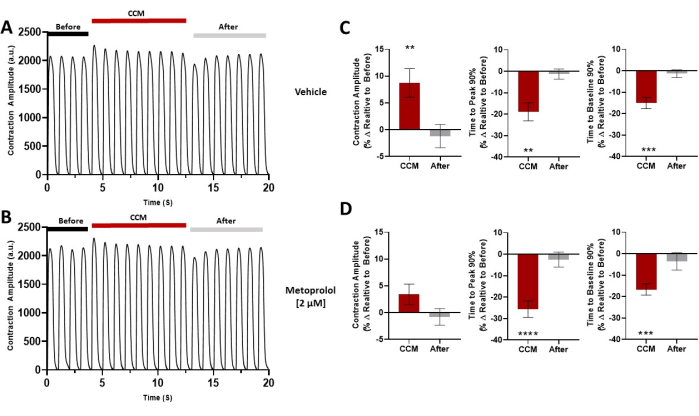
Figura 7: Sfida farmacologica. Tracce di contrazione rappresentative per ciascun gruppo prima di CCM (5 V), durante CCM (10 V) e dopo CCM (5V); gli hiPSC-CM sono stati pretrattati con (A) veicolo o (B) metoprololo (2 μM). (C,D) Grafici a barre di riepilogo per ogni condizione. Variazione percentuale, i dati sono medi ± SEM. n = 10 per gruppo. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001. Questa figura è stata ristampata da Feaster et al.17. Abbreviazioni: hiPSC-CM = cardiomiocita derivato da cellule staminali pluripotenti indotte umane; CCM = modulazione della contrattilità cardiaca. Fare clic qui per visualizzare una versione ingrandita di questa figura.
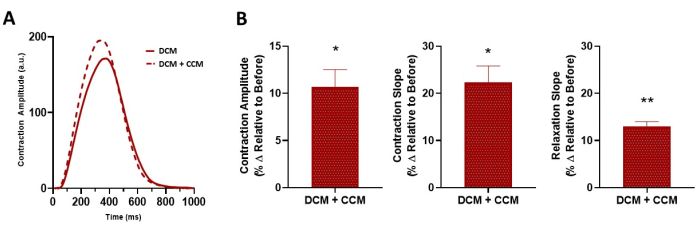
Figura 8: Effetto acuto del CCM sulle proprietà contrattili delle hiPSC-CM 2D malate. (A) Traccia di contrazione rappresentativa per DCM L35P, basale di controllo (prima, 6 V) e DCM L35P più CCM (10 V). (B) Grafici a barre riassuntivi. Variazione percentuale, i dati sono medi ± SEM. n = 3. *p < 0,05, **p < 0,01. Abbreviazioni: hiPSC-CM = cardiomiocita derivato da cellule staminali pluripotenti indotte umane; CCM = modulazione della contrattilità cardiaca; DCM = cardiomiopatia dilatativa. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Video supplementare S1: Timelapse degli hiPSC-CMs sull'idrogel a base di matrice extracellulare. HiPSC-CMs bidimensionali placcati sul substrato flessibile di idrogel; Tempo: 0-90 h; un pozzetto di una piastra di fondo di vetro a 48 pozzetti; Ingrandimento 4x. Gli hiPSC-CM formano un sincizio monostrato orizzontale (cioè da sinistra a destra). Barra della scala = 1 mm. Clicca qui per scaricare questo video.
Video supplementare S2: hiPSC-CMs sull'idrogel a base di matrice extracellulare. HiPSC-CMs bidimensionali placcati sul substrato flessibile di idrogel; Tempo: ~24 h; un pozzetto di una piastra di fondo di vetro a 48 pozzetti; Ingrandimento 4x. Gli hiPSC-CM formano una morfologia monostrato e mostrano una robusta contrazione a ~24 h dopo la placcatura. Barra di scala = 1 mm. Questo video è tratto da Feaster et al.17. Clicca qui per scaricare questo video.
| Parametro | CCM | Dopo |
| Ampiezza | 16 ± 4%** | 4 ± 5% |
| Tempo di picco 50% | -20 ± 9%* | 7 ± 5% |
| Tempo di picco del 90% | -22 ± 8%* | 6 ± 5% |
| Tempo al basale 50% | -8 ± 5% | 4 ± 4% |
| Tempo al basale 90% | -12 ± 6%* | 5 ± 5% |
| Durata della contrazione 10% | -13 ± 6% | 3 ± 5% |
| Durata della contrazione 50% | -6 ± 5 % | 3 ± 5% |
| Durata della contrazione 90% | 0 ± 5% | 3 ± 4% |
| N | 23 | 23 |
Tabella 1: Proprietà contrattili. Variazione percentuale rispetto a prima del CCM (5 V); i dati sono medi ± SEM per tutti i battiti in ciascun gruppo durante CCM (10 V) e dopo CCM (5 V). n = 23. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001. Questa tabella è stata ristampata da Feaster et al.17.
Discussione
Il protocollo qui descritto descrive un metodo per generare monostrati hiPSC-CM 2D robustamente contraenti su un substrato di idrogel a matrice extracellulare flessibile (ECM) con reagenti commerciali 7,17. Gli hiPSC-CM seminati sul substrato flessibile di idrogel rimangono vitali e hanno proprietà contrattili migliorate7. Questa tecnica si basa su attrezzature e capacità di laboratorio standard7. Ci sono diversi passaggi critici nel protocollo, anche in relazione al lavoro con il substrato idrogel a base di ECM, che richiedono un'attenta attenzione ai dettagli. Un potenziale problema è la presenza di siero nel mezzo. Ciò può comportare la formazione di reti hiPSC-CM (ad esempio, reti endoteliali / vascolari) invece di un foglio monostrato confluente; quindi, si raccomanda un mezzo privo di siero durante la creazione dei monostrati flessibili idrogel hiPSC-CM (cioè dal giorno 0 al giorno 4). Allo stesso modo, la preparazione di troppi substrati di idrogel contemporaneamente può causare substrati poveri o irregolari a causa dell'affaticamento dell'operatore. Mentre è importante lavorare rapidamente, l'integrità di ogni substrato di idrogel è fondamentale. Allo stesso modo, si dovrebbe seminare attentamente gli hiPSC-CM e cambiare il mezzo; Questo non dovrebbe essere fatto con forza. Quando si cambia il mezzo, deve essere aggiunto delicatamente dal bordo superiore del pozzetto in modo da non interrompere il substrato di idrogel o le cellule. Come con le colture hiPSC-CM 2D standard (cioè la coltura convenzionale di tessuti in plastica o vetro), la placcatura a bassa densità si tradurrà in una formazione monostrato incompleta. È importante ispezionare visivamente gli hiPSC-CM per confermare che si trovano sul substrato di idrogel e utilizzare un timer per garantire una temporizzazione accurata. Inoltre, la coltura dei monostrati 2D hiPSC-CM per più di 14 giorni sul substrato idrogel può causare la rottura del monostrato, in base alle proprietà ECM e alle istruzioni del produttore del substrato.
Ci sono diverse limitazioni al metodo attuale che devono essere considerate. In primo luogo, le celle utilizzate in questo protocollo provenivano da un fornitore commerciale di hiPSC-CM e quelle celle formano un sincizio di celle accoppiate elettricamente. Il sincizio contiene una miscela di hiPSC-CMs di tutti e tre i sottotipi cardiaci (ventricolare, atriale e nodale)17. Gli studi possono trarre beneficio da una popolazione hiPSC-CM esclusiva per sottotipo (cioè 100% ventricolare o 100% atriale). In secondo luogo, questo metodo ha utilizzato solo hiPSC-CMs, mentre i non-miociti, inclusi fibroblasti cardiaci, cellule endoteliali e neuroni, possono migliorare la funzionalità hiPSC-CM22,36. In terzo luogo, gli hiPSC-CM 2D mostrano diverse caratteristiche dei cardiomiociti relativamente immaturi, tra cui battito spontaneo, morfologia amorfa e mancanza di una risposta inotropa 8,37. In quarto luogo, mentre questo protocollo produce monostrati hiPSC-CM 2D fortemente contratti, è probabile che i modelli hiPSC-CM 3D funzionalmente migliorati come i tessuti cardiaci ingegnerizzati (ECT) si tradurranno in una risposta contrattile indotta da CCM migliorata sotto concentrazioni fisiologiche di calcio 8,38. Infine, il protocollo qui descritto è progettato per un formato a 48 pozzetti. Tuttavia, con l'ottimizzazione e l'inclusione dell'automazione, questo può essere scalato a un formato ad alta produttività (ad esempio, piastre a 96 pozzetti o 384 pozzetti).
L'attuale gold standard per gli studi hiPSC-CM sono le condizioni di coltura 2D rigide convenzionali (ad esempio, plastica o vetro). Sebbene utile per gli studi di elettrofisiologia3 e manipolazione del calcio39, la metodologia convenzionale si traduce in proprietà contrattili minime 5,6,7. Di conseguenza, le condizioni di coltura 2D rigida convenzionale non sono suscettibili di valutazione degli effetti contrattili della CCM8. I metodi 3D hiPSC-CM ECT funzionalmente migliorati38 sono tecnicamente impegnativi, richiedono tempo e richiedono apparecchiature sofisticate che non sono prontamente disponibili in tutti i laboratori. In questo protocollo, descriviamo una metodologia semplice per generare monostrati hiPSC-CM 2D robustamente contraenti in un lasso di tempo più breve rispetto ai metodi ECT 3D o ai metodi 2D convenzionali a lungo termine 7,40,41. Inoltre, i reagenti utilizzati qui sono disponibili in commercio, compreso il substrato di idrogel e gli hiPSC-CM, ed entrambi hanno una notevole consistenza da lotto a lotto. Mentre abbiamo utilizzato elettrodi a filo di platino rimovibili (distanza interelettrodo: 2,0 mm, larghezza: 1,0 mm), vari materiali e configurazioni degli elettrodi sono suscettibili di valutazioni contrattili CCM in vitro 8,15,17,18,22. Allo stesso modo, sono disponibili più software automatizzati che consentono l'analisi dei video di contrazione 7,31,32.
La maggior parte dei metodi non clinici per valutare la contrattilità dei dispositivi medici cardiaci si basa in gran parte su costosi modelli animali in vivo (ad esempio, cani o maiali) e strisce muscolari papillari tecnicamente impegnative (ad esempio, conigli)18. Questo articolo ha descritto un modello umano in vitro per valutare gli effetti dei segnali dei dispositivi medici di elettrofisiologia cardiaca sulla contrattilità. Questo strumento potrebbe ridurre la dipendenza dagli studi sugli animali ed essere utile per la valutazione in vitro delle proprietà contrattili dei dispositivi di elettrofisiologia cardiaca.
Divulgazioni
Questo articolo riflette le opinioni degli autori e non deve essere interpretato per rappresentare le opinioni o le politiche della Food and Drug Administration degli Stati Uniti. La menzione di prodotti commerciali, delle loro fonti o del loro uso in relazione al materiale qui riportato non deve essere interpretata come un'approvazione effettiva o implicita di tali prodotti da parte del Dipartimento della salute e dei servizi umani. Gli autori non dichiarano interessi concorrenti per questo lavoro.
Riconoscimenti
Questo lavoro è stato supportato in parte da una nomina al Programma di partecipazione alla ricerca presso il Center for Devices and Radiological Health amministrato dall'Oak Ridge Institute for Science and Education attraverso un accordo interagenzia tra il Dipartimento dell'Energia degli Stati Uniti e la Food and Drug Administration degli Stati Uniti. Gli autori ringraziano Richard Gray, Trent Robertson e Anna Avila per i loro suggerimenti e assistenza tecnica. Lo studio è stato finanziato attraverso la Food and Drug Administration degli Stati Uniti, Office of Science and Engineering Laboratories.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.1% Gelatin | STEMCELL Technologies | 7903 | Pre-plating Culture Substrate |
| 48-well Plate | MatTek | P48G-1.5-6-F | Hydrogel Substrate hiPSC-CM Culture, Glass |
| 6-well Plate | Thermofisher | 140675 | hiPSC-CM Culture, Plastic |
| B-27 Supplement, with insulin | Invitrogen | 17504-044 | Cardiomyocyte Media |
| Calcium Chloride dihydrate (CaCl2) | Fisher Scientific | c70-500 | Tyrode’s solution |
| CellOPTIQ Platform and Software | Clyde Biosciences | Contraction Recording and Analysis | |
| Conical tube 15 mL | Corning | 352099 | hiPSC-CM Dissociation |
| Digital CMOS Camera | Hamamatsu | C11440-42U30 | Contraction Video Recording |
| D-PBS | Life Technologies | 14190-144 | Cell Wash |
| Environmental Control Chamber | OKOLAB INC | H201-K-FRAME | Environmental Regulation |
| Glucose | Sigma-Aldrich | G8270-1kg | Tyrode’s solution |
| Hemocytometer | Fisher Scientific | 22-600-107 | hiPSC-CM Counting |
| HEPES | Sigma-Aldrich | H3375 | Tyrode’s solution |
| iCell Cardiomyocytes Plating Medium | Fujifilm Cellular Dynamic, Inc. | M1001 | hiPSC-CM Plating Media |
| iCell Cardiomyocytes2, 01434 | Fujifilm Cellular Dynamic, Inc. | R1017 | hiPSC-CMs |
| Incubator (37 °C, 5% CO2) | Thermofisher | 50116047 | Maintain hiPSC-CMs |
| Inverted Microscope | Olympus | IX73 | Imaging hiPSC-CMs |
| Magnesium Chloride hexahydrate (MgCl2) | Fisher Scientific | m33-500 | Tyrode’s solution |
| Matrigel Growth Factor Reduced Basement Membrane Matrix | Corning | 356230 | Flexible Hydrogel Substrate |
| Microcentrifuge tubes 1.5 ml | Fisher Scientific | 05-408-129 | Hydrogel Substrate Aliquot |
| Model 4100 Isolated High Power Stimulator | AM-Systems | Model 4100 | Pulse Generator |
| MyCell Cardiomyocytes DCM LMNA L35P, 01016 | Fujifilm Cellular Dynamic, Inc. | R1153 | DCM hiPSC-CMs |
| Pen-Strep | Invitrogen | 15140-122 | Cardiomyocyte Media |
| Pipette L-20 | Rainin | 17014392 | Plating Hydrogel Substrate |
| Pipette P1000 | Fisher Scientific | F123602G | |
| Pipette tips, 1000 ul | Fisher Scientific | 02-707-509 | |
| Pipette tips, 20 ul | Rainin | GPS-L10S | Making Hydrogel Substrate |
| Potassium Chloride (KCl) | Fisher Scientific | P330-500 | Tyrode’s solution |
| RPMI 1640, with glucose | Invitrogen | 11875 | Cardiomyocyte Media |
| Sodium Chloride (NaCl) | Fisher Scientific | s641-212 | Tyrode’s solution |
| Sodium Hydroxide (NaOH) | Sigma-Aldrich | 221465 | Tyrode’s solution |
| Stimulation Electrodes | Pacing and CCM Stimulation | ||
| Stopwatch/Timer | Fisher Scientific | 02-261-840 | Plating Hydrogel Substrate |
| Trypan Blue Stain | Life Technologies | T10282 | hiPSC-CM Counting |
| TrypLE Express | Life Technologies | 12605-010 | hiPSC-CM Dissociation |
Riferimenti
- Jackson, S. L., et al. National burden of heart failure events in the United States, 2006 to 2014. Circulation: Heart Failure. 11 (12), 004873 (2018).
- Cook, C., Cole, G., Asaria, P., Jabbour, R., Francis, D. P. The annual global economic burden of heart failure. International Journal of Cardiology. 171 (3), 368-376 (2014).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Yang, X., Ribeiro, A. J. S., Pang, L., Strauss, D. G. Use of human iPSC-CMs in nonclinical regulatory studies for cardiac safety assessment. Toxicology Sciences. 190 (2), 117-126 (2022).
- Zuppinger, C. 3D cardiac cell culture: A critical review of current technologies and applications. Frontiers in Cardiovascular Medicine. 6, 87 (2019).
- Huethorst, E., et al. Conventional rigid 2D substrates cause complex contractile signals in monolayers of human induced pluripotent stem cell-derived cardiomyocytes. The Journal of Physiology. 600 (3), 483-507 (2022).
- Feaster, T. K., et al. Matrigel mattress: A method for the generation of single contracting human-induced pluripotent stem cell-derived cardiomyocytes. Circulation Research. 117 (12), 995-1000 (2015).
- Feaster, T. K., et al. Acute effects of cardiac contractility modulation stimulation in conventional 2D and 3D human induced pluripotent stem cell-derived cardiomyocyte models. Frontiers in Physiology. 13, 1023563 (2022).
- Feaster, T. K. . Implementation of human-induced pluripotent stem cell-derived cardiomyocyte to model excitation-contraction coupling in health and disease. , (2015).
- Cadar, A. G., et al. Real-time visualization of titin dynamics reveals extensive reversible photobleaching in human induced pluripotent stem cell-derived cardiomyocytes. American Journal of Physiology-Cell Physiology. 318 (1), 163-173 (2020).
- Parikh, S. S., et al. Thyroid and glucocorticoid hormones promote functional T-tubule development in human-induced pluripotent stem cell-derived cardiomyocytes. Circulation Research. 121 (12), 1323-1330 (2017).
- Wang, L., et al. Hypertrophic cardiomyopathy-linked mutation in troponin T causes myofibrillar disarray and pro-arrhythmic action potential changes in human iPSC cardiomyocytes. Journal of Molecular and Cellular Cardiology. 114, 320-327 (2018).
- Campbell, C. M., Kahwash, R., Abraham, W. T. Optimizer Smart in the treatment of moderate-to-severe chronic heart failure. Future Cardiology. 16 (1), 13-25 (2020).
- PMA P180036. FDA Summary of Safety and Effectiveness Data. Food and Drug Administration Available from: https://www.accessdata.fda.gov/cdrh_docs/pdf18/P180036B.pdf (2019)
- Blinova, K., et al. Acute effects of nonexcitatory electrical stimulation during systole in isolated cardiac myocytes and perfused heart. Physiological Reports. 2 (8), 12106 (2014).
- Sabbah, H. N., et al. Cardiac contractility modulation with the impulse dynamics signal: Studies in dogs with chronic heart failure. Heart Failure Reviews. 6 (1), 45-53 (2001).
- Feaster, T. K., Casciola, M., Narkar, A., Blinova, K. Acute effects of cardiac contractility modulation on human induced pluripotent stem cell-derived cardiomyocytes. Physiological Reports. 9 (21), 15085 (2021).
- Brunckhorst, C. B., Shemer, I., Mika, Y., Ben-Haim, S. A., Burkhoff, D. Cardiac contractility modulation by non-excitatory currents: Studies in isolated cardiac muscle. European Journal of Heart Failure. 8 (1), 7-15 (2006).
- Mohri, S., et al. Cardiac contractility modulation by electric currents applied during the refractory period. American Journal of Physiology-Heart and Circulatory Physiology. 282 (5), 1642-1647 (2002).
- Mohri, S., et al. Electric currents applied during refractory period enhance contractility and systolic calcium in the ferret heart. American Journal of Physiology-Heart and Circulatory Physiology. 284 (4), 1119-1123 (2003).
- Burkhoff, D., et al. Electric currents applied during the refractory period can modulate cardiac contractility in vitro and in vivo. Heart Failure Reviews. 6 (1), 27-34 (2001).
- Narkar, A., Feaster, T. K., Casciola, M., Blinova, K. Human in vitro neurocardiac coculture (ivNCC) assay development for evaluating cardiac contractility modulation. Physiological Reports. 10 (21), 15498 (2022).
- Harris, K., et al. Comparison of electrophysiological data from human-induced pluripotent stem cell-derived cardiomyocytes to functional preclinical safety assays. Toxicological Sciences. 134 (2), 412-426 (2013).
- Blinova, K., et al. Comprehensive translational assessment of human-induced pluripotent stem cell derived cardiomyocytes for evaluating drug-induced arrhythmias. Toxicological Sciences. 155 (1), 234-247 (2017).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), 2006-2017 (2011).
- Burridge, P. W., Holmstrom, A., Wu, J. C. Chemically defined culture and cardiomyocyte differentiation of human pluripotent stem cells. Current Protocols in Human Genetics. 87, 1-15 (2015).
- Cadar, A. G., Feaster, T. K., Durbin, M. D., Hong, C. C. Production of single contracting human induced pluripotent stem cell-derived cardiomyocytes: Matrigel mattress technique. Current Protocols in Stem Cell Biology. 42, 1-7 (2017).
- Narkar, A., Willard, J. M., Blinova, K. Chronic cardiotoxicity assays using human induced pluripotent stem cell-derived cardiomyocytes (hiPSC-CMs). International Journal of Molecular Sciences. 23 (6), 3199 (2022).
- OPTIMIZER® Smart Implantable Pulse Generator INSTRUCTIONS FOR USE. ImpulseDynamics Available from: https://impulse-dynamics.com/wp-content/uploads/2020/05/13-290-008-01-US-Rev-01-OPT-Smart-IPG-IFU.pdf (2018)
- OPTIMIZER™ Smart Mini Implantable Pulse Generator INSTRUCTIONS FOR USE. ImpulseDynamics Available from: https://impulse-dynamics.com/wp-content/uploads/2021/02/13-290-011-EU-Rev-00-OPTIMIZER-Smart-Mini-IPG-IFU-EU.pdf (2019)
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), 5-16 (2018).
- Grune, T., Ott, C., Haseli, S., Hohn, A., Jung, T. The "MYOCYTER" - Convert cellular and cardiac contractions into numbers with ImageJ. Scientific Reports. 9, 15112 (2019).
- Masarone, D., et al. Use of cardiac contractility modulation as bridge to transplant in an obese patient with advanced heart failure: A case report. Frontiers in Cardiovascular Medicine. 9, 833143 (2022).
- Nadeem, M., Tariq, E. F., Aslam, H. M., Illahi, Y., Shah, R. All-cause mortality outcomes of usage of cardiac contractility modulation in patients with dilated cardiomyopathy ineligible for cardiac re-synchronization therapy: An updated meta-analysis of randomized controlled trials. Cureus. 12 (9), 10627 (2020).
- Manganelli, G., et al. Use of cardiac contractility modulation in an older patient with non-ischemic dilated cardiomyopathy: A case report. Clinics and Practice. 11 (4), 835-840 (2021).
- Mannhardt, I., et al. Automated contraction analysis of human engineered heart tissue for cardiac drug safety screening. Journal of Visualized Experiments. (122), e55461 (2017).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756 (2020).
- Feric, N. T., et al. Engineered cardiac tissues generated in the Biowire™ II: A platform for human-based drug discovery. Toxicology Sciences. 172 (1), 89-97 (2019).
- Hwang, H. S., et al. Human induced pluripotent stem cell (hiPSC) derived cardiomyocytes to understand and test cardiac calcium handling: A glass half full. Journal of Molecular and Cellular Cardiology. 89, 379-380 (2015).
- Lundy, S. D., Zhu, W. Z., Regnier, M., Laflamme, M. A. Structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Stem Cells and Development. 22 (14), 1991-2002 (2013).
- Stoehr, A., et al. Automated analysis of contractile force and Ca2+ transients in engineered heart tissue. American Journal of Physiology-Heart and Circulatory Physiology. 306 (9), 1353-1363 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon