Method Article
زرع قنية داخل الجمجمة لمستقبلات المستضد الخيمري التسلسلي (CAR) في الخلايا التائية في الفئران
In This Article
Summary
أورام الجهاز العصبي المركزي (CNS) هي السبب الرئيسي للوفاة المرتبطة بالسرطان لدى الأطفال ، ويتم اختبار العلاجات القائمة على المناعة المحلية بشكل متزايد للمرضى في التجارب السريرية. يصف هذا البروتوكول طرق زرع القنية الموضعية في الفئران للتقييم قبل السريري للدفعات المناعية التي تستهدف أورام الجهاز العصبي المركزي.
Abstract
أورام الجهاز العصبي المركزي لدى الأطفال مسؤولة عن غالبية الوفيات المرتبطة بالسرطان لدى الأطفال ولديها توقعات سيئة ، على الرغم من التقدم في العلاج الكيميائي والعلاج الإشعاعي. نظرا لأن العديد من الأورام تفتقر إلى العلاجات الفعالة ، فهناك حاجة ماسة لتطوير خيارات علاجية واعدة أكثر ، مثل العلاجات المناعية. استخدام العلاج بالخلايا التائية لمستقبلات المستضد الخيمري (CAR) الموجه ضد أورام الجهاز العصبي المركزي له أهمية خاصة. يتم التعبير عن أهداف سطح الخلية مثل B7-H3 و IL13RA2 و disialoganglioside GD2 بشكل كبير على سطح العديد من أورام الجهاز العصبي المركزي للأطفال والبالغين ، مما يزيد من فرصة استخدام العلاج بالخلايا التائية CAR T ضد هذه الأهداف السطحية وغيرها. لتقييم التسليم الموضعي المتكرر للخلايا التائية ذات مستقبلات المستضدات الخيمرية في نماذج الفئران قبل السريرية ، تم إنشاء نظام قسطرة ساكن يلخص القسطرة الساكنة المستخدمة حاليا في التجارب السريرية البشرية. على عكس الولادة التجسيمية ، يسمح نظام القسطرة الساكنة بالجرعات المتكررة دون استخدام عمليات جراحية متعددة. يصف هذا البروتوكول الموضع داخل الورم لقنية توجيه ثابتة تم استخدامها لاختبار ضخ الخلايا التائية CAR T التسلسلي بنجاح في نماذج الفئران التقويمية لأورام الدماغ لدى الأطفال. بعد حقن تقويم العظام وتطعيم الخلايا السرطانية في الفئران ، يتم الانتهاء من وضع قنية إرشادية ثابتة داخل الورم على جهاز تجسيمي وتثبيتها بمسامير وراتنج أكريليك. ثم يتم إدخال قنيات العلاج من خلال قنية التوجيه الثابتة لتوصيل الخلايا التائية ذات مستقبلات المستضدات الخيمرية المتكررة. يمكن تعديل الوضع التجسيمي للقنية الموجهة لتوصيل الخلايا التائية ذات مستقبلات المستضدات الخيمرية مباشرة إلى البطين الجانبي أو مواقع أخرى في الدماغ. توفر هذه المنصة آلية موثوقة للاختبار قبل السريري للحقن المتكرر داخل الجمجمة للخلايا التائية ذات مستقبلات المستضدات الخيمرية وغيرها من العلاجات الجديدة لهذه الأورام المدمرة لدى الأطفال.
Introduction
على الرغم من التحسينات في العلاج الكيميائي والعلاج الإشعاعي والجراحة ، فإن أورام الجهاز العصبي المركزي (CNS) هي أكثر الأورام الخبيثة فتكا في طب الأطفال1 ، مما يؤكد الحاجة المهمة لأساليب جديدة ذات نتائج أكثر نجاحا. مع التقدم الكبير في مجال العلاج المناعي ، أظهرت مناهج العلاج الخلوي بالتبني (ACT) نتائج واعدة في العديد من أنواع السرطان ، وخاصة الأورام الخبيثة الدموية2. يستفيد العلاج بالخلايا التائية لمستقبلات المستضد الخيمري (CAR) ، وهو نوع معين من ACT ، من القدرة الطبيعية للجهاز المناعي على التعرف على الخلايا الضارة وقتلها عن طريق إعادة توجيه خصوصية الخلايا التائية لتوليد الخلايا التائية التي تستهدف الورم3. أظهر العلاج بالخلايا التائية ذات مستقبلات المستضدات الخيمرية نجاحا كبيرا في علاج اللوكيميا والأورام اللمفاوية4 ، مما يجعله نهجا علاجيا مناعيا واعدا ويشجع على التحقيق في الأورام الصلبة. ومع ذلك ، حتى الآن ، حقق العلاج بالخلايا التائية ذات مستقبلات المستضدات الخيمرية في الأورام الصلبة نجاحا سريريا ضئيلا ويواجه العديد من التحديات ، مثل اختراق الورم غير الفعال ، والمستضدات المحدودة القابلة للاستهداف ، والبيئة المكروية القمعيةللورم 5.
بدأت التجارب السريرية الأخيرة في تقييم العلاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية لأورام الجهاز العصبي المركزي لدى الأطفال ، مما يوفر دليلا على المفهوم والأدلة المبكرة على نشاط الخلايا التائية في التقارير الأولية6،7،8. بينما ركزت معظم البيانات الأولية قبل السريرية على التوصيل الوريدي للخلايا التائية ذات مستقبلات المستضدات الوهمية ، فقد أشارت الأدلة قبل السريرية الحديثة إلى تفوق التسليم الموضعي في الجهاز العصبي المركزي9،10 ، والذي تم استخدامه أيضا بنجاح في العديد من التجارب السريرية6،7،8،11. اعتمدت الدراسات قبل السريرية حتى الآن التي أدرجت التسليم الموضعي للخلايا التائية ذات مستقبلات المستضدات الخيمرية في الجهاز العصبي المركزي على جرعة واحدة داخل الجمجمة من الخلايا التائية ذات مستقبلات المستضدات الخيمرية التي يتم تسليمها بشكل تجسيمي 9,10. ومع ذلك ، فقد تطلبت التجارب السريرية على البشر دفعات متكررة من الخلايا التائية ذات مستقبلات المستضدات الخيمرية في الجهاز العصبي المركزي6،7،8،11 ، مما يؤكد الحاجة إلى تقييم الحقن المتكررة المتعددة في التطور قبل السريري. الهدف من هذا الإجراء هو اختبار ضخ الخلايا التائية ذات مستقبلات المستضدات الخيمرية بنجاح باستخدام قسطرة في نماذج الفئران التقويمية لأورام الدماغ لدى الأطفال. ميزة هذه التقنية هي تجنب العمليات الجراحية المتعددة لتوفير علاجات متكررة داخل الجهاز العصبي المركزي. تم استخدام الكانيولا في المقام الأول لأخذ عينات غسيل الكلى الدقيقة من الناقلات العصبية وتوصيل المواد العصبية في علم الأعصاب والبحوث السلوكية في القوارض12 ، مع تقارير محدودة عن استخدامها لتقديم العلاجات المضادة للسرطان. بناء على التقارير السابقة ، يستخدم هذا البروتوكول نظام قنية ساكنة موضوعة بشكل تجسيمي لتوصيل خلايا CAR T في نماذج الفئران ذات الطعم الأجنبي لأورام الجهاز العصبي المركزي. يمكن استخدام البروتوكول لاختبار علاجات إضافية في نماذج الفئران للاضطرابات العصبية أو العصبية للأورام ، وقد يكون مفيدا لاختبار علاجات جديدة حيث يكون تجاوز الحاجز الدموي الدماغي أمرا بالغ الأهمية للفعالية.
Protocol
تمت الموافقة على جميع إجراءات البروتوكول من قبل اللجنة المؤسسية لرعاية واستخدام الحيوانات في مستشفى الأطفال في فيلادلفيا (IAC 19-000907) ، المعتمدة من قبل AAALAC. استخدمت هذه الدراسة فئران NOD scid gamma (NSG) البالغة من العمر 6-12 أسبوعا مع أورام xenograft التقويمية. ومع ذلك ، يمكن استخدام البروتوكول على أي سلالة ماوس. تم إيواء الفئران NSG في ظروف حاجز معقم وأجريت الجراحة تحت خزانات السلامة البيولوجية المعقمة. عند استخدام المواد البشرية مثل الخلايا السرطانية أو الخلايا التائية ، يجب إكمال الإجراءات والمناولة في خزانات السلامة الحيوية ABSL-2.
1. تحضير الفأر للجراحة
- تخدير الفأر في غرفة الحث مع الأيزوفلوران (2-4٪) بمعدل تدفق أكسجين 1 لتر / دقيقة حتى يتم الوصول إلى مستوى مناسب من التخدير (حوالي 5 دقائق).
- وزن الفأر باستخدام ميزان لأقرب 0.1 جم وتطبيق البوبرينورفين بطيء الإطلاق (SR) تحت الجلد (1 ملغ/كغ) أو مسكن آخر.
ملاحظة: يوفر SR البوبرينورفين تسكين لمدة 72 ساعة. - حلق الفراء في الجزء العلوي من رأس الفأر باستخدام كليبرز كهربائي أو عوامل إزالة الشعر.
- استخدم ملعقة لفتح الجزء السفلي من الذراع التجسيمي برفق وأدخل قنية التوجيه باستخدام الملقط. أحكم ربط المسمار على الذراع لتأمين القنية بحيث يبرز ما يقرب من 1/2 إلى 2/3 من الجزء البلاستيكي الأبيض من القنية من أسفل الفتحة ، جنبا إلى جنب مع طول القنية المعدني البالغ 5 مم.
- أدخل وثبت الأسنان العلوية للفأر في شريط العضة لجهاز التجسيم. اسحب مخروط الأنف للأمام وشده ، مع التأكد من أن الماوس يستنشق الأيزوفلوران.
- قم بتركيب الماوس على جهاز التجسيم الدافئ باستخدام أصفاد الأذن أو قضبان الأذن ، وتجنب الضغط المفرط.
ملاحظة: يجب أن تحتوي صينية التسخين على مقياس حرارة مستقيمي ، ويجب ضبط درج التسخين للحفاظ على درجة حرارة الجسم الطبيعية للماوس أثناء الإجراء. - ضع مرهما معقم للعين على كلتا العينين باستخدام قضيب ذو رأس قطني.
- امسح موقع الجراحة باستخدام البوفيدون اليود على وسادة أو قضيب ، متبوعا بوسادة كحولية. نفذ هذه الخطوة ثلاث مرات في المجموع.
- قبل البدء في الإجراء ، قم بإجراء قرصة إصبع القدم بالملقط لتقييم التخدير الكافي.
2. الإجراء الجراحي
ملاحظة: تستخدم جميع جوانب الإجراء الجراحي أدوات معقمة وتقنيات معقمة. تستمر الفئران تحت التخدير مع الأيزوفلوران (2-4٪) طوال مدة الإجراء ، حوالي 10-20 دقيقة.
- التقط فروة الرأس برفق بين الأذنين بالملقط. باستخدام مقص معقم ، قم بقص فروة الرأس المرفوعة بالتوازي مع الجمجمة وإزالة رفرف بيضاوي من الجلد (طوله 0.75-1 سم) لكشف الجمجمة.
ملاحظة: يفضل المقص على المشرط لتوفير فتحة نظيفة بيضاوية الشكل ولمنع الضرر غير الضروري للجلد والأنسجة المحيطة. - ادفع اللفافة بعيدا باستخدام مشرط أو مسحات ذات رؤوس قطنية وحبيبات قطنية مرقئ للمساعدة في إبطاء النزيف المفرط حسب الحاجة.
ملاحظة: يمكن أن يؤدي استخدام الجانب الخشبي من طرف قطني معقم أيضا إلى إبعاد اللفافة والمساعدة في تجنب النزيف المفرط. - تحديد المعالم bregma و lambda ، والعلامات الأمامية والخلفية على الجمجمة حيث تلتقي لوحات الجمجمة13.
ملاحظة: يمكن زيادة تحديد الهوية عن طريق مسح الجزء العلوي من الجمجمة المكشوفة باستخدام بيروكسيد الهيدروجين. - سجل الجمجمة برفق باستخدام مشرط لإنشاء سطح لربط الأكريليك. يجب أن يتضمن التسجيل خطوطا خطية متعددة يبلغ طولها حوالي 0.5-1 سم بزاوية 90 درجة لبعضها البعض.
- باستخدام الذراع المجسمة ، قم بتوطين القنية إلى المعلم المثير للاهتمام (bregma أو lambda). بمجرد تحديد موقعها ، ارفع طرف القنية 1-2 مم فوق سطح الجمجمة وانتقل إلى الإحداثيات المطلوبة. بالنسبة للحقن داخل الورم ، يستخدم هذا نفس إحداثيات A / P و M / L مثل موضع الورم.
- على الجمجمة المكشوفة ، بعيدا عن المنطقة التي ستدخل فيها القنية ، قم بعمل فتحتين لولبيتين بإبرة 18 G أو مثقاب جراحي. تأكد من أن الثقوب متباعدة لتشمل مساحة كافية للقنية. باستخدام مثقاب ، قم بتحريف ثقوب المسمار حتى تمسك بالجمجمة. أدخل وربط اثنين من البراغي في الثقوب باستخدام مفك البراغي مسطح الرأس. ثم اسحب البراغي برفق للتأكد من تثبيتها.
ملاحظة: لا تقم بإدخال البراغي حتى تتدفق مع الجمجمة ، وإلا فقد تتلف دماغ الفأر تحتها. اترك فجوة 1-2 مم على الأقل بين المسمار والجمجمة. - باستخدام إبرة 18 G أو المثقاب الجراحي ، قم بالحفر من خلال الجمجمة عند الإحداثيات المحددة لإنشاء ثقب لإدخال القنية.
- باستخدام ذراع التوضيع التجسيمي ، اخفض القنية إلى إحداثيات D / V المطلوبة.
ملاحظة: يحتاج إحداثي D / V لزرع القنية إلى حساب طول إسقاط الدمية وقنيات العلاج ، وقد يكون أكثر سطحية من الحقن التقويمي للخلايا السرطانية (الشكل 1). - في صفيحة من 12 بئرا من البورسلين ، املأ بئرا واحدا بمسحوق راتنج الأكريليك (حوالي 0.3 جم) و 10-15 قطرة (حوالي 0.5-0.75 مل) من سائل راتنج الأكريليك. هذا ينتج مادة بيضاء لزجة. ضع الخليط في حقنة سعة 1 مل واستخدمه لطلاء الجمجمة وتغطيتها ، وملء الفراغات حول القنية والبراغي.
ملاحظة: تتصلب المادة اللزجة إلى أسمنت بمرور الوقت ، لذلك يجب إكمال هذه الخطوة على الفور بعد الخلط. - بينما لا يزال الأسمنت مرنا ، قم بفك المسمار الموجود على ذراع التوضيع التجسيمي واستخدم ملعقة في الفتحة الموجودة في الأسفل لتحرير القنية برفق من الحامل واسحب ذراع التوضيع التجسيمي ببطء لأعلى بعيدا عن الماوس.
- بمجرد أن يجف الأسمنت تماما ، أدخل القنية الوهمية في قنية التوجيه وقم بتثبيتها بإحكام عن طريق الدوران في اتجاه عقارب الساعة.
- بمجرد اكتمال الإجراء ، ضع الفأر مرة أخرى في قفصه المنزلي الدافئ للمراقبة بعناية ، وضمان التعافي الكافي وتسجيل أي ملاحظات بعد الإجراء ، بما في ذلك أن الفأر قد استعاد وعيه بالكامل ، قبل العودة إلى المستعمرة.
ملاحظة: يوصى عموما بوضع نصف القفص فقط على وسادة تدفئة للسماح للحيوان بالانتقال إلى الجانب الأكثر برودة لتجنب ارتفاع درجة الحرارة. - يجب تطبيق مسكنات إضافية حسب الحاجة إذا أظهرت الفئران سلوكيات تدل على الألم بعد الجراحة، مثل ميلوكسيكام 5 ملغ/كغ تحت الجلد مرة واحدة يوميا لمدة تصل إلى 3 أيام.
3. تحضير الخلايا التائية ذات مستقبلات المستضدات الخيمرية
- قم بقياس تركيز الخلايا التائية ذات مستقبلات المستضدات الخيمرية قبل نقلها باستخدام عداد الخلايا.
- خلايا T مسبقة النقل بالطرد المركزي عند 200 × جم لمدة 5 دقائق في درجة حرارة الغرفة (RT).
- نضح المادة الطافية باستخدام ماصة باستور معقمة على نظام شفط فراغ وإعادة تعليق الحبيبات في محلول ملحي مخزن من الفوسفاتي (PBS) إلى التركيز المطلوب. أحجام التسليم النموذجية هي 2-5 ميكرولتر. جرعات الخلايا النموذجية هي 0.5-5 × 106 خلايا.
4. ضخ الخلايا التائية CAR
- قم بإعداد قنية العلاج عن طريق تغذية الجزء العلوي من خلال قطعة صغيرة من أنابيب PKG.
- املأ حقنة العلاج بتعليق الخلايا التائية ذات مستقبلات المستضدات الخيمرية وأدخلها من خلال الطرف الآخر من أنبوب PKG ، وهو ما يكفي لتغطية الجزء العلوي من قنية العلاج.
- تخدير الفأر بالإيزوفلوران (2-4٪) بمعدل تدفق أكسجين 1 لتر / دقيقة.
- ثبت قنية التوجيه باستخدام ملقط في القاعدة ، ثم قم بفك وإزالة القنية الوهمية بعناية ، مما يسمح بالوصول إلى قنية التوجيه.
ملاحظة: الإعداد التجسيمي ليس ضروريا ، ولكن يمكن استخدامه لتثبيت الرأس للعلاج. - نقع الخلايا التائية ذات مستقبلات المستضدات الخيمرية لمدة دقيقة واحدة وثبت قنية العلاج في مكانها لمدة دقيقة إضافية بعد التوقف عن التسريب.
- قم بإزالة قنية العلاج وربط القنية الوهمية بإحكام في مكانها.
- يجب تطبيق ميلوكسيكام تحت الجلد (5 ملغ/ كغ) للتحكم الاختياري في الألم.
النتائج
زرع قنية ناجحة في الجهاز العصبي المركزي للفأر
الفئران ذات القنية الناجحة لديها قنية إرشادية آمنة في مكانها ، والتي لا تتداخل مع أنشطة الحياة اليومية (الشكل 2 أ) والتي يمكنها بسهولة تمرير قنية العلاج وتوصيل السوائل دون مقاومة (الشكل 2 ب). في تجربتنا ، تظل غالبية القنية في مكانها لأكثر من 4 أسابيع ، على الرغم من أنه يمكن إزاحة 0-25٪ بمرور الوقت. يمكن تأكيد التحقق من الموضع الصحيح باستخدام صبغة إيفانز الزرقاء المحقونة في القنية. على سبيل المثال ، تظهر قنية يتم إدخالها في البطين الجانبي صبغة إيفانز الزرقاء في جميع أنحاء نظام البطين أثناء انتقالها عبر السائل النخاعي الدماغي ، مما يؤكد الموضع الصحيح (الشكل 2C). تظهر القنية التي يتم إدخالها في الورم صبغة إيفانز الزرقاء في موقع زرع الورم.
التسليم الفعال للخلايا التائية ذات مستقبلات المستضدات الخيمرية إلى الجهاز العصبي المركزي لعلاج أورام الطعم الخارجي.
يمكن قياس فعالية نظام القنية داخل الجمجمة والفعالية العلاجية للخلايا التائية ذات مستقبلات المستضدات الخيمرية في نماذج الفئران من خلال مجموعة متنوعة من الآليات ، بما في ذلك التصوير الحيوي والبقاء على قيد الحياة بشكل عام. تم اختبار الخلايا التائية CAR T الموجهة من GPC2 ضد نماذج الورم الأرومي النخاعي والورم الدبقي المنتشر في خط الوسط ، 7316-4509 و 7316-3058 ، على التوالي ، باستخدام جرعات متكررة من الخلايا التائية CAR T عبر نظام القنية داخل الجمجمة14. تم تأكيد وضع الورم التقويمي وتطعيمه عن طريق التصوير الحيوي ، وتم وضع القنية في سرير الورم باستخدام نفس الإحداثيات مثل وضع الورم التقويمي. تألفت العلاجات من ضخ الخلايا التائية GPC2 CAR مرة إلى مرتين في الأسبوع لمدة 2-4 أسابيع ، بإجمالي أربع إلى ست جرعات. بعد العلاج ، تسبب العلاج بالخلايا التائية ذات مستقبلات المستضدات الخيمرية الموجهة من GPC2 في انحدار كبير للورم في نموذج الورم الأرومي النخاعي 7316-4509 (p < 0.01) (الشكل 3A) والبقاء على قيد الحياة لفترة طويلة بشكل كبير في الورم الدبقي في خط الوسط المنتشر المهادي 7316-3058 (p < 0.05) (الشكل 3B) 14.

الشكل 1: توجيه القنية مع دمية الإسقاط وقنية العلاج . (أ) قنية إرشادية بإسقاط 0.5 مم وقنيات وهمية إسقاط 2 مم في مكانها. (ب) قنية توجيه مع قنيات معالجة إسقاط 0.5 مم وإسقاط 2 مم في مكانها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
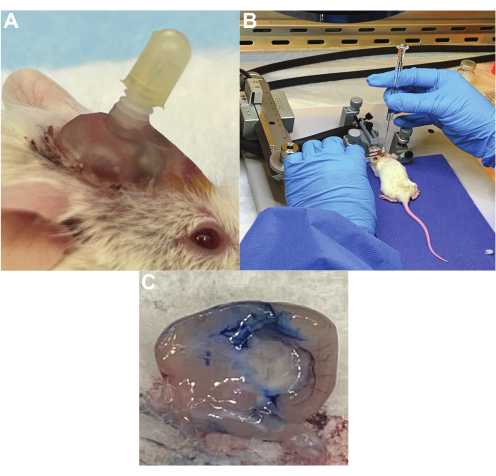
الشكل 2: نظام توصيل قنية العلاج للجرعات المتكررة من الخلايا التائية ذات مستقبلات المستضدات الوهمية. أ: قنية مزروعة في جمجمة فأر مع وجود غطاء في مكانه عندما لا يكون قيد الاستخدام. (ب) ضخ الخلايا التائية ذات مستقبلات المستضدات الوهمية في ورم جسري عبر قنية العلاج أثناء تخدير الفأر. ج: التحقق من وضع القنية في البطين الجانبي باستخدام صبغة إيفانز الزرقاء. تم إدخال الصبغة من خلال القنية ، تليها القتل الرحيم واستئصال الدماغ ، مع وجود صبغة في جميع أنحاء البطينين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
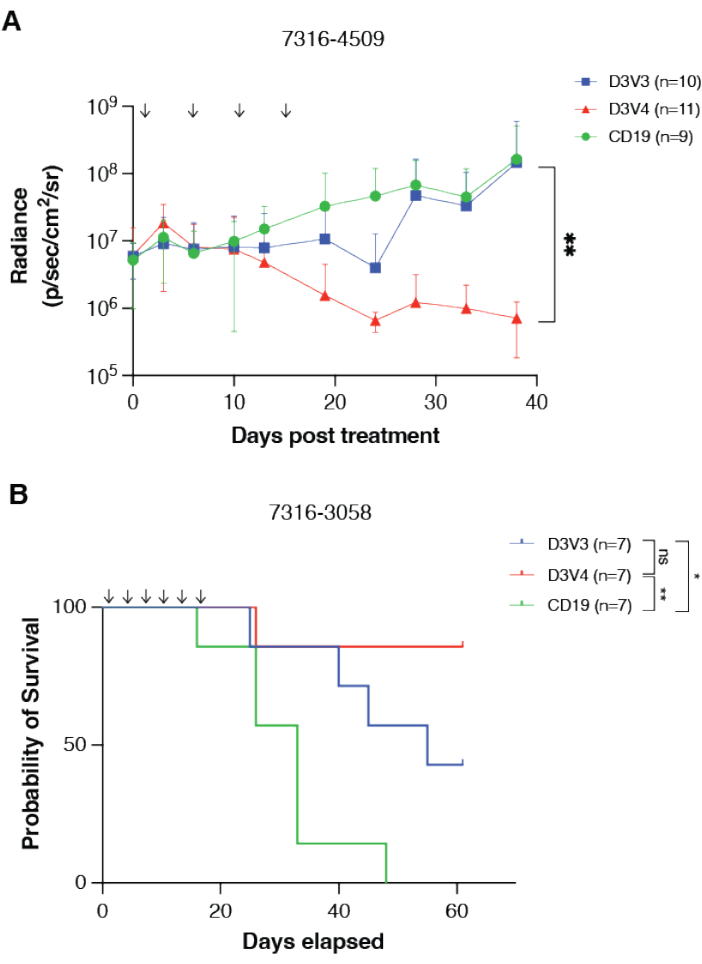
الشكل 3: تتوسط الخلايا التائية ذات مستقبلات المستضدات الخيمرية الموجهة ل GPC2 الاستجابات المضادة للأورام وتطيل البقاء على قيد الحياة في أورام الدماغ لدى الأطفال في الجسم الحي . (أ) القياس الكمي للتلألؤ الحيوي للمجموعة 4 من الورم الأرومي النخاعي xenograft 7316-4509 المعالج إما بخلايا mRNA CAR T الموجهة من GPC2 أو CD19. يشار إلى الجرعات بالأسهم على الرسم البياني. يتم عرض البيانات كمتوسط مع SD ، n = 9-11 فئران لكل ذراع. (ب) البقاء على قيد الحياة بشكل عام للفئران المزروعة بطعم خارجي DMG 7316-3058 المهادي المعالج بست جرعات متكررة من 2 × 106 خلايا CAR T. يشار إلى الجرعات بالأسهم على الرسم البياني. ن = 7 فئران لكل ذراع. ** ع < 0.01 ؛ * ص < 0.05 ؛ ns = غير مهم. وقد استنسخ هذا الرقم بإذن من فوستر وآخرين.14. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
أحدث العلاج بالخلايا التائية ذات مستقبلات المستضدات الخيمرية ثورة في علاج سرطانات الدم ويظهر قيمة واعدة في علاج أورام المخ الصلبة6،7،8. تم تصميم هذا البروتوكول لتمكين التقييم قبل السريري لتوصيل الخلايا التائية ذات مستقبلات المستضدات الخيمرية المحلية لعلاج أورام الجهاز العصبي المركزي لدى الأطفال. يكرر نظام القنية خزان Ommaya أو Rickham ، وهو نظام قسطرة داخل البطيني يستخدم حاليا في التجارب السريرية الجارية للعلاج بالخلايا التائية CAR T في أورام الجهاز العصبي المركزي للأطفال6،7،8 ، مما يؤكد أهمية هذه الأساليب وإمكاناتها الانتقالية. يسمح هذا النظام بالتسليم المتكرر للخلايا التائية ذات مستقبلات المستضدات الخيمرية التي تتجاوز الحاجز الدموي الدماغي ، مرة أخرى على غرار الأساليب المستخدمة في التجارب السريرية الجارية. ويمكن أن يوفر التسليم الموضعي أقصى قدر من الفعالية في الجهاز العصبيالمركزي 9 وقد يقلل أيضا من خطر السمية الجهازية المرتبطة بالاتجار من الدورة15. في حين أن التسليم التجسيمي يمكن أن يوفر جرعة واحدة في الجهاز العصبي المركزي ، فإن ميزة هذا النظام هي فرصة توفير جرعات متكررة متعددة في مكان محدد في الجهاز العصبي المركزي دون الحاجة إلى عمليات جراحية متعددة. وتشمل قيود هذا الإجراء وجود موقع تسليم ثابت دون القدرة على تغيير الموقع أو إجراء تعديلات بمجرد وضع القنية في مكانها، وإمكانية إزاحة القنية.
تتمثل إحدى الخطوات الحاسمة في هذا البروتوكول في زرع قنية التوجيه الثابتة عند إحداثيات D / V التي تأخذ في الاعتبار إسقاط قنيات العلاج. ستبرز قنية العلاج خارج طرف قنية التوجيه ، لذا يجب توخي الحذر لضمان أن يؤدي التنسيب إلى توصيل الخلايا التائية ذات مستقبلات المستضدات الخيمرية إلى المنطقة المعنية. يمكن تخصيص أطوال إسقاط قنية العلاج ، وفي تجربة المؤلف ، 0.5 مم هو طول إسقاط مفيد. يضمن هذا الطول عدم بقاء العلاج في قنية التوجيه عند الاستغناء ، ولكنه لا يتطلب أيضا تعديلا كبيرا لإحداثيات D / V لقنية التوجيه إلى المنطقة المعنية. خطوة إضافية مهمة في هذا البروتوكول هي الوقت الذي تترك فيه قنية العلاج في مكانها بعد ضخ الخلايا التائية ذات مستقبلات المستضدات الخيمرية الخيمرية (CAR T). يجب تثبيت قنية العلاج في مكانها لمدة 1 دقيقة على الأقل بعد نهاية التسريب ، لمنع التسربات وفقدان التوصيل الموضعي للعلاج بالخلايا التائية ذات مستقبلات المستضدات الخيمرية .
استكشاف أخطاء هذه الطريقة واضحة ومباشرة ، حيث تتضمن معظم المضاعفات صعوبة في إزالة القنية الوهمية أو إدخال قنية العلاج في قنية التوجيه الثابتة ، ويرجع ذلك على الأرجح إلى جفاف الدم داخل القنية التوجيهية. يمكن حل ذلك بسهولة عن طريق تمرير القنية الوهمية برفق عبر قنية التوجيه حتى تقل المقاومة ويتم إزالة الحطام. يمكن أن يزيح راتنج الأكريليك أحيانا من الجمجمة ، مما يؤدي إلى فقدان نظام القنية. في تجربتنا ، يكون هذا محدودا بشكل عام عن طريق تسجيل الجمجمة بمشرط ووضع مسمارين. بالإضافة إلى ذلك ، تتم إزالة أي عناصر من القفص قد تطبق القوة عن طريق الخطأ على القنية أثناء تحرك الماوس ، مثل أكواخ تخصيب الماوس الخاصة ذات الفتحات الصغيرة.
في الختام ، الموصوف هنا هو بروتوكول لإدخال نظام قنية في نماذج الفئران من أورام الجهاز العصبي المركزي للتسليم المتكرر للخلايا التائية CAR. يمكن تعديل وضع القنية إلى مواقع تسليم محلية متعددة ، واختبار فعالية مواقع التسليم المختلفة. بالإضافة إلى ذلك ، يمكن استخدام هذا النظام لعلاجات إضافية تتجاوز الخلايا التائية ذات مستقبلات المستضدات الخيمرية لتقييم الفعالية عند تجاوز الحاجز الدموي الدماغي ، وقد يكون مفيدا أيضا لتقييم العلاجات في نماذج الفئران للاضطرابات غير الأورام.
Disclosures
يحمل JBF براءة اختراع تتعلق بالعلاجات المناعية الموجهة ل glypican 2 (GPC2). جميع المؤلفين الآخرين ليس لديهم ما يكشفون عنه.
Acknowledgements
تم توفير التمويل لهذا العمل من قبل مؤسسة ماثيو لارسون ، ومؤسسة غرايسون ينقذ ، وجائزة هيونداي هوب أون ويلز للمحقق الشاب ، ومؤسسة كورتني روز ، والمعاهد الوطنية للصحة NCI K12 CA076931-19 و 1K08CA263179-01 ، ووزارة الدفاع W81XWH-21-1-0221.
Materials
| Name | Company | Catalog Number | Comments |
| 18 G needles | BD | 511097 | 1 1/2 inch metal hub |
| Acrylic resin liquid | Lang Dental | B1323 | |
| Acrylic resin powder | Lang Dental | B1323 | |
| Alcohol wipes | BD | 326895 | |
| Centrifuge 5240 | Eppendorf | 5420000040 | Centrifuge |
| Cotton tipped swabs | Puritan | 826-WC | Handle Width = 2.11 mm (0.083), Head Width = 1.27 mm (0.050), Handle Length = 147.62 mm (5.812), Overall Length = 152.4 mm (6), Head Length = 12.7 mm (0.500) |
| Drill bit holder | P1 Technologies | DH-1 | Drill bit holder for D56-D70 |
| Drill bit | P1 Technologies | D58 | 1.07 mm |
| Dummy cannula | P1 Technologies | C315DCS-5/SPC | Configuration: Small cap; Length: Cut 5.00 mm below pedestal; Projection: 0.50 mm |
| Flat tip screwdriver | P1 Technologies | SD-80 | Screwdriver |
| Graefe forceps | Fine Science Tools | 11051-10 | Forceps |
| Guide cannula | P1 Technologies | C315GS-5/SPC | Configuration: 5.00 mm pedestal height; Length: Cut 5.00 mm below pedestal |
| Hemostatic cotton pellets with racemic epinephrine | Pascal | 1151602 | |
| MOXI Z Mini automated cell counter Kit | Moxi | MXZ001 | Cell counter |
| NOD scid gamma (NSG) mice | Jackson Laboratory | 5557 | 6 to 12-week-old males and females |
| Pasteur pipet | VWR | 14673-043 | |
| PKG tubing | P1 Technologies | C313CT | Diameter: 0.58 mm x 1.27 mm |
| Porcelain 12 well plate | Flinn Scientific | AP6064 | |
| Povidone iodine | Medline | MDS093943 | |
| Scalpel | World Precision Instrument | 50-822-457 | Disposable Scalpel, no.10, sterile, 10/box, Plastic Handle with 6" Ruler |
| Screws | P1 Technologies | 0-80 X 3/32 | 2.4 mm |
| Stereotaxic Frame | David Kopf Instruments | 940 | Model 940 Small Animal Stereotaxic Instrument with Digital Display Console |
| Student fine scissors | Fine Science Tools | 91460-12 | Scissors |
| Treatment cannula | P1 Technologies | C315IS-5/SPC | 33GA; Configuration: Standard internal; Length: Cut 5.00 mm below pedestal; Projection: 0.50 mm |
| Treatment syringes | Hamilton | 87908 | 5 µL, Model 75 Cemented Needle Special (SN) Syringe, 75SN/22/0.5"/PT3 |
| Vactrap XL | Foxx Life Sciences | 305-4401-FLS | Vacuum System |
References
- Curtin, S. C., Minino, A. M., Anderson, R. N. Declines in cancer death rates among children and adolescents in the United States, 1999-2014. NCHS Data Brief. 257, 1-8 (2016).
- Rohaan, M. W., Wilgenhof, S., Haanen, J. B. A. G. Adoptive cellular therapies: the current landscape. Virchows Archiv. 474 (4), 449-461 (2019).
- Sadelain, M., Brentjens, R., Riviere, I. The basic principles of chimeric antigen receptor design. Cancer Discovery. 3 (4), 388-398 (2013).
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. The New England Journal of Medicine. 378 (5), 439-448 (2018).
- Wagner, J., Wickman, E., DeRenzo, C., Gottschalk, S. CAR T cell therapy for solid tumors: Bright future or dark reality. Molecular Therapy. 28 (11), 2320-2339 (2020).
- Vitanza, N. A., et al. Locoregional infusion of HER2-specific CAR T cells in children and young adults with recurrent or refractory CNS tumors: an interim analysis. Nature Medicine. 27 (9), 1544-1552 (2021).
- Majzner, R. G., et al. GD2-CAR T cell therapy for H3K27M-mutated diffuse midline gliomas. Nature. 603 (7903), 934-941 (2022).
- Vitanza, N. A., et al. Intraventricular B7-H3 CAR T cells for diffuse intrinsic pontine glioma: preliminary first-in-human bioactivity and safety. Cancer Discovery. 13 (1), 114-131 (2023).
- Theruvath, J., et al. Locoregionally administered B7-H3-targeted CAR T cells for treatment of atypical teratoid/rhabdoid tumors. Nature Medicine. 26 (5), 712-719 (2020).
- Donovan, L. K., et al. Locoregional delivery of CAR T cells to the cerebrospinal fluid for treatment of metastatic medulloblastoma and ependymoma. Nature Medicine. 26 (5), 720-731 (2020).
- Brown, C. E., et al. Regression of glioblastoma after chimeric antigen receptor T-Cell therapy. The New England Journal of Medicine. 375 (26), 2561-2569 (2016).
- Bourne, J. A. Intracerebral microdialysis: 30 years as a tool for the neuroscientist. Clinical and Experimental Pharmacology and Physiology. 30 (1-2), 16-24 (2003).
- Zhou, P., et al. Automatically detecting bregma and lambda points in rodent skull anatomy images. PLoS One. 15 (12), 0244378 (2020).
- Foster, J. B., et al. Development of GPC2-directed chimeric antigen receptors using mRNA for pediatric brain tumors. Journal for Immunotherapy of Cancer. 10 (9), 004450 (2022).
- Akhavan, D., et al. T cells for brain tumors: Lessons learned and road ahead. Immunological Reviews. 290 (1), 60-84 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved