Method Article
Имплантация внутричерепных канюль для серийных локорегионарных инфузий Т-клеток химерного антигенного рецептора (CAR) у мышей
В этой статье
Резюме
Опухоли центральной нервной системы (ЦНС) являются основной причиной смерти от рака у детей, и локорегионарная иммунная терапия все чаще тестируется на пациентах в клинических испытаниях. В этом протоколе описываются методы локорегионарной имплантации канюли мышам для доклинической оценки иммунотерапевтических инфузий, нацеленных на опухоли ЦНС.
Аннотация
Опухоли ЦНС у детей являются причиной большинства смертей, связанных с раком, у детей и имеют плохие прогнозы, несмотря на достижения в области химиотерапии и лучевой терапии. Поскольку многие опухоли не имеют эффективных методов лечения, существует острая необходимость в разработке более перспективных терапевтических вариантов, таких как иммунотерапия; особый интерес представляет применение химерного антигенного рецептора (CAR) Т-клеточной терапии, направленной против опухолей ЦНС. Мишени на клеточной поверхности, такие как B7-H3, IL13RA2 и дисиалоганглиозид GD2, высоко экспрессируются на поверхности нескольких опухолей ЦНС у детей и взрослых, что повышает возможность использования терапии CAR-T-клетками против этих и других поверхностных мишеней. Для оценки повторной локорегионарной доставки CAR-Т-клеток на доклинических мышиных моделях была создана постоянная катетерная система, которая повторяет внутренние катетеры, которые в настоящее время используются в клинических испытаниях на людях. В отличие от стереотаксической доставки, постоянная катетерная система позволяет многократно дозировать без использования нескольких операций. Этот протокол описывает внутриопухолевое размещение фиксированной направляющей канюли, которая была использована для успешного тестирования серийных инфузий CAR-T-клеток на ортотопических мышиных моделях опухолей головного мозга у детей. После ортотопической инъекции и приживления опухолевых клеток у мышей внутриопухолевое размещение фиксированной направляющей канюли завершается на стереотаксическом аппарате и закрепляется винтами и акриловой смолой. Затем лечебные канюли вставляются через неподвижную направляющую канюлю для повторной доставки CAR-Т-клеток. Стереотаксическое размещение направляющей канюли может быть скорректировано для доставки CAR-T-клеток непосредственно в боковой желудочек или другие места в головном мозге. Эта платформа предлагает надежный механизм для доклинических испытаний повторных внутричерепных инфузий CAR-Т-клеток и других новых терапевтических средств для этих разрушительных педиатрических опухолей.
Введение
Несмотря на улучшения в химиотерапии, лучевой терапии и хирургии, опухоли центральной нервной системы (ЦНС) являются самыми смертоносными злокачественными новообразованиями в педиатрии1, что подчеркивает важную потребность в новых подходах с более успешными результатами. Благодаря значительным достижениям в области иммунотерапии подходы адоптивной клеточной терапии (ACT) показали многообещающие результаты при различных видах рака, особенно при гематологических злокачественных новообразованиях2. Терапия Т-клетками химерного антигена (CAR), специфический тип ACT, использует естественную способность иммунной системы распознавать и убивать вредные клетки, перенаправляя специфичность Т-клеток для генерации Т-клеток, нацеленных на опухоль3. Терапия CAR-Т-клетками продемонстрировала значительный успех в лечении лейкозов и лимфом4, что делает ее перспективным иммунотерапевтическим подходом и способствует ее исследованию при солидных опухолях. Однако до сих пор терапия CAR-Т-клетками при солидных опухолях достигла небольшого клинического успеха и сталкивается со многими проблемами, такими как неэффективное проникновение опухоли, ограниченное количество целевых антигенов и супрессивное микроокружение опухоли5.
Недавние клинические испытания начали оценивать терапию CAR-Т-клетками при опухолях ЦНС у детей, что обеспечивает доказательство концепции и ранние доказательства активности Т-клеток в предварительных отчетах 6,7,8. В то время как большинство первоначальных доклинических данных было сосредоточено на внутривенном введении CAR-T-клеток, последние доклинические данные свидетельствуют о превосходстве локорегионарной доставки в ЦНС9,10, которая также была успешно использована в нескольких клинических испытаниях 6,7,8,11 . Доклинические исследования на сегодняшний день, которые включали локорегиональную доставку CAR-Т-клеток в ЦНС, основывались на однократной внутричерепной дозе CAR-Т-клеток, доставляемой стереотаксически 9,10. Однако клинические испытания на людях потребовали повторных инфузий CAR-Т-клеток в ЦНС 6,7,8,11, что подчеркивает необходимость оценки многократных повторных инфузий в доклинической разработке. Целью этой процедуры является успешное тестирование серийных инфузий CAR-T-клеток с использованием катетера на ортотопических мышиных моделях опухолей головного мозга у детей. Преимущество этого метода заключается в том, что он избегает многократных хирургических процедур для повторного лечения внутри ЦНС. Канюли в основном использовались для микродиализного отбора проб нейротрансмиттеров и доставки нейроактивных веществ в нейробиологии и поведенческих исследованиях у грызунов12, с ограниченными сообщениями об их использовании для доставки противораковых терапевтических средств. Основываясь на предыдущих отчетах, этот протокол использует стереотаксически размещенную внутреннюю систему канюль для доставки CAR-Т-клеток в мышиные модели опухолей ЦНС с ксенотрансплантатом. Протокол может быть использован для тестирования дополнительных терапевтических средств на мышиных моделях неврологических или нейроонкологических расстройств и может быть полезен для тестирования новых терапевтических средств, где обход гематоэнцефалического барьера имеет решающее значение для эффективности.
протокол
Все протокольные процедуры были одобрены Институциональным комитетом по уходу за животными и их использованию Детской больницы Филадельфии (IAC 19-000907), который аккредитован AAALAC. В этом исследовании использовались мыши NOD scid гамма (NSG) в возрасте 6-12 недель с ортотопическими опухолями ксенотрансплантата; Тем не менее, протокол может быть использован на любом штамме мыши. Мышей NSG размещали в стерильных барьерных условиях, а операции проводили в стерильных шкафах биобезопасности. Когда используется человеческий материал, такой как опухолевые клетки или Т-клетки, процедуры и обработка должны выполняться в шкафах биобезопасности ABSL-2.
1. Подготовка мыши к операции
- Анестезируют мышей в индукционной камере изофлураном (2-4%) при скорости потока кислорода 1 л/мин до достижения адекватной плоскости анестезии (примерно 5 мин).
- Взвесьте мышь с помощью весов с точностью до 0,1 г и введите подкожный бупренорфин с медленным высвобождением (SR) (1 мг / кг) или другой анальгетик.
ПРИМЕЧАНИЕ: SR бупренорфин обеспечивает анальгезию в течение 72 часов. - Сбрейте шерсть на макушке мыши с помощью электрических машинок для стрижки или средств для депиляции.
- С помощью шпателя аккуратно откройте нижнюю часть стереотаксического рычага и вставьте направляющую канюлю с помощью щипцов. Затяните винт на рычаге, чтобы закрепить канюлю так, чтобы примерно от 1/2 до 2/3 белой пластиковой части канюли выступала из нижней части отверстия вместе со всей длиной металла канюли 5 мм.
- Вставьте и закрепите верхние зубы мыши в стержне прикуса стереотаксического аппарата. Потяните носовой конус вперед и затяните его, убедившись, что мышь вдыхает изофлуран.
- Установите мышь на подогретый стереотаксический аппарат с помощью амбушюр или амбушюр, избегая чрезмерного давления.
ПРИМЕЧАНИЕ: В подогретый лоток должен быть вставлен ректальный термометр, а согревающий лоток должен регулироваться для поддержания нормальной температуры тела мыши во время процедуры. - Нанесите стерильную офтальмологическую мазь на оба глаза с помощью аппликатора с ватным наконечником.
- Протрите место операции повидон-йодом на подушечке или аппликаторе, а затем спиртовой прокладкой. В общей сложности выполните этот шаг три раза.
- Перед началом процедуры выполните защемление пальца ноги щипцами, чтобы оценить адекватный седативный эффект.
2. Хирургическое вмешательство
ПРИМЕЧАНИЕ: Во всех аспектах хирургической процедуры используются стерилизованные инструменты и асептические методы. Мыши продолжают находиться под наркозом изофлураном (2-4%) на протяжении всей процедуры, примерно 10-20 мин.
- Аккуратно подцепите щипцами кожу головы между ушами. С помощью стерильных ножниц разрежьте приподнятый скальп параллельно черепу и удалите овальный лоскут кожи (0,75-1 см в длину), чтобы обнажить череп.
ПРИМЕЧАНИЕ: Ножницы предпочтительнее скальпеля, чтобы обеспечить чистое отверстие овальной формы и предотвратить ненужное повреждение окружающей кожи и тканей. - Оттолкните фасцию с помощью скальпеля или ватных тампонов и кровоостанавливающего ватного шарика, чтобы замедлить чрезмерное кровотечение по мере необходимости.
ПРИМЕЧАНИЕ: Использование деревянной стороны стерильного ватного наконечника также может отодвинуть фасцию и помочь избежать чрезмерного кровотечения. - Определите ориентиры брегма и лямбда, соответствующие передние и задние отметины на черепе, где встречаютсячерепные пластины 13.
ПРИМЕЧАНИЕ: Идентификация может быть дополнена путем протирания верхней части обнаженного черепа перекисью водорода. - Аккуратно надрежьте череп с помощью скальпеля, чтобы создать поверхность для прикрепления акрила. Подсчет очков должен включать несколько линейных линий длиной примерно 0,5-1 см под углом 90° друг к другу.
- Используя стереотаксическое плечо, локализуйте канюлю до интересующего ориентира (брегмы или лямбды). После локализации поднимите кончик канюли на 1-2 мм над поверхностью черепа и двигайтесь к нужным координатам. Для внутриопухолевых инъекций используются те же координаты A / P и M / L, что и при размещении опухоли.
- На обнаженном черепе, вдали от области, куда будет входить канюля, сделайте два отверстия для винтов иглой 18 G или хирургическим сверлом. Убедитесь, что отверстия разнесены, чтобы было достаточно места для канюли. С помощью сверла прокрутите отверстия для винтов до тех пор, пока они не зацепятся за череп. Вставьте и закрепите два винта в отверстия с помощью отвертки с плоским наконечником. Затем осторожно потяните винты вверх, чтобы убедиться, что они закреплены.
ПРИМЕЧАНИЕ: Не вставляйте винты, пока они не окажутся на одном уровне с черепом, иначе они могут повредить мозг мыши под ним. Оставьте зазор не менее 1-2 мм между винтом и черепом. - Используя иглу 18 G или хирургическое сверло, просверлите череп в определенных координатах, чтобы создать отверстие для установки канюли.
- Используя стереотаксическую руку, опустите канюлю до желаемой координаты D/V.
ПРИМЕЧАНИЕ: Координата D/V имплантации канюли должна учитывать длину проекции манекена и лечебных канюль и может быть более поверхностной, чем ортотопическая инъекция опухолевых клеток (рис. 1). - В фарфоровой 12-луночной тарелке заполните одну лунку порошком акриловой смолы (примерно 0,3 г) и 10-15 каплями (примерно 0,5-0,75 мл) жидкости акриловой смолы. В результате получается вязкий материал белого цвета. Наберите смесь в шприц объемом 1 мл и используйте его, чтобы покрыть и покрыть череп, заполняя пространства вокруг канюли и винтов.
ПРИМЕЧАНИЕ: Вязкий материал со временем затвердевает в цемент, поэтому этот шаг следует выполнить сразу после смешивания. - Пока цемент еще податлив, ослабьте винт на стереотаксическом рычаге и используйте шпатель в отверстии внизу, чтобы осторожно освободить канюлю от держателя и медленно втянуть стереотаксическую руку вверх от мыши.
- Как только цемент полностью высохнет, вставьте фиктивную канюлю в направляющую канюлю и плотно закрепите ее, повернув по часовой стрелке.
- После завершения процедуры поместите мышь обратно в подогретую домашнюю клетку, чтобы тщательно контролировать, обеспечивая адекватное восстановление и записывая любые наблюдения после процедуры, в том числе то, что мышь полностью пришла в сознание, прежде чем вернуться в колонию.
ПРИМЕЧАНИЕ: Обычно рекомендуется помещать только половину клетки на грелку, чтобы животное могло переместиться на более прохладную сторону, чтобы избежать перегрева. - Вводите дополнительные анальгетики по мере необходимости, если мыши демонстрируют поведение, указывающее на боль после операции, например, мелоксикам 5 мг / кг, подкожно доставляемый один раз в день в течение 3 дней.
3. Подготовка CAR-Т-клеток
- Измерьте предварительно трансфицированную концентрацию CAR-Т-клеток с помощью счетчика клеток.
- Центрифуга предварительно трансфицируют Т-клетки при 200 x g в течение 5 мин при комнатной температуре (RT).
- Аспирируйте надосадочную жидкость с помощью стерильной пипетки Пастера на вакуумной аспирационной системе и ресуспендируйте гранулу в фосфатированном солевом буфере (PBS) до желаемой концентрации. Типичные объемы доставки составляют 2-5 мкл. Типичные дозы клеток составляют 0,5-5 х 106 клеток.
4. Инфузии CAR-Т-клеток
- Приготовьте лечебную канюлю, подав верхнюю часть через небольшой кусочек трубки PKG.
- Наполните лечебный шприц суспензией CAR-T-клеток и вставьте его через другой конец трубки PKG так, чтобы покрыть верхнюю часть лечебной канюли.
- Обезболивают мышей изофлураном (2-4%) при скорости потока кислорода 1 л/мин.
- Стабилизируйте направляющую канюлю с помощью щипцов у основания, а затем осторожно отвинтите и извлеките фиктивную канюлю, обеспечив доступ к направляющей канюле.
ПРИМЕЧАНИЕ: Стереотаксическая установка не обязательна, но может быть использована для стабилизации головы для лечения. - Инфузия CAR-Т-клеток в течение 1 мин и удержание лечебной канюли на месте еще 1 мин после прекращения инфузии.
- Снимите лечебную канюлю и плотно закрутите фиктивную канюлю на место.
- Вводите подкожный мелоксикам (5 мг / кг) для дополнительного контроля боли.
Результаты
Успешная имплантация канюли в ЦНС мыши
Мыши с успешной канюляцией имеют надежную направляющую канюлю, которая не мешает повседневной деятельности (рис. 2A) и может легко проходить через лечебную канюлю и доставлять жидкость без сопротивления (рис. 2B). По нашему опыту, большинство канюль остаются на месте более 4 недель, хотя 0-25% могут быть смещены с течением времени. Проверка правильности размещения может быть подтверждена с помощью синего красителя Эванса, введенного в канюлю. Например, канюля, вставленная в боковой желудочек, показывает синий краситель Эванса по всей желудочковой системе, когда он проходит через спинномозговую жидкость, подтверждая правильное размещение (рис. 2C). Канюли, вставленные в опухоль, показывают синий краситель Эванса в месте имплантации опухоли.
Эффективная доставка CAR-Т-клеток в ЦНС для лечения опухолей ксенотрансплантата.
Эффективность системы внутричерепных канюль и терапевтическая эффективность CAR-Т-клеток на мышиных моделях могут быть измерены с помощью различных механизмов, включая биолюминесцентную визуализацию и общую выживаемость. CAR-Т-клетки, направленные на GPC2, были протестированы против медуллобластомы мышей и диффузной срединной глиомы моделей, 7316-4509 и 7316-3058, соответственно, с использованием повторного дозирования CAR-Т-клеток через указанную систему внутричерепных канюль14. Размещение ортотопической опухоли и приживление трансплантата были подтверждены биолюминесцентной визуализацией, а канюли были помещены в ложе опухоли с использованием тех же координат, что и ортотопическое размещение опухоли. Лечение состояло из инфузий CAR-T-клеток GPC2 один-два раза в неделю в течение 2-4 недель, в общей сложности от четырех до шести доз. После лечения терапия CAR-Т-клетками, направленная на GPC2, вызвала значительную регрессию опухоли в модели медуллобластомы 7316-4509 (p < 0,01) (рис. 3A) и значительно увеличила выживаемость при таламической диффузной глиоме средней линии 7316-3058 (p < 0,05) (рис. 3B)14.

Рисунок 1: Направляющая канюля с проекционным манекеном и лечебными канюлями. (A) Направляющая канюля с проекцией 0,5 мм и проекцией 2 мм на месте. (B) Направляющая канюля с проекцией 0,5 мм и проекцией 2 мм на месте. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
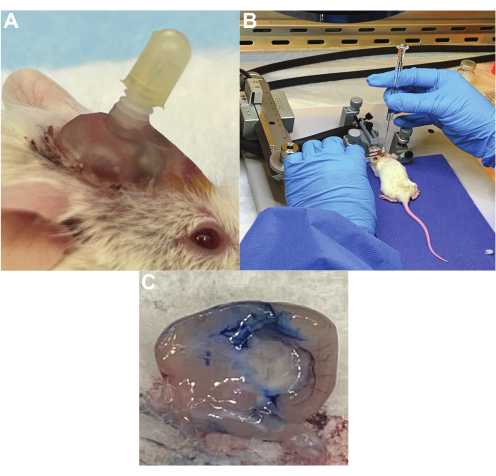
Рисунок 2: Система доставки лечебной канюли для повторных доз CAR-Т-клеток. (A) Канюля, имплантированная в череп мыши с колпачком на месте, когда она не используется. (B) Инфузия CAR-Т-клеток в опухоль моста через лечебную канюлю, когда мышь находится под наркозом. (C) Проверка размещения канюли в боковом желудочке с использованием синего красителя Эванса. Краситель вводили через канюлю с последующей эвтаназией и удалением мозга, при этом краситель присутствовал во всех желудочках. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
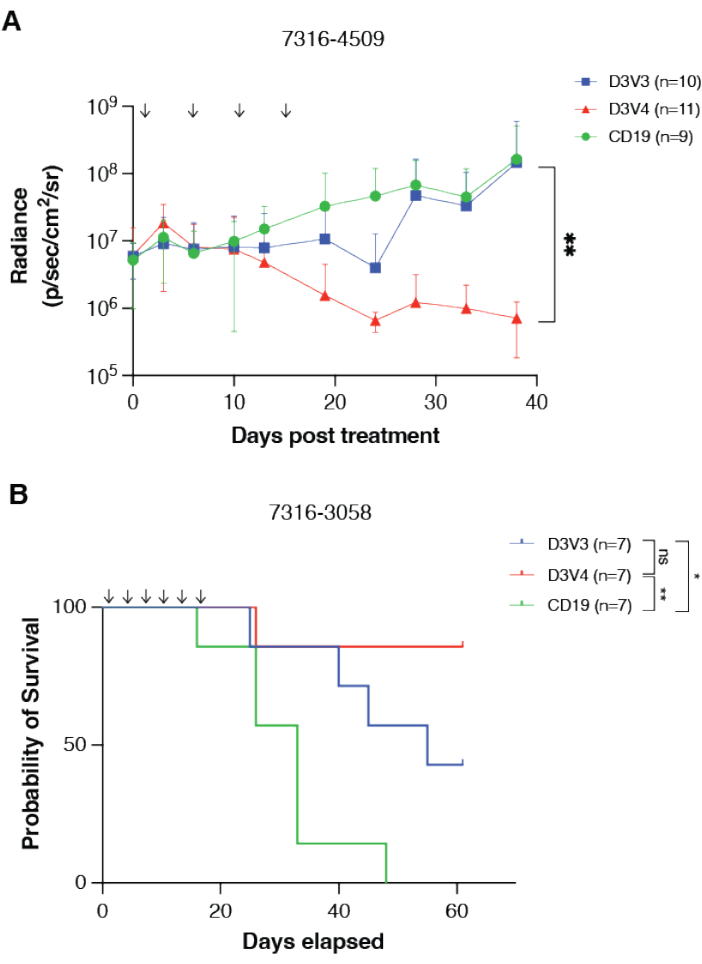
Рисунок 3: CAR-Т-клетки, направленные на GPC2, опосредуют противоопухолевые реакции и продлевают выживаемость при опухолях головного мозга у детей in vivo . (A) Количественная оценка биолюминесценции ксенотрансплантата медуллобластомы 7316-4509 ортотопической группы, обработанного CAR-T-клетками, направленными на GPC2 или CD19. Дозы обозначены стрелками на графике. Данные отображаются как средние с SD, n = 9-11 мышей на группу. (B) Общая выживаемость мышей, которым имплантировали таламический ксенотрансплантат DMG 7316-3058, получавших шесть повторных доз 2 x 106 CAR-Т-клеток. Дозы обозначены стрелками на графике. n = 7 мышей на руку. **p < 0,01; *p < 0,05; ns = не значительно. Этот рисунок был воспроизведен с разрешения Foster et al.14. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
CAR-Т-клеточная терапия произвела революцию в лечении гематологических онкологических заболеваний и показала многообещающую ценность в лечении солидных опухолей головного мозга 6,7,8. Этот протокол был разработан для доклинической оценки локорегионарной доставки CAR-T-клеток для лечения опухолей ЦНС у детей. Система канюль воспроизводит резервуар Ommaya или Rickham, внутрижелудочковую катетерную систему, которая в настоящее время используется в текущих клинических испытаниях терапии CAR-T-клетками при опухолях ЦНС у детей 6,7,8, что подчеркивает актуальность и трансляционный потенциал этих методов. Эта система обеспечивает повторную доставку CAR-T-клеток в обход гематоэнцефалического барьера, что также аналогично методам, используемым в текущих клинических испытаниях. Локорегиональная доставка может обеспечить максимальную эффективность в ЦНС9, а также может снизить риск системной токсичности, связанной с трафиком из циркуляции15. В то время как стереотаксическая доставка может обеспечить однократную дозу в ЦНС, преимущество этой системы заключается в возможности введения нескольких повторных доз в указанное место в ЦНС без необходимости проведения нескольких операций. Ограничения этой процедуры включают фиксированное место доставки без возможности изменить местоположение или внести коррективы после того, как канюля будет на месте, а также возможность смещения канюли.
Критическим шагом в этом протоколе является имплантация фиксированной направляющей канюли с координатой D/V, которая учитывает проекцию лечебных канюль. Лечебная канюля будет выступать за кончик направляющей канюли, поэтому необходимо позаботиться о том, чтобы размещение привело к доставке CAR-Т-клеток в интересующую область. Длину проекции лечебной канюли можно настроить, и, по опыту автора, 0,5 мм является полезной длиной проекции. Такая длина гарантирует, что терапевтическая канюля не останется в направляющей канюле при дозировании, но также не требует существенной корректировки координат D/V для направляющей канюли в интересующую область. Дополнительным важным этапом в этом протоколе является время, в течение которого лечебная канюля остается на месте после инфузии CAR-T-клеток. Лечебную канюлю следует удерживать на месте не менее 1 минуты после окончания инфузии, чтобы предотвратить утечки и потерю локорегионарной доставки терапии CAR-T-клетками.
Устранение неполадок с этим методом является простым, при этом большинство осложнений связано с трудностями при удалении фиктивной канюли или вставке лечебной канюли в неподвижную направляющую канюлю, вероятно, из-за засохшей крови на внутренней стороне направляющей канюли. Эту проблему можно легко решить, осторожно пропустив фиктивную канюлю через направляющую канюлю до тех пор, пока сопротивление не уменьшится и мусор не будет очищен. Акриловая смола может иногда выбиваться из черепа, что приводит к потере системы канюль. По нашему опыту, это, как правило, ограничивается забиванием черепа скальпелем и размещением двух винтов. Кроме того, удаляются любые предметы из клетки, которые могут случайно приложить силу к канюле во время движения мыши, например, специальные хижины для обогащения мышей с небольшими отверстиями.
В заключение здесь описан протокол введения системы канюль в мышиные модели опухолей ЦНС для повторной доставки CAR-Т-клеток. Размещение канюли может быть адаптировано к нескольким локорегиональным местам доставки, проверяя эффективность различных мест доставки. Кроме того, эта система может быть использована для дополнительных терапевтических средств, помимо CAR-T-клеток, для оценки эффективности при обходе гематоэнцефалического барьера, а также может быть полезна для оценки терапевтических средств на мышиных моделях неонкологических заболеваний.
Раскрытие информации
JBF имеет патент, относящийся к иммунотерапии, направленной на глипикан 2 (GPC2). Всем остальным авторам раскрывать нечего.
Благодарности
Финансирование этой работы было предоставлено Фондом Мэтью Ларсона, Фондом Грейсона Сейвса, Hyundai Hope on Wheels Young Investigator Award, Фондом Кортни Роуз, Национальными институтами здравоохранения NCI K12 CA076931-19 и 1K08CA263179-01 и Министерством обороны W81XWH-21-1-0221.
Материалы
| Name | Company | Catalog Number | Comments |
| 18 G needles | BD | 511097 | 1 1/2 inch metal hub |
| Acrylic resin liquid | Lang Dental | B1323 | |
| Acrylic resin powder | Lang Dental | B1323 | |
| Alcohol wipes | BD | 326895 | |
| Centrifuge 5240 | Eppendorf | 5420000040 | Centrifuge |
| Cotton tipped swabs | Puritan | 826-WC | Handle Width = 2.11 mm (0.083), Head Width = 1.27 mm (0.050), Handle Length = 147.62 mm (5.812), Overall Length = 152.4 mm (6), Head Length = 12.7 mm (0.500) |
| Drill bit holder | P1 Technologies | DH-1 | Drill bit holder for D56-D70 |
| Drill bit | P1 Technologies | D58 | 1.07 mm |
| Dummy cannula | P1 Technologies | C315DCS-5/SPC | Configuration: Small cap; Length: Cut 5.00 mm below pedestal; Projection: 0.50 mm |
| Flat tip screwdriver | P1 Technologies | SD-80 | Screwdriver |
| Graefe forceps | Fine Science Tools | 11051-10 | Forceps |
| Guide cannula | P1 Technologies | C315GS-5/SPC | Configuration: 5.00 mm pedestal height; Length: Cut 5.00 mm below pedestal |
| Hemostatic cotton pellets with racemic epinephrine | Pascal | 1151602 | |
| MOXI Z Mini automated cell counter Kit | Moxi | MXZ001 | Cell counter |
| NOD scid gamma (NSG) mice | Jackson Laboratory | 5557 | 6 to 12-week-old males and females |
| Pasteur pipet | VWR | 14673-043 | |
| PKG tubing | P1 Technologies | C313CT | Diameter: 0.58 mm x 1.27 mm |
| Porcelain 12 well plate | Flinn Scientific | AP6064 | |
| Povidone iodine | Medline | MDS093943 | |
| Scalpel | World Precision Instrument | 50-822-457 | Disposable Scalpel, no.10, sterile, 10/box, Plastic Handle with 6" Ruler |
| Screws | P1 Technologies | 0-80 X 3/32 | 2.4 mm |
| Stereotaxic Frame | David Kopf Instruments | 940 | Model 940 Small Animal Stereotaxic Instrument with Digital Display Console |
| Student fine scissors | Fine Science Tools | 91460-12 | Scissors |
| Treatment cannula | P1 Technologies | C315IS-5/SPC | 33GA; Configuration: Standard internal; Length: Cut 5.00 mm below pedestal; Projection: 0.50 mm |
| Treatment syringes | Hamilton | 87908 | 5 µL, Model 75 Cemented Needle Special (SN) Syringe, 75SN/22/0.5"/PT3 |
| Vactrap XL | Foxx Life Sciences | 305-4401-FLS | Vacuum System |
Ссылки
- Curtin, S. C., Minino, A. M., Anderson, R. N. Declines in cancer death rates among children and adolescents in the United States, 1999-2014. NCHS Data Brief. 257, 1-8 (2016).
- Rohaan, M. W., Wilgenhof, S., Haanen, J. B. A. G. Adoptive cellular therapies: the current landscape. Virchows Archiv. 474 (4), 449-461 (2019).
- Sadelain, M., Brentjens, R., Riviere, I. The basic principles of chimeric antigen receptor design. Cancer Discovery. 3 (4), 388-398 (2013).
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. The New England Journal of Medicine. 378 (5), 439-448 (2018).
- Wagner, J., Wickman, E., DeRenzo, C., Gottschalk, S. CAR T cell therapy for solid tumors: Bright future or dark reality. Molecular Therapy. 28 (11), 2320-2339 (2020).
- Vitanza, N. A., et al. Locoregional infusion of HER2-specific CAR T cells in children and young adults with recurrent or refractory CNS tumors: an interim analysis. Nature Medicine. 27 (9), 1544-1552 (2021).
- Majzner, R. G., et al. GD2-CAR T cell therapy for H3K27M-mutated diffuse midline gliomas. Nature. 603 (7903), 934-941 (2022).
- Vitanza, N. A., et al. Intraventricular B7-H3 CAR T cells for diffuse intrinsic pontine glioma: preliminary first-in-human bioactivity and safety. Cancer Discovery. 13 (1), 114-131 (2023).
- Theruvath, J., et al. Locoregionally administered B7-H3-targeted CAR T cells for treatment of atypical teratoid/rhabdoid tumors. Nature Medicine. 26 (5), 712-719 (2020).
- Donovan, L. K., et al. Locoregional delivery of CAR T cells to the cerebrospinal fluid for treatment of metastatic medulloblastoma and ependymoma. Nature Medicine. 26 (5), 720-731 (2020).
- Brown, C. E., et al. Regression of glioblastoma after chimeric antigen receptor T-Cell therapy. The New England Journal of Medicine. 375 (26), 2561-2569 (2016).
- Bourne, J. A. Intracerebral microdialysis: 30 years as a tool for the neuroscientist. Clinical and Experimental Pharmacology and Physiology. 30 (1-2), 16-24 (2003).
- Zhou, P., et al. Automatically detecting bregma and lambda points in rodent skull anatomy images. PLoS One. 15 (12), 0244378 (2020).
- Foster, J. B., et al. Development of GPC2-directed chimeric antigen receptors using mRNA for pediatric brain tumors. Journal for Immunotherapy of Cancer. 10 (9), 004450 (2022).
- Akhavan, D., et al. T cells for brain tumors: Lessons learned and road ahead. Immunological Reviews. 290 (1), 60-84 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены