Method Article
颅内插管植入小鼠连续局部区域嵌合抗原受体(CAR)T细胞输注
摘要
中枢神经系统(CNS)肿瘤是儿童癌症相关死亡的主要原因,基于局部免疫的疗法越来越多地在临床试验中为患者进行测试。该协议描述了在小鼠中植入局部区域套管的方法,用于靶向CNS肿瘤的免疫治疗输注的临床前评估。
摘要
尽管化疗和放疗取得了进展,但儿科中枢神经系统肿瘤是导致大多数儿童癌症相关死亡的原因,并且预后不良。由于许多肿瘤缺乏有效的治疗方法,因此迫切需要开发更有前途的治疗方案,例如免疫疗法;使用嵌合抗原受体(CAR)T细胞疗法针对CNS肿瘤特别令人感兴趣。细胞表面靶标如B7-H3、IL13RA2和二脂离子苷GD2在几种儿童和成人中枢神经系统肿瘤的表面上高表达,增加了使用CAR-T细胞疗法对抗这些和其他表面靶标的机会。为了评估临床前小鼠模型中CAR-T细胞的重复局部区域递送,建立了一种留置导管系统,该系统概括了目前用于人体临床试验的留置导管。与立体定向给药不同,留置导管系统允许重复给药,而无需使用多次手术。该协议描述了固定引导套管的肿瘤内放置,该套管已用于在小儿脑肿瘤的原位鼠模型中成功测试连续CAR T细胞输注。在小鼠原位注射和植入肿瘤细胞后,在立体定向装置上完成固定引导套管的肿瘤内放置,并用螺钉和丙烯酸树脂固定。然后通过固定的引导套管插入治疗插管,以重复CAR-T细胞递送。可以调整引导套管的立体定向放置,以将CAR-T细胞直接输送到侧脑室或大脑的其他位置。该平台为CAR-T细胞的重复颅内输注和其他针对这些破坏性儿科肿瘤的新疗法的临床前测试提供了一种可靠的机制。
引言
尽管化疗、放疗和手术有所改善,但中枢神经系统 (CNS) 肿瘤是儿科中最致命的恶性肿瘤1,这突显了对具有更成功结果的新方法的重要需求。随着免疫治疗领域的重大进展,过继细胞疗法(ACT)方法在各种癌症,尤其是血液系统恶性肿瘤中显示出有希望的结果2。嵌合抗原受体(CAR)T细胞疗法是一种特定类型的ACT,它利用免疫系统识别和杀死有害细胞的天然能力,通过重定向T细胞的特异性来产生肿瘤靶向T细胞3。CAR T细胞疗法在治疗白血病和淋巴瘤方面取得了巨大成功4,使其成为一种有前途的免疫治疗方法,并鼓励其在实体瘤中的研究。然而,到目前为止,CAR-T细胞治疗实体瘤的临床成功不大,面临肿瘤渗透效率低下、可靶向抗原有限、肿瘤微环境抑制等诸多挑战5。
最近的临床试验已经开始评估CAR T细胞疗法治疗儿科CNS肿瘤,在初步报告6,7,8中提供了T细胞活性的概念证明和早期证据。虽然大多数初始临床前数据都集中在CAR-T细胞的静脉内递送上,但最近的临床前证据表明,中枢神经系统9,10的局部区域递送具有优越性,该中枢神经系统也已成功用于多项临床试验6,7,8,11.迄今为止,纳入中枢神经系统中CAR-T细胞局部区域递送的临床前研究依赖于单次颅内剂量的CAR-T细胞立体定向递送9,10。然而,人体临床试验需要在CNS6,7,8,11中反复输注CAR-T细胞,这强调了在临床前开发中评估多次重复输注的必要性。该程序的目标是在小儿脑肿瘤的原位鼠模型中使用导管成功测试连续CAR-T细胞输注。该技术的优点是避免了多次外科手术来提供重复的CNS内治疗。插管主要用于神经递质的微透析取样和啮齿动物12的神经科学和行为研究中神经活性物质的递送,关于它们用于递送抗癌治疗剂的报道有限。在先前报告的基础上,该协议使用立体定向放置的留置套管系统在CNS肿瘤的异种移植小鼠模型中递送CAR T细胞。该协议可用于测试神经或神经肿瘤疾病的小鼠模型中的其他治疗方法,并且可能有助于测试绕过血脑屏障对疗效至关重要的新疗法。
研究方案
所有协议程序均由费城儿童医院机构动物护理和使用委员会(IAC 19-000907)批准,该委员会已获得AAALAC的认可。这项研究使用了6-12周龄的NOD scid γ(NSG)小鼠与原位异种移植肿瘤;但是,该协议可用于任何小鼠品系。将NSG小鼠饲养在无菌屏障条件下,并在无菌生物安全柜下进行手术。当使用肿瘤细胞或T细胞等人类材料时,必须在ABSL-2生物安全柜中完成程序和处理。
1. 准备手术小鼠
- 在用异氟醚(2-4%)的诱导室中以1L / min的氧气流速麻醉小鼠,直到达到足够的麻醉平面(约5分钟)。
- 使用秤称量小鼠至最接近的0.1g,并给予皮下缓释(SR)丁丙诺啡(1mg / kg)或其他镇痛药。
注意:SR丁丙诺啡提供镇痛72小时。 - 使用电动剪或脱毛剂剃掉鼠标头顶上的皮毛。
- 使用刮刀轻轻打开立体定向臂的底部,并使用镊子插入引导套管。拧紧手臂上的螺钉以固定套管,使套管的白色塑料部分的大约 1/2 至 2/3 与套管的整个 5 mm 金属长度一起从开口底部突出。
- 将鼠标的上牙插入并固定在立体定位装置的咬杆中。向前拉鼻锥并拧紧它,确保小鼠吸入异氟醚。
- 使用耳套或耳条将鼠标安装在加热的立体定位装置上,避免压力过大。
注意:加热托盘应插入直肠温度计,并且加热托盘应进行调整以在手术过程中保持鼠标的正常体温。 - 使用棉头涂抹器将无菌眼药膏涂抹在双眼上。
- 用聚维酮碘在垫子或涂抹器上擦拭手术部位,然后用酒精垫擦拭。总共执行此步骤三次。
- 在开始手术之前,用镊子捏住脚趾以评估是否有足够的镇静剂。
2. 外科手术
注意:外科手术的所有方面都使用无菌器械和无菌技术。小鼠在整个手术过程中继续用异氟醚(2-4%)麻醉,约10-20分钟。
- 用镊子轻轻地捡起耳朵之间的头皮。使用无菌剪刀,切开平行于颅骨的抬起的头皮,并去除椭圆形皮瓣(长 0.75-1 厘米)以露出头骨。
注意:剪刀优先于手术刀,以提供干净的椭圆形开口,并防止对周围皮肤和组织造成不必要的损害。 - 使用手术刀或棉签和止血棉丸推开筋膜,以帮助根据需要减缓过度出血。
注意:使用无菌棉签的木头也可以推开筋膜,并有助于避免出血过多。 - 识别前膛和λ的标志,颅骨上颅板相交处的前后标记13.
注意:可以通过用过氧化氢擦拭暴露的头骨顶部来增强识别。 - 使用手术刀轻轻划伤头骨,为丙烯酸附着创造一个表面。评分应包括多条长度约为 0.5-1 厘米的线,彼此成 90° 角。
- 使用立体定位臂,将套管定位到感兴趣的地标(前置或λ)。定位后,将套管尖端抬高到颅骨表面上方 1-2 毫米,并移动到所需的坐标。对于肿瘤内注射,这使用与肿瘤放置相同的A / P和M / L坐标。
- 在暴露的头骨上,远离套管进入的区域,用18 G针或手术钻头打两个螺丝孔。确保孔间隔开,为套管留出足够的空间。使用钻头,拧开螺丝孔,直到它们卡在头骨上。使用平头螺丝刀将两个螺钉插入孔中并固定。然后,轻轻拉起螺钉以确保它们已固定。
注意:在螺钉与头骨齐平之前不要插入螺钉,否则它们可能会损坏下面的小鼠大脑。在螺钉和颅骨之间至少留出 1-2 毫米的间隙。 - 使用 18 G 针或手术钻头,在确定的坐标处钻穿颅骨,为插入套管创建一个孔。
- 使用立体定向臂,将套管降低到所需的D / V坐标。
注意:插管植入的D/V坐标需要考虑假人和治疗插管的投影长度,并且可能比肿瘤细胞的原位注射更浅(图1)。 - 在瓷12孔板中,用丙烯酸树脂粉末(约0.3g)和10-15滴(约0.5-0.75mL)丙烯酸树脂液体填充一个孔。生成粘稠的白色材料。将混合物拉入 1 mL 注射器中,并用它来涂覆和覆盖颅骨,填充套管和螺钉周围的空间。
注意:粘性材料会随着时间的推移硬化成水泥,因此此步骤应在混合后立即完成。 - 当水泥仍然柔韧时,松开立体定向臂上的螺钉,并在底部的开口中使用刮刀轻轻地从支架上释放套管,然后慢慢地将立体定向臂向上收回,远离鼠标。
- 水泥完全干燥后,将假套管插入导向套管中,并通过顺时针转动将其牢固固定。
- 手术完成后,将小鼠放回其温暖的笼子中仔细监测,确保充分恢复并记录任何术后观察结果,包括小鼠已完全恢复意识,然后再返回殖民地。
注意:通常建议仅将笼子的一半放在加热垫上,以使动物移动到较冷的一侧,以避免过热。 - 如果小鼠在术后表现出指示疼痛的行为,则根据需要给予额外的镇痛药,例如美洛昔康5mg / kg皮下给药,每天一次,持续长达3天。
3. 制备CAR-T细胞
- 使用细胞计数器测量预转染的CAR T细胞浓度。
- 在室温(RT)下以200× g 离心预转染的T细胞5分钟。
- 在真空抽吸系统上使用无菌巴斯德移液管吸出上清液,并将沉淀重悬于磷酸盐缓冲盐水(PBS)中至所需浓度。典型给药体积为 2-5 μL,典型细胞剂量为 0.5-5 x 106 个细胞。
4. CAR-T细胞输注
- 通过一小块PKG管将顶部喂入来准备治疗套管。
- 用CAR T细胞悬液填充治疗注射器,并将其插入PKG管的另一端,足以覆盖治疗套管的顶部。
- 用异氟醚(2-4%)以1L / min的氧气流速麻醉小鼠。
- 使用底部的镊子稳定导引套管,然后小心地拧下并取出假套管,以便进入导引套管。
注意:立体定位设置不是必需的,但可用于稳定头部以进行治疗。 - 输注CAR-T细胞1分钟,并在停止输注后将治疗套管保持在原位1分钟。
- 取下治疗套管并将假套管紧紧拧回原位。
- 皮下注射美洛昔康(5 mg/kg)以控制疼痛。
结果
成功将套管植入小鼠中枢神经系统
成功插管的小鼠有一个安全的引导套管,不会干扰日常生活活动(图2A),并且可以很容易地通过治疗套管并在没有阻力的情况下输送液体(图2B)。根据我们的经验,大多数插管会保留超过 4 周,尽管随着时间的推移,0-25% 的插管会移位。通过将埃文斯蓝染料注入套管中,可以确认正确放置的验证。例如,插入侧脑室的套管在穿过脑脊液时显示整个脑室系统的埃文斯蓝色染料,确认正确放置(图2C)。插入肿瘤的插管在肿瘤植入部位显示埃文斯蓝色染料。
有效将CAR-T细胞递送到中枢神经系统中,用于治疗异种移植肿瘤。
颅内套管系统的疗效和CAR-T细胞在小鼠模型中的治疗效果可以通过多种机制进行测量,包括生物发光成像和总生存期。分别使用所述颅内套管系统重复给药的CAR T细胞14,分别针对鼠髓母细胞瘤和弥漫性中线胶质瘤模型7316-4509和7316-3058测试GPC2定向CAR-T细胞。通过生物发光成像确认原位肿瘤的放置和植入,并使用与原位肿瘤放置相同的坐标将插管放入肿瘤床中。治疗包括每周一次至两次GPC2 CAR T细胞输注,持续2-4周,共四至六剂。治疗后,GPC2 定向的 CAR T 细胞疗法诱导髓母细胞瘤模型 7316-4509 的显着肿瘤消退 (p < 0.01)(图 3A),并在丘脑弥漫性中线胶质瘤 7316-3058 中显着延长生存期 (p < 0.05) (图 3B)14。

图 1:带有投影假人和治疗插管的引导套管。 (A) 引导套管,具有 0.5 毫米投影和 2 毫米投影假套管。(B)引导套管,0.5毫米投影和2毫米投影处理插管就位。请点击此处查看此图的大图。
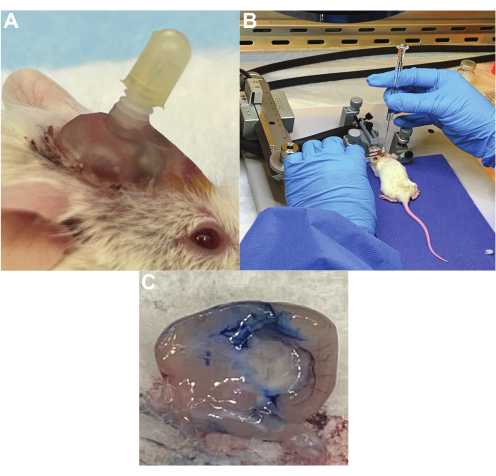
图2:重复剂量CAR-T细胞的治疗套管输送系统 。 (A)在不使用时植入小鼠头骨中的套管,并带有盖子。(B)在小鼠麻醉期间通过治疗套管 将 CAR-T细胞输注到脑桥肿瘤中。(C)使用埃文斯蓝染料验证侧脑室中的套管位置。染料通过套管插入,然后安乐死和脑切除,染料存在于整个脑室。 请点击此处查看此图的大图。
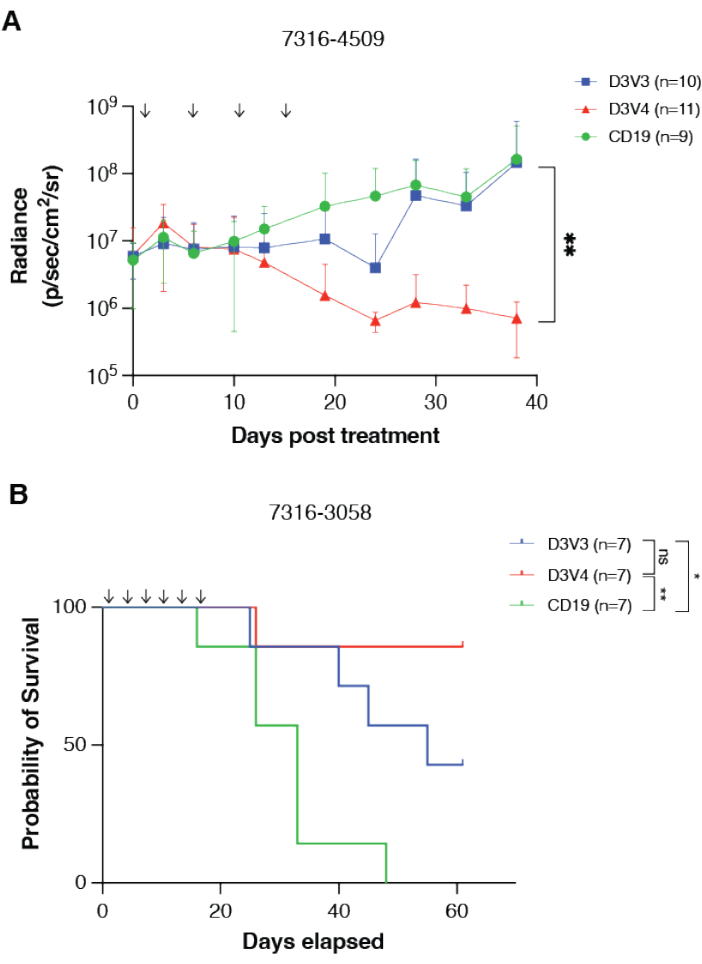
图 3:GPC2 定向的 CAR T 细胞介导体内小儿脑肿瘤的抗肿瘤反应并延长生存期。 (A) 用 GPC2 或 CD19 定向 mRNA CAR T 细胞处理的原位组 4 髓母细胞瘤异种移植物 7316-4509 的生物发光定量。剂量由图表上的箭头表示。数据显示为SD平均值,n = 每臂9-11只小鼠。(B)植入丘脑DMG异种移植物7316-3058的小鼠的总存活率,用六次重复剂量的2 x 106 CAR T细胞处理。剂量由图表上的箭头表示。n = 每臂 7 只小鼠。**p < 0.01;*p < 0.05;ns = 不显著。该图经福斯特等人许可转载14。请点击此处查看此图的大图。
讨论
CAR T细胞疗法彻底改变了血液系统癌症的治疗,并在治疗实体脑肿瘤方面显示出有希望的价值6,7,8。该方案旨在能够对用于治疗儿科CNS肿瘤的局部区域CAR-T细胞递送进行临床前评估。套管系统复制了Ommaya或Rickham储液器,这是一种脑室内导管系统,目前正在儿科CNS肿瘤6,7,8中进行CAR-T细胞治疗的临床试验,强调了这些方法的相关性和转化潜力。该系统允许重复递送绕过血脑屏障的CAR-T细胞,再次类似于正在进行的临床试验中采用的方法。局部区域递送可在中枢神经系统9中提供最大功效,还可以降低与循环贩运相关的全身毒性风险15。虽然立体定向给药可以向中枢神经系统提供单剂量,但该系统的优点是有机会将多个重复剂量提供到中枢神经系统的指定位置,而无需多次手术。该程序的局限性包括固定的分娩部位,一旦套管就位,就无法更改位置或进行调整,以及插管移位的可能性。
该协议中的一个关键步骤是在考虑到治疗套管的投影的D / V坐标处植入固定的引导套管。治疗套管将突出到引导套管的尖端之外,因此必须注意确保放置将导致CAR-T细胞递送到感兴趣的区域。治疗套管的投影长度可以定制,根据作者的经验,0.5毫米是一个有用的投影长度。该长度可确保治疗药物在分配时不会留在引导套管中,但也不需要将引导套管的D / V坐标显着调整到感兴趣的区域。该方案中的另一个重要步骤是在CAR-T细胞输注后将治疗套管留在原位的时间。输注结束后,治疗套管应保持至少1分钟,以防止CAR-T细胞治疗的泄漏和局部区域递送的损失。
排除此方法的故障很简单,大多数并发症涉及难以移除假套管或将治疗套管插入固定导引套管,可能是由于导引套管内部的干血。这可以通过轻轻地将假套管穿过导向套管,直到阻力较小并且碎片被清除来轻松解决。丙烯酸树脂偶尔会从头骨上脱落,导致套管系统的丧失。根据我们的经验,这通常受到用手术刀划伤头骨和放置两个螺钉的限制。此外,笼子中任何可能在鼠标四处移动时意外对套管施加力的物品都会被移除,例如带有小开口的特定小鼠浓缩小屋。
总之,这里描述的是用于在CNS肿瘤的小鼠模型中插入套管系统的方案,用于重复递送CAR-T细胞。插管位置可以调整到多个区域交付位置,测试不同交付地点的功效。此外,该系统可用于CAR-T细胞以外的其他治疗方法,以评估绕过血脑屏障时的疗效,并且还可用于评估非肿瘤性疾病小鼠模型中的治疗药物。
披露声明
JBF拥有与glypican 2(GPC2)定向免疫疗法相关的专利。所有其他作者都没有什么可透露的。
致谢
这项工作的资金由Matthew Larson基金会,Grayson Save Foundation,Hyundai Hope on Wheels青年研究员奖,Kortney Rose基金会,美国国立卫生研究院NCI K12 CA076931-19和1K08CA263179-01以及国防部W81XWH-21-1-0221提供。
材料
| Name | Company | Catalog Number | Comments |
| 18 G needles | BD | 511097 | 1 1/2 inch metal hub |
| Acrylic resin liquid | Lang Dental | B1323 | |
| Acrylic resin powder | Lang Dental | B1323 | |
| Alcohol wipes | BD | 326895 | |
| Centrifuge 5240 | Eppendorf | 5420000040 | Centrifuge |
| Cotton tipped swabs | Puritan | 826-WC | Handle Width = 2.11 mm (0.083), Head Width = 1.27 mm (0.050), Handle Length = 147.62 mm (5.812), Overall Length = 152.4 mm (6), Head Length = 12.7 mm (0.500) |
| Drill bit holder | P1 Technologies | DH-1 | Drill bit holder for D56-D70 |
| Drill bit | P1 Technologies | D58 | 1.07 mm |
| Dummy cannula | P1 Technologies | C315DCS-5/SPC | Configuration: Small cap; Length: Cut 5.00 mm below pedestal; Projection: 0.50 mm |
| Flat tip screwdriver | P1 Technologies | SD-80 | Screwdriver |
| Graefe forceps | Fine Science Tools | 11051-10 | Forceps |
| Guide cannula | P1 Technologies | C315GS-5/SPC | Configuration: 5.00 mm pedestal height; Length: Cut 5.00 mm below pedestal |
| Hemostatic cotton pellets with racemic epinephrine | Pascal | 1151602 | |
| MOXI Z Mini automated cell counter Kit | Moxi | MXZ001 | Cell counter |
| NOD scid gamma (NSG) mice | Jackson Laboratory | 5557 | 6 to 12-week-old males and females |
| Pasteur pipet | VWR | 14673-043 | |
| PKG tubing | P1 Technologies | C313CT | Diameter: 0.58 mm x 1.27 mm |
| Porcelain 12 well plate | Flinn Scientific | AP6064 | |
| Povidone iodine | Medline | MDS093943 | |
| Scalpel | World Precision Instrument | 50-822-457 | Disposable Scalpel, no.10, sterile, 10/box, Plastic Handle with 6" Ruler |
| Screws | P1 Technologies | 0-80 X 3/32 | 2.4 mm |
| Stereotaxic Frame | David Kopf Instruments | 940 | Model 940 Small Animal Stereotaxic Instrument with Digital Display Console |
| Student fine scissors | Fine Science Tools | 91460-12 | Scissors |
| Treatment cannula | P1 Technologies | C315IS-5/SPC | 33GA; Configuration: Standard internal; Length: Cut 5.00 mm below pedestal; Projection: 0.50 mm |
| Treatment syringes | Hamilton | 87908 | 5 µL, Model 75 Cemented Needle Special (SN) Syringe, 75SN/22/0.5"/PT3 |
| Vactrap XL | Foxx Life Sciences | 305-4401-FLS | Vacuum System |
参考文献
- Curtin, S. C., Minino, A. M., Anderson, R. N. Declines in cancer death rates among children and adolescents in the United States, 1999-2014. NCHS Data Brief. 257, 1-8 (2016).
- Rohaan, M. W., Wilgenhof, S., Haanen, J. B. A. G. Adoptive cellular therapies: the current landscape. Virchows Archiv. 474 (4), 449-461 (2019).
- Sadelain, M., Brentjens, R., Riviere, I. The basic principles of chimeric antigen receptor design. Cancer Discovery. 3 (4), 388-398 (2013).
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. The New England Journal of Medicine. 378 (5), 439-448 (2018).
- Wagner, J., Wickman, E., DeRenzo, C., Gottschalk, S. CAR T cell therapy for solid tumors: Bright future or dark reality. Molecular Therapy. 28 (11), 2320-2339 (2020).
- Vitanza, N. A., et al. Locoregional infusion of HER2-specific CAR T cells in children and young adults with recurrent or refractory CNS tumors: an interim analysis. Nature Medicine. 27 (9), 1544-1552 (2021).
- Majzner, R. G., et al. GD2-CAR T cell therapy for H3K27M-mutated diffuse midline gliomas. Nature. 603 (7903), 934-941 (2022).
- Vitanza, N. A., et al. Intraventricular B7-H3 CAR T cells for diffuse intrinsic pontine glioma: preliminary first-in-human bioactivity and safety. Cancer Discovery. 13 (1), 114-131 (2023).
- Theruvath, J., et al. Locoregionally administered B7-H3-targeted CAR T cells for treatment of atypical teratoid/rhabdoid tumors. Nature Medicine. 26 (5), 712-719 (2020).
- Donovan, L. K., et al. Locoregional delivery of CAR T cells to the cerebrospinal fluid for treatment of metastatic medulloblastoma and ependymoma. Nature Medicine. 26 (5), 720-731 (2020).
- Brown, C. E., et al. Regression of glioblastoma after chimeric antigen receptor T-Cell therapy. The New England Journal of Medicine. 375 (26), 2561-2569 (2016).
- Bourne, J. A. Intracerebral microdialysis: 30 years as a tool for the neuroscientist. Clinical and Experimental Pharmacology and Physiology. 30 (1-2), 16-24 (2003).
- Zhou, P., et al. Automatically detecting bregma and lambda points in rodent skull anatomy images. PLoS One. 15 (12), 0244378 (2020).
- Foster, J. B., et al. Development of GPC2-directed chimeric antigen receptors using mRNA for pediatric brain tumors. Journal for Immunotherapy of Cancer. 10 (9), 004450 (2022).
- Akhavan, D., et al. T cells for brain tumors: Lessons learned and road ahead. Immunological Reviews. 290 (1), 60-84 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。