Method Article
マウスにおける連続局所キメラ抗原受容体(CAR)T細胞注入のための頭蓋内カニューレ移植
要約
中枢神経系(CNS)腫瘍は、小児のがん関連死の主な原因であり、局所免疫ベースの治療法は、臨床試験で患者に対してますますテストされています。このプロトコルは、CNS腫瘍を標的とする免疫療法注入の前臨床評価のためのマウスへの局所カニューレ移植の方法を記載しています。
要約
小児中枢神経系腫瘍は、化学療法と放射線療法の進歩にもかかわらず、小児の癌関連死亡の大部分の原因であり、予後不良です。多くの腫瘍は効果的な治療法を欠いているため、免疫療法などのより有望な治療オプションを開発することが非常に重要です。CNS腫瘍に対するキメラ抗原受容体(CAR)T細胞療法の使用は特に興味深い。B7-H3、IL13RA2、およびジシアロガングリオシドGD2などの細胞表面標的は、いくつかの小児および成人CNS腫瘍の表面に高発現しており、これらおよび他の表面標的に対してCAR-T細胞療法を使用する機会を高めている。前臨床マウスモデルにおけるCAR T細胞の繰り返し局所送達を評価するために、現在ヒト臨床試験で使用されている留置カテーテルを再現する留置カテーテルシステムが確立されました。定位送達とは異なり、留置カテーテルシステムは、複数の手術を使用せずに繰り返し投与することができます。このプロトコルは、小児脳腫瘍の同所性マウスモデルで連続CAR T細胞注入を正常にテストするために使用された固定ガイドカニューレの腫瘍内配置について説明しています。マウスにおける腫瘍細胞の同所性注射および生着に続いて、固定ガイドカニューレの腫瘍内留置を定位装置上に完了させ、スクリューおよびアクリル樹脂で固定する。次に、治療用カニューレを固定ガイドカニューレに挿入し、CAR T細胞送達を繰り返します。ガイドカニューレの定位配置は、CAR T細胞を側脳室または脳内の他の場所に直接送達するように調整することができる。このプラットフォームは、これらの壊滅的な小児腫瘍に対するCAR T細胞の繰り返し頭蓋内注入やその他の新しい治療法の前臨床試験のための信頼できるメカニズムを提供します。
概要
化学療法、放射線療法、手術の改善にもかかわらず、中枢神経系(CNS)腫瘍は小児科で最も致命的な悪性腫瘍であり1、より成功した結果をもたらす新しいアプローチの重要な必要性を強調しています。免疫療法の分野における大きな進歩に伴い、養子細胞療法(ACT)アプローチは、さまざまな癌、特に血液悪性腫瘍で有望な結果を示しています2。特定のタイプのACTであるキメラ抗原受容体(CAR)T細胞療法は、T細胞の特異性をリダイレクトして腫瘍標的T細胞を生成することにより、有害な細胞を認識して殺す免疫系の自然な能力を利用します3。CAR T細胞療法は、白血病およびリンパ腫の治療において大きな成功を収めており4、有望な免疫療法アプローチとなり、固形腫瘍におけるその研究を奨励しています。しかし、これまでのところ、固形腫瘍におけるCAR T細胞療法は臨床的成功をほとんど達成しておらず、非効率的な腫瘍浸透、限られた標的抗原、抑制的な腫瘍微小環境など、多くの課題に直面しています5。
最近の臨床試験では、小児中枢神経系腫瘍に対するCAR T細胞療法の評価が開始されており、予備報告6,7,8で概念実証とT細胞活性の初期証拠を提供しています。ほとんどの初期の前臨床データはCAR T細胞の静脈内送達に焦点を当てていましたが、最近の前臨床証拠はCNS 9,10における局所送達の優位性を示唆しており、これはいくつかの臨床試験でも成功裏に利用されています6,7,8,11.CNSにおけるCAR T細胞の局所送達を組み込んだこれまでの前臨床試験は、定位的に送達されたCAR T細胞の単回頭蓋内用量に依存してきた9、10。しかし、ヒトでの臨床試験では、CNS 6,7,8,11にCAR-T細胞を繰り返し注入する必要があり、前臨床開発における複数回の反復注入を評価する必要性を強調しています。.この手順の目標は、小児脳腫瘍の同所性マウスモデルでカテーテルを使用して連続CAR-T細胞注入を正常にテストすることです。この技術の利点は、繰り返しCNS内治療を提供するための複数の外科的処置の回避である。カニューレは主に、げっ歯類の神経科学および行動研究における神経伝達物質の微量透析サンプリングおよび神経活性物質の送達に使用されてきました12、抗癌治療薬の送達への使用の報告は限られています。以前の報告に基づいて、このプロトコルは、定位的に配置された留置カニューレシステムを使用して、CNS腫瘍の異種移植マウスモデルにCAR-T細胞を送達します。このプロトコルは、神経疾患または神経腫瘍学的障害のマウスモデルで追加の治療法をテストするために利用でき、血液脳関門をバイパスすることが有効性にとって重要である新しい治療法をテストするのに役立つ可能性があります。
プロトコル
すべてのプロトコル手順は、AAALACによって認定されているフィラデルフィア小児病院の施設動物管理および使用委員会(IAC 19-000907)によって承認されました。この研究では、同所性異種移植片腫瘍を有する6〜12週齢のNOD scid γ(NSG)マウスを使用しました。しかしながら、このプロトコルは、任意のマウス系統に利用することができる。NSGマウスを無菌バリア条件で飼育し、手術は無菌のバイオセーフティキャビネットの下で行った。腫瘍細胞やT細胞などのヒト材料を使用する場合、手順と取り扱いはABSL-2バイオセーフティキャビネットで完了する必要があります。
1.手術のためのマウスの準備
- 適切な麻酔面に達するまで(約5分)、イソフルラン(2〜4%)を酸素流量1 L / minで誘導チャンバーでマウスを麻酔します。.
- 体重計を使用してマウスの体重を0.1 g近くまで増やし、皮下徐放性(SR)ブプレノルフィン(1 mg / kg)またはその他の鎮痛剤を投与します。.
注:SRブプレノルフィンは72時間の鎮痛を提供します。 - 電気バリカンまたは脱毛剤を使用して、マウスの頭のてっぺんの毛皮を剃ります。
- ヘラを使って定位アームの底をそっと開き、鉗子を使ってガイドカニューレを挿入します。カニューレの白いプラスチック部分の約1/2〜2/3が開口部の底から突き出るように、カニューレのネジを締めてカニューレを固定します。
- マウスの上歯を脳定位固定装置のバイトバーに挿入して固定します。ノーズコーンを前方に引いて締め、マウスがイソフルランを吸入していることを確認します。
- 過度の圧力を避けて、イヤーカフまたはイヤーバーを使用して、温められた定位固定装置にマウスを取り付けます。
注意: ウォームトレイには直腸体温計を挿入し、ウォーミングトレイは手順中にマウスの正常な体温を維持するように調整する必要があります。 - 綿の先端のアプリケーターを使用して、滅菌眼科用軟膏を両目に塗ります。
- パッドまたはアプリケーター上のポビドンヨードで手術部位を拭き、続いてアルコールパッドを拭きます。この手順を合計 3 回実行します。
- 手順を開始する前に、鉗子でつま先をつまんで、適切な鎮静を評価します。
2.外科的処置
注:外科的処置のすべての側面は、滅菌器具と無菌技術を利用しています。マウスは、処置の期間中、約10〜20分間、イソフルラン(2〜4%)による麻酔下で継続する。
- 鉗子で耳の間の頭皮をそっと持ち上げます。滅菌ハサミを使用して、頭蓋骨と平行に持ち上げた頭皮を切り、皮膚の楕円形の皮弁(長さ0.75〜1 cm)を取り除き、頭蓋骨を露出させます。
注意: はさみは、清潔で楕円形の開口部を提供し、周囲の皮膚や組織への不必要な損傷を防ぐために、メスよりも好まれます。 - メスまたは綿先の綿棒と止血綿ペレットを使用して筋膜を押しのけ、必要に応じて過度の出血を遅らせます。
注意: 滅菌綿の先端の木製側を使用すると、筋膜を押しのけて、過度の出血を防ぐこともできます。 - ランドマークのブレグマとラムダ、頭蓋板が出会う頭蓋骨のそれぞれの前部と後部のマークを特定します13。
注:露出した頭蓋骨の上部を過酸化水素で拭くことで識別を強化できます。 - メスを使用して頭蓋骨をそっと刻み、アクリルを取り付ける表面を作成します。スコアリングには、互いに90°の角度で長さ約0.5〜1 cmの複数の直線を含める必要があります。
- 定位固定アームを使用して、カニューレを目的のランドマーク(ブレグマまたはラムダ)にローカライズします。局在化したら、カニューレの先端を頭蓋骨の表面から1〜2 mm上に上げ、目的の座標に移動します。腫瘍内注射の場合、これは腫瘍配置と同じA / PおよびM / L座標を使用します。
- カニューレが入る領域から離れた露出した頭蓋骨に、18 Gの針または外科用ドリルで2つのネジ穴を開けます。カニューレのための十分なスペースを含むように穴が間隔を空けていることを確認してください。ドリルビットを使用して、頭蓋骨に引っかかるまでネジ穴をひねります。マイナスドライバーを使用して、2本のネジを穴に挿入して固定します。次に、ネジをそっと引き上げて、ネジが固定されていることを確認します。
注意: 頭蓋骨と同じ高さになるまでネジを挿入しないでください、またはネジは下のマウスの脳を損傷する可能性があります。ネジと頭蓋骨の間に少なくとも1〜2 mmの隙間を残します。 - 18 Gの針または外科用ドリルを使用して、識別された座標で頭蓋骨にドリルで穴を開け、カニューレを挿入するための穴を作成します。
- 定位アームを使用して、カニューレを目的のD / V座標まで下げます。
注:カニューレ移植のD/V座標は、ダミーおよび治療用カニューレの投影長を考慮する必要があり、腫瘍細胞の同所性注射よりも表面的である可能性があります(図1)。 - 磁器の12穴プレートに、1ウェルにアクリル樹脂粉末(約0.3g)とアクリル樹脂液10〜15滴(約0.5〜0.75mL)を充填する。これにより、粘性のある白色の材料が生成されます。混合物を1 mLシリンジに吸い込み、それを使用して頭蓋骨をコーティングして覆い、カニューレとネジの周りのスペースを埋めます。
注意: 粘性材料は時間の経過とともにセメントに硬化するため、このステップは混合後すぐに完了する必要があります。 - セメントがまだ柔軟である間に、定位アームのネジを緩め、下部の開口部にヘラを使用してカニューレをホルダーからそっと解放し、定位アームをマウスからゆっくりと上に引っ込めます。
- セメントが完全に乾いたら、ダミーのカニューレをガイドカニューレに挿入し、時計回りに回してしっかりと固定します。
- 手順が完了したら、マウスを温めたホームケージに戻し、注意深く監視し、適切な回復を確認し、マウスが完全に意識を取り戻したことなど、手順後の観察を記録してからコロニーに戻ります。
注意: 過熱を避けるために、動物が涼しい側に移動できるように、ケージの半分だけを加熱パッドに置くことをお勧めします。 - マウスが術後の痛みを示す行動を示す場合は、メロキシカム5 mg / kgを1日1回最大3日間皮下投与するなど、必要に応じて追加の鎮痛薬を投与します。.
3. CAR T細胞の調製
- セルカウンターを使用して、事前にトランスフェクトされたCAR T細胞濃度を測定します。
- プリトランスフェクトしたT細胞を200 x g で室温(RT)で5分間遠心分離します。
- 真空吸引システム上で滅菌パスツールピペットを使用して上清を吸引し、ペレットをホスファエ緩衝生理食塩水(PBS)に所望の濃度に再懸濁します。典型的な送達量は2〜5μLであり、典型的な細胞用量は0.5〜5 x 106 細胞である。
4.CAR T細胞注入
- PKGチューブの小片を通して上部を供給して、治療カニューレを準備します。
- 治療用シリンジにCAR T細胞懸濁液を満たし、治療用カニューレの上部を覆うのに十分なPKGチューブのもう一方の端に挿入します。
- マウスをイソフルラン(2〜4%)で1 L / minの酸素流量で麻酔します。
- ベースの鉗子を使用してガイドカニューレを安定させ、ダミーカニューレを慎重に緩めて取り外し、ガイドカニューレにアクセスできるようにします。
注:定位固定装置のセットアップは必要ありませんが、治療のために頭を安定させるために使用できます。 - CAR T細胞を1分間注入し、注入の停止後さらに1分間治療カニューレを所定の位置に保持します。.
- 治療用カニューレを取り外し、ダミーカニューレをしっかりとねじ込みます。
- オプションの疼痛管理のために皮下メロキシカム(5 mg / kg)を投与します。.
結果
マウス中枢神経系へのカニューレ移植に成功
カニューレ挿入が成功したマウスは、日常生活動作に支障をきたさず(図2A)、治療用カニューレを容易に通過させ、抵抗なく体液を送達できる安全なガイドカニューレを備えています(図2B)。私たちの経験では、カニューレの大部分は4週間以上そのまま残りますが、0〜25%は時間の経過とともに取り除くことができます。正しい配置の検証は、カニューレに注入されたエバンスブルー染料で確認できます。たとえば、側脳室に挿入されたカニューレは、脳脊髄液を通過するときに心室系全体にエバンスの青い染料を示し、正しい配置を確認します(図2C)。腫瘍に挿入されたカニューレは、腫瘍移植部位にエバンスブルー染料を示す。
異種移植片腫瘍の治療のためのCNSへのCAR-T細胞の効果的な送達。
マウスモデルにおける頭蓋内カニューレ系の有効性とCAR T細胞の治療効果は、生物発光イメージングや全生存期間など、さまざまなメカニズムを通じて測定できます。GPC2指向性CAR T細胞を、マウス髄芽腫およびびまん性正中線神経膠腫モデル、それぞれ7316〜4509および7316〜3058に対して、述べられた頭蓋内カニューレ系を介した反復CAR T細胞投与を用いて試験した14。同所性腫瘍の配置と生着を生物発光イメージングによって確認し、同所性腫瘍の配置と同じ座標を使用してカニューレを腫瘍床に配置しました。治療は、GPC2 CAR T細胞注入を週に1〜2回、2〜4週間、合計4〜6回投与することで構成されていました。治療後、GPC2指向性CAR T細胞療法は、髄芽腫モデル7316-4509(p < 0.01)において有意な腫瘍退縮を誘導し(図3A)、視床びまん性正中線グリオーマ7316-3058(p < 0.05)において有意に生存期間を延長した(図3B)14。

図1:投影ダミーと治療用カニューレを備えたガイドカニュー レ。 (A)0.5mmの突起と2mmの突起ダミーカニューレが所定の位置にあるガイドカニューレ。(B)0.5mmの突起と2mmの突起処理カニューレを所定の位置に置いたガイドカニューレ。 この図の拡大版を表示するには、ここをクリックしてください。
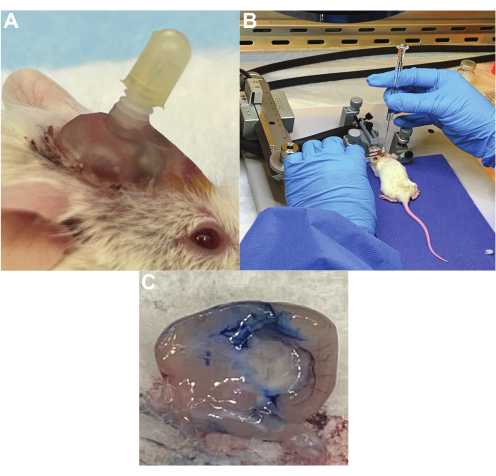
図2:CAR T細胞の反復投与のための治療カニューレ送達システム 。 (A)使用しないときはキャップをした状態でマウスの頭蓋骨に埋め込まれたカニューレ。(B)マウスが麻酔下にある間に、治療用カニューレ を介して 橋腫瘍にCAR T細胞を注入します。(C)エバンスブルー染料を使用した側脳室内のカニューレ配置の検証。色素をカニューレに挿入し、続いて安楽死と脳切除を行い、脳室全体に色素が存在しました。 この図の拡大版を表示するには、ここをクリックしてください。
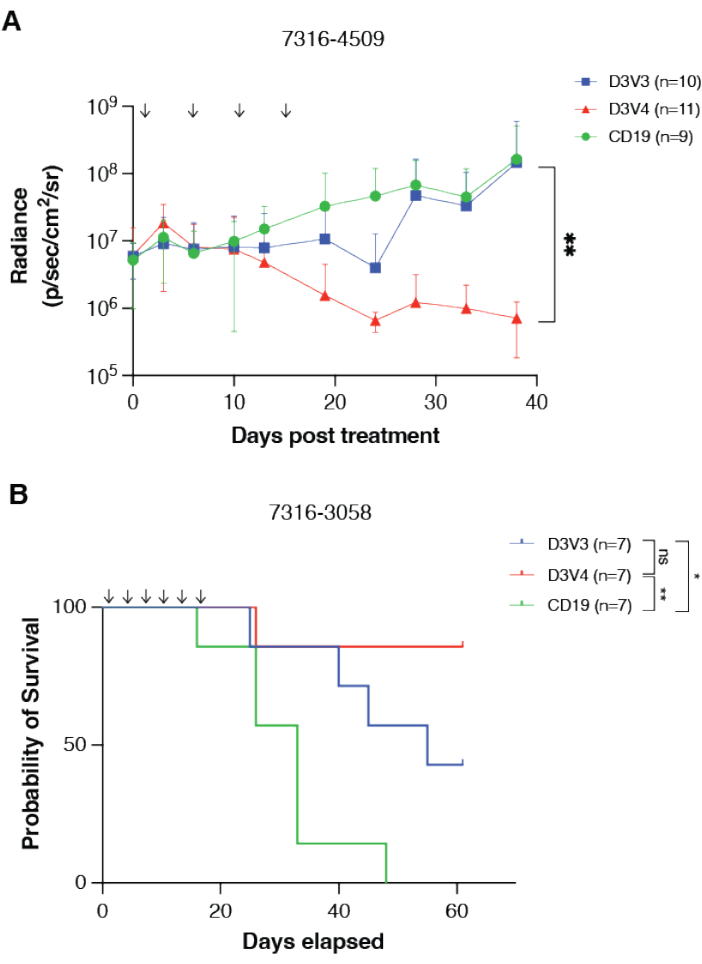
図3:GPC2指向性CAR T細胞は、in vivoで小児脳腫瘍の抗腫瘍応答を媒介し、生存期間を延長します。 (A)GPC2またはCD19指向性mRNA CAR T細胞のいずれかで処理された同所性グループ4髄芽腫異種移植片7316-4509の生物発光の定量。線量はグラフ上の矢印で示されています。データはSDで平均して表示し、n=1群あたり9〜11匹のマウス。(B)視床DMG異種移植片7316-3058を移植したマウスの全生存期間を、2 x 10 6 CAR T細胞の6回の反復投与で処理した。線量はグラフ上の矢印で示されています。n=1群あたり7匹のマウス。**p < 0.01;*p < 0.05;ns = 有意ではない。この図は、Fosterらの許可を得て複製されている14。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
CAR T細胞療法は血液がんの治療に革命をもたらし、固形脳腫瘍の治療に有望な価値を示しています6,7,8。このプロトコルは、小児CNS腫瘍の治療のための局所CAR-T細胞送達の前臨床評価を可能にするように設計されました。カニューレシステムは、小児CNS腫瘍におけるCAR T細胞療法の進行中の臨床試験で現在使用されている脳室内カテーテルシステムであるオンマヤまたはリッカムリザーバーを複製し6、7、8、これらの方法の関連性と翻訳の可能性を強調しています。このシステムは、血液脳関門をバイパスするCAR T細胞の繰り返し送達を可能にし、これも進行中の臨床試験で採用されている方法と同様である。局所送達は、CNS9において最大の有効性を提供することができ、循環からの人身売買に関連する全身毒性のリスクも低減し得る15。定位送達はCNSに単回投与を提供することができるが、このシステムの利点は、複数回の手術を必要とせずに、CNS内の指定された場所に複数回の反復投与を提供する機会である。この手順の制限には、カニューレが設置された後、場所を変更したり調整したりする機能のない固定された配送サイト、およびカニューレが外れる可能性があることが含まれます。
このプロトコルの重要なステップは、治療用カニューレの投影を考慮したD/V座標での固定ガイドカニューレの移植です。治療用カニューレはガイドカニューレの先端からはみ出しているため、配置によってCAR T細胞が関心領域に送達されるように注意する必要があります。治療カニューレの投影長はカスタマイズでき、著者の経験では、0.5mmが有用な投影長さです。この長さは、分注時に治療剤がガイドカニューレに残らないようにするだけでなく、ガイドカニューレのD/V座標を関心領域に大幅に調整する必要もありません。このプロトコルの追加の重要なステップは、CAR T細胞注入後に治療カニューレが所定の位置に残される時間です。治療カニューレは、CAR T細胞療法の漏れや局所送達の喪失を防ぐために、注入終了後少なくとも1分間所定の位置に保持する必要があります。.
この方法のトラブルシューティングは簡単で、ほとんどの合併症は、ガイドカニューレの内部に乾燥した血液があるために、ダミーカニューレを取り外したり、治療用カニューレを固定ガイドカニューレに挿入したりするのが難しいことを含みます。これは、抵抗が少なくなり、破片が取り除かれるまで、ダミーのカニューレをガイドカニューレにそっと通すことで簡単に解決できます。アクリル樹脂は時折頭蓋骨から外れ、カニューレシステムが失われることがあります。私たちの経験では、これは一般的にメスで頭蓋骨にスコアを付け、2本のネジを配置することによって制限されます。さらに、マウスが動き回っている間に誤ってカニューレに力を加える可能性のあるケージからのアイテム(小さな開口部のある特定のマウス濃縮小屋など)は削除されます。
結論として、本明細書に記載されるのは、CAR T細胞の反復送達のためのCNS腫瘍のマウスモデルにおけるカニューレ系の挿入のためのプロトコールである。カニューレの配置は、複数の局所的な配送場所に調整でき、さまざまな配送サイトの有効性をテストできます。さらに、このシステムは、血液脳関門をバイパスした場合の有効性を評価するために、CAR T細胞以外の追加の治療法に使用でき、非腫瘍性疾患のマウスモデルにおける治療法の評価にも役立つ可能性があります。
開示事項
JBFは、グリピカン2(GPC2)指向性免疫療法に関連する特許を保有しています。他のすべての著者は開示するものは何もありません。
謝辞
この研究の資金は、マシューラーソン財団、グレイソンセーブ財団、ヒュンダイホープオンホイール若手研究者賞、コートニーローズ財団、国立衛生研究所NCI K12 CA076931-19および1K08CA263179-01、および国防総省W81XWH-21-1-0221によって提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 18 G needles | BD | 511097 | 1 1/2 inch metal hub |
| Acrylic resin liquid | Lang Dental | B1323 | |
| Acrylic resin powder | Lang Dental | B1323 | |
| Alcohol wipes | BD | 326895 | |
| Centrifuge 5240 | Eppendorf | 5420000040 | Centrifuge |
| Cotton tipped swabs | Puritan | 826-WC | Handle Width = 2.11 mm (0.083), Head Width = 1.27 mm (0.050), Handle Length = 147.62 mm (5.812), Overall Length = 152.4 mm (6), Head Length = 12.7 mm (0.500) |
| Drill bit holder | P1 Technologies | DH-1 | Drill bit holder for D56-D70 |
| Drill bit | P1 Technologies | D58 | 1.07 mm |
| Dummy cannula | P1 Technologies | C315DCS-5/SPC | Configuration: Small cap; Length: Cut 5.00 mm below pedestal; Projection: 0.50 mm |
| Flat tip screwdriver | P1 Technologies | SD-80 | Screwdriver |
| Graefe forceps | Fine Science Tools | 11051-10 | Forceps |
| Guide cannula | P1 Technologies | C315GS-5/SPC | Configuration: 5.00 mm pedestal height; Length: Cut 5.00 mm below pedestal |
| Hemostatic cotton pellets with racemic epinephrine | Pascal | 1151602 | |
| MOXI Z Mini automated cell counter Kit | Moxi | MXZ001 | Cell counter |
| NOD scid gamma (NSG) mice | Jackson Laboratory | 5557 | 6 to 12-week-old males and females |
| Pasteur pipet | VWR | 14673-043 | |
| PKG tubing | P1 Technologies | C313CT | Diameter: 0.58 mm x 1.27 mm |
| Porcelain 12 well plate | Flinn Scientific | AP6064 | |
| Povidone iodine | Medline | MDS093943 | |
| Scalpel | World Precision Instrument | 50-822-457 | Disposable Scalpel, no.10, sterile, 10/box, Plastic Handle with 6" Ruler |
| Screws | P1 Technologies | 0-80 X 3/32 | 2.4 mm |
| Stereotaxic Frame | David Kopf Instruments | 940 | Model 940 Small Animal Stereotaxic Instrument with Digital Display Console |
| Student fine scissors | Fine Science Tools | 91460-12 | Scissors |
| Treatment cannula | P1 Technologies | C315IS-5/SPC | 33GA; Configuration: Standard internal; Length: Cut 5.00 mm below pedestal; Projection: 0.50 mm |
| Treatment syringes | Hamilton | 87908 | 5 µL, Model 75 Cemented Needle Special (SN) Syringe, 75SN/22/0.5"/PT3 |
| Vactrap XL | Foxx Life Sciences | 305-4401-FLS | Vacuum System |
参考文献
- Curtin, S. C., Minino, A. M., Anderson, R. N. Declines in cancer death rates among children and adolescents in the United States, 1999-2014. NCHS Data Brief. 257, 1-8 (2016).
- Rohaan, M. W., Wilgenhof, S., Haanen, J. B. A. G. Adoptive cellular therapies: the current landscape. Virchows Archiv. 474 (4), 449-461 (2019).
- Sadelain, M., Brentjens, R., Riviere, I. The basic principles of chimeric antigen receptor design. Cancer Discovery. 3 (4), 388-398 (2013).
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. The New England Journal of Medicine. 378 (5), 439-448 (2018).
- Wagner, J., Wickman, E., DeRenzo, C., Gottschalk, S. CAR T cell therapy for solid tumors: Bright future or dark reality. Molecular Therapy. 28 (11), 2320-2339 (2020).
- Vitanza, N. A., et al. Locoregional infusion of HER2-specific CAR T cells in children and young adults with recurrent or refractory CNS tumors: an interim analysis. Nature Medicine. 27 (9), 1544-1552 (2021).
- Majzner, R. G., et al. GD2-CAR T cell therapy for H3K27M-mutated diffuse midline gliomas. Nature. 603 (7903), 934-941 (2022).
- Vitanza, N. A., et al. Intraventricular B7-H3 CAR T cells for diffuse intrinsic pontine glioma: preliminary first-in-human bioactivity and safety. Cancer Discovery. 13 (1), 114-131 (2023).
- Theruvath, J., et al. Locoregionally administered B7-H3-targeted CAR T cells for treatment of atypical teratoid/rhabdoid tumors. Nature Medicine. 26 (5), 712-719 (2020).
- Donovan, L. K., et al. Locoregional delivery of CAR T cells to the cerebrospinal fluid for treatment of metastatic medulloblastoma and ependymoma. Nature Medicine. 26 (5), 720-731 (2020).
- Brown, C. E., et al. Regression of glioblastoma after chimeric antigen receptor T-Cell therapy. The New England Journal of Medicine. 375 (26), 2561-2569 (2016).
- Bourne, J. A. Intracerebral microdialysis: 30 years as a tool for the neuroscientist. Clinical and Experimental Pharmacology and Physiology. 30 (1-2), 16-24 (2003).
- Zhou, P., et al. Automatically detecting bregma and lambda points in rodent skull anatomy images. PLoS One. 15 (12), 0244378 (2020).
- Foster, J. B., et al. Development of GPC2-directed chimeric antigen receptors using mRNA for pediatric brain tumors. Journal for Immunotherapy of Cancer. 10 (9), 004450 (2022).
- Akhavan, D., et al. T cells for brain tumors: Lessons learned and road ahead. Immunological Reviews. 290 (1), 60-84 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved