Method Article
تتبع العتبة الكهربائية ذات الحلقة المغلقة في الوقت الفعلي مفتوحة المصدر لأبحاث الألم الانتقالية
In This Article
Summary
APTrack هو مكون إضافي برمجي تم تطويره لمنصة Open Ephys التي تتيح تصور البيانات في الوقت الفعلي وتتبع العتبة الكهربائية ذات الحلقة المغلقة لإمكانات العمل العصبي. لقد استخدمنا هذا بنجاح في تصوير الأعصاب الدقيقة لمستقبلات الألم البشرية من الألياف C ومستقبلات الألم من الألياف C والألياف Aδ.
Abstract
مستقبلات الألم هي فئة من الخلايا العصبية الواردة الأولية التي تشير إلى محفزات ضارة محتملة. تحدث زيادة في استثارة مستقبلات الألم في حالات الألم الحاد والمزمن. ينتج عن هذا نشاط مستمر غير طبيعي أو انخفاض عتبات التنشيط إلى محفزات ضارة. مطلوب تحديد سبب هذه الإثارة المتزايدة لتطوير العلاجات القائمة على الآلية والتحقق من صحتها. يمكن لتتبع العتبة الكهربائية للخلايا العصبية المفردة تحديد استثارة مستقبلات الألم. لذلك ، قمنا بتطوير تطبيق للسماح بمثل هذه القياسات وإثبات استخدامها في البشر والقوارض. يوفر APTrack تصورا للبيانات في الوقت الفعلي وتحديد إمكانات الإجراء باستخدام مخطط نقطي زمني. تكتشف الخوارزميات إمكانات الفعل عن طريق عبور العتبة وتراقب زمن وصولها بعد التحفيز الكهربائي. ثم يقوم المكون الإضافي بتعديل سعة التحفيز الكهربائي باستخدام طريقة من أعلى إلى أسفل لتقدير العتبة الكهربائية لمستقبلات الألم. تم بناء البرنامج على نظام Open Ephys (V0.54) وتم ترميزه في C ++ باستخدام إطار عمل JUCE. يعمل على أنظمة تشغيل ويندوز ولينكس وماك. الكود مفتوح المصدر متاح (https://github.com/
Introduction
مستقبلات الألم هي خلايا عصبية واردة أولية في الجهاز العصبي المحيطي يتم تنشيطها من خلال الأحداث العلنية أو التي يحتمل أن تكون ضارة بالأنسجة وتلعب دورا وقائيا حاسما في الألم الحاد1. كشفت التسجيلات الفيزيولوجية الكهربية من مستقبلات الألم من الألياف C والألياف Aδ في النماذج الحيوانية والمتطوعين البشريين الأصحاء والمرضى عن التحسس والنشاط التلقائي غير الطبيعي في مجموعة متنوعة من حالات الألم2،3،4،5،6،7. إن فهم الآليات التي تكمن وراء هذه التغييرات في استثارة مستقبلات الألم لدى المرضى يمكن أن يتيح التدخلات العلاجية المستهدفة8. ومع ذلك ، هناك عدد قليل من الأدوات لتقييم استثارة مستقبلات الألم مباشرة ، لا سيما في المرضى9 ، ولكن إمكانية فائدة هذه الأدوات معترف بها جيدا10,11.
يمكن استخدام تتبع العتبة الكهربائية للأعصاب الكاملة لفحص استثارة المحور العصبي لدى البشر12. ومع ذلك ، نظرا لأن الخلايا العصبية الطرفية الكبيرة الميالينية تساهم بشكل غير متناسب في سعة جهد عمل المركب الحسي ، فإن تتبع العتبة الكهربائية للأعصاب الكاملة لا يسمح بتقييم وظيفة الألياف C11,13. في الواقع ، في دراسة سابقة ، لم يظهر تتبع العتبة الكهربائية للعصب الكامل في مجموعات آلام الأعصاب المزمنة مع اعتلال الأعصاب السكري واعتلال الأعصاب الناجم عن العلاج الكيميائي أي اختلافات في استثارة المحورالعصبي 11.
في دراسة سابقة ، تم استخدام تتبع العتبة الكهربائية على مستوى الخلايا العصبية المفردة لفحص استثارة مستقبلات الألم من الألياف C أثناء تسجيلات الألياف المثارة في إعداد العصب الجلدي للفئران خارج الجسم الحي 14. أظهر المؤلفون أن زيادة تركيز البوتاسيوم ، والظروف الحمضية ، وبراديكينين كلها زادت من استثارة مستقبلات الألم من الألياف C ، كما ينعكس في انخفاض العتبة الكهربائية لتوليد جهد العمل. علاوة على ذلك ، أدى تسخين المجال المستقبلي لمستقبلات الألم الحساسة للحرارة إلى تقليل عتبتها الكهربائية ، في حين أظهرت مستقبلات الألم غير الحساسة للحرارة زيادة في عتبتها الكهربائية14. يوفر هذا دليلا مهما على أن تتبع العتبة الكهربائية للخلية العصبية المفردة ممكن ويمكن أن يكون مفيدا ، ولكن لا توجد حاليا حلول برامج و / أو أجهزة متاحة لتمكين مثل هذه التحقيقات ، خاصة للدراسات البشرية.
في البشر ، تصوير الأعصاب الدقيقة هو الطريقة الوحيدة المتاحة لتقييم الخصائص الفيزيولوجية الكهربية للأليافC 15 مباشرة. وقد استخدم هذا النهج لإثبات خلل مسبب الألم في المرضى الذين يعانون من الألم المزمن2،3،4،5،6،7. يمكن لتصوير الأعصاب الدقيقة الكشف عن إمكانات عمل الخلايا العصبية المفردة. ومع ذلك ، نظرا لانخفاض نسب الإشارة إلى الضوضاء ، يستخدم الباحثون تقنية الوسم لتوصيف نشاط الألياف C16. في تقنية الوسم ، يتم تطبيق التحفيز الكهربائي فوق العتبة على المجالات المستقبلة للألياف C في الجلد. يولد هذا التحفيز الكهربائي جهد فعل يحدث عند زمن انتقال ثابت ، والذي يتم تحديده بواسطة سرعة توصيل الألياف C. تظهر الألياف C تباطؤا يعتمد على النشاط ، حيث تقل سرعة التوصيل ، وبالتالي يزداد زمن انتقال التوصيل خلال فترات تفريغ جهد العمل17. في ظل الظروف القاعدية ، لا تولد الألياف C عادة إمكانات عمل في حالة عدم وجود محفزات ضارة ، وبالتالي ، فإن زمن انتقال التوصيل استجابة للتحفيز الكهربائي منخفض التردد ثابت. تحفز المحفزات الميكانيكية أو الحرارية أو الدوائية ، التي تثير إطلاق النار ، التباطؤ المعتمد على النشاط ، مما يزيد من زمن انتقال إمكانات الفعل التي يثيرها التحفيز الكهربائي منخفض التردد المصاحب. وهذا يسمح بالتحديد الموضوعي للاستجابات للمحفزات غير الكهربائية المطبقة في سياق انخفاض نسبة الإشارة إلى الضوضاء. لذلك ، يمكن استخدام التباطؤ المعتمد على النشاط لتوصيف الألياف C16 وظيفيا. في الواقع ، تظهر الفئات الوظيفية المختلفة للألياف C أنماطا مميزة من التباطؤ المعتمد على النشاط في نماذج التحفيز الكهربائي التي تتضمن تغيير تردد التحفيز18,19. يمثل هذا التباين في زمن انتقال إمكانات عمل الألياف C تحديا للخوارزميات المصممة لمراقبتها.
يؤدي النشاط المستمر في مستقبلات الألم إلى زيادة التباين في زمن الوصول أثناء التحفيز الكهربائي منخفض التردد ، وهذا يرجع مرة أخرى إلى التباطؤ المعتمد على النشاط. هذا التباين المتزايد ، أو الارتعاش ، هو مقياس بديل قابل للقياس الكميللاستثارة 2. تشمل الأسباب الأخرى للتباين في زمن انتقال جهد الفعل التقليب ، حيث يتم تحفيز الفروع الطرفية البديلة لخلية عصبية واحدة ، مما يؤدي إلى أن يكون لجهد الفعل المستثار أزمنان انتقالان أساسيان (أو أكثر) يستبعد أحدهماالآخر 20. أخيرا ، تتسبب التغيرات في درجة حرارة الفروع الطرفية للخلايا العصبية الطرفية أيضا في حدوث تغييرات في زمن انتقال جهد الفعل بطريقة ديناميكية حرارية ، حيث يؤدي الاحترار إلى زيادة سرعة التوصيل والتبريد إلى إبطاء سرعة التوصيل19. وبالتالي ، فإن أي برنامج يسعى إلى إجراء تتبع عتبة كهربائية مغلقة الحلقة للألياف C المسببة للألم يجب أن يسمح بإجراء تغييرات في زمن الوصول في إمكانات الفعل المستثارة كهربائيا.
لتحقيق هدفنا المتمثل في تتبع العتبة الكهربائية عبر الأنواع لمستقبلات الألم من الألياف C ، قمنا بتطوير APTrack ، وهو مكون إضافي لبرنامج مفتوح المصدر لمنصة Open Ephys21 ، لتمكين تتبع العتبة الكهربائية في الوقت الفعلي والحلقة المغلقة وتتبع زمن الوصول. نحن نقدم بيانات إثبات المفهوم التي توضح أن تتبع العتبة الكهربائية لمستقبلات الألم من الألياف C أثناء تصوير الأعصاب المجهري البشري أمر ممكن. علاوة على ذلك ، نظهر أنه يمكن استخدام هذه الأداة في الفيزيولوجيا الكهربية للألياف خارج الجسم الحي للقوارض ، مما يتيح إجراء دراسات متعدية بين البشر والقوارض. هنا ، سنصف بالتفصيل كيف يمكن للباحثين تنفيذ واستخدام هذه الأداة للمساعدة في دراستهم لوظيفة nociceptor والإثارة.
Protocol
تمت الموافقة على تجارب تصوير الأعصاب المجهري البشري من قبل لجنة أخلاقيات البحث بكلية علوم الحياة في جامعة بريستول (الرقم المرجعي: 51882). أعطى جميع المشاركين في الدراسة موافقة خطية مستنيرة. تم إجراء التجارب على الحيوانات في جامعة بريستول وفقا لقانون الحيوانات في المملكة المتحدة (الإجراءات العلمية) لعام 1986 بعد موافقة مجلس رعاية الحيوان والمراجعة الأخلاقية بجامعة بريستول وتم تغطيتها بترخيص مشروع.
1. تثبيت واجهة المستخدم الرسومية المفتوحة Ephys و APTrack
- راجع وثائق البرنامج للعثور على أحدث إصدار من واجهة المستخدم الرسومية Open Ephys (GUI) المعتمدة (https://github.com/Microneurography/APTrack#readme)، ثم قم بتنزيل واجهة المستخدم الرسومية وتثبيتها.
- قم بتثبيت إصدار متوافق من واجهة المستخدم الرسومية من عنوان URL التالي: https://github.com/open-ephys/plugin-GUI/releases.
- قم بتنزيل أحدث إصدار من GitHub: https://github.com/Microneurography/APTrack/releases. بالنسبة لجهاز كمبيوتر يعمل بنظام Windows ، انسخ ملف .dll إلى مجلد المكونات الإضافية ، والذي يوجد عادة في C: \ Program Files \ Open Ephys \ plugins. بالنسبة لجهاز كمبيوتر يعمل بنظام التشغيل MacOS ، انسخ ملف .bundle إلى مجلد المحتويات / المكونات الإضافية للحزمة.
2. تجميع جهاز التسجيل والتحفيز
- قم بتوصيل لوحة الاستحواذ بالكمبيوتر باستخدام الكبل المرفق من الشركة المصنعة ، وقم بتشغيله.
ملاحظة: بالنسبة لتصوير الأعصاب الدقيقة البشرية ، تم استخدام عازل USB 3.0 لعزل المشارك كهربائيا عن الكمبيوتر ، وتم تشغيل لوحة الاستحواذ بواسطة بطارية محمولة بدلا من مصدر طاقة الجهد الكهربائي المستخدم في دراسات القوارض. تم تمرير جميع اتصالات USB ، باستثناء لوحة التحكم في محرك السائر ، من خلال عازل USB أثناء الدراسات البشرية. - قم بتوصيل لوحة الإدخال / الإخراج بالمنفذ التناظري في لوحة الاستحواذ. قم بتوصيل مرحلة تسجيل Intan RHD بلوحة الاستحواذ باستخدام كابل واجهة طرفية تسلسلية (SPI).
ملاحظة: تم استخدام مرحلة الرأس ثنائية القطب ذات 16 قناة Intan هنا ، ولكن يمكن استخدام مراحل رأس أخرى من سلسلة RHD2000 أحادية القطب. - قم بتوصيل PulsePal بالكمبيوتر22. للتجميع باستخدام محفز تناظري يتم التحكم فيه بالجهد (على سبيل المثال ، DS4) باستخدام PulsePal ، كما هو الحال مع تسجيلات الألياف المثارة بالماوس ، اتبع الخطوات 2.5.1-2.5.3 ؛ للتجميع باستخدام محفز قائم على التشفير الدوار (على سبيل المثال ، DS7) باستخدام محرك متدرج ، كما هو الحال مع تسجيلات تصوير الأعصاب الدقيقة البشرية ، اتبع الخطوات 2.6.1-2.6.8 (الشكل 1).
- قم ببناء سلسلة الإشارة في واجهة المستخدم الرسومية كما هو موضح أدناه.
- أدخل المكون الإضافي Rhythm FPGA في سلسلة الإشارة عن طريق النقر بزر الماوس الأيسر وسحبه إلى سلسلة الإشارة ؛ هذا يربط واجهة المستخدم الرسومية بلوحة الاستحواذ. تأكد من النقر فوق زر ADC لبدء تسجيل قنوات ADC من لوحة الإدخال / الإخراج. سيضيء زر ADC باللون البرتقالي عندما يكون قيد التشغيل.
ملاحظة: إذا كنت ترغب في تشغيل البيانات التجريبية المسجلة مسبقا ، فيمكن استخدام المكون الإضافي File Reader في البداية بدلا من Rhythm FPGA. سيسمح استخدام هذا مع APTrack بالتصور وتتبع زمن الوصول لإمكانات الفعل في التجارب السابقة. - أدخل مرشح تمرير النطاق في سلسلة الإشارة ؛ الإعدادات الافتراضية من 300-6,000 هرتز مناسبة لكل من التسجيلات البشرية والماوس. بالإضافة إلى ذلك ، أدخل الخائن بعده.
- أدخل المكون الإضافي APTrack في سلسلة الإشارة على جانب واحد من الخائن وعارض LFP على الجانب الآخر. يوفر LFP Viewer عرضا تقليديا لتتبع الجهد يشبه راسم الذبذبات ، وهو أمر مفيد أثناء التجارب.
- أدخل عقدة سجل بعد المكون الإضافي. في القائمة المنسدلة ، قم بتغيير تنسيق حفظ البيانات من ثنائي إلى Open Ephys. هذا يكمل سلسلة إشارة بسيطة تعمل بشكل جيد (الشكل 2) ؛ ومع ذلك ، يمكن إضافة مكونات إضافية على النحو الذي تحدده المتطلبات التجريبية.
ملاحظة: إذا تم وضع عقدة التسجيل قبل المكون الإضافي في سلسلة الإشارة ، فلن يتم حفظ معلومات تتبع إمكانات الإجراء. - في الجزء العلوي الأيمن من واجهة المستخدم الرسومية ، انقر فوق زر التشغيل لبدء نقل البيانات من لوحة الاستحواذ وتصورها. لبدء التسجيل ، انقر فوق زر التسجيل الدائري بجوار زر التشغيل.
ملاحظة: من السهل أن تنسى النقر فوق التسجيل ؛ نسجل البيانات من اللحظة التي نبدأ فيها في الحصول عليها لمنع حدوث ذلك.
- أدخل المكون الإضافي Rhythm FPGA في سلسلة الإشارة عن طريق النقر بزر الماوس الأيسر وسحبه إلى سلسلة الإشارة ؛ هذا يربط واجهة المستخدم الرسومية بلوحة الاستحواذ. تأكد من النقر فوق زر ADC لبدء تسجيل قنوات ADC من لوحة الإدخال / الإخراج. سيضيء زر ADC باللون البرتقالي عندما يكون قيد التشغيل.
- للتجميع باستخدام محفز تناظري يتم التحكم فيه بالجهد ، اتبع الخطوات كما هو موضح أدناه.
- قم بتشغيل محفز تيار ثابت يتم التحكم في سعة التحفيز الخاصة به بواسطة إدخال جهد تناظري. تم استخدام DS4 في هذه الحالة (الشكل 1).
- قناة إخراج PulsePal 1 مخصصة لأمر الجهد التناظري. قم بتقسيم هذه الإشارة باستخدام مقسم BNC T ، ثم قم بتوصيلها بإدخال محفز التيار المستمر ولوحة الإدخال / الإخراج بحيث يتم تسجيل جهد الأمر.
- قناة إخراج PulsePal 2 مخصصة لعلامة حدث TTL للتحفيز الكهربائي. قم بتوصيل هذا بلوحة الإدخال / الإخراج بحيث يتم تسجيل علامات حدث TTL للتحفيز لاستخدام المكون الإضافي وللتحليل اللاحق المخصص.
- للتجميع باستخدام محفز تناظري يتم التحكم فيه بالجهد ، اتبع الخطوات كما هو موضح أدناه.
- قم بتشغيل محفز تيار مستمر يتم التحكم في سعة التحفيز الخاصة به بواسطة قرص تشفير دوار. تم استخدام DS7 في هذه الحالة (الشكل 1).
- قم بتوصيل لوحة التحكم في محرك السائر بمحرك السائر باستخدام الكابل المزود من الشركة المصنعة والحامل المغناطيسي.
- قم بتوصيل لوحة التحكم بالكمبيوتر مباشرة باستخدام أي كابل USB A إلى USB micro-B قياسي. لا تقم بتوصيل لوحة التحكم على جانب المشارك من عازل USB لأنها متصلة أيضا بمصدر طاقة رئيسي بجهد 12 فولت.
- إذا كانت هذه هي المرة الأولى التي تستخدم فيها لوحة التحكم ، فقم بتحميل البرنامج النصي لمحرك السائر من GitHub إلى لوحة التحكم ؛ يجب القيام بذلك مرة واحدة فقط ، أو إذا تم إصدار أي تحديثات برامج للبرنامج النصي لمحرك السائر.
- اضبط قرص سعة التحفيز على محفز التيار المستمر على 0 مللي أمبير. استخدم كتيفة تثبيت مخصصة لربط محرك السائر وقرص سعة التحفيز. يمكن أن تكون هذه 3D المطبوعة ، والتي تتيح حلول تركيب رخيصة وسريعة وقابلة للتخصيص. استشر GitHub لمعرفة ما إذا كان قد تم بالفعل تصميم حامل للمحفز المفضل.
- استخدم محول أسطوانة مخصص لتوصيل أسطوانة محرك السائر بقرص التحكم في سعة التحفيز. يجب أن تكون هذه المحولات مصنوعة من المعدن لأسباب تتعلق بالقوة والمتانة ؛ ومع ذلك ، فإن الأجزاء المطبوعة 3D ستكون مناسبة أيضا ، على الرغم من أنها قد تحتاج إلى استبدالها بانتظام. استشر GitHub لمعرفة ما إذا كان محول الأسطوانة قد تم تصميمه بالفعل للمحفز المفضل.
- قم بتوصيل لوحة التحكم / جهاز محرك السائر بشكل غير محكم بقرص التحكم في المحفز باستخدام محول تثبيت وبرميل مخصص.
ملاحظة: سيتم تشديد محول التركيب والأسطوانة لاحقا بمجرد تشغيل البرنامج وضبط محرك السائر تلقائيا على الموضع صفر. - قم بتوصيل PulsePal كما هو موضح في خطوات البروتوكول 2.5.2-2.5.3 (ناقص توصيل قناة الإخراج 1 بمحفز) ، حيث لا يزال إنشاء علامات أحداث TTL مطلوبا للتحليل ولكي يعمل المكون الإضافي. بالإضافة إلى ذلك ، قم بتوصيل قناة الإخراج 2 بمحفز DS7 لتشغيله.
- إعداد إعداد العصب الجلد الماوس كما هو موضح أدناه.
- تزويد الفئران C57BL / 6J (مختبرات تشارلز ريفر ، المملكة المتحدة ، في هذه الدراسة) من عمر 2-4 أشهر وكلا الجنسين بالطعام والماء حسب الحاجة.
- بعد الإعدام بجرعة زائدة مخدرة من خلال الحقن داخل الصفاق من بنتوباربيتال الصوديوم (≥200 ملغم / كغم) وتأكيد توقف الدورة الدموية ، تشريح الجلد من الجانب الظهري لمخلب الفأر الخلفي والعصب الصافن ، الذي يعصب هذه المنطقة ، باستخدام الطرق التي وصفها Zimmermann et al.23.
- الحفاظ على تحضير العصب الجلدي في السائل الخلالي الاصطناعي الكربوجيني (الجدول 1) عند 30-32 درجة مئوية في نصف حمام أكريليك مزدوج الحجرة مصنوع خصيصا (معدل نضح 15 مل / دقيقة ، حجم 30 مل). قم بتمرير العصب من خلال ثقب صغير في الغرفة المملوءة بالزيت المعدني ، وأغلقه بالفازلين. يوفر الزيت بيئة تسجيل معزولة.
- قم بإزالة خيطين دقيقين من جذع العصب باستخدام ملقط فائق الدقة وقم بتعليق واحد على كل جانب من قطب تسجيل كلوريد الفضة / الفضة ثنائي القطب.
- رقمنة وتضخيم الإشارة العصبية باستخدام RHD2216 16 قناة ثنائية القطب ، ومعالجتها باستخدام لوحة الاستحواذ. قم بأخذ عينة من الإشارة عند 30 كيلو هرتز ، مع مرشح تمرير النطاق من 300-6000 هرتز ، وتصورها باستخدام واجهة المستخدم الرسومية.
- باستخدام قضيب زجاجي حاد ، قم بضرب جلد المستحضر. استخدم النشاط الكتلي منخفض السعة للتأكد من أن المستحضر حي.
- إجراء تصوير الأعصاب المجهري للألياف C البشرية كما هو موضح أدناه.
- إجراء تصوير الأعصاب المكروي مع المشاركين الذين قدموا موافقة خطية مستنيرة ، كما هو موضح سابقا24.
- مع جلوس المشارك متكئا بشكل مريح على سرير ومدعوم بالوسائد ، حدد العصب الشظوي السطحي باستخدام ماسح ضوئي بالموجات فوق الصوتية ، وحدد منطقة مستهدفة على بعد حوالي 5-10 سم بالقرب من المليولوس الجانبي ، حول مستوى منتصف الساق.
- تعقيم الجلد حول المنطقة المستهدفة باستخدام 2٪ كلورهيكسيدين في 70٪ مناديل كحولية وإدخال قطب مرجعي معقم تحت الجلد بالقرب من موقع التسجيل المقصود على مستوى منتصف الساق.
- أدخل قطب تسجيل معقم في العصب الشظوي السطحي تحت توجيه الموجات فوق الصوتية داخل المنطقة المستهدفة.
- رقمنة وتضخيم الإشارة العصبية باستخدام RHD2216 16 قناة ثنائية القطب ، ومعالجتها باستخدام لوحة الاستحواذ. قم بأخذ عينة من الإشارة عند 30 كيلو هرتز ، مع مرشح تمرير النطاق من 300-6000 هرتز ، وتصورها باستخدام واجهة المستخدم الرسومية.
ملاحظة: تم عزل معدات الاستحواذ كهربائيا عن الكمبيوتر المحمول بواسطة عازل USB 3.0 مع عزل RMS 5 كيلو فولت وتشغيله عبر مصدر طاقة بطارية 12 فولت مصنوع خصيصا. - قم بتأكيد الوضع الناجح داخل العصب عن طريق تمسيد الجلد بلطف للكشف عن النشاط الجماعي المثار ميكانيكيا. بالإضافة إلى ذلك ، عادة ما يبلغ المشاركون عن تنمل في الجانب الظهري الوحشي للقدم عند وضع ناجح داخل العصب.
3. إعداد البرمجيات وتحديد والتنميط الظاهري للخلايا العصبية الطرفية
- قم بإعداد البرنامج كما هو موضح أدناه.
- افتح واجهة المستخدم الرسومية (الشكل 3). إذا كانت لوحة التحكم في محرك السائر متصلة بجهاز الكمبيوتر الخاص بك ، اكتشافها وتعيين نفسها على الموضع صفر. أحكم ربط الحامل المخصص ومحول الأسطوانة الموصوف في الخطوات 2.6.5-2.6.7 ، حيث تم ضبط قرص سعة التحفيز والمحرك السائر على الصفر.
ملاحظة: إذا لم يكن كل من محرك السائر وقرص سعة التحفيز "صفرا" ، فقد يؤدي ذلك إلى محاولة محرك السائر تحويل قرص التحكم خارج نطاقه ، مما قد يتسبب في حدوث تلف. - في قائمة الخيارات ، حدد قناة الزناد. اختر قناة ADC التي تحتوي على علامة TTL للتحفيز الكهربائي من قناة إخراج PulsePal 2.
- في قائمة الخيارات، حدد قناة البيانات، واختر القناة التي تحتوي على بيانات الفيزيولوجيا الكهربية.
- في لوحة التحكم في التحفيز ، حدد سعة التحفيز الأولية والحد الأدنى والحد الأقصى باستخدام شريط التمرير. تأكد من ضبط التحفيز الحالي فوق 0 بحيث يتم إنشاء علامات TTL.
ملاحظة: بعض المحفزات لها نسبة قياس المدخلات إلى المخرجات ليست 1: 1; ضع في اعتبارك هذا عند اختيار سعة التحفيز المناسبة. على سبيل المثال ، يمكن اختيار نسبة إخراج 1:10 في بعض أنظمة التحفيز لتحقيق ناتج أعلى من محفز التيار المستمر. - في لوحة التحكم في التحفيز ، انقر فوق F لتحميل ملف يحتوي على تعليمات التحفيز. يتم تخزين بروتوكولات التحفيز الكهربائي كملفات قيمة مفصولة بفواصل (CSV) تتكون من ترددات التحفيز المطلوبة ومدتها ، مما يسمح للمستخدمين بإنشاء نماذج تحفيز معقدة لتجاربهم. يتوفر مثال على النموذج هنا: https://github.com/Microneurography/APTrack/blob/main/example_playlist.csv
- في لوحة التحكم في التحفيز ، انقر فوق > لبدء نموذج التحفيز المحمل. بشكل افتراضي ، تطلب APTrack من PulsePal توليد نبضات موجة مربعة موجبة مدتها 0.5 مللي ثانية بسعات متفاوتة للتحكم في سعة تحفيز محفز التيار المستمر.
- سيبدأ تحديث المخطط النقطي الزمني بالاستجابة للتحفيز الكهربائي، مع عرض كل استجابة تحفيز جديدة كعمود جديد على اليمين.
- افتح واجهة المستخدم الرسومية (الشكل 3). إذا كانت لوحة التحكم في محرك السائر متصلة بجهاز الكمبيوتر الخاص بك ، اكتشافها وتعيين نفسها على الموضع صفر. أحكم ربط الحامل المخصص ومحول الأسطوانة الموصوف في الخطوات 2.6.5-2.6.7 ، حيث تم ضبط قرص سعة التحفيز والمحرك السائر على الصفر.
- تصور وتحديد جهود فعالية الخلية العصبية الواحدة.
- للكشف الناجح عن إمكانات عمل الخلايا العصبية المفردة ، من المهم تعيين عتبات صورة مناسبة. في لوحة الرسم النقطي الزمني، اضبط قيم عتبة الصورة المنخفضة، والاكتشاف، والعالية.
- حدد نظام ألوان في قائمة الخيارات. في وضع WHOT (الأبيض الساخن) (افتراضي) ، يتم ترميز الفولتية التي تقل عن عتبة الصورة المنخفضة باللون الأسود. يتم ترميز الفولتية بين الصورة المنخفضة وعتبات الكشف بتدرج الرمادي. يتم ترميز الفولتية فوق عتبة الكشف باللون الأخضر ، ويتم ترميز الفولتية فوق عتبة الصورة العالية باللون الأحمر.
- تظهر الخلايا العصبية الطرفية استجابات كمون ثابتة عند ترددات تحفيز منخفضة (<0.25 هرتز) ، ويتم تحديد هذه الاستجابات من خلال سرعة التوصيل والمسافة بين مواقع التحفيز والتسجيل. مع تعيين عتبات الصورة المناسبة ، سيتم ترميز أحداث عبور العتبة المكتشفة بواسطة الخوارزميات باللون الأخضر (الشكل 4).
- حرك القطب المنبه بشكل منهجي حول منطقة الجلد المعصبة بواسطة العصب الذي يتم تسجيله ، مما يسمح بما لا يقل عن ثلاثة أحداث تحفيز في كل موقع. راقب المخطط النقطي الزمني لأحداث عبور العتبة (المميزة باللون الأخضر) التي تحدث في نفس النقطة الزمنية بعد كل حدث تحفيز كهربائي.
ملاحظة: في الفئران ، تم استخدام حافز بحث قدره 5 مللي أمبير. في البشر ، تمت معايرة سعة محفز البحث الكهربائي عبر الجلد إلى تصنيف الألم اللفظي بحيث لم يتجاوز أبدا 7/10. - تحقق من وجود ثلاثة أحداث عبور عتبة (أشرطة خضراء) تظهر في صف واحد في نفس زمن الوصول وفي نفس موضع التحفيز ؛ وهذا يشير إلى تحديد جهد عمل الخلايا العصبية الطرفية.
- قم بتحسين موضع القطب المحفز عن طريق تحديد النقطة الأكثر حساسية للكهرباء في مجال استقبال الخلايا العصبية المستهدفة ، ثم قم بتثبيت القطب في موضعه. في هذه المرحلة من تصوير الأعصاب الدقيقة البشرية ، انتقل إلى استخدام إبر الوخز بالإبر الكهربائية داخل الأدمة (قطر 0.2 مم) للتحفيز الكهربائي ثنائي القطب ، في الفئران ، يتم استخدام مسبار تحفيز مخصص عبر الجلد بحيث يكون موضع التحفيز ثابتا.
- للكشف الناجح عن إمكانات عمل الخلايا العصبية المفردة ، من المهم تعيين عتبات صورة مناسبة. في لوحة الرسم النقطي الزمني، اضبط قيم عتبة الصورة المنخفضة، والاكتشاف، والعالية.
- إجراء التصنيف والتنميط الظاهري الحسي للخلايا العصبية الطرفية.
- قم بتقدير العتبة الكهربائية لجهد الفعل المستهدف عن طريق ضبط سعة المحاكاة يدويا أو باستخدام APTrack إذا رغبت في ذلك (كما هو موضح في الخطوات 4.1-4.2).
- تحفيز المجال المستقبلي عند 2x العتبة الكهربائية المقدرة بتردد 0.25 هرتز في جميع أنحاء بروتوكول التنميط الظاهري الحسي.
- احسب سرعة التوصيل للخلية العصبية بقسمة مسافة التوصيل على زمن انتقال التوصيل. يمكن التعرف على الألياف C من خلال سرعة توصيل مقدارها ≤2 m/s.
- تحفيز المجال المستقبلي ميكانيكيا باستخدام خيوط فون فراي لتحديد العتبة الميكانيكية للتنشيط. يمكن التعرف على الإحساس الميكانيكي من خلال إمكانات الفعل المستثارة المرئية على تتبع الجهد وزيادة زمن انتقال الخلية العصبية ، إذا كانت ألياف C ، عند القوة الكافية.
- قم بتسخين المجال المستقبلي للخلية العصبية ، وراقب مرة أخرى إمكانات الفعل المرئية على تتبع الجهد وزيادة في زمن انتقال الخلية العصبية ، إذا كانت ألياف C ، عند تطبيق الحرارة الكافي. ستظهر الخلايا العصبية غير الحساسة للحرارة انخفاضا في الكمون بسبب التأثير الديناميكي الحراري على الانتشار المحوري.
ملاحظة: في تصوير الأعصاب المجهري البشري ، استخدم TSC-II للتحكم الحراري السريع والدقيق. في تحضير الماوس ، أضف السائل الخلالي الاصطناعي الدافئ أو المبرد إلى غرفة عزل من الألومنيوم موضوعة فوق المجال المستقبلي للسماح بالوصول إلى أطراف الخلايا العصبية مع تقييد تبديد الحرارة السريع في السائل المحيط. سجل درجة الحرارة باستخدام مزدوج حراري. - قم بتبريد المجال المستقبلي ، وراقب مرة أخرى إمكانات الفعل المرئية على تتبع الجهد وزيادة ملحوظة في زمن انتقال الخلية العصبية ، إذا كانت ألياف C ، عند التطبيق البارد الكافي. ستظهر جميع الخلايا العصبية زيادة في زمن الوصول بسبب التأثير الديناميكي الحراري على الانتشار المحوري ، لذا توخي الحذر في تصنيف الخلايا العصبية على أنها حساسة للبرد بناء على زيادة الكمون وحدها.
4. الكمون وتتبع العتبة الكهربائية
- قم بإجراء تتبع زمن الانتقال كما هو موضح أدناه.
- بعد تحديد جهد (إمكانات) عمل الخلية العصبية المفردة على مخطط البيانات النقطية الزمنية، حرك شريط التمرير الخطي الرمادي على الجانب الأيمن من مخطط البيانات النقطية الزمنية لضبط موضع مربع البحث.
- أسفل المخطط النقطي الزمني، اضبط شريط التمرير الدوار لعرض مربع البحث إلى عرض مناسب. اجعل عرض مربع البحث ضيقا لتقليل فرصة حدوث طفرات ضوضاء عابرة أو إطلاق إمكانات فعل تلقائية أو غيرها من إمكانات عمل زمن الانتقال الثابت القريبة التي يتم تحديدها بشكل خاطئ على أنها إمكانات الفعل محل الاهتمام.
- لبدء تتبع الإجراء المستهدف المحتمل ، انقر فوق + أسفل جدول التتبع متعدد الوحدات. ستتم إضافة صف جديد إلى الجدول يحتوي على تفاصيل إمكانات الإجراء المستهدف ، بما في ذلك موقع الكمون ، والنسبة المئوية لإطلاق أكثر من 2-10 محفزات (معدلة في قائمة الخيارات) ، وسعة الذروة المكتشفة.
- بمجرد إضافة جهد إجراء إلى جدول التتبع متعدد الوحدات ، سيتم تنفيذ خوارزمية تتبع زمن الوصول (الشكل 5) تلقائيا عليه عند كل تحفيز كهربائي لاحق.
- إذا كانت هناك العديد من جهود الفعل المنفصلة المرئية على المخطط النقطي الزمني، فقم بإضافتها إلى جدول التتبع متعدد الوحدات كما هو موضح أعلاه. الحد الأقصى النظري لعدد إمكانات الإجراء التي يمكن إضافتها إلى الجدول لتتبع زمن الانتقال المتزامن هو الحد الأقصى لقيمة العدد الصحيح 32 بت.
- حدد مربع Track Spike في جدول التتبع متعدد الوحدات لنقل مربع البحث إلى الموضع المناسب لإمكانية الإجراء المحددة هذه، على النحو الذي تحدده خوارزمية تتبع زمن الوصول. سيسمح ذلك بمراقبة تتبع زمن الوصول في الوقت الفعلي والتأكد من أن التتبع يتبع إمكانات الإجراء كما هو متوقع. سيستمر تتبع زمن الوصول للطفرات الأخرى كالمعتاد في الخلفية.
- قم بإزالة إمكانات العمل المتعقب من جدول التتبع متعدد الوحدات باستخدام زر الحذف في نهاية كل صف.
- قم بإجراء تتبع العتبة الكهربائية كما هو موضح أدناه.
- اضبط معدلات الزيادة والنقصان في لوحة التحكم في التحفيز بين 0.1 فولت و 0.5 فولت. حافظ على هذه القيم متساوية ، ولا تقم بتعديلها أثناء التجربة ما لم يكن هذا جزءا من النموذج التجريبي.
- تأكد من ضبط تردد التحفيز على معدل مناسب ، عادة 0.25-0.5 هرتز ، ما لم يكن تعديل تردد التحفيز جزءا من النموذج التجريبي. قد تؤدي زيادة معدلات إطلاق مستقبلات الألم إلى تغيير العتبة الكهربائية لمستقبلات الألم.
- بمجرد تتبع جهد الإجراء بنجاح ، حدد مربع عتبة المسار في جدول التتبع متعدد الوحدات ، والذي سيبدأ خوارزمية تتبع العتبة الكهربائية (الشكل 6).
ملاحظة: يتم تشغيل تتبع العتبة الكهربائية فقط على إمكانات الإجراء المستهدف ؛ في الواقع ، سيتم تحديث معدلات إطلاق إمكانات الفعل الأخرى في جدول التتبع متعدد الوحدات وفقا لذلك مع تغير سعة التحفيز. - ضبط سعة التحفيز يدويا لتقدير العتبة الكهربائية ؛ سيؤدي ذلك إلى تقليل وقت الانتظار لتحديد العتبة الكهربائية. يعتمد الوقت المستغرق لإنشاء عتبة كهربائية موثوقة على تردد التحفيز ، ومعدلات الزيادة والنقصان ، والفرق في سعة التحفيز من التحفيز الأولي إلى العتبة الكهربائية للخلية العصبية.
- يستخدم البرنامج طريقة من أعلى إلى أسفل لتقدير العتبة الكهربائية للخلايا العصبية. في جدول التتبع متعدد الوحدات ، يتم تحديد معدل إطلاق النار على 2-10 محفزات سابقة (محددة في قائمة الخيارات). حدد عدد أحداث التحفيز التي يجب مراعاتها ؛ سيزيد الرقم الأعلى من موثوقية تقدير العتبة ولكنه سيستغرق وقتا أطول لتحقيقه.
- أثناء تصوير الأعصاب الدقيقة البشرية ، من المهم مراقبة ألم المنبهات الكهربائية لمنع الانزعاج المفرط للمشاركين. بعض الانزعاج أمر لا مفر منه أثناء دراسة مستقبلات الألم ، وخاصة الألياف C الصامتة / النائمة. اسأل بانتظام عن معدلات الألم بينما تزداد سعة التحفيز أثناء تتبع العتبة الكهربائية وتبقى بالقرب من محفز التيار المستمر لفك ارتباطه بناء على طلب المشارك.
ملاحظة: بدلا من ذلك ، يمكن فصل التحفيز الكهربائي من خلال واجهة المستخدم بالنقر فوق الزر [ ] في لوحة تحكم التحفيز. - يشير معدل إطلاق النار البالغ 50٪ إلى تحديد العتبة الكهربائية التقريبية.
- أثناء تتبع العتبة الكهربائية ، قم بتطبيق معالجة تجريبية على المجال المستقبلي ، مثل درجة الحرارة أو التلاعب بالمخدرات. سيتم تتبع آثار هذه التلاعبات على العتبة الكهربائية لمستقبلات الألم.
ملاحظة: امنح وقتا كافيا لتحديد عتبة جديدة لمستقبلات الألم بعد التلاعب التجريبي.
النتائج
يوضح الشكل 7 مثالا تمثيليا للبرنامج الذي يعمل للتحكم في تجربة. يقوم بضبط سعة التحفيز بشكل متكرر باستخدام طريقة من أعلى إلى أسفل للعثور بشكل فعال على العتبة الكهربائية لمستقبلات الألم المفردة. لأول مرة ، نوضح جدوى تتبع العتبة الكهربائية للخلية العصبية المفردة في الوقت الفعلي في البشر أثناء تصوير الأعصاب المجهري (الشكل 7 أ). بالإضافة إلى ذلك ، نعرض تتبع العتبة الكهربائية في الماوس Aδ-fiber (الشكل 7B). إن تحديد جهود الفعل عن طريق عبور العتبة، كما هو مستخدم هنا، كاف لتتبع العتبات الكهربائية بمرور الوقت. نوصي المستخدمين باتخاذ خطوات لتقليل الضوضاء الكهربائية أثناء تسجيلاتهم ، مثل استخدام قفص فاراداي ومرشحات النطاق الترددي لتحسين نسبة الإشارة إلى الضوضاء.
لإثبات أنه يمكن استخدام تتبع العتبة الكهربائية كمقياس للتغيرات في استثارة مستقبلات الألم لدى البشر ، تم إجراء تتبع العتبة الكهربائية أثناء نموذج التسخين المتدرج (الشكل 8). أدت زيادة درجة حرارة أطراف مستقبلات الألم إلى تقليل تيار التحفيز الكهربائي المطلوب لاستنباط جهد الفعل ، مما يعكس زيادة في استثارة مستقبلات الألم (الشكل 8C). من المحتمل أن يكون هذا ناتجا عن توليد إمكانات المستقبلات بواسطة القنوات الأيونية الحساسة للحرارة المعبر عنها في مستقبلات الألم C-fiber14. عند أعلى درجة حرارة ، 44 درجة مئوية ، تم استنباط جهود الفعل المستثارة حراريا (الشكل 8 أ ، رقم التحفيز 86-96). يؤدي هذا إلى زيادة في العتبة الكهربائية حيث قد يكون مستقبل الألم في حالة مقاومة للحرارة بعد التفريغ عالي التردد. كما هو متوقع ، انخفض زمن انتقال جهد الإجراء المتعقب مع زيادة درجة الحرارة. يعتقد أن هذا يحدث بسبب التأثير الديناميكي الحراري على آلية التوصيل ، مما يزيد من سرعة التوصيل للألياف C. قد تظهر هذه الألياف C أيضا شبشبا (الشكل 8B ، رقم التحفيز 47-54) ، مما قد يؤدي إلى زيادة التحفيز الكهربائي التالي عن طريق الخطأ في السعة إذا كان جهد الفعل يقع خارج نافذة بحث الخوارزمية.
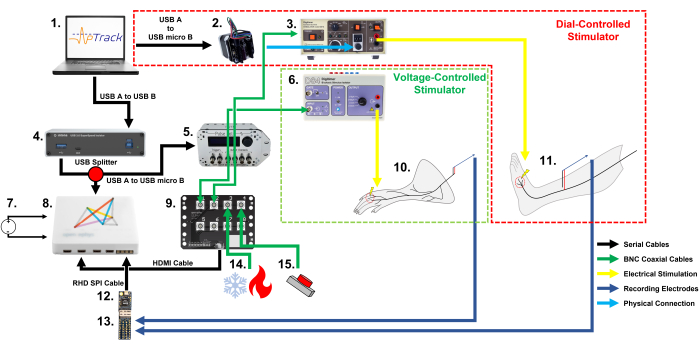
الشكل 1: رسم تخطيطي لإعداد المعدات وتوصيلات الكابلات المطلوبة لتتبع العتبة الكهربائية لمستقبلات الألم باستخدام APTrack في القوارض والبشر. لاحظ الطريقتين المختلفتين للتحكم في سعة التحفيز: محرك متدرج للمحفزات المعدلة يدويا في إعدادنا البشري ، و PulsePal للمحفزات التي يتم التحكم فيها بجهد الإدخال في إعداد القوارض لدينا. (1) جهاز كمبيوتر (يعمل بنظام التشغيل Windows أو Mac أو Linux) يقوم بتشغيل المكون الإضافي لمنصة Open Ephys. (2) محرك متدرج يقوم بتشغيل قرص سعة التحفيز على DS7. (3) محفز تيار مستمر معتمد للاستخدام في البشر ؛ هنا استخدمنا DS7. (4) معزل ضوئي USB 3.0 ، والذي يعزل المشارك البشري عن جهاز الكمبيوتر (اختياري ، مطلوب فقط للبحث البشري). (5) مولد نبض PulsePal V2 ، والذي يولد طوابع زمنية TTL (قناة الإخراج 2) وخطوات الجهد المقابلة لسعة التحفيز المطلوبة (قناة الإخراج 1). (6) محفز تيار مستمر للاستخدام في الحيوانات ؛ هنا ، استخدمنا DS4. (7) مصدر طاقة تيار مستمر للنظام (مصدر طاقة التيار المستمر الرئيسي المستخدم لإعداد القوارض ومصدر طاقة التيار المستمر للبطارية المستخدم في الإعداد البشري). (8) مجلس اقتناء. (9) لوحة إدخال / إخراج لتوصيل الكابلات المحورية BNC التي تحمل الإشارات المراد تسجيلها ، مثل مخرجات المزدوجة الحرارية وعلامات TTL. (10) إعداد العصب الجلدي للفأر يخضع لتسجيلات الفيزيولوجيا الكهربية لمستقبلات الألم. (11) مشارك بشري يخضع لتسجيل تصوير الأعصاب المجهري من ألياف C في العصب الشظوي السطحي. (12) Intan RHD2216 لاقتناء التسجيلات ورقمنتها. (13) لوحة محول قطب كهربائي Intan ، والتي يتم توصيل أقطاب التسجيل بها والتي تسمح بتمرير الإشارة إلى مرحلة الرأس RHD2216. (14) نظام تحفيز حراري يمكنه إخراج درجة الحرارة عبر اتصال BNC متحد المحور. (15) زر / دواسة قدم تعمل بالبطارية 3.3 فولت تستخدم لتحديد أحداث التحفيز الميكانيكي وتطبيقات الأدوية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
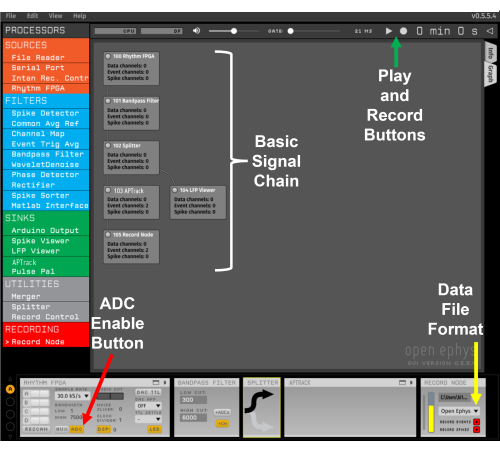
الشكل 2: سلسلة إشارة القالب. يشير السهم الأحمر إلى الزر لتمكين إدخال ADC من لوحة الإدخال / الإخراج. يشير السهم الأصفر إلى القائمة المنسدلة لتحديد تنسيق ملف Open Ephys. يشير السهم الأخضر إلى زري التشغيل والتسجيل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
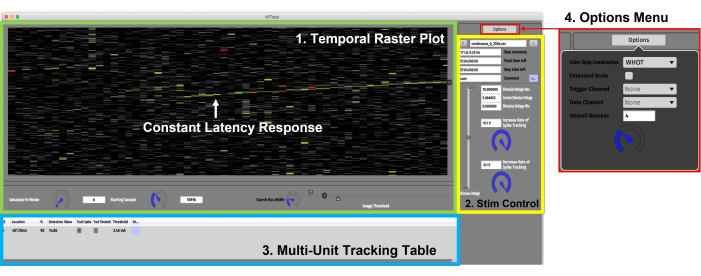
الشكل 3: واجهة المستخدم الرسومية. تتكون واجهة المستخدم الرسومية من أربعة مكونات رئيسية. (1) لوحة الرسم النقطي الزمني (أخضر) لتصور البيانات والإعدادات المرتبطة بالتحكم في المؤامرة. يشار إلى استجابة زمن الانتقال الثابتة التي تظهر تباطؤا تدريجيا يعتمد على النشاط بواسطة السهم الأخضر. (2) لوحة التحكم في التحفيز (صفراء) لضبط معلمات سعة التحفيز وتحميل نصوص نموذج التحفيز. (3) جدول تتبع متعدد الوحدات (أزرق) لإضافة إمكانات العمل لتتبع وتفعيل زمن الوصول وتتبع العتبة الكهربائية. (4) قائمة الخيارات لتحديد أنماط الألوان وقناة الإدخال للبيانات ومشغلات TTL. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
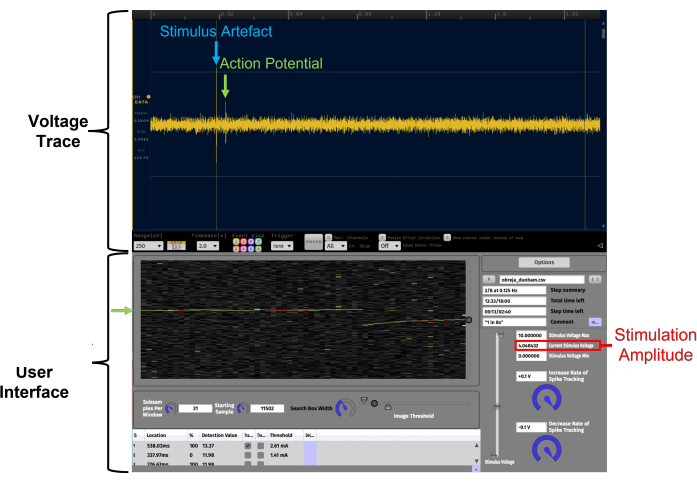
الشكل 4: تسهيل تحديد إمكانات عمل زمن الانتقال الثابت من خلال تصور البيانات في الوقت الفعلي على مخطط نقطي زمني باستخدام APTrack. هذا مثال على نسبة إشارة إلى ضوضاء عالية. البيانات المقدمة في مخطط النقطية الصدغية مأخوذة من تسجيل ألياف C بشري من العصب الشظوي السطحي أثناء تصوير الأعصاب الدقيقة. تتبع الجهد هو المكون الإضافي LFP Viewer الشبيه بالذبذبات داخل Open Ephys. واجهة مستخدم APTrack هي واجهة المستخدم الرسومية للمكون الإضافي. تتم الإشارة إلى إمكانات الإجراء المتعقب بواسطة أسهم خضراء ، وشريط التمرير الدائري على حدود المخطط النقطي الزمني مخصص للتحكم في موضع مربع البحث حيث ستبحث الخوارزميات عن أحداث عبور العتبة. تم تمييز قطعة التحفيز الكهربائي باللون الأزرق على أثر الجهد. يشار إلى سعة التحفيز لأمر الجهد التناظري باللون الأحمر ؛ لاحظ أن هذا قد لا يكون هو نفسه سعة تيار التحفيز اعتمادا على عامل القياس المحدد على المحفز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
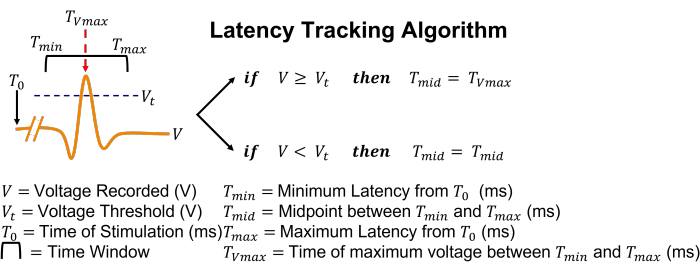
الشكل 5: تمثيل رسومي لخوارزمية تتبع زمن الوصول. بعبارات بسيطة ، إذا تم اكتشاف جهد إجراء عن طريق عبور العتبة ، فسيقوم مربع البحث بضبط موضعه لتوسيط نفسه في وقت ذروة الجهد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: تمثيل رسومي لخوارزمية تتبع العتبة الكهربائية. بعبارات بسيطة ، إذا تم اكتشاف جهد الفعل عن طريق عبور العتبة ، تقليل سعة التحفيز بمعدل الانخفاض. إذا لم يتم الكشف عن أي جهد فعل ، فستزداد سعة التحفيز بمعدل الزيادة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
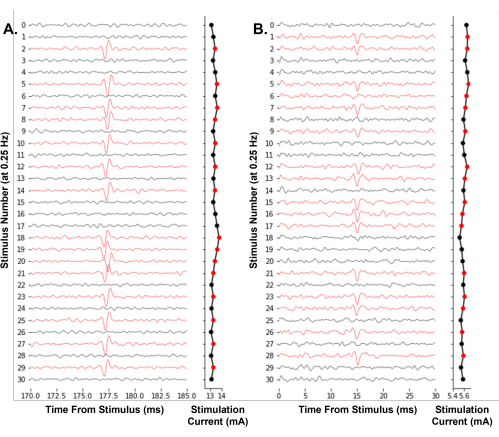
الشكل 7: تتبع العتبة الكهربية الآلي لجهود فعالية الخلية العصبية المفردة عند تردد تحفيز 0.25 هرتز. أ: آثار متسلسلة لألياف C بشرية للعصب الشظوي السطحي أثناء تجربة تصوير الأعصاب المجهري. (ب) آثار متسلسلة من الفأر Aδ-fiber من العصب الصافن أثناء تحضير عصب الجلد تثير الفيزيولوجيا الكهربية للألياف. تم تلوين الآثار باللون الأحمر عند تحديد جهد الفعل ، مما أدى إلى انخفاض سعة المثير. تجد خوارزمية البرنامج بشكل فعال سعة التحفيز المطلوبة لاحتمال إطلاق النار بنسبة 50٪. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
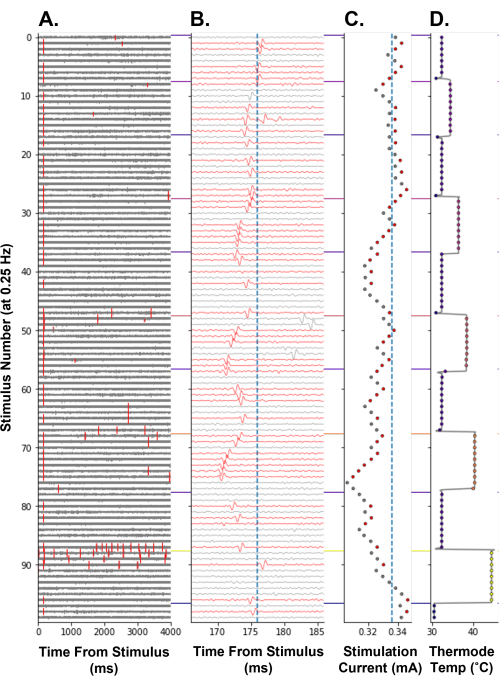
الشكل 8: تتبع العتبة الكهربائية عند تردد تحفيز 0.25 هرتز أثناء التحفيز الحراري لمستقبل مسبب للألم من الألياف C. يقوم المحور ص بتشفير رقم التحفيز من بداية النموذج. (أ) تتبع الجهد لمدة 4000 مللي ثانية بعد التحفيز الكهربائي ، مع تمييز أحداث عبور العتبة باللون الأحمر. (B) تكبير أثر الجهد من A حول جهد الفعالية المتتبع. تم تلوين الآثار باللون الأحمر عندما تم اكتشاف جهد الفعل المتتبع. الخط الأزرق العمودي هو زمن انتقال خط الأساس للوحدة المتعقبة. (ج) تيار التحفيز الذي يأمر به APTrack. الخط الأزرق الرأسي هو العتبة الكهربائية الأساسية. (د) درجة حرارة مسبار التحفيز الحراري TCS-II للمجال الاستقبالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مركب | تركيز |
| كلوريد الصوديوم | 107.8 مللي متر |
| ناهكو3 | 26.2 مللي متر |
| ككل | 3.5 مللي متر |
| NaH2PO4 | 1.67 مللي متر |
| كلوريد متعدد الكلور2 | 1.53 مللي متر |
| مغسو4 | 0.69 مللي متر |
| غلوكونات الصوديوم | 9.64 مللي متر |
| سكروز | 7.6 مللي متر |
| الجلوكوز | 5.55 مللي متر |
الجدول 1: محتويات السائل الخلالي الاصطناعي لإعداد العصب الجلدي للفأر23.
Discussion
APTrack هو برنامج إضافي للاستخدام مع منصة Open Ephys. لقد اخترنا هذه المنصة لأنها مفتوحة المصدر ومرنة ورخيصة التنفيذ. باستثناء تكلفة محفز التيار المستمر ، يمكن شراء جميع المعدات المطلوبة لبدء استخدام المكون الإضافي بحوالي 5,000 دولار أمريكي في وقت كتابة هذا التقرير. نأمل أن يمكن هذا الباحثين من تنفيذ APTrack في دراساتهم الفيزيولوجيا الكهربية للأعصاب الطرفية بسهولة أكبر. علاوة على ذلك ، يمكن للباحثين تعديل البرنامج بحرية ليناسب احتياجاتهم التجريبية. الأهم من ذلك ، سمحت هذه الأداة بتتبع العتبة الكهربائية لمستقبلات الألم المفردة من الألياف C ، لأول مرة ، في البشر.
كلما زادت نسبة الإشارة إلى الضوضاء ، كان بإمكان الخوارزميات تحديد إمكانات الفعل بشكل أفضل. كانت نسبة الإشارة إلى الضوضاء أثناء تصوير الأعصاب الدقيقة كافية في غالبية تسجيلاتنا ، ولكن يجب أن يكون المستخدمون في حالة تأهب لخطر تدهور الإشارة بمرور الوقت. هذا مهم بشكل خاص للبروتوكولات التجريبية الأطول ، لأنه إذا انخفضت سعة جهد الفعل المتعقب إلى ما دون عتبة الكشف ، فستزداد سعة التحفيز عن طريق الخطأ ؛ يمكن التخفيف من ذلك من خلال المجربين الذين يراقبون المكون الإضافي ثم يضبطون الإعدادات إذا لزم الأمر. يتم تحسين نسبة الإشارة إلى الضوضاء مع تصفية تمرير النطاق ، ولكن قد لا يزال يتم تحديد العابرين الأكبر بشكل خاطئ على أنهم إمكانات عمل في حالة وصولهم أثناء النافذة الزمنية لمربع البحث. يمكن تقليل خطر الخطأ في تحديد الضوضاء العابرة كجهد فعل عن طريق تضييق النافذة الزمنية التي يبحث خلالها المكون الإضافي عن إمكانات الفعل وعن طريق تحسين إعدادات العتبة. ومع ذلك ، لا تزال هناك مواقف قد يواجهها المرء تعيق أداء المكون الإضافي. قد يسبب النشاط التلقائي صعوبات إذا كانت إمكانات الفعل ذات السعة الأكبر تقع داخل نافذة مربع البحث الخاص بالخوارزمية ، حيث سيتم تحديدها بشكل خاطئ على أنها إمكانات الفعل المستهدفة. بالإضافة إلى ذلك ، قد يعني النشاط التلقائي في الخلية العصبية محل الاهتمام أن التحفيز الكهربائي يسقط خلال فترة الانكسار ، مما يتسبب في الفشل في توليد جهد الفعل. يمكن أن تنشأ صعوبات في استخدام البرنامج أيضا عندما تظهر الخلايا العصبية الواردة الأولية تقلبا ، حيث يتم تحفيز الفروع الطرفية البديلة لخلية عصبية واحدة ، مما يتسبب في أن يكون لجهد الفعل المستثار زمن انتقال أساسي (أو أكثر) يستبعد أحدهماالآخر 20. أثناء التسجيلات من الخلايا العصبية التي تظهر التقليب مع نسب إشارة إلى ضوضاء عالية ، نجحنا في إجراء زمن الوصول وتتبع العتبة الكهربائية عن طريق زيادة عرض مربع البحث لتغليف جميع سرعات التوصيل المحتملة التي أظهرتها الخلايا العصبية. ومع ذلك ، قد تختلف العتبة الكهربائية اعتمادا على الفرع الطرفي للخلية العصبية التي يتم إثارتها ، والتي من المحتمل أن تكون جزئيا بسبب الاختلافات في المسافة من موقع التحفيز الكهربائي إلى أطراف مستقبلات الألم البديلة. ومن الممكن القيام بعمل إضافي بشأن عملية تحديد هوية إمكانات العمل لتشمل، على سبيل المثال، مطابقة النماذج ويمكن دمجها في هذا البرنامج. يمكن أيضا استخدام المكونات الإضافية لواجهة المستخدم الرسومية لإيقاف النطاق أو ترشيح الضوضاء التكيفي في المنبع من APTrack في سلسلة الإشارة في حالة تطويرها.
نحن نعتبر العتبة الكهربائية المحددة على أنها التيار المطلوب لاستنباط جهد فعل بنسبة 50٪ من الوقت ، على عدد محدد من قبل المستخدم من المحفزات الكهربائية ، عادة 2-10. مورفولوجيا التحفيز الكهربائي هي 0.5 مللي ثانية ونبضات موجة مربعة موجية. هذا ليس هو نفسه تحديد rheobase ، وهو مقياس شائع الاستخدام لاستثارة الخلايا العصبية. يمكن تكييف المكون الإضافي لتحديد قاعدة الريوبيس. ومع ذلك ، فقد اتبعنا مقياسا أبسط ، حيث أن التغييرات الديناميكية في الإثارة ، مثل تلك التي يفترض حدوثها أثناء التسخين ، كان من الصعب تحديدها كميا مع تغييرات قاعدة الريو من تقدير العتبة الكهربائية لدينا.
يمكن استخدام هذا البرنامج في كل من التجارب البشرية والقوارض. أصبح هذا ممكنا بفضل الدعم المرن لأنظمة التحفيز الكهربائي. سيعمل البرنامج مع أي محفز يقبل جهد أمر تناظري أو يمكن توصيله يدويا بمحرك متدرج. بالنسبة لتصوير الأعصاب الدقيقة ، استخدمناه مع محفز تيار ثابت يحمل علامة CE تم تصميمه للاستخدام في الأبحاث البشرية وتم التحكم في تحفيزه بواسطة قرص. يمكن أن تكون المحفزات التي تقبل أوامر الجهد التناظري صاخبة لأنها لا تفصل الدائرة بين المحفزات ، مما يعني أن أي همهمة أو ضوضاء 50/60 هرتز على الإدخال التناظري سيتم نقلها إلى التسجيل. يعد المحفز الذي يتطلب إشارة تشغيل TLL إضافية لتوصيل الدائرة ، مما يسمح بتوليد حافز عند تيار مشابه لإدخال الجهد التناظري ، مثاليا للاستخدام مع المكون الإضافي. هذا يمنع انتقال الضوضاء إلى التسجيل بين المحفزات.
يستخدم البرنامج طريقة بسيطة من أعلى إلى أسفل لتقدير العتبة الكهربائية. وقد استخدم هذا في اختبارات الفيزياء النفسية لعدة عقود25. تماشيا مع الطريقة من أعلى إلى أسفل ، فإن خوارزمية تتبع العتبة الكهربائية لتعديل سعة التحفيز تأخذ في الاعتبار فقط سعة التحفيز السابق واستجابته عند حساب سعة التحفيز التالي. هذا يعني أن سعة التحفيز سوف تتأرجح حول العتبة الكهربائية الحقيقية ، وبالتالي تنتج معدل إطلاق بنسبة 50٪ ، على افتراض أن العتبة مستقرة. الحد الأدنى لحجم الزيادة أو النقصان هو 0.01 فولت ؛ هذا يعادل 0.01 مللي أمبير بافتراض أن المحفز لديه نسبة مدخلات إلى مخرجات 1 V: 1 mA ودقة كافية لتحقيق تغييرات خطوة صغيرة. سيقوم المكون الإضافي بتحديث التقدير المباشر للعتبة الكهربائية لجهد الفعل المستهدف في كل مرة يصل فيها إلى معدل إطلاق 50٪ على عدد محدد من المحفزات السابقة التي يحددها المستخدم (2-10). بعد ذلك ، نوصي باستخدام متوسط المتداول لسعة التحفيز على آخر 2-10 محفزات لتقدير العتبة الكهربائية ، وتجدر الإشارة إلى أن هذا التقدير لن يكون دقيقا إلا عندما يكون معدل إطلاق النار مستقرا نسبيا عند 50٪. في كل من التقديرات الحية واللاحقة للعتبة الكهربائية ، هناك توازن بين الدقة والموثوقية والوقت الذي يجب مراعاته. سيؤدي استخدام خطوات الزيادة والنقصان الأصغر إلى زيادة دقة تقدير العتبة الكهربائية ولكنه سيزيد من الوقت المستغرق للعثور على العتبة الكهربائية الجديدة في البداية وبعد الاضطراب. سيوفر حساب العتبة الكهربائية على عدد أكبر من المحفزات السابقة موثوقية أفضل ولكنه سيزيد من الوقت اللازم للوصول إلى تقدير دقيق.
تم تصميم APTrack للاستخدام في تسجيلات الأعصاب الطرفية ، وتحديدا لتتبع العتبات الكهربائية للألياف C أثناء الاضطرابات التجريبية والمرضية على مدى فترات قد يختلف فيها زمن انتقال جهد الفعل اعتمادا على النشاط العصبي الأساسي. ستمكن هذه الطريقة من فحص ليس فقط استثارة المحور العصبي ولكن أيضا إمكانات مولد مستقبلات الألم لدى المتطوعين والمرضى الأصحاء. نتوقع أن تتبنى مجالات أخرى من الفيزيولوجيا الكهربية هذه الأداة وتكيفها لاستخدامها في أي تجربة تتطلب تتبع العتبة الكهربائية لنشاط مغلق بالتحفيز. على سبيل المثال ، يمكن تكييف هذا بسهولة للتحفيز البصري الوراثي بنبضات ضوئية مدفوعة من APTrack. البرنامج المساعد مفتوح المصدر ومتاح للباحثين بموجب ترخيص GPLv3. إنه مبني على منصة Open Ephys ، وهو نظام للحصول على بيانات مفتوح المصدر ومنخفض التكلفة وقابل للتكيف ومنخفض التكلفة. يوفر المكون الإضافي خطافات إضافية للمكونات الإضافية النهائية لاستخراج معلومات إمكانات الإجراء وتوفير واجهات مستخدم إضافية أو نماذج تكيفية. يوفر المكون الإضافي واجهة مستخدم بسيطة للتصور وتتبع زمن الوصول لإمكانات العمل في الوقت الفعلي. يمكنه أيضا تشغيل البيانات السابقة وتصورها باستخدام مخطط البيانات النقطية الزمنية. علاوة على ذلك ، يمكنه أيضا إجراء تتبع زمن الوصول أثناء تشغيل البيانات السابقة. في حين أن هناك حزم برامج أخرى متاحة لتتبع زمن الوصول في الوقت الفعلي ، إلا أنها ليست مفتوحة المصدر ولا يمكنها إجراء تتبع العتبة الكهربائية26,27. يتمتع APTrack بميزة على الطرق التقليدية لتحديد إمكانات عمل زمن الانتقال الثابت من آثار الجهد لأنه يستخدم مخططا نقطيا زمنيا لتصور البيانات. علاوة على ذلك ، أشارت تجاربنا في استخدامه في التجارب ذات نسب الإشارة إلى الضوضاء المنخفضة إلى أن طريقة تصور المخطط النقطي الزمني تسمح بتحديد إمكانات عمل الكمون الثابت التي ربما تم تفويتها بطريقة أخرى.
تتبع عتبة العصب الكامل هو طريقة مستخدمة على نطاق واسع لتقييم استثارة المحورالعصبي 13. تم استخدام تتبع العتبة الكهربائية أحادية الخلية العصبية في ألياف C للقوارض سابقا لتحديد استثارة مستقبلات الألم14 ، وتم التعرف على فائدتها في البشر10,11 ؛ ومع ذلك ، حتى الآن ، لم يكن هذا ممكنا. نحن نقدم أداة جديدة ومفتوحة المصدر لقياس استثارة مستقبلات الألم المفردة بشكل مباشر في كل من دراسات الفيزيولوجيا الكهربية للأعصاب الطرفية للقوارض والإنسان. يتيح APTrack تتبع العتبة الكهربائية المفتوحة المصدر في الوقت الفعلي لجهود عمل الخلايا العصبية المفردة في البشر ، لأول مرة. نتوقع أنه سيسهل الدراسات الانتقالية لمستقبلات الألم بين القوارض والبشر.
Disclosures
G.W.T.N. هي منحة دكتوراه في شراكة التدريب التعاوني BBSRC مع جامعة بريستول وشركة Eli Lilly and Company (BB / T508342 / 1). APN هو موظف حالي في Eli Lilly and Company وقد يمتلك أسهما في هذه الشركة.
Acknowledgements
نود أن نشكر ممولينا على دعمهم: أكاديمية العلوم الطبية (J.P.D. ، A.E.P.) ، مقابل التهاب المفاصل (J.P.D. ، A.E.P.) ، معهد جان جولدنج Seedcorn Grant (J.P.D. ، A.E.P. ، GW ، A.C.S. ، M.M.P.) ، ومنحة الدكتوراه في شراكة التدريب التعاوني لمجلس أبحاث التكنولوجيا الحيوية والعلوم البيولوجية مع Eli Lilly (G.W.T.N.). نود أن نعرب عن شكرنا لجميع المساهمين في تطوير APTrack. نود أيضا أن نشكر متطوعينا الذين شاركوا في تجارب تصوير الأعصاب الدقيقة والمتعاونين معنا في إشراك المرضى والجمهور ومشاركتهم على مساهماتهم التي لا تقدر بثمن.
Materials
| Name | Company | Catalog Number | Comments |
| 12V DC Power Supply | NA | NA | To power uStepper S-lite. Required for dial-controlled stimulators. |
| 36 Pin Electrode Adapter Board | Intan Technology | C3410 | APTrack Dependency. For connecting electrode input to headstage. $255 USD as of March 2021. |
| APTrack Plugin | NA | NA | https://github.com/Microneurography/APTrack |
| Bipolar Ag/AgCl Recording Electrode | Custom | NA | Recording electrode for the skin-nerve preparation. Or equivalent. |
| Bipolar Concentric Stimulating Electrode | World Precision Instruments | SNE-100 | For electrical stimulation in the mouse skin-nerve preparation. Or equivalent. |
| Bipolar Transcutaneous Stimulating Electrode | Custom | NA | For transcutaneous electrical stimulation while searching for single-neuron action potentials during microneurography. |
| BNC T Splitter (1+) | NA | NA | APTrack Dependency. Any standard BNC T splitter. |
| BNC to BNC cables (3+) | NA | NA | APTrack Dependency. Any standard BNC cables. |
| C6H11NaO7 | Merck | S2054 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| CaCl2 | Merck | C5670 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| Digitimer DS4 Constant Current Stimulator | Digitimer | DS4 | Constant current stiulator for animal research. £1,695 GBP as of September 2022. |
| Digitimer DS7 Constant Current Stimulator | Digitimer | DS7A | Constant current stiulator for human research. £3,400 GBP as of September 2022. |
| Electroaccupuncture Classic Plus Stimulating Electrodes | Harmony Medical | NA | For fixed position intradermal electrical stimulation of the dorsal aspect of the foot during human microneurography. |
| Glucose | Fisher Scientific | G/0450/60 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| HDMI Cable | NA | NA | APTrack Dependency. Any standard passive HMDI cable. To connect OE I/O Board to OE Acquisition Board. |
| KCl | Merck | P9541 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| MgSO4 | Acros Organics | 213115000 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| Mineral Oil | Merck | 330779 | Electrical insulation for nerve recordings in th skin-nerve preparation. Or equivalent. |
| NaCl | Merck | S9888 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| NaHCO3 | Merck | S6014 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| NaHCO3 | Merck | S0751 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| Open Ephys Acquisition Board | Open Ephys | NA | APTrack Dependency. Includes USB cable to connect to computer and mains socket power supply. €2,955 EUR as of September 2022. |
| Open Ephys Graphical User Interface | Open Ephys | NA | https://github.com/open-ephys/plugin-GUI |
| Open Ephys I/O Board | Open Ephys | NA | APTrack Dependency. For ADC voltage inputs via BNC cables. €12.5 EUR without connectors, €85 EUR with connectors as of September 2022. |
| PulsePal V2 | Sanworks | 1102 | APTrack Dependency. Open-source DAC and train generator. $725 USD pre-assembled as of September 2022. Approx. $275 USD for self-assembly. |
| RHD 6ft SPI Cable | Intan Technology | C3206 | APTrack Dependency. For connecting headstage to OE Acquisition Board. $295 USD as of March 2021 |
| RHD2216 16ch Bipolar Headstage | Intan Technology | C3313 | APTrack Dependency. For data acquisition and digitization. $725 USD as of March 2021. Or equivalent RHD2000 series headstage. |
| Sucrose | Fisher Scientific | S/8560/60 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| TCS-II Thermal Stimulator | QST.Lab | NA | For thermal stimualtion of nociceptor receptive fields during human microneurography. |
| Tungsten Microelectrode Pair (Active + Reference) | FHC | 30085 | For microneurography recordings. 35mm. |
| Ultrasound Scanner iQ+ | Butterfly Network | NA | For ultrasound-guided electrode insertion during microneurography. |
| USB 3.0 5kV RMS Isolation | Inota Technology | 7055-D | For isolating human microneuroography participant from computer. €459 EUR as of September 2022. |
| USB-A to micro USB-B cable (2) | NA | NA | APTrack Dependency. To connect computer to PulsePal and to uStepper S-lite if using stepper-stimulator interfacing. |
| uStepper S-lite + NEMA17 motor | uStepper | NA | To interface with stimulators via a control dial. €50 EUR as of September 2022. |
| Von Frey Filaments | Ugo Basile | 37450-275 | For mechanical stimulation of receptive fields during sensory phenotyping of nociceptors. |
References
- Dubin, A. E., Patapoutian, A. Nociceptors: The sensors of the pain pathway. Journal of Clinical Investigation. 120 (11), 3760-3772 (2010).
- Serra, J., et al. Microneurographic identification of spontaneous activity in C-nociceptors in neuropathic pain states in humans and rats. Pain. 153 (1), 42-55 (2012).
- Serra, J., et al. Hyperexcitable C nociceptors in fibromyalgia. Annals of Neurology. 75 (2), 196-208 (2014).
- Namer, B., et al. Specific changes in conduction velocity recovery cycles of single nociceptors in a patient with erythromelalgia with the I848T gain-of-function mutation of Nav1.7. Pain. 156 (9), 1637-1646 (2015).
- Kleggetveit, I. P., et al. High spontaneous activity of C-nociceptors in painful polyneuropathy. Pain. 153 (10), 2040-2047 (2012).
- Orstavik, K., et al. Abnormal function of C-fibers in patients with diabetic neuropathy. Journal of Neuroscience. 26 (44), 11287-11294 (2006).
- Orstavik, K., et al. Pathological C-fibres in patients with a chronic painful condition. Brain. 126, 567-578 (2003).
- Raja, S. N., Ringkamp, M., Guan, Y., Campbell, J. N., John, J. Bonica Award Lecture: Peripheral neuronal hyperexcitability: The "low-hanging" target for safe therapeutic strategies in neuropathic pain. Pain. 161, S14-S26 (2020).
- Middleton, S. J., et al. Studying human nociceptors: From fundamentals to clinic. Brain. 144 (5), 1312-1335 (2021).
- Marshall, A., Alam, U., Themistocleous, A., Calcutt, N., Marshall, A. Novel and emerging electrophysiological biomarkers of diabetic neuropathy and painful diabetic neuropathy. Clinical Therapeutics. 43 (9), 1441-1456 (2021).
- Themistocleous, A. C., et al. Axonal excitability does not differ between painful and painless diabetic or chemotherapy-induced distal symmetrical polyneuropathy in a multicenter observational study. Annals of Neurology. 91 (4), 506-520 (2022).
- Bostock, H., Cikurel, K., Burke, D. Threshold tracking techniques in the study of human peripheral nerve. Muscle Nerve. 21 (2), 137-158 (1998).
- Kiernan, M. C., et al. Measurement of axonal excitability: Consensus guidelines. Clinical Neurophysiology. 131 (1), 308-323 (2020).
- Sauer, S. K., et al. Can receptor potentials be detected with threshold tracking in rat cutaneous nociceptive terminals. Journal of Neurophysiology. 94 (1), 219-225 (2005).
- Vallbo, A. B. Microneurography: How it started and how it works. Journal of Neurophysiology. 120 (3), 1415-1427 (2018).
- Torebjork, H., Hallin, R. A new method for classification of C-unit activity in intact human skin nerves. Advances in Pain Research and Therapy. 1, 29-34 (1976).
- Brown, G. L., Holmes, O. The effects of activity on mammalian nerve fibres of low conduction velocity. Proceedings of the Royal Society of London. Series B: Biological Sciences. 144 (918), 1-14 (1956).
- Obreja, O., et al. Patterns of activity-dependent conduction velocity changes differentiate classes of unmyelinated mechano-insensitive afferents including cold nociceptors, in pig and in human. Pain. 148 (1), 59-69 (2010).
- Serra, J., Campero, M., Ochoa, J., Bostock, H. Activity-dependent slowing of conduction differentiates functional subtypes of C fibres innervating human skin. Journal of Physiology. 515, 799-811 (1999).
- Weidner, C., Schmidt, R., Schmelz, M., Torebjork, H. E., Handwerker, H. O. Action potential conduction in the terminal arborisation of nociceptive C-fibre afferents. Journal of Physiology. 547, 931-940 (2003).
- Siegle, J. H., et al. Open Ephys: An open-source, plugin-based platform for multichannel electrophysiology. Journal of Neural Engineering. 14 (4), 045003 (2017).
- Sanders, J. I., Kepecs, A. A low-cost programmable pulse generator for physiology and behavior. Frontiers in Neuroengineering. 7, 43 (2014).
- Zimmermann, K., et al. Phenotyping sensory nerve endings in vitro in the mouse. Nature Protocols. 4 (2), 174-196 (2009).
- Dunham, J. P., Sales, A. C., Pickering, A. E. Ultrasound-guided, open-source microneurography: Approaches to improve recordings from peripheral nerves in man. Clinical Neurophysiology. 129 (11), 2475-2481 (2018).
- Levitt, H. Transformed up-down methods in psychoacoustics. Journal of the Acoustical Society of America. 49 (2), 467 (1971).
- Turnquist, B., RichardWebster, B., Namer, B. Automated detection of latency tracks in microneurography recordings using track correlation. Journal of Neuroscience Methods. 262, 133-141 (2016).
- Kiernan, M. C., Burke, D., Andersen, K. V., Bostock, H. Multiple measures of axonal excitability: A new approach in clinical testing. Muscle Nerve. 23 (3), 399-409 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved