Method Article
Отслеживание электрических порогов с обратной связью в режиме реального времени с открытым исходным кодом для трансляционных исследований боли
В этой статье
Резюме
APTrack — это программный плагин, разработанный для платформы Open Ephys, который позволяет визуализировать данные в реальном времени и отслеживать электрические пороги потенциалов действия нейронов с обратной связью. Мы успешно использовали это в микроневрографии для ноцицепторов С-волокна человека и ноцицепторов С-волокна и Аδ-волокна мыши.
Аннотация
Ноцицепторы представляют собой класс первичных афферентных нейронов, которые сигнализируют о потенциально вредных вредных раздражителях. Повышение возбудимости ноцицепторов происходит при острых и хронических болевых состояниях. Это приводит к аномальной постоянной активности или снижению порогов активации вредных раздражителей. Выявление причины этой повышенной возбудимости необходимо для разработки и валидации методов лечения, основанных на механизмах. Отслеживание однонейронного электрического порога может количественно оценить возбудимость ноцицепторов. Поэтому мы разработали приложение, позволяющее проводить такие измерения и демонстрировать его использование у людей и грызунов. APTrack обеспечивает визуализацию данных в реальном времени и идентификацию потенциала действия с использованием временного растрового графика. Алгоритмы обнаруживают потенциалы действия при пересечении пороговых значений и отслеживают их задержку после электрической стимуляции. Затем плагин модулирует амплитуду электрической стимуляции, используя метод вверх-вниз для оценки электрического порога ноцицепторов. Программное обеспечение было построено на системе Open Ephys (V0.54) и написано на C++ с использованием фреймворка JUCE. Он работает на платформах Windows, Linux и Mac. Доступен открытый исходный код (https://github.com/
Введение
Ноцицепторы представляют собой первичные афферентные нейроны в периферической нервной системе, которые активируются явными или потенциально повреждающими ткани событиями и играют решающую защитную роль при острой боли1. Электрофизиологические записи ноцицепторов С-волокна и Аδ-волокна на животных моделях, здоровых добровольцев и пациентов выявили сенсибилизацию и аномальную спонтанную активность в различных болевых состояниях 2,3,4,5,6,7. Понимание механизмов, лежащих в основе этих изменений возбудимости ноцицепторов у пациентов, может позволить проводить целенаправленные терапевтические вмешательства8. Тем не менее, существует несколько инструментов для непосредственной оценки возбудимости ноцицепторов, особенно у пациентов9, но потенциал полезности таких инструментов хорошо известен10,11.
Отслеживание электрического порога всего нерва может быть использовано для изучения возбудимости аксонов у людей12. Однако, поскольку крупные миелинизированные периферические нейроны вносят непропорциональный вклад в амплитуду потенциала действия сенсорных соединений, отслеживание электрического порога всего нерва не позволяет оценить функцию С-волокна11,13. Действительно, в предыдущем исследовании отслеживание электрического порога всего нерва в когортах хронической нейропатической боли с диабетической невропатией и полинейропатией, вызванной химиотерапией, не показало различий в аксональной возбудимости11.
В предыдущем исследовании отслеживание электрического порога на уровне одного нейрона использовалось для изучения возбудимости ноцицепторов С-волокна во время записи дразнящих волокон в препарате кожно-нервных нервов крыс ex vivo 14. Авторы продемонстрировали, что повышенная концентрация калия, кислые условия и брадикинин увеличивают возбудимость ноцицепторов С-волокон, что отражается в сниженном электрическом пороге генерации потенциала действия. Кроме того, нагревание рецептивного поля термочувствительных ноцицепторов снижало их электрический порог, тогда как нечувствительные к теплу ноцицепторы демонстрировали увеличение их электрического порога14. Это является важным доказательством того, что отслеживание однонейронного электрического порога возможно и может быть полезным, но в настоящее время нет доступных программных и/или аппаратных решений, позволяющих проводить такие исследования, особенно для исследований на людях.
У человека микроневропатология является единственным доступным методом прямой оценки электрофизиологических свойств С-волокон15. Этот подход был использован для демонстрации дисфункции ноцицепторов у пациентов с хронической болью 2,3,4,5,6,7. Микроневропатология может обнаруживать потенциалы действия одного нейрона; однако из-за низкого отношения сигнал/шум исследователи используют технику маркировки для характеристики активности C-волокна16. В технике маркировки надпороговая электрическая стимуляция применяется к рецептивным полям С-волокна в коже. Эта электрическая стимуляция генерирует потенциал действия, который возникает с постоянной задержкой, которая определяется скоростью проводимости С-волокна. С-волокна проявляют замедление, зависящее от активности, в результате чего скорость их проводимости уменьшается и, следовательно, их задержка проводимости увеличивается в периоды разрядапотенциала действия 17. В базальных условиях С-волокна обычно не генерируют потенциалы действия в отсутствие вредных раздражителей, и, следовательно, их латентность проводимости в ответ на низкочастотную электрическую стимуляцию постоянна. Механические, тепловые или фармакологические стимулы, вызывающие возбуждение, вызывают замедление, зависящее от активности, что увеличивает латентность потенциалов действия, вызванных сопутствующей низкочастотной электрической стимуляцией. Это позволяет объективно идентифицировать реакции на приложенные неэлектрические стимулы в условиях низкого отношения сигнал/шум. Следовательно, замедление, зависящее от активности, может быть использовано для функциональной характеристики С-волокон16. Действительно, различные функциональные классы С-волокон демонстрируют отличительные паттерны зависящего от активности замедления в парадигмах электрической стимуляции, которые включают изменение частоты стимуляции18,19. Эта изменчивость задержек потенциалов действия C-волокна представляет собой проблему для алгоритмов, предназначенных для их мониторинга.
Постоянная активность ноцицептора приводит к увеличению вариабельности его латентности во время низкочастотной электрической стимуляции, и это опять же связано с замедлением, зависящим от активности. Эта повышенная изменчивость, или джиттер, является количественной косвенной мерой возбудимости2. Другие причины вариабельности задержки потенциала действия включают триггер, когда стимулируются альтернативные концевые ветви одного нейрона, что приводит к тому, что вызванный потенциал действия имеет две (или более) базовые латентности, которые являются взаимоисключающими20. Наконец, изменения температуры концевых ветвей периферического нейрона также вызывают изменения латентности потенциала действия термодинамическим образом, при этом нагревание увеличивает скорость проводимости, а охлаждение замедляет скоростьпроводимости 19. Таким образом, любое программное обеспечение, стремящееся выполнить замкнутое электрическое пороговое отслеживание ноцицептивных С-волокон, должно учитывать изменения латентности в электрически вызванных потенциалах действия.
Для достижения нашей цели межвидового отслеживания электрических пороговых значений ноцицепторов C-волокна мы разработали APTrack, программный плагин с открытым исходным кодом для платформы Open Ephys21, чтобы обеспечить отслеживание электрических порогов в режиме реального времени, с обратной связью, отслеживание электрических порогов и отслеживание задержки. Мы предоставляем доказательство концепции, демонстрирующие, что отслеживание электрического порога ноцицептора С-волокна во время микроневрографии человека возможно. Кроме того, мы показываем, что этот инструмент может быть использован в электрофизиологии дразнящих волокон грызунов ex vivo , что позволяет проводить трансляционные исследования между людьми и грызунами. Здесь мы подробно опишем, как исследователи могут внедрить и использовать этот инструмент, чтобы помочь им изучить функцию ноцицепторов и возбудимость.
протокол
Эксперименты по микронейрографии человека были одобрены Комитетом по этике исследований факультета наук о жизни Бристольского университета (референтный номер: 51882). Все участники исследования дали письменное информированное согласие. Эксперименты на животных были проведены в Бристольском университете в соответствии с Законом Великобритании о животных (научные процедуры) 1986 года после одобрения Советом по защите животных и этике Бристольского университета и были защищены лицензией на проект.
1. Установка Open Ephys GUI и APTrack
- Ознакомьтесь с документацией по программному обеспечению, чтобы найти самую последнюю версию поддерживаемого графического интерфейса пользователя (GUI) Open Ephys (https://github.com/Microneurography/APTrack#readme), а затем загрузите и установите графический интерфейс.
- Установите совместимую версию графического интерфейса по следующему URL-адресу: https://github.com/open-ephys/plugin-GUI/releases.
- Загрузите последнюю версию с GitHub: https://github.com/Microneurography/APTrack/releases. Для компьютера с Windows скопируйте файл .dll в папку plugins, которая обычно находится в C:\Program Files\Open Ephys\plugins. Для компьютера с MacOS скопируйте файл .bundle в папку Contents/PlugIns пакета.
2. Сборка регистрирующей и стимулирующей аппаратуры
- Подключите плату сбора данных к компьютеру с помощью кабеля, поставляемого производителем, и включите ее.
ПРИМЕЧАНИЕ: Для микроневрографии человека изолятор USB 3.0 использовался для электрической изоляции участника от компьютера, а плата сбора данных питалась от портативной батареи, а не от источника питания сетевого напряжения, используемого для исследований грызунов. Все USB-соединения, за исключением платы управления шаговым двигателем, были пропущены через USB-изолятор во время исследований на людях. - Подключите плату ввода/вывода к порту аналогового входа на плате сбора данных. Подключите записывающую головку Intan RHD к плате сбора данных с помощью кабеля последовательно-периферийного интерфейса (SPI).
ПРИМЕЧАНИЕ: Здесь использовалась 16-канальная биполярная головная сцена Intan, но могут использоваться и другие монополярные головные ступени серии RHD2000. - Подключите PulsePal к компьютеру22. Для сборки с аналоговым стимулятором, управляемым напряжением (например, DS4) с использованием PulsePal, как и в случае с записью дразнящего волокна мыши, выполните шаги 2.5.1-2.5.3; для сборки со стимулятором на основе поворотного энкодера (например, DS7) с использованием шагового двигателя, как и в случае с записями микронейрографии человека, выполните шаги 2.6.1-2.6.8 (рис. 1).
- Постройте сигнальную цепочку в графическом интерфейсе, как описано ниже.
- Вставьте плагин Rhythm FPGA в сигнальную цепочку, щелкнув левой кнопкой мыши и перетащив его в сигнальную цепочку; это соединяет графический интерфейс с платой сбора. Убедитесь, что нажата кнопка АЦП, чтобы начать запись каналов АЦП с платы ввода/вывода. Кнопка АЦП загорится оранжевым цветом, когда она включена.
ПРИМЕЧАНИЕ: Если вы хотите воспроизвести ранее записанные экспериментальные данные, плагин File Reader можно использовать в начале вместо Rhythm FPGA. Использование этого в сочетании с APTrack позволит визуализировать и отслеживать задержки потенциалов действия в предыдущих экспериментах. - Вставьте полосовой фильтр в сигнальную цепь; настройки по умолчанию 300-6,000 Гц подходят как для записи человеком, так и для записи с помощью мыши. Дополнительно вставьте после него разветвитель.
- Вставьте плагин APTrack в сигнальную цепь с одной стороны разветвителя и LFP Viewer с другой стороны. LFP Viewer предоставляет традиционное представление трассировки напряжения, похожее на осциллограф, что полезно во время экспериментов.
- Вставьте узел записи после плагина. В выпадающем меню измените формат сохранения данных с двоичного на Open Ephys. Это завершает простую сигнальную цепочку, которая хорошо работает (рис. 2); Тем не менее, дополнительные компоненты могут быть добавлены в соответствии с экспериментальными требованиями.
ПРИМЕЧАНИЕ: Если узел записи размещен перед плагином в сигнальной цепочке, информация о потенциальном отслеживании действия не будет сохранена. - В правом верхнем углу графического интерфейса нажмите кнопку воспроизведения, чтобы начать передачу данных с платы сбора данных и их визуализацию. Чтобы начать запись, нажмите на круглую кнопку записи рядом с кнопкой воспроизведения.
ПРИМЕЧАНИЕ: Легко забыть нажать на запись; Мы записываем данные с того момента, как начинаем их получать, чтобы этого не произошло.
- Вставьте плагин Rhythm FPGA в сигнальную цепочку, щелкнув левой кнопкой мыши и перетащив его в сигнальную цепочку; это соединяет графический интерфейс с платой сбора. Убедитесь, что нажата кнопка АЦП, чтобы начать запись каналов АЦП с платы ввода/вывода. Кнопка АЦП загорится оранжевым цветом, когда она включена.
- Для сборки с аналоговым стимулятором, управляемым напряжением, выполните действия, описанные ниже.
- Включите стимулятор постоянного тока, амплитуда стимуляции которого контролируется аналоговым входом напряжения. В этом случае использовался DS4 (рис. 1).
- Выходной канал PulsePal 1 предназначен для аналоговой команды напряжения. Разделите этот сигнал с помощью Т-образного разветвителя BNC, а затем подключите его к входу стимулятора постоянного тока и плате ввода-вывода, чтобы было записано командное напряжение.
- Выходной канал PulsePal 2 предназначен для маркера событий TTL электростимуляции. Подключите его к плате ввода-вывода, чтобы маркеры событий TTL стимуляции были записаны для использования подключаемым модулем и для последующего анализа.
- Для сборки с аналоговым стимулятором, управляемым напряжением, выполните действия, описанные ниже.
- Включите стимулятор постоянного тока, амплитуда которого контролируется поворотным кодирующим диском. В данном случае использовался DS7 (рис. 1).
- Подключите плату управления шаговым двигателем к шаговому двигателю с помощью кабеля, поставляемого производителем, и магнитного крепления.
- Подключите плату управления к компьютеру напрямую с помощью любого стандартного кабеля USB A — USB MICRO-B. Не подключайте плату управления со стороны участника USB-изолятора, так как он также подключен к сети 12 В.
- Если вы используете плату управления впервые, загрузите скрипт шагового двигателя с GitHub на плату управления; Это необходимо сделать только один раз или если выпущены какие-либо обновления программного обеспечения для сценария шагового двигателя.
- Установите шкалу амплитуды стимуляции на стимуляторе постоянного тока на 0 мА. Используйте специальный монтажный кронштейн для сопряжения шагового двигателя и диска амплитуды стимуляции. Они могут быть напечатаны на 3D-принтере, что обеспечивает дешевые, быстрые и настраиваемые монтажные решения. Обратитесь к GitHub, чтобы узнать, было ли уже разработано крепление для выбранного стимулятора.
- Используйте специальный адаптер цилиндра для подключения ствола шагового двигателя к диску управления амплитудой стимуляции. Эти адаптеры должны быть изготовлены из металла из соображений прочности и долговечности; тем не менее, детали, напечатанные на 3D-принтере, также будут подходящими, хотя их, возможно, потребуется регулярно заменять. Обратитесь к GitHub, чтобы узнать, разработан ли уже адаптер для ствола для выбранного стимулятора.
- Неплотно прикрепите плату управления/шаговый двигатель к диску управления стимулятором с помощью специального крепления и адаптера ствола.
ПРИМЕЧАНИЕ: Крепление и адаптер ствола будут затянуты позже, как только программное обеспечение будет запущено, и шаговый двигатель автоматически установится в нулевое положение. - Подключите PulsePal, как описано в шагах протокола 2.5.2-2.5.3 (за вычетом подключения выходного канала 1 к стимулятору), так как генерация маркеров событий TTL по-прежнему требуется для анализа и для работы плагина. Кроме того, подключите выходной канал 2 к стимулятору DS7, чтобы запустить его.
- Приготовьте препарат для кожи и нерва мыши, как описано ниже.
- Обеспечьте мышей C57BL/6J (Charles River Laboratories, Великобритания, в этом исследовании) в возрасте 2-4 месяцев и обоего пола пищей и водой ad libitum.
- После выбраковки путем передозировки анестетика путем внутрибрюшинной инъекции пентобарбитала натрия (≥200 мг / кг) и подтверждения прекращения кровообращения рассекают кожу с дорсальной стороны задней лапы мыши и подкожного нерва, который иннервирует эту область, используя методы, описанные Zimmermann et al.23.
- Поддерживайте препарат кожно-нервного нерва в карбогенированной синтетической интерстициальной жидкости (таблица 1) при температуре 30-32 °C в половине изготовленной по индивидуальному заказу двухкамерной акриловой ванны (скорость перфузии 15 мл/мин, объем 30 мл). Проденьте нерв через небольшое отверстие в камеру, заполненную минеральным маслом, и запечатайте вазелином. Масло обеспечивает изолированную среду записи.
- Удалите две тонкие нити из ствола нерва с помощью сверхтонких щипцов и повесьте по одному с каждой стороны биполярного записывающего электрода из серебра / хлорида серебра.
- Оцифровывайте и усиливайте нейронный сигнал с помощью 16-канальной биполярной головки RHD2216 и обрабатывайте его с помощью платы сбора данных. Дискретизируйте сигнал на частоте 30 кГц с полосовым фильтром 300-6 000 Гц и визуализируйте его с помощью графического интерфейса.
- С помощью тупой стеклянной палочки прогладьте кожу препарата. Используйте малоамплитудную массовую активность, чтобы подтвердить, что препарат жив.
- Выполните микронейрографию С-волокна человека, как описано ниже.
- Проведите микронейрографию с участниками, которые предоставили письменное информированное согласие, как описано ранее24.
- Когда участник удобно сидит на кровати и поддерживается подушками, определите поверхностный малоберцовый нерв с помощью ультразвукового сканера и отметьте целевую область примерно на 5-10 см проксимальнее латеральной лодыжки, примерно на уровне середины голени.
- Стерилизуйте кожу вокруг целевой области с помощью салфетки с 2% хлоргексидином в 70% спирте и вставьте стерильный электрод сравнения подкожно рядом с предполагаемым местом записи на уровне середины голени.
- Вставьте стерильный записывающий электрод в поверхностный малоберцовый нерв под ультразвуковым контролем в целевой области.
- Оцифровывайте и усиливайте нейронный сигнал с помощью 16-канальной биполярной головки RHD2216 и обрабатывайте его с помощью платы сбора данных. Дискретизируйте сигнал на частоте 30 кГц с полосовым фильтром 300-6 000 Гц и визуализируйте его с помощью графического интерфейса.
ПРИМЕЧАНИЕ: Оборудование для сбора данных было электрически изолировано от ноутбука изолятором USB 3.0 с развязкой 5 кВ RMS и питалось от специально изготовленного источника питания от аккумулятора 12 В. - Подтвердите успешное интраневральное позиционирование, осторожно поглаживая кожу, чтобы выявить механически вызванную массовую активность. Кроме того, участники обычно сообщают о парестезии в дорсолатеральной части стопы при успешном интраневральном позиционировании.
3. Настройка программного обеспечения, идентификация и фенотипирование периферических нейронов
- Настройте программное обеспечение, как описано ниже.
- Откройте графический интерфейс (рисунок 3). Если плата управления шаговым двигателем подключена к вашему ПК, она будет обнаружена и установлена в нулевое положение. Затяните специальное крепление и адаптер цилиндра, описанные в шагах 2.6.5-2.6.7, так как диск амплитуды стимуляции стимулятора и шаговый двигатель установлены на ноль.
ПРИМЕЧАНИЕ: Если шаговый двигатель и циферблат амплитуды стимуляции не «обнулены», это может привести к тому, что шаговый двигатель попытается вывернуть диск управления за пределы своего диапазона, что может привести к повреждению. - В меню параметров выберите Триггерный канал. Выберите канал АЦП , содержащий маркер TTL электростимуляции, из выходного канала PulsePal 2.
- В меню параметров выберите канал данных и выберите канал, содержащий электрофизиологические данные.
- На панели управления стимуляцией определите начальную, минимальную и максимальную амплитуды стимуляции с помощью ползунка. Убедитесь, что текущая стимуляция установлена выше 0, чтобы генерировались маркеры TTL.
ПРИМЕЧАНИЕ: Некоторые стимуляторы имеют коэффициент масштабирования на входе и выходе, который не составляет 1:1; Учитывайте это при выборе подходящей амплитуды стимуляции. Например, на некоторых системах стимуляции можно выбрать выходное соотношение 1:10 для достижения более высокой выходной мощности стимулятора постоянного тока. - На панели управления стимуляцией нажмите F, чтобы загрузить файл, содержащий инструкции по стимуляции. Протоколы электростимуляции хранятся в виде файлов значений, разделенных запятыми (CSV), состоящих из желаемых частот и продолжительности стимуляции, что позволяет пользователям создавать сложные парадигмы стимуляции для своих экспериментов. Пример шаблона доступен здесь: https://github.com/Microneurography/APTrack/blob/main/example_playlist.csv
- На панели управления стимуляцией нажмите на >, чтобы запустить загруженную парадигму стимуляции. По умолчанию APTrack запрашивает у PulsePal генерацию положительных прямоугольных импульсов длительностью 0,5 мс различной амплитуды для управления амплитудой стимуляции стимулятора постоянного тока.
- Временной растровый график начнет обновляться с ответа на электрическую стимуляцию, при этом каждый новый ответ на стимуляцию будет отображаться в виде нового столбца справа.
- Откройте графический интерфейс (рисунок 3). Если плата управления шаговым двигателем подключена к вашему ПК, она будет обнаружена и установлена в нулевое положение. Затяните специальное крепление и адаптер цилиндра, описанные в шагах 2.6.5-2.6.7, так как диск амплитуды стимуляции стимулятора и шаговый двигатель установлены на ноль.
- Визуализируйте и идентифицируйте потенциалы действия одного нейрона.
- Для успешного обнаружения потенциалов действия одного нейрона важно установить подходящие пороговые значения изображения. На панели временного растрового графика отрегулируйте пороговые значения нижнего, обнаружения и высокого порога изображения.
- Выберите цветовую схему в меню параметров. В режиме WHOT (White Hot) (по умолчанию) напряжения ниже нижнего порога изображения кодируются черным цветом. Напряжения между низкими порогами изображения и обнаружения кодируются в оттенках серого. Напряжения выше порога обнаружения кодируются зеленым цветом, а напряжения выше высокого порога изображения кодируются красным.
- Периферические нейроны демонстрируют постоянные латентные реакции на низких частотах стимуляции (<0,25 Гц), и эти реакции определяются скоростью их проводимости и расстоянием между участками стимуляции и записи. Если установлены подходящие пороговые значения изображения, события пересечения порогов, обнаруженные алгоритмами, будут закодированы зеленым цветом (рис. 4).
- Систематически перемещайте стимулирующий электрод вокруг участка кожи, иннервируемого регистрируемым нервом, что позволяет провести как минимум три события стимуляции в каждом участке. Отслеживайте временной растровый график на предмет событий пересечения порога (отмечены зеленым цветом), происходящих в один и тот же момент времени после каждого события электрической стимуляции.
ПРИМЕЧАНИЕ: У мышей использовался поисковый стимул 5 мА. У людей амплитуда чрескожного электрического поискового стимула была титрована до словесной оценки боли, так что она никогда не превышала 7/10. - Проверьте наличие трех событий пересечения порога (зеленых полос), которые появляются подряд с одинаковой задержкой и в одной и той же позиции стимуляции; Это указывает на идентификацию потенциала действия периферического нейрона.
- Оптимизируйте положение стимулирующего электрода, определив наиболее электрически чувствительную точку рецептивного поля целевого нейрона, а затем зафиксируйте электрод в нужном положении. На этом этапе в микроневрографии человека переключитесь на использование внутрикожных электроакупунктурных игл (диаметром 0,2 мм) для биполярной электростимуляции, у мышей используется специальный чрескожный стимулирующий зонд, чтобы положение стимуляции было постоянным.
- Для успешного обнаружения потенциалов действия одного нейрона важно установить подходящие пороговые значения изображения. На панели временного растрового графика отрегулируйте пороговые значения нижнего, обнаружения и высокого порога изображения.
- Выполнять классификацию и сенсорное фенотипирование периферических нейронов.
- Оцените электрический порог целевого потенциала действия, отрегулировав амплитуду моделирования вручную или с помощью APTrack, если это необходимо (описано в шагах 4.1-4.2).
- Стимулируйте рецептивное поле в 2 раза выше расчетного электрического порога на частоте 0,25 Гц по всему протоколу сенсорного фенотипирования.
- Рассчитайте скорость проводимости нейрона, разделив расстояние проводимости на задержку проводимости. С-волокна можно идентифицировать по скорости проводимости ≤2 м/с.
- Механически стимулировать рецептивное поле с помощью нитей фон Фрея для определения механического порога активации. Механочувствительность может быть идентифицирована по вызванным потенциалам действия, видимым на трассе напряжения, и увеличению латентности нейрона, если это С-волокно, при достаточной силе.
- Нагрейте рецептивное поле нейрона, снова наблюдая за потенциалами действия, видимыми на следе напряжения, и увеличением латентности нейрона, если это С-волокно, при достаточном приложении тепла. Нечувствительные к теплу нейроны будут демонстрировать уменьшение латентности из-за термодинамического эффекта на распространение аксонов.
ПРИМЕЧАНИЕ: В микроневрографии человека используйте TSC-II для быстрого и точного термоконтроля. При подготовке мыши добавьте нагретую или охлажденную синтетическую интерстициальную жидкость в алюминиевую изолирующую камеру, расположенную над рецептивным полем, чтобы обеспечить доступ к окончаниям нейронов, ограничивая при этом быстрое рассеивание тепла в окружающую жидкость. Запишите температуру с помощью термопары. - Охладите рецептивное поле, снова наблюдая за потенциалами действия, видимыми на трассе напряжения, и заметным увеличением латентности нейрона, если это С-волокно, при достаточном холодном применении. Все нейроны будут демонстрировать увеличение латентности из-за термодинамического эффекта на распространение аксонов, поэтому будьте осторожны при маркировке нейронов как чувствительных к холоду только на основе увеличения латентности.
4. Отслеживание задержки и электрического порога
- Выполните отслеживание задержки, как описано ниже.
- После идентификации потенциалов действия одного нейрона на временном растровом графике переместите серый линейный ползунок в правой части временной растровой диаграммы, чтобы отрегулировать положение поля поиска.
- Под временным растровым графиком отрегулируйте ширину поворотного ползунка поля поиска на соответствующую ширину. Сузьте ширину поля поиска, чтобы уменьшить вероятность того, что переходные всплески шума, спонтанно срабатывающие потенциалы действия или другие близлежащие потенциалы действия с постоянной задержкой будут ошибочно идентифицированы как интересующий потенциал действия.
- Чтобы начать отслеживать потенциал целевого действия, нажмите на + под таблицей отслеживания нескольких единиц. В таблицу будет добавлена новая строка, содержащая подробную информацию о потенциале целевого действия, включая местоположение задержки, процент срабатывания более 2-10 стимулов (настраивается в меню параметров) и обнаруженную амплитуду пика.
- После того, как потенциал действия добавлен в таблицу отслеживания нескольких блоков, алгоритм отслеживания задержки (рис. 5) будет автоматически выполняться на нем при каждой последующей электрической стимуляции.
- Если на временном растровом графике видно несколько дискретных потенциалов действия, добавьте их в многоэлементную таблицу слежения, как описано выше. Теоретическое максимальное количество потенциалов действий, которое может быть добавлено в таблицу для одновременного отслеживания задержки, является максимальным 32-битным целочисленным значением.
- Установите флажок «Отслеживать всплеск » в таблице отслеживания нескольких единиц, чтобы переместить поле поиска в место, соответствующее этому конкретному потенциалу действия, как определено алгоритмом отслеживания задержки. Это позволит отслеживать задержку в режиме реального времени и гарантировать, что отслеживание соответствует потенциалу действия, как и ожидалось. Отслеживание задержки других всплесков будет продолжаться в обычном режиме в фоновом режиме.
- Удалите отслеживаемые потенциалы действий из таблицы отслеживания с несколькими единицами с помощью кнопки удаления в конце каждой строки.
- Выполните отслеживание электрических порогов, как описано ниже.
- Отрегулируйте скорости приращения и уменьшения на панели управления стимуляцией в диапазоне от 0,1 В до 0,5 В. Сохраняйте эти значения равными и не регулируйте их во время эксперимента, если это не является частью экспериментальной парадигмы.
- Убедитесь, что частота стимуляции установлена на соответствующую частоту, обычно 0,25-0,5 Гц, если модуляция частоты стимуляции не является частью экспериментальной парадигмы. Увеличение скорости срабатывания ноцицептора может изменить электрический порог ноцицептора.
- После успешного отслеживания потенциала действия установите флажок Track Threshold в таблице отслеживания нескольких единиц, который инициирует алгоритм отслеживания электрического порога (рис. 6).
ПРИМЕЧАНИЕ: Отслеживание электрического порога выполняется только на потенциале целевого действия; Действительно, скорости срабатывания других потенциалов действия в таблице слежения за несколькими единицами будут соответствующим образом обновляться по мере изменения амплитуды стимуляции. - Отрегулируйте амплитуду стимуляции вручную в соответствии с оценкой электрического порога; Это сократит время ожидания определения электрического порога. Время, необходимое для установления надежного электрического порога, зависит от частоты стимуляции, скорости приращения и уменьшения, а также разницы в амплитуде стимуляции от начальной стимуляции до электрического порога нейрона.
- Программное обеспечение использует метод «вверх-вниз» для оценки электрического порога нейронов. В таблице слежения за несколькими юнитами скорость стрельбы определяется по 2-10 предыдущим стимуляциям (выбирается в меню параметров). Выберите количество событий стимуляции, которые будут учитываться; Более высокое число повысит надежность пороговой оценки, но для ее достижения потребуется больше времени.
- Во время микронейрографии человека важно контролировать болезненность электрических раздражителей, чтобы предотвратить чрезмерный дискомфорт участника; некоторый дискомфорт неизбежен во время исследования ноцицепторов, особенно молчаливых/спящих С-волокон. Регулярно запрашивайте оценки боли, пока амплитуда стимуляции увеличивается во время отслеживания электрического порога, и оставайтесь рядом со стимулятором постоянного тока, чтобы отключить его по просьбе участника.
ПРИМЕЧАНИЕ: Кроме того, электрическую стимуляцию можно отключить через пользовательский интерфейс, нажав кнопку [ ] на панели управления стимуляцией. - Скорость стрельбы 50% указывает на то, что был определен приблизительный электрический порог.
- Во время отслеживания электрического порога примените экспериментальные манипуляции к рецептивному полю, такие как манипуляции с температурой или лекарствами. Влияние этих манипуляций на электрический порог ноцицептора будет отслеживаться.
ПРИМЕЧАНИЕ: Выделите достаточно времени для выявления нового порога ноцицептора после экспериментальной манипуляции.
Результаты
Репрезентативный пример программного обеспечения, работающего для управления экспериментом, показан на рисунке 7. Он итеративно регулирует амплитуду стимуляции, используя метод вверх-вниз, чтобы эффективно найти электрический порог одиночных ноцицепторов. Впервые мы демонстрируем возможность отслеживания однонейронного электрического порога в режиме реального времени у человека во время микронейрографии (рис. 7А). Кроме того, мы показываем отслеживание электрического порога в Aδ-волокне мыши (рис. 7B). Идентификация потенциалов действия путем пересечения порогов, используемая здесь, достаточна для отслеживания электрических порогов с течением времени. Мы рекомендуем пользователям принять меры для минимизации электрических помех во время записи, например, использовать клетку Фарадея и полосовые фильтры для улучшения отношения сигнал/шум.
Чтобы продемонстрировать, что отслеживание электрического порога может быть использовано в качестве меры изменения возбудимости ноцицепторов у людей, было проведено отслеживание электрического порога во время ступенчатой парадигмы нагрева (рис. 8). Повышение температуры ноцицепторных терминалов уменьшало ток электрической стимуляции, необходимый для возникновения потенциала действия, что отражало увеличение возбудимости ноцицептора (рис. 8C). Вероятно, это было вызвано генерацией рецепторных потенциалов термочувствительными ионными каналами, экспрессируемыми в ноцицепторе14 С-волокна. На самой высокой температурной ступени, 44 °C, были вызваны термически вызванные потенциалы действия (рис. 8A, стимул No 86-96). Это вызывает увеличение электрического порога, поскольку ноцицептор может находиться в тугоплавком состоянии после высокочастотного разряда. Как и ожидалось, задержка отслеживаемого потенциала действия уменьшалась по мере повышения температуры. Считается, что это происходит из-за термодинамического воздействия на проводящий механизм, который увеличивает скорость проводимости С-волокна. Это С-волокно также может демонстрировать триггер (рис. 8B, номер стимула 47-54), что может привести к ошибочному увеличению амплитуды следующей электрической стимуляции, если потенциал действия выпадает за пределы окна поиска алгоритма.
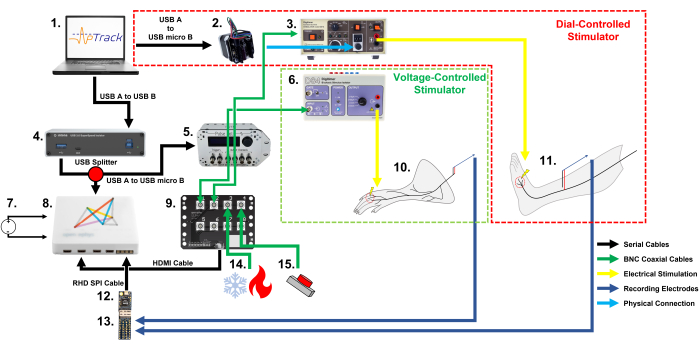
Рисунок 1: Схема настройки оборудования и кабельных соединений, необходимых для отслеживания электрического порога ноцицептора с помощью APTrack у грызунов и людей. Обратите внимание на два различных метода управления амплитудой стимуляции: шаговый двигатель для стимуляторов с ручной регулировкой в нашей человеческой установке и PulsePal для стимуляторов, управляемых входным напряжением, в нашей установке для грызунов. (1) ПК (Windows, Mac или Linux) с подключаемым модулем для платформы Open Ephys. (2) Шаговый двигатель, который управляет регулятором амплитуды стимуляции на DS7. (3) Стимулятор постоянного тока, одобренный для использования у людей; здесь мы использовали DS7. (4) Оптоизолятор USB 3.0, который изолирует человека от ПК (опционально, требуется только для исследований на людях). (5) Генератор импульсов PulsePal V2, который генерирует временные метки TTL (выходной канал 2) и шаги напряжения, соответствующие запрошенной амплитуде стимуляции (выходной канал 1). (6) Стимулятор постоянного тока для использования у животных; здесь мы использовали DS4. (7) Источник питания постоянного тока для системы (сетевой источник питания постоянного тока, используемый для установки грызунов, и аккумуляторный источник питания постоянного тока, используемый для установки человека). (8) Совет по приобретению. (9) Плата ввода-вывода для подключения коаксиальных кабелей BNC, несущих сигналы, подлежащие записи, такие как выходы термопар и маркеры TTL. (10) Препарат кожно-нервного нерва мыши, подвергающийся электрофизиологической записи ноцицепторов. (11) Участник-человек, проходящий микронейрографическую регистрацию из С-волокон в поверхностном малоберцовом нерве. (12) Головная часть Intan RHD2216 для сбора и оцифровки записей. (13) Плата адаптера электродов Intan, к которой подключены записывающие электроды и которая позволяет передавать сигнал на переднюю часть RHD2216. (14) Система термостимуляции, которая может выводить температуру через коаксиальное соединение BNC. (15) Кнопочная/ножная педаль с батарейным питанием 3,3 В, которая используется для маркировки событий механической стимуляции и применения лекарств. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
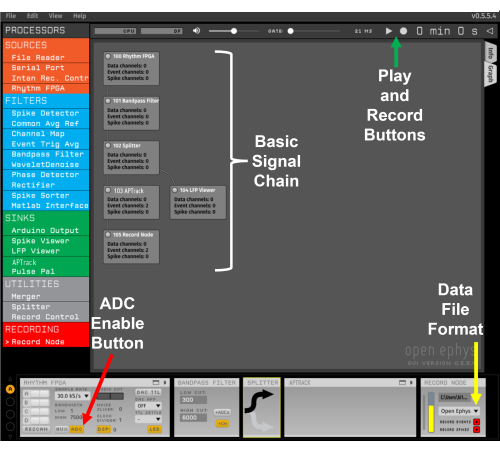
Рисунок 2: Шаблон сигнальной цепи. Красная стрелка указывает на кнопку включения входа АЦП на плате ввода/вывода. Желтая стрелка указывает на выпадающее меню для выбора формата файла Open Ephys. Зеленая стрелка указывает кнопки «Воспроизведение» и «Запись». Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
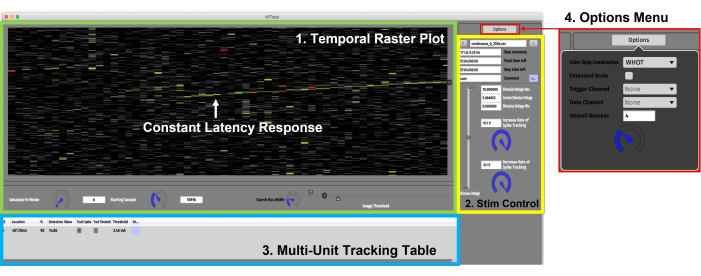
Рисунок 3: Графический интерфейс пользователя. Графический интерфейс состоит из четырех основных компонентов. (1) Панель «Временной растровый график» (зеленая) для визуализации данных и настроек, связанных с управлением графиком. Реакция постоянной задержки, показывающая постепенное замедление, зависящее от активности, обозначена зеленой стрелкой. (2) Панель управления стимуляцией (желтая) для настройки параметров амплитуды стимуляции и загрузки сценариев парадигмы стимуляции. (3) Таблица отслеживания нескольких блоков (синяя) для добавления потенциалов действия для отслеживания и активации отслеживания задержки и электрического порога. (4) Меню параметров для выбора цветовых стилей и входного канала для триггеров данных и TTL. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
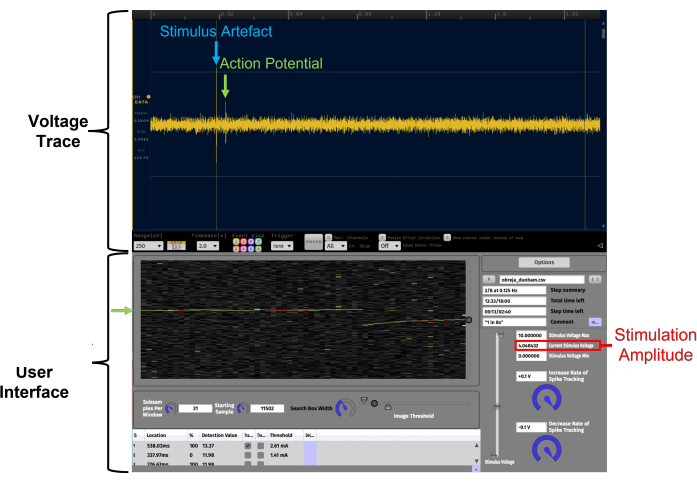
Рисунок 4: Облегчение идентификации потенциалов действия с постоянной задержкой посредством визуализации данных в реальном времени на временном растровом графике с использованием APTrack. Это пример с высоким отношением сигнал/шум. Данные, представленные на графике вистра, взяты из записи С-волокна человека с поверхностного малоберцового нерва во время микронейрографии. Voltage Trace — это подключаемый модуль LFP Viewer, похожий на осциллограф, в Open Ephys. Пользовательский интерфейс APTrack — это графический пользовательский интерфейс плагина. Отслеживаемый потенциал действия обозначен зелеными стрелками, а круговой ползунок на границе временного растрового графика предназначен для управления положением окна поиска, в котором алгоритмы будут искать события пересечения порога. Артефакт электростимуляции отмечен синим цветом на дорожке напряжения. Амплитуда стимуляции команды аналогового напряжения обозначена красным цветом; Обратите внимание, что это может не совпадать с амплитудой тока стимуляции в зависимости от коэффициента масштабирования, установленного на стимуляторе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
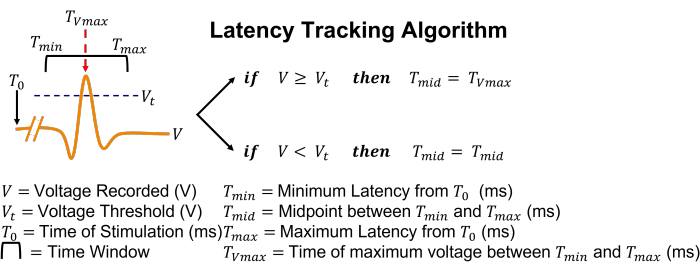
Рисунок 5: Графическое представление алгоритма отслеживания задержек. Проще говоря, если потенциал действия обнаружен при пересечении порога, поле поиска скорректирует свое положение так, чтобы оно центрировалось во время пикового напряжения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Графическое представление алгоритма отслеживания электрического порога. Проще говоря, если потенциал действия обнаруживается при пересечении порога, амплитуда стимуляции будет уменьшена на скорость снижения. Если потенциал действия не обнаружен, амплитуда стимуляции будет увеличена на скорость приращения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
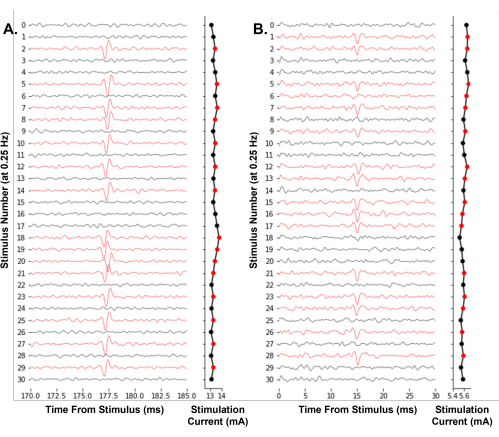
Рисунок 7: Автоматическое отслеживание электрических пороговых потенциалов действия одного нейрона на частоте стимуляции 0,25 Гц . (A) Последовательные следы человеческого С-волокна поверхностного малоберцового нерва во время эксперимента по микронейрографии. (B) Последовательные следы мышиного Aδ-волокна подкожного нерва во время подготовки кожно-нервного волокна дразнили электрофизиологию волокна. Следы были окрашены в красный цвет, когда был идентифицирован потенциал действия, что привело к уменьшению амплитуды стимула. Программный алгоритм эффективно находит амплитуду стимула, необходимую для 50% вероятности срабатывания. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
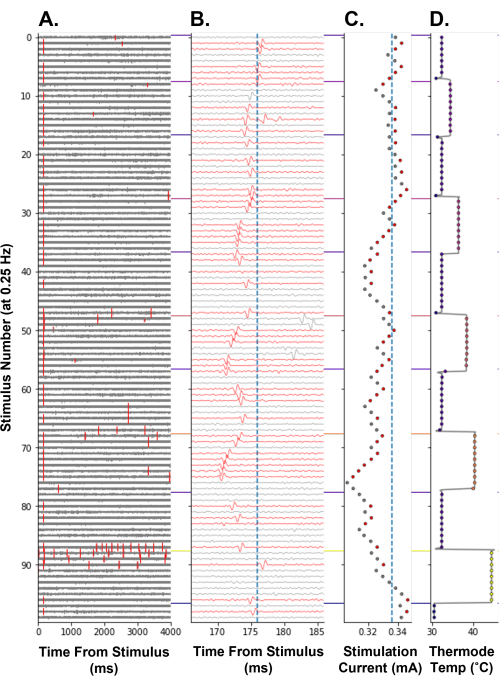
Рисунок 8: Отслеживание электрического порога на частоте стимуляции 0,25 Гц во время тепловой стимуляции ноцицептора С-волокна человека. Ось Y кодирует число стимуляции с самого начала парадигмы. (A) Трассировка напряжения в течение 4 000 мс после электрической стимуляции с событиями пересечения пороговых значений, отмеченными красным цветом. (B) Трассировка напряжения от А , увеличенная вокруг отслеживаемого потенциала действия. Следы были окрашены в красный цвет при обнаружении отслеживаемого потенциала действия. Вертикальная синяя линия — это базовая задержка отслеживаемого объекта. (C) Ток стимуляции, управляемый APTrack. Вертикальная синяя линия является базовым электрическим порогом. (D) Температура термостимулирующего зонда TCS-II рецептивного поля. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Соединение | Концентрация |
| NaCl | 107,8 мМ |
| NaHCO3 | 26,2 мМ |
| KCl | 3,5 мМ |
| 2PO4 | 1,67 мМ |
| CaCl2 | 1,53 мМ |
| МгСО4 | 0,69 мМ |
| Глюконат натрия | 9.64 мМ |
| Сахароза | 7,6 мМ |
| Глюкоза | 5,55 мМ |
Таблица 1: Содержание синтетической интерстициальной жидкости для препарата кожно-нервный препарат мыши23.
Обсуждение
APTrack — это программный плагин для использования с платформой Open Ephys. Мы выбрали эту платформу, так как она с открытым исходным кодом, гибкая и дешевая в реализации. Не включая стоимость стимулятора постоянного тока, все оборудование, необходимое для начала использования плагина, можно было приобрести примерно за 5,000 долларов США на момент написания статьи. Мы надеемся, что это позволит исследователям легче внедрять APTrack в свои исследования электрофизиологии периферических нервов. Кроме того, исследователи могут свободно модифицировать программное обеспечение в соответствии со своими экспериментальными потребностями. Важно отметить, что этот инструмент впервые позволил отслеживать электрические пороги одиночных ноцицепторов С-волокна у людей.
Чем выше отношение сигнал/шум, тем лучше алгоритмы могут идентифицировать потенциалы действия. Соотношение сигнал/шум во время микронейрографии было достаточным в большинстве наших записей, но пользователи должны быть готовы к риску ухудшения сигнала с течением времени. Это особенно важно для более длительных экспериментальных протоколов, потому что, если амплитуда отслеживаемого потенциала действия падает ниже порога обнаружения, амплитуда стимуляции будет увеличена ошибочно; Это можно смягчить, если экспериментаторы будут следить за плагином, а затем при необходимости корректировать настройки. Отношение сигнал/шум улучшается с помощью полосовой фильтрации, но более крупные переходные процессы все равно могут быть ошибочно идентифицированы как потенциалы действия, если они поступят во время окна поиска. Риск неправильной идентификации переходного шума в качестве потенциала действия может быть снижен за счет сужения временного окна, в течение которого плагин ищет потенциалы действия, и оптимизации пороговых настроек. Тем не менее, все еще есть ситуации, с которыми можно столкнуться, которые препятствуют работе плагина. Спонтанная активность может вызвать трудности, если потенциалы действия большей амплитуды попадают в окно окна поиска алгоритма, поскольку они будут ошибочно идентифицированы как целевой потенциал действия. Кроме того, спонтанная активность в интересующем нейроне может означать, что электрическая стимуляция падает в течение ее рефрактерного периода, что приводит к неспособности генерировать потенциал действия. Трудности с использованием программного обеспечения также могут возникнуть, когда первичные афферентные нейроны демонстрируют триггер-флоп, в результате чего стимулируются альтернативные концевые ветви одного нейрона, что приводит к тому, что вызванный потенциал действия имеет две (или более) базовые латентности, которые являются взаимоисключающими20. Во время записи нейронов, демонстрирующих триггер с высоким отношением сигнал/шум, мы успешно выполнили отслеживание задержки и электрического порога, увеличив ширину окна поиска, чтобы инкапсулировать все потенциальные скорости проводимости, которые демонстрировал нейрон. Однако электрический порог может варьироваться в зависимости от возбуждаемой концевой ветви нейрона, что, вероятно, отчасти связано с различиями в расстоянии от места электрической стимуляции до альтернативных ноцицепторных терминалей. Возможна дополнительная работа по процессу идентификации потенциала действия, включающая, например, сопоставление шаблонов, и она может быть интегрирована в это программное обеспечение. Плагины GUI для полосовой или адаптивной фильтрации шума также могут использоваться выше по течению от APTrack в сигнальной цепи, если они будут разработаны.
Мы считаем, что определенный электрический порог - это ток, необходимый для возникновения потенциала действия в 50% случаев при заданном пользователем количестве электрических стимулов, обычно 2-10. Морфология электростимуляции составляет 0,5 мс и положительные, прямоугольные импульсы. Это не то же самое, что определить реобазу, широко используемую меру возбудимости нейронов. Плагин может быть адаптирован для определения реобазы. Тем не менее, мы преследовали более простую меру, поскольку динамические изменения возбудимости, такие как те, которые предположительно происходили во время нагрева, было бы труднее количественно оценить с помощью изменений реобазы, чем нашу оценку электрического порога.
Это программное обеспечение можно использовать как в экспериментах на людях, так и на грызунах. Это стало возможным благодаря гибкой поддержке систем электростимуляции. Программное обеспечение будет работать с любым стимулятором, который принимает аналоговое командное напряжение или может быть вручную сопряжен с шаговым двигателем. Для микронейрографии мы использовали его со стимулятором постоянного тока с маркировкой CE, который был разработан для использования в исследованиях на людях и контролировал его стимуляцию с помощью циферблата. Стимуляторы, принимающие аналоговые команды напряжения, могут быть шумными, поскольку они не отключают цепь между стимулами, а это означает, что любой гул или шум 50/60 Гц на аналоговом входе будет передаваться на запись. Стимулятор, который требует дополнительного триггерного сигнала TLL для подключения цепи, позволяя генерировать стимул при токе, аналогичном входному аналоговому напряжению, идеально подходит для использования с плагином. Это предотвращает передачу шума на запись между стимулами.
Программное обеспечение использует простой метод вверх-вниз для оценки электрического порога. Это использовалось в психофизических тестах в течение многих десятилетий25. В соответствии с методом «вверх-вниз» алгоритм отслеживания электрического порога для модуляции амплитуды стимуляции учитывает только амплитуду и реакцию предыдущей стимуляции при расчете амплитуды следующей стимуляции. Это означает, что амплитуда стимуляции будет колебаться вокруг истинного электрического порога, создавая таким образом 50% скорость срабатывания, при условии, что порог стабилен. Минимальный размер приращения или уменьшения составляет 0,01 В; это эквивалентно 0,01 мА, предполагая, что стимулятор имеет отношение входа/выхода 1 В: 1 мА и достаточное разрешение для достижения таких малых ступенчатых изменений. Плагин будет обновлять оценку электрического порога целевого потенциала действия в реальном времени каждый раз, когда он достигает 50% скорости срабатывания по сравнению с заданным пользователем количеством предыдущих стимулов (2-10). Постфактум мы рекомендуем использовать скользящее среднее амплитуды стимуляции за последние 2-10 стимулов для оценки электрического порога, и следует отметить, что эта оценка будет точной только тогда, когда скорость срабатывания относительно стабильна на уровне 50%. Как в живых, так и в постфактум оценках электрического порога существует баланс разрешения, надежности и времени для рассмотрения. Использование меньших шагов приращения и уменьшения повысит точность оценки электрического порога, но увеличит время, необходимое для нахождения нового электрического порога на начальном этапе и после возмущения. Расчет электрического порога для большего количества предыдущих стимулов обеспечит лучшую надежность, но увеличит время, необходимое для достижения точной оценки.
APTrack был разработан для использования в записях периферических нервов, в частности, для отслеживания электрических порогов С-волокон во время экспериментальных и патологических возмущений в периоды, когда задержка потенциала действия может варьироваться в зависимости от основной активности нейронов. Этот метод позволит исследовать не только возбудимость аксонов, но и потенциалы генератора ноцицепторов у здоровых добровольцев и пациентов. Мы ожидаем, что другие области электрофизиологии могут принять и адаптировать этот инструмент для использования в любом эксперименте, который требует отслеживания электрического порога активности, заблокированной стимулом. Например, это может быть легко адаптировано для оптогенетической стимуляции световыми импульсами, управляемыми APTrack. Плагин с открытым исходным кодом и доступен исследователям под лицензией GPLv3. Он построен на платформе Open Ephys, которая представляет собой адаптируемую, недорогую систему сбора данных с открытым исходным кодом. Плагин предоставляет дополнительные перехватчики для последующих плагинов для извлечения информации о потенциальном действии и предоставления дополнительных пользовательских интерфейсов или адаптивных парадигм. Плагин предоставляет простой пользовательский интерфейс для визуализации и отслеживания задержек потенциалов действий в режиме реального времени. Он также может воспроизводить предыдущие данные и визуализировать их с помощью временного растрового графика. Кроме того, он также может отслеживать задержку во время воспроизведения предыдущих данных. Хотя существуют и другие программные пакеты, доступные для отслеживания задержек в реальном времени, они не имеют открытого исходного кода и не могут выполнять отслеживание электрических порогов26,27. APTrack имеет преимущество перед традиционными методами идентификации потенциалов действия с постоянной задержкой по трассам напряжения, поскольку он использует временной растровый график для визуализации данных. Кроме того, наш опыт использования его в экспериментах с низким отношением сигнал/шум показал, что метод визуализации временного растрового графика позволяет идентифицировать потенциалы действия с постоянной задержкой, которые в противном случае могли бы быть упущены.
Отслеживание порога всего нерва является широко используемым методом оценки возбудимости аксонов13. Отслеживание однонейронного электрического порога в С-волокнах грызунов ранее использовалось для количественной оценки возбудимости ноцицепторов14, и его полезность для людей признана10,11; Однако до сих пор это не удавалось. Мы предоставляем новый инструмент с открытым исходным кодом для непосредственного измерения возбудимости отдельных ноцицепторов в электрофизиологических исследованиях периферических нервов как у грызунов, так и у человека. APTrack впервые позволяет в режиме реального времени с открытым исходным кодом отслеживать электрические пороговые значения потенциалов действия одного нейрона у людей. Мы ожидаем, что это облегчит трансляционные исследования ноцицепторов между грызунами и людьми.
Раскрытие информации
G.W.T.N. является докторантурой BBSRC Collaborative Training Partnership с Бристольским университетом и Eli Lilly and Company (BB / T508342 / 1). A.P.N. является действующим сотрудником Eli Lilly and Company и может владеть акциями этой компании.
Благодарности
Мы хотели бы поблагодарить наших спонсоров за их поддержку: Академию медицинских наук (J.P.D., A.E.P.), Versus Arthritis (J.P.D., A.E.P.), Институт Джин Голдинг Seedcorn Grant (J.P.D., A.E.P., G.W., A.C.S., M.M.P.) и докторантуру Исследовательского совета по биотехнологии и биологическим наукам с Eli Lilly (G.W.T.N.). Мы хотели бы выразить благодарность всем, кто внес свой вклад в разработку APTrack. Мы также хотели бы поблагодарить наших волонтеров, которые участвовали в экспериментах по микронейрографии, и наших сотрудников по вовлечению и вовлечению пациентов и общественности за их неоценимый вклад.
Материалы
| Name | Company | Catalog Number | Comments |
| 12V DC Power Supply | NA | NA | To power uStepper S-lite. Required for dial-controlled stimulators. |
| 36 Pin Electrode Adapter Board | Intan Technology | C3410 | APTrack Dependency. For connecting electrode input to headstage. $255 USD as of March 2021. |
| APTrack Plugin | NA | NA | https://github.com/Microneurography/APTrack |
| Bipolar Ag/AgCl Recording Electrode | Custom | NA | Recording electrode for the skin-nerve preparation. Or equivalent. |
| Bipolar Concentric Stimulating Electrode | World Precision Instruments | SNE-100 | For electrical stimulation in the mouse skin-nerve preparation. Or equivalent. |
| Bipolar Transcutaneous Stimulating Electrode | Custom | NA | For transcutaneous electrical stimulation while searching for single-neuron action potentials during microneurography. |
| BNC T Splitter (1+) | NA | NA | APTrack Dependency. Any standard BNC T splitter. |
| BNC to BNC cables (3+) | NA | NA | APTrack Dependency. Any standard BNC cables. |
| C6H11NaO7 | Merck | S2054 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| CaCl2 | Merck | C5670 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| Digitimer DS4 Constant Current Stimulator | Digitimer | DS4 | Constant current stiulator for animal research. £1,695 GBP as of September 2022. |
| Digitimer DS7 Constant Current Stimulator | Digitimer | DS7A | Constant current stiulator for human research. £3,400 GBP as of September 2022. |
| Electroaccupuncture Classic Plus Stimulating Electrodes | Harmony Medical | NA | For fixed position intradermal electrical stimulation of the dorsal aspect of the foot during human microneurography. |
| Glucose | Fisher Scientific | G/0450/60 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| HDMI Cable | NA | NA | APTrack Dependency. Any standard passive HMDI cable. To connect OE I/O Board to OE Acquisition Board. |
| KCl | Merck | P9541 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| MgSO4 | Acros Organics | 213115000 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| Mineral Oil | Merck | 330779 | Electrical insulation for nerve recordings in th skin-nerve preparation. Or equivalent. |
| NaCl | Merck | S9888 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| NaHCO3 | Merck | S6014 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| NaHCO3 | Merck | S0751 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| Open Ephys Acquisition Board | Open Ephys | NA | APTrack Dependency. Includes USB cable to connect to computer and mains socket power supply. €2,955 EUR as of September 2022. |
| Open Ephys Graphical User Interface | Open Ephys | NA | https://github.com/open-ephys/plugin-GUI |
| Open Ephys I/O Board | Open Ephys | NA | APTrack Dependency. For ADC voltage inputs via BNC cables. €12.5 EUR without connectors, €85 EUR with connectors as of September 2022. |
| PulsePal V2 | Sanworks | 1102 | APTrack Dependency. Open-source DAC and train generator. $725 USD pre-assembled as of September 2022. Approx. $275 USD for self-assembly. |
| RHD 6ft SPI Cable | Intan Technology | C3206 | APTrack Dependency. For connecting headstage to OE Acquisition Board. $295 USD as of March 2021 |
| RHD2216 16ch Bipolar Headstage | Intan Technology | C3313 | APTrack Dependency. For data acquisition and digitization. $725 USD as of March 2021. Or equivalent RHD2000 series headstage. |
| Sucrose | Fisher Scientific | S/8560/60 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| TCS-II Thermal Stimulator | QST.Lab | NA | For thermal stimualtion of nociceptor receptive fields during human microneurography. |
| Tungsten Microelectrode Pair (Active + Reference) | FHC | 30085 | For microneurography recordings. 35mm. |
| Ultrasound Scanner iQ+ | Butterfly Network | NA | For ultrasound-guided electrode insertion during microneurography. |
| USB 3.0 5kV RMS Isolation | Inota Technology | 7055-D | For isolating human microneuroography participant from computer. €459 EUR as of September 2022. |
| USB-A to micro USB-B cable (2) | NA | NA | APTrack Dependency. To connect computer to PulsePal and to uStepper S-lite if using stepper-stimulator interfacing. |
| uStepper S-lite + NEMA17 motor | uStepper | NA | To interface with stimulators via a control dial. €50 EUR as of September 2022. |
| Von Frey Filaments | Ugo Basile | 37450-275 | For mechanical stimulation of receptive fields during sensory phenotyping of nociceptors. |
Ссылки
- Dubin, A. E., Patapoutian, A. Nociceptors: The sensors of the pain pathway. Journal of Clinical Investigation. 120 (11), 3760-3772 (2010).
- Serra, J., et al. Microneurographic identification of spontaneous activity in C-nociceptors in neuropathic pain states in humans and rats. Pain. 153 (1), 42-55 (2012).
- Serra, J., et al. Hyperexcitable C nociceptors in fibromyalgia. Annals of Neurology. 75 (2), 196-208 (2014).
- Namer, B., et al. Specific changes in conduction velocity recovery cycles of single nociceptors in a patient with erythromelalgia with the I848T gain-of-function mutation of Nav1.7. Pain. 156 (9), 1637-1646 (2015).
- Kleggetveit, I. P., et al. High spontaneous activity of C-nociceptors in painful polyneuropathy. Pain. 153 (10), 2040-2047 (2012).
- Orstavik, K., et al. Abnormal function of C-fibers in patients with diabetic neuropathy. Journal of Neuroscience. 26 (44), 11287-11294 (2006).
- Orstavik, K., et al. Pathological C-fibres in patients with a chronic painful condition. Brain. 126, 567-578 (2003).
- Raja, S. N., Ringkamp, M., Guan, Y., Campbell, J. N., John, J. Bonica Award Lecture: Peripheral neuronal hyperexcitability: The "low-hanging" target for safe therapeutic strategies in neuropathic pain. Pain. 161, S14-S26 (2020).
- Middleton, S. J., et al. Studying human nociceptors: From fundamentals to clinic. Brain. 144 (5), 1312-1335 (2021).
- Marshall, A., Alam, U., Themistocleous, A., Calcutt, N., Marshall, A. Novel and emerging electrophysiological biomarkers of diabetic neuropathy and painful diabetic neuropathy. Clinical Therapeutics. 43 (9), 1441-1456 (2021).
- Themistocleous, A. C., et al. Axonal excitability does not differ between painful and painless diabetic or chemotherapy-induced distal symmetrical polyneuropathy in a multicenter observational study. Annals of Neurology. 91 (4), 506-520 (2022).
- Bostock, H., Cikurel, K., Burke, D. Threshold tracking techniques in the study of human peripheral nerve. Muscle Nerve. 21 (2), 137-158 (1998).
- Kiernan, M. C., et al. Measurement of axonal excitability: Consensus guidelines. Clinical Neurophysiology. 131 (1), 308-323 (2020).
- Sauer, S. K., et al. Can receptor potentials be detected with threshold tracking in rat cutaneous nociceptive terminals. Journal of Neurophysiology. 94 (1), 219-225 (2005).
- Vallbo, A. B. Microneurography: How it started and how it works. Journal of Neurophysiology. 120 (3), 1415-1427 (2018).
- Torebjork, H., Hallin, R. A new method for classification of C-unit activity in intact human skin nerves. Advances in Pain Research and Therapy. 1, 29-34 (1976).
- Brown, G. L., Holmes, O. The effects of activity on mammalian nerve fibres of low conduction velocity. Proceedings of the Royal Society of London. Series B: Biological Sciences. 144 (918), 1-14 (1956).
- Obreja, O., et al. Patterns of activity-dependent conduction velocity changes differentiate classes of unmyelinated mechano-insensitive afferents including cold nociceptors, in pig and in human. Pain. 148 (1), 59-69 (2010).
- Serra, J., Campero, M., Ochoa, J., Bostock, H. Activity-dependent slowing of conduction differentiates functional subtypes of C fibres innervating human skin. Journal of Physiology. 515, 799-811 (1999).
- Weidner, C., Schmidt, R., Schmelz, M., Torebjork, H. E., Handwerker, H. O. Action potential conduction in the terminal arborisation of nociceptive C-fibre afferents. Journal of Physiology. 547, 931-940 (2003).
- Siegle, J. H., et al. Open Ephys: An open-source, plugin-based platform for multichannel electrophysiology. Journal of Neural Engineering. 14 (4), 045003 (2017).
- Sanders, J. I., Kepecs, A. A low-cost programmable pulse generator for physiology and behavior. Frontiers in Neuroengineering. 7, 43 (2014).
- Zimmermann, K., et al. Phenotyping sensory nerve endings in vitro in the mouse. Nature Protocols. 4 (2), 174-196 (2009).
- Dunham, J. P., Sales, A. C., Pickering, A. E. Ultrasound-guided, open-source microneurography: Approaches to improve recordings from peripheral nerves in man. Clinical Neurophysiology. 129 (11), 2475-2481 (2018).
- Levitt, H. Transformed up-down methods in psychoacoustics. Journal of the Acoustical Society of America. 49 (2), 467 (1971).
- Turnquist, B., RichardWebster, B., Namer, B. Automated detection of latency tracks in microneurography recordings using track correlation. Journal of Neuroscience Methods. 262, 133-141 (2016).
- Kiernan, M. C., Burke, D., Andersen, K. V., Bostock, H. Multiple measures of axonal excitability: A new approach in clinical testing. Muscle Nerve. 23 (3), 399-409 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены