Method Article
Open-Source-Echtzeit-Closed-Loop-Tracking des elektrischen Schwellenwerts für die translationale Schmerzforschung
In diesem Artikel
Zusammenfassung
APTrack ist ein Software-Plugin, das für die Open Ephys-Plattform entwickelt wurde und die Echtzeit-Datenvisualisierung und das Closed-Loop-Tracking neuronaler Aktionspotentiale ermöglicht. Wir haben dies erfolgreich in der Mikroneurographie für menschliche C-Faser-Nozizeptoren und C-Faser- und Aδ-Faser-Nozizeptoren der Maus eingesetzt.
Zusammenfassung
Nozizeptoren sind eine Klasse von primären afferenten Neuronen, die potenziell schädliche schädliche Reize signalisieren. Eine Zunahme der Nozizeptorerregbarkeit tritt bei akuten und chronischen Schmerzzuständen auf. Dies führt zu abnormaler Daueraktivität oder reduzierten Aktivierungsschwellen für schädliche Reize. Die Identifizierung der Ursache für diese erhöhte Erregbarkeit ist für die Entwicklung und Validierung mechanismusbasierter Behandlungen erforderlich. Die Verfolgung des elektrischen Schwellenwerts einzelner Neuronen kann die Erregbarkeit von Nozizeptoren quantifizieren. Daher haben wir eine Anwendung entwickelt, um solche Messungen zu ermöglichen und ihre Anwendung bei Menschen und Nagetieren zu demonstrieren. APTrack bietet Echtzeit-Datenvisualisierung und Identifizierung von Aktionspotenzialen mithilfe eines zeitlichen Rasterdiagramms. Algorithmen detektieren Aktionspotentiale durch Schwellenüberschreiten und überwachen deren Latenz nach elektrischer Stimulation. Das Plugin moduliert dann die elektrische Stimulationsamplitude mit einer Auf-Ab-Methode, um die elektrische Schwelle der Nozizeptoren abzuschätzen. Die Software wurde auf dem Open Ephys-System (V0.54) aufgebaut und in C++ unter Verwendung des JUCE-Frameworks programmiert. Es läuft auf Windows-, Linux- und Mac-Betriebssystemen. Der Open-Source-Code ist verfügbar (https://github.com/
Einleitung
Nozizeptoren sind primäre afferente Neuronen im peripheren Nervensystem, die durch offensichtliche oder potenziell gewebeschädigende Ereignisse aktiviert werden und bei akuten Schmerzen eine entscheidende schützende Rolle spielen1. Elektrophysiologische Ableitungen von C-Faser- und Aδ-Faser-Nozizeptoren in Tiermodellen, gesunden Probanden und Patienten haben eine Sensibilisierung und abnorme spontane Aktivität bei einer Vielzahl von Schmerzzuständen gezeigt 2,3,4,5,6,7. Das Verständnis der Mechanismen, die diesen Veränderungen der Nozizeptor-Erregbarkeit bei Patienten zugrunde liegen, könnte gezielte therapeutische Interventionen ermöglichen8. Es gibt jedoch nur wenige Instrumente, um die Erregbarkeit von Nozizeptoren direkt zu beurteilen, insbesondere bei Patienten9, aber das Potenzial für den Nutzen solcher Instrumente ist allgemein anerkannt10,11.
Die Verfolgung des elektrischen Schwellenwerts des gesamten Nervs kann verwendet werden, um die axonale Erregbarkeit beim Menschen zu untersuchen12. Da jedoch große, myelinisierte, periphere Neurone überproportional zur Amplitude des sensorischen Aktionspotentials beitragen, erlaubt das Tracking des gesamten Nervs nicht die Beurteilung der C-Faser-Funktion11,13. In einer früheren Studie zeigte die Verfolgung des elektrischen Schwellenwerts des gesamten Nervensystems in chronischen neuropathischen Schmerzkohorten mit diabetischer Neuropathie und Chemotherapie-induzierter Polyneuropathie keine Unterschiede in der axonalen Erregbarkeit11.
In einer vorangegangenen Studie wurde die elektrische Schwellenwertverfolgung auf Einzelneuronenebene verwendet, um die Erregbarkeit von C-Faser-Nozizeptoren während der Ableitung von geneckten Fasern in einem ex vivo Haut-Nerven-Präparat der Ratte zu untersuchen14. Die Autoren zeigten, dass eine erhöhte Kaliumkonzentration, saure Bedingungen und Bradykinin die Erregbarkeit der C-Faser-Nozizeptoren erhöhten, was sich in einer reduzierten elektrischen Schwelle für die Erzeugung von Aktionspotentialen widerspiegelt. Darüber hinaus verringerte die Erwärmung des rezeptiven Feldes der wärmeempfindlichen Nozizeptoren ihre elektrische Schwelle, während wärmeunempfindliche Nozizeptoren eine Erhöhung ihrer elektrischen Schwelleaufwiesen 14. Dies ist ein wichtiger Beweis dafür, dass die Verfolgung des elektrischen Schwellenwerts einzelner Neuronen möglich ist und von Nutzen sein kann, aber es gibt derzeit keine Software- und/oder Hardwarelösungen, um solche Untersuchungen zu ermöglichen, insbesondere für Studien am Menschen.
Beim Menschen ist die Mikroneurographie die einzige verfügbare Methode, um die elektrophysiologischen Eigenschaften von C-Fasern direkt zu beurteilen15. Dieser Ansatz wurde verwendet, um eine Nozizeptor-Dysfunktion bei Patienten mit chronischen Schmerzen zu demonstrieren 2,3,4,5,6,7. Die Mikroneurographie kann Aktionspotentiale einzelner Neuronen erkennen. Aufgrund des geringen Signal-Rausch-Verhältnisses verwenden die Forscher die Markierungstechnik jedoch, um die C-Faser-Aktivität zu charakterisieren16. Bei der Markierungstechnik wird eine überschwellige elektrische Stimulation auf C-Faser-rezeptive Felder in der Haut angewendet. Diese elektrische Stimulation erzeugt ein Aktionspotential, das mit einer konstanten Latenz auftritt, die durch die Leitungsgeschwindigkeit der C-Faser bestimmt wird. C-Fasern weisen eine aktivitätsabhängige Verlangsamung auf, wodurch sich ihre Leitungsgeschwindigkeit verringert und daher ihre Leitungslatenz während der Perioden der Aktionspotentialentladung zunimmt17. Unter basalen Bedingungen erzeugen C-Fasern normalerweise keine Aktionspotentiale, wenn keine schädlichen Reize vorhanden sind, und daher ist ihre Leitungslatenz als Reaktion auf niederfrequente elektrische Stimulation konstant. Mechanische, thermische oder pharmakologische Reize, die Feuer hervorrufen, induzieren eine aktivitätsabhängige Verlangsamung, die die Latenz der Aktionspotentiale erhöht, die durch die gleichzeitige niederfrequente elektrische Stimulation hervorgerufen werden. Dies ermöglicht die objektive Identifizierung von Reaktionen auf die applizierten nicht-elektrischen Reize im Rahmen eines niedrigen Signal-Rausch-Verhältnisses. Daher kann die aktivitätsabhängige Verlangsamung zur funktionellen Charakterisierung von C-Fasernverwendet werden 16. In der Tat zeigen verschiedene funktionelle Klassen von C-Fasern unterschiedliche Muster der aktivitätsabhängigen Verlangsamung in elektrischen Stimulationsparadigmen, die eine Variation der Stimulationsfrequenz beinhalten18,19. Diese Variabilität in der Latenz von C-Faser-Aktionspotentialen stellt eine Herausforderung für Algorithmen dar, die sie überwachen sollen.
Die anhaltende Aktivität in einem Nozizeptor führt zu einer erhöhten Variabilität in seiner Latenz während der niederfrequenten elektrischen Stimulation, was wiederum auf eine aktivitätsabhängige Verlangsamung zurückzuführen ist. Diese erhöhte Variabilität oder Jitter ist ein quantifizierbares Proxy-Maß für die Erregbarkeit2. Weitere Ursachen für die Variabilität der Latenz des Aktionspotentials sind Flip-Flop, bei dem abwechselnde terminale Zweige eines einzelnen Neurons stimuliert werden, was dazu führt, dass das evozierte Aktionspotenzial zwei (oder mehr) Basislatenzen aufweist, die sich gegenseitig ausschließen20. Schließlich verursachen Änderungen der Temperatur der Endäste eines peripheren Neurons auch thermodynamische Änderungen der Latenz des Aktionspotentials, wobei die Erwärmung die Leitungsgeschwindigkeit erhöht und die Abkühlung die Leitungsgeschwindigkeit verlangsamt19. Daher muss jede Software, die eine Closed-Loop-Verfolgung des elektrischen Schwellenwerts von nozizeptiven C-Fasern durchführen will, Änderungen der Latenz in elektrisch evozierten Aktionspotentialen berücksichtigen.
Um unser Ziel der speziesübergreifenden Verfolgung des elektrischen Schwellenwerts von C-Faser-Nozizeptoren zu erreichen, haben wir APTrack entwickelt, ein Open-Source-Software-Plugin für die Open Ephys-Plattform21, das Echtzeit-Closed-Loop-Tracking von elektrischen Schwellenwerten und Latenz-Tracking ermöglicht. Wir stellen Proof-of-Concept-Daten zur Verfügung, die zeigen, dass die Verfolgung des elektrischen Schwellenwerts von C-Faser-Nozizeptoren während der humanen Mikroneurographie möglich ist. Darüber hinaus zeigen wir, dass dieses Werkzeug in der Ex-vivo-Elektrophysiologie von Nagetieren eingesetzt werden kann, was translationale Studien zwischen Menschen und Nagetieren ermöglicht. Hier werden wir im Detail beschreiben, wie Forscher dieses Werkzeug implementieren und nutzen können, um ihre Untersuchung der Nozizeptorfunktion und Erregbarkeit zu unterstützen.
Protokoll
Die humanen Mikroneurographie-Experimente wurden von der Ethikkommission der Fakultät für Lebenswissenschaften der Universität Bristol genehmigt (Referenznummer: 51882). Alle Studienteilnehmer gaben eine schriftliche Einverständniserklärung ab. Die Tierversuche wurden an der Universität Bristol in Übereinstimmung mit dem UK Animals (Scientific Procedures) Act 1986 nach Genehmigung durch das Tierschutz- und Ethikprüfungsgremium der Universität Bristol durchgeführt und waren durch eine Projektlizenz abgedeckt.
1. Installation der Open Ephys GUI und APTrack
- Überprüfen Sie die Softwaredokumentation, um die neueste Version der unterstützten grafischen Benutzeroberfläche (GUI) von Open Ephys zu finden (https://github.com/Microneurography/APTrack#readme), und laden Sie dann die GUI herunter und installieren Sie sie.
- Installieren Sie eine kompatible Version der GUI über die folgende URL: https://github.com/open-ephys/plugin-GUI/releases.
- Laden Sie die neueste Version von GitHub herunter: https://github.com/Microneurography/APTrack/releases. Kopieren Sie bei einem Windows-Computer die .dll Datei in den Ordner plugins, der sich normalerweise unter C:\Programme\Open Ephys\plugins befindet. Kopieren Sie bei einem MacOS-Computer die .bundle-Datei in den Ordner Contents/PlugIns des Pakets.
2. Montage des Aufzeichnungs- und Stimulationsgerätes
- Schließen Sie die Erfassungskarte mit dem vom Hersteller mitgelieferten Kabel an den Computer an und schalten Sie sie ein.
HINWEIS: Für die menschliche Mikroneurographie wurde ein USB 3.0-Isolator verwendet, um den Teilnehmer elektrisch vom Computer zu isolieren, und die Erfassungsplatine wurde von einer tragbaren Batterie mit Strom versorgt, im Gegensatz zu der Netzspannung, die für Nagetierstudien verwendet wird. Alle USB-Anschlüsse, mit Ausnahme der Schrittmotor-Steuerplatine, wurden während der Studien am Menschen durch den USB-Isolator geführt. - Verbinden Sie die I/O-Karte mit dem analogen Eingang der Erfassungskarte. Schließen Sie einen Intan RHD-Aufnahme-Headstage über ein SPI-Kabel (Serial-Peripheral Interface) an die Erfassungsplatine an.
HINWEIS: Hier wurde der bipolare 16-Kanal-Headstage Intan verwendet, es können jedoch auch andere monopolare Headstage der RHD2000-Serie verwendet werden. - Schließen Sie den PulsePal an den Computer22 an. Für die Montage mit einem analogen spannungsgesteuerten Stimulator (z. B. einem DS4) unter Verwendung eines PulsePal, wie bei den mit der Maus gehänselten Faseraufnahmen, führen Sie die Schritte 2.5.1-2.5.3 aus. Für die Montage mit einem Drehgeber-basierten Stimulator (z. B. einem DS7) unter Verwendung eines Schrittmotors, wie bei den Aufnahmen der menschlichen Mikroneurographie, befolgen Sie die Schritte 2.6.1-2.6.8 (Abbildung 1).
- Erstellen Sie die Signalkette in der GUI wie unten beschrieben.
- Fügen Sie das Rhythm FPGA-Plugin in die Signalkette ein, indem Sie es mit der linken Maustaste klicken und in die Signalkette ziehen. Dadurch wird die GUI mit dem Erfassungsboard verbunden. Stellen Sie sicher, dass auf die ADC-Taste geklickt wurde, um die Aufnahme der ADC-Kanäle von der I/O-Karte zu starten. Die ADC-Taste leuchtet orange, wenn sie eingeschaltet ist.
HINWEIS: Wenn Sie zuvor aufgenommene experimentelle Daten wiedergeben möchten, kann das File Reader-Plugin zu Beginn anstelle von Rhythm FPGA verwendet werden. Die Verwendung in Kombination mit APTrack ermöglicht die Visualisierung und Latenzverfolgung der Aktionspotentiale in früheren Experimenten. - Fügen Sie einen Bandpassfilter in die Signalkette ein. Die Standardeinstellungen von 300-6.000 Hz eignen sich sowohl für menschliche als auch für Mausaufnahmen. Fügen Sie zusätzlich einen Splitter danach ein.
- Fügen Sie das APTrack-Plugin auf der einen Seite des Splitters und den LFP-Viewer auf der anderen Seite in die Signalkette ein. LFP Viewer bietet eine herkömmliche oszilloskopähnliche Spannungsverfolgungsansicht, die bei Experimenten nützlich ist.
- Fügen Sie nach dem Plugin einen Datensatzknoten ein. Ändern Sie im Dropdown-Menü das Datenspeicherformat von binär in Open Ephys. Damit ist eine einfache Signalkette abgeschlossen, die gut funktioniert (Abbildung 2); Es können jedoch je nach experimentellen Anforderungen zusätzliche Komponenten hinzugefügt werden.
HINWEIS: Wenn der Datensatzknoten in der Signalkette vor dem Plugin platziert wird, werden die Informationen zum Aktionspotenzial-Tracking nicht gespeichert. - Klicken Sie oben rechts in der GUI auf die Wiedergabetaste, um mit der Übertragung von Daten von der Erfassungsplatine und deren Visualisierung zu beginnen. Um die Aufnahme zu starten, klicken Sie auf die kreisförmige Aufnahmeschaltfläche neben der Wiedergabetaste.
HINWEIS: Es ist leicht zu vergessen, auf Aufnahme zu klicken; Wir zeichnen Daten von dem Moment an auf, in dem wir mit der Erfassung beginnen, um dies zu verhindern.
- Fügen Sie das Rhythm FPGA-Plugin in die Signalkette ein, indem Sie es mit der linken Maustaste klicken und in die Signalkette ziehen. Dadurch wird die GUI mit dem Erfassungsboard verbunden. Stellen Sie sicher, dass auf die ADC-Taste geklickt wurde, um die Aufnahme der ADC-Kanäle von der I/O-Karte zu starten. Die ADC-Taste leuchtet orange, wenn sie eingeschaltet ist.
- Für die Montage mit einem analogen spannungsgesteuerten Stimulator befolgen Sie die unten beschriebenen Schritte.
- Schalten Sie einen Konstantstromstimulator ein, dessen Stimulationsamplitude über einen analogen Spannungseingang gesteuert wird. In diesem Fall kam ein DS4 zum Einsatz (Abbildung 1).
- Der PulsePal-Ausgangskanal 1 ist für den analogen Spannungsbefehl vorgesehen. Teilen Sie dieses Signal mit einem BNC-T-Splitter auf und verbinden Sie es dann mit dem Eingang des Konstantstromstimulators und der I/O-Karte, so dass die Befehlsspannung aufgezeichnet wird.
- Der PulsePal-Ausgangskanal 2 ist für den TTL-Ereignismarker der elektrischen Stimulation vorgesehen. Verbinden Sie diese mit der I/O-Platine, damit die TTL-Ereignismarker der Stimulation für die Verwendung durch das Plugin und für die Post-hoc-Analyse aufgezeichnet werden.
- Für die Montage mit einem analogen spannungsgesteuerten Stimulator befolgen Sie die unten beschriebenen Schritte.
- Schalten Sie einen Konstantstromstimulator ein, dessen Stimulationsamplitude über einen Drehregler gesteuert wird. In diesem Fall kam ein DS7 zum Einsatz (Abbildung 1).
- Verbinden Sie die Schrittmotor-Steuerplatine mit dem vom Hersteller gelieferten Kabel und der Magnethalterung mit dem Schrittmotor.
- Schließen Sie die Steuerplatine mit einem beliebigen Standard-USB-A-auf-USB-Micro-B-Kabel direkt an den Computer an. Schließen Sie die Steuerplatine nicht auf der Teilnehmerseite des USB-Isolators an, da diese ebenfalls an eine 12-V-Netzspannung angeschlossen ist.
- Wenn Sie die Steuerplatine zum ersten Mal verwenden, laden Sie das Schrittmotorskript von GitHub auf die Steuerplatine hoch. Dies muss nur einmal durchgeführt werden, oder wenn Software-Updates für das Schrittmotorskript veröffentlicht werden.
- Stellen Sie den Regler für die Stimulationsamplitude am Konstantstromstimulator auf 0 mA. Verwenden Sie eine benutzerdefinierte Montagehalterung, um den Schrittmotor und den Stimulationsamplitudenregler zu verbinden. Diese können 3D-gedruckt werden, was kostengünstige, schnelle und anpassbare Montagelösungen ermöglicht. Konsultieren Sie GitHub, um zu sehen, ob bereits eine Halterung für den Stimulator Ihrer Wahl entwickelt wurde.
- Verwenden Sie einen benutzerdefinierten Zylinderadapter, um den Schrittmotorzylinder mit dem Regler für die Stimulationsamplitude zu verbinden. Diese Adapter sollten aus Gründen der Festigkeit und Haltbarkeit aus Metall gefertigt werden. aber auch 3D-gedruckte Teile wären geeignet, auch wenn sie ggf. regelmäßig ausgetauscht werden müssen. Konsultieren Sie GitHub, um zu sehen, ob bereits ein Laufadapter für den Stimulator Ihrer Wahl entwickelt wurde.
- Befestigen Sie die Steuerplatine/das Schrittmotorgerät mit einer benutzerdefinierten Halterung und einem Zylinderadapter lose am Stimulator-Steuerrad.
Anmerkungen: Die Halterung und der Laufadapter werden später festgezogen, sobald die Software gestartet wurde und der Schrittmotor automatisch auf Position Null gesetzt wird. - Schließen Sie den PulsePal wie in den Protokollschritten 2.5.2-2.5.3 beschrieben an (abzüglich der Verbindung von Ausgangskanal 1 mit einem Stimulator), da das Erzeugen von TTL-Ereignismarkern für die Analyse und die Funktion des Plugins weiterhin erforderlich ist. Schließen Sie außerdem den Ausgangskanal 2 an den DS7-Stimulator an, um ihn auszulösen.
- Bereiten Sie das Haut-Nerven-Präparat der Maus wie unten beschrieben vor.
- C57BL/6J-Mäuse (Charles River Laboratories, UK, in dieser Studie) im Alter von 2-4 Monaten und beiderlei Geschlechts ad libitum mit Futter und Wasser versorgen.
- Nach der Tötung durch eine Überdosierung des Anästhetikums durch eine intraperitoneale Injektion von Natrium-Pentobarbital (≥200 mg/kg) und der Bestätigung der Einstellung der Durchblutung wird die Haut von der dorsalen Seite der Hinterpfote der Maus und dem Nervus saphenus, der diesen Bereich innerviert, mit den von Zimmermann et al.23 beschriebenen Methoden präpariert.
- Die Haut-Nerven-Präparation wird in karbogenierter synthetischer interstitieller Flüssigkeit (Tabelle 1) bei 30-32 °C in einer Hälfte eines speziell angefertigten Zweikammer-Acrylbades (15 ml/min Perfusionsrate, 30 ml Volumen) aufbewahrt. Fädeln Sie den Nerv durch ein kleines Loch in die mit Mineralöl gefüllte Kammer und verschließen Sie ihn mit Vaseline. Das Öl bietet eine isolierte Aufnahmeumgebung.
- Ziehen Sie zwei feine Filamente mit einer superfeinen Pinzette aus dem Rumpf des Nervs heraus und hängen Sie eines auf jede Seite einer bipolaren Silber/Silberchlorid-Aufzeichnungselektrode.
- Digitalisieren und verstärken Sie das neuronale Signal mit einem 16-Kanal-Bipolar-Headstage RHD2216 und verarbeiten Sie es mit der Erfassungsplatine. Tasten Sie das Signal bei 30 kHz mit einem Bandpassfilter von 300-6.000 Hz ab und visualisieren Sie es über die GUI.
- Streichen Sie mit einem stumpfen Glasstab über die Haut des Präparats. Verwenden Sie die Massenaktivität mit niedriger Amplitude, um zu bestätigen, dass das Präparat lebendig ist.
- Führen Sie eine menschliche C-Faser-Mikroneurographie wie unten beschrieben durch.
- Führen Sie eine Mikroneurographie mit Teilnehmern durch, die eine schriftliche Einwilligungserklärung abgegeben haben, wie zuvor beschrieben24.
- Wenn der Teilnehmer bequem auf einem Bett sitzt und mit Kissen gestützt ist, identifizieren Sie den oberflächlichen Nervus peroneus mit einem Ultraschallgerät und markieren Sie einen Zielbereich etwa 5-10 cm proximal des lateralen Knöchels, etwa auf Höhe des mittleren Schienbeins.
- Sterilisieren Sie die Haut um den Zielbereich herum mit einem Tuch mit 2 % Chlorhexidin in 70 % Alkohol und führen Sie eine sterile Referenzelektrode subkutan in der Nähe der vorgesehenen Aufnahmestelle in der Mitte des Schienbeins ein.
- Führen Sie eine sterile Aufzeichnungselektrode unter Ultraschallkontrolle innerhalb des Zielbereichs in den oberflächlichen Nervus peroneus ein.
- Digitalisieren und verstärken Sie das neuronale Signal mit einem 16-Kanal-Bipolar-Headstage RHD2216 und verarbeiten Sie es mit der Erfassungsplatine. Tasten Sie das Signal bei 30 kHz mit einem Bandpassfilter von 300-6.000 Hz ab und visualisieren Sie es über die GUI.
HINWEIS: Das Erfassungsgerät wurde durch einen USB 3.0-Isolator mit 5 kV RMS-Isolierung elektrisch vom Laptop getrennt und über ein speziell angefertigtes 12-V-Batterienetzteil mit Strom versorgt. - Bestätigen Sie die erfolgreiche intraneurale Positionierung, indem Sie sanft über die Haut streichen, um die mechanisch hervorgerufene Massenaktivität zu enthüllen. Darüber hinaus berichten die Teilnehmer in der Regel über Parästhesien im dorsolateralen Teil des Fußes nach erfolgreicher intraneuraler Positionierung.
3. Software-Setup und Identifizierung und Phänotypisierung peripherer Neuronen
- Richten Sie die Software wie unten beschrieben ein.
- Öffnen Sie die GUI (Abbildung 3). Wenn die Schrittmotor-Steuerplatine an Ihren PC angeschlossen ist, wird sie erkannt und auf Position Null gesetzt. Ziehen Sie die in den Schritten 2.6.5 bis 2.6.7 beschriebene kundenspezifische Halterung und den Zylinderadapter fest, da sowohl der Stimulationsamplitudenregler als auch der Schrittmotor des Stimulators auf Null eingestellt sind.
Anmerkungen: Wenn der Schrittmotor und der Stimulationsamplitudenregler nicht beide auf "Null" gesetzt sind, kann dies dazu führen, dass der Schrittmotor versucht, den Drehregler außerhalb seines Bereichs zu drehen, was zu Schäden führen kann. - Wählen Sie im Optionsmenü den Triggerkanal aus. Wählen Sie den ADC-Kanal , der den TTL-Marker für die elektrische Stimulation enthält, aus dem PulsePal-Ausgangskanal 2 aus.
- Wählen Sie im Optionsmenü den Datenkanal aus, und wählen Sie den Kanal aus, der die elektrophysiologischen Daten enthält.
- Definieren Sie in der Stimulationssteuerung mit dem Schieberegler die anfänglichen, minimalen und maximalen Stimulationsamplituden. Stellen Sie sicher, dass die aktuelle Stimulation über 0 eingestellt ist, damit TTL-Marker generiert werden.
HINWEIS: Einige Stimulatoren haben ein Input-to-Output-Skalierungsverhältnis, das nicht 1:1 beträgt. Berücksichtigen Sie dies bei der Auswahl einer geeigneten Stimulationsamplitude. Beispielsweise kann bei einigen Stimulationssystemen ein Ausgangsverhältnis von 1:10 gewählt werden, um eine höhere Leistung des Konstantstromstimulators zu erzielen. - Klicken Sie in der Stimulationssteuerung auf F, um eine Datei mit den Stimulationsanweisungen zu laden. Elektrische Stimulationsprotokolle werden als CSV-Dateien (Comma-Separated Value) gespeichert, die sich aus den gewünschten Stimulationsfrequenzen und -dauer zusammensetzen, sodass Benutzer komplexe Stimulationsparadigmen für ihre Experimente erstellen können. Eine Beispielvorlage finden Sie hier: https://github.com/Microneurography/APTrack/blob/main/example_playlist.csv
- Klicken Sie in der Stimulationssteuerung auf >, um das Paradigma der geladenen Stimulation zu starten. Standardmäßig fordert APTrack den PulsePal auf, positive Rechteckwellenimpulse mit einer Dauer von 0,5 ms und unterschiedlichen Amplituden zu erzeugen, um die Stimulationsamplitude des Konstantstromstimulators zu steuern.
- Das zeitliche Raster-Diagramm wird mit der Reaktion auf die elektrische Stimulation aktualisiert, wobei jede neue Stimulationsantwort als neue Spalte auf der rechten Seite angezeigt wird.
- Öffnen Sie die GUI (Abbildung 3). Wenn die Schrittmotor-Steuerplatine an Ihren PC angeschlossen ist, wird sie erkannt und auf Position Null gesetzt. Ziehen Sie die in den Schritten 2.6.5 bis 2.6.7 beschriebene kundenspezifische Halterung und den Zylinderadapter fest, da sowohl der Stimulationsamplitudenregler als auch der Schrittmotor des Stimulators auf Null eingestellt sind.
- Visualisieren und identifizieren Sie Aktionspotentiale einzelner Neuronen.
- Für die erfolgreiche Detektion von Einzelneuronen-Aktionspotentialen ist es wichtig, geeignete Bildschwellen eingestellt zu haben. Passen Sie in der Zeit-Raster-Plotgruppe die Bildschwellenwerte "Niedrig", "Erkennung" und "Hoch" an.
- Wählen Sie im Optionsmenü ein Farbschema aus. Im WHOT-Modus (White Hot) (Standard) werden Spannungen unterhalb der niedrigen Bildschwelle schwarz kodiert. Spannungen zwischen der niedrigen Bild- und der Erkennungsschwelle werden in Graustufen kodiert. Spannungen oberhalb der Erkennungsschwelle werden grün und Spannungen oberhalb der hohen Bildschwelle rot kodiert.
- Periphere Neuronen zeigen konstante Latenzantworten bei niedrigen Stimulationsfrequenzen (<0,25 Hz), und diese Antworten werden durch ihre Leitungsgeschwindigkeit und den Abstand zwischen den Stimulations- und Aufzeichnungsstellen bestimmt. Wenn geeignete Bildschwellenwerte festgelegt sind, werden die von den Algorithmen erkannten Schwellenüberschreitungsereignisse grün kodiert (Abbildung 4).
- Bewegen Sie die Stimulationselektrode systematisch um den Hautbereich, der von dem aufgezeichneten Nerv innerviert wird, wobei mindestens drei Stimulationsereignisse an jeder Stelle möglich sind. Überwachen Sie das zeitliche Raster-Diagramm auf Schwellenwertüberschreitungsereignisse (grün markiert), die zum gleichen Zeitpunkt nach jedem elektrischen Stimulationsereignis auftreten.
HINWEIS: Bei Mäusen wurde ein Suchstimulus von 5 mA verwendet. Beim Menschen wurde die Amplitude des transkutanen elektrischen Suchreizes auf eine verbale Schmerzbewertung titriert, so dass sie nie 7/10 überstieg. - Prüfen Sie, ob drei Schwellenwertüberschreitungsereignisse (grüne Balken) hintereinander mit derselben Latenz und in derselben Stimulationsposition auftreten. Dies deutet auf die Identifizierung eines peripheren Neuronenaktionspotentials hin.
- Optimieren Sie die Position der stimulierenden Elektrode, indem Sie den elektrisch empfindlichsten Punkt des rezeptiven Feldes des Zielneurons identifizieren, und fixieren Sie dann die Elektrode in Position. Wechseln Sie an dieser Stelle in der menschlichen Mikroneurographie zur Verwendung von intradermalen Elektroakupunkturnadeln (0,2 mm Durchmesser) für die bipolare elektrische Stimulation, bei Mäusen wird eine spezielle transkutane Stimulationssonde verwendet, damit die Stimulationsposition konstant ist.
- Für die erfolgreiche Detektion von Einzelneuronen-Aktionspotentialen ist es wichtig, geeignete Bildschwellen eingestellt zu haben. Passen Sie in der Zeit-Raster-Plotgruppe die Bildschwellenwerte "Niedrig", "Erkennung" und "Hoch" an.
- Führen Sie eine Klassifizierung und sensorische Phänotypisierung der peripheren Neuronen durch.
- Schätzen Sie den elektrischen Schwellenwert des Zielaktionspotentials, indem Sie die Simulationsamplitude manuell anpassen oder bei Bedarf APTrack verwenden (beschrieben in den Schritten 4.1-4.2).
- Stimulieren Sie das rezeptive Feld mit dem 2-fachen der geschätzten elektrischen Schwelle bei einer Frequenz von 0,25 Hz während des gesamten sensorischen Phänotypisierungsprotokolls.
- Berechnen Sie die Leitungsgeschwindigkeit des Neurons, indem Sie die Leitungsdistanz durch die Leitungslatenz dividieren. C-Fasern können durch eine Leitungsgeschwindigkeit von ≤2 m/s identifiziert werden.
- Mechanische Stimulation des rezeptiven Feldes unter Verwendung von Frey-Filamenten, um die mechanische Schwelle für die Aktivierung zu bestimmen. Mechanosensibilität kann durch evozierte Aktionspotentiale identifiziert werden, die auf der Spannungskurve sichtbar sind, und durch eine Erhöhung der Latenz des Neurons, wenn es sich um eine C-Faser handelt, bei ausreichender Kraft.
- Erhitzen Sie das rezeptive Feld des Neurons und achten Sie erneut auf Aktionspotentiale, die auf der Spannungskurve sichtbar sind, und auf eine Erhöhung der Latenz des Neurons, wenn es sich um eine C-Faser handelt, bei ausreichender Wärmeanwendung. Wärmeunempfindliche Neuronen weisen aufgrund des thermodynamischen Effekts auf die axonale Ausbreitung eine Verringerung der Latenz auf.
Anmerkungen: Verwenden Sie in der menschlichen Mikroneurographie ein TSC-II für eine schnelle und genaue Temperaturkontrolle. Geben Sie bei der Mauspräparation erwärmte oder abgekühlte synthetische interstitielle Flüssigkeit in eine Aluminium-Isolationskammer, die über dem rezeptiven Feld platziert ist, um den Zugang zu den Neuronenendigungen zu ermöglichen und gleichzeitig die schnelle Wärmeableitung in die umgebende Flüssigkeit zu begrenzen. Erfassen Sie die Temperatur mit einem Thermoelement. - Kühlen Sie das rezeptive Feld ab und achten Sie erneut auf Aktionspotentiale, die auf der Spannungskurve sichtbar sind, und auf eine deutliche Erhöhung der Latenz des Neurons, wenn es sich um eine C-Faser handelt, bei ausreichender Kälteanwendung. Alle Neuronen weisen aufgrund des thermodynamischen Effekts auf die axonale Ausbreitung eine Erhöhung der Latenz auf, daher seien Sie vorsichtig, wenn Sie Neuronen allein aufgrund einer Latenzerhöhung als kälteempfindlich bezeichnen.
4. Latenz und elektrische Schwellenwertverfolgung
- Führen Sie die Latenzverfolgung wie unten beschrieben durch.
- Verschieben Sie nach der Identifizierung der Aktionspotentiale einzelner Neuronen im zeitlichen Raster-Diagramm den grauen linearen Schieberegler auf der rechten Seite des zeitlichen Raster-Diagramms, um die Position des Suchfelds anzupassen.
- Passen Sie unterhalb des zeitlichen Rasterdiagramms den Drehregler für die Breite des Suchfelds auf eine entsprechende Breite an. Verringern Sie die Breite des Suchfelds, um die Wahrscheinlichkeit zu verringern, dass vorübergehende Rauschspitzen, spontan auslösende Aktionspotentiale oder andere Aktionspotentiale mit konstanter Latenz in der Nähe fälschlicherweise als das gewünschte Aktionspotenzial identifiziert werden.
- Um mit der Verfolgung des angestrebten Aktionspotenzials zu beginnen, klicken Sie auf das + unter der Multi-Unit-Tracking-Tabelle. Der Tabelle wird eine neue Zeile hinzugefügt, die Details zum Zielaktionspotenzial enthält, einschließlich der Latenzposition, des Prozentsatzes, der über 2-10 Stimuli ausgelöst wird (angepasst im Optionsmenü) und der erkannten Spitzenamplitude.
- Sobald ein Aktionspotential zur Multi-Unit-Tracking-Tabelle hinzugefügt wird, wird der Latenz-Tracking-Algorithmus (Abbildung 5) bei jeder nachfolgenden elektrischen Stimulation automatisch darauf ausgeführt.
- Wenn im zeitlichen Raster-Diagramm mehrere diskrete Aktionspotenziale sichtbar sind, fügen Sie sie der Tracking-Tabelle mit mehreren Einheiten wie oben beschrieben hinzu. Die theoretische maximale Anzahl von Aktionspotentialen, die der Tabelle für die simultane Latenzverfolgung hinzugefügt werden können, ist der maximale 32-Bit-Integer-Wert.
- Aktivieren Sie das Kontrollkästchen "Spitze verfolgen " in der Tracking-Tabelle mit mehreren Einheiten, um das Suchfeld an die entsprechende Position für das jeweilige Aktionspotenzial zu verschieben, wie vom Latenzverfolgungsalgorithmus bestimmt. Dies ermöglicht die Überwachung des Latenz-Trackings in Echtzeit und stellt sicher, dass das Tracking dem Aktionspotenzial wie erwartet folgt. Die Latenzverfolgung anderer Spitzen wird wie gewohnt im Hintergrund fortgesetzt.
- Entfernen Sie verfolgte Aktionspotenziale aus der Multi-Unit-Tracking-Tabelle, indem Sie auf die Schaltfläche "Löschen" am Ende jeder Zeile klicken.
- Führen Sie die Verfolgung des elektrischen Schwellenwerts wie unten beschrieben durch.
- Stellen Sie die Inkrement- und Dekrementraten im Stimulationsbedienfeld zwischen 0,1 V und 0,5 V ein. Halten Sie diese Werte gleich und passen Sie sie während des Experiments nicht an, es sei denn, dies ist Teil des experimentellen Paradigmas.
- Stellen Sie sicher, dass die Stimulationsfrequenz auf eine geeignete Rate eingestellt ist, in der Regel 0,25-0,5 Hz, es sei denn, die Modulation der Stimulationsfrequenz ist Teil des experimentellen Paradigmas. Eine Erhöhung der Nozizeptor-Feuerraten kann die elektrische Schwelle des Nozizeptors verändern.
- Sobald ein Aktionspotenzial erfolgreich verfolgt wurde, aktivieren Sie das Kontrollkästchen Track-Schwellenwert in der Multi-Unit-Tracking-Tabelle, wodurch der Algorithmus zur Verfolgung des elektrischen Schwellenwerts initiiert wird (Abbildung 6).
HINWEIS: Die Verfolgung des elektrischen Schwellenwerts wird nur für das angestrebte Aktionspotenzial ausgeführt. In der Tat werden die Feuerraten anderer Aktionspotentiale in der Multi-Unit-Tracking-Tabelle entsprechend aktualisiert, wenn sich die Stimulationsamplitude ändert. - Passen Sie die Stimulationsamplitude manuell an die Schätzung des elektrischen Schwellenwerts an. Dadurch verkürzt sich die Wartezeit auf die Bestimmung des elektrischen Schwellenwerts. Die Zeit, die benötigt wird, um einen zuverlässigen elektrischen Schwellenwert zu etablieren, hängt von der Stimulationsfrequenz, den Inkrement- und Dekrementraten und der Differenz der Stimulationsamplitude von der anfänglichen Stimulation bis zur elektrischen Schwelle des Neurons ab.
- Die Software verwendet ein Up-Down-Verfahren zur Schätzung der elektrischen Schwelle der Neuronen. In der Multi-Unit-Tracking-Tabelle wird die Feuerrate über 2-10 vorherige Stimulationen (im Optionsmenü ausgewählt) bestimmt. Wählen Sie die Anzahl der zu berücksichtigenden Stimulationsereignisse aus. Eine höhere Zahl erhöht die Zuverlässigkeit der Schwellenwertschätzung, es dauert jedoch länger, bis sie erreicht ist.
- Während der menschlichen Mikroneurographie ist es wichtig, die Schmerzhaftigkeit elektrischer Reize zu überwachen, um übermäßige Beschwerden der Teilnehmer zu vermeiden. einige Beschwerden sind während der Untersuchung von Nozizeptoren, insbesondere von stillen/schlafenden C-Fasern, unvermeidlich. Fragen Sie regelmäßig nach Schmerzwerten, während die Stimulationsamplitude während der Verfolgung des elektrischen Schwellenwerts zunimmt, und bleiben Sie in der Nähe des Konstantstromstimulators, um ihn auf Wunsch des Teilnehmers zu deaktivieren.
HINWEIS: Alternativ kann die elektrische Stimulation über die Benutzeroberfläche durch Klicken auf die Schaltfläche [ ] im Stimulationsbedienfeld deaktiviert werden. - Eine Feuerrate von 50 % zeigt an, dass der ungefähre elektrische Schwellenwert bestimmt wurde.
- Wenden Sie bei der Verfolgung des elektrischen Schwellenwerts eine experimentelle Manipulation des rezeptiven Feldes an, z. B. Temperatur- oder Medikamentenmanipulationen. Die Auswirkungen dieser Manipulationen auf die elektrische Schwelle des Nozizeptors werden verfolgt.
HINWEIS: Planen Sie genügend Zeit ein, um nach der experimentellen Manipulation eine neue Nozizeptorschwelle zu identifizieren.
Ergebnisse
Ein repräsentatives Beispiel für die Software, die zur Steuerung eines Experiments arbeitet, ist in Abbildung 7 dargestellt. Es passt die Stimulationsamplitude iterativ mit einer Auf-Ab-Methode an, um die elektrische Schwelle einzelner Nozizeptoren effektiv zu finden. Zum ersten Mal demonstrieren wir die Machbarkeit der Echtzeit-Verfolgung des elektrischen Schwellenwerts einzelner Neuronen beim Menschen während der Mikroneurographie (Abbildung 7A). Zusätzlich zeigen wir die Verfolgung des elektrischen Schwellenwerts in einer Aδ-Faser der Maus (Abbildung 7B). Die Identifizierung von Aktionspotentialen durch Schwellenüberschreitung, wie sie hier verwendet wird, reicht aus, um elektrische Schwellenwerte über die Zeit zu verfolgen. Wir empfehlen Benutzern, Maßnahmen zu ergreifen, um das elektrische Rauschen während ihrer Aufnahmen zu minimieren, z. B. durch die Verwendung eines Faradayschen Käfigs und Bandpassfilter, um das Signal-Rausch-Verhältnis zu verbessern.
Um zu zeigen, dass die Verfolgung des elektrischen Schwellenwerts als Maß für Veränderungen der Erregbarkeit des Nozizeptors beim Menschen verwendet werden kann, wurde die Verfolgung des elektrischen Schwellenwerts während eines abgestuften Heizparadigmas durchgeführt (Abbildung 8). Die Erhöhung der Temperatur der Nozizeptorterminals verringerte den elektrischen Stimulationsstrom, der erforderlich ist, um ein Aktionspotential auszulösen, was eine Erhöhung der Erregbarkeit der Nozizeptoren widerspiegelt (Abbildung 8C). Dies wurde wahrscheinlich durch die Erzeugung von Rezeptorpotentialen durch die wärmeempfindlichen Ionenkanäle verursacht, die im C-Faser-Nozizeptor14 exprimiert werden. Bei der höchsten Temperaturstufe, 44 °C, wurden thermisch evozierte Aktionspotentiale hervorgerufen (Abbildung 8A, Stimuluszahl 86-96). Dies führt zu einer Erhöhung der elektrischen Schwelle, da sich der Nozizeptor nach einer hochfrequenten Entladung in einem refraktären Zustand befinden kann. Erwartungsgemäß nahm die Latenz des verfolgten Aktionspotentials mit steigender Temperatur ab. Es wird angenommen, dass dies auf einen thermodynamischen Effekt auf die Leitungsmaschinerie zurückzuführen ist, der die Leitungsgeschwindigkeit der C-Faser erhöht. Diese C-Faser kann auch ein Flip-Flop aufweisen (Abbildung 8B, Stimulusnummer 47-54), was dazu führen kann, dass die folgende elektrische Stimulation fälschlicherweise in der Amplitude erhöht wird, wenn das Aktionspotential außerhalb des Suchfensters des Algorithmus liegt.
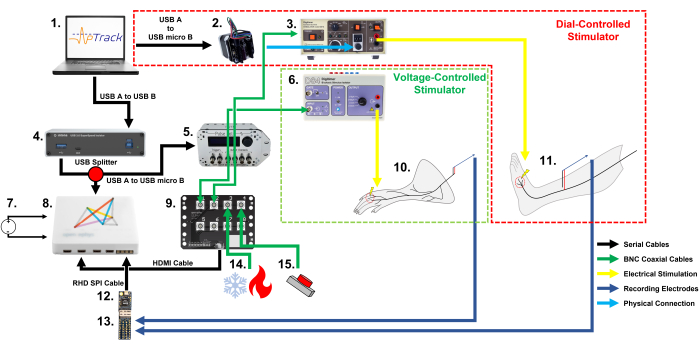
Abbildung 1: Schematische Darstellung des Geräteaufbaus und der Kabelverbindungen, die für die Verfolgung des elektrischen Schwellenwerts des Nozizeptors mit APTrack bei Nagetieren und Menschen erforderlich sind. Beachten Sie die zwei verschiedenen Methoden zur Steuerung der Stimulationsamplitude: einen Schrittmotor für manuell eingestellte Stimulatoren in unserem menschlichen Setup und einen PulsePal für eingangsspannungsgesteuerte Stimulatoren in unserem Nagetier-Setup. (1) Ein PC (Windows, Mac oder Linux), auf dem das Plugin für die Open Ephys-Plattform ausgeführt wird. (2) Ein Schrittmotor, der den Stimulationsamplitudenregler des DS7 betätigt. (3) Ein Konstantstromstimulator, der für die Anwendung beim Menschen zugelassen ist; hier haben wir einen DS7 verwendet. (4) Ein USB 3.0-Optoisolator, der den menschlichen Teilnehmer vom PC isoliert (optional, nur für die Forschung am Menschen erforderlich). (5) Ein PulsePal V2 Impulsgenerator, der TTL-Zeitstempel (Ausgangskanal 2) und Spannungsschritte erzeugt, die der angeforderten Stimulationsamplitude (Ausgangskanal 1) entsprechen. (6) Konstantstromstimulator zur Anwendung bei Tieren; hier haben wir einen DS4 verwendet. (7) Ein DC-Netzteil für das System (DC-Netzteil für das Nagetier-Setup und Batterie-DC-Netzteil für das menschliche Setup). (8) Ein Akquisitionsausschuss. (9) Eine I/O-Karte zum Anschließen der BNC-Koaxialkabel, die die aufzuzeichnenden Signale übertragen, wie z. B. die Thermoelementausgänge und TTL-Marker. (10) Das Haut-Nerven-Präparat der Maus erfährt elektrophysiologische Nozizeptor-Ableitungen. (11) Ein menschlicher Teilnehmer, der sich einer mikroneurographischen Aufzeichnung von C-Fasern im oberflächlichen Nervus peroneus unterzieht. (12) Ein Intan RHD2216 Headstage für die Erfassung und Digitalisierung der Aufnahmen. (13) Eine Intan-Elektroden-Adapterplatine, an die die Aufnahmeelektroden angeschlossen sind und die es ermöglicht, das Signal an die RHD2216-Kopfstufe weiterzuleiten. (14) Ein Wärmestimulationssystem, das die Temperatur über eine BNC-Koaxialverbindung ausgeben kann. (15) Ein batteriebetriebenes 3,3-V-Tasten-/Fußpedal, das zur Kennzeichnung der mechanischen Stimulationsereignisse und Arzneimittelanwendungen verwendet wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
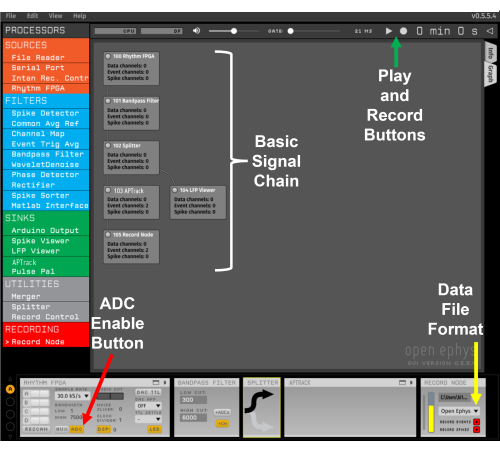
Abbildung 2: Template-Signalkette. Der rote Pfeil zeigt auf die Schaltfläche zum Aktivieren des ADC-Eingangs von der I/O-Karte. Der gelbe Pfeil zeigt das Dropdown-Menü zur Auswahl des Open Ephys-Dateiformats an. Der grüne Pfeil zeigt die Tasten "Wiedergabe" und "Aufnahme" an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
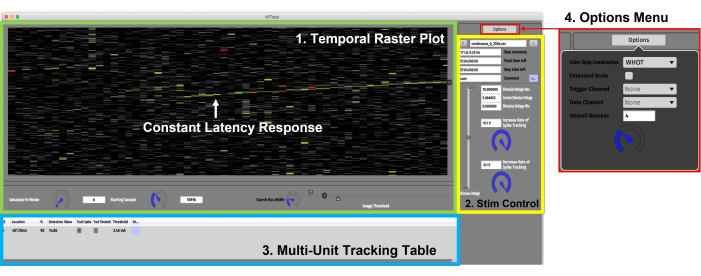
Abbildung 3: Grafische Benutzeroberfläche. Die GUI besteht aus vier Hauptkomponenten. (1) Zeitlicher Raster-Plot-Bereich (grün) für die Datenvisualisierung und die Einstellungen, die mit der Steuerung des Diagramms verbunden sind. Eine konstante Latenzantwort, die eine allmähliche aktivitätsabhängige Verlangsamung anzeigt, wird durch den grünen Pfeil angezeigt. (2) Stimulations-Bedienfeld (gelb) zum Einstellen der Stimulationsamplitudenparameter und zum Laden der Stimulationsparadigma-Skripte. (3) Multi-Unit Tracking Table (blau) zum Addieren der Aktionspotentiale für das Tracking und Aktivieren des Latenz- und elektrischen Schwellenwert-Trackings. (4) Optionsmenü zur Auswahl der Farbstile und des Eingangskanals für die Daten- und TTL-Trigger. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
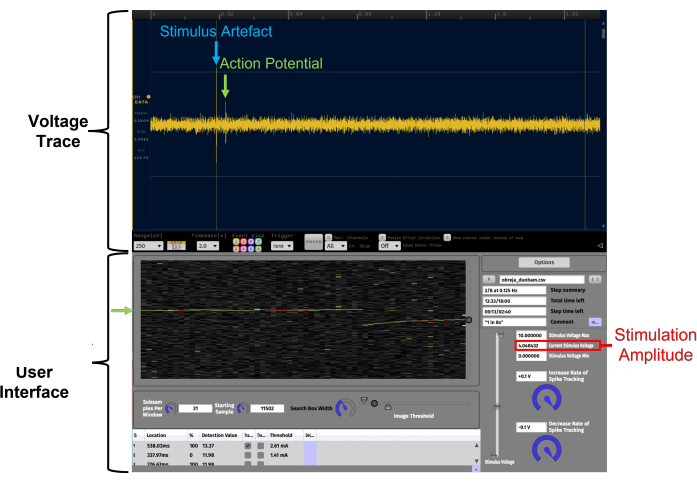
Abbildung 4: Erleichterung der Identifizierung von Aktionspotentialen mit konstanter Latenz durch Echtzeit-Datenvisualisierung auf einem zeitlichen Rasterplot mit APTrack. Dies ist ein Beispiel für ein hohes Signal-Rausch-Verhältnis. Die im zeitlichen Rasterdiagramm dargestellten Daten stammen aus einer menschlichen C-Faser-Aufzeichnung des oberflächlichen Nervus peroneus während der Mikroneurographie. Voltage Trace ist das oszilloskopartige LFP-Viewer-Plugin in Open Ephys. Die APTrack-Benutzeroberfläche ist die grafische Benutzeroberfläche des Plugins. Das verfolgte Aktionspotenzial wird durch grüne Pfeile angezeigt, und der kreisförmige Schieberegler am Rand des zeitlichen Rasterdiagramms dient zur Steuerung der Position des Suchfelds, an dem die Algorithmen nach Ereignissen suchen, die Schwellenwerte überschreiten. Das Artefakt der elektrischen Stimulation ist auf der Spannungskurve blau markiert. Die Stimulationsamplitude des analogen Spannungsbefehls wird rot angezeigt; Beachten Sie, dass dies möglicherweise nicht mit der Amplitude des Stimulationsstroms identisch ist, abhängig von dem am Stimulator eingestellten Skalierungsfaktor. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
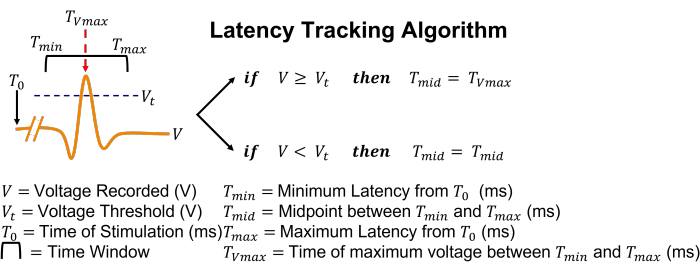
Abbildung 5: Grafische Darstellung des Latenz-Tracking-Algorithmus. Einfach ausgedrückt: Wenn ein Aktionspotential durch Überschreiten des Schwellenwerts erkannt wird, passt das Suchfeld seine Position so an, dass es sich zum Zeitpunkt der Spitzenspannung zentriert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: Grafische Darstellung des Algorithmus zur Verfolgung des elektrischen Schwellenwerts. Einfach ausgedrückt: Wenn ein Aktionspotential durch Schwellenüberschreiten erkannt wird, wird die Stimulationsamplitude um die Dekrementrate verringert. Wenn kein Aktionspotential erkannt wird, wird die Stimulationsamplitude um die Inkrementrate erhöht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
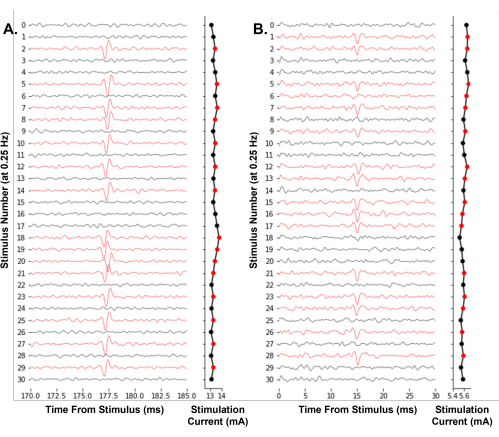
Abbildung 7: Automatisiertes elektrisches Schwellenwert-Tracking von Einzelneuronen-Aktionspotentialen bei einer Stimulationsfrequenz von 0,25 Hz . (A) Sequenzielle Spuren einer menschlichen C-Faser des Nervus peroneus oberflächlich während eines Mikroneurographie-Experiments. (B) Sequenzielle Spuren einer Maus-Aδ-Faser des Nervus saphena während der Haut-Nerven-Präparation der gereizten Faserelektrophysiologie. Die Spuren wurden rot eingefärbt, wenn ein Aktionspotential identifiziert wurde, was zu einer Abnahme der Reizamplitude führte. Der Softwarealgorithmus ermittelt effektiv die Stimulusamplitude, die für eine 50%ige Wahrscheinlichkeit des Auslösens erforderlich ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
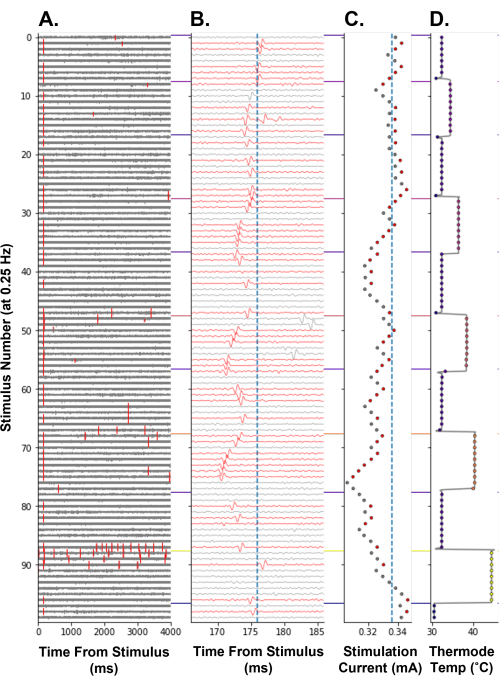
Abbildung 8: Elektrische Schwellenwertverfolgung bei einer Stimulationsfrequenz von 0,25 Hz während der thermischen Stimulation eines humanen C-Faser-Nozizeptors. Die y-Achse kodiert die Stimulationszahl vom Anfang des Paradigmas an. (A) Spannungsverlauf für 4.000 ms nach elektrischer Stimulation, wobei Schwellenwertüberschreitungen rot markiert sind. (B) Spannungskurve von A vergrößert um das verfolgte Aktionspotential. Die Spuren waren rot eingefärbt, als das verfolgte Aktionspotential detektiert wurde. Die vertikale blaue Linie ist die Basislatenz der verfolgten Einheit. (C) Stimulationsstrom, der von APTrack befehligt wird. Die vertikale blaue Linie ist der elektrische Schwellenwert der Basislinie. (D) Temperatur des empfänglichen Feldes TCS-II mit thermischer Stimulationssonde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Verbindung | Konzentration |
| NaCl | 107.8 mM |
| NaHCO3 | 26.2 mM |
| Kcl | 3,5 mM |
| NaH2PO4 | 1.67 mM |
| CaCl2 | 1.53 mM |
| MgSO4 | 0.69 mM |
| Natriumgluconat | 9.64 mM |
| Saccharose | 7,6 mM |
| Traubenzucker | 5.55 mM |
Tabelle 1: Inhalt der synthetischen interstitiellen Flüssigkeit für die Haut-Nerven-Präparation der Maus23.
Diskussion
APTrack ist ein Software-Plugin für die Verwendung mit der Open Ephys-Plattform. Wir haben uns für diese Plattform entschieden, da sie quelloffen, flexibel und kostengünstig zu implementieren ist. Ohne die Kosten für den Konstantstromstimulator könnten alle Geräte, die für die Verwendung des Plugins erforderlich sind, zum Zeitpunkt des Schreibens für etwa 5.000 USD erworben werden. Wir hoffen, dass dies die Forscher in die Lage versetzen wird, APTrack einfacher in ihre peripheren Nervenelektrophysiologie-Studien zu integrieren. Darüber hinaus können Forscher die Software frei modifizieren, um sie an ihre experimentellen Bedürfnisse anzupassen. Wichtig ist, dass dieses Werkzeug zum ersten Mal die Verfolgung des elektrischen Schwellenwerts einzelner C-Faser-Nozizeptoren beim Menschen ermöglicht hat.
Je höher das Signal-Rausch-Verhältnis, desto besser können die Algorithmen Aktionspotentiale erkennen. Das Signal-Rausch-Verhältnis während der Mikroneurographie war bei den meisten unserer Aufnahmen ausreichend, aber die Benutzer müssen sich des Risikos einer Signalverschlechterung im Laufe der Zeit bewusst sein. Dies ist besonders wichtig für längere experimentelle Protokolle, denn wenn die Amplitude des verfolgten Aktionspotentials unter die Nachweisschwelle fällt, wird die Stimulationsamplitude fälschlicherweise erhöht; Dies kann dadurch gemildert werden, dass Experimentatoren das Plugin überwachen und dann bei Bedarf die Einstellungen anpassen. Das Signal-Rausch-Verhältnis wird durch Bandpassfilterung verbessert, aber größere Transienten können immer noch fälschlicherweise als Aktionspotentiale identifiziert werden, wenn sie während des Zeitfensters des Suchfelds eintreffen. Das Risiko, transientes Rauschen fälschlicherweise als Aktionspotential zu identifizieren, kann durch die Verengung des Zeitfensters, in dem das Plugin nach Aktionspotentialen sucht, und durch die Optimierung der Schwellwerteinstellungen verringert werden. Es gibt jedoch immer noch Situationen, in denen die Leistung des Plugins beeinträchtigt wird. Spontane Aktivität kann zu Schwierigkeiten führen, wenn Aktionspotentiale mit größerer Amplitude in das Suchfeld des Algorithmus fallen, da sie fälschlicherweise als Zielaktionspotenzial identifiziert werden. Darüber hinaus kann spontane Aktivität in dem interessierenden Neuron bedeuten, dass die elektrische Stimulation während ihrer Refraktärphase abnimmt, was dazu führt, dass kein Aktionspotential erzeugt wird. Schwierigkeiten bei der Verwendung der Software können auch auftreten, wenn primäre afferente Neuronen ein Flip-Flop aufweisen, bei dem abwechselnde terminale Zweige eines einzelnen Neurons stimuliert werden, wodurch das evozierte Aktionspotential zwei (oder mehr) Basislatenzen aufweist, die sich gegenseitig ausschließen20. Während der Aufnahmen von Neuronen, die ein Flip-Flop mit hohen Signal-Rausch-Verhältnissen aufwiesen, führten wir erfolgreich eine Latenz- und elektrische Schwellenwertverfolgung durch, indem wir die Breite des Suchfelds erhöhten, um alle potenziellen Leitungsgeschwindigkeiten des Neurons zu kapseln. Die elektrische Schwelle kann jedoch je nach Endast des erregten Neurons variieren, was wahrscheinlich zum Teil auf Unterschiede in der Entfernung vom Ort der elektrischen Stimulation zu den alternativen Nozizeptorenterminals zurückzuführen ist. Zusätzliche Arbeiten am Prozess der Identifizierung von Aktionspotenzialen, z. B. um den Vorlagenabgleich einzubeziehen, sind machbar und könnten in diese Software integriert werden. Die GUI-Plugins für Band-Stop oder adaptive Rauschfilterung könnten auch vor APTrack in der Signalkette verwendet werden, falls sie entwickelt werden.
Wir betrachten die elektrische Schwelle als den Strom, der erforderlich ist, um ein Aktionspotential in 50% der Fälle über eine benutzerdefinierte Anzahl von elektrischen Reizen auszulösen, typischerweise 2-10. Die Morphologie der elektrischen Stimulation beträgt 0,5 ms und positive Rechteckimpulse. Dies ist nicht dasselbe wie die Bestimmung der Rheobase, einem häufig verwendeten Maß für die neuronale Erregbarkeit. Das Plugin könnte angepasst werden, um die Rheobase zu bestimmen. Wir verfolgten jedoch eine einfachere Messung, da dynamische Änderungen der Erregbarkeit, wie sie während der Erwärmung auftreten, mit Rheobasenänderungen schwieriger zu quantifizieren gewesen wären als unsere elektrische Schwellenwertschätzung.
Diese Software kann sowohl in Experimenten am Menschen als auch an Nagetieren eingesetzt werden. Möglich wird dies durch eine flexible Unterstützung der elektrischen Stimulationssysteme. Die Software funktioniert mit jedem Stimulator, der eine analoge Befehlsspannung akzeptiert oder manuell mit einem Schrittmotor verbunden werden kann. Für die Mikroneurographie haben wir es mit einem CE-gekennzeichneten Konstantstromstimulator verwendet, der für den Einsatz in der Humanforschung entwickelt wurde und dessen Stimulation über einen Drehregler gesteuert wurde. Stimulatoren, die analoge Spannungsbefehle akzeptieren, können verrauscht sein, da sie den Stromkreis zwischen den Stimuli nicht unterbrechen, was bedeutet, dass jedes Brummen oder Rauschen von 50/60 Hz am analogen Eingang auf die Aufnahme übertragen wird. Ein Stimulator, der ein zusätzliches TLL-Triggersignal benötigt, um die Schaltung anzuschließen, wodurch ein Stimulus mit einem Strom erzeugt werden kann, der dem analogen Spannungseingang entspricht, ist ideal für die Verwendung mit dem Plugin. Dadurch wird verhindert, dass das Rauschen zwischen den Reizen auf die Aufzeichnung übertragen wird.
Die Software verwendet eine einfache Auf-Ab-Methode, um den elektrischen Schwellenwert zu schätzen. Dies wird seit vielen Jahrzehnten in psychophysikalischen Tests verwendet25. In Übereinstimmung mit der Auf-Ab-Methode berücksichtigt der elektrische Schwellenwertverfolgungsalgorithmus zur Modulation der Stimulationsamplitude nur die Amplitude und die Reaktion der vorherigen Stimulation bei der Berechnung der Amplitude der nächsten Stimulation. Dies bedeutet, dass die Stimulationsamplitude um die wahre elektrische Schwelle oszilliert und somit eine Feuerrate von 50 % erzeugt, vorausgesetzt, die Schwelle ist stabil. Die Mindestgröße eines Inkrements oder Dekrements beträgt 0,01 V. Dies entspricht 0,01 mA, vorausgesetzt, der Stimulator hat ein Eingangs-Ausgangs-Verhältnis von 1 V:1 mA und eine ausreichende Auflösung, um so kleine Sprungänderungen zu erzielen. Das Plugin aktualisiert die Live-Schätzung des elektrischen Schwellenwerts des Zielaktionspotentials jedes Mal, wenn es eine Feuerrate von 50 % über eine benutzerdefinierte Anzahl von vorherigen Stimuli (2-10) erreicht. Im Nachhinein empfehlen wir, einen gleitenden Durchschnitt der Stimulationsamplitude über die letzten 2-10 Stimuli zu verwenden, um den elektrischen Schwellenwert zu schätzen, und es sollte beachtet werden, dass diese Schätzung nur dann genau ist, wenn die Feuerrate relativ stabil bei 50% liegt. Sowohl bei den Live- als auch bei den Post-hoc-Schätzungen des elektrischen Schwellenwerts gibt es ein Gleichgewicht zwischen Auflösung, Zuverlässigkeit und Zeit, das berücksichtigt werden muss. Die Verwendung kleinerer Inkrement- und Dekrementschritte erhöht die Genauigkeit der elektrischen Schwellenwertschätzung, verlängert jedoch die Zeit, die benötigt wird, um den neuen elektrischen Schwellenwert anfänglich und nach einer Störung zu finden. Die Berechnung des elektrischen Schwellenwerts über eine größere Anzahl früherer Stimuli bietet eine bessere Zuverlässigkeit, verlängert jedoch die Zeit, die erforderlich ist, um eine genaue Schätzung zu erreichen.
APTrack wurde für den Einsatz in peripheren Nervenableitungen entwickelt, insbesondere um die elektrischen Schwellenwerte von C-Fasern während experimenteller und pathologischer Störungen über Zeiträume zu verfolgen, in denen die Latenz des Aktionspotentials je nach zugrunde liegender neuronaler Aktivität variieren kann. Diese Methode wird es ermöglichen, nicht nur die axonale Erregbarkeit, sondern auch das Potenzial des Nozizeptorgenerators bei gesunden Probanden und Patienten zu untersuchen. Wir gehen davon aus, dass andere Bereiche der Elektrophysiologie dieses Werkzeug für den Einsatz in jedem Experiment übernehmen und anpassen werden, das die Verfolgung des elektrischen Schwellenwerts einer stimulusgebundenen Aktivität erfordert. Dies könnte zum Beispiel genauso gut für die optogenetische Stimulation mit Lichtimpulsen angepasst werden, die von APTrack angetrieben werden. Das Plugin ist Open Source und steht Forschern unter einer GPLv3-Lizenz zur Verfügung. Es basiert auf der Open Ephys-Plattform, einem anpassungsfähigen, kostengünstigen Open-Source-Datenerfassungssystem. Das Plugin bietet zusätzliche Hooks für nachgelagerte Plugins, um die Informationen zum Aktionspotenzial zu extrahieren und zusätzliche Benutzeroberflächen oder adaptive Paradigmen bereitzustellen. Das Plugin bietet eine einfache Benutzeroberfläche für die Visualisierung und Latenzverfolgung von Aktionspotentialen in Echtzeit. Es kann auch vorherige Daten wiedergeben und mithilfe des zeitlichen Rasterdiagramms visualisieren. Darüber hinaus kann es auch eine Latenzverfolgung während der Wiedergabe früherer Daten durchführen. Es gibt zwar andere Softwarepakete für die Echtzeit-Latenzverfolgung, diese sind jedoch nicht quelloffen und können keine elektrische Schwellenwertverfolgung durchführen26,27. APTrack hat einen Vorteil gegenüber herkömmlichen Methoden zur Identifizierung von Aktionspotentialen mit konstanter Latenz aus Spannungskurven, da es ein zeitliches Rasterdiagramm für die Datenvisualisierung verwendet. Darüber hinaus haben unsere Erfahrungen mit dem Einsatz in Experimenten mit niedrigen Signal-Rausch-Verhältnissen gezeigt, dass die Methode der zeitlichen Rasterplot-Visualisierung die Identifizierung von Aktionspotentialen mit konstanter Latenz ermöglicht, die sonst möglicherweise übersehen worden wären.
Die Verfolgung der Ganznervenschwelle ist eine weit verbreitete Methode zur Beurteilung der axonalen Erregbarkeit13. Die Verfolgung des elektrischen Schwellenwerts einzelner Neuronen in C-Fasern von Nagetieren wurde bereits früher verwendet, um die Erregbarkeit von Nozizeptoren zu quantifizieren14, und ihr Nutzen beim Menschen ist anerkannt10,11; Bisher war dies jedoch nicht möglich. Wir stellen ein neuartiges Open-Source-Tool zur direkten Messung der Erregbarkeit einzelner Nozizeptoren sowohl in elektrophysiologischen Studien an Nagetieren als auch an menschlichen peripheren Nerven zur Verfügung. APTrack ermöglicht zum ersten Mal die Echtzeit-Verfolgung von elektrischen Schwellenwerten in Echtzeit von Aktionspotentialen einzelner Neuronen beim Menschen. Wir gehen davon aus, dass es translationale Studien von Nozizeptoren zwischen Nagetieren und Menschen erleichtern wird.
Offenlegungen
G.W.T.N. ist ein BBSRC Collaborative Training Partnership Doctoral Studentship mit der University of Bristol und Eli Lilly and Company (BB/T508342/1). A.P.N. ist ein derzeitiger Mitarbeiter von Eli Lilly and Company und besitzt möglicherweise Aktien dieses Unternehmens.
Danksagungen
Wir bedanken uns bei unseren Geldgebern für ihre Unterstützung: Academy of Medical Sciences (J.P.D., A.E.P.), Versus Arthritis (J.P.D., A.E.P.), Jean Golding Institute Seedcorn Grant (J.P.D., A.E.P., G.W., A.C.S., M.M.P.) und Biotechnology and Biological Sciences Research Council kooperative Ausbildungspartnerschaft Doktorandenschaft mit Eli Lilly (G.W.T.N.). Wir bedanken uns bei allen, die an der Entwicklung von APTrack mitgewirkt haben. Wir möchten uns auch bei unseren Freiwilligen bedanken, die an den Mikroneurographie-Experimenten teilgenommen haben, und bei unseren Mitarbeitern für Patienten- und Öffentlichkeitsbeteiligung und -engagement für ihre unschätzbaren Beiträge.
Materialien
| Name | Company | Catalog Number | Comments |
| 12V DC Power Supply | NA | NA | To power uStepper S-lite. Required for dial-controlled stimulators. |
| 36 Pin Electrode Adapter Board | Intan Technology | C3410 | APTrack Dependency. For connecting electrode input to headstage. $255 USD as of March 2021. |
| APTrack Plugin | NA | NA | https://github.com/Microneurography/APTrack |
| Bipolar Ag/AgCl Recording Electrode | Custom | NA | Recording electrode for the skin-nerve preparation. Or equivalent. |
| Bipolar Concentric Stimulating Electrode | World Precision Instruments | SNE-100 | For electrical stimulation in the mouse skin-nerve preparation. Or equivalent. |
| Bipolar Transcutaneous Stimulating Electrode | Custom | NA | For transcutaneous electrical stimulation while searching for single-neuron action potentials during microneurography. |
| BNC T Splitter (1+) | NA | NA | APTrack Dependency. Any standard BNC T splitter. |
| BNC to BNC cables (3+) | NA | NA | APTrack Dependency. Any standard BNC cables. |
| C6H11NaO7 | Merck | S2054 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| CaCl2 | Merck | C5670 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| Digitimer DS4 Constant Current Stimulator | Digitimer | DS4 | Constant current stiulator for animal research. £1,695 GBP as of September 2022. |
| Digitimer DS7 Constant Current Stimulator | Digitimer | DS7A | Constant current stiulator for human research. £3,400 GBP as of September 2022. |
| Electroaccupuncture Classic Plus Stimulating Electrodes | Harmony Medical | NA | For fixed position intradermal electrical stimulation of the dorsal aspect of the foot during human microneurography. |
| Glucose | Fisher Scientific | G/0450/60 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| HDMI Cable | NA | NA | APTrack Dependency. Any standard passive HMDI cable. To connect OE I/O Board to OE Acquisition Board. |
| KCl | Merck | P9541 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| MgSO4 | Acros Organics | 213115000 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| Mineral Oil | Merck | 330779 | Electrical insulation for nerve recordings in th skin-nerve preparation. Or equivalent. |
| NaCl | Merck | S9888 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| NaHCO3 | Merck | S6014 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| NaHCO3 | Merck | S0751 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| Open Ephys Acquisition Board | Open Ephys | NA | APTrack Dependency. Includes USB cable to connect to computer and mains socket power supply. €2,955 EUR as of September 2022. |
| Open Ephys Graphical User Interface | Open Ephys | NA | https://github.com/open-ephys/plugin-GUI |
| Open Ephys I/O Board | Open Ephys | NA | APTrack Dependency. For ADC voltage inputs via BNC cables. €12.5 EUR without connectors, €85 EUR with connectors as of September 2022. |
| PulsePal V2 | Sanworks | 1102 | APTrack Dependency. Open-source DAC and train generator. $725 USD pre-assembled as of September 2022. Approx. $275 USD for self-assembly. |
| RHD 6ft SPI Cable | Intan Technology | C3206 | APTrack Dependency. For connecting headstage to OE Acquisition Board. $295 USD as of March 2021 |
| RHD2216 16ch Bipolar Headstage | Intan Technology | C3313 | APTrack Dependency. For data acquisition and digitization. $725 USD as of March 2021. Or equivalent RHD2000 series headstage. |
| Sucrose | Fisher Scientific | S/8560/60 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| TCS-II Thermal Stimulator | QST.Lab | NA | For thermal stimualtion of nociceptor receptive fields during human microneurography. |
| Tungsten Microelectrode Pair (Active + Reference) | FHC | 30085 | For microneurography recordings. 35mm. |
| Ultrasound Scanner iQ+ | Butterfly Network | NA | For ultrasound-guided electrode insertion during microneurography. |
| USB 3.0 5kV RMS Isolation | Inota Technology | 7055-D | For isolating human microneuroography participant from computer. €459 EUR as of September 2022. |
| USB-A to micro USB-B cable (2) | NA | NA | APTrack Dependency. To connect computer to PulsePal and to uStepper S-lite if using stepper-stimulator interfacing. |
| uStepper S-lite + NEMA17 motor | uStepper | NA | To interface with stimulators via a control dial. €50 EUR as of September 2022. |
| Von Frey Filaments | Ugo Basile | 37450-275 | For mechanical stimulation of receptive fields during sensory phenotyping of nociceptors. |
Referenzen
- Dubin, A. E., Patapoutian, A. Nociceptors: The sensors of the pain pathway. Journal of Clinical Investigation. 120 (11), 3760-3772 (2010).
- Serra, J., et al. Microneurographic identification of spontaneous activity in C-nociceptors in neuropathic pain states in humans and rats. Pain. 153 (1), 42-55 (2012).
- Serra, J., et al. Hyperexcitable C nociceptors in fibromyalgia. Annals of Neurology. 75 (2), 196-208 (2014).
- Namer, B., et al. Specific changes in conduction velocity recovery cycles of single nociceptors in a patient with erythromelalgia with the I848T gain-of-function mutation of Nav1.7. Pain. 156 (9), 1637-1646 (2015).
- Kleggetveit, I. P., et al. High spontaneous activity of C-nociceptors in painful polyneuropathy. Pain. 153 (10), 2040-2047 (2012).
- Orstavik, K., et al. Abnormal function of C-fibers in patients with diabetic neuropathy. Journal of Neuroscience. 26 (44), 11287-11294 (2006).
- Orstavik, K., et al. Pathological C-fibres in patients with a chronic painful condition. Brain. 126, 567-578 (2003).
- Raja, S. N., Ringkamp, M., Guan, Y., Campbell, J. N., John, J. Bonica Award Lecture: Peripheral neuronal hyperexcitability: The "low-hanging" target for safe therapeutic strategies in neuropathic pain. Pain. 161, S14-S26 (2020).
- Middleton, S. J., et al. Studying human nociceptors: From fundamentals to clinic. Brain. 144 (5), 1312-1335 (2021).
- Marshall, A., Alam, U., Themistocleous, A., Calcutt, N., Marshall, A. Novel and emerging electrophysiological biomarkers of diabetic neuropathy and painful diabetic neuropathy. Clinical Therapeutics. 43 (9), 1441-1456 (2021).
- Themistocleous, A. C., et al. Axonal excitability does not differ between painful and painless diabetic or chemotherapy-induced distal symmetrical polyneuropathy in a multicenter observational study. Annals of Neurology. 91 (4), 506-520 (2022).
- Bostock, H., Cikurel, K., Burke, D. Threshold tracking techniques in the study of human peripheral nerve. Muscle Nerve. 21 (2), 137-158 (1998).
- Kiernan, M. C., et al. Measurement of axonal excitability: Consensus guidelines. Clinical Neurophysiology. 131 (1), 308-323 (2020).
- Sauer, S. K., et al. Can receptor potentials be detected with threshold tracking in rat cutaneous nociceptive terminals. Journal of Neurophysiology. 94 (1), 219-225 (2005).
- Vallbo, A. B. Microneurography: How it started and how it works. Journal of Neurophysiology. 120 (3), 1415-1427 (2018).
- Torebjork, H., Hallin, R. A new method for classification of C-unit activity in intact human skin nerves. Advances in Pain Research and Therapy. 1, 29-34 (1976).
- Brown, G. L., Holmes, O. The effects of activity on mammalian nerve fibres of low conduction velocity. Proceedings of the Royal Society of London. Series B: Biological Sciences. 144 (918), 1-14 (1956).
- Obreja, O., et al. Patterns of activity-dependent conduction velocity changes differentiate classes of unmyelinated mechano-insensitive afferents including cold nociceptors, in pig and in human. Pain. 148 (1), 59-69 (2010).
- Serra, J., Campero, M., Ochoa, J., Bostock, H. Activity-dependent slowing of conduction differentiates functional subtypes of C fibres innervating human skin. Journal of Physiology. 515, 799-811 (1999).
- Weidner, C., Schmidt, R., Schmelz, M., Torebjork, H. E., Handwerker, H. O. Action potential conduction in the terminal arborisation of nociceptive C-fibre afferents. Journal of Physiology. 547, 931-940 (2003).
- Siegle, J. H., et al. Open Ephys: An open-source, plugin-based platform for multichannel electrophysiology. Journal of Neural Engineering. 14 (4), 045003 (2017).
- Sanders, J. I., Kepecs, A. A low-cost programmable pulse generator for physiology and behavior. Frontiers in Neuroengineering. 7, 43 (2014).
- Zimmermann, K., et al. Phenotyping sensory nerve endings in vitro in the mouse. Nature Protocols. 4 (2), 174-196 (2009).
- Dunham, J. P., Sales, A. C., Pickering, A. E. Ultrasound-guided, open-source microneurography: Approaches to improve recordings from peripheral nerves in man. Clinical Neurophysiology. 129 (11), 2475-2481 (2018).
- Levitt, H. Transformed up-down methods in psychoacoustics. Journal of the Acoustical Society of America. 49 (2), 467 (1971).
- Turnquist, B., RichardWebster, B., Namer, B. Automated detection of latency tracks in microneurography recordings using track correlation. Journal of Neuroscience Methods. 262, 133-141 (2016).
- Kiernan, M. C., Burke, D., Andersen, K. V., Bostock, H. Multiple measures of axonal excitability: A new approach in clinical testing. Muscle Nerve. 23 (3), 399-409 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten