Method Article
قياسات انقباضية عالية الإنتاجية لألياف عضلات الفأر السليمة المضمنة في الهيدروجيل باستخدام نظام قائم على البصريات
* These authors contributed equally
In This Article
Summary
يمكن تقييم وظيفة العضلات الهيكلية عن طريق تحديد انقباض ألياف العضلات المعزولة ، وذلك تقليديا باستخدام أساليب شاقة منخفضة الإنتاجية. هنا ، نصف طريقة عالية الإنتاجية قائمة على البصريات لتحديد انقباض ألياف العضلات المدمجة في الهيدروجيل. هذا النهج له تطبيقات لفحص الأدوية والتطوير العلاجي.
Abstract
تعد زراعة الخلايا في المختبر أداة قوية لتقييم العمليات الخلوية واختبار الاستراتيجيات العلاجية. بالنسبة للعضلات الهيكلية ، تتضمن الأساليب الأكثر شيوعا إما تمييز الخلايا السلفية العضلية المنشأ إلى أنابيب عضلية غير ناضجة أو الثقافة خارج الجسم الحي قصيرة المدى لألياف العضلات الفردية المعزولة. تتمثل إحدى الفوائد الرئيسية للثقافة خارج الجسم الحي في المختبر في الاحتفاظ بالبنية الخلوية المعقدة والخصائص المقلصة. هنا ، نقوم بتفصيل بروتوكول تجريبي لعزل ألياف العضلات المثنية المثنية السليمة من الفئران وثقافتها اللاحقة خارج الجسم الحي. في هذا البروتوكول ، يتم تضمين ألياف العضلات في هيدروجيل مصفوفة الغشاء القائم على الفيبرين والغشاء القاعدي لشل حركة الألياف والحفاظ على وظيفتها المقلصة. ثم نصف طرق تقييم وظيفة انقباض الألياف العضلية باستخدام نظام انقباض عالي الإنتاجية قائم على البصريات. يتم تحفيز الألياف العضلية المدمجة كهربائيا للحث على الانقباضات ، وبعد ذلك يتم تقييم خصائصها الوظيفية ، مثل تقصير القطعة العضلية وسرعة الانقباض ، باستخدام القياس الكمي القائم على البصريات. يسمح اقتران زراعة الألياف العضلية بهذا النظام بإجراء اختبار عالي الإنتاجية لتأثيرات العوامل الدوائية على وظيفة الانقباض والدراسات خارج الجسم الحي لاضطرابات العضلات الوراثية. أخيرا ، يمكن أيضا تكييف هذا البروتوكول لدراسة العمليات الخلوية الديناميكية في ألياف العضلات باستخدام الفحص المجهري للخلايا الحية.
Introduction
فتحت التطورات في تقنيات زراعة الخلايا في المختبر إمكانيات جديدة لدراسة قدرات تجديد الأنسجة ، والآليات الخلوية الفيزيولوجية المرضية ، والاستراتيجيات العلاجية اللاحقة ، كل ذلك أثناء استخدام أنسجة الثدييات في ظل ظروف جيدة التحكم1،2،3. استخدام أنظمة الاستزراع في المختبر راسخ في مجال أبحاث العضلات 4,5. بشكل عام ، في الأنابيب العضلية غير الناضجة المتمايزة في المختبر من الخلايا السلفية العضليةتستخدم 2،6،7،8. على الرغم من إحراز تقدم في بروتوكول التمايز لتوليد ألياف عضلية أكثر نضجا9 ، إلا أن عدم نضجها لا يزال يحد من ترجمة النتائج إلى إعداد في الجسم الحي 1,10. تتمثل إحدى القضايا المركزية في مجال بيولوجيا العضلات في عدم قدرة الأنابيب العضلية المتمايزة في المختبر على تلخيص الهياكل المعقدة داخل الخلايا وعمليات إشارات الخلايا والتفاعلات خارج الخلية التي لوحظت في الأنسجة العضلية الأصلية ، والأهم من ذلك ، تلخيص القوى المقلصة التي تنتجها ألياف العضلات1،2،10،11،12. بالإضافة إلى ذلك ، غالبا ما يؤدي الانقباض غير المنسق للأنابيب العضلية أثناء عملية التمايز إلى انفصال تلقائي عن أطباق الاستزراع ، مما يجعل التقييم المقلص للأنابيب العضلية المتمايزة في المختبر أمرا صعبا ويقتصر على التقييم النوعي أو شبه الكمي8،11،12،13. غالبا ما تتطلب هذه القيود إجراء تجارب منتظمة في الجسم الحي مع الحيوانات ، خاصة إذا كان انقباض العضلات هو نتيجة تجريبية أولية1.
بديل للزراعة في الأنابيب العضلية المتمايزة في المختبر هو الثقافة خارج الجسم الحي لألياف العضلات الناضجة المعزولة 1,14. أثناء الزراعة خارج الجسم الحي ، يتم استئصال الأنسجة العضلية الناضجة تنمويا خارج الجسم ، تليها عزل خلية واحدة للزراعة في ظروف المختبر1،14. تحافظ ألياف العضلات الناضجة المعزولة على هياكلها الخلوية المعقدة التي لوحظت داخل الأنسجة الأصلية14،15 ، وتفتح هذه الطريقة إمكانية التدخلات المباشرة ، مثل التلاعب الجيني وفحص الأدوية ، في بيئة استزراع محددة جيدا ويمكن التحكم فيها. يعود أحد التقارير الأولى المتعلقة بعزل الألياف العضلية الهيكلية والثقافة خارج الجسم الحي إلى ثلاثينيات القرن العشرين. ومع ذلك ، كان العائد من الألياف القابلة للحياة من هذا البروتوكول منخفضة16. مع التحسين المستمر لإجراء العزل وظروف الاستزراع ، أصبح من الممكن الآن حدوث تحسن كبير في كمية ألياف العضلات القابلة للحياة والوظيفية14،15،17،18،19. أحد هذه التحسينات في ظروف الاستزراع يتضمن طلاء أطباق الاستزراع ببروتينات مصفوفة خارج الخلية لتعزيز التصاق ألياف العضلات المعزولة على طبق الاستزراع15،18،20. عادة ، يتم استخدام طلاء اللامينين ، لأن اللامينين هو أحد أكثر العناصر وفرة داخل مصفوفة العضلاتخارج الخلية 20,21. مكن تحسين إجراء العزل جنبا إلى جنب مع طلاء أطباق الاستزراع مجال أبحاث العضلات من الحفاظ على ألياف عضلية معزولة قابلة للحياة مع بنية خلوية سليمة ووظائف انقباضية في الثقافة لفترات قصيرة من الزمن1،15،18،22.
النهج الأكثر تقليدية المستخدمة في مجال العضلات لقياس القوة وقدرات الانقباض هو تركيب ألياف العضلات الفردية بين محرك محرك الطول ومحول القوة23,24. بشكل عام ، يتم تشريح الألياف العضلية المستخدمة في هذه الإعدادات التي تحركها المحركات إما من الأنسجة المجمدة أو الطازجة ، تليها النفاذية أو "السلخ" ، مما يسمح بتنشيط الكالسيوم الخارجي ، حيث يتم استخدام تركيزات مختلفة من الكالسيوم للحث على تقلص الألياف العضلية24. في حين أن هذه الطريقة هي المعيار الذهبي لقياسات انقباض الألياف العضلية ، يمكن قياس ألياف عضلية واحدة فقط في كل مرة ، مما يجعل هذه التقنية إجراء شاقا ويستغرق وقتا طويلا25. علاوة على ذلك ، فإن إجراء العزل والسلخ للألياف العضلية يعطل الهياكل المختلفة المشاركة في اقتران الإثارة والانكماش (أي إطلاق الكالسيوم وإعادة امتصاصه لاحقا في الشبكة الساركوبلازمية) ، وبالتالي لا يسمح بدراسة حركية الاسترخاء وأي أمراض قد تؤثر على هذه العملية26,27. بديل لإعداد الألياف الجلدية هو استخدام التشريح الميكانيكي لعزل ألياف العضلات السليمة ، حيث يمكن قياس قوى الانقباض استجابة للتنشيط الكهربائي28 ؛ ومع ذلك ، فإن هذا النهج يمثل تحديا تقنيا ويستغرق وقتا طويلا للغاية ، مما يؤدي إلى قياسات منخفضة الإنتاجية. أخيرا ، في كل من المستحضرات الجلدية والسليمة ، تتم إزالة خلايا العضلات تماما من البيئة خارج الخلية أثناء القياسات المقلصة 24 ، مما يجعل التحقيق في تأثير تكوين / تصلب المصفوفة خارج الخلية على تقلص الألياف العضلية مستحيلا24. نتيجة لذلك ، هناك حاجة إلى تطوير طرق بديلة لتمكين قياسات انقباض الألياف العضلية للألياف العضلية السليمة المعزولة بطريقة عالية الإنتاجية مع إعادة إنشاء الاتصال بين ألياف العضلات والمصفوفة خارج الخلية.
في الآونة الأخيرة ، تم تطوير نهج جديد قائم على البصريات لقياسات انقباض الألياف العضلية عالية الإنتاجية29. يقيس هذا النظام القائم على البصريات دورية القطع العضلية لتقييم طول القطعة العضلية أثناء الانكماش باستخدام التصوير عالي السرعة. ضمن هذا النظام ، تبقى الخلايا في مكانها في طبق الاستزراع أثناء تحريك البصريات ، وبالتالي تقليل الوقت اللازم بين قياسات الخلاياالمتعددة 29. الميزة الرئيسية لاستخدام هذا النهج عالي الإنتاجية القائم على البصريات هو أنه يسمح بتطوير ظروف استزراع مشابهة لتلك الموجودة في الأنسجة الأصلية. النهج المستخدم لتقليد الظروف الأصلية في الجسم الحي هو تضمين الخلايا في الهلاميات المائية30. عادة ما يكون الهيدروجيل مادة لزجة مرنة قادرة على الحفاظ على حجمها وشكلها ، والهلاميات المائية لها خصائص كل من المواد الصلبة والسائلة31. يتكون الجزء الصلب من سلاسل بوليمر مترابطة مع بعضها البعض ، مما يخلق بنية تشبه الشبكة30,31. يمكن ضبط الخصائص المادية للهلاميات المائية لتقليد ترسب مصفوفة العضلات30,31. وبالتالي ، فإن الجمع بين نظام عالي الإنتاجية قائم على البصريات مع خلايا مدمجة في الهلاميات المائية يفتح إمكانيات جديدة لتقييم آثار تكوين المصفوفة خارج الخلية والخصائص الميكانيكية على وظائف الألياف العضلية.
الهدف العام من هذه الورقة هو 1) وصف منهجية العزل الأنزيمي والزراعة خارج الجسم الحي لألياف العضلات في ظروف تحاكي بيئة الأنسجة الأصلية و 2) تقييم انقباض الألياف العضلية باستخدام نهج عالي الإنتاجية. وصفنا منهجية مفصلة لعزل عدد كبير من الألياف العضلية المفردة بسهولة من العضلة المثنية الرقمية (FDB) باستخدام الهضم الأنزيمي. بالإضافة إلى ذلك ، وصفنا تقنية لتضمين ألياف العضلات المعزولة في هيدروجيل قائم على الفيبرين من أجل محاكاة البيئة الأصلية للعضلات وتحسين صلاحية الألياف العضلية وانقباضها. ثم نحدد طريقة عالية الإنتاجية لقياس تقلصات الألياف العضلية الحية في المختبر باستخدام هذا النظام الذي تم تطويره مؤخرا. ميزة إضافية لإجراء التضمين هذا هي تثبيت الألياف أثناء الانكماش ، مما قد يحسن نسبة الإشارة إلى الضوضاء لهذه القياسات. طريقة تضمين الهلام هذه قابلة للتطبيق على كل من إجراءات تغليف البوليمر الفردي والهلام المركب ، مما يسهل تقييم آثار تكوين المصفوفة خارج الخلية على انقباض الألياف العضلية.
Protocol
بالنسبة لدراسات الانكماش خارج الجسم الحي ، تم الحصول على أنسجة ما بعد الوفاة من الحيوانات التي تم التضحية بها لمشاريع بحثية أخرى معتمدة و / أو فائض تربية جامعة VU وفقا لتوجيه المجلس الأوروبي (2010/63 / EU) بإذن من قانون البحوث الحيوانية في هولندا.
1. إعداد المواد
- تحضير الماصات للتثليج (تخزينها في 70 ٪ من الإيثانول في خزانة التدفق حتى الاستخدام). قطع طرفي طرفين P1,000 لإنشاء أحجام ثقب مختلفة ؛ تأكد من أن الثقب كبير بما يكفي لمرور العضلات دون سد الماصة. قم بتشغيل الأطراف المقطوعة من خلال اللهب حتى تصبح ناعمة.
- تحضير أطباق سيلجارد كما هو موضح في مكان آخر32 ، وتعقيمها بنسبة 70٪ من الإيثانول مقدما لاستخدامها في تأمين المخلب والعضلات أثناء العزل.
ملاحظة: يمكن إعادة استخدام أطباق سيلجارد بعد التنظيف الشامل بالماء منزوع الأيونات و 70٪ إيثانول. - قم بإعداد المحاليل التالية قبل إجراء العزل: وسط التشريح ، وسط زراعة الفيبرين ، ووسط هضم العضلات (انظر الجدول 1).
ملاحظة: يجب تعقيم وسط الهضم العضلي باستخدام مرشح 0.22 ميكرومتر. يجب موازنة جميع المحاليل المعدة في حاضنة زراعة الخلايا القياسية عند 37 درجة مئوية و 5٪ CO2 لمدة 30 دقيقة على الأقل قبل الاستخدام. - بعد هضم العضلات ، قم بإعداد الحلول التالية لصب الهيدروجيل: مزيج الخلايا ومزيج المصفوفة (انظر الجدول 2). اجمع بين مزيج الخلايا ومزيج المصفوفة بنسبة 1: 1 للحصول على تركيز نهائي من الفيبرين يبلغ 2.5 مجم / مل.
ملاحظة: قم بإعداد المصفوفة على الجليد ، واستخدم أطراف الماصة المبردة مسبقا لمنع البلمرة المبكرة لمصفوفة الغشاء القاعدي. تم تحسين نسبة الثرومبين: الفيبرينوجين البالغة 1:10 (وحدات لكل ملغ من الفيبرينوجين) المستخدمة هنا لفترة بلمرة تبلغ 30 دقيقة. إذا تبلمر الجل في غضون 30 دقيقة ، فيجب استخدام تركيز أقل من الثرومبين. راجع المناقشة لمزيد من المعلومات.
2. تشريح العضلات FDB
- القتل الرحيم للفأر عن طريق خلع عنق الرحم. تطهير الطرف الخلفي مع الكحول 70 ٪.
- قطع الساق الخلفية السفلى فوق الكاحل. قطع فتح الجلد على الجانب الظهري من القدم نحو أصابع القدم.
ملاحظة: قطع الساق الخلفية السفلية عند مفصل الكاحل لمنع تلف عضلات الطرف السفلي والساق إذا لزم الأمر لاحقا. - قشر الجلد بعناية نحو أصابع القدم. احرص على عدم إتلاف العضلات. FDB هي العضلات الأكثر سطحية على الجانب البطني من القدم.
- ضع القدم المقطعة في طبق سيلجارد مع 10 مل من وسط التشريح المسخن مسبقا عند 37 درجة مئوية. ثبت القدم من خلال الجلد الذي لا يزال متصلا بأصابع القدم ، وقم بتثبيت أسفل الساق خارج الكاحل.
- قم بإزالة النسيج الضام بعناية أعلى العضلات. قطع الوتر عند الكعب ، ورفع العضلات من وترها.
- قطع جنبا إلى جنب وتحت العضلات من خلال النسيج الضام. استمر في القطع حتى تنكشف أوتار إصبع القدم.
- عندما يتعرض نصف طول الأوتار الثلاثة ، قم بقطع الأوتار ، وحرر العضلات من القدم. اختياري: تقليم الوتر الجانبي الرابع وأليافه العضلية.
- نظف النسيج الضام من العضلات ، وانقله إلى أنبوب يحتوي على وسط تشريح مسخن مسبقا.
3. هضم العضلات FDB
- تحضير وسط هضم العضلات وفقا للجدول 1.
- نقل عضلات FDB إلى وسط هضم العضلات باستخدام ماصة مصلية. احتضان في حاضنة زراعة الأنسجة في 37 درجة مئوية و 5 ٪ CO2 لمدة 80 دقيقة.
ملاحظة: يجب تحسين هذه المرة لكل دفعة كولاجيناز. يكتمل الهضم عندما تبدأ العضلات في التآكل وتبدو متضخمة. انظر المناقشة لتحسين وقت الهضم. - بعد الهضم ، انقل العضلة إلى أنبوب سعة 15 مل يحتوي على 3 مل من وسط التشريح ، واحتضانها لمدة 30 دقيقة قبل التثليج.
4. FDB تثليج العضلات وترسيب الجاذبية
- قم بطحن العضلات باستخدام أطراف التثليج المعدة مسبقا (الخطوة 1.1) عن طريق سحب العضلات ، والانتقال من الحجم الأكبر إلى الأصغر. إذا استغرقت هذه الخطوة أكثر من 5 دقائق ، ضع العضلات في الحاضنة لمدة 5 دقائق للسماح لها بالراحة.
- سحن حتى تخرج ألياف العضلات في الغالب من الوتر ويمكن أن يمر الوتر عبر طرف P200. إزالة الأوتار.
- أضف ألياف FDB المنفصلة إلى أنبوب سعة 15 مل يحتوي على 10 مل من وسط التشريح ، واترك الألياف تستقر في الحاضنة لمدة 20 دقيقة. مراقبة بيليه شكلت.
- اختياري: قم بإزالة 10 مل من الوسط من الأعلى ، وكرر الخطوة 4.3. تسهل هذه الخطوة إزالة الحطام الزائد والخلايا أحادية النواة المرتبطة به.
5. FDB الألياف التضمين
- قم بإزالة كل الوسائط بعناية من أعلى حبيبات الألياف. أعد تعليق الخلايا في 875 ميكرولتر من مزيج الخلايا لكل عضلة FDB (على الجليد).
ملاحظة: تنتج عضلة FDB واحدة أليافا كافية لسبعة آبار من صفيحة 24 بئرا. يمكن تعديل هذه الكثافة وفقا لاحتياجات التجربة. تم تحسين حجم الجل التالي (250 ميكرولتر) لتنسيق 24 بئرا ولكن يمكن قياسه وفقا للتنسيقات الأخرى. - تخلط القسمة 125 ميكرولتر من الخلية في أنابيب طرد مركزي دقيقة واحدة.
- بئر واحد في كل مرة ، أضف 125 ميكرولتر من مزيج المصفوفة إلى قسمة تعليق الخلية ، واخلطها عن طريق السحب لأعلى ولأسفل بعناية ، وتجنب تكوين الفقاعات.
- نقل المزيج النهائي على الفور إلى بئر.
ملاحظة: تأكد من سحب المزيج في منتصف البئر. كرر الخطوة 5.3 والخطوة 5.4 لكل بئر. - تصلب المواد الهلامية في حاضنة لمدة 30-45 دقيقة. بعد التصلب ، أضف بعناية وسط الاستزراع إلى الآبار.
ملاحظة: يمكن أن يؤدي السحب السريع إلى فصل الهيدروجيل عن البئر. من هذه النقطة فصاعدا ، يمكن تحفيز الألياف وقياسها. ومع ذلك ، في تجربتنا ، فإن السماح للألياف بالتكيف مع ظروف الثقافة لمدة 24 ساعة قد يحسن انقباض الألياف. - لثقافة أطول ، قم بتجديد وسط الثقافة بمقدار نصف تغيير كل 2 أيام. للقيام بذلك ، قم بإزالة نصف وسط الثقافة ، واستبدله بكمية متساوية من الوسط الجديد.
6. قياسات الانقباض القائمة على البصريات
- قم بتشغيل نظام قياس الانقباض القائم على البصريات (انظر جدول المواد) ، ومصباح التألق ، وجهاز قياس الخلايا الكهربائية ، والكمبيوتر. اضبط المحفز الكهربائي على 1.0 هرتز و 10.0 فولت ومدة نبضة 5.00 مللي ثانية لتحفيز ألياف العضلات المعزولة.
- أدخل اللوحة في نظام القياس. قم بتوصيل pacer بملحق السرعة ، وأدخله في لوحة الاستزراع.
- افتح برنامج IonWizard ، وافتح ملفا جديدا بالنقر فوق ملف (أعلى يسار الشاشة) | جديد.
- تحقق مما إذا كان البرنامج على التجربة الصحيحة ، القطعة العضلية الهيكلية ، من خلال النقر على جديد | جمع التجربة. لتغيير التجربة ، انقر فوق التجربة المطلوبة ، واضغط على إضافة. بالنسبة لتجربة القطعة العضلية الهيكلية ، قم بتطبيق الإعدادات التالية: Sarc 20x ، متوسط الخطوط ، FFT واحد ، معدل أخذ العينات 250 هرتز ، ووقت اكتساب 10 ثوان.
ملاحظة: يجب إعداد الإعدادات التجريبية قبل التجربة. يمكن ضبط الإعدادات وفقا لاحتياجات التجربة. - اضبط درجة حرارة نظام القياس على 25 درجة مئوية. انقر فوق فتح مكتشف الخلية أسفل شريط الأدوات ، وانتظر ظهور شاشة جديدة. في أعلى يمين هذه الشاشة ، حدد نوع اللوحة والآبار النشطة.
ملاحظة: يتم إجراء القياسات عند 25 درجة مئوية لتقليل سرعة تقلص ألياف عضلات FDB سريعة الارتعاش ، وبالتالي منع نقص أخذ العينات من حدث الانقباض. - ضع الألياف في بؤرة التركيز عن طريق ضبط شريط تمرير التركيز. بدلا من ذلك ، استخدم مفتاح W ومفتاح S لوظيفة التركيز هذه.
- قم بتمكين السرعة لبدء التحفيز الكهربائي. لاحظ أن الألياف تبدأ الآن في الوخز.
ملاحظة: إذا لم تكن هناك ألياف ترتعش ، فتأكد من توصيل جميع الأسلاك وأن المقبض مغمور تماما. إذا لم تكن هناك حركة بعد ذلك ، فقد لا تستجيب الألياف بسبب فرط الهضم أو التلف المفرط أثناء التثليج. - ركز منطقة القياس على طرف الألياف؛ بحيث تعمل القطع العضلية رأسيا. تأكد من التركيز على القطع العضلية. إذا كانت القطع العضلية في بؤرة التركيز، تظهر قمة واحدة في شريط الأدوات. أثناء الانكماش، ستتحرك هذه القمة إلى اليمين مع تقصير القطعة العضلية.
ملاحظة: يمكن تعديل منطقة القياس الأرجواني قبل بدء التجربة. لضمان القياس المناسب ، قم بتضمين ~ 20 قطعة عضلية. إذا تغير شكل هذه الذروة أثناء الانقباض، فقد يشير ذلك إلى أن القطعة العضلية محجوبة أو خارج نطاق التركيز أثناء الانقباض، وهو ما يحدث ضوضاء. - ابدأ التجربة بالنقر فوق ابدأ في شريط الأدوات. اضغط على المفتاح Q لبدء القياس ، وانتظر حتى يقيس البرنامج 10 عابرات انكماش. إذا بدا أكثر من أربعة عابرين خاليا من الضوضاء ، فاقبل القياس بالضغط على المفتاح Z . إذا كان لدى العابرين الكثير من الضوضاء ، فارفض القياس بالضغط على المفتاح X .
- قم بقياس ما بين 10 ألياف و 20 أليافا لكل حالة. يتم الاحتفاظ بمواقع الألياف المقاسة مسبقا.
- اختياري: أضف مركبات ، وبعد ذلك يمكن إعادة قياس الألياف في هذه المرحلة.
- عند الانتهاء من التجربة، اضغط على زر الإيقاف في شريط الأدوات السفلي لإغلاق نافذة مكتشف الخلايا. احفظ الملف وابدأ ملفا جديدا.
- لتحليل البيانات ، افتح برنامج "سطح المكتب Cytosolver". انقر فوق استيراد ، وحدد الملف (الملفات) المراد تحليله.
- بعد انتهاء البرنامج من التحليل ، ابحث عن القمم الزرقاء والحمراء والرمادية. القمم الزرقاء هي عابرة يقبلها البرنامج. القمم الحمراء هي عابرة يرفضها البرنامج ، والقمم الرمادية عابرة يرفضها المستخدم.
ملاحظة: يمكن تعديل معايير الرفض في برنامج التحليل. بشكل عام ، يتم رفض القيم إذا تجاوزت الحد الأقصى للمشتقات ، ويتم رفض العابرين بناء على قيم المنحنى R2 البالغة <0.95. - انقر فوق تصدير. ضع علامة في المربعات التالية: متوسط البيانات العابرة والتصدير إلى Excel.
- عند الانتهاء ، قم بإيقاف تشغيل جميع الأجهزة. أخرج طبق الثقافة وتخلص منه. نظف أقطاب pacer بماء منزوع الأيونات و 70٪ إيثانول.
النتائج
باستخدام هذا البروتوكول ، تم عزل ألياف العضلات FDB المفردة ودمجها في هيدروجيل. يوضح الشكل 1 نظرة عامة على إجراء تشريح العضلات. تتعرض عضلة FDB بأوتار سليمة وتقطع من اللفافة. الحفاظ على أوتار العضلات كنقاط تثبيت يقلل من الضرر المحتمل لألياف العضلات أثناء إجراء العزل. يمكن قطع النسيج الضام الزائد لتقليل الحطام ونمو أنواع الخلايا الثانوية. بمجرد استئصال العضلات وتنظيفها بشكل كاف ، يتم هضم العضلات إنزيميا باستخدام كولاجيناز ، ويتم إطلاق ألياف العضلات المفردة عن طريق التثليج قبل تضمين الخلايا المعزولة في الهلاميات المائية. يوفر عزل ألياف العضلات FDB أليافا عضلية قصيرة نسبيا ، والتي تتميز بسهولة التلاعب بها. نظرا لحجمها ، يمكن سحب ألياف عضلات FDB بأمان دون تلف ناتج عن التشابك ويمكن دمجها بسهولة داخل هيدروجيل. نظرا لأن الألياف العضلية المفردة لا تلتصق بألواح الاستزراع جيدا ، فإن تضمين الألياف في هيدروجيل يضمن بقاء الألياف في مكانها أثناء زراعة الخلايا والقياسات المقلصة. علاوة على ذلك ، فإن إضافة مصفوفة الغشاء القاعدي إلى هلام الفيبرين تسمح بالتفاعلات بين ألياف العضلات والمصفوفة ، مما يحاكي البيئة الأصلية في الجسم الحي . يمكن التلاعب بالألياف العضلية المفردة المعزولة والحفاظ عليها في الثقافة لعدة أيام بعد العزل. في الشكل 2 ، يوضح مثال على ألياف FDB المعزولة المضمنة في مصفوفة هيدروجيل. تحتوي الألياف السليمة على قطع عضلية مرئية وتمتد بشكل مستقيم (سهم أزرق) ، في حين أن الألياف المنحنية عادة ما تكون تالفة أو غير قابلة للحياة (سهم أصفر) ويجب استبعادها من القياسات. تظهر الألياف شديدة الانقباض كأجسام مكروة داكنة في المصفوفة (سهم أحمر). إذا كان إجراء العزل ناجحا ، يجب أن تكون نسبة الألياف السليمة ~ 75٪. عادة ما تشير نسبة أكبر من الألياف شديدة الانقباض إلى تلف أثناء إجراء العزل. يمكن أن يتلف غشاء ألياف العضلات إما عن طريق الإفراط في هضم العضلات أو تلف الألياف أثناء التثليج. يحدث تلف التثليج بشكل رئيسي إذا كانت العضلات غير مهضومة ، وبالتالي لا تتفكك بسهولة.
تم تقييم وظائف الألياف وصلاحيتها من خلال قياسات انقباضية للألياف العضلية باستخدام نظام قياس انقباضي عالي الإنتاجية قائم على البصريات. يخرج النظام العديد من المعلمات ، مثل طول القطعة العضلية ، والنسبة المئوية لتقصير القطعة العضلية ، وسرعة الانقباض ، وسرعة الاسترخاء. باستخدام نظام القياس المقلص، يمكن قياس انقباض القطعة العضلية لكل ليفة عضلية. يوضح الشكل 3 أمثلة على انقباضات الألياف العضلية التي تم قياسها باستخدام نظام القياس. من انكماش عابر واحد ، يتم الحصول على المعلمات التالية: طول القطعة العضلية عند خط الأساس ، ومدة الانكماش ، وطول القطعة العضلية عند الانكماش الأقصى ، ومدة الاسترخاء (الشكل 3 أ). تستخدم هذه المعلمات لحساب النسبة المئوية لتقصير القطعة العضلية وتقلصها وسرعات الانبساط. يمكن أيضا حساب قيم السرعة المتوسطة من قيم المدة والتقصير المطلق ، إذا لزم الأمر. يتميز قياس الانكماش الصحيح بخط أساس مستقيم ، متبوعا بانخفاض إلى القمة ، والعودة إلى خط الأساس (الشكل 3 أ). يمكن أن تؤثر الضوضاء أو القطع العضلية غير المركزة أو الحركة الشاذة للألياف على القياس العابر (الشكل 3B ، C) ، ويمكن تجاهل هذه القياسات يدويا أو سيتم رفضها بواسطة برنامج التحليل. في هذا النهج ، يعد التصور الواضح للقطع العضلية مهما لقياس الانقباضات. وبالتالي ، فإن أي شيء يقلل من رؤية القطع العضلية قد يحدث ضوضاء. قد يحدث هذا إذا كانت هناك حركة للقطعة العضلية خارج المستوى البؤري أثناء الانقباض. يجب أيضا استبعاد القياسات التي تختلف فيها سلسلة من الانقباضات في السرعة أو العمق من مجموعة البيانات.
يمكن استخدام البيانات المقلصة للألياف العضلية المفردة التي تم الحصول عليها باستخدام هذا النظام لمقارنة ظروف الثقافة المختلفة. يوضح الشكل 4 فعالية النظام. هنا ، قمنا بقياس تقلصات ألياف العضلات FDB في كل من تنسيقات ثقافة 2D (لوحات الثقافة المغلفة باللامينين) و 3D (هيدروجيل الفيبرين). تم تحقيق نسبة أعلى من القياسات القابلة للاستخدام في 3D ، حيث منع تضمين الألياف في الجل الحركة الجانبية وغيرها من القطع الأثرية للحركة من التأثير على القياس (الشكل 4A). لم يكن لتضمين الألياف تأثير كبير على تقصير القطعة العضلية أو قيم سرعة الانكماش القصوى مقارنة بالألياف المستزرعة ثنائية الأبعاد (الشكل 4 ب). لتوضيح كيفية تأثير المصفوفات المختلفة على تقلص ألياف عضلات FDB ، قارنا أيضا هيدروجيل الفيبرين هذا بمصفوفة غشاء قاعدي نقي (4 مجم / مل) (الشكل 4C). من المحتمل أن يكون انخفاض الانقباض الذي لوحظ في مصفوفة الغشاء القاعدي النقي بسبب صلابة الجل أو زيادة تفاعلات مصفوفة الخلية. كما تم اختبار تركيزات الفيبرين التي تصل إلى 7 ملغم / مل ، مع عدم وجود تأثير كبير على سرعة الانقباض والتقصير (بيانات غير منشورة). يضمن استخدام هذا الهيدروجيل القائم على الفيبرين الحد الأدنى من التداخل مع المعلمات المقلصة.
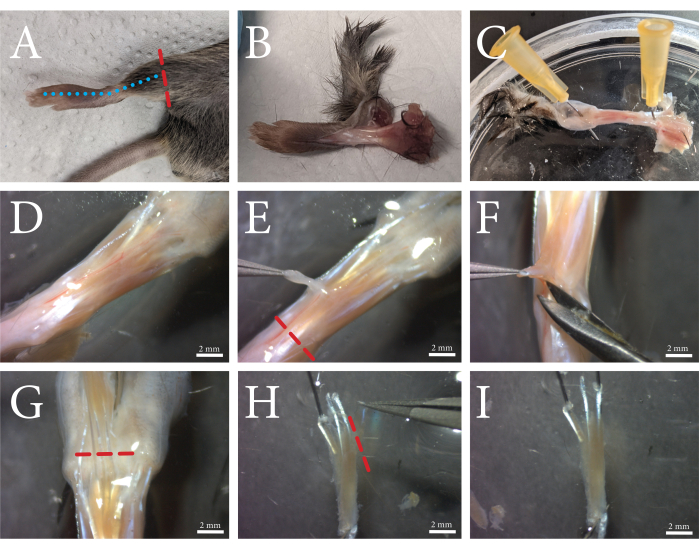
الشكل 1: نظرة عامة على إجراء تشريح العضلات FDB. (أ) يقطع الطرف الخلفي فوق الكاحل (خط أحمر متقطع)، و(ب) يزال الجلد عن طريق قطع الجزء العلوي من القدم على طول الخط الأزرق المتقطع. (ج) تثبت القدم من خلال الكاحل والجلد عند أصابع القدمين. د: المنظر المجهري للعضلة المكشوفة والنسيج الضام المحيط بها. تظهر اللفافة كطبقة بيضاء معتمة تمر من خلالها الأوعية الدموية. (ه) تزال اللفافة من العضلة، ويقطع الوتر على طول الخط الأحمر المتقطع. (F) يتم فصل عضلة FDB عن الأنسجة الكامنة عن طريق رفع وقطع أسفل وبجانب العضلات. (ز) عندما تكون أوتار أصابع القدم مرئية بوضوح ، يتم قطع FDB على طول الخط الأحمر المتقطع. (H) يتم تأمين FDB بواسطة الأوتار ، ويمكن إزالة الوتر الجانبي الرابع وأليافه عن طريق القطع على طول الخط الأحمر المتقطع. يمكن الآن قطع اللفافة الزائدة. (I) بعد التنظيف ، يتم نقل عضلة FDB إلى محلول كولاجيناز. قضبان المقياس = (D-I) 2 مم. اختصار: FDB = flexor digitorum brevis. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
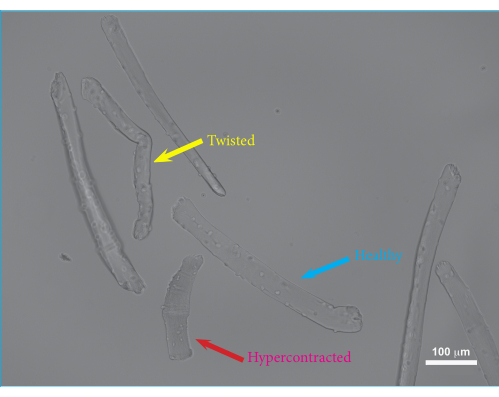
الشكل 2: صورة مجهرية لألياف عضلات FDB مدمجة في هيدروجيل بعد 24 ساعة من الثقافة. السهم الأزرق: مثال على الألياف العضلية FDB قابلة للحياة. السهم الأصفر: مثال على الألياف العضلية FDB الملتوية. قد تكون ألياف العضلات الملتوية قد قللت من صلاحيتها وضعف الانقباضات ، وبالتالي يجب استبعادها من القياسات. السهم الأحمر: مثال على الألياف العضلية FDB مفرطة الانقباض. يحدث فرط الانقباض المفرط عندما يتم إجراء التثليج بقوة كبيرة أو يمكن أن يكون ناتجا عن فرط هضم الكولاجيناز أو استخدام وسط ثقافة غير متوازن. شريط المقياس = 100 ميكرومتر. اختصار: FDB = flexor digitorum brevis. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
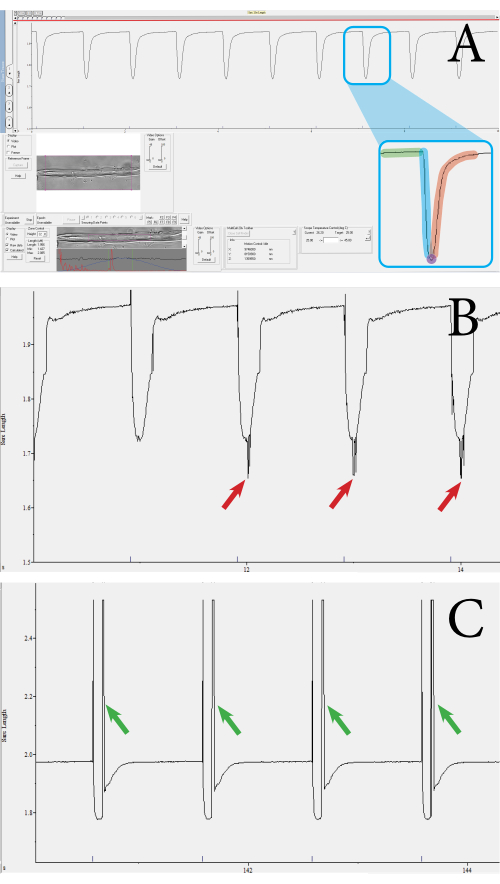
الشكل 3: مثال على عابرات تقلص الألياف المقاسة باستخدام نظام انقباض عالي الإنتاجية قائم على البصريات. أ: مثال على انكماش طبيعي عابر. يتم الحصول على هذا العابر من القطع العضلية المحاطة بالمربع الأرجواني الموضح في شريط الأدوات السفلي. يتكون العابر من المكونات التالية: طول القطعة العضلية عند خط الأساس (الأخضر) ، ومدة الانكماش (الأزرق) ، وطول القطعة العضلية عند أقصى انكماش (أرجواني) ، ومدة الانحلال (أحمر). يتم حساب المعلمات مثل السرعة والنسبة المئوية للانكماش من هذه القيم. (ب) مثال على انكماش عابر غير كاف. تحدث هذه القياسات عندما لا يتم التقاط إشارة القطعة العضلية بسبب الضوضاء (انظر الأسهم الحمراء). (ج) مثال على انكماش عابر له قطعة أثرية متحركة (انظر الأسهم الخضراء). تحدث آثار الحركة عندما تتحرك الألياف العضلية خارج التركيز أثناء الانقباض. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
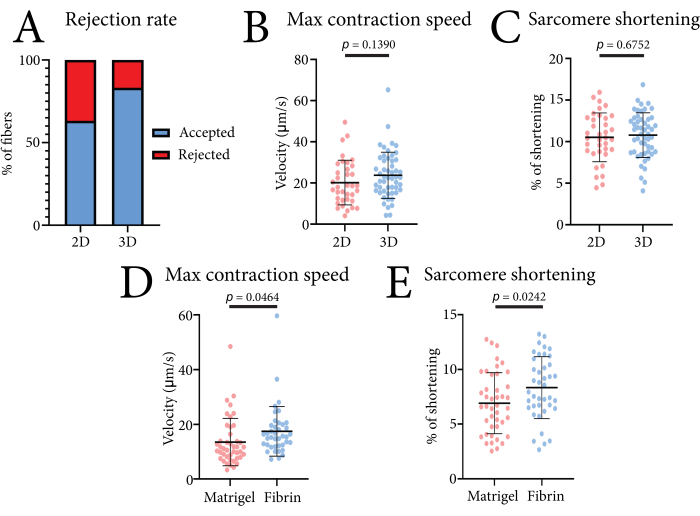
الشكل 4: البيانات التمثيلية التي تم الحصول عليها باستخدام نظام الانقباض عالي الإنتاجية القائم على البصريات عند مقارنة ظروف 2D مقابل 3D والهلاميات المائية المختلفة . (أ) النسبة المئوية لقياسات الانكماش المقبولة والمرفوضة التي وجدها برنامج تحليل البيانات في الثقافة ثنائية الأبعاد وفي الثقافة ثلاثية الأبعاد بناء على 30 قياسا. (ب) مقارنة سرعة الانقباض القصوى في الألياف العضلية المستزرعة ثنائية الأبعاد وثلاثية الأبعاد المستزرعة المعزولة من ثلاثة فئران بعد 24 ساعة من الثقافة. (ج) مقارنة تقصير القطعة العضلية في الألياف العضلية المستزرعة ثنائية الأبعاد والألياف العضلية المستزرعة ثلاثية الأبعاد المعزولة من ثلاثة فئران بعد 24 ساعة من الثقافة. (د) مقارنة سرعة الانقباض القصوى لمصفوفة الغشاء القاعدي النقي (Matrigel) المدمجة والألياف العضلية المدمجة في هيدروجيل الفيبرين المعزولة من ثلاثة فئران بعد 24 ساعة من الثقافة. (ه) مقارنة تقصير القطعة العضلية لمصفوفة الغشاء القاعدي النقي (Matrigel) المدمجة والألياف العضلية المدمجة في هيدروجيل الفيبرين المعزولة من ثلاثة فئران بعد 24 ساعة من الثقافة. تم تحليل البيانات باستخدام اختبار t للطالب ويتم عرضها كمتوسط ± SD. كل نقطة بيانات هي ليفة عضلية واحدة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: تركيب وسط التشريح المستخدم لتشريح العضلات ، ووسط زراعة الفيبرين المستخدم لاستزراع الألياف العضلية المعزولة ، ووسط هضم العضلات المستخدم لهضم العضلات المعزولة إنزيميا. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: تكوين مزيج الخلايا المستخدم في صب الهلاميات المائية ومزيج المصفوفة المستخدم في صب الهلاميات المائية. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
هنا ، نقوم بتفصيل بروتوكول لأداء العزل الأنزيمي وثقافة ألياف العضلات FDB بتنسيق ثقافة 3D ، تليها قياسات مقلصة باستخدام نظام قياس انقباضي قائم على البصريات. يحتوي هذا البروتوكول على عدد من المزايا ، بما في ذلك 1) عزل مباشر وفي الوقت المناسب للعديد من ألياف العضلات السليمة من عضلة واحدة. 2) تضمين ألياف العضلات في مصفوفة هيدروجيل قابلة للضبط ؛ 3) أداء قياسات الانقباض عالية الإنتاجية باستخدام النظام القائم على البصريات ؛ و 4) القدرة على إجراء قياسات متكررة لنفس الألياف العضلية بعد التدخل. يوفر عزل الألياف العضلية الحية المفردة خلايا عضلية ناضجة تحتفظ بوظيفة انقباضها. نظرا لأن الألياف العضلية التي تم الحصول عليها من الفأر FDB صغيرة نسبيا ، فيمكن التلاعب بها بسهولة أثناء العزل والحفاظ على شكلها المستقيم ، مما يسمح بقياسات انقباض المصب. على الرغم من أن النظام تم تطويره في المقام الأول لدراسة تقلص الخلايا العضلية القلبية ، إلا أن الألياف العضلية الهيكلية تحتوي على نفس الآلية المقلصة مع نمط القطعة العضلية الذي يمكن تمييزه بسهولة ، وبالتالي يمكن قياسه أيضا باستخدام هذا النظام29. يعد اقتران قياسات انقباض الخلية الواحدة مع ثقافة الألياف العضلية الحية خارج الجسم الحي أداة قوية لتقييم صحة الألياف العضلية الناضجة ووظيفتها استجابة للتنشيط الكهربائي.
يتمثل أحد قيود استخدام الألياف العضلية المنفصلة في عدم وجود قوى خارجية (أي التمدد السلبي) المطبقة على الألياف ، مما يؤدي إلى انخفاض أطوال العضل العضلي مقارنة بتلك الموجودة في الجسم الحي. على الرغم من أن طول القطعة العضلية 2.4-2.5 ميكرومتر يضمن الإنتاج الأمثل للقوة، فإن طول القطعة العضلية أثناء الراحة يمكن أن يختلف اختلافا كبيرا33. في حين أن طول القطعة العضلية في الجسم الحي ل FDB لم يتم وصفه بعد ، تشير بياناتنا غير المنشورة إلى متوسط طول يبلغ 2.2 ميكرومتر. تظهر النتائج الحالية متوسط طول القطعة العضلية أثناء الراحة ~ 1.95 ميكرومتر في ألياف FDB غير المحملة بعد 24 ساعة في الاستزراع (الشكل 3). على الرغم من أن طول القطعة العضلية المنخفض هذا سيؤدي إلى انخفاض إنتاج القوة ، إلا أن طول ~ 1.95 ميكرومتر يجب أن ينتج >90٪ من القوة القصوى34. وعلى هذا النحو، يجب أن تكون أطوال القطعة العضلية هذه كافية لتحديد الاختلافات في وظيفة الألياف بين النماذج الجينية المختلفة أو بعد العلاجات الدوائية. بالإضافة إلى ذلك ، يوفر تضمين الألياف في هيدروجيل العديد من النقاط الإضافية للالتصاق مقارنة بالألياف المستزرعة 2D العائمة ، والتي من شأنها أن تحد من تقصير القطعة العضلية بمرور الوقت.
تتمثل إحدى مزايا بروتوكول عزل الألياف العضلية هذا في استخدام عضلة سريعة الارتعاش سهلة التشريح تتكون من ألياف عضلية صغيرة نسبيا عند مقارنتها بالعضلات الأخرى ، مثل الباسطة الرقمية الطويلة (EDL). حجمها الأصغر يجعل عزل العضلات أكثر ملاءمة للفصل القائم على التثليج ، مما يقلل من فرصة حدوث تلف ناتج عن الماصة أو التشابك لألياف العضلات. يمكن هضم المصفوفة خارج الخلية لعضلات FDB بسهولة إنزيميا باستخدام الكولاجين ، مما يسمح بعزل مئات الألياف العضلية في فترة زمنية قصيرة. ومع ذلك ، يمكن أن يؤدي فرط الهضم إلى تلف ألياف العضلات. يمكن التعرف على فرط هضم ألياف العضلات عندما تنهار العضلات على الفور تقريبا عند تنقيط العضلات أو عندما يتم تقلص نسبة كبيرة من حجم الخلية بشكل مفرط أثناء إجراء بذر الخلايا. لمنع فرط هضم العضلات ، يجب تحسين وقت الهضم لكل دفعة كولاجيناز. لاختبار ذلك ، يجب هضم عضلتين FDB بالتوازي مع وقت هضم متداخل يبلغ 5 دقائق بينهما. يجب اختيار وقت الهضم مع أعلى عائد من ألياف العضلات القابلة للحياة. يجب بعد ذلك إجراء هذا التحسين مرة ثانية ، مرة أخرى مع 5 دقائق من الفصل في وقت الهضم. يجب استخدام وقت الهضم الذي ينتج أعلى ألياف عضلية قابلة للحياة كوقت هضم مثالي للدفعة الحالية من الكولاجيناز. هناك طريقة أخرى للحد من تباين الكولاجيناز من دفعة إلى دفعة وهي حساب وحدات النشاط لكل ملليلتر من محلول المخزون مباشرة ثم إعادة تكوين دفعات كولاجيناز اللاحقة بنفس المقدار. أخيرا ، قد تحتاج أوقات الهضم إلى التحسين عبر سلالات الفئران المختلفة ، على سبيل المثال ، إذا كانت دراسة الحيوانات المسنة أو المريضة التي تظهر زيادة في ترسب المصفوفة خارج الخلية35,36.
إن إمكانية سحب ألياف العضلات المعزولة القابلة للحياة تفتح إمكانيات لاستزراع ألياف العضلات FDB في ظروف الاستزراع المختلفة. أحد هذه الخيارات هو زراعة هذه الألياف في الهلاميات المائية لتقليد بيئة زراعة الأنسجة الأصلية. يضمن بروتوكول التضمين هذا بقاء الألياف في مكانها أثناء القياسات المقلصة وقد تم تحسينها للسماح للألياف بالاستقرار في قاع اللوحة قبل تثبيت الهلام. ومع ذلك ، قد يحتاج هذا البروتوكول إلى التعديل لاستيعاب الاختلافات في مخزون الثرومبين والفيبرينوجين. إذا كان نشاط الثرومبين مرتفعا جدا ، فسوف يتماسك الجل قبل الأوان ، وقد تظل الألياف معلقة في مواقع أعلى خارج المستوى البؤري للمجهر. إذا حدث هذا ، فإن الثرومبين: نسبة الفيبرينوجين تحتاج إلى تعديل. يمكن اختبار ذلك عن طريق طلاء الألياف بتركيزات أقل من الثرومبين بشكل متزايد وملاحظة المدة التي تستغرقها البلمرة. عادة ، لا ينبغي أن يحدث هذا أسرع من 30 دقيقة. ومع ذلك ، فإن وجود تركيز الثرومبين المنخفض جدا قد يضعف أيضا عملية البلمرة. هناك طريقة أخرى للتأكد من أن الألياف في المستوى البؤري الصحيح وهي زرعها أولا باستخدام بروتوكول 2D ثم إضافة طبقة من الهيدروجيل فوق الألياف بعد التصاقها بلوحة الاستزراع. ومع ذلك ، يجب على المرء أن يدرك أن إزالة الوسط من الألياف قد يؤدي إلى فرط الانكماش ، لأنها حساسة للجفاف. كما أنه من غير الواضح ما إذا كان الهيدروجيل سوف يلتصق بالكامل بلوحة الاستزراع ، وقد ينفصل بسهولة أكبر. لذلك ، يفضل إجراء التضمين هذا للحفاظ على الألياف قابلة للحياة وفي مكانها لقياسات الانكماش.
يتيح استخدام هذا البروتوكول دراسة ديناميكيات انقباض ألياف العضلات الناضجة خارج الجسم الحي ويمكن تطبيقه على كل من الفئران السليمة وتلك التي تحمل طفرات جينية للأمراض العضلية. وبالمثل ، فإنه يتيح اختبار كيفية تأثير ظروف الثقافة أو إضافة المركبات على وظيفة الألياف العضلية. تعطي البيانات المقلصة التي تم الحصول عليها باستخدام النظام القائم على البصريات مؤشرا على قدرة انقباض ألياف العضلات المفردة الحية ، ويمكن ربط التغييرات في هذه القدرة بصحة الألياف. ومع ذلك، فإن هذه البيانات وحدها ليست كافية لتحديد ما إذا كانت هذه التغييرات تحدث في مراحل الجسور المتقاطعة للأكتين-الميوسين أو إطلاق الكالسيوم لانقباض العضلات. على الرغم من أننا لا نصف طرق قياس إشارات الكالسيوم في هذا البروتوكول ، إلا أن هذا الإعداد قادر أيضا على قياس عابرات الكالسيوم القائمة على Fura في خلايا العضلاتالمنقبضة 29. عيب هذا النظام هو أن عضلة FDB تحتوي فقط على ألياف عضلية من النوع IIa / IIx سريعة النشل ، والعضلات التي تحتوي على ألياف من النوع الأول بطيئة النشل بهذا الحجم لم يتم وصفها بعد37. هذا يلغي القدرة على دراسة الأداء الخاص بنوع الألياف باستخدام هذه الطريقة. يمكن تكييف البروتوكول الذي نقترحه هنا مع عضلات أخرى مثل EDL أو النعل لدراسة الاختلافات في نوع الألياف. نظرا لحجمها الأكبر ، سيحتاج هذا البروتوكول إلى مزيد من التحسين لهذه العضلات. تميل الألياف الأطول إلى التشابك أثناء خطوة ترسيب الجاذبية وسوف تتمزق إذا تم التلاعب بها عن طريق السحب ، مما قد يؤدي إلى انخفاض الغلة. نظرا لعدم توافقها مع السحب ، فإن الألياف الأطول تكون أيضا أقل توافقا مع تقنية تضمين الهلام. لا يزال من الممكن إجراء قياسات هذه الألياف بتنسيق ثقافة 2D ، ولكن قد تتحرك الألياف أكثر أثناء الانكماش بسبب حجمها ، مما يؤثر على نسبة الإشارة إلى الضوضاء. هناك قيد آخر لهذا النظام وهو عدم القدرة على إجراء قياسات القوة جنبا إلى جنب مع القياسات المقلصة ، مثل قياسات القوة التي يمكن الحصول عليها باستخدام مستحضرات الألياف العضلية السليمة الأخرى28. ومع ذلك ، يمكن التحايل على هذا القيد عن طريق تقدير القوة الناتجة عن الألياف العضلية. يمكن تقدير القوة المتولدة للألياف العضلية إذا كان شكل الألياف العضلية أثناء حالات الانقباض والاسترخاء وكذلك معامل يونغ للمصفوفة معروفا25. ومع ذلك ، يوفر هذا النظام القائم على البصريات نهجا سهل الاستخدام وعالي الإنتاجية لدراسة وظيفة انقباض العضلات ويفتح مجموعة من الاحتمالات الجديدة لدراسة أمراض العضلات الوراثية والتدخلات العلاجية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
يود المؤلفون أن يشكروا سيلفيا بوجاردز وسانا لويجكس وفالنتين يانسن وميشيل هيلمز وإيمي ماندرز على خبرتهم الفنية في المساعدة في تطوير هذا البروتوكول. تم دعم هذا العمل بجوائز من جمعية ضمور العضلات (جائزة التطوير MDA603238 إلى TJK) ، والتحالف الهولندي للقلب والأوعية الدموية (منحة المواهب إلى TJK) ، والمجلس الوطني للصحة والبحوث الطبية (NHMRC ، أستراليا. زمالة APP1121651 إلى M.Y).
Materials
| Name | Company | Catalog Number | Comments |
| Aprotinin, from Bovine Lung | Thermo Scientific | AAJ63039MC | 100 mM stock solution in PBS can be stored at -20 °C. Sterilize stock solution using a 0.22 µm filter. |
| Collagenase type 2 | Worthington | 77336 | 10% (w/v) stock solution can be stored at -20 °C. Weighing collagenase should be done in a safety cabinet as inhalation is dangerous. |
| Fetal Bovine Serum | Thermo Fisher | 10500064 | |
| Fibrinogen from Bovine Plasma | Sigma Aldrich | 50-176-5054 | 20 mg/mL stock solution in PBS can be stored at -80 °C. Sterilize stock solution using a 0.22 µm filter. |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher | A1413201 | 4 mg/mL stock solution is prepared in MEM and stored at -20 °C. |
| Gibco MEM High glucose + pyruvate | Thermo Fisher | 11095080 | |
| Horse serum | Thermo Fisher | H1270 | |
| Matrigel GFR Membrane Matrix | Corning | CB-40230 | 4 mg/mL stock solution is prepared in MEM and stored at -20 °C. |
| Penicillin/Streptomycin | Sigma Aldrich | P4333 | |
| Serum Replacement 2 (50x) | Sigma Aldrich | S9388 | |
| Thrombin, Bovine Plasma | Thermo Scientific | AAJ63383EXP | 125 U/mL stock in PBS can be stored at -20 °C. Sterilize stock solution using a 0.22 µm filter. |
| Tranexamic Acid | Thermo Scientific | AC228042500 | 80 mM stock solution in PBS can be stored at -20 °C. Sterilize stock solution using a 0.22 µm filter. |
| Equipment | |||
| 24-well electrical stimulator | IonOptix | N/a | |
| Dumont #55 Forceps | Fine Science Tools | 11295-51 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| MultiCell Cytocypher | IonOptix | N/a | |
| MyoCam-S3 | IonOptix | N/a | |
| MyoPacer | IonOptix | N/a | |
| SYLGARD 184 silicone elastomer, Base & Curing Agent | Dow corning | N/a | |
| Vannas Spring Scissor - 25 mm Cutting Edge | Fine Science Tools | 15002-08 | |
| Software | |||
| CytoSolver | IonOptix | N/a | |
| IonWizard | IonOptix | N/a |
References
- Smith, L. R., Meyer, G. A. Skeletal muscle explants: Ex-vivo models to study cellular behavior in a complex tissue environment. Connective Tissue Research. 61 (3-4), 248-261 (2020).
- Khodabukus, A., Prabhu, N., Wang, J., Bursac, N. In vitro tissue-engineered skeletal muscle models for studying muscle physiology and disease. Advanced Healthcare Materials. 7 (15), 1701498 (2018).
- Fernandez-Costa, J. M., Fernandez-Garibay, X., Velasco-Mallorqui, F., Ramon-Azcon, J. Bioengineered in vitro skeletal muscles as new tools for muscular dystrophies preclinical studies. Journal of Tissue Engineering. 12, 2041731420981339 (2021).
- Romagnoli, C., Iantomasi, T., Brandi, M. L. Available in vitro models for human satellite cells from skeletal muscle. International Journal of Molecular Sciences. 22 (24), 13221 (2021).
- Dessauge, F., Schleder, C., Perruchot, M. -. H., Rouger, K. 3D in vitro models of skeletal muscle: Myopshere, myobundle and bioprinted muscle construct. Veterinary Research. 52 (1), 72 (2021).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell Biology International. 37 (2), 191-196 (2013).
- Guo, X., et al. In vitro differentiation of functional human skeletal myotubes in a defined system. Biomaterials Science. 2 (1), 131-138 (2014).
- Denes, L. T., et al. Culturing C2C12 myotubes on micromolded gelatin hydrogels accelerates myotube maturation. Skeletal Muscle. 9 (1), 17 (2019).
- Pimentel, M. R., Falcone, S., Cadot, B., Gomes, E. R. In vitro differentiation of mature myofibers for live imaging. Journal of Visualized Experiments. (119), e55141 (2017).
- Khodabukus, A. Tissue-engineered skeletal muscle models to study muscle function, plasticity, and disease. Frontiers in Physiology. 12, 619710 (2021).
- Engler, A. J., et al. Myotubes differentiate optimally on substrates with tissue-like stiffness: Pathological implications for soft or stiff microenvironments. Journal of Cell Biology. 166 (6), 877-887 (2004).
- Huang, N. F., et al. Myotube assembly on nanofibrous and micropatterned polymers. Nano Letters. 6 (3), 537-542 (2006).
- Earle, A. J., et al. Mutant lamins cause nuclear envelope rupture and DNA damage in skeletal muscle cells. Nature Materials. 19 (4), 464-473 (2020).
- Stange, K., Ahrens, H. E., von Maltzahn, J., Rontgen, M. Isolation and ex vivo cultivation of single myofibers from porcine muscle. In Vitro Cellular and Developmental Biology. Animal. 56 (8), 585-592 (2020).
- Ravenscroft, G., et al. Dissociated flexor digitorum brevis myofiber culture system--A more mature muscle culture system. Cell Motility and the Cytoskeleton. 64 (10), 727-738 (2007).
- Ramsey, R. W., Street, S. F. The isometric length-tension diagram of isolated skeletal muscle fibers of the frog. Journal of Cellular and Comparative Physiology. 15 (1), 11-34 (1940).
- Selvin, D., Hesse, E., Renaud, J. M. Properties of single FDB fibers following a collagenase digestion for studying contractility, fatigue, and pCa-sarcomere shortening relationship. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 308 (6), R467-R479 (2015).
- Renzini, A., et al. Culture conditions influence satellite cell activation and survival of single myofibers. European Journal of Translational Myology. 28 (2), 7567 (2018).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and culture of individual myofibers and their satellite cells from adult skeletal muscle. Journal of Visualized Experiments. (73), e50074 (2013).
- Holmberg, J., Durbeej, M. Laminin-211 in skeletal muscle function. Cell Adhesion and Migration. 7 (1), 111-121 (2013).
- Stuelsatz, P., Keire, P., Yablonka-Reuveni, Z. Isolation, culture, and immunostaining of skeletal muscle myofibers from wildtype and nestin-GFP mice as a means to analyze satellite cell. Methods in Molecular Biology. 1556, 51-102 (2017).
- Alkhateeb, H., Chabowski, A., Bonen, A. Viability of the isolated soleus muscle during long-term incubation. Applied Physiology, Nutrition, and Metabolism. 31 (4), 467-476 (2006).
- Roche, S. M., Gumucio, J. P., Brooks, S. V., Mendias, C. L., Claflin, D. R. Measurement of maximum isometric force generated by permeabilized skeletal muscle fibers. Journal of Visualized Experiments. (100), e52695 (2015).
- Ottenheijm, C. A., et al. Altered myofilament function depresses force generation in patients with nebulin-based nemaline myopathy (NEM2). Journal of Structural Biology. 170 (2), 334-343 (2010).
- Rausch, M., et al. Measurement of skeletal muscle fiber contractility with high-speed traction microscopy. Biophysical Journal. 118 (3), 657-666 (2020).
- de Winter, J. M., et al. KBTBD13 is an actin-binding protein that modulates muscle kinetics. Journal of Clinical Investigation. 130 (2), 754-767 (2020).
- Wijnker, P. J. M., vander Velden, J. Mutation-specific pathology and treatment of hypertrophic cardiomyopathy in patients, mouse models and human engineered heart tissue. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1866 (8), 165774 (2020).
- Cheng, A. J., Westerblad, H. Mechanical isolation, and measurement of force and myoplasmic free [Ca(2+)] in fully intact single skeletal muscle fibers. Nature Protocols. 12 (9), 1763-1776 (2017).
- Cao, L., Manders, E., Helmes, M. Automatic detection of adult cardiomyocyte for high throughput measurements of calcium and contractility. PLoS One. 16 (9), e0256713 (2021).
- Geckil, H., Xu, F., Zhang, X., Moon, S., Demirci, U. Engineering hydrogels as extracellular matrix mimics. Nanomedicine. 5 (3), 469-484 (2010).
- Lin, C. C., Anseth, K. S. PEG hydrogels for the controlled release of biomolecules in regenerative medicine. Pharmaceutical Research. 26 (3), 631-643 (2009).
- Cold Spring Harbor Protocols. Sylgard-coated coverslips and petri dishes. Cold Spring Harbor Protocols. 2022 (8), (2022).
- Moo, E. K., Fortuna, R., Sibole, S. C., Abusara, Z., Herzog, W. In vivo sarcomere lengths and sarcomere elongations are not uniform across an intact muscle. Frontiers in Physiology. 7, 187 (2016).
- Moo, E. K., Leonard, T. R., Herzog, W. The sarcomere force-length relationship in an intact muscle-tendon unit. Journal of Experimental Biology. 223, 215020 (2020).
- Schuler, S. C., et al. Extensive remodeling of the extracellular matrix during aging contributes to age-dependent impairments of muscle stem cell functionality. Cell Reports. 35 (10), 109223 (2021).
- Carberry, S., Zweyer, M., Swandulla, D., Ohlendieck, K. Proteomics reveals drastic increase of extracellular matrix proteins collagen and dermatopontin in the aged mdx diaphragm model of Duchenne muscular dystrophy. International Journal of Molecular Medicine. 30 (2), 229-234 (2012).
- Tarpey, M. D., et al. Characterization and utilization of the flexor digitorum brevis for assessing skeletal muscle function. Skeletal Muscle. 8 (1), 14 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved