Method Article
Hochdurchsatz-Kontraktionsmessungen von Hydrogel-eingebetteten intakten Muskelfasern der Maus mit einem optikbasierten System
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die Funktion der Skelettmuskulatur kann durch die Quantifizierung der Kontraktilität isolierter Muskelfasern beurteilt werden, wobei traditionell mühsame Ansätze mit niedrigem Durchsatz verwendet werden. Hier beschreiben wir eine optikbasierte Hochdurchsatzmethode zur Quantifizierung der Kontraktilität von Hydrogel-eingebetteten Muskelfasern. Dieser Ansatz hat Anwendungen für das Wirkstoffscreening und die therapeutische Entwicklung.
Zusammenfassung
Die In-vitro-Zellkultur ist ein leistungsfähiges Werkzeug, um zelluläre Prozesse zu beurteilen und therapeutische Strategien zu testen. Für die Skelettmuskulatur sind die gebräuchlichsten Ansätze entweder die Differenzierung myogener Vorläuferzellen in unreife Myotuben oder die kurzfristige ex vivo Kultur isolierter einzelner Muskelfasern. Ein wesentlicher Vorteil der Ex-vivo-Kultur gegenüber der In-vitro-Kultur ist die Beibehaltung der komplexen zellulären Architektur und der kontraktilen Eigenschaften. In dieser Arbeit beschreiben wir ein experimentelles Protokoll für die Isolierung von intakten Muskelfasern des Flexor digitorum brevis aus Mäusen und deren anschließende ex vivo Kultur. Bei diesem Protokoll werden die Muskelfasern in ein Hydrogel auf Fibrinbasis und Basalmembranmatrix eingebettet, um die Fasern zu immobilisieren und ihre kontraktile Funktion aufrechtzuerhalten. Anschließend beschreiben wir Methoden zur Beurteilung der kontraktilen Funktion der Muskelfaser mit Hilfe eines optikbasierten Hochdurchsatz-Kontraktilitätssystems. Die eingebetteten Muskelfasern werden elektrisch stimuliert, um Kontraktionen zu induzieren, woraufhin ihre funktionellen Eigenschaften, wie Sarkomerverkürzung und Kontraktionsgeschwindigkeit, mit Hilfe einer optischen Quantifizierung bewertet werden. Die Kopplung der Muskelfaserkultur mit diesem System ermöglicht Hochdurchsatztests der Auswirkungen pharmakologischer Wirkstoffe auf die kontraktile Funktion und Ex-vivo-Studien zu genetischen Muskelerkrankungen. Schließlich kann dieses Protokoll auch angepasst werden, um dynamische zelluläre Prozesse in Muskelfasern mit Hilfe der Lebendzellmikroskopie zu untersuchen.
Einleitung
Fortschritte in der In-vitro-Zellkulturtechnik haben neue Möglichkeiten eröffnet, die Regenerationsfähigkeit von Gewebe, pathophysiologische zelluläre Mechanismen und anschließende therapeutische Strategien zu untersuchen und dabei Säugetiergewebe unter gut kontrollierten Bedingungen zu verwenden 1,2,3. Der Einsatz von In-vitro-Kultursystemen ist in der Muskelforschung gut etabliert 4,5. Im Allgemeinen werden in vitro differenzierte unreife Myotuben aus myogenen Vorläuferzellen verwendet 2,6,7,8. Obwohl Fortschritte im Differenzierungsprotokoll erzielt wurden, um reifere Muskelfasern zu erzeugen9, schränkt ihre Unreife die Übertragung der Ergebnisse auf eine In-vivo-Umgebung immer noch ein 1,10. Ein zentrales Problem auf dem Gebiet der Muskelbiologie ist die Unfähigkeit von in vitro differenzierten Myotuben, die komplexen intrazellulären Strukturen, zellulären Signalprozesse und extrazellulären Interaktionen, die in nativem Muskelgewebe beobachtet werden, vollständig zu verkörpern und vor allem die von Muskelfasern erzeugten kontraktilen Kräfte zu rekapitulieren 1,2,10,11,12 . Darüber hinaus führt die unkoordinierte Kontraktion von Myotuben während des Differenzierungsprozesses häufig zu einer spontanen Ablösung von den Kulturschalen, was die kontraktile Beurteilung von in vitro differenzierten Myotuben schwierig macht und auf eine qualitative oder semiquantitativeBewertung beschränkt 8,11,12,13. Diese Einschränkungen erfordern häufig regelmäßige In-vivo-Experimente mit Tieren, insbesondere wenn die Muskelkontraktilität ein primäres Versuchsergebnis ist1.
Eine Alternative zur Kultivierung von in vitro differenzierten Myotuben ist die ex vivo Kultur isolierter reifer Muskelfasern 1,14. Bei der Ex-vivo-Kultur wird entwicklungsreifes Muskelgewebe aus dem Körper herausgeschnitten, gefolgt von einer Einzelzellisolierung zur Kultivierung unter Laborbedingungen 1,14. Die isolierten reifen Muskelfasern behalten ihre komplexen zellulären Strukturen bei, die im nativen Gewebe beobachtet werden14,15, und diese Methode eröffnet die Möglichkeit für direkte Eingriffe, wie z. B. genetische Manipulation und Drogenscreening, in einer genau definierten und kontrollierbaren Kulturumgebung. Einer der ersten Berichte über die Isolierung von Skelettmuskelfasern und die Ex-vivo-Kultur stammt aus den 1930er Jahren. Die Ausbeute an lebensfähigen Fasern aus diesem Protokoll war jedoch gering16. Mit der kontinuierlichen Optimierung des Isolationsverfahrens und der Kulturbedingungen ist nun eine signifikante Verbesserung der Menge an lebensfähigen und funktionellen Muskelfasern möglich 14,15,17,18,19. Eine solche Verbesserung der Kulturbedingungen besteht darin, Kulturschalen mit extrazellulären Matrixproteinen zu beschichten, um die Adhärenz der isolierten Muskelfasern auf der Kulturschale zu fördern15,18,20. In der Regel wird eine Lamininbeschichtung verwendet, da Laminin eines der am häufigsten vorkommenden Elemente in der extrazellulären Matrix der Muskeln ist20,21. Die Optimierung des Isolationsverfahrens in Kombination mit der Beschichtung der Kulturschalen hat es der Muskelforschung ermöglicht, isolierte lebensfähige Muskelfasern mit intakter zellulärer Architektur und kontraktiler Funktionalität für kurze Zeiträume in Kultur zu halten 1,15,18,22.
Der gebräuchlichste Ansatz, der im Muskelfeld zur Messung von Kraft und Kontraktionsfähigkeiten verwendet wird, besteht darin, einzelne Muskelfasern zwischen einem Längentreibermotor und einem Kraftaufnehmerzu montieren 23,24. Im Allgemeinen werden die Muskelfasern, die für diese motorgetriebenen Setups verwendet werden, entweder aus schockgefrorenem oder frischem Gewebe präpariert, gefolgt von einer Permeabilisierung oder "Enthäutung", die eine externe Kalziumaktivierung ermöglicht, bei der unterschiedliche Kalziumkonzentrationen verwendet werden, um die Muskelfaserkontraktion zu induzieren24. Obwohl diese Methode der Goldstandard für kontraktile Messungen von Muskelfasern ist, kann jeweils nur eine einzelne Muskelfaser gemessen werden, was diese Technik zu einem mühsamen und zeitaufwändigen Verfahren macht25. Darüber hinaus stört das Isolations- und Enthäutungsverfahren der Muskelfasern die verschiedenen Strukturen, die an der Kopplung von Erregung und Kontraktion beteiligt sind (d. h. die Freisetzung von Kalzium und die anschließende Wiederaufnahme in das sarkoplasmatische Retikulum), wodurch die Untersuchung der Relaxationskinetik und aller Krankheiten, die diesen Prozess beeinflussen könnten, nicht möglich ist26,27. Eine Alternative zur Präparation von Skinnfasern ist die mechanische Dissektion zur Isolierung intakter Muskelfasern, bei denen kontraktile Kräfte als Reaktion auf die elektrische Aktivierung gemessen werden können28; Dieser Ansatz ist jedoch technisch anspruchsvoll und sehr zeitaufwändig, was zu Messungen mit geringem Durchsatz führt. Schließlich werden sowohl bei gehäuteten als auch bei intakten Präparaten die Muskelzellen während kontraktiler Messungen 24 vollständig aus der extrazellulären Umgebung entfernt, was die Untersuchung des Einflusses der Zusammensetzung/Steifigkeit der extrazellulären Matrix auf die Muskelfaserkontraktion24 unmöglich macht. Daher ist die Entwicklung alternativer Methoden erforderlich, um Messungen der Muskelfaserkontraktilität isolierter intakter Muskelfasern in einem Hochdurchsatz zu ermöglichen und gleichzeitig die Verbindung zwischen Muskelfasern und der extrazellulären Matrix wiederherzustellen.
Kürzlich wurde ein neuer optikbasierter Ansatz für Hochdurchsatzmessungen der Muskelfaserkontraktilität entwickelt29. Dieses auf Optik basierende System misst die Periodizität von Sarkomen, um die Sarkomerlänge während der Kontraktion mit Hilfe von Hochgeschwindigkeitsbildgebung zu bestimmen. Innerhalb dieses Systems bleiben die Zellen in der Kulturschale an Ort und Stelle, während die Optik bewegt wird, wodurch die Zeit, die zwischen den Messungen mehrerer Zellen29 benötigt wird, minimiert wird. Ein großer Vorteil dieses optischen Hochdurchsatzansatzes besteht darin, dass er die Entwicklung von Kulturbedingungen ermöglicht, die denen des nativen Gewebes ähneln. Ein Ansatz, der zur Nachahmung nativer In-vivo-Bedingungen verwendet wird, ist die Einbettung von Zellen in Hydrogele30. Typischerweise ist ein Hydrogel ein viskoelastisches Material, das in der Lage ist, sein Volumen und seine Form beizubehalten, und Hydrogele haben die Eigenschaften sowohl fester als auch flüssiger Materialien31. Der feste Teil besteht aus miteinander vernetzten Polymerketten, wodurch eine Struktur entsteht, die einem Netzähnelt 30,31. Die Materialeigenschaften von Hydrogelen können so eingestellt werden, dass sie die Matrixablagerung von Muskeln nachahmen30,31. Die Kombination eines optischen Hochdurchsatzsystems mit in Hydrogelen eingebetteten Zellen eröffnet somit neue Möglichkeiten, die Auswirkungen der Zusammensetzung der extrazellulären Matrix und der mechanischen Eigenschaften auf die Funktionalität der Muskelfaser zu bewerten.
Das übergeordnete Ziel dieser Arbeit ist es, 1) die Methodik für die enzymatische Isolierung und Ex-vivo-Kultur von Muskelfasern unter Bedingungen, die die native Gewebeumgebung nachahmen, zu beschreiben und 2) die Kontraktilität der Muskelfasern unter Verwendung eines Hochdurchsatzansatzes zu bewerten. Wir beschreiben eine detaillierte Methodik zur einfachen Isolierung einer großen Anzahl einzelner Muskelfasern aus dem Musculus flexor digitorum brevis (FDB) mittels enzymatischer Verdauung. Darüber hinaus beschreiben wir eine Technik, bei der die isolierten Muskelfasern in ein Hydrogel auf Fibrinbasis eingebettet werden, um die natürliche Umgebung der Muskeln nachzuahmen und die Lebensfähigkeit und Kontraktilität der Muskelfasern zu verbessern. Anschließend skizzieren wir eine Hochdurchsatzmethode zur Messung lebender Muskelfaserkontraktionen in vitro mit diesem kürzlich entwickelten System. Ein weiterer Vorteil dieses Einbettungsverfahrens ist die Immobilisierung der Fasern während der Kontraktion, was das Signal-Rausch-Verhältnis dieser Messungen verbessern kann. Diese Geleinbettungsmethode ist sowohl für Einzelpolymer- als auch für Kompositgelverkapselungsverfahren anwendbar und erleichtert die Beurteilung der Auswirkungen der Zusammensetzung der extrazellulären Matrix auf die Kontraktilität der Muskelfasern.
Protokoll
Für die Ex-vivo-Kontraktionsstudien wurde mit Genehmigung des niederländischen Tierversuchsgesetzes postmortales Gewebe von Tieren gewonnen, die für andere genehmigte Forschungsprojekte und/oder Zuchtüberschüsse der VU-Universität gemäß der Richtlinie des Europäischen Rates (2010/63/EU) geopfert wurden.
1. Materialvorbereitung
- Bereiten Sie die Pipetten für die Verreibung vor (lagern Sie sie bis zur Verwendung in 70%igem Ethanol in einem Durchflussschrank). Schneiden Sie die Enden von zwei P1.000-Spitzen ab, um unterschiedliche Lochgrößen zu erstellen. Stellen Sie sicher, dass das Loch gerade groß genug ist, damit der Muskel hindurchgehen kann, ohne die Pipette zu blockieren. Führen Sie die geschnittenen Enden durch eine Flamme, damit sie glatt werden.
- Bereiten Sie Sylgard-Gerichte wie an anderer Stelle32 beschrieben vor und sterilisieren Sie sie im Voraus mit 70 % Ethanol, um die Pfote und den Muskel während der Isolierung zu sichern.
Anmerkungen: Sylgard-Geschirr kann nach gründlicher Reinigung mit deionisiertem Wasser und 70 % Ethanol wiederverwendet werden. - Bereiten Sie vor dem Isolierungsverfahren die folgenden Lösungen vor: Dissektionsmedium, Fibrinkulturmedium und Muskelaufschlussmedium (siehe Tabelle 1).
Anmerkungen: Das Muskelaufschlussmedium sollte mit einem 0,22-μm-Filter filtersterilisiert werden. Alle hergestellten Lösungen sollten vor der Verwendung in einem Standard-Zellkultur-Inkubator bei 37 °C und 5 % CO2 für mindestens 30 Minuten äquilibriert werden. - Bereiten Sie nach der Muskelverdauung die folgenden Lösungen zum Gießen des Hydrogels vor: Zellmischung und Matrixmischung (siehe Tabelle 2). Kombinieren Sie die Zellmischung und die Matrixmischung im Verhältnis 1:1 für eine endgültige Fibrinkonzentration von 2,5 mg/ml.
Anmerkungen: Bereiten Sie die Matrix auf Eis vor und verwenden Sie vorgekühlte Pipettenspitzen, um eine vorzeitige Polymerisation der Basalmembranmatrix zu verhindern. Das hier verwendete Thrombin:Fibrinogen-Verhältnis von 1:10 (Einheiten pro mg Fibrinogen) wurde für eine Polymerisationszeit von 30 min optimiert. Wenn das Gel innerhalb von 30 min polymerisiert, sollte eine niedrigere Thrombinkonzentration verwendet werden. Weitere Informationen finden Sie in der Diskussion.
2. FDB-Muskeldissektion
- Euthanasieren Sie die Maus durch Zervixluxation. Desinfizieren Sie die Hintergliedmaßen mit 70%igem Alkohol.
- Schneiden Sie das untere Hinterbein oberhalb des Knöchels ab. Schneiden Sie die Haut auf der Rückenseite des Fußes in Richtung Zehen auf.
HINWEIS: Schneiden Sie das untere Hinterbein am Sprunggelenk ab, um Schäden an den Muskeln der unteren Gliedmaßen und des Schienbeins zu vermeiden, falls sie später benötigt werden. - Schälen Sie die Haut vorsichtig zu den Zehen hin. Achten Sie darauf, den Muskel nicht zu beschädigen. Der FDB ist der oberflächlichste Muskel auf der ventralen Seite des Fußes.
- Legen Sie den präparierten Fuß in eine Sylgard-Schale mit 10 ml vorgewärmtem Präpariermedium bei 37 °C. Stecken Sie den Fuß durch die Haut, die noch an den Zehen befestigt ist, und stecken Sie den Unterschenkel über den Knöchel hinaus fest.
- Entfernen Sie vorsichtig das Bindegewebe auf der Oberseite des Muskels. Durchtrennen Sie die Sehne an der Ferse und heben Sie den Muskel an der Sehne an.
- Schneiden Sie entlang und unter dem Muskel durch das Bindegewebe. Schneiden Sie weiter, bis die Zehensehnen freiliegen.
- Wenn die Hälfte der Länge der drei Sehnen freiliegt, schneiden Sie die Sehnen ab und lösen Sie den Muskel vom Fuß. OPTIONAL: Schneiden Sie die vierte Seitensehne und ihre Muskelfasern ab.
- Reinigen Sie das Bindegewebe vom Muskel und geben Sie es in ein Röhrchen mit vorgewärmtem Präziermedium.
3. FDB-Muskelverdauung
- Bereiten Sie das Muskelverdauungsmedium gemäß Tabelle 1 vor.
- Übertragen Sie die FDB-Muskeln mit einer serologischen Pipette auf das Muskelaufschlussmedium. In einem Gewebekultur-Inkubator bei 37 °C und 5 % CO2 für 80 min inkubieren.
HINWEIS: Diese Zeit sollte für jede Kollagenase-Charge optimiert werden. Die Verdauung ist abgeschlossen, wenn der Muskel auszufransen beginnt und vergrößert aussieht. Siehe die Diskussion zur Optimierung der Verdauungszeit. - Nach der Verdauung wird der Muskel in ein 15-ml-Röhrchen mit 3 ml Präpariermedium überführt und vor der Verreibung 30 Minuten lang inkubiert.
4. FDB-Muskelverreibung und Schwerkraftsedimentation
- Verreiben Sie den Muskel mit den zuvor vorbereiteten Verreibungsspitzen (Schritt 1.1), indem Sie den Muskel von der größten zur kleinsten Größe pipettieren. Wenn dieser Schritt länger als 5 Minuten dauert, legen Sie den Muskel für 5 Minuten in den Inkubator, damit er ruhen kann.
- Tritutieren, bis sich die Muskelfasern größtenteils von der Sehne gelöst haben und die Sehne durch eine P200-Spitze gehen kann. Entfernen Sie die Sehnen.
- Geben Sie die dissoziierten FDB-Fasern in ein 15-ml-Röhrchen mit 10 ml Dissektionsmedium und lassen Sie die Fasern 20 Minuten lang im Inkubator absetzen. Beobachten Sie das gebildete Pellet.
- Optional: Entfernen Sie 10 ml Medium von oben und wiederholen Sie Schritt 4.3. Dieser Schritt erleichtert die Entfernung von überschüssigem Schmutz und damit verbundenen einkernigen Zellen.
5. Einbettung von FDB-Fasern
- Entfernen Sie vorsichtig das gesamte Medium von der Oberseite des Faserpellets. Resuspendieren Sie die Zellen in 875 μl Zellmischung pro FDB-Muskel (auf Eis).
HINWEIS: Ein FDB-Muskel liefert genug Fasern für sieben Vertiefungen einer 24-Well-Platte. Diese Dichte kann je nach Bedarf des Experiments angepasst werden. Das folgende Gelvolumen (250 μL) ist für ein 24-Well-Format optimiert, kann aber für andere Formate entsprechend skaliert werden. - Aliquot 125 μl der Zellmischung in einzelne Mikrozentrifugenröhrchen.
- Geben Sie eine Vertiefung nach der anderen 125 μl Matrixmischung zu einem Zellsuspensionsaliquot und mischen Sie, indem Sie vorsichtig auf und ab pipettieren, um die Bildung von Blasen zu vermeiden.
- Übertragen Sie die endgültige Mischung sofort in eine Vertiefung.
Anmerkungen: Achten Sie darauf, die Mischung in die Mitte der Vertiefung zu pipetieren. Wiederholen Sie Schritt 5.3 und Schritt 5.4 für jede Vertiefung. - Verfestigen Sie die Gele in einem Inkubator für 30-45 Minuten. Nach dem Erstarren wird das Nährmedium vorsichtig in die Vertiefungen gegeben.
Anmerkungen: Durch schnelles Pipettieren kann sich das Hydrogel von der Vertiefung lösen. Ab diesem Zeitpunkt können die Fasern stimuliert und gemessen werden. Unserer Erfahrung nach kann es jedoch die Kontraktilität der Fasern verbessern, wenn man die Fasern 24 Stunden lang an die Kulturbedingungen anpassen lässt. - Für eine längere Kultur füllen Sie das Nährmedium alle 2 Tage um einen halben Wechsel auf. Entfernen Sie dazu die Hälfte des Nährmediums und ersetzen Sie es durch die gleiche Menge frisches Medium.
6. Optikbasierte kontraktile Messungen
- Schalten Sie das auf Optik basierende kontraktile Messsystem (siehe Materialtabelle), die Leuchtstofflampe, den elektrischen Schrittmacher und den Computer ein. Stellen Sie den elektrischen Stimulator auf 1,0 Hz, 10,0 V und eine Pulsdauer von 5,00 ms ein, um die isolierten Muskelfasern zu stimulieren.
- Setzen Sie die Platte in das Messsystem ein. Schließen Sie den Schrittmacher an den Schrittmachereinsatz an und setzen Sie ihn in die Kulturplatte ein.
- Öffnen Sie das Programm IonWizard und öffnen Sie eine neue Datei, indem Sie auf Datei (oben links auf dem Bildschirm) | Neu.
- Überprüfen Sie, ob sich das Programm auf dem richtigen Experiment, Skeletal Sarcomere, befindet, indem Sie auf Neu | Sammle Experiment. Um das Experiment zu ändern, klicken Sie auf das gewünschte Experiment und klicken Sie auf Hinzufügen. Wenden Sie für das Skelettsarkomer-Experiment die folgenden Einstellungen an: Sarc 20x, Durchschnittliche Linien, Einzel-FFT, 250 Hz Abtastrate und eine Erfassungszeit von 10 s.
HINWEIS: Die Versuchseinstellungen sollten vor dem Experiment vorbereitet werden. Die Einstellungen können an die Bedürfnisse des Experiments angepasst werden. - Stellen Sie die Temperatur des Messsystems auf 25 °C ein. Klicken Sie in der Symbolleiste auf Open Cell Finder und warten Sie, bis ein neuer Bildschirm angezeigt wird. Wählen Sie oben rechts auf diesem Bildschirm den Plattentyp und die aktiven Vertiefungen aus.
HINWEIS: Die Messungen werden bei 25 °C durchgeführt, um die Kontraktionsgeschwindigkeit der schnell zuckenden FDB-Muskelfasern zu reduzieren und so eine Unterabtastung des kontraktilen Ereignisses zu verhindern. - Bringen Sie die Fasern in den Fokus, indem Sie den Fokus-Schieberegler anpassen. Alternativ können Sie für diese Fokussierfunktion die W-Taste und die S-Taste verwenden.
- Aktivieren Sie die Stimulation, um die elektrische Stimulation zu starten. Beobachte, dass die Fasern nun anfangen zu zucken.
Anmerkungen: Wenn keine Fasern zucken, stellen Sie sicher, dass alle Drähte angeschlossen sind und der Schrittmacher vollständig untergetaucht ist. Wenn danach immer noch keine Bewegung stattfindet, reagieren die Fasern möglicherweise aufgrund von Überverdauung oder übermäßiger Schädigung während der Verreibung nicht. - Fokussieren Sie den Messbereich so auf das Ende einer Faser, dass die Sarkomere senkrecht verlaufen. Stellen Sie sicher, dass die Sarkomere scharf sind. Wenn die Sarkomere scharf sind, wird ein einzelner Peak in der Symbolleiste angezeigt. Während der Kontraktion verschiebt sich dieser Gipfel nach rechts, wenn sich das Sarkomer verkürzt.
HINWEIS: Der violette Messbereich kann vor Beginn des Experiments angepasst werden. Um eine ordnungsgemäße Messung zu gewährleisten, schließen Sie ~20 Sarkomere ein. Wenn sich dieser Peak während der Kontraktion verformt, kann dies darauf hindeuten, dass das Sarkomer während der Kontraktion verdeckt oder unscharf ist, was zu Rauschen führt. - Starten Sie das Experiment, indem Sie in der Symbolleiste auf Start klicken. Drücken Sie die Taste Q , um eine Messung zu starten, und warten Sie, bis das Programm 10 Kontraktionstransienten gemessen hat. Wenn mehr als vier Transienten rauschfrei aussehen, bestätigen Sie die Messung durch Drücken der Z-Taste . Wenn die Transienten zu viel Rauschen aufweisen, lehnen Sie die Messung ab, indem Sie die X-Taste drücken.
- Messen Sie zwischen 10 und 20 Fasern pro Bedingung. Die Positionen der zuvor gemessenen Fasern bleiben erhalten.
- Optional: Fügen Sie Verbindungen hinzu, danach können die Fasern an dieser Stelle erneut gemessen werden.
- Wenn das Experiment beendet ist, drücken Sie die Stopp-Taste in der unteren Symbolleiste, um das Fenster des Zellfinders zu schließen. Speichern Sie die Datei, und beginnen Sie eine neue Datei.
- Um die Daten zu analysieren, öffnen Sie das Programm "Cytosolver desktop". Klicken Sie auf Importieren und wählen Sie die zu analysierende(n) Datei(en) aus.
- Nachdem das Programm die Analyse abgeschlossen hat, suchen Sie nach blauen, roten und grauen Spitzen. Die blauen Spitzen sind Transienten, die vom Programm akzeptiert werden. Die roten Spitzen sind Transienten, die vom Programm zurückgewiesen werden, und die grauen Spitzen sind Transienten, die vom Benutzer zurückgewiesen werden.
HINWEIS: Die Ablehnungskriterien können in der Analysesoftware angepasst werden. Im Allgemeinen werden Werte zurückgewiesen, wenn sie eine maximale Ableitungsgrenze überschreiten, und Transienten werden basierend auf Kurvenanpassungswerten von R2 von <0,95 zurückgewiesen. - Klicken Sie auf Exportieren. Markieren Sie die folgenden Kästchen: Gemittelte transiente Daten und Export nach Excel.
- Wenn Sie fertig sind, schalten Sie alle Maschinen aus. Nehmen Sie die Kulturplatte heraus und entsorgen Sie sie. Reinigen Sie die Schrittmacherelektroden mit deionisiertem Wasser und 70%igem Ethanol.
Ergebnisse
Mit diesem Protokoll wurden einzelne FDB-Muskelfasern isoliert und in Hydrogel eingebettet. Eine Übersicht über das Verfahren zur Muskeldissektion ist in Abbildung 1 dargestellt. Der FDB-Muskel wird mit intakten Sehnen freigelegt und von den Faszien gelöst. Die Beibehaltung der Sehnen der Muskeln als Fixationspunkte minimiert mögliche Schäden an den Muskelfasern während des Isolationsverfahrens. Überschüssiges Bindegewebe kann abgeschnitten werden, um Ablagerungen und das Wachstum sekundärer Zelltypen zu reduzieren. Sobald der Muskel herausgeschnitten und ausreichend gereinigt wurde, wird der Muskel mit Hilfe von Kollagenase enzymatisch verdaut, und einzelne Muskelfasern werden durch Verreibung freigesetzt, bevor die isolierten Zellen in Hydrogele eingebettet werden. Durch die Isolierung von FDB-Muskelfasern entstehen relativ kurze Muskelfasern, die den Vorteil haben, dass sie leicht manipuliert werden können. Aufgrund ihrer Größe können FDB-Muskelfasern sicher pipettiert werden, ohne dass es zu Verwicklungen kommt, und lassen sich leicht in ein Hydrogel einbetten. Da einzelne Muskelfasern nicht sehr gut an Kulturplatten haften, sorgt die Einbettung der Fasern in Hydrogel dafür, dass die Fasern während der Zellkultur und der kontraktilen Messungen an Ort und Stelle bleiben. Darüber hinaus ermöglicht die Zugabe einer Basalmembranmatrix zum Fibringel Interaktionen zwischen den Muskelfasern und der Matrix, die die native In-vivo-Umgebung nachahmen. Isolierte einzelne Muskelfasern können manipuliert und nach der Isolation mehrere Tage lang in Kultur gehalten werden. In Abbildung 2 ist ein Beispiel für isolierte FDB-Fasern gezeigt, die in eine Hydrogelmatrix eingebettet sind. Die gesunden Fasern haben sichtbare Sarkomere und sind gerade gedehnt (blauer Pfeil), während die gekrümmten Fasern typischerweise beschädigt oder nicht lebensfähig sind (gelber Pfeil) und von den Messungen ausgeschlossen werden sollten. Hyperkontrahierte Fasern erscheinen als dunkel zusammengeballte Objekte in der Matrix (roter Pfeil). Wenn das Isolationsverfahren erfolgreich war, sollte der Anteil an gesunden Fasern ~75% betragen. Ein größerer Anteil an hyperkontrahierten Fasern deutet in der Regel auf eine Schädigung während des Isolationsvorgangs hin. Die Membran der Muskelfasern kann entweder durch eine Überverdauung des Muskels oder durch eine Schädigung der Fasern während der Verreibung geschädigt werden. Verreibungsschäden treten vor allem dann auf, wenn der Muskel unterverdaut ist und sich daher nicht so leicht löst.
Die Funktionalität und Viabilität der Fasern wurde durch kontraktile Messungen der Muskelfasern unter Verwendung eines optikbasierten Hochdurchsatz-Kontraktionsmesssystems bewertet. Das System gibt verschiedene Parameter aus, wie z. B. die Sarkomerlänge, den Prozentsatz der Sarkomerverkürzung, die Kontraktionsgeschwindigkeit und die Relaxationsgeschwindigkeit. Mit dem kontraktilen Messsystem kann die Sarkomerkontraktion pro Muskelfaser gemessen werden. Abbildung 3 zeigt Beispiele für Muskelfaserkontraktionen, die mit dem Messsystem gemessen wurden. Aus einem einzelnen Kontraktionstransienten werden die folgenden Parameter erhalten: Sarkomerlänge zu Beginn der Kontraktion, Kontraktionsdauer, Sarkomerlänge bei maximaler Kontraktion und Relaxationsdauer (Abbildung 3A). Diese Parameter werden verwendet, um den Prozentsatz der Verkürzungs-, Kontraktions- und Relaxationsgeschwindigkeiten von Sarkomeren zu berechnen. Bei Bedarf können auch durchschnittliche Geschwindigkeitswerte aus den Werten für die Dauer und die absolute Verkürzung berechnet werden. Eine valide Kontraktionsmessung zeichnet sich durch eine gerade Basislinie aus, gefolgt von einem Rückgang zum Höchststand und einer Rückkehr zur Basislinie (Abbildung 3A). Rauschen, unfokussierte Sarkomere oder abweichende Bewegungen der Faser können den Messtransienten beeinflussen (Abbildung 3B,C), und diese Messungen können manuell verworfen oder vom Analyseprogramm verworfen werden. Bei diesem Ansatz ist die klare Visualisierung der Sarkomere wichtig für die Messung der Kontraktionen; Daher kann alles, was die Sichtbarkeit der Sarkomere einschränkt, zu Rauschen führen. Dies kann auftreten, wenn sich das Sarkomer während der Kontraktion außerhalb der Fokusebene bewegt. Messungen, bei denen sich eine Reihe von Kontraktionen in Geschwindigkeit oder Tiefe unterscheiden, sollten ebenfalls aus dem Datensatz ausgeschlossen werden.
Die mit diesem System gewonnenen kontraktilen Daten einzelner Muskelfasern können verwendet werden, um verschiedene Kulturbedingungen zu vergleichen. Die Wirksamkeit des Systems ist in Abbildung 4 dargestellt. In dieser Arbeit haben wir die Kontraktionen von FDB-Muskelfasern sowohl im 2D- (lamininbeschichtete Kulturplatten) als auch im 3D-Kulturformat (Fibrin-Hydrogel) gemessen. Ein höherer Prozentsatz der verwertbaren Messungen wurde in 3D erreicht, da die Einbettung der Fasern in das Gel verhinderte, dass laterale Bewegungen und andere Bewegungsartefakte die Messung beeinflussen (Abbildung 4A). Die Einbettung der Fasern hatte im Vergleich zu den 2D-kultivierten Fasern keinen signifikanten Einfluss auf die Sarkomerverkürzung oder die maximale Kontraktionsgeschwindigkeit (Abbildung 4B). Um zu veranschaulichen, wie verschiedene Matrices die Kontraktion von FDB-Muskelfasern beeinflussen, verglichen wir dieses Fibrin-Hydrogel auch mit einer reinen Basalmembranmatrix (4 mg/ml) (Abbildung 4C). Die reduzierte Kontraktilität, die in der reinen Basalmembranmatrix beobachtet wurde, war wahrscheinlich auf die Steifigkeit des Gels oder auf erhöhte Zell-Matrix-Wechselwirkungen zurückzuführen. Fibrinkonzentrationen von bis zu 7 mg/ml wurden ebenfalls getestet, ohne signifikante Auswirkungen auf die kontraktile Geschwindigkeit und Verkürzung (unveröffentlichte Daten). Die Verwendung dieses Hydrogels auf Fibrinbasis gewährleistet eine minimale Beeinträchtigung der kontraktilen Parameter.
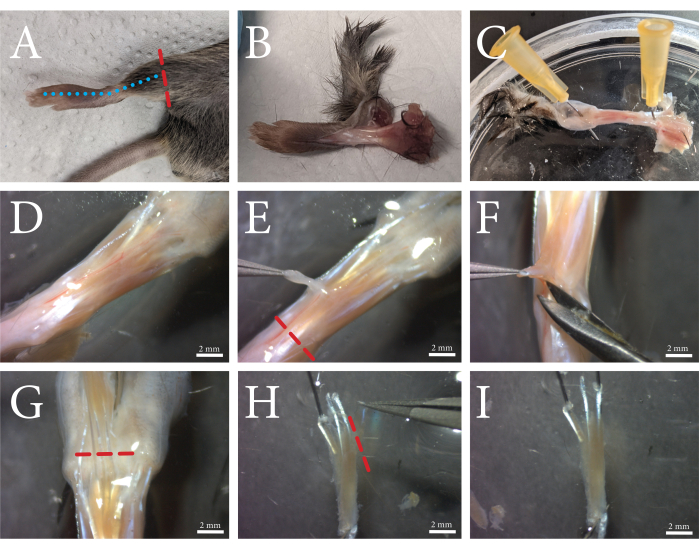
Abbildung 1: Ein Überblick über das FDB-Muskeldissektionsverfahren. (A) Die Hintergliedmaße wird oberhalb des Knöchels abgeschnitten (rote gestrichelte Linie) und (B) die Haut wird entfernt, indem entlang der Oberseite des Fußes entlang der blau gestrichelten Linie geschnitten wird. (C) Der Fuß wird durch den Knöchel und die Haut an den Zehen festgenagelt. (D) Mikroskopische Ansicht des freiliegenden Muskels und des umgebenden Bindegewebes. Die Faszie ist als weiße, undurchsichtige Schicht sichtbar, durch die das Gefäßsystem verläuft. (E) Die Faszie wird vom Muskel entfernt und die Sehne entlang der rot gestrichelten Linie durchtrennt. (F) Der FDB-Muskel wird vom darunter liegenden Gewebe getrennt, indem er unter und neben dem Muskel angehoben und geschnitten wird. (G) Wenn die Sehnen der Zehen deutlich sichtbar sind, wird die FDB entlang der rot gestrichelten Linie losgeschnitten. (H) Die FDB wird durch die Sehnen gesichert, und die vierte seitliche Sehne und ihre Fasern können durch Schneiden entlang der rot gestrichelten Linie entfernt werden. Überschüssige Faszien können nun abgeschnitten werden. (I) Nach der Reinigung wird der FDB-Muskel auf die Kollagenase-Lösung übertragen. Maßstabsbalken = (D-I) 2 mm. Abkürzung: FDB = Flexor digitorum brevis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
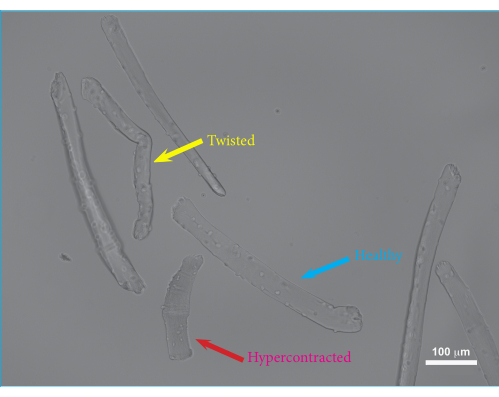
Abbildung 2: Mikroskopische Aufnahme von FDB-Muskelfasern, die nach 24 Stunden Kultur in Hydrogel eingebettet sind. Blauer Pfeil: Beispiel für eine lebensfähige FDB-Muskelfaser. Gelber Pfeil: Beispiel für eine verdrehte FDB-Muskelfaser. Verdrehte Muskelfasern können eine verminderte Lebensfähigkeit und beeinträchtigte Kontraktionen aufweisen und sollten daher von den Messungen ausgeschlossen werden. Roter Pfeil: Beispiel für eine hyperkontrahierte FDB-Muskelfaser. Eine übermäßige Hyperkontraktion tritt auf, wenn die Verreibung zu stark durchgeführt wird, oder kann durch Kollagenase-Überverdauung oder die Verwendung von nicht äquilibriertem Nährmedium verursacht werden. Maßstabsbalken = 100 μm. Abkürzung: FDB = Flexor digitorum brevis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
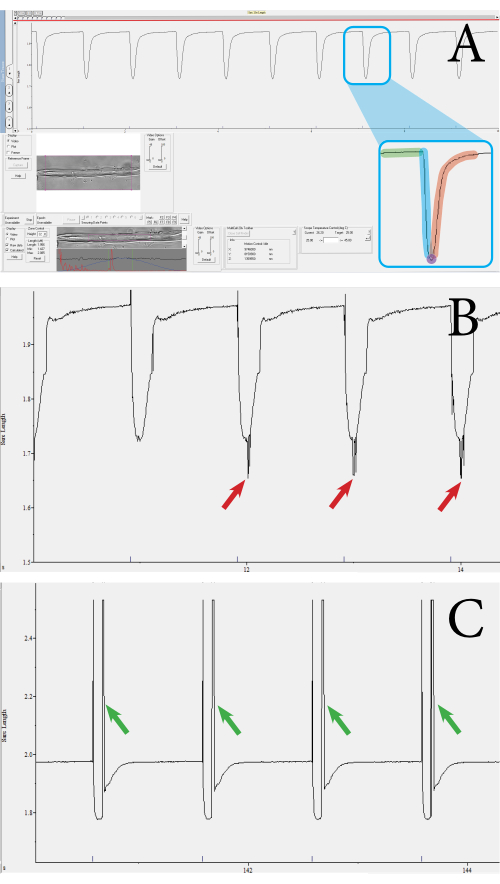
Abbildung 3: Beispiel für Faserkontraktionstransienten, die mit dem optikbasierten kontraktilen Hochdurchsatzsystem gemessen wurden. (A) Beispiel für einen normalen Kontraktionstransienten. Dieser Transient wird aus den Sarkomeren gewonnen, die von dem violetten Quadrat in der unteren Symbolleiste umschlossen sind. Der Transient besteht aus den folgenden Komponenten: Sarkomerlänge zu Beginn (grün), Kontraktionsdauer (blau), Sarkomerlänge bei maximaler Kontraktion (lila) und Relaxationsdauer (rot). Aus diesen Werten werden Parameter wie die Geschwindigkeit und der Prozentsatz der Kontraktion berechnet. (B) Beispiel für eine inadäquate transiente Kontraktion. Diese Messungen treten auf, wenn das Sarkomersignal aufgrund von Rauschen nicht aufgenommen wird (siehe rote Pfeile). (C) Beispiel für einen Kontraktionstransienten, der ein Bewegungsartefakt aufweist (siehe grüne Pfeile). Bewegungsartefakte treten auf, wenn sich die Muskelfaser während der Kontraktion außerhalb des Fokus bewegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
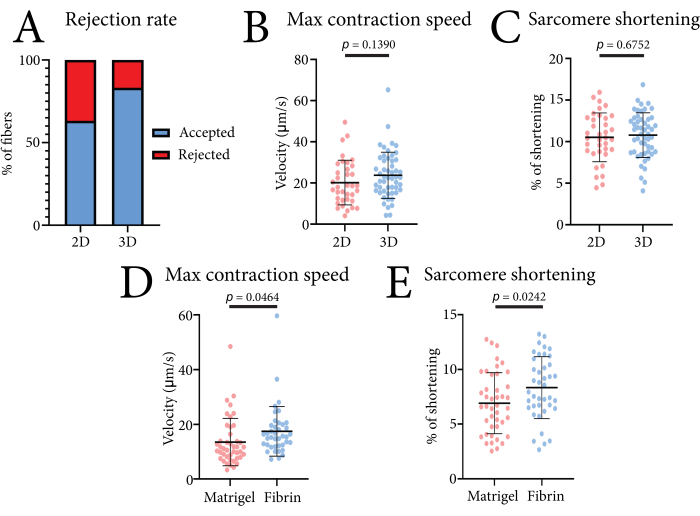
Abbildung 4: Repräsentative Daten, die mit dem optikbasierten Hochdurchsatz-Kontraktilsystem beim Vergleich von 2D- und 3D-Bedingungen und verschiedenen Hydrogelen erhalten wurden. (A) Prozentsatz der akzeptierten und abgelehnten Kontraktionsmessungen, die vom Datenanalyseprogramm in der 2D-Kultur und in der 3D-Kultur auf der Grundlage von 30 Messungen gefunden wurden. (B) Vergleich der maximalen Kontraktionsgeschwindigkeit in 2D-kultivierten und 3D-kultivierten Muskelfasern, die von drei Mäusen nach 24 Stunden Kultur isoliert wurden. (C) Vergleich der Sarkomerverkürzung in 2D-kultivierten und 3D-kultivierten Muskelfasern, die von drei Mäusen nach 24 h Kultur isoliert wurden. (D) Vergleich der maximalen Kontraktionsgeschwindigkeit von reinen Basalmembranmatrix (Matrigel)-eingebetteten und Fibrin-Hydrogel-eingebetteten Muskelfasern, die von drei Mäusen nach 24 Stunden Kultur isoliert wurden. (E) Vergleich der Sarkomerverkürzung von reinen Basalmembranmatrix (Matrigel)-eingebetteten und Fibrin-Hydrogel-eingebetteten Muskelfasern, die von drei Mäusen nach 24 h Kultur isoliert wurden. Die Daten wurden mit einem Student's t-Test analysiert und werden als Mittelwert ± SD dargestellt. Jeder Datenpunkt ist eine Muskelfaser. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Zusammensetzung des Dissektionsmediums, das zur Präparierung des Muskels verwendet wird, des Fibrinkulturmediums, das zur Kultivierung der isolierten Muskelfasern verwendet wird, und des Muskelverdauungsmediums, das zur enzymatischen Verdauung der isolierten Muskeln verwendet wird. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Zusammensetzung der Zellmischung, die zum Gießen der Hydrogele verwendet wird, und der Matrixmischung, die zum Gießen der Hydrogele verwendet wird. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Hier beschreiben wir ein Protokoll zur Durchführung der enzymatischen Isolierung und Kultivierung von FDB-Muskelfasern in einem 3D-Kulturformat, gefolgt von kontraktilen Messungen mit einem optikbasierten kontraktilen Messsystem. Dieses Protokoll hat eine Reihe von Vorteilen, darunter 1) die einfache und rechtzeitige Isolierung vieler intakter Muskelfasern von einem einzigen Muskel; 2) die Einbettung der Muskelfasern in eine einstellbare Hydrogelmatrix; 3) die Durchführung von Hochdurchsatz-Kontraktilitätsmessungen unter Verwendung des optikbasierten Systems; und 4) die Fähigkeit, nach einem Eingriff wiederholte Messungen derselben Muskelfasern durchzuführen. Die Isolierung einzelner lebender Muskelfasern sorgt für reife Muskelzellen, die ihre kontraktile Funktion behalten. Da die Muskelfasern, die aus dem FDB der Maus gewonnen werden, relativ klein sind, können sie während der Isolation leicht manipuliert werden und behalten ihre gerade Form bei, was nachgeschaltete kontraktile Messungen ermöglicht. Obwohl das System in erster Linie entwickelt wurde, um die Kontraktion von Kardiomyozyten zu untersuchen, enthalten die Skelettmuskelfasern die gleiche kontraktile Maschinerie mit leicht unterscheidbaren Sarkomermustern und können daher auch mit diesem System gemessen werden29. Die Kopplung von Einzelzell-Kontraktilmessungen mit lebenden ex vivo Muskelfaserkulturen ist ein leistungsfähiges Werkzeug zur Beurteilung der Gesundheit und Funktion reifer Muskelfasern als Reaktion auf elektrische Aktivierung.
Eine Einschränkung bei der Verwendung dissoziierter Muskelfasern ist das Fehlen externer Kräfte (d. h. passive Dehnung), die auf die Fasern ausgeübt werden, was zu geringeren Ruhesarkomerlängen im Vergleich zu denen führt, die in vivo gefunden wurden. Obwohl eine Sarkomerlänge von 2,4-2,5 μm für eine optimale Krafterzeugung sorgt, kann die Ruhesarkomerlänge stark variieren33. Während die in vivo Ruhesarkomerlänge des FDB noch nicht beschrieben wurde, deuten unsere eigenen unveröffentlichten Daten auf eine durchschnittliche Länge von 2,2 μm hin. Die aktuellen Ergebnisse zeigen eine durchschnittliche Ruhesarkomerlänge von ~1,95 μm in unbelasteten FDB-Fasern nach 24 h in Kultur (Abbildung 3). Obwohl diese geringere Ruhesarkomerlänge zu einer geringeren Krafterzeugung führen würde, sollte eine Länge von ~1,95 μm immer noch >90% der maximalen Krafterzeugen 34. Daher sollten diese Sarkomerlängen ausreichen, um Unterschiede in der Faserfunktion zwischen verschiedenen genetischen Modellen oder nach medikamentösen Behandlungen zu bestimmen. Darüber hinaus bietet die Einbettung von Fasern in ein Hydrogel im Vergleich zu frei schwebenden 2D-kultivierten Fasern viele zusätzliche Adhäsionspunkte, was eine weitere Sarkomerverkürzung im Laufe der Zeit begrenzen würde.
Ein Vorteil dieses Protokolls zur Isolierung von Muskelfasern ist die Verwendung eines leicht zu präparierenden, schnell zuckenden Muskels, der im Vergleich zu anderen Muskeln, wie z. B. dem Extensor digitorum longus (EDL), aus relativ kleinen Muskelfasern besteht. Aufgrund ihrer geringeren Größe eignet sich die Muskelisolierung besser für die Verreibungstrennung, wodurch die Wahrscheinlichkeit einer durch Pipetten oder Verwicklungen verursachten Schädigung der Muskelfasern verringert wird. Die extrazelluläre Matrix der FDB-Muskeln kann leicht enzymatisch mit Kollagenase verdaut werden, was die Isolierung von Hunderten von Muskelfasern in kurzer Zeit ermöglicht. Eine Überverdauung kann jedoch zu einer Schädigung der Muskelfasern führen. Die Überverdauung der Muskelfasern ist daran zu erkennen, dass der Muskel beim Verreiben des Muskels fast augenblicklich auseinanderfällt oder wenn ein großer Teil des Zellvolumens während der Zellaussaat überkontrahiert wird. Um eine Überverdauung des Muskels zu verhindern, muss die Verdauungszeit für jede Kollagenase-Charge optimiert werden. Um dies zu testen, sollten zwei FDB-Muskeln parallel mit einer gestaffelten Verdauungszeit von 5 min dazwischen verdaut werden. Es sollte die Verdauungszeit mit der höchsten Ausbeute an lebensfähigen Muskelfasern gewählt werden. Diese Optimierung sollte dann ein zweites Mal durchgeführt werden, wieder mit einer Trennung von 5 Minuten in der Aufschlusszeit. Die Verdauungszeit, die die höchsten lebensfähigen Muskelfasern liefert, sollte als optimale Verdauungszeit für die aktuelle Kollagenase-Charge verwendet werden. Eine andere Möglichkeit, die Variabilität der Kollagenase von Charge zu Charge zu begrenzen, besteht darin, die Aktivitätseinheiten pro Milliliter Stammlösung direkt zu berechnen und dann die nachfolgenden Kollagenase-Chargen auf die gleiche Menge zu rekonstruieren. Schließlich müssen die Verdauungszeiten möglicherweise über verschiedene Mausstämme hinweg optimiert werden, z. B. bei der Untersuchung älterer oder erkrankter Tiere, die eine erhöhte Ablagerung der extrazellulären Matrix aufweisen35,36.
Die Möglichkeit, lebensfähige isolierte Muskelfasern zu pipettieren, eröffnet die Möglichkeit, FDB-Muskelfasern unter verschiedenen Kulturbedingungen zu kultivieren. Eine solche Option ist die Kultivierung dieser Fasern in Hydrogelen, um die native Gewebekulturumgebung nachzuahmen. Dieses Einbettungsprotokoll stellt sicher, dass die Fasern während der kontraktilen Messungen an Ort und Stelle bleiben, und wurde so optimiert, dass sich die Fasern am Boden der Platte absetzen können, bevor das Gel aushärtet. Dieses Protokoll muss jedoch möglicherweise angepasst werden, um den Unterschieden in den Thrombin- und Fibrinogenvorräten Rechnung zu tragen. Wenn die Thrombinaktivität zu hoch ist, wird das Gel vorzeitig aushärten, und die Fasern können an höheren Stellen außerhalb der Brennebene des Mikroskops in der Schwebe bleiben. In diesem Fall muss das Verhältnis von Thrombin zu Fibrinogen angepasst werden. Dies kann getestet werden, indem Fasern in immer niedrigeren Thrombinkonzentrationen plattiert werden und darauf geachtet wird, wie lange die Polymerisation dauert. In der Regel sollte dies nicht schneller als 30 Minuten geschehen. Eine zu niedrige Thrombinkonzentration kann jedoch auch den Polymerisationsprozess beeinträchtigen. Eine andere Methode, um sicherzustellen, dass sich die Fasern in der richtigen Fokusebene befinden, besteht darin, sie zuerst mit einem 2D-Protokoll zu säen und dann eine Schicht Hydrogel über die Fasern zu legen, nachdem sie an der Kulturplatte haften. Man sollte sich jedoch darüber im Klaren sein, dass das Entfernen des Mediums aus den Fasern zu einer Hyperkontraktion führen kann, da diese empfindlich auf Austrocknung reagieren. Es ist auch unklar, ob sich das Hydrogel vollständig an der Kulturplatte festsetzt und sich leichter lösen kann. Daher ist dieses Einbettungsverfahren vorzuziehen, um Fasern lebensfähig und für Kontraktionsmessungen an Ort und Stelle zu halten.
Die Verwendung dieses Protokolls ermöglicht die Untersuchung der kontraktilen Dynamik reifer Muskelfasern ex vivo und kann sowohl auf gesunde Mäuse als auch auf Mäuse angewendet werden, die genetische Mutationen für Muskelerkrankungen tragen. Ebenso ermöglicht es zu testen, wie sich die Kulturbedingungen oder die Zugabe von Verbindungen auf die Funktion der Muskelfasern auswirken. Die mit dem optischen System gewonnenen kontraktilen Daten geben einen Hinweis auf die Kontraktionsfähigkeit lebender einzelner Muskelfasern, und Veränderungen dieser Fähigkeit können mit der Fasergesundheit korreliert werden. Diese Daten allein reichen jedoch nicht aus, um festzustellen, ob diese Veränderungen in den Phasen der Aktin-Myosin-Kreuzüberbrückung oder der Kalziumfreisetzung der Muskelkontraktion auftreten. Obwohl wir in diesem Protokoll keine Methoden zur Messung der Calcium-Signalübertragung beschreiben, ist dieser Aufbau auch in der Lage, Fura-basierte Calcium-Transienten in kontrahierenden Muskelzellen zu messen29. Ein Nachteil dieses Systems besteht darin, dass der FDB-Muskel nur schnell zuckende Typ-IIa/IIx-Muskelfasern enthält, und Muskeln, die langsam zuckende Typ-I-Fasern dieser Größe enthalten, wurden noch nicht beschrieben37. Dadurch entfällt die Möglichkeit, die fasertypspezifische Funktion mit dieser Methode zu untersuchen. Das Protokoll, das wir hier vorschlagen, könnte möglicherweise für andere Muskeln wie den EDL oder den Soleus angepasst werden, um Unterschiede im Fasertyp zu untersuchen. Aufgrund ihrer größeren Größe müsste dieses Protokoll für diese Muskeln weiter optimiert werden. Längere Fasern neigen dazu, sich während der Schwerkraftsedimentation zu verheddern und zu reißen, wenn sie durch Pipettieren manipuliert werden, was zu einer geringeren Ausbeute führen würde. Aufgrund ihrer Unverträglichkeit mit dem Pipettieren sind längere Fasern daher auch weniger kompatibel mit der Gel-Embedding-Technik. Messungen dieser Fasern können immer noch in einem 2D-Kulturformat durchgeführt werden, aber die Fasern können sich aufgrund ihrer Größe während der Kontraktion stärker bewegen, was das Signal-Rausch-Verhältnis beeinflusst. Eine weitere Einschränkung dieses Systems ist die Unfähigkeit, Kraftmessungen neben den kontraktilen Messungen durchzuführen, wie z. B. Kraftmessungen, die mit anderen intakten Muskelfaserpräparaten erzielt werden können28. Diese Einschränkung kann jedoch umgangen werden, indem die von der Muskelfaser erzeugte Kraft geschätzt wird. Die erzeugte Kraft der Muskelfasern kann abgeschätzt werden, wenn die Muskelfaserform im kontrahierten und entspannten Zustand sowie der Elastizitätsmodul der Matrix bekannt sind25. Nichtsdestotrotz bietet dieses optische System einen einfach zu bedienenden Hochdurchsatzansatz zur Untersuchung der kontraktilen Funktion von Muskeln und eröffnet eine Reihe neuer Möglichkeiten für die Untersuchung genetisch bedingter Muskelerkrankungen und therapeutischer Interventionen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu erklären.
Danksagungen
Die Autoren danken Sylvia Bogaards, Sanna Luijcx, Valentijn Jansen, Michiel Helmes und Emmy Manders für ihre technische Expertise bei der Entwicklung dieses Protokolls. Diese Arbeit wurde durch Auszeichnungen der Muscular Dystrophy Association (Development Award MDA603238 to T.J.K), der Dutch Cardiovascular Alliance (Talent Grant to T.J.K) und des National Health and Medical Research Council (NHMRC, Australien; Fellowship APP1121651 bis M.Y.).
Materialien
| Name | Company | Catalog Number | Comments |
| Aprotinin, from Bovine Lung | Thermo Scientific | AAJ63039MC | 100 mM stock solution in PBS can be stored at -20 °C. Sterilize stock solution using a 0.22 µm filter. |
| Collagenase type 2 | Worthington | 77336 | 10% (w/v) stock solution can be stored at -20 °C. Weighing collagenase should be done in a safety cabinet as inhalation is dangerous. |
| Fetal Bovine Serum | Thermo Fisher | 10500064 | |
| Fibrinogen from Bovine Plasma | Sigma Aldrich | 50-176-5054 | 20 mg/mL stock solution in PBS can be stored at -80 °C. Sterilize stock solution using a 0.22 µm filter. |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher | A1413201 | 4 mg/mL stock solution is prepared in MEM and stored at -20 °C. |
| Gibco MEM High glucose + pyruvate | Thermo Fisher | 11095080 | |
| Horse serum | Thermo Fisher | H1270 | |
| Matrigel GFR Membrane Matrix | Corning | CB-40230 | 4 mg/mL stock solution is prepared in MEM and stored at -20 °C. |
| Penicillin/Streptomycin | Sigma Aldrich | P4333 | |
| Serum Replacement 2 (50x) | Sigma Aldrich | S9388 | |
| Thrombin, Bovine Plasma | Thermo Scientific | AAJ63383EXP | 125 U/mL stock in PBS can be stored at -20 °C. Sterilize stock solution using a 0.22 µm filter. |
| Tranexamic Acid | Thermo Scientific | AC228042500 | 80 mM stock solution in PBS can be stored at -20 °C. Sterilize stock solution using a 0.22 µm filter. |
| Equipment | |||
| 24-well electrical stimulator | IonOptix | N/a | |
| Dumont #55 Forceps | Fine Science Tools | 11295-51 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| MultiCell Cytocypher | IonOptix | N/a | |
| MyoCam-S3 | IonOptix | N/a | |
| MyoPacer | IonOptix | N/a | |
| SYLGARD 184 silicone elastomer, Base & Curing Agent | Dow corning | N/a | |
| Vannas Spring Scissor - 25 mm Cutting Edge | Fine Science Tools | 15002-08 | |
| Software | |||
| CytoSolver | IonOptix | N/a | |
| IonWizard | IonOptix | N/a |
Referenzen
- Smith, L. R., Meyer, G. A. Skeletal muscle explants: Ex-vivo models to study cellular behavior in a complex tissue environment. Connective Tissue Research. 61 (3-4), 248-261 (2020).
- Khodabukus, A., Prabhu, N., Wang, J., Bursac, N. In vitro tissue-engineered skeletal muscle models for studying muscle physiology and disease. Advanced Healthcare Materials. 7 (15), 1701498 (2018).
- Fernandez-Costa, J. M., Fernandez-Garibay, X., Velasco-Mallorqui, F., Ramon-Azcon, J. Bioengineered in vitro skeletal muscles as new tools for muscular dystrophies preclinical studies. Journal of Tissue Engineering. 12, 2041731420981339 (2021).
- Romagnoli, C., Iantomasi, T., Brandi, M. L. Available in vitro models for human satellite cells from skeletal muscle. International Journal of Molecular Sciences. 22 (24), 13221 (2021).
- Dessauge, F., Schleder, C., Perruchot, M. -. H., Rouger, K. 3D in vitro models of skeletal muscle: Myopshere, myobundle and bioprinted muscle construct. Veterinary Research. 52 (1), 72 (2021).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell Biology International. 37 (2), 191-196 (2013).
- Guo, X., et al. In vitro differentiation of functional human skeletal myotubes in a defined system. Biomaterials Science. 2 (1), 131-138 (2014).
- Denes, L. T., et al. Culturing C2C12 myotubes on micromolded gelatin hydrogels accelerates myotube maturation. Skeletal Muscle. 9 (1), 17 (2019).
- Pimentel, M. R., Falcone, S., Cadot, B., Gomes, E. R. In vitro differentiation of mature myofibers for live imaging. Journal of Visualized Experiments. (119), e55141 (2017).
- Khodabukus, A. Tissue-engineered skeletal muscle models to study muscle function, plasticity, and disease. Frontiers in Physiology. 12, 619710 (2021).
- Engler, A. J., et al. Myotubes differentiate optimally on substrates with tissue-like stiffness: Pathological implications for soft or stiff microenvironments. Journal of Cell Biology. 166 (6), 877-887 (2004).
- Huang, N. F., et al. Myotube assembly on nanofibrous and micropatterned polymers. Nano Letters. 6 (3), 537-542 (2006).
- Earle, A. J., et al. Mutant lamins cause nuclear envelope rupture and DNA damage in skeletal muscle cells. Nature Materials. 19 (4), 464-473 (2020).
- Stange, K., Ahrens, H. E., von Maltzahn, J., Rontgen, M. Isolation and ex vivo cultivation of single myofibers from porcine muscle. In Vitro Cellular and Developmental Biology. Animal. 56 (8), 585-592 (2020).
- Ravenscroft, G., et al. Dissociated flexor digitorum brevis myofiber culture system--A more mature muscle culture system. Cell Motility and the Cytoskeleton. 64 (10), 727-738 (2007).
- Ramsey, R. W., Street, S. F. The isometric length-tension diagram of isolated skeletal muscle fibers of the frog. Journal of Cellular and Comparative Physiology. 15 (1), 11-34 (1940).
- Selvin, D., Hesse, E., Renaud, J. M. Properties of single FDB fibers following a collagenase digestion for studying contractility, fatigue, and pCa-sarcomere shortening relationship. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 308 (6), R467-R479 (2015).
- Renzini, A., et al. Culture conditions influence satellite cell activation and survival of single myofibers. European Journal of Translational Myology. 28 (2), 7567 (2018).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and culture of individual myofibers and their satellite cells from adult skeletal muscle. Journal of Visualized Experiments. (73), e50074 (2013).
- Holmberg, J., Durbeej, M. Laminin-211 in skeletal muscle function. Cell Adhesion and Migration. 7 (1), 111-121 (2013).
- Stuelsatz, P., Keire, P., Yablonka-Reuveni, Z. Isolation, culture, and immunostaining of skeletal muscle myofibers from wildtype and nestin-GFP mice as a means to analyze satellite cell. Methods in Molecular Biology. 1556, 51-102 (2017).
- Alkhateeb, H., Chabowski, A., Bonen, A. Viability of the isolated soleus muscle during long-term incubation. Applied Physiology, Nutrition, and Metabolism. 31 (4), 467-476 (2006).
- Roche, S. M., Gumucio, J. P., Brooks, S. V., Mendias, C. L., Claflin, D. R. Measurement of maximum isometric force generated by permeabilized skeletal muscle fibers. Journal of Visualized Experiments. (100), e52695 (2015).
- Ottenheijm, C. A., et al. Altered myofilament function depresses force generation in patients with nebulin-based nemaline myopathy (NEM2). Journal of Structural Biology. 170 (2), 334-343 (2010).
- Rausch, M., et al. Measurement of skeletal muscle fiber contractility with high-speed traction microscopy. Biophysical Journal. 118 (3), 657-666 (2020).
- de Winter, J. M., et al. KBTBD13 is an actin-binding protein that modulates muscle kinetics. Journal of Clinical Investigation. 130 (2), 754-767 (2020).
- Wijnker, P. J. M., vander Velden, J. Mutation-specific pathology and treatment of hypertrophic cardiomyopathy in patients, mouse models and human engineered heart tissue. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1866 (8), 165774 (2020).
- Cheng, A. J., Westerblad, H. Mechanical isolation, and measurement of force and myoplasmic free [Ca(2+)] in fully intact single skeletal muscle fibers. Nature Protocols. 12 (9), 1763-1776 (2017).
- Cao, L., Manders, E., Helmes, M. Automatic detection of adult cardiomyocyte for high throughput measurements of calcium and contractility. PLoS One. 16 (9), e0256713 (2021).
- Geckil, H., Xu, F., Zhang, X., Moon, S., Demirci, U. Engineering hydrogels as extracellular matrix mimics. Nanomedicine. 5 (3), 469-484 (2010).
- Lin, C. C., Anseth, K. S. PEG hydrogels for the controlled release of biomolecules in regenerative medicine. Pharmaceutical Research. 26 (3), 631-643 (2009).
- Cold Spring Harbor Protocols. Sylgard-coated coverslips and petri dishes. Cold Spring Harbor Protocols. 2022 (8), (2022).
- Moo, E. K., Fortuna, R., Sibole, S. C., Abusara, Z., Herzog, W. In vivo sarcomere lengths and sarcomere elongations are not uniform across an intact muscle. Frontiers in Physiology. 7, 187 (2016).
- Moo, E. K., Leonard, T. R., Herzog, W. The sarcomere force-length relationship in an intact muscle-tendon unit. Journal of Experimental Biology. 223, 215020 (2020).
- Schuler, S. C., et al. Extensive remodeling of the extracellular matrix during aging contributes to age-dependent impairments of muscle stem cell functionality. Cell Reports. 35 (10), 109223 (2021).
- Carberry, S., Zweyer, M., Swandulla, D., Ohlendieck, K. Proteomics reveals drastic increase of extracellular matrix proteins collagen and dermatopontin in the aged mdx diaphragm model of Duchenne muscular dystrophy. International Journal of Molecular Medicine. 30 (2), 229-234 (2012).
- Tarpey, M. D., et al. Characterization and utilization of the flexor digitorum brevis for assessing skeletal muscle function. Skeletal Muscle. 8 (1), 14 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten