Method Article
使用基于光学的系统对水凝胶嵌入的完整小鼠肌纤维进行高通量收缩测量
* 这些作者具有相同的贡献
摘要
骨骼肌功能可以通过量化孤立的肌肉纤维的收缩力来评估,传统上使用费力的低通量方法。在这里,我们描述了一种基于光学的高通量方法来量化水凝胶嵌入的肌肉纤维的收缩性。这种方法在药物筛选和治疗开发方面有应用。
摘要
体外细胞培养是评估细胞过程和测试治疗策略的有力工具。对于骨骼肌,最常见的方法是将肌源性祖细胞分化为未成熟的肌管,或对分离的单个肌纤维进行短期离体培养。体外培养的一个关键好处是保留了复杂的细胞结构和收缩特性。在这里,我们详细介绍了从小鼠中分离完整的指趾短屈肌纤维及其随后的离体培养的实验方案。在该协议中,肌肉纤维嵌入基于纤维蛋白和基底膜基质水凝胶中以固定纤维并保持其收缩功能。然后,我们描述了使用基于光学的高通量收缩力系统评估肌纤维收缩功能的方法。对嵌入的肌纤维进行电刺激以诱导收缩,然后使用基于光学的定量评估其功能特性,例如肌节缩短和收缩速度。将肌纤维培养与该系统相结合,可以高通量测试药物对遗传性肌肉疾病的收缩功能和离体研究的影响。最后,该协议还可以适用于使用活细胞显微镜研究肌肉纤维中的动态细胞过程。
引言
体外细胞培养技术的进步为研究组织再生能力、病理生理细胞机制和随后的治疗策略开辟了新的可能性,同时在良好控制的条件下使用哺乳动物组织1,2,3。体外培养系统的使用在肌肉研究领域内已经确立4,5。通常,使用来自肌源性祖细胞的体外分化未成熟肌管2,6,7,8。尽管在产生更成熟的肌纤维9的分化方案中取得了进展,但它们的不成熟性仍然限制了研究结果的转化到体内环境1,10。肌肉生物学领域的一个核心问题是体外分化肌管无法完全体现天然肌肉组织中观察到的复杂细胞内结构、细胞信号传导过程和细胞外相互作用,重要的是,无法概括肌肉纤维产生的收缩力1,2,10,11,12.此外,分化过程中肌管的不协调收缩通常会导致自发脱离培养皿,使得体外分化肌管的收缩评估具有挑战性,并且仅限于定性或半定量评估8,11,12,13。这些限制通常需要定期对动物进行体内实验,特别是如果肌肉收缩力是主要的实验结果1。
体外分化肌管培养的替代方法是分离成熟肌纤维的离体培养1,14。在离体培养期间,将发育成熟的肌肉组织从体内切除,然后在实验室条件下进行单细胞分离培养1,14。分离的成熟肌纤维保持其在天然组织14,15内观察到的复杂细胞结构,并且该方法为直接干预(例如遗传操作和药物筛选)在定义明确且可控的培养环境中提供了可能性。关于骨骼肌纤维分离和离体培养的首批报告之一可以追溯到 1930 年代;然而,该方案的活纤维产量很低16。随着分离程序和培养条件的不断优化,现在可以显着改善活肌纤维和功能性肌纤维的数量14,15,17,18,19。培养条件的一种改进涉及用细胞外基质蛋白包被培养皿以促进分离的肌纤维在培养皿15,18,20上的粘附。通常使用层粘连蛋白涂层,因为层粘连蛋白是肌肉细胞外基质中最丰富的元素之一20,21。分离程序的优化与培养皿的涂层相结合,使肌肉研究领域能够在短时间内将分离的具有完整细胞结构和收缩功能的活肌纤维保持在培养物中1,15,18,22。
在肌肉场内用于测量力和收缩能力的最常规方法是在长度驱动电机和力传感器23,24 之间安装单个肌肉纤维。通常,用于这些运动驱动装置的肌纤维从快速冷冻或新鲜组织中解剖,然后透化或"剥皮",这允许外部钙激活,其中不同的钙浓度用于诱导肌纤维收缩24。虽然这种方法是肌纤维收缩测量的黄金标准,但一次只能测量一种肌肉纤维,这使得该技术成为一种费力且耗时的过程25。此外,肌肉纤维的分离和蒙皮过程破坏了激发-收缩耦合所涉及的各种结构(即钙释放和随后再摄取到肌质网中),因此不允许研究松弛动力学和任何可能影响该过程的疾病26,27.剥皮纤维制备的替代方案是使用机械解剖来分离完整的肌纤维,其中可以测量响应电激活的收缩力28;然而,这种方法在技术上具有挑战性且非常耗时,导致测量通量低。最后,在有皮和完整制剂中,肌肉细胞在收缩测量期间从细胞外环境中完全去除24,使得研究细胞外基质组成/刚度对肌纤维收缩的影响是不可能的24。因此,需要开发替代方法,以便能够以高通量方式对分离的完整肌纤维进行肌纤维收缩力测量,同时重建肌纤维和细胞外基质之间的连接。
最近,开发了一种基于光学的新方法,用于高通量肌纤维收缩力测量29。这种基于光学的系统测量肌节的周期性,以使用高速成像评估收缩过程中的肌节长度。在该系统中,当光学元件移动时,细胞保持在培养皿中的位置,从而最大限度地减少了多个细胞测量之间所需的时间29。使用这种基于光学的高通量方法的一个主要优点是,它允许开发与天然组织相似的培养条件。用于模拟天然 体内 条件的方法是将细胞包埋在水凝胶30中。通常,水凝胶是能够保持其体积和形状的粘弹性材料,并且水凝胶具有固体和液体材料31的性质。固体部分由相互交联的聚合物链组成,形成类似于净30,31的结构。可以调整水凝胶的材料特性以模拟肌肉的基质沉积30,31。因此,高通量、基于光学的系统与嵌入水凝胶中的细胞相结合,为评估细胞外基质组成和机械性能对肌纤维功能的影响开辟了新的可能性。
本文的总体目标是 1) 描述在模拟天然组织环境的条件下酶分离和 离体 培养肌肉纤维的方法,以及 2) 使用高通量方法评估肌肉纤维收缩力。我们描述了一种使用酶消化从指趾短屈肌(FDB)肌肉中轻松分离大量单肌纤维的详细方法。此外,我们描述了一种将分离的肌肉纤维嵌入基于纤维蛋白的水凝胶中的技术,以模仿肌肉的天然环境并提高肌肉纤维的活力和收缩力。然后,我们概述了使用这个最近开发的系统在 体外 测量活肌纤维收缩的高通量方法。 这种包埋过程的另一个优点是在收缩过程中固定纤维,这可以提高这些测量的信噪比。这种凝胶包埋方法适用于单聚合物和复合凝胶包封程序,有助于评估细胞外基质组成对肌纤维收缩力的影响。
研究方案
对于 离体 收缩研究,根据欧洲理事会指令(2010/63 / EU)经荷兰动物研究法许可,从为其他批准的研究项目和/或VU大学育种盈余而牺牲的动物中获得死后组织。
1. 材料准备
- 准备用于研磨的移液器(将70%乙醇储存在流动柜中直至使用)。切割两个P1,000尖端的末端以创建不同的孔尺寸;确保孔足够大,使肌肉通过而不会阻塞移液管。将切割端穿过火焰,使它们变得光滑。
- 按照其他地方32所述准备Sylgard菜肴,并提前用70%乙醇消毒,以便在隔离期间用于固定爪子和肌肉。
注意:用去离子水和70%乙醇彻底清洁后,可以重复使用Sylgard培养皿。 - 在分离程序之前准备以下溶液:解剖培养基,纤维蛋白培养基和肌肉消化培养基(见 表1)。
注意:肌肉消化培养基应使用0.22μm过滤器进行过滤灭菌。所有制备的溶液应在使用前在37°C和5%CO 2的标准细胞培养箱中平衡至少30分钟。 - 肌肉消化后,准备以下溶液来浇铸水凝胶:细胞混合物和基质混合物(见 表2)。以 1:1 的比例混合细胞混合物和基质混合物,最终纤维蛋白浓度为 2.5 mg/mL。
注意:在冰上制备基质,并使用预冷的移液器吸头以防止基底膜基质过早聚合。这里使用的凝血酶:纤维蛋白原比例为1:10(单位/毫克纤维蛋白原),已针对30分钟的聚合时间进行了优化。如果凝胶在30分钟内聚合,则应使用较低的凝血酶浓度。有关详细信息,请参阅讨论。
2. FDB肌肉解剖
- 通过颈椎脱位对小鼠实施安乐死。用70%的酒精消毒后肢。
- 切掉脚踝以上的后腿小腿。切开脚背侧朝向脚趾的皮肤。
注意:在踝关节处切断小后腿,以防止在以后需要时损坏下肢肌肉和胫骨。 - 小心地将皮肤剥向脚趾。注意不要损伤肌肉。FDB是足腹侧最浅的肌肉。
- 将解剖的脚放入带有10mL预热解剖培养基的Sylgard培养皿中,温度为37°C。 将脚穿过仍然附着在脚趾上的皮肤,并将小腿固定在脚踝之外。
- 小心地去除肌肉顶部的结缔组织。切掉脚跟处的肌腱,然后用肌腱将肌肉抬起。
- 通过结缔组织在肌肉旁边和下方切开。继续切割,直到脚趾肌腱暴露出来。
- 当三根肌腱的一半长度暴露出来时,切断肌腱,并从脚上释放肌肉。可选:修剪第四外侧肌腱及其肌肉纤维。
- 清除肌肉上的结缔组织,并转移到装有预热解剖介质的管中。
3. FDB肌肉消化
- 根据 表1制备肌肉消化培养基。
- 使用血清移液管将FDB肌肉转移到肌肉消化培养基中。在37°C和5%CO2 的组织培养箱中孵育80分钟。
注意:此时间应针对每个胶原酶批次进行优化。当肌肉开始磨损并看起来变大时,消化就完成了。有关消化时间的优化,请参阅讨论。 - 消化后,将肌肉转移到含有 3 mL 解剖培养基的 15 mL 管中,并在研磨前孵育 30 分钟。
4. FDB肌肉磨合和重力沉降
- 使用先前准备好的研磨吸头(步骤1.1)通过移液肌肉来研磨肌肉,从最大到最小尺寸。如果此步骤花费超过5分钟,请将肌肉放入培养箱中5分钟以使其休息。
- 研磨直到肌纤维大部分从肌腱上脱落,肌腱可以通过 P200 尖端。去除肌腱。
- 将解离的FDB纤维加入含有10mL解剖培养基的15 mL管中,并使纤维在培养箱中沉降20分钟。观察形成的颗粒。
- 可选:从顶部取出 10 mL 培养基,然后重复步骤 4.3。此步骤有助于去除多余的碎片和相关单核细胞。
5. FDB光纤嵌入
- 小心地从纤维颗粒顶部取出所有培养基。将细胞重悬于每块FDB肌肉的875μL细胞混合物中(冰上)。
注意:一块FDB肌肉产生足够的纤维用于24孔板的七个孔。该密度可以根据实验的需要进行调整。以下凝胶体积(250 μL)针对24孔规格进行了优化,但可以针对其他规格进行相应缩放。 - 将 125 μL 细胞混合物等分到单个微量离心管中。
- 一次一个孔,将 125 μL 基质混合物加入细胞悬液等分试样中,并通过小心地上下移液进行混合,避免形成气泡。
- 立即将最终混合物转移到孔中。
注意:确保将混合物移入孔中间。对每个孔重复步骤5.3和步骤5.4。 - 将凝胶在培养箱中固化30-45分钟。凝固后,小心地将培养基加入孔中。
注意:快速移液可以将水凝胶从孔中分离出来。从这一点开始,可以刺激和测量纤维。然而,根据我们的经验,让纤维适应培养条件24小时可能会提高纤维的收缩力。 - 对于较长的培养时间,每2天更换一次半次培养基。为此,请去除一半的培养基,并用等量的新鲜培养基代替。
6. 基于光学的收缩测量
- 打开基于光学的收缩测量系统(见材料表)、荧光灯、电池起搏器和计算机。将电刺激器设置为 1.0 Hz、10.0 V,脉冲持续时间为 5.00 毫秒,以刺激孤立的肌肉纤维。
- 将板插入测量系统。将起搏器连接到起搏插入物,然后将其插入培养板中。
- 打开程序 IonWizard,然后单击"文件"(屏幕左上角)打开一个新 文件 | 新。
- 检查程序是否在正确的实验上,骨骼肌节,通过单击新建 |收集实验。要更改实验,请单击所需的实验,然后按添加。对于骨骼肌节实验,应用以下设置:Sarc 20x、平均线、单 FFT、250 Hz 采样率和 10 秒的采集时间。
注意:实验设置应在实验前准备好。可以根据实验的需要调整设置。 - 将测量系统的温度调整为25°C。单击工具栏下的打开单元格查找器,然后等待弹出新屏幕。在此屏幕的右上角,选择板类型和活动孔。
注意:测量在25°C下进行,以降低快速抽搐的FDB肌纤维的收缩速度,从而防止收缩事件的欠采样。 - 通过调整 焦点滑块使光纤聚焦。或者,使用 W 键和 S 键 进行此对焦功能。
- 启用起搏以开始电刺激。观察纤维现在开始抽搐。
注意:如果没有光纤抽搐,请确保所有电线都已连接并且起搏器完全浸没。如果在此之后仍然没有运动,则由于研磨过程中过度消化或过度损伤,纤维可能没有反应。 - 将测量区域聚焦在光纤末端,使肌节垂直运行。确保肌节清晰可见。如果肌节聚焦,则工具栏中可以看到单个峰。在收缩期间,随着肌节缩短,该峰值将向右移动。
注意:紫色测量区域可以在开始实验之前进行调整。为确保正确测量,请包括~20个肌节。如果该峰在收缩过程中改变形状,这可能表明肌节在收缩期间被遮挡或失焦,从而引入噪音。 - 通过单击工具栏中的"开始 "开始 实验。按 Q 键开始测量,然后等待程序测量 10 个收缩瞬变。如果四个以上的瞬变看起来没有噪声,请按 Z键接受 测量。如果瞬变噪声太大,请按 X 键拒绝测量。
- 每种条件测量 10 根纤维到 20 根纤维。先前测量的光纤的位置被保留。
- 可选:添加化合物,之后可以在此时重新测量纤维。
- 实验完成后,按下下方工具栏中的 停止 按钮关闭细胞查找器窗口。保存文件,然后启动一个新文件。
- 要分析数据,请打开程序"细胞溶解器桌面"。单击 导入,然后选择要分析的文件。
- 程序完成分析后,查找蓝色、红色和灰色峰。蓝色峰值是程序接受的瞬态。红色峰是程序拒绝的瞬态,灰色峰是用户拒绝的瞬态。
注意:可以在分析软件中调整剔除标准。通常,如果值超过最大导数限制,则拒绝这些值,并且根据曲线拟合 R2 值 <0.95 拒绝瞬态。 - 单击 导出。勾选以下框: 平均瞬态数据 并 导出到 excel。
- 完成后,关闭所有计算机。取出培养板,并处理掉。用去离子水和70%乙醇清洁起搏器电极。
结果
使用该协议,分离单个FDB肌纤维并嵌入水凝胶中。肌肉解剖程序的概述如图 1所示。FDB肌肉暴露在完整的肌腱上,并从筋膜上松开。将肌肉肌腱作为固定点可以最大限度地减少隔离过程中对肌肉纤维的潜在损害。多余的结缔组织可以被修剪掉,以减少碎片和二次细胞类型的生长。一旦肌肉被切除并充分清洁,使用胶原酶对肌肉进行酶消化,并且在将分离的细胞包埋在水凝胶中之前通过研磨释放单个肌肉纤维。FDB肌纤维的分离提供了相对较短的肌纤维,其优点是易于操纵。由于其尺寸,FDB肌纤维可以安全地移液,而不会引起缠结引起的损伤,并且很容易嵌入水凝胶中。由于单肌纤维不能很好地粘附在培养板上,因此将纤维嵌入水凝胶可确保纤维在细胞培养和收缩测量期间保持原位。此外,在纤维蛋白凝胶中添加基底膜基质允许肌纤维和基质之间的相互作用,模仿天然 体内 环境。分离的单肌纤维可以在分离后在培养物中操纵和维持数天。 在图2中,显示了嵌入水凝胶基质中的分离FDB纤维的示例。健康的纤维具有可见的肌节并且笔直伸展(蓝色箭头),而弯曲的纤维通常受损或无法存活(黄色箭头),应从测量中排除。超收缩的纤维在基质中显示为深色的球状物体(红色箭头)。如果分离程序成功,健康纤维的比例应为~75%。较大比例的超收缩光纤通常表示隔离过程中的损坏。肌肉纤维的膜可能因肌肉过度消化或在研磨过程中损伤纤维而受损。磨擦损伤主要发生在肌肉消化不足的情况下,因此不容易分开。
通过使用基于光学的高通量收缩测量系统对肌肉纤维进行收缩测量来评估纤维功能和活力。系统输出多个参数,例如肌节长度、肌节缩短百分比、收缩速度和松弛速度。使用收缩测量系统,可以测量每根肌肉纤维的肌节收缩。 图3 显示了使用测量系统测量的肌纤维收缩的示例。从单个收缩瞬态中获得以下参数:基线时的肌节长度,收缩持续时间,最大收缩时的肌节长度和松弛持续时间(图3A)。这些参数用于计算肌节缩短、收缩和松弛速度的百分比。如果需要,还可以根据持续时间和绝对缩短值计算平均速度值。有效的收缩测量具有直线基线,然后下降到峰值,然后返回到基线(图3A)。噪声、未聚焦的肌节或光纤的异常运动会影响测量瞬态(图 3B,C),这些测量可以手动丢弃或被分析程序拒绝。在这种方法中,肌节的清晰可视化对于测量宫缩很重要;因此,任何降低肌节能见度的东西都可能引入噪音。如果在收缩过程中肌节在焦平面外移动,则可能会发生这种情况。一系列收缩在速度或深度上不同的测量也应从数据集中排除。
用该系统获得的单肌纤维的收缩数据可用于比较不同的培养条件。该系统的有效性如图 4所示。在这里,我们测量了2D(层粘连蛋白包被的培养板)和3D(纤维蛋白水凝胶)培养形式中FDB肌纤维的收缩。在3D中实现了更高比例的可用测量,因为将纤维嵌入凝胶中可以防止横向移动和其他移动伪影影响测量(图4A)。与2D培养的纤维相比,嵌入纤维对肌节缩短或最大收缩速度值没有显着影响(图4B)。为了说明不同基质如何影响FDB肌纤维的收缩,我们还将该纤维蛋白水凝胶与纯基底膜基质(4mg / mL)进行了比较(图4C)。在纯基底膜基质中观察到的收缩性降低可能是由于凝胶的刚度或细胞-基质相互作用的增加。还测试了高达7mg / mL的纤维蛋白浓度,对收缩速度和缩短没有显着影响(未发表的数据)。这种基于纤维蛋白的水凝胶的使用确保了对收缩参数的最小干扰。
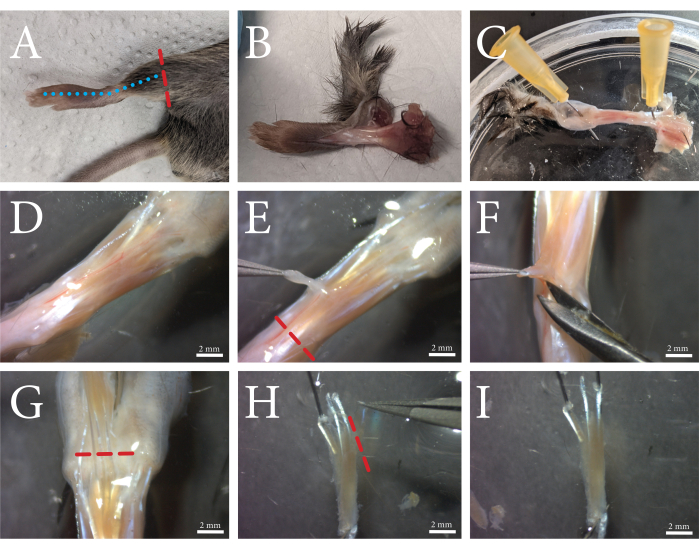
图1:FDB肌肉解剖程序概述。 (A)后肢在脚踝上方切开(红色虚线),以及 (B)沿着蓝色虚线沿着脚的顶部切割皮肤。(C)脚穿过脚踝和脚趾皮肤。(D)暴露的肌肉及其周围结缔组织的显微镜视图。筋膜可见为脉管系统穿过的白色不透明层。(E)筋膜从肌肉中移除,肌腱沿红色虚线切割。(F)FDB肌肉通过在肌肉下方和肌肉旁边抬起和切割来与下面的组织分开。(G)当脚趾的肌腱清晰可见时,FDB沿着红色虚线被切断。(H)FDB由肌腱固定,第四侧肌腱及其纤维可以通过沿红色虚线切割来去除。多余的筋膜现在可以修剪掉。 (I)清洁后,FDB肌肉转移到胶原酶溶液中。比例尺 = (D-I) 2 毫米。缩写:FDB = 短指屈肌。请点击此处查看此图的大图。
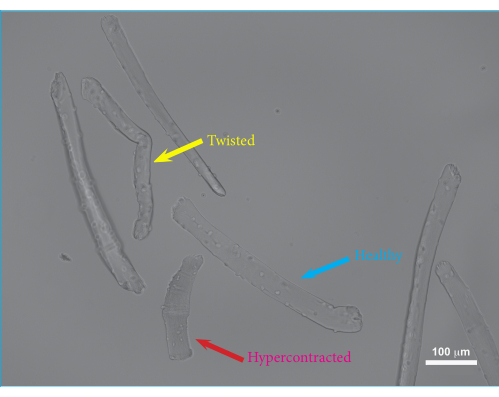
图2:培养24小时后嵌入水凝胶中的FDB肌纤维的显微图像。 蓝色箭头:可行的FDB肌纤维示例。黄色箭头:扭曲的FDB肌纤维示例。扭曲的肌纤维可能具有降低的活力和受损的收缩,因此应从测量中排除。红色箭头:过度收缩的FDB肌纤维的例子。当研磨过度进行或可能由胶原酶过度消化或使用非平衡培养基引起时,就会发生过度收缩。比例尺 = 100 μm。缩写:FDB = 短指屈肌。 请点击此处查看此图的大图。
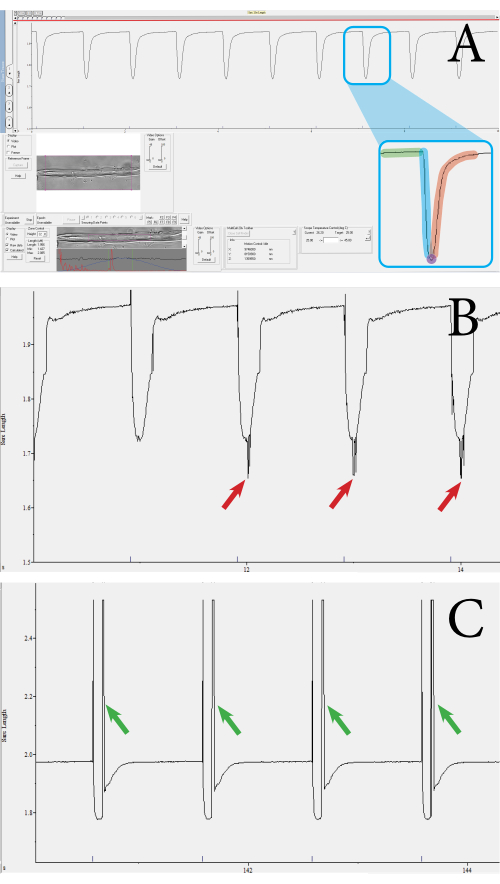
图 3:使用基于光学的高吞吐量收缩系统测量的光纤 收缩瞬变示例。 (A) 正常收缩瞬变的示例。这种瞬变是从下部工具栏中显示的紫色方块包围的肌节中获得的。瞬时由以下部分组成:基线时的肌节长度(绿色)、收缩持续时间(蓝色)、最大收缩时的肌节长度(紫色)和松弛持续时间(红色)。收缩速度和收缩百分比等参数是根据这些值计算的。(B)收缩瞬态不足的例子。当由于噪声而未拾取肌节信号时,就会进行这些测量(见红色箭头)。(C) 具有运动伪影的收缩瞬态示例(见绿色箭头)。当肌肉纤维在收缩期间移动到焦点之外时,就会出现运动伪影。 请点击此处查看此图的大图。
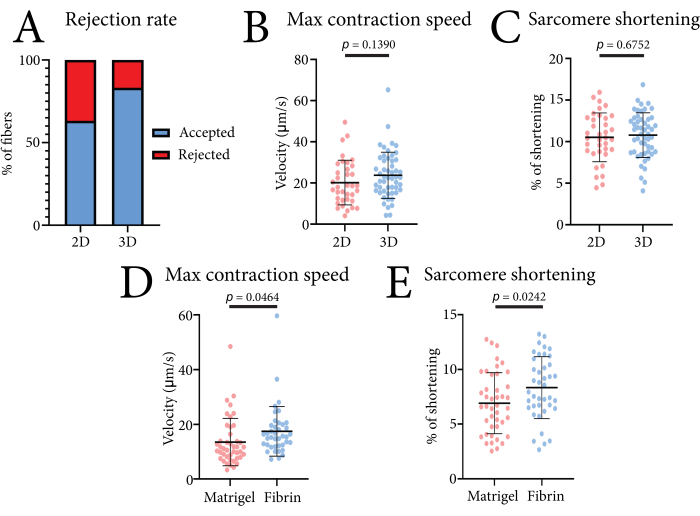
图 4:比较 2D 与 3D 条件以及不同水凝胶时,使用基于光学的高通量收缩系统获得的代表性数据 。 (A) 数据分析程序在 2D 培养和 3D 培养中基于 30 次测量发现的接受和拒绝收缩测量的百分比。(B)培养24小时后从三只小鼠分离的2D培养和3D培养肌纤维的最大收缩速度的比较。(C)培养24小时后从三只小鼠分离的2D培养和3D培养肌纤维中肌节缩短的比较。(D)培养24小时后从三只小鼠分离的纯基底膜基质(Matrigel)包埋和纤维蛋白水凝胶包埋肌纤维的最大收缩速度比较。(E)培养24小时后从三只小鼠分离的纯基底膜基质(Matrigel)包埋和纤维蛋白水凝胶包埋肌纤维的肌节缩短的比较。数据使用学生t检验进行分析,显示为平均值±SD。每个数据点是一根肌肉纤维。 请点击此处查看此图的大图。
表1:用于解剖肌肉的解剖培养基、用于培养分离的肌肉纤维的纤维蛋白培养基以及用于酶消化分离的肌肉的肌肉消化培养基的组成。请按此下载此表格。
表2:用于灌制水凝胶的细胞混合物和用于浇注水凝胶的基质混合物的组成。请按此下载此表格。
讨论
在这里,我们详细介绍了一个以3D培养形式对FDB肌纤维进行酶分离和培养的方案,然后使用基于光学的收缩测量系统进行收缩测量。该方案具有许多优点,包括1)从单个肌肉中直接及时地分离许多完整的肌肉纤维;2)将肌纤维嵌入可调水凝胶基质中;3)使用基于光学的系统进行高通量收缩性测量的性能;4)干预后对相同肌肉纤维进行重复测量的能力。单个活肌纤维的分离提供了保留其收缩功能的成熟肌肉细胞。由于从小鼠FDB获得的肌纤维相对较小,因此在分离过程中很容易操纵它们并保持其笔直形状,从而允许进行下游收缩测量。尽管该系统主要用于研究心肌细胞收缩,但骨骼肌纤维包含相同的收缩机制,具有易于区分的肌节图案,因此也可以使用该系统进行测量29。单细胞收缩测量与活体 离体 肌纤维培养的耦合是评估成熟肌纤维健康和响应电激活功能的有力工具。
使用解离肌纤维的一个局限性是缺乏施加到纤维上的外力(即被动拉伸),与 体内发现的肌节相比,这导致静息肌节长度较低。虽然 2.4-2.5 μm 的肌节长度可确保最佳的力产生,但静息肌节长度可能会有很大差异33。虽然FDB的 体内 静息肌节长度尚未被描述,但我们自己未发表的数据表明平均长度为2.2μm。目前的结果显示,在培养24小时后,卸载的FDB纤维中平均静息肌节长度为~1.95μm(图3)。虽然这种较低的静息肌节长度会导致较低的力产生,但~1.95μm的长度仍应产生最大力的>90%34。因此,这些肌节长度应足以确定不同遗传模型之间或药物治疗后的纤维功能差异。此外,与自由浮动的2D培养纤维相比,纤维在水凝胶中的嵌入提供了许多额外的粘附点,这将限制肌节随着时间的推移进一步缩短。
与其他肌肉(例如指长伸肌 (EDL))相比,这种肌纤维分离方案的一个优点是使用易于解剖的快肌,该肌肉由相对较小的肌纤维组成。它们的较小尺寸使肌肉隔离更适合基于研磨的分离,从而减少移液管或缠结引起的肌肉纤维损伤的机会。FDB肌肉的细胞外基质可以很容易地用胶原酶酶消化,允许在短时间内分离数百种肌肉纤维。然而,过度消化会导致肌肉纤维受损。当肌肉在磨擦肌肉时几乎立即分崩离析或在细胞接种过程中大部分细胞体积过度收缩时,可以识别出肌肉纤维的过度消化。为了防止肌肉过度消化,需要针对每个胶原酶批次优化消化时间。为了测试这一点,两个FDB肌肉应该并行消化,它们之间的交错消化时间为5分钟。应选择活肌纤维产量最高的消化时间。然后应第二次执行此优化,再次在消化时间内分离5分钟。产生最高活性肌纤维的消化时间应用作当前批次胶原酶的最佳消化时间。限制胶原酶批次间变异性的另一种方法是直接计算每毫升储备溶液的活性单位,然后将后续胶原酶批次重新配制成相同的量。最后,可能需要优化不同小鼠品系的消化时间,例如,如果研究表现出细胞外基质沉积增加的衰老或患病动物35,36。
移液活的分离肌纤维的可能性为在各种培养条件下培养FDB肌纤维提供了可能性。其中一种选择是在水凝胶中培养这些纤维以模拟天然组织培养环境。该包埋方案可确保纤维在收缩测量期间保持原位,并经过优化,允许纤维在凝胶凝固之前沉降到板底部。然而,可能需要调整该方案以适应凝血酶和纤维蛋白原储备的差异。如果凝血酶活性过高,凝胶会过早凝固,纤维可能会悬浮在显微镜焦平面外的较高位置。如果发生这种情况,需要调整凝血酶:纤维蛋白原的比例。这可以通过电镀凝血酶浓度越来越低的纤维并注意聚合需要多长时间来测试。通常,这不应该发生在 30 分钟以上。然而,凝血酶浓度过低也可能损害聚合过程。确保纤维处于正确焦平面的另一种方法是首先使用2D方案播种,然后在纤维粘附到培养板上后在纤维上添加一层水凝胶。然而,应该意识到,从纤维中去除培养基可能会引起过度收缩,因为它们对干燥很敏感。目前还不清楚水凝胶是否会完全附着在培养板上,并且可能更容易松动。因此,这种包埋程序对于保持纤维存活和收缩测量是优选的。
该协议的使用能够 研究 成熟肌纤维的体外收缩动力学,并且可以应用于健康小鼠和携带肌肉疾病基因突变的小鼠。同样,它可以测试培养条件或添加化合物如何影响肌纤维功能。使用基于光学的系统获得的收缩数据表明了活的单肌纤维的收缩能力,并且这种能力的变化可以与纤维健康相关。然而,仅凭这些数据不足以确定这些变化是否发生在肌动蛋白-肌球蛋白交叉桥接或肌肉收缩的钙释放阶段。虽然我们没有描述在该协议中测量钙信号传导的方法,但该设置也能够测量收缩肌肉细胞中基于Fura的钙瞬变29。该系统的一个缺点是FDB肌肉仅包含快抽搐IIa/IIx型肌纤维,而含有这种大小的慢抽搐I型纤维的肌肉尚未描述37。这消除了使用这种方法研究光纤类型特定功能的能力。我们在这里提出的协议可能适用于其他肌肉,如EDL或比目鱼肌,以研究纤维类型差异。由于它们的尺寸较大,该协议需要针对这些肌肉进一步优化。在重力沉降步骤中,较长的纤维往往会缠结,如果通过移液操作,就会破裂,从而导致产量降低。由于它们与移液不相容,因此较长的纤维与凝胶包埋技术的相容性也较差。这些纤维的测量仍然可以以2D培养形式进行,但由于纤维的大小,它们在收缩过程中可能会移动更多,从而影响信噪比。该系统的另一个限制是无法在收缩测量的同时进行力测量,例如可以使用其他完整肌纤维制剂获得的力测量28。然而,可以通过估计肌肉纤维产生的力来规避这一限制。如果已知收缩和松弛状态下的肌肉纤维形状以及基质的杨氏模量,则可以估计肌肉纤维的产生力25。尽管如此,这种基于光学的系统为研究肌肉收缩功能提供了一种易于使用的高通量方法,并为研究遗传性肌肉疾病和治疗干预开辟了一系列新的可能性。
披露声明
作者没有利益冲突需要声明。
致谢
作者要感谢Sylvia Bogaards,Sanna Luijcx,Valentijn Jansen,Michiel Helmes和Emmy Manders在帮助开发该协议方面的技术专长。这项工作得到了肌肉萎缩症协会(MDA603238 TJ K发展奖)、荷兰心血管联盟(TJK 人才资助)和国家健康与医学研究委员会(NHMRC,澳大利亚;奖学金APP1121651到M.Y)。
材料
| Name | Company | Catalog Number | Comments |
| Aprotinin, from Bovine Lung | Thermo Scientific | AAJ63039MC | 100 mM stock solution in PBS can be stored at -20 °C. Sterilize stock solution using a 0.22 µm filter. |
| Collagenase type 2 | Worthington | 77336 | 10% (w/v) stock solution can be stored at -20 °C. Weighing collagenase should be done in a safety cabinet as inhalation is dangerous. |
| Fetal Bovine Serum | Thermo Fisher | 10500064 | |
| Fibrinogen from Bovine Plasma | Sigma Aldrich | 50-176-5054 | 20 mg/mL stock solution in PBS can be stored at -80 °C. Sterilize stock solution using a 0.22 µm filter. |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher | A1413201 | 4 mg/mL stock solution is prepared in MEM and stored at -20 °C. |
| Gibco MEM High glucose + pyruvate | Thermo Fisher | 11095080 | |
| Horse serum | Thermo Fisher | H1270 | |
| Matrigel GFR Membrane Matrix | Corning | CB-40230 | 4 mg/mL stock solution is prepared in MEM and stored at -20 °C. |
| Penicillin/Streptomycin | Sigma Aldrich | P4333 | |
| Serum Replacement 2 (50x) | Sigma Aldrich | S9388 | |
| Thrombin, Bovine Plasma | Thermo Scientific | AAJ63383EXP | 125 U/mL stock in PBS can be stored at -20 °C. Sterilize stock solution using a 0.22 µm filter. |
| Tranexamic Acid | Thermo Scientific | AC228042500 | 80 mM stock solution in PBS can be stored at -20 °C. Sterilize stock solution using a 0.22 µm filter. |
| Equipment | |||
| 24-well electrical stimulator | IonOptix | N/a | |
| Dumont #55 Forceps | Fine Science Tools | 11295-51 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| MultiCell Cytocypher | IonOptix | N/a | |
| MyoCam-S3 | IonOptix | N/a | |
| MyoPacer | IonOptix | N/a | |
| SYLGARD 184 silicone elastomer, Base & Curing Agent | Dow corning | N/a | |
| Vannas Spring Scissor - 25 mm Cutting Edge | Fine Science Tools | 15002-08 | |
| Software | |||
| CytoSolver | IonOptix | N/a | |
| IonWizard | IonOptix | N/a |
参考文献
- Smith, L. R., Meyer, G. A. Skeletal muscle explants: Ex-vivo models to study cellular behavior in a complex tissue environment. Connective Tissue Research. 61 (3-4), 248-261 (2020).
- Khodabukus, A., Prabhu, N., Wang, J., Bursac, N. In vitro tissue-engineered skeletal muscle models for studying muscle physiology and disease. Advanced Healthcare Materials. 7 (15), 1701498 (2018).
- Fernandez-Costa, J. M., Fernandez-Garibay, X., Velasco-Mallorqui, F., Ramon-Azcon, J. Bioengineered in vitro skeletal muscles as new tools for muscular dystrophies preclinical studies. Journal of Tissue Engineering. 12, 2041731420981339 (2021).
- Romagnoli, C., Iantomasi, T., Brandi, M. L. Available in vitro models for human satellite cells from skeletal muscle. International Journal of Molecular Sciences. 22 (24), 13221 (2021).
- Dessauge, F., Schleder, C., Perruchot, M. -. H., Rouger, K. 3D in vitro models of skeletal muscle: Myopshere, myobundle and bioprinted muscle construct. Veterinary Research. 52 (1), 72 (2021).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell Biology International. 37 (2), 191-196 (2013).
- Guo, X., et al. In vitro differentiation of functional human skeletal myotubes in a defined system. Biomaterials Science. 2 (1), 131-138 (2014).
- Denes, L. T., et al. Culturing C2C12 myotubes on micromolded gelatin hydrogels accelerates myotube maturation. Skeletal Muscle. 9 (1), 17 (2019).
- Pimentel, M. R., Falcone, S., Cadot, B., Gomes, E. R. In vitro differentiation of mature myofibers for live imaging. Journal of Visualized Experiments. (119), e55141 (2017).
- Khodabukus, A. Tissue-engineered skeletal muscle models to study muscle function, plasticity, and disease. Frontiers in Physiology. 12, 619710 (2021).
- Engler, A. J., et al. Myotubes differentiate optimally on substrates with tissue-like stiffness: Pathological implications for soft or stiff microenvironments. Journal of Cell Biology. 166 (6), 877-887 (2004).
- Huang, N. F., et al. Myotube assembly on nanofibrous and micropatterned polymers. Nano Letters. 6 (3), 537-542 (2006).
- Earle, A. J., et al. Mutant lamins cause nuclear envelope rupture and DNA damage in skeletal muscle cells. Nature Materials. 19 (4), 464-473 (2020).
- Stange, K., Ahrens, H. E., von Maltzahn, J., Rontgen, M. Isolation and ex vivo cultivation of single myofibers from porcine muscle. In Vitro Cellular and Developmental Biology. Animal. 56 (8), 585-592 (2020).
- Ravenscroft, G., et al. Dissociated flexor digitorum brevis myofiber culture system--A more mature muscle culture system. Cell Motility and the Cytoskeleton. 64 (10), 727-738 (2007).
- Ramsey, R. W., Street, S. F. The isometric length-tension diagram of isolated skeletal muscle fibers of the frog. Journal of Cellular and Comparative Physiology. 15 (1), 11-34 (1940).
- Selvin, D., Hesse, E., Renaud, J. M. Properties of single FDB fibers following a collagenase digestion for studying contractility, fatigue, and pCa-sarcomere shortening relationship. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 308 (6), R467-R479 (2015).
- Renzini, A., et al. Culture conditions influence satellite cell activation and survival of single myofibers. European Journal of Translational Myology. 28 (2), 7567 (2018).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and culture of individual myofibers and their satellite cells from adult skeletal muscle. Journal of Visualized Experiments. (73), e50074 (2013).
- Holmberg, J., Durbeej, M. Laminin-211 in skeletal muscle function. Cell Adhesion and Migration. 7 (1), 111-121 (2013).
- Stuelsatz, P., Keire, P., Yablonka-Reuveni, Z. Isolation, culture, and immunostaining of skeletal muscle myofibers from wildtype and nestin-GFP mice as a means to analyze satellite cell. Methods in Molecular Biology. 1556, 51-102 (2017).
- Alkhateeb, H., Chabowski, A., Bonen, A. Viability of the isolated soleus muscle during long-term incubation. Applied Physiology, Nutrition, and Metabolism. 31 (4), 467-476 (2006).
- Roche, S. M., Gumucio, J. P., Brooks, S. V., Mendias, C. L., Claflin, D. R. Measurement of maximum isometric force generated by permeabilized skeletal muscle fibers. Journal of Visualized Experiments. (100), e52695 (2015).
- Ottenheijm, C. A., et al. Altered myofilament function depresses force generation in patients with nebulin-based nemaline myopathy (NEM2). Journal of Structural Biology. 170 (2), 334-343 (2010).
- Rausch, M., et al. Measurement of skeletal muscle fiber contractility with high-speed traction microscopy. Biophysical Journal. 118 (3), 657-666 (2020).
- de Winter, J. M., et al. KBTBD13 is an actin-binding protein that modulates muscle kinetics. Journal of Clinical Investigation. 130 (2), 754-767 (2020).
- Wijnker, P. J. M., vander Velden, J. Mutation-specific pathology and treatment of hypertrophic cardiomyopathy in patients, mouse models and human engineered heart tissue. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1866 (8), 165774 (2020).
- Cheng, A. J., Westerblad, H. Mechanical isolation, and measurement of force and myoplasmic free [Ca(2+)] in fully intact single skeletal muscle fibers. Nature Protocols. 12 (9), 1763-1776 (2017).
- Cao, L., Manders, E., Helmes, M. Automatic detection of adult cardiomyocyte for high throughput measurements of calcium and contractility. PLoS One. 16 (9), e0256713 (2021).
- Geckil, H., Xu, F., Zhang, X., Moon, S., Demirci, U. Engineering hydrogels as extracellular matrix mimics. Nanomedicine. 5 (3), 469-484 (2010).
- Lin, C. C., Anseth, K. S. PEG hydrogels for the controlled release of biomolecules in regenerative medicine. Pharmaceutical Research. 26 (3), 631-643 (2009).
- Cold Spring Harbor Protocols. Sylgard-coated coverslips and petri dishes. Cold Spring Harbor Protocols. 2022 (8), (2022).
- Moo, E. K., Fortuna, R., Sibole, S. C., Abusara, Z., Herzog, W. In vivo sarcomere lengths and sarcomere elongations are not uniform across an intact muscle. Frontiers in Physiology. 7, 187 (2016).
- Moo, E. K., Leonard, T. R., Herzog, W. The sarcomere force-length relationship in an intact muscle-tendon unit. Journal of Experimental Biology. 223, 215020 (2020).
- Schuler, S. C., et al. Extensive remodeling of the extracellular matrix during aging contributes to age-dependent impairments of muscle stem cell functionality. Cell Reports. 35 (10), 109223 (2021).
- Carberry, S., Zweyer, M., Swandulla, D., Ohlendieck, K. Proteomics reveals drastic increase of extracellular matrix proteins collagen and dermatopontin in the aged mdx diaphragm model of Duchenne muscular dystrophy. International Journal of Molecular Medicine. 30 (2), 229-234 (2012).
- Tarpey, M. D., et al. Characterization and utilization of the flexor digitorum brevis for assessing skeletal muscle function. Skeletal Muscle. 8 (1), 14 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。