Method Article
دليل على تعبير EpCAM و Cytokeratin عن الخلايا الظهارية في الدم البشري الطبيعي والفئران ونخاع العظام
In This Article
Summary
تقدم هذه الورقة طريقة قابلة للتكرار مع نتائج جديدة حول وجود الخلايا الظهارية في دم الإنسان والفأر الطبيعي ونخاع العظام باستخدام قياس التدفق الخلوي والفحص المجهري المناعي. تم استخدام الفئران المعدلة وراثيا Krt1-14 ؛ mTmG كطريقة في الجسم الحي لتأكيد هذه النتائج.
Abstract
تم تحديد الخلايا الظهارية في الدم ونخاع العظام لمرضى السرطان وأمراض أخرى. ومع ذلك ، فإن وجود الخلايا الظهارية الطبيعية في الدم ونخاع العظام للأفراد الأصحاء لم يتم تحديده بعد بطريقة متسقة. تظهر هنا طريقة قابلة للتكرار لعزل الخلايا الظهارية من الدم البشري السليم والفئران ونخاع العظام (BM) باستخدام قياس التدفق الخلوي والفحص المجهري المناعي (IF). تم تحديد الخلايا الظهارية في الأفراد الأصحاء لأول مرة وعزلها عن طريق قياس التدفق الخلوي باستخدام جزيء التصاق الخلايا الظهارية (EpCAM). تم تأكيد أن خلايا EpCAM + هذه تعبر عن الكيراتين باستخدام الفحص المجهري المناعي في الفئران المعدلة وراثيا Krt1-14 ؛ mTmG. كانت عينات الدم البشرية تحتوي على 0.18٪ ± 0.0004 خلية EpCAM + (SEM ؛ n = 7 مكررات بيولوجية ، 4 نسخ تجريبية مكررة). في BM البشري ، كان 3.53٪ ± 0.006 (SEM ؛ n = 3 نسخ بيولوجية ، 4 نسخ تجريبية مكررة) من الخلايا أحادية النواة EpCAM +. في دم الفأر ، شكلت خلايا EpCAM + 0.45٪ ± 0.0006 (SEM ؛ n = 2 مكررات بيولوجية ، 4 تكرارات تجريبية) ، وفي الفئران BM ، 5.17٪ ± 0.001 (SEM ؛ n = 3 مكررات بيولوجية ، 4 نسخ مكررة تجريبية) كانت EpCAM +. في الفئران ، كانت جميع خلايا EpCAM + مناعية لعموم السيتوكيراتين ، على النحو الذي يحدده الفحص المجهري IF. تم تأكيد النتائج باستخدام الفئران المعدلة وراثيا Krt1-14 ؛ mTmG ، مع انخفاض (8.6 خلايا GFP + أصلية لكل 106 خلايا تم تحليلها ؛ 0.085٪ من الخلايا القابلة للحياة) ، ولكن أعداد كبيرة (p < 0.0005) من خلايا GFP + الموجودة في الفئران الطبيعية BM ، والتي لم تكن نتيجة للعشوائية مقارنة مع الضوابط السلبية المتعددة. علاوة على ذلك ، كانت خلايا EpCAM + في دم الفئران أكثر تجانسا من خلايا CD45 + (0.58٪ في BM ؛ 0.13٪ في الدم). خلصت هذه الملاحظات إلى أن الخلايا التي تعبر عن بروتينات السيتوكيراتين قابلة للتكرار بين الخلايا أحادية النواة من دم الإنسان والفئران و BM. نوضح طريقة لحصاد الأنسجة ، وقياس التدفق الخلوي ، والتلوين المناعي التي يمكن استخدامها لتحديد وتحديد وظيفة هذه الخلايا الظهارية للسيتوكيراتين في الأفراد الأصحاء.
Introduction
توجد الخلايا الظهارية في الحواجز المادية بين أجسامنا والبيئة وهي قادرة على التعرف على التغيرات في بيئتها المكروية والاستجابة لها1. لديهم مكانة الخلايا الجذعية المتكاثرة التي توفر وسيلة لتسليم الأنسجة الجديدة وإصلاح الضرر2. يدرس مختبرنا الخلايا الجذعية في بصيلات الشعر في الجلد. الجلد هو نموذج جيد لدراسة الأنسجة الظهارية وتكاثر الخلايا الجذعية لأنه يمكن رؤيته بسهولة وهناك دوران مستمر للخلايا. السرطانات الظهارية هي أكثر أشكال السرطان شيوعا ، ربما بسبب الأنسجة الظهارية ، مثل الجلد ، كونها خط الدفاع الأول ضد المواد المسرطنة البيئية ، مما يؤدي إلى ارتفاع معدلات الدوران وتكاثر الخلايا الظهارية3. تتكون معظم البشرة الجلدية ، الطبقة الواقية العليا ، من الخلايا الكيراتينية ، والتي تعبر عن أنواع مختلفة من الكيراتين لتوفير الدعم والبنية4. المرضى الذين يعانون من السرطانات الظهارية غالبا ما يكون لديهم خلايا ظهارية موجودة في دمائهم ونخاع العظام التي تعبر أيضا عن الكيراتين. الخزعات السائلة هي طريقة غير جراحية لاكتشاف ومراقبة هذه الخلايا الظهارية في سوائل الجسم المختلفة5. توجد الخلايا الظهارية المنتشرة ، والتي تسمى أيضا الخلايا السرطانية المنتشرة (CTCs) ، في الدم المحيطي ويمكن أن تكون مؤشرات حيوية لتشخيص السرطان ، بالإضافة إلى توجيه علاجات العلاج الفردية. يمكن أن تشير CTCs أيضا إلى تطور المرض وفعالية العلاج وبقاء المريض بشكل عام 5,6.
جزيء التصاق الخلايا الظهارية (EpCAM) هو علامة مستخدمة سريريا ل CTCs ويمكنه تحديد الأورام ذات الأصل الظهاري في مرضى السرطان. يلعب EpCAM دورا في التصاق الخلايا ، والترحيل ، والإشارات ، والانتشار ، والتمايز6. لكي تصنف الخلية الظهارية المنتشرة على أنها CTC ، يجب أن تكون موجبة للسيتوكيراتين 8 و 18 و 19 ، وسالبة ل CD45 ، وهي علامة كريات الدم البيضاء الشائعة6. عادة ما يتم تحديد CTCs عن طريق استنفاد CD45 أولا مع الميكروبيدات المغناطيسية ، يليه اختبار EpCAM والسيتوكيراتين 19 باستخدام المجهر المناعي7. القيد الرئيسي في الكشف عن CTCs هو ندرتها. وهي تشكل أقل من 0.01٪ من جميع الخلايا في الدم ، وقليل جدا منها يعيش في الدورة الدموية للوصول إلى الأعضاء البعيدة8،9،10. يجب مراعاة تصميم التجارب والتقنيات لعزل وتحديد هذه الخلايا بسبب طبيعتها النادرة. حاليا ، لا يوجد سوى فارز آلي أحادي الخلية معتمد من إدارة الغذاء والدواء (FDA) يستخدم لتحديد CTCs ، ويستخدم EpCAM كعلامة حيوية له. تشمل الطرق الأخرى فصل الخرزة المغناطيسية وقياس التدفق الخلوي ، أو مزيج من هذه الطرق. هناك حاجة إلى تقنيات جديدة ذات حساسية وخصوصية أعلى للكشف عنCTCs 11 النادرة.
قياس التدفق الخلوي هو طريقة مفضلة للكشف عن مجموعات الخلايا النادرة في الدم ونخاع العظام وعينات الأنسجة الأخرى. يمكن أن تشمل هذه الخلايا النادرة الخلايا الجذعية والخلايا البطانية المنتشرة و CTCs وخلايا المرض المتبقية. يتيح قياس التدفق الخلوي إجراء قياسات كمية لكل نوع من الخلايا وفرز هذه الخلايا لإجراء مزيد من الاختبارات 7,9. تم إجراء تعداد تدريجي لضمان تقييم دقيق لهذه الخلايا النادرة. القدرة على استخدام البوابات لاستبعاد الخلايا من مزيد من التحليل هي وسيلة لزيادة الخصوصية عند تحليل الخلايا. قيود قياس التدفق الخلوي هي الوقت اللازم لتحليل العينات الكبيرة وعدم وجود تأكيد مرئي لهوية الخلية. للتغلب على هذا ، تم إجراء الفحص المجهري المناعي على الخلايا المصنفة لتأكيد هوياتها.
أظهر مختبرنا سابقا أنه في الفئران يتم تجنيد خلايا نخاع العظم وتساهم في أورام الجلد12. هذه الخلايا المشتقة من نخاع العظم إيجابية لعموم السيتوكيراتين وسيتوكيراتين البشرة. لمزيد من توضيح دور الخلايا الجذعية الظهارية والخلايا المشتقة من نخاع العظام والخلايا المعبرة عن السيتوكيراتين في تطور الورم ، تم البحث عن الخلايا الإيجابية للسيتوكيراتين EpCAM + في الفئران الطبيعية والدم البشري وعينات نخاع العظام. كما هو الحال مع معظم التجارب ، تم تطوير هذه الطريقة من خلال تكرارات متعددة. في السابق ، تم استخدام الفئران المعدلة وراثيا جنبا إلى جنب مع الأعداد الإضافية للبحث عن الخلايا المعبرة عن K14GFP في نخاع العظم12. مع عد المزيد من الخلايا، أمكن تحديد مجموعة تمثيلية من الخلايا النادرة، كما هو موضح في الشكل 1 في قسم النتائج التمثيلية. استند الأساس المنطقي للتحقيق في الخلايا الظهارية في الدم الطبيعي ونخاع العظام إلى الأدبيات المبكرة حول CTCs ، حيث كان لدى المتبرعين الأصحاء العاديين مستويات خلفية من خلايا EpCAM+ 13. كما ذكرنا سابقا ، غالبا ما يبدأ توصيف EpCAM باستنفاد CD45. تم حذف هذه الخطوة لأن بعض الخلايا المكونة للدم لها تعبير EpCAM و cytokeratin لأسباب غير معروفة تحتاج إلى مزيد من التحقيق. لذلك ، تم فرز الخلايا بناء على وجود أو عدم وجود EpCAM ، بغض النظر عن نسب الخلية ، ثم تم تطوينها المناعية للسيتوكيراتين. يصف البروتوكول الآتي وسير العمل الموضح في الشكل 2 تقنية تستخدم قياس التدفق الخلوي مع التعويض والضوابط، والطرق الإحصائية، والتصوير المناعي لعزل هذه المجموعات النادرة من الخلايا الطلائية وتحديدها.
Protocol
تمت الموافقة على جميع بروتوكولات الحيوانات من قبل لجنة رعاية واستخدام الحيوانات المؤسسية بجامعة مينيسوتا وفقا للمعاهد الوطنية للصحة والمبادئ التوجيهية الفيدرالية. تم شراء الدم البشري الطازج ونخاع العظام من مصادر تجارية. تم جمع العينات من قبل الشركة بموجب بروتوكول IRB معتمد من متبرعين سلبيين لفيروس نقص المناعة البشرية والتهاب الكبد B والتهاب الكبد C وفحصها بحثا عن COVID-19. تم أولا إلغاء تحديد هوية جميع العينات وإخفاء هويتها قبل شحنها من قبل الشركة. نظرا لأنه تم الحصول عليها تجاريا ، لم تكن هناك حاجة إلى موافقة IRB.
1. إعداد الحلول
ملاحظة: يجب تحضير جميع المحاليل في غطاء بيولوجي مع بيئة معقمة. الحصول على شهادة السلامة البيولوجية المستوى 2 (BSL2) للعمل مع الدم البشري ونخاع العظام.
- تحضير محلول حصاد نخاع العظم بإضافة 1 مل من الجنتاميسين و 5 مل من مصل الجنين البقري (FBS) إلى 500 مل من محلول ملح التوازن هانك (HBSS).
- قم بإعداد محلول المخزن المؤقت للتلطيخ بإضافة 50 مل من FBS إلى 500 مل من HBSS.
- قم بإعداد 1x محلول تحلل من خلال الجمع بين 10 مل من محلول تحلل 10x مع 90 مل من الماء المعقم.
2. تحضير غطاء المحرك
- قم بتشغيل غطاء المحرك واتركه يعمل لبضع دقائق للحصول على تدفق هواء مناسب.
- جمع كل المواد لأداء حصاد نخاع العظام. رشها داخل الغطاء بإيثانول 70٪ للحفاظ على بيئة معقمة. رش اليدين في كل مرة قبل أن يتم أخذها داخل الغطاء.
- ضع صينية التعقيم في الغطاء مع مقص معقم ومشرط مجمع وملاقط وملقط منحني في كوب صغير مملوء بالإيثانول بنسبة 70٪ لإبقائها معقمة.
- أضف 10 مل من محلول حصاد نخاع العظم إلى أنبوب طرد مركزي سعة 50 مل وقم بتسميته "أطراف". قم بتسمية أنبوب طرد مركزي آخر سعة 50 مل باسم "نخاع العظام".
- ارسم 10 مل من محلول حصاد نخاع العظم في حقنة ثم قم بتوصيل إبرة 26 جرام.
3. حصاد نخاع العظام من الفئران
- القتل الرحيم للماوس باستخدام اختناق CO2 . يتم تأكيد الوفاة من خلال عدم وجود نبضات القلب وقرص القدمين لضمان عدم وجود رد فعل. يمكن إجراء خلع عنق الرحم كوسيلة ثانوية للقتل الرحيم الكامل.
- ضع الماوس في وعاء سعة 500 مل وأضف ما يكفي من اليود لتغطية نصف الفأر. هز الحاوية برفق وقم بتدويرها لضمان تغطية شاملة. شطف بالماء منزوع الأيونات. قم بإجراء غسل آخر باليود ، ثم غسلتين بنسبة 70٪ من الإيثانول باتباع نفس الخطوات.
- ضع الماوس في الغطاء وضعه على ظهره على الدرج. أمسك الأرجل الخلفية واسحبها بعيدا حتى تشعر بالفرقعة ؛ هذا لفصل الساقين عن العمود الفقري.
- قم بعمل شق 1 سم على جلد الفأر بالقرب من منطقة الفخذ. أدخل مقصا مغلقا في الشق ثم افتح المقص تحت الجلد لفصله عن الصفاق.
- قطع الجلد على الساق حول الفخذ ، ثم قطع الجلد أسفل الساق لكشف العضلات والعظام.
- قم بإزالة الساقين الخلفيتين عن طريق قطع مفصل الورك ، مع التأكد من عدم قطع عظم الفخذ. ضع الأطراف في الأنبوب المسمى "الأطراف" عند إزالة كلتا الساقين ، ضع الماوس في كيس الذبيحة وضعه في الثلاجة.
ملاحظة: يجب تحسس عظم الورك أولا قبل القطع لتوجيه المقص وتجنب قطع عظم الفخذ ، حيث يتم الحصول على معظم نخاع العظم من عظم الفخذ. - ابدأ في قطع العضلات والأنسجة والدهون على طول أحد الأطراف باستخدام المقص. قطع موازية للعظم. ثم استخدم المشرط وقم بإزالة الدهون أو العضلات المتبقية ، باستخدام حركة كشط عمودية على العظام.
- بمجرد تنظيف العظم بشكل صحيح ، افصل عظم الفخذ والساق عند الركبة. استخدم المشرط لعمل جروح على طرفي عظم الفخذ والساق حيث لا يوجد نخاع عظمي مرئي.
- أدخل المحقنة والإبرة المحضرة في العظم. إذا كانت هناك مقاومة ، فقم بقطع المزيد من نهاية العظم حتى لا يكون هناك المزيد من المقاومة.
- أثناء إمساك العظم فوق الأنبوب المسمى "نخاع العظام" ، اطرد محلول حصاد نخاع العظم من خلال العظم لطرد نخاع العظم في الأنبوب. كرر على الطرف الآخر من العظم للحصول على بقية نخاع العظم ، حتى يظهر العظم أبيض أو فارغا.
- كرر الخطوات 7-9 لجميع العظام والأطراف المتبقية ؛ سيتم مسح كل النخاع في نفس الأنبوب المخروطي.
- باستخدام حقنة فارغة سعة 10 مل وإبرة 20 جم ، قم بتفتيت كتل نخاع العظم في الأنبوب عن طريق سحب نخاع العظم لأعلى ولأسفل في المحقنة 5-10 مرات.
- أضف مرشحا معقم 40 ميكرومتر إلى أنبوب طرد مركزي نظيف سعة 50 مل واشطفه ب 1 مل من محلول حصاد نخاع العظام. ثم قم بتصفية نخاع العظم لإزالة أي كتل متبقية. قم بتسمية هذا الأنبوب "نخاع العظم المصفى".
- قم بتخزين نخاع العظم المصفى في الثلاجة أو على الثلج حتى الاستخدام. يجب استخدامه في نفس يوم الحصاد. إذا لم يتم استخدامها في نفس اليوم ، فقم بتجميد الخلايا باستخدام مادة حافظة بالتبريد ، مثل ثنائي ميثيل سلفوكسيد (DMSO).
تنبيه: يجب التخلص من جميع النفايات الناتجة عن هذه التجارب بشكل صحيح في حاوية نفايات بيولوجية. يجب وضع جميع الأدوات الحادة في حاوية أدوات حادة ذات مخاطر بيولوجية تحمل علامات صحيحة.
4. تحلل خلايا الدم الحمراء من نخاع العظام
- أجهزة الطرد المركزي خلايا نخاع العظم عند 170 × جم لمدة 10 دقائق في درجة حرارة الغرفة. فراغ والتخلص من طاف. إعادة تعليق الخلايا في 10 مل من 1x العازلة تحلل خلايا الدم الحمراء واحتضانها لمدة 4 دقائق.
- أضف 30 مل من محلول ملحي مخزن بالفوسفات من Dulbecco (DPBS) لإيقاف تفاعل محلول التحلل. أجهزة الطرد المركزي الخلايا لمدة 8 دقائق عند 170 × جم في درجة حرارة الغرفة. فراغ والتخلص من طاف. إعادة تعليق في 10-20 مل من العازلة تلطيخ.
5. عدد الخلايا
- اجمع بين 500 ميكرولتر من الخلايا مع 9.5 مل من محلول حصاد نخاع العظم للحصول على تخفيف 1:20.
ملاحظة: سيتم استخدام هذا لتعداد الخلايا ولا يحتاج إلى إبقائه معقما. - اسحب 200 ميكرولتر من الخلايا من التخفيف 1:20 ، وأضفها إلى 200 ميكرولتر من التريبان الأزرق ، واخلطها جيدا.
- أضف الخليط إلى مقياس الدم وعد الخلايا الحية والميتة على كلا الجانبين. احسب تعليق الخلية الأصلي باستخدام هذا الجدول (كما هو موضح في الملف التكميلي 1) والمعادلات:
خلايا لكل ملليلتر: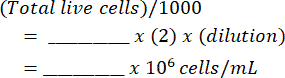
مجموع الخلايا: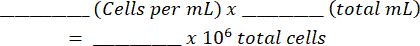
- قم بتدوير الخلايا عند 170 × جم لمدة 10 دقائق عند 4 درجات مئوية وأعد تعليقها إلى تركيز 10 × 10 6 لكل 1 مل (1 × 106 خلايا لكل 100 ميكرولتر) ، بناء على اقتراحات الشركة المصنعة لتخفيفات الأجسام المضادة.
- انتقل إلى قياس التدفق الخلوي (الخطوة 8).
6. حصاد الدم من الفئران
- القتل الرحيم للفأر باستخدام غاز CO2 أو خلع عنق الرحم.
- قم بإجراء سحب دم القلب بزاوية 45 درجة بإبرة 26 جم متصلة بحقنة سعة 1 مل مغلفة بحمض إيثيلين ديامينيترايتيك 0.5 متر (EDTA).
- قم بتدوير الدم وإعادة تعليقه في الوسائط أو المخزن المؤقت للتلطيخ.
ملاحظة: سيتم تدوير الخلايا وإعادة تعليقها إلى التركيز النهائي في مخزن مؤقت للتلوين بعد تحلل خلايا الدم الحمراء وعدد الخلايا. - إجراء تحلل خلايا الدم الحمراء (الخطوة 4).
- قم بإجراء عدد الخلايا (الخطوة 5).
- انتقل إلى قياس التدفق الخلوي (الخطوة 8).
7. معالجة عينات الدم البشري ونخاع العظام
- قم بتنفيذ جميع الإجراءات تحت غطاء محرك السيارة المعتمد من BSL2 أثناء ارتداء معدات الحماية الشخصية.
- جمع العينات في الليلة السابقة وإجراء تحلل خلايا الدم الحمراء. تأكد من إلغاء تحديد هوية العينات وإخفاء هويتها قبل شحن العينات أحادية النواة طوال الليل على الجليد.
- عند الوصول ، قم بتدوير الخلايا الحية عند 170 × جم عند 4 درجات مئوية لمدة 10 دقائق.
ملاحظة: هذه هي عينات BSL2 التي يجب أن تتبع الإرشادات المحلية. - أعد تعليق الخلايا في الوسائط أو المخزن المؤقت للتلطيخ.
ملاحظة: يجب تدوير الخلايا وإعادة تعليقها إلى التركيز النهائي بعد عد الخلايا باستخدام مخزن مؤقت للتلطيخ. - قم بإجراء عدد الخلايا (الخطوة 5).
- انتقل إلى قياس التدفق الخلوي (الخطوة 8).
8. قياس التدفق الخلوي
- تلطيخ
- قسم الخلايا إلى أنابيب مصنفة بشكل فردي بناء على لوحة التلوين المستخدمة ، بما في ذلك عناصر التحكم في التعويض (غير ملوثة ، وأدوات التحكم في النمط المتماثل ، والبقع الفردية ، والتألق ناقص تلك [FMOs]). قم بتجميد أي خلايا متبقية أو استخدمها لفرز الخلايا المنشطة بالفلورة. انظر الجدول 1 للحصول على مثال للوحة تلطيخ مع تخفيفات الأجسام المضادة المستخدمة.
ملاحظة: لكل فلوروفور إضافي يضاف ، يجب إضافة FMOs مع الفلوروفورات المتبقية مع بقعة واحدة من هذا الفلوروفور. يمكن استخدام عناصر التحكم في النمط المتماثل لمنع تلطيخ غير محدد. يجب معايرة كل جسم مضاد جديد مستخدم مع العينات من أجل التخفيف الأمثل. - أضف الأجسام المضادة وفقا للتخفيفات الموصى بها من قبل الشركة المصنعة واخلطها جيدا عن طريق تحريك الجزء السفلي من الأنابيب. عادة ما يتم إعطاء تركيزات الأجسام المضادة على شكل 1 × 106 خلايا لكل 100 ميكرولتر. التخفيفات مع الأجسام المضادة والضوابط موضحة في الجدول 1. تترافق الأجسام المضادة مع الفلوروفور ويجب حمايتها من الضوء.
ملاحظة: من الأفضل استخدام EpCAM المترافق مع phycoerythrin (PE) لتمكين تصور مجموعات منخفضة من الخلايا (معايرة عند 3-5 ميكرولتر لكل مليون خلية ، كما هو موضح في الجدول 1). تم استخدام PE-CD49f كعنصر تحكم في PE لبقعة واحدة (20 ميكرولتر لكل 1 مليون خلية) ، لأن هذه الخلايا أكثر انتشارا من PE-EpCAM وبالتالي أسهل في الاستخدام للتعويض. - احتضان لمدة 30 دقيقة في 4 درجة مئوية في الظلام.
- بعد الحضانة ، أعد الأنابيب إلى غطاء BSL2 وأضف 1 مل من محلول التلوين إلى كل أنبوب.
- ثم ، أجهزة الطرد المركزي الأنابيب في 170 × غرام في 4 درجة مئوية لمدة 5-10 دقائق.
- بعد الطرد المركزي ، أعد الأنابيب المغطاة مع الخلايا إلى غطاء BSL2 واستنشق المادة الطافية. تأكد من تغيير أطراف ماصة الشفط بين كل أنبوب لمنع التلوث المتبادل.
- أعد تعليق حبيبات الخلية في 1 مل من المخزن المؤقت للتلطيخ ونفض الغبار عن قاع الأنابيب للخلط.
- اغسل الخلايا مرتين أخريين بتكرار الخطوات 8.1.4-8.1.7.
ملاحظة: لا تستخدم الماصات للإنعاش ، لتجنب فقدان الخلايا. - أعد التعليق في 500 ميكرولتر من المخزن المؤقت للتلوين لإعادة التعليق النهائي قبل قياس التدفق الخلوي. أضف 4 ′،6-دياميدينو -2-فينيليندول (DAPI) أو مميز الخلايا الميتة ، وفقا لتوصيات الشركة المصنعة.
- قسم الخلايا إلى أنابيب مصنفة بشكل فردي بناء على لوحة التلوين المستخدمة ، بما في ذلك عناصر التحكم في التعويض (غير ملوثة ، وأدوات التحكم في النمط المتماثل ، والبقع الفردية ، والتألق ناقص تلك [FMOs]). قم بتجميد أي خلايا متبقية أو استخدمها لفرز الخلايا المنشطة بالفلورة. انظر الجدول 1 للحصول على مثال للوحة تلطيخ مع تخفيفات الأجسام المضادة المستخدمة.
- مقياس التدفق الخلوي
- بعد إعداد الجهاز ، استخدم عناصر التحكم و FMOs لتعيين التعويض والبوابات. استخدم محلول الملح المتوازن (HBSS) من هانك كسائل غمد للمساعدة في دعم الخلايا الهشة. استخدم PBS إذا لم يكن HBSS متاحا.
ملاحظة: يتم سرد مقياس التدفق الخلوي المستخدم والبرنامج في جدول المواد. - قم بتحميل العينات واحدة تلو الأخرى واجمع نقاط البيانات ل 50,000 و 100,000 و 500,000 ومليون حدث. احتفظ بالأنابيب على الثلج أو مبردة حتى الاستخدام.
ملاحظة: يمكن تعيين حد زمني عند التجميع لضمان صلاحية العينة. - اجمع الخلايا في 3 مل من RPMI مع 10٪ FBS في أنابيب طرد مركزي سعة 15 مل.
- في حالة إجراء التألق المناعي على خلايا EpCAM + ، استخدم مقياس التدفق الخلوي لفرز 800 إلى 1000 خلية في كل بئر من شريحة 8 آبار.
- قم بفرز مجموعة خلايا EpCAM على شرائح منفصلة كعنصر تحكم سلبي لاستخدامه عند تلطيخ التألق المناعي.
ملاحظة: يمكن أيضا فرز الخلايا إلى أنابيب سعة 15 مل تحتوي على FBS ونسجها على شريحة باستخدام جهاز الطرد المركزي الخلوي أو ماصة لمنع الخلايا من الفرقعة. - ثبت الشرائح في خليط 50٪ ميثانول / 50٪ أسيتون عند -20 درجة مئوية لمدة 10 دقائق. قم بتخزين الشرائح في درجة حرارة -20 درجة مئوية حتى تلطيخ بالتألق المناعي.
- بعد إعداد الجهاز ، استخدم عناصر التحكم و FMOs لتعيين التعويض والبوابات. استخدم محلول الملح المتوازن (HBSS) من هانك كسائل غمد للمساعدة في دعم الخلايا الهشة. استخدم PBS إذا لم يكن HBSS متاحا.
- تحليل التدفق الخلوي
- افتح برنامج تحليل التدفق الخلوي المرخص.
- تحميل ملفات قياس التدفق الخلوي القياسية (FCS) التي تم الحصول عليها من مقياس التدفق الخلوي مع عناصر التحكم والعينات.
- انقر فوق إنشاء مجموعة واستخدم الكلمات الأساسية لوضع العينات وعناصر التحكم في مجموعة.
ملاحظة: استخدم عنصر التحكم "بدون بقعة" للدخول في برنامج تحليل قياس التدفق الخلوي ، كما هو موضح في الشكل 3. - انقر نقرا مزدوجا فوق عينة عدم التحكم في البقع لفتح رسم بياني غير محدد.
- اضبط المحور ص للرسم البياني على SSC-A والمحور x على FSC-A (منطقة التشتت الجانبية بمنطقة التشتت الأمامية) ، مما يشير إلى حجم الخلية والتعقيد الداخلي.
- انقر على شكل المضلع في اللوحة العلوية اليسرى وقم بإنشاء بوابة حول الخلايا. تأكد من استبعاد الخلايا الموجودة على المحيط ، لأنها على الأرجح حطام. قم بتسمية هذه البوابة "الخلايا" ، كما هو موضح في الشكل 3 أ.
- بمجرد بوابة الخلايا ، انقر نقرا مزدوجا داخل شكل المضلع لفتح رسم بياني آخر في نافذة جديدة.
- اضبط المحور ص للرسم البياني الجديد على SSC-A والمحور x على SSC-W للتمييز المزدوج. انقر فوق شكل المضلع وأنشئ مستطيلا حول الخلايا المفردة. سمي هذا «الخلايا المفردة»، كما هو موضح في الشكل 3 ب.
- بمجرد بوابة الخلايا ، انقر نقرا مزدوجا داخل شكل المضلع لفتح رسم بياني آخر في نافذة جديدة.
- اضبط المحور ص على FSC-A والمحور x على DAPI-A (أو أي مميز للخلايا الميتة مستخدم).
- قم بإنشاء بوابة مضلعة حول الخلايا السالبة DAPI على الجانب الأيسر من الرسم البياني. سمها «الخلايا الحية»، كما هو موضح في الشكل 3ج.
- بمجرد بوابة الخلايا ، انقر نقرا مزدوجا داخل شكل المضلع لفتح رسم بياني آخر في نافذة جديدة.
- اضبط المحور ص على SSC-A والمحور x على EpCAM-PE (أو أي فلوروفور يستخدم لتحديد خلايا EpCAM). الخلايا الموجودة على اليسار سالبة EpCAM. إذا ظهرت أي خلايا على اليمين ، فهي إيجابية EpCAM.
- استخدم الرسم البياني EpCAM-PE لإنشاء بوابة مضلعة ، والتي تستبعد الخلايا الموجودة على اليسار وتتضمن فقط المساحة الفارغة على اليمين. قم بتسمية المنطقة الفارغة على اليمين داخل المضلع "EpCAM" ، كما هو موضح في الشكل 3D.
ملاحظة: هذا لا يوجد تحكم في البقع ، لذلك يجب ألا يكون هناك تعبير EpCAM. استخدم عنصر التحكم في عدم وجود بقع لتحديد الخلايا الإيجابية ل EpCAM. هذا يكمل استراتيجية البوابات للتعويض ، لذلك قد يتم إغلاق جميع الرسوم البيانية في هذا الوقت. - في صفحة مساحة العمل ، قم بتمييز نسب عدم وجود بقع باستخدام "الخلايا" و "الخلايا المفردة" و "الخلايا الحية" و "EpCAM". انقر بزر الماوس الأيمن وحدد نسخ التحليل إلى المجموعة. يؤدي هذا إلى نسخ إستراتيجية البوابات إلى جميع العينات المحملة الأخرى داخل المجموعة التي تم إنشاؤها مسبقا. إذا لم يتم إنشاء مجموعة في البداية، فيمكن إنشاؤها الآن عن طريق تحديد إنشاء مجموعة في الجزء العلوي الأيمن.
- راجع العينات داخل المجموعة وتحقق من بوابات المضلع المرسومة مسبقا للتأكد من ملاءمتها لجميع العينات وعناصر التحكم. يوفر هذا النسبة المئوية لعدد الخلايا وعددها.
- انقر فوق زر محرر التخطيط L في الزاوية اليسرى العليا أعلى "مساحة العمل". يمكن بعد ذلك ترتيب هذه الرسوم البيانية وتصديرها باستخدام محرر التخطيط.
- تحضير كواشف التألق المناعي
- قم بإعداد مخفف الجسم المضاد عن طريق الجمع بين 1 غرام من ألبومين مصل الأبقار (BSA) ، و 2 غرام من الحليب الخالي من الدسم ، و 10 مل من 10x محلول ملحي مخزن (TBS) ، و 100 ميكرولتر من توين ، و 90 مل من الماء المقطر.
- قم بإعداد TBST من خلال الجمع بين 50 مل من 20x TBS و 950 مل من الماء المقطر و 200 ميكرولتر من Tween.
- قم بإعداد مصل الحصان الطبيعي بنسبة 10٪ (NHS) من خلال الجمع بين 1 مل من NHS مع 9 مل من مخفف الأجسام المضادة (الخطوة 8.4.1).
- تحضير 1٪ NHS من خلال الجمع بين 1 مل من 10٪ NHS مع 9 مل من TBST.
- تلطيخ المناعي
- قم بإزالة الشرائح من -20 درجة مئوية واتركها تسخن إلى درجة حرارة الغرفة.
- اغسل الشرائح ثلاث مرات في الماء المقطر لمدة 5 دقائق لكل منها.
- سد الشرائح لمدة 1 ساعة في درجة حرارة الغرفة في 10٪ NHS في مخفف الأجسام المضادة (الخطوة 8.4.3).
- قم بتخفيف الجسم المضاد الأساسي (عموم السيتوكيراتين) إلى 1: 750 في 1٪ NHS في TBST (الخطوة 8.4.4). احتضان الشرائح في الجسم المضاد الأولي المخفف طوال الليل عند 4 درجات مئوية.
- في اليوم التالي ، اغسل الشرائح ثلاث مرات باستخدام مخزن مؤقت للغسيل 1x (PBS أو TBST) لمدة 5 دقائق لكل منهما.
- تمييع الجسم المضاد الثانوي إلى 1: 1,000 في 1٪ NHS في TBST (الخطوة 8.4.4). احتضان الشرائح في الجسم المضاد الثانوي المخفف لمدة 1 ساعة في درجة حرارة الغرفة.
- اغسل الشرائح ثلاث مرات باستخدام 1x Wash buffer لمدة 5 دقائق لكل منها. قم بتركيب الشرائح وتغطيتها باستخدام وسائط التركيب الصلبة باستخدام DAPI. استخدم قطعة قطن لفرد أي فقاعات برفق تحت غطاء الغطاء.
النتائج
باستخدام هذه الطرق ، تم تصور مجموعات نادرة من الخلايا الظهارية في الدم ونخاع العظام للبشر والفئران العادية. مع التعويضات والضوابط المناسبة كما هو موضح ، أظهرت النتائج باستمرار أن 4٪ -5٪ من الخلايا في نخاع عظم الفئران كانت EpCAM + ، بغض النظر عن عدد الخلايا التي تم عدها ، كما هو موضح في الشكل 4 والشكل 5. في عينات دم الفئران، كان أقل من 0.5٪ من الخلايا عبارة عن EpCAM+ ، كما هو موضح في الشكل 6. في عينات نخاع العظم البشري ، كانت 2٪ -5٪ من الخلايا عبارة عن EpCAM + ، كما هو موضح في الشكل 7 والشكل 8. في حين أن 2٪ -5٪ هو نطاق كبير ، كانت النسب المئوية داخل كل متبرع فردي متسقة حيث تم حساب المزيد من الخلايا بشكل تدريجي. في عينات الدم البشرية ، كان حوالي 0.3٪ من الخلايا عبارة عن EpCAM + ، كما هو موضح في الشكل 9. أسفرت عينات التحكم الخاصة بنا (بدون بقع ، والتحكم في النمط المتماثل ، و FMOs) عن عدد قليل جدا من نتائج EpCAM + الإيجابية الكاذبة ، كما هو موضح في الشكل 4 والشكل 7. أظهرت الخلايا من مجموعات EpCAM + و EpCAM التي تم فرزها على شرائح تلطيخا إيجابيا لعموم السيتوكيراتين في عينات EpCAM + ، وكانت سلبية لعموم السيتوكيراتين في عينات EpCAM ، كما هو موضح في الشكل 10. تشير هذه النتائج إلى أن التجارب كانت مصممة بشكل مناسب وقابلة للتكرار.
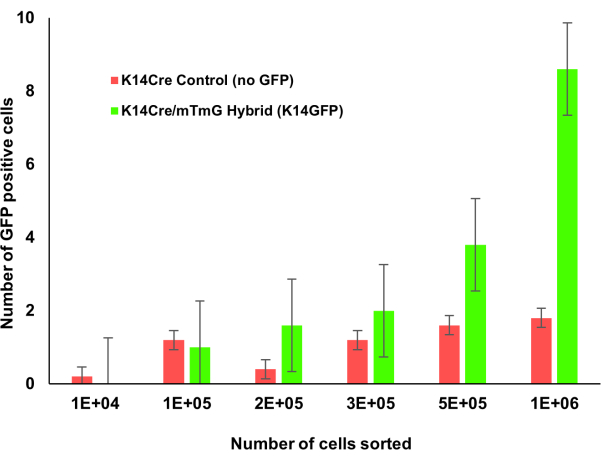
الشكل 1: الفئران المعدلة وراثيا Krt14Cre ؛ mTmG مع تعداد متزايد من نخاع العظام. تم حساب النخاع العظمي للفئران Krt1-14 ؛ mTmG بشكل تدريجي. تشير الخلايا الإيجابية GFP إلى تعبير الكيراتين 14 وتم تحديدها باستخدام قياس التدفق الخلوي. مع إحصاء المزيد من خلايا نخاع العظم ، كان من السهل التعرف على مجموعة الخلايا الإيجابية للكيراتين 14. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: سير عمل خلايا EpCAM+ والسيتوكيراتين+. تم فرز نخاع العظم وخلايا الدم أولا باستخدام فرز الخلايا المنشطة بالفلورة (FACS) لفصل خلايا EpCAM + و EpCAM. تم فرز هذه الخلايا إلى أنبوبي اختبار مختلفين ، وكذلك على شريحتين مختلفتين. تم نسج الخلايا التي تم فرزها في أنابيب اختبار على شرائح باستخدام جهاز طرد مركزي خلوي. ثم تم تلطيخ الشرائح باستخدام جسم مضاد أولي لعموم السيتوكيراتين ، ثم تلطيخها بجسم مضاد ثانوي. تم تحليل الشرائح باستخدام المجهر الفلوري لمراقبة تعبير عموم السيتوكيراتين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
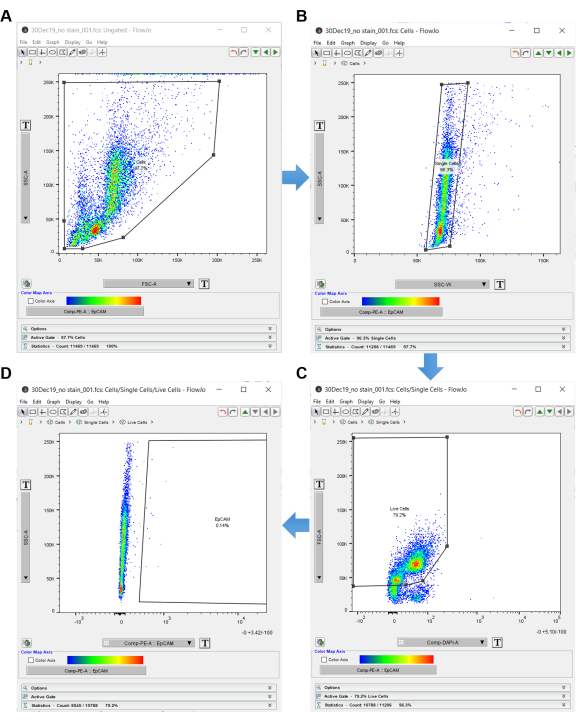
الشكل 3: برنامج تحليل التدفق الخلوي. عند تحليل بيانات قياس التدفق الخلوي باستخدام برنامج التحليل ، يتم استخدام التحكم في عدم وجود بقع لتحديد الخلايا ذات الأهمية. يتم تحديد الخلايا أولا باستخدام SSC-A و FSC-A ، والتي تظهر التعقيد الداخلي وحجم الخلايا. (أ) توجد بوابة مضلعة مرسومة حول الخلايا. (ب) يتم الحصول على الخلايا المفردة عن طريق بوابة SSC-A بواسطة SSC-W. (ج) يتم الحصول على الخلايا الحية عن طريق بوابة FSC-A مقابل DAPI. (د) تستبعد الخلايا السالبة EpCAM عن طريق البوابات الموجودة على يمين الخلايا السالبة EpCAM. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
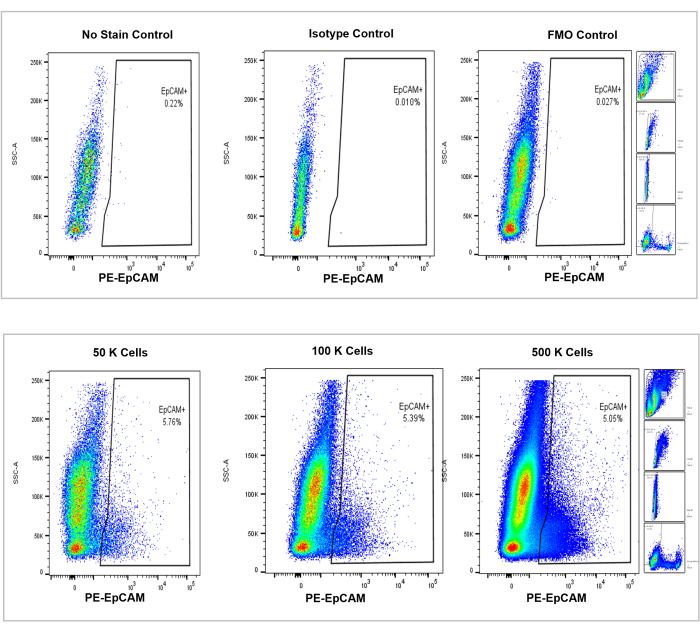
الشكل 4: تحليل التدفق الخلوي لخلايا EpCAM + في نخاع عظم الفأر. يتم عرض عناصر التحكم في عدم وجود صبغة ونمط نظائري و FMOs في اللوحة العلوية ، مع الأعداد الإضافية ل 50000 و 100000 و 500000 خلية معروضة في اللوحة السفلية. تصور هذه المخططات الاتساق في النسب المئوية عبر الأعداد ، على الرغم من الزيادة الإجمالية في إجمالي الخلايا التي تم عدها. تشير اللوحات الموجودة على اليمين إلى استراتيجية البوابات، كما تمت مناقشته سابقا في قسم تحليل قياس التدفق الخلوي وكما هو موضح في الشكل 3. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
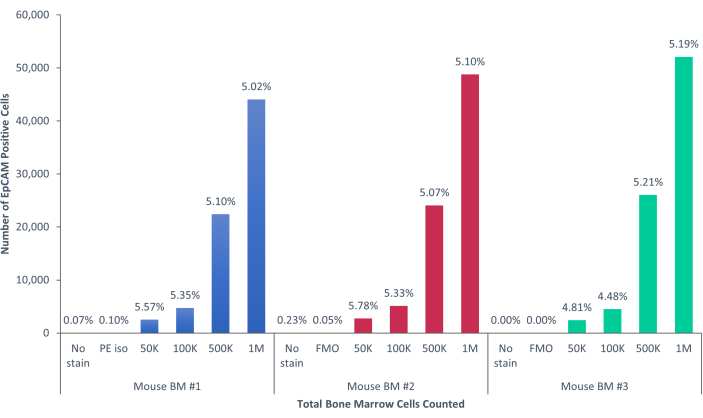
الشكل 5: تشكل خلايا EpCAM + في نخاع عظم الفأر 5.17٪ ± 0.001٪ من السكان. تم تحليل خلايا نخاع العظم لثلاثة فئران فردية. تم تضمين الضوابط المناسبة من أجل الدقة العلمية المناسبة. ظلت النسبة المئوية للخلايا الإيجابية ثابتة عبر العينات ، نظرا لكون الفئران متطابقة وراثيا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
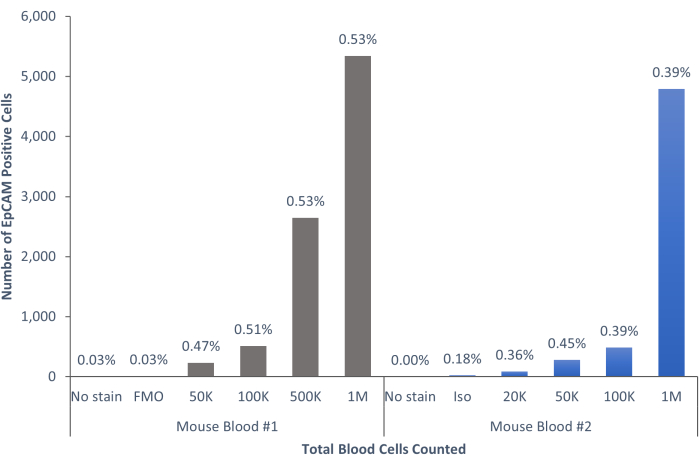
الشكل 6: تشكل خلايا EpCAM + في دم الفئران 0.45٪ ± 0.0006٪ من السكان. تم تحليل خلايا الدم لفئران فردية. تم تضمين الضوابط لإظهار الإجراء المناسب الذي تم اتباعه لتحقيق نتائج حاسمة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
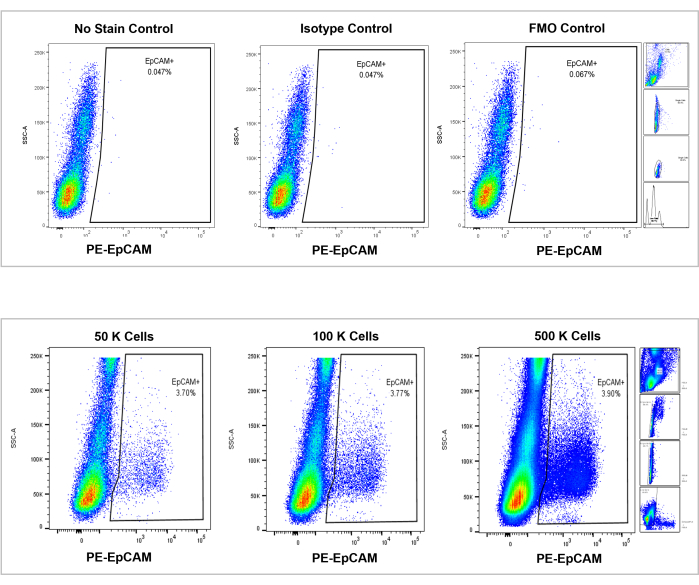
الشكل 7: تحليل التدفق الخلوي على نخاع العظم البشري EpCAM +. يتم عرض عناصر التحكم في عدم وجود صبغة ونمط متساوي وFMOs في اللوحة العلوية ، ويتم عرض الأعداد الإضافية ل 50000 و 100000 و 500000 خلية في اللوحة السفلية. تصور هذه المخططات الاتساق في النسب المئوية عبر الأعداد ، على الرغم من الزيادة الإجمالية في إجمالي الخلايا التي تم عدها. تشير اللوحات الموجودة على اليمين إلى استراتيجية البوابات، كما تمت مناقشته سابقا في قسم تحليل قياس التدفق الخلوي وكما هو موضح في الشكل 3. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: تشكل خلايا EpCAM + في نخاع العظم البشري 3.53٪ ± 0.006٪ من السكان. تم تحليل ثلاث عينات مختلفة من نخاع العظم البشري. تم تضمين الضوابط المناسبة للدقة العلمية. تختلف النسبة المئوية للخلايا الإيجابية بسبب عدم التجانس الجيني بين البشر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
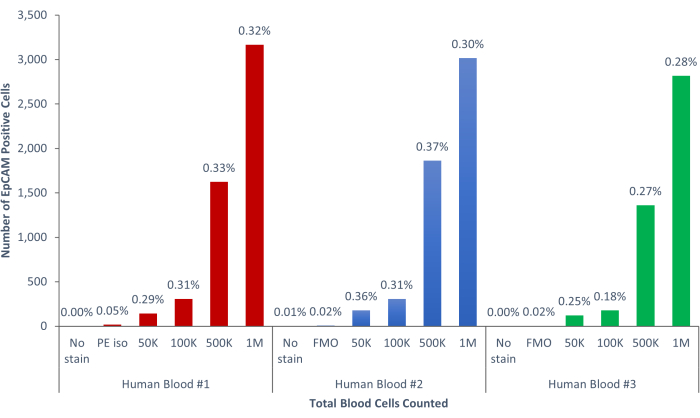
الشكل 9: تشكل خلايا EpCAM + من دم الإنسان 0.18٪ ± 0.0004٪ من السكان. تم تحليل ثلاث عينات دم بشرية مختلفة. تم تضمين الضوابط المناسبة للدقة العلمية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
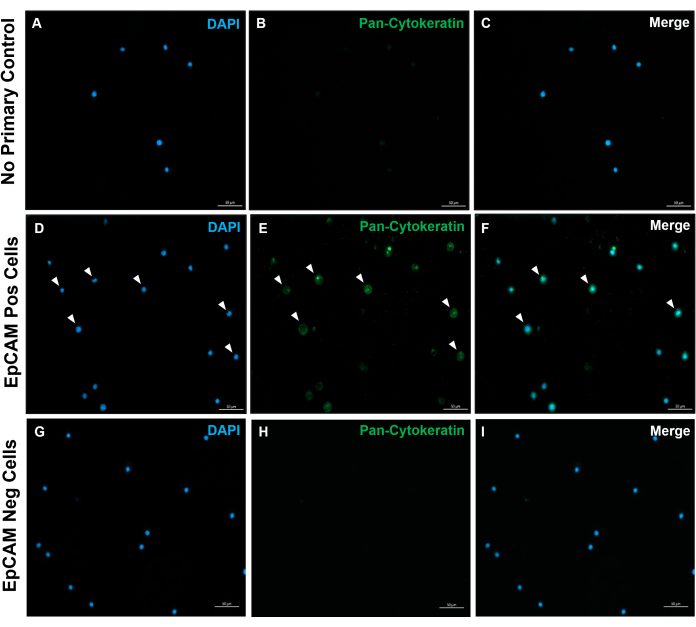
الشكل 10: التألق المناعي لشرائح EpCAM + و EpCAM. تم استخدام FACS لفصل خلايا EpCAM + و EpCAM. تم تلطيخ عموم السيتوكيراتين لاستخدام الجسم المضاد DAKO عموم السيتوكيراتين. لم يتم استخدام أي تحكم أولي في الأجسام المضادة في المصل الطبيعي ، لأن عموم السيتوكيراتين هو جسم مضاد متعدد النسيلة. وتؤكد هذه النتائج دقة نظام مراقبة الأصول الميدانية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| نخاع العظم البشري أو الدم | |||
| جسم | أنبوب # | # عدد الخلايا | أب كونك |
| غير ملوثة | 1 | 1x106 | X |
| دابي فقط | 2 | 1x106 | 1uL / مل |
| التحكم في النمط المتماثل PE | 3 | 1x106 | 1 ميكرولتر |
| CD49f-PE التحكم في البقع الواحدة | 4 | 1x106 | 20 ميكرولتر في 100 ميكرولتر لكل 1 × 106 |
| EpCAM-PE معايرة منخفضة | 5 | 1x106 | 3 ميكرولتر في 100 ميكرولتر لكل 1 × 106 |
| المعايرة بالتحليل الحجمي المتوسطة EpCAM-PE | 6 | 1x106 | 4 ميكرولتر في 100 ميكرولتر لكل 1x106 |
| EpCAM-PE معايرة عالية | 7 | 1x106 | 5 ميكرولتر في 100 ميكرولتر لكل 1x106 |
| EpCAM-PE فرز عالي على الشرائح | 8 | 10x106 | 50 ميكرولتر في 1 مل |
الجدول 1: لوحة تلطيخ قياس التدفق الخلوي. مثال على لوحة تلطيخ قياس التدفق الخلوي للخلايا أحادية النواة للدم أو نخاع العظم. عناصر التحكم المضمنة هي DAPI فقط ، والتحكم غير الملوث ، والتحكم الفردي في البقع PE (تم استخدام PE-CD49f كعنصر تحكم إيجابي أفضل). لا يتم تضمين مضان ناقص واحد في هذه اللوحة لأنه لون واحد فقط (PE). عند إضافة المزيد من ألوان الفلوروفور ، مثل الفلوريسئين إيزوثيوسيانات (FITC) أو الوفيكوسيانين (APC) ، يجب تضمين FMOs عن طريق استبعاد فلوروفور واحد لكل عنصر تحكم FMO.
الملف التكميلي 1: عد الخلايا الحية باستخدام مقياس الدم. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
هناك بعض الأدلة في الأدبيات على وجود الخلايا الظهارية في نخاع العظام. في السابق ، كانت الأوراق تبحث عادة في دور الخلايا الظهارية في سياق المرض والإصابة ، كما هو الحال في الكبد والرئة والجهاز الهضمي (GI) والغدة الصعترية والجلد14،15،16،17. ومع ذلك ، لا يعرف الكثير عن وجود هذه الخلايا الظهارية في نخاع العظام للأفراد الأصحاء. تسعى هذه الورقة إلى إنشاء طريقة قابلة للتكرار ، بهدف تحديد وعزل الخلايا الظهارية من الدم الطبيعي ونخاع العظام. ستدفع هذه الطريقة المجال إلى الأمام لتحديد سبب وجود الخلايا الظهارية وما هو دورها في الدم ونخاع العظام في غياب المرض. ربما تكون هذه الخلايا جزءا من صيانة الأنسجة الطبيعية أو يتم تنشيطها في أوقات الإصابة. نخاع العظم هو مستودع للخلايا الجذعية. ومع ذلك ، فمن غير الواضح ما هو نسب هذه الخلايا الظهارية. تناقش ورقة بحثية حديثة الخلايا الظهارية المشتقة من نخاع العظم في الغدة الصعترية ، والتي تعبر أولا عن EpCAM وعلامة المكونة للدم CD45 ، ثم تفقد تعبير CD45 بمرور الوقت بعد الإصابة15. أكدت الأبحاث من مختبرنا أيضا وجود خلايا CD45 + EpCAM + داخل الدم السليم ونخاع العظام في حالة عدم وجود إصابة12. ومع ذلك ، فإن دور هذه الخلايا لم يتحدد بعد.
كانت هناك حاجة إلى طريقة قابلة للتكرار لفحص الخلايا الظهارية داخل نخاع العظم السليم. ستساعد الطريقة الموضحة في توصيف هذه الخلايا بشكل أكبر في حالتها الطبيعية. هناك خطوات مهمة في هذه الطريقة للحفاظ على التكاثر. واحدة من أهم الخطوات في هذا البروتوكول هي الحفاظ على بيئة معقمة في غطاء المحرك أثناء حصاد نخاع العظم من الفئران. في حالة الحصاد من فئران متعددة ، يتم تجنب التلوث المتبادل بين العينات باستخدام إبر ومحاقن جديدة لكل فأر. هذا يضمن أيضا أن العينة نظيفة وخالية من أي ملوثات قد تؤثر على النتائج. بالإضافة إلى ذلك ، يجب زيادة عدد المحاقن المعدة والأنابيب المخروطية الموسومة لكل ماوس إضافي. خطوة أخرى مهمة تنطوي على غسل العظام حتى يصبح اللون الأبيض النظيف واضحا لضمان إزالة معظم خلايا نخاع العظم. تزداد فرص اكتشاف الخلايا النادرة في عينة أنقى. تم إجراء تعديل لتحسين بروتوكول تحلل خلايا الدم الحمراء. تم اختبار العديد من مخازن التحلل للعثور على المخزن الصحيح الذي أعطى قابلية عالية باستمرار ، حيث تم فقد ما يقرب من نصف الخلايا خلال هذه الخطوة. قد تحتاج الكواشف المختلفة وفترات الحضانة إلى تحسين النتائج في بيئات أخرى.
أهم قيود هذا البروتوكول هو استخدام قياس التدفق الخلوي للعثور على مجموعات الخلايا النادرة. كما نوقش سابقا ، تساعد إضافة عناصر التحكم والأعداد الإضافية على زيادة خصوصية التحليل ودقته. ومن القيود الأخرى أنه يجب تحديد العلامات المناسبة للسكان موضع الاهتمام مسبقا. وبالتالي ، يحتاج المرء إلى معرفة العلامات الرئيسية والأجسام المضادة لقياس التدفق الخلوي والأجسام المضادة المتوافقة مع الأنواع المستهدفة.
هذه الطرق هي تحسين على الطرق الحالية لأنها تسمح بتحليل خلية واحدة بجزء بسيط من تكلفة عازل CTC التلقائي الحالي وتسلسل الحمض النووي الريبي أحادي الخلية. بالإضافة إلى ذلك ، يتوفر قياس التدفق الخلوي بسهولة أكبر. حافظت FACS على صلاحية أعلى للخلايا مقارنة بالنتائج المبلغ عنها سابقا باستخدام فصل الميكروبيدات المغناطيسية. أخيرا ، تسمح هذه التقنيات بفصل الخلايا لتحليلات المصب ، مثل تسلسل الحمض النووي الريبي السائب أو تسلسل scRNA أو زراعة الخلايا.
Disclosures
لا يوجد تضارب معروف في المصالح.
Acknowledgements
جوش مونتس ، فني مقياس تدفق الخلايا في المرفق الأساسي ، معهد هورميل
تود شوستر، مدير المرافق الأساسية، معهد هورميل
ديريك جوردون ، إحصائي ، جامعة روتجرز
نود أن نشكر كارين كلاين من كلاروس للخدمات التحريرية ، سانتا في ، نيو مكسيكو على مساعدتها التحريرية.
تم دعم هذا العمل جزئيا من قبل المعهد الوطني لالتهاب المفاصل وأمراض الجهاز العضلي الهيكلي والجلد التابع للمعاهد الوطنية للصحة بموجب رقم الجائزة R21 AR075281 ، ومنحة مساعدة البحث والفن والمنح الدراسية ، مكتب نائب الرئيس للأبحاث ، جامعة مينيسوتا (اقتراح #324240). نحن نقدر بامتنان الدعم المقدم من معهد هورمل.
Materials
| Name | Company | Catalog Number | Comments |
| 40 μm Cell Strainer | Falcon | 352340 | Used to filter out any large clumps of cells from bone marrow |
| 5 mL Polystyrene Round-bottom tube | Falcon | 352054 | Tubes used for flow cytometry |
| 500 mL jar with lid | Nalgene | 11-823-32 | Used to wash the mouse |
| 190 proof Ethanol | Decon laboratories Inc | 2801 | Diluted to 70% with dH2O |
| Alexa Fluor 488 Goat anti-rabbit IgG (H+L) | Invitrogen | A11008 | Dilution: 1:1000 |
| Brightline Hemacytometer | Hausser Scientific | 02-671-10 | Used to count alive cells |
| Bovine Serum Albumin | Jackson ImmunoResearch | 001-000-162 | Component of antibody diluent |
| Characterized Fetal Bovine Serum (FBS) | Hyclone | SH30071.03 | Component of staining buffer and harvesting solution |
| Curity gauze sponges | Covidien | 2187 | Used to keep a clean work area when harvesting limbs and bone marrow |
| Curved Forceps | Miltex | 18-784 | Used during harvest |
| Cytokeratin, Wide Spectrum Screening | Dako | Z0622 | Dilution 1:750 *Now discontinued |
| Dulbecco's Phosphate Buffered Saline (DPBS 1x) | Gibco | 14190-144 500mL | Used to stop the red blood cell lysis reaction |
| Ethylenediaminetetraacetic acid | Sigma Aldrich | E9884-100G | Used at 0.5 M |
| Gentamicin sulfate | Lonza | 17-518Z | Component of harvesting solution |
| Hank's Balanced Salt Solution (HBSS 1x) | Gibco | 14175-095 500mL | Component of harvesting solution and staining buffer solution |
| Luer-Lok tip 10 mL syringe | Becton, Dickinson and Co | 309604 | Used with 26G needle to flush bones, used with 20G needle to break up clumps |
| Magic touch 2 ice bucket | BelArt | M16807-2001 | Used to store the specimens on ice |
| Nonfat dry milk | Apex | 20-241 | Component of Antibody Diluent |
| Normal horse serum | Vector | ZE0122 | Component of Antibody Diluent |
| PE anti-human CD 326 (EpCAM) | Biolegend | 324206 | Dilution: 5 µl in 100 µl per 1x106 cells |
| PE anti-mouse CD 326 (EpCAM) | Biolegend | 118205 | Dilution: 3 µl in 100 µl per 1x106 cells |
| PE mouse IgG2b, κ isotype control | Biolegend | 400313 | Dilution: 1 µl in 100 µl per 1x106 cells |
| PE rat anti-human CD49f | BD Biosciences | 555763 | Dilution: 20 µl in 100 µl per 1x106 cells |
| PE rat IgG2am, κ Isotype control | Biolegend | 400508 | Dilution: 1 µl in 100 µl per 1x106 cells |
| Polypropylene Conical Centrifuge Tubes 50 mL | Basix | 14-955-240 | Used in the centrifuge |
| Povidone-Iodine Scrub | Aplicare | 82-227 | Antiseptic used to sterilize the mice |
| PrecisionGlide Needle 20G x 1 1/2 | Becton, Dickinson and Co | 305176 | 20G needle used to break up bone marrow clumps |
| PrecisionGlide Needle 26G x 1/2 | Becton, Dickinson and Co | 305111 | 26G needle used to flush bone marrow from bones |
| PTFE Printed Slides | Electron Microscopy Services | 63422-06 | 8 well slides cells sorted onto for immunofluorescence |
| RBC Lysis buffer 10X | Invitrogen | 00-4300-54 | Dilution 1:10 using sterile deionized water |
| Scissors | Roboz | RS-6762 | Used during harvest |
| Stainless steel surgical blade #4 | Bard-Parker | 371222 | Used during harvest |
| Sterile tray | Polar ware | 10F | Used during harvest |
| StretchEase Powder-free nitrile examination gloves | Denville Scientific | G4161 | Used during harvest |
| Surgical Scalpel handle #4 | Fischer | 12-000-164 | Used with surgical blade |
| TBS 20x | Thermo | Component of TBST, used at 1X | |
| Trypan Blue Stain (0.4%) | Gibco | 15250-061 | Used to count dead cells. Filtered with .45 µm |
| Tween 20 | Sigma Aldrich | P1379-500mL | Component of TBST |
| Tweezers | Miltex | 6-8 | Used during harvest |
| Vectashield Vibrance Antifade Mounting Medium with DAPI | Vector | H-1800 | Nuclear stain for immunofluorescence |
References
- Larsen, S. B., Cowley, C. J., Fuchs, E. Epithelial cells: liaisons of immunity. Current Opinion in Immunology. 62, 45-53 (2020).
- Blanpain, C., Fuchs, E. Plasticity of epithelial stem cells in tissue regeneration. Science. 344 (6189), 1242281 (2014).
- Coradini, D., Casarsa, C., Oriana, S. Epithelial cell polarity and tumorigenesis: New perspectives for cancer detection and treatment. Acta Pharmacologica Sinica. 32 (5), 552-564 (2011).
- Dmello, C., et al. Multifaceted role of keratins in epithelial cell differentiation and transformation. Journal of Biosciences. 44 (2), 33 (2019).
- Poulet, G., Massias, J., Taly, V. Liquid biopsy: General concepts. Acta Cytologica. 63 (6), 449-455 (2019).
- Eslami-S, Z., Cortés-Hernández, L. E., Alix-Panabières, C. Epithelial cell adhesion molecule: an anchor to isolate clinically relevant circulating tumor cells. Cells. 9 (8), 1836 (2020).
- Morris, R. J. Circulating tumor cells: quintessential precision oncology presenting challenges for biology. NPJ Precision Oncology. 1 (1), 16 (2017).
- Lin, D., et al. Circulating tumor cells: biology and clinical significance. Signal Transduction and Targeted Therapy. 6 (1), 404 (2021).
- Spence, M., Adai, S., Landon, T., Richter, G. Few and far between: Tools and strategies for rare-event detection using flow cytometry. BioprobesJournal of Cell Biology. 71, 14-18 (2015).
- Yu, M., Stott, S., Toner, M., Maheswaran, S., Haber, D. A. Circulating tumor cells: approaches to isolation and characterization. Journal of Cell Biology. 192 (3), 373-382 (2011).
- Ye, Q., Ling, S., Zheng, S., Xu, X. Liquid biopsy in hepatocellular carcinoma: circulating tumor cells and circulating tumor DNA. Molecular Cancer. 18 (1), 114 (2019).
- Park, H., et al. marrow-derived epithelial cells and hair follicle stem cells contribute to development of chronic cutaneous neoplasms. Nature Communications. 9 (1), 5293 (2018).
- Marsman, W. A., et al. Epithelial cells in bone marrow: do they matter. Gut. 54 (12), 1821-1822 (2005).
- Borue, X., et al. marrow-derived cells contribute to epithelial engraftment during wound healing. The American Journal of Pathology. 165 (5), 1767-1772 (2004).
- Chakrabarti, S., et al. marrow-derived cells contribute to the maintenance of thymic stroma including TECs. Journal of Immunology Research. 2022, 6061746 (2022).
- Krause, D. S., et al. Multi-organ, multi-lineage engraftment by a single bone marrow-derived stem cell. Cell. 105 (3), 369-377 (2001).
- Wong, A. P., et al. Targeted cell replacement with bone marrow cells for airway epithelial regeneration. American Journal of Physiology-Lung Cellular and Molecular Physiology. 293 (3), L740-L752 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved