Method Article
Normal İnsan ve Murin Kanı ve Kemik İliğinde Epitel Hücrelerini Eksprese Eden EpCAM ve Sitokeratin Kanıtları
Bu Makalede
Özet
Bu yazıda, flow sitometri ve immünofloresan mikroskopi kullanılarak normal insan ve fare kanı ve kemik iliğinde epitel hücrelerinin varlığına dair yeni bulgular içeren tekrarlanabilir bir yöntem sunulmaktadır. Bu bulguları doğrulamak için in vivo yöntem olarak Krt1-14;mTmG transgenik fareler kullanıldı.
Özet
Epitel hücreleri, kanser ve diğer hastalıkları olan hastaların kan ve kemik iliğinde tanımlanmıştır. Bununla birlikte, sağlıklı bireylerin kanında ve kemik iliğinde normal epitel hücrelerinin varlığı henüz tutarlı bir şekilde tanımlanmamıştır. Burada, epitel hücrelerini sağlıklı insan ve murin kanından ve kemik iliğinden (BM) akış sitometrisi ve immünofloresan (IF) mikroskobu kullanarak izole etmek için tekrarlanabilir bir yöntem sunulmaktadır. Sağlıklı bireylerde epitel hücreleri ilk olarak epitel hücre adezyon molekülü (EpCAM) kullanılarak akım sitometrisi ile tanımlanmış ve izole edilmiştir. Bu EpCAM+ hücrelerinin, Krt1-14;mTmG transgenik farelerde immünofloresan mikroskopi kullanılarak keratin eksprese ettiği doğrulandı. İnsan kan örneklerinde %0.18 ± 0.0004 EpCAM+ hücresi vardı (SEM; n=7 biyolojik replika, 4 deneysel replika). İnsan BM'sinde, mononükleer hücrelerin %3.53'ü ± 0.006'sı (SEM; n=3 biyolojik replika, 4 deneysel replika) EpCAM+ idi. Fare kanında EpCAM+ hücreleri %0.45 ± 0.0006 (SEM; n=2 biyolojik replika, 4 deneysel replika) ve fare BM'sinde %5.17 ± 0.001 (SEM; n=3 biyolojik replika, 4 deneysel replika) EpCAM+ idi. Farelerde, tüm EpCAM + hücreleri, IF mikroskobu ile belirlendiği gibi, pan-sitokeratine immünoreaktifti. Sonuçlar, Krt1-14;mTmG transgenik fareler kullanılarak, düşük (analiz edilen 10 6 hücre başına8.6 doğal GFP + hücresi; canlı hücrelerin% 0.085'i), ancak normal murin BM'de bulunan GFP + hücrelerinin önemli sayıları (p < 0.0005) kullanılarak doğrulandı. çoklu negatif kontrollerle karşılaştırıldığında rastgeleliğin sonucu değildi. Ayrıca, fare kanındaki EpCAM + hücreleri CD45 + hücrelerinden daha heterojendi (BM'de% 0.58; kanda% 0.13). Bu gözlemler, sitokeratin proteinlerini eksprese eden hücrelerin, insan ve murin kanı ve BM'den mononükleer hücreler arasında tekrarlanabilir olarak tespit edilebildiği sonucuna varmıştır. Sağlıklı bireylerde bu pan-sitokeratin epitel hücrelerinin işlevini tanımlamak ve belirlemek için kullanılabilecek bir doku toplama, akış sitometrisi ve immün boyama yöntemi gösteriyoruz.
Giriş
Epitel hücreleri, vücudumuz ve çevre arasındaki fiziksel bariyerlerde bulunur ve mikro ortamlarındaki değişiklikleri tanıyabilir ve bunlara cevap verebilir1. Yeni dokuyu tersine çevirmek ve hasarı onarmak için bir yol sağlayan çoğalan bir kök hücre nişine sahiptirler2. Laboratuvarımız cildin saç köklerindeki kök hücreleri inceler; Deri, epitel dokusunu ve kök hücre proliferasyonunu incelemek için iyi bir modeldir, çünkü kolayca görülebilir ve sürekli bir hücre döngüsü vardır. Epitel kanserleri, muhtemelen cilt gibi epitel dokuları nedeniyle, çevresel kanserojenlere karşı ilk savunma hattı olan, yüksek devir hızlarına ve epitel hücrelerinin çoğalmasına neden olan en yaygın kanser şeklidir3. Üst koruyucu tabaka olan deri epidermisinin çoğu, destek ve yapı sağlamak için farklı keratin türlerini ifade eden keratinositlerden oluşur4. Epitel kanserli hastalar genellikle kanlarında ve kemik iliğinde keratinleri de eksprese eden epitel hücrelerine sahiptir. Sıvı biyopsiler, farklı vücut sıvılarındaki bu epitel hücrelerini tespit etmek ve izlemek için invaziv olmayan bir yoldur5. Dolaşımdaki tümör hücreleri (CTC'ler) olarak da adlandırılan dolaşımdaki epitel hücreleri, periferik kanda bulunur ve kanser prognozu için biyobelirteçler olabilir, ayrıca bireyselleştirilmiş tedavi tedavilerine rehberlik edebilir. CTC'ler ayrıca hastalığın ilerlemesini, tedavi etkinliğini ve genel hasta sağkalımını da gösterebilir 5,6.
Epitel hücre adezyon molekülü (EpCAM), KTC'ler için klinik olarak kullanılan bir belirteçtir ve kanser hastalarında epitel kökenli tümörleri tanımlayabilir. EpCAM hücre yapışması, göçü, sinyalizasyonu, çoğalması ve farklılaşmasında rol oynar6. Dolaşımdaki bir epitel hücresinin CTC olarak sınıflandırılması için, sitokeratinler 8, 18 ve 19 için pozitif ve yaygın bir lökosit belirteci6 olan CD45 için negatif olması gerekir. CTC'ler genellikle önce CD45'in manyetik mikroboncuklarla tükenmesi, ardından immünofloresan mikroskopi7 kullanılarak EpCAM ve sitokeratin 19'un test edilmesiyle tanımlanır. CTC'lerin tespitindeki ana sınırlama nadirlikleridir; Kandaki tüm hücrelerin% 0.01'inden azını oluştururlar ve çok azı uzak organlara ulaşmak için dolaşımda hayatta kalır 8,9,10. Nadir doğaları nedeniyle bu hücreleri izole etmek ve tanımlamak için deneyler ve teknikler tasarlarken dikkate alınmalıdır. Şu anda, CTC'leri tanımlamak için kullanılan yalnızca bir Gıda ve İlaç İdaresi (FDA) onaylı otomatik tek hücreli ayıklayıcı vardır ve biyobelirteç olarak EpCAM'i kullanmaktadır. Diğer yöntemler arasında manyetik boncuk ayırma ve akış sitometrisi veya bu yöntemlerin bir kombinasyonu bulunur. Nadir CTC'lerin tespiti için daha yüksek duyarlılık ve özgüllüğe sahip yeni tekniklere ihtiyaç vardır11.
Akım sitometrisi, kan, kemik iliği ve diğer doku örneklerinde nadir hücre popülasyonlarının tespiti için tercih edilen bir yöntemdir. Bu nadir hücreler kök hücreleri, dolaşımdaki endotel hücrelerini, CTC'leri ve artık hastalık hücrelerini içerebilir. Akış sitometrisi, her hücre tipinin kantitatif ölçümlerini sağlar ve bu hücreleri daha fazla test için sıralar 7,9. Bu nadir hücrelerin doğru bir şekilde değerlendirilmesini sağlamak için artımlı sayımlar yapıldı. Hücreleri daha fazla analizden dışlamak için geçit kullanma yeteneği, hücreleri analiz ederken özgüllüğü arttırmanın bir yoludur. Akış sitometrisinin sınırlamaları, büyük örneklerin analizi için gereken süre ve hücre kimliği için görsel doğrulama eksikliğidir. Bunun üstesinden gelmek için, kimliklerini doğrulamak için sıralanan hücreler üzerinde immünofloresan mikroskobu yapıldı.
Daha önce laboratuvarımız farelerde kemik iliği hücrelerinin işe alındığını ve cilt tümörlerine katkıda bulunduğunu göstermiştir12. Bu kemik iliği kaynaklı hücreler pan-sitokeratin ve epidermal sitokeratin için pozitiftir. Epitel kök hücrelerinin, kemik iliği kaynaklı hücrelerin ve sitokeratin eksprese eden hücrelerin tümör progresyonundaki rolünü daha fazla aydınlatmak için, normal murin ve insan kanı ve kemik iliği örneklerinde EpCAM + sitokeratin-pozitif hücreler arandı. Çoğu deneyde olduğu gibi, bu yöntem birden fazla yineleme yoluyla geliştirilmiştir. Daha önce, transgenik fareler, kemik iliği12'deki K14GFP eksprese eden hücreleri aramak için artımlı sayımlarla birlikte kullanıldı. Daha fazla hücre sayıldıkça, temsili sonuçlar bölümünde Şekil 1'de gösterildiği gibi, nadir hücrelerin temsili bir popülasyonu tanımlanabildi. Normal kan ve kemik iliğindeki epitel hücrelerini araştırmanın mantığı, normal sağlıklı donörlerin arka plan EpCAM + hücre seviyelerine sahip olduğu CTC'lerle ilgili erken literatüre dayanıyordu13. Daha önce de belirtildiği gibi, EpCAM karakterizasyonu genellikle CD45'in tükenmesiyle başlar. Bazı hematopoetik hücrelerin EpCAM ve sitokeratin ekspresyonuna sahip olması nedeniyle bu adım atlanmıştır ve daha fazla araştırılması gereken bilinmeyen nedenlerden dolayıdır. Bu nedenle, hücreler, hücre soyuna bakılmaksızın EpCAM'in varlığına veya yokluğuna göre sıralandı ve daha sonra sitokeratin için immünoboya yapıldı. Aşağıdaki protokol ve Şekil 2'de gösterilen iş akışı, epitel hücrelerinin bu nadir popülasyonlarını izole etmek ve tanımlamak için kompanzasyon ve kontroller, istatistiksel yöntemler ve immünofloresan görüntüleme ile akış sitometrisini kullanan bir tekniği tanımlamaktadır.
Protokol
Tüm hayvan protokolleri, Minnesota Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından NIH ve federal yönergelere uygun olarak onaylanmıştır. Taze insan kanı ve kemik iliği ticari kaynaklardan satın alındı. Örnekler, şirket tarafından HIV, Hepatit B, Hepatit C için negatif olan bağışçılardan onaylanmış bir IRB protokolü kapsamında toplandı ve COVID-19 için tarandı. Tüm örnekler şirket tarafından gönderilmeden önce ilk önce kimliksizleştirildi ve anonimleştirildi. Bunlar ticari olarak elde edildiğinden, IRB onayı gerekli değildi.
1. Çözümlerin hazırlanması
NOT: Tüm çözeltiler steril bir ortama sahip biyolojik bir davlumbazda hazırlanmalıdır. İnsan kanı ve kemik iliği ile çalışmak için biyogüvenlik seviye 2 (BSL2) sertifikası alın.
- 500 mL Hank denge tuzu çözeltisine (HBSS) 1 mL gentamisin ve 5 mL fetal sığır serumu (FBS) ekleyerek kemik iliği hasat çözeltisi hazırlayın.
- 500 mL HBSS'ye 50 mL FBS ekleyerek boyama tamponu çözeltisini hazırlayın.
- 10 mL 10x lizis tamponunu 90 mL steril su ile birleştirerek 1x lizis tamponu hazırlayın.
2. Davlumbazın hazırlanması
- Kaputu açın ve uygun hava akışını elde etmek için birkaç dakika çalışmasına izin verin.
- Kemik iliği hasadı yapmak için tüm malzemeleri toplayın. Steril bir ortamı korumak için davlumbazın içine %70 etanol püskürtün. Kaputun içine alınmadan önce ellerinizi her seferinde püskürtün.
- Otoklavlanmış tepsiyi, otoklavlanmış makas, monte edilmiş bir neşter, cımbız ve kavisli forseps ile birlikte, steril tutmak için% 70 etanol ile doldurulmuş küçük bir kaba kaputa yerleştirin.
- Bir 50 mL santrifüj tüpüne 10 mL kemik iliği hasat çözeltisi ekleyin ve "Uzuvlar" olarak etiketleyin. Başka bir 50 mL santrifüj tüpünü "Kemik İliği" olarak etiketleyin.
- Bir şırıngaya 10 mL kemik iliği hasat çözeltisi hazırlayın ve ardından 26 G'lik bir iğne takın.
3. Farelerden kemik iliği hasadı
- CO2 boğulmasını kullanarak fareyi ötenazi yapın. Ölüm, kalp atışının olmaması ve reaksiyon olmadığından emin olmak için ayakların sıkıştırılması ile doğrulanır. Servikal çıkık, tam ötenazinin ikincil bir yolu olarak gerçekleştirilebilir.
- Fareyi 500 mL'lik bir kaba yerleştirin ve farenin yarısını kaplayacak kadar iyot ekleyin. Tam bir kapsama alanı sağlamak için kabı yavaşça sallayın ve döndürün. Deiyonize su ile durulayın. Bir iyot yıkaması daha yapın ve ardından aynı adımları izleyerek% 70 etanol ile iki yıkama yapın.
- Fareyi davlumbaza yerleştirin ve tepsiye sırt üstü koyun. Arka ayakları tutun ve bir pop hissedilene kadar birbirinden ayırın; Bu, bacakları omurgadan ayırmaktır.
- Kasık bölgesine yakın farenin derisinde 1 cm'lik bir kesi yapın. Kesi içine kapalı bir makas çifti yerleştirin ve ardından peritondan ayırmak için makası cildin altında açın.
- Bacaktaki cildi uyluk çevresinde kesin ve ardından kasları ve kemikleri açığa çıkarmak için cildi bacaktan aşağı doğru kesin.
- Kalça ekleminin etrafını keserek arka bacakları çıkarın, femuru kesmediğinizden emin olun. Uzuvları "Uzuvlar" olarak etiketlenmiş tüpe yerleştirin Her iki bacak da çıkarıldığında, fareyi bir karkas torbasına yerleştirin ve dondurucuya koyun.
NOT: Makası yönlendirmek ve femur kemiğini kesmekten kaçınmak için kesmeden önce kalça kemiği hissedilmelidir, çünkü kemik iliğinin çoğu femurdan elde edilir. - Makası kullanarak uzuvlardan biri boyunca kasları, dokuları ve yağları kesmeye başlayın. Kemiğe paralel olarak kesin. Ardından, neşteri kullanın ve kemiğe karşı dik bir kazıma hareketi kullanarak kalan yağ veya kası çıkarın.
- Kemik düzgün bir şekilde temizlendikten sonra, dizdeki femur ve tibiayı ayırın. Neşteri, görünür kemik iliğinin olmadığı femur ve tibianın her iki ucunda kesikler yapmak için kullanın.
- Hazırlanan şırıngayı ve iğneyi kemiğe yerleştirin. Direnç varsa, daha fazla direnç kalmayana kadar kemiğin ucundan biraz daha kesin.
- Kemiği "Kemik İliği" olarak etiketlenmiş tüpün üzerinde tutarken, kemik iliğini tüpe yıkamak için kemik iliği toplama solüsyonunu kemikten dışarı atın. Kemik iliğinin geri kalanını elde etmek için kemiğin diğer ucunda, kemik tamamen beyaz veya boş görünene kadar tekrarlayın.
- Kalan tüm kemikler ve uzuvlar için 7-9 arasındaki adımları tekrarlayın; Tüm ilikler aynı konik tüpe yıkanacaktır.
- Boş bir 10 mL şırınga ve 20 G iğne kullanarak, kemik iliğini şırıngada 5-10 kez yukarı ve aşağı çekerek tüpteki kemik iliği kümelerini parçalayın.
- Temiz bir 50 mL santrifüj tüpüne steril bir 40 μm filtre ekleyin ve 1 mL kemik iliği hasat çözeltisi ile durulayın. Ardından, kalan kümeleri çıkarmak için kemik iliğini filtreleyin. Bu tüpü "Filtrelenmiş Kemik İliği" olarak etiketleyin.
- Filtrelenmiş kemik iliğini kullanana kadar buzdolabında veya buz üzerinde saklayın. Aynı hasat gününde kullanılmalıdır. Aynı gün kullanılmazsa, dimetil sülfoksit (DMSO) gibi bir kriyo-koruyucu kullanarak hücreleri dondurun.
DİKKAT: Bu deneylerden kaynaklanan tüm atıklar, biyolojik tehlike altındaki bir atık konteynerine uygun şekilde atılmalıdır. Tüm keskinlikler, uygun şekilde etiketlenmiş bir biyolojik tehlike keskinleştirme kabına girmelidir.
4. Kemik iliğinin kırmızı kan hücresi lizisi
- Kemik iliği hücrelerini oda sıcaklığında 10 dakika boyunca 170 x g'de santrifüj edin. Supernatan'ı vakumlayın ve atın. Hücreleri 10 mL 1x kırmızı kan hücresi lizis tamponunda tekrar askıya alın ve 4 dakika boyunca inkübe edin.
- Lizis tamponunun reaksiyonunu durdurmak için 30 mL Dulbecco'nun fosfat tamponlu salini (DPBS) ekleyin. Hücreleri oda sıcaklığında 170 x g'de 8 dakika boyunca santrifüj edin. Supernatan'ı vakumlayın ve atın. 10-20 mL boyama tamponunda tekrar askıya alın.
5. Hücre sayısı
- 1:20 seyreltme elde etmek için 500 μl hücreyi 9,5 mL kemik iliği hasat çözeltisi ile birleştirin.
NOT: Bu, hücre sayımları için kullanılacaktır ve steril tutulmasına gerek yoktur. - 1:20 seyreltmeden 200 μL hücre çıkarın, bunları 200 μL tripan mavisine ekleyin ve iyice karıştırın.
- Karışımı bir hemositometreye ekleyin ve her iki taraftaki canlı ve ölü hücreleri sayın. Bu tabloyu ( Ek Dosya 1'de gösterilmiştir) ve denklemleri kullanarak orijinal hücre süspansiyonunu hesaplayın:
Mililitre başına hücreler: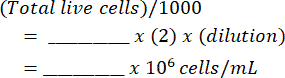
Toplam Hücre: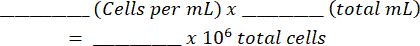
- Hücreleri 4 ° C'de 10 dakika boyunca 170 x g'de döndürün ve üreticinin antikor seyreltmeleri için önerilerine dayanarak 1 mL başına 10 x 10 6 konsantrasyonuna (100 μL başına 1 x 106 hücre) askıya alın.
- Akış sitometrisine geçin (adım 8).
6. Farelerden kan toplanması
- CO2 gazı veya servikal çıkık kullanarak fareyi ötenazi yapın.
- 0,5 M etilendiamintetraasetik asit (EDTA) ile kaplanmış 1 mL'lik bir şırıngaya bağlı 26 G iğne ile 45 ° 'lik bir açıyla kardiyak kan alımı gerçekleştirin.
- Kanı aşağı doğru döndürün ve ortamda veya tamponda yeniden askıya alın.
NOT: Hücreler döndürülecek ve kırmızı kan hücresi lizisi ve hücre sayımından sonra boyama tamponunda son konsantrasyona yeniden askıya alınacaktır. - Kırmızı kan hücresi lizizini gerçekleştirin (adım 4).
- Hücre sayımını gerçekleştirin (adım 5).
- Akış sitometrisine geçin (adım 8).
7. İnsan kanı ve kemik iliği örneklerinin işlenmesi
- Kişisel koruyucu ekipman giyerken BSL2 sertifikalı bir başlık altında tüm prosedürleri gerçekleştirin.
- Önceki gece örnekleri toplayın ve kırmızı kan hücresi lizisi yapın. Mononükleer numuneleri bir gecede buz üzerinde göndermeden önce numunelerin kimliksizleştirildiğinden ve anonimleştirildiğinden emin olun.
- Varışta, canlı hücreleri 10 dakika boyunca 4 ° C'de 170 x g'de döndürün.
NOT: Bunlar, yerel yönergelere uyması gereken BSL2 numuneleridir. - Hücreleri ortamdaki veya boyama tamponundaki yeniden askıya alın.
NOT: Hücreler aşağı doğru döndürülmeli ve boyama tamponu ile hücre sayımından sonra son konsantrasyona geri asılmalıdır. - Hücre sayımını gerçekleştirin (adım 5).
- Akış sitometrisine geçin (adım 8).
8. Akış sitometrisi
- Boy -ama
- Hücreleri, kompanzasyon kontrolleri (lekesiz, izotip kontrolleri, tek boyalı ve floresan eksi olanlar [FMO'lar]) dahil olmak üzere kullanılan boyama paneline göre ayrı ayrı etiketlenmiş tüplere bölün. Kalan hücreleri dondurun veya floresanla aktive edilmiş hücre sıralama için kullanın. Kullanılan antikor seyreltmeleriyle boyama paneli örneği için Tablo 1'e bakınız.
NOT: Eklenen her ilave florofor için, kalan floroforlarla kombinasyon halinde FMO'lar, bu floroforun tek bir lekesi ile birlikte eklenmelidir. İzotip kontrolleri, spesifik olmayan boyamayı engellemek için kullanılabilir. Kullanılan her yeni antikor, optimum seyreltme için numunelerle titre edilmelidir. - Üreticinin önerdiği seyreltmelere göre antikorlar ekleyin ve tüplerin tabanını hareket ettirerek iyice karıştırın. Antikor konsantrasyonları genellikle 100 μL başına 1 x 106 hücre olarak verilir. antikorlar ve kontrollerle seyreltmeler Tablo 1'de gösterilmiştir. Antikorlar floroforlarla konjuge edilir ve ışıktan korunmalıdır.
NOT: Düşük hücre popülasyonlarının görselleştirilmesini sağlamak için fikoeritrin (PE) ile konjuge edilmiş EpCAM kullanmak en iyisidir (Tablo 1'de gösterildiği gibi 1 milyon hücre başına 3-5 μL'de titre eder). PE-CD49f, tek bir leke PE kontrolü (1 milyon hücre başına 20 μL) olarak kullanılmıştır, çünkü bu hücreler PE-EpCAM'den daha yaygındır ve bu nedenle telafi için kullanımı daha kolaydır. - Karanlıkta 4 ° C'de 30 dakika inkübe edin.
- İnkübasyondan sonra, tüpleri BSL2 davlumbazına geri getirin ve her tüpe 1 mL boyama tamponu ekleyin.
- Daha sonra, tüpleri 5-10 dakika boyunca 4 ° C'de 170 x g'de santrifüj edin.
- Santrifüjlemeden sonra, kapaklı tüpleri hücrelerle birlikte BSL2 davlumbazına geri getirin ve süpernatanı aspire edin. Çapraz kontaminasyonu önlemek için her tüp arasında aspirasyon pipetinin uçlarını değiştirdiğinizden emin olun.
- Hücre peletini 1 mL boyama tamponunda tekrar askıya alın ve karıştırmak için tüplerin tabanını hafifçe kaydırın.
- 8.1.4-8.1.7 adımlarını tekrarlayarak hücreleri iki kez daha yıkayın.
NOT: Hücreleri kaybetmemek için pipetleri yeniden askıya almak için kullanmayın. - Akış sitometrisinden önce son resüspansiyon için 500 μL boyama tamponunda tekrar askıya alın. Üreticinin tavsiyelerine göre 4′,6-diamidino-2-fenilindol (DAPI) veya ölü hücre ayırıcı ekleyin.
- Hücreleri, kompanzasyon kontrolleri (lekesiz, izotip kontrolleri, tek boyalı ve floresan eksi olanlar [FMO'lar]) dahil olmak üzere kullanılan boyama paneline göre ayrı ayrı etiketlenmiş tüplere bölün. Kalan hücreleri dondurun veya floresanla aktive edilmiş hücre sıralama için kullanın. Kullanılan antikor seyreltmeleriyle boyama paneli örneği için Tablo 1'e bakınız.
- Akış sitometresi
- Makineyi kurduktan sonra, kompanzasyonu ve kapıları ayarlamak için kontrolleri ve FMO'ları kullanın. Kırılgan hücreleri desteklemeye yardımcı olmak için Hank'in dengeli tuz çözeltisini (HBSS) kılıf sıvısı olarak kullanın. HBSS kullanılamıyorsa PBS kullanın.
NOT: Kullanılan akış sitometresi ve yazılım Malzemeler Tablosunda listelenmiştir. - Örnekleri teker teker yükleyin ve 50.000, 100.000, 500.000 ve bir milyon olay için veri noktaları toplayın. Tüpleri kullanana kadar buz üzerinde veya buzdolabında tutun.
NOT: Numunenin yaşayabilirliğini sağlamak için toplama sırasında bir zaman sınırı ayarlanabilir. - Hücreleri 15 mL santrifüj tüplerinde% 10 FBS ile 3 mL RPMI'ye toplayın.
- EpCAM+ hücrelerinde immünofloresan yapıyorsanız, 8 kuyucuklu bir slaytın her bir kuyucuğuna 800 ila 1.000 hücreyi sıralamak için akış sitometresini kullanın.
- İmmünofloresan için boyama yaparken kullanmak üzere negatif bir kontrol olarak EpCAM hücre popülasyonunu ayrı slaytlara ayırın.
NOT: Hücreler ayrıca FBS içeren 15 mL'lik tüplere ayrılabilir ve hücrelerin patlamasını önlemek için sitosantrifüj veya pipet kullanılarak bir slayt üzerine döndürülebilir. - Slaytları -20 °C'de %50 metanol/%50 aseton karışımına 10 dakika sabitleyin. Slaytları immünofloresan ile boyanana kadar -20 ° C'de saklayın.
- Makineyi kurduktan sonra, kompanzasyonu ve kapıları ayarlamak için kontrolleri ve FMO'ları kullanın. Kırılgan hücreleri desteklemeye yardımcı olmak için Hank'in dengeli tuz çözeltisini (HBSS) kılıf sıvısı olarak kullanın. HBSS kullanılamıyorsa PBS kullanın.
- Akış sitometrisi analizi
- Lisanslı akış sitometrisi analiz yazılımını açın.
- Kontroller ve numuneler ile akış sitometresinden elde edilen yük akış sitometri standardı (FCS) dosyaları.
- Grup Oluştur'u tıklatın ve örnekleri ve denetimleri bir gruba yerleştirmek için anahtar sözcükleri kullanın.
NOT: Şekil 3'te gösterildiği gibi, akış sitometrisi analiz yazılımına geçiş yapmak için "lekesiz" kontrolünü kullanın. - Lekesiz bir grafiği açmak için leke kontrolü olmayan örneğe çift tıklayın.
- Grafiği y eksenini SSC-A ve x eksenini FSC-A (ileri saçılma alanına göre yan dağılım alanı) olarak ayarlayın, bu da hücre boyutunu ve iç karmaşıklığı gösterir.
- Sol üst paneldeki çokgen şekline tıklayın ve hücrelerin etrafında bir kapı oluşturun. Çevredeki hücreleri dışladığınızdan emin olun, çünkü bunlar büyük olasılıkla enkazdır. Bu kapıyı Şekil 3A'da gösterildiği gibi "Hücreler" olarak etiketleyin.
- Hücrelerin kapısı açıldıktan sonra, yeni bir pencerede başka bir grafik açmak için çokgen şeklinin içine çift tıklayın.
- Çift ayrım için yeni grafiğin y eksenini SSC-A ve x eksenini SSC-W olarak ayarlayın. Poligon şeklini tıklatın ve tek hücrelerin etrafında bir dikdörtgen oluşturun. Bunu Şekil 3B'de gösterildiği gibi "Tek Hücreler" olarak etiketleyin.
- Hücrelerin kapısı açıldıktan sonra, yeni bir pencerede başka bir grafik açmak için çokgen şeklinin içine çift tıklayın.
- Y eksenini FSC-A ve x eksenini DAPI-A olarak ayarlayın (veya hangi ölü hücre ayırıcısı kullanılıyorsa).
- Grafiğin sol tarafındaki DAPI negatif hücrelerinin etrafında bir çokgen kapısı oluşturun. Bu "Canlı Hücreler"i Şekil 3C'de gösterildiği gibi etiketleyin.
- Hücrelerin kapısı açıldıktan sonra, yeni bir pencerede başka bir grafik açmak için çokgen şeklinin içine çift tıklayın.
- Y eksenini SSC-A ve x eksenini EpCAM-PE olarak ayarlayın (veya EpCAM hücrelerini tanımlamak için hangi florofor kullanılıyorsa). Soldaki hücreler EpCAM negatiftir. Sağda herhangi bir hücre gösteriliyorsa, bunlar EpCAM pozitiftir.
- Soldaki hücreleri dışlayan ve yalnızca sağdaki boş alanı içeren bir çokgen kapısı oluşturmak için EpCAM-PE grafiğini kullanın. Sağdaki boş alanı Şekil 3D'de gösterildiği gibi "EpCAM" poligonunun içinde etiketleyin.
NOT: Bu leke kontrolü yoktur, bu nedenle EpCAM ifadesi olmamalıdır. Hangi hücrelerin EpCAM pozitif olduğunu belirlemek için leke yok kontrolünü kullanın. Bu, tazminat için geçit stratejisini tamamlar, bu nedenle tüm grafikler şu anda kapatılabilir. - Çalışma alanı sayfasında, "Hücreler", "Tek Hücreler", "Canlı Hücreler" ve "EpCAM" ile lekesiz soyağacını vurgulayın. Sağ tıklayın ve grubu oluşturmak için analizi kopyala'yı seçin. Bu, geçit stratejisini önceden oluşturulan gruptaki diğer tüm yüklü örneklere kopyalar. Bir grup başlangıçta oluşturulmadıysa, sol üstteki Grup Oluştur'u seçerek şimdi oluşturulabilir.
- Grup içindeki örnekleri gözden geçirin ve tüm numunelere ve kontrollere uyduklarından emin olmak için daha önce çizilen çokgen kapılarını kontrol edin. Bu, yüzde sayısını ve hücre sayısını sağlar.
- "Çalışma Alanı"nın sol üst köşesindeki düzen düzenleyici düğmesi L'yi tıklayın. Bu grafikler daha sonra mizanpaj düzenleyicisi kullanılarak düzenlenebilir ve dışa aktarılabilir.
- İmmünofloresan reaktiflerin hazırlanması
- 1 g sığır serum albümini (BSA), 2 g yağsız süt, 10 mL 10x tris tamponlu salin (TBS), 100 μL Ara ve 90 mL damıtılmış suyu birleştirerek antikor seyrelticiyi hazırlayın.
- 50 mL 20x TBS, 950 mL damıtılmış su ve 200 μL Ara'yı birleştirerek TBST'yi hazırlayın.
- 1 mL NHS'yi 9 mL antikor seyreltici ile birleştirerek% 10 Normal At Serumu (NHS) hazırlayın (adım 8.4.1).
- 1 mL% 10 NHS'yi 9 mL TBST ile birleştirerek% 1 NHS hazırlayın.
- İmmünofloresan boyama
- Slaytları -20 °C'den çıkarın ve oda sıcaklığına kadar ısınmalarını bekleyin.
- Slaytları damıtılmış suda her biri 5 dakika boyunca üç kez yıkayın.
- Slaytları oda sıcaklığında antikor seyreltici içinde% 10 NHS'de 1 saat boyunca bloke edin (adım 8.4.3).
- TBST'de primer antikoru (pan-sitokeratin) %1 NHS'de 1:750'ye seyreltin (adım 8.4.4). Seyreltilmiş birincil antikordaki slaytları gece boyunca 4 ° C'de inkübe edin.
- Ertesi gün, slaytları her biri 5 dakika boyunca 1x yıkama tamponu (PBS veya TBST) ile üç kez yıkayın.
- İkincil antikoru TBST'de% 1 NHS'de 1: 1.000'e seyreltin (adım 8.4.4). Seyreltilmiş ikincil antikordaki slaytları oda sıcaklığında 1 saat boyunca inkübe edin.
- Slaytları her biri 5 dakika boyunca 1x yıkama tamponu ile üç kez yıkayın. Slaytları DAPI'li sabit montaj ortamıyla monte edin ve örtün. Kapak kaymasının altındaki kabarcıkları nazikçe yuvarlamak için pamuklu çubuk kullanın.
Sonuçlar
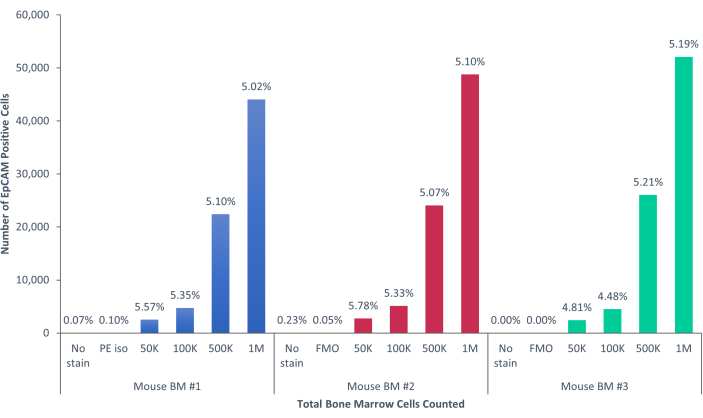
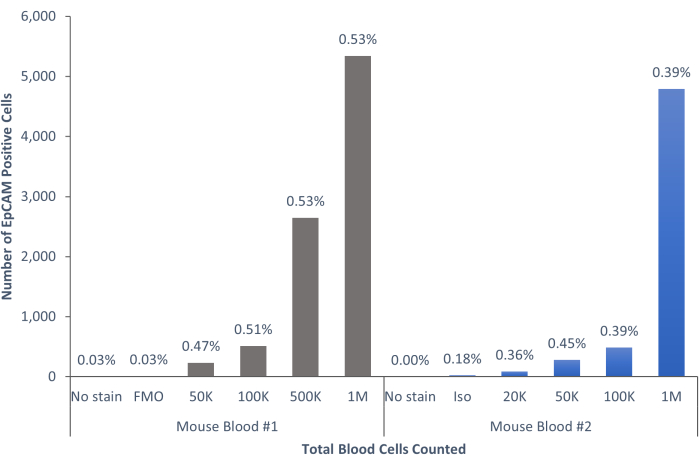
Bu yöntemler kullanılarak, normal insan ve farelerin kanındaki ve kemik iliğindeki nadir epitel hücresi popülasyonları görselleştirildi. Tarif edildiği gibi uygun kompanzasyonlar ve kontrollerle, murin kemik iliğindeki hücrelerin% 4-5'ini tutarlı bir şekilde gösteren sonuçlar, Şekil 4 ve Şekil 5'te gösterildiği gibi, kaç hücrenin sayıldığına bakılmaksızın EpCAM + idi. Murin kan örneklerinde, Şekil 6'da gösterildiği gibi, hücrelerin% 0.5'inden azı EpCAM + idi. İnsan kemik iliği örneklerinde, Şekil 7 ve Şekil 8'de gösterildiği gibi, hücrelerin% 2 -% 5'i EpCAM + idi. % 2 -% 5 büyük bir aralık olsa da, her bir donör içindeki yüzdeler, kademeli olarak daha fazla hücre sayıldığı için tutarlıydı. İnsan kan örneklerinde, hücrelerin yaklaşık% 0.3'ü Şekil 9'da gösterildiği gibi EpCAM + idi. Kontrol numunelerimiz (lekesiz, izotip kontrolü ve FMO'lar), Şekil 4 ve Şekil 7'de gösterildiği gibi çok az yanlış pozitif EpCAM+ sonucu vermiştir. Slaytlar halinde sıralanan EpCAM+ ve EpCAM gruplarından hücreler, Şekil 10'da gösterildiği gibi, EpCAM+ örneklerinde pan-sitokeratin için pozitif boyama ve EpCAM- örneklerinde pan-sitokeratin için negatif olmuştur. Bu sonuçlar, deneylerin uygun şekilde tasarlandığını ve tekrarlanabilir olduğunu göstermektedir.
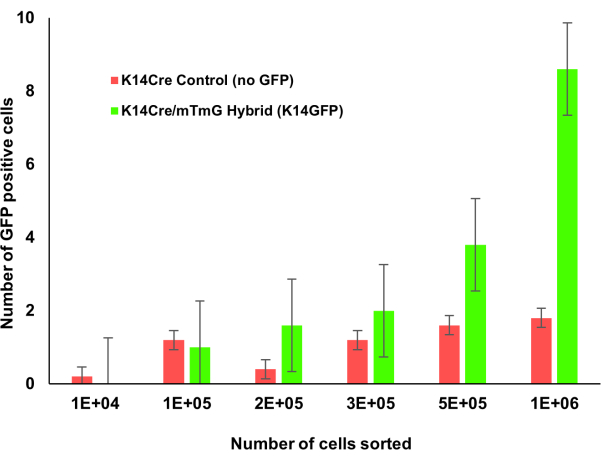
Resim 1: Krt14Cre;mTmG transgenik fareler, kemik iliğinin artımlı sayımlarına sahiptir. Krt1-14;mTmG farelerin kemik iliği artımlı olarak sayıldı. GFP pozitif hücreler keratin 14 ekspresyonunu gösterir ve akım sitometrisi kullanılarak tanımlanmıştır. Daha fazla kemik iliği hücresi sayıldıkça, bu keratin 14 pozitif hücre popülasyonu daha kolay tanımlanabilirdi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 2: EpCAM+ ve sitokeratin+ hücreleri için iş akışı. Kemik iliği ve kan hücreleri ilk olarak EpCAM + ve EpCAM hücrelerini ayırmak için floresan aktive hücre sıralama (FACS) kullanılarak sıralandı. Bu hücreler iki farklı test tüpüne ve iki farklı slayda ayrıldı. Test tüplerine ayrılan hücreler, bir sitosantrifüj kullanılarak slaytlara döndürüldü. Slaytlar daha sonra bir pan-sitokeratin primer antikoru kullanılarak boyandı, daha sonra ikincil bir antikor ile boyandı. Slaytlar, pan-sitokeratin ekspresyonunu gözlemlemek için floresan mikroskobu kullanılarak analiz edildi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
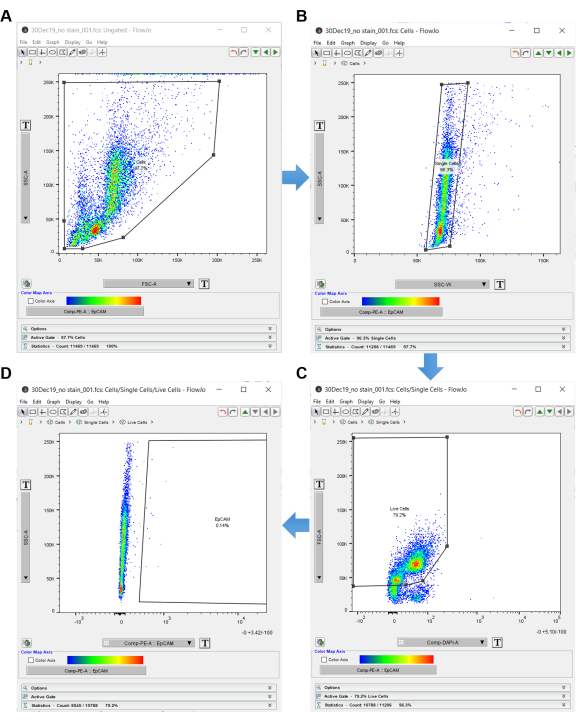
Şekil 3: Akış sitometrisi analiz yazılımı. Analiz yazılımı kullanarak akış sitometrisi verilerini analiz ederken, ilgilenilen hücreleri seçmek için leke kontrolü yoktur. Hücreler ilk olarak, hücrelerin iç karmaşıklığını ve boyutunu gösteren SSC-A ve FSC-A ile seçilir. (A) Hücrelerin etrafına bir çokgen kapısı çizilir. (B) Tek hücreler, SSC-A'nın SSC-W ile geçitlenmesiyle elde edilir. (C) Canlı hücreler, FSC-A'nın DAPI'ye karşı geçitlenmesiyle elde edilir. (D) EpCAM negatif hücreleri, EpCAM negatif hücrelerinin sağına geçilerek hariç tutulur. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
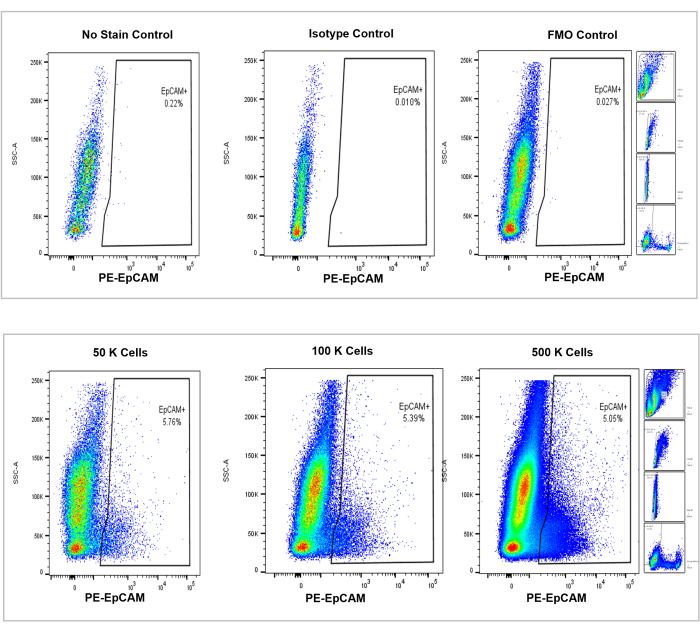
Şekil 4: Fare kemik iliğindeki EpCAM+ hücrelerinin akış sitometrik analizi. Lekesiz, izotip ve FMO'suz kontroller üst panelde, 50.000, 100.000 ve 500.000 hücrenin artımlı sayıları alt panelde gösterilir. Bu grafikler, sayılan toplam hücrelerdeki genel artışa rağmen, sayımlar arasındaki yüzde tutarlılığını görselleştirir. Sağdaki paneller, daha önce akış sitometrisi analizi bölümünde tartışıldığı ve Şekil 3'te gösterildiği gibi geçit stratejisini göstermektedir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Şekil 5: Fare kemik iliğindeki EpCAM+ hücreleri popülasyonun %5,17 ± %0,001'ini oluşturmaktadır. Üç ayrı farenin kemik iliği hücreleri analiz edildi. Uygun bilimsel titizlik için uygun kontroller dahil edildi. Pozitif hücrelerin yüzdesi, farelerin genetik olarak aynı olması nedeniyle örnekler arasında tutarlı kalmıştır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Şekil 6: Fare kanındaki EpCAM+ hücreleri popülasyonun %0,45 ± %0,0006'sını oluşturmaktadır. İki ayrı farenin kan hücreleri analiz edildi. Kesin sonuçlar üretmek için uygun prosedürün izlendiğini göstermek için kontroller dahil edildi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
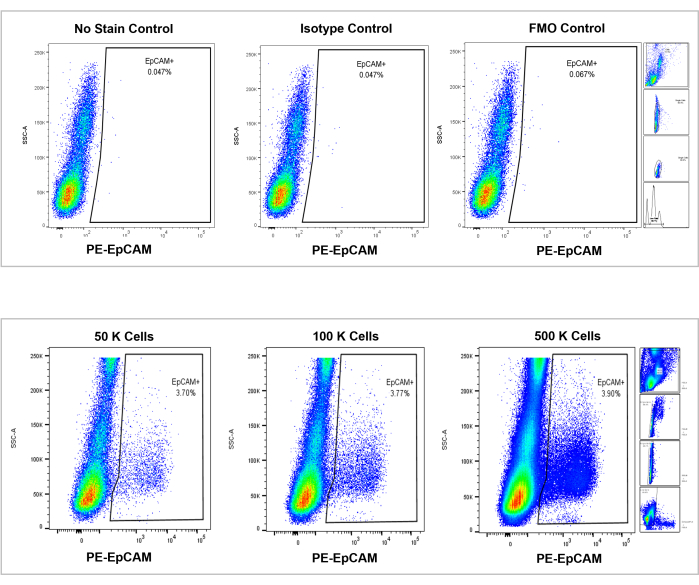
Şekil 7: EpCAM+ insan kemik iliği üzerinde akış sitometrik analizi. Lekesiz, izotip ve FMO'ların kontrolleri üst panelde, 50.000, 100.000 ve 500.000 hücrenin artımlı sayıları ise alt panelde gösterilir. Bu grafikler, sayılan toplam hücrelerin genel artışına rağmen, sayımlar arasındaki yüzde cinsinden tutarlılığı görselleştirir. Sağdaki paneller, daha önce akış sitometrisi analizi bölümünde tartışıldığı ve Şekil 3'te gösterildiği gibi geçit stratejisini göstermektedir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 8: İnsan kemik iliğindeki EpCAM+ hücreleri popülasyonun %3.53 ± %0.006'sını oluşturmaktadır. Üç farklı insan kemik iliği örneği analiz edildi. Bilimsel titizlik için uygun kontroller dahil edildi. Pozitif hücrelerin yüzdesi, insanlar arasındaki genetik heterojenliğe bağlı olarak değişir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
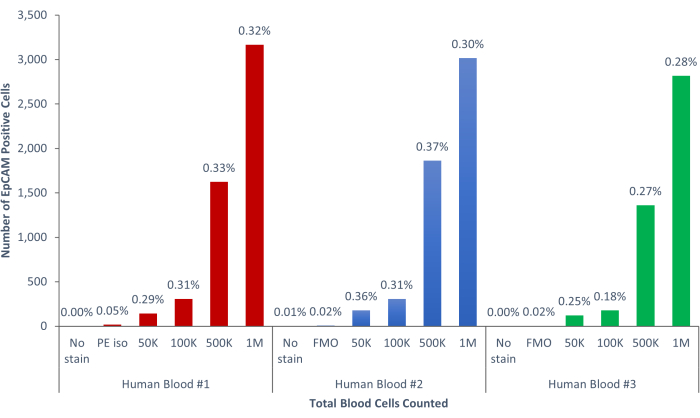
Şekil 9: İnsan kanının EpCAM+ hücreleri, popülasyonun %0.18 ± %0.0004'ünü oluşturmaktadır. Üç farklı insan kan örneği analiz edildi. Bilimsel titizlik için uygun kontroller dahil edildi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
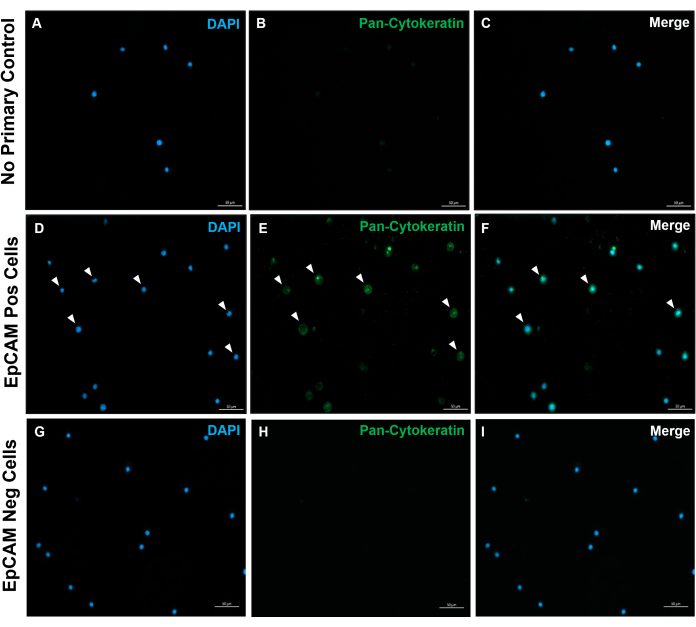
Şekil 10: EpCAM+ ve EpCAM- slaytlarının immünofloresansı. FACS, EpCAM+ ve EpCAM hücrelerini ayırmak için kullanıldı. Pan-sitokeratin, DAKO pan-sitokeratin antikoru kullanılarak boyandı. Pan-sitokeratin, poliklonal bir antikor olduğu için normal serumda primer antikor kontrolü kullanılmadı. Bu sonuçlar FACS'ın doğruluğunu doğrulamaktadır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| İnsan Kemik İliği veya Kanı | |||
| Antikor | Tüp # | # Hücrelerin | AB Conc |
| Lekesiz | 1 | 1x106 | X |
| Yalnızca DAPI | 2 | 1x106 | 1uL/mL |
| PE izotip kontrolü | 3 | 1x106 | 1 uL |
| CD49f-PE Tek Leke Kontrolü | 4 | 1x106 | 1x10 başına 100uL'de 20 uL6 |
| EpCAM-PE Düşük Titrasyon | 5 | 1x106 | 1x10 başına 100uL'de 3 uL6 |
| EpCAM-PE Orta Titrasyon | 6 | 1x106 | 1x10 başına 100uL'de 4 uL6 |
| EpCAM-PE Yüksek Titrasyon | 7 | 1x106 | 1x10 başına 100uL'de 5 uL6 |
| Slaytlarda EpCAM-PE Yüksek Sıralama | 8 | 10x106 | 1 mL'de 50 uL |
Tablo 1: Akış sitometri boyama paneli. Kan veya kemik iliği mononükleer hücreleri için bir akış sitometri boyama paneli örneği. Dahil edilen kontroller sadece DAPI, lekesiz kontrol ve PE tek leke kontrolüdür (PE-CD49f daha iyi bir pozitif kontrol olarak kullanılmıştır). Floresan eksi bir, yalnızca tek bir renk (PE) olduğu için bu panele dahil değildir. Floresein izotiyosiyanat (FITC) veya allofikosiyanin (APC) gibi daha fazla florofor rengi eklerken, her FMO kontrolü için bir florofor hariç tutularak FMO'lar dahil edilmelidir.
Ek Dosya 1: Hematositometre kullanılarak canlı hücre sayımı. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Literatürde kemik iliğinde epitel hücrelerinin varlığına dair bazı kanıtlar vardır. Daha önce, makaleler tipik olarak epitel hücrelerinin karaciğer, akciğer, gastrointestinal (GI) sistem, timus ve cilt14,15,16,17 gibi hastalık ve yaralanma bağlamında rolünü araştırmıştır. Bununla birlikte, sağlıklı bireylerin kemik iliğinde bu epitel hücrelerinin varlığı hakkında fazla bir şey bilinmemektedir. Bu yazıda, epitel hücrelerinin normal kan ve kemik iliğinden tanımlanması ve izole edilmesi amacıyla tekrarlanabilir bir yöntem oluşturulması amaçlanmıştır. Bu yöntem, epitel hücrelerinin neden mevcut olduğunu ve hastalığın yokluğunda kan ve kemik iliğindeki rollerinin ne olduğunu belirlemek için alanı ileriye götürecektir; Belki de bu hücreler normal doku bakımının bir parçasıdır veya yaralanma zamanlarında aktive edilir. Kemik iliği kök hücrelerin bir deposudur; Bununla birlikte, bu epitel hücrelerinin soyunun ne olabileceği belirsizdir. Yakın tarihli bir makalede, timusta kemik iliği kaynaklı epitel hücreleri, ilk önce EpCAM ve hematopoetik belirteç CD45'i eksprese eden ve daha sonra yaralanmadan sonra zamanla CD45 ekspresyonunu kaybeden tartışılmaktadır15. Laboratuvarımızdan yapılan araştırmalar, yaralanma yokluğunda sağlıklı kan ve kemik iliğinde CD45 + EpCAM + hücrelerinin varlığını da doğrulamıştır12. Bununla birlikte, bu hücrelerin rolü henüz belirlenmemiştir.
Sağlıklı kemik iliğindeki epitel hücrelerini incelemek için tekrarlanabilir bir yönteme ihtiyaç vardı. Açıklanan yöntem, bu hücrelerin normal durumlarında daha fazla karakterize edilmesine yardımcı olacaktır. Tekrarlanabilirliği korumak için bu yöntemde önemli adımlar vardır. Bu protokoldeki en kritik adımlardan biri, kemik iliğini farelerden toplarken davlumbazda steril bir ortam sağlamaktır. Birden fazla fareden hasat yapılıyorsa, her fare için yeni iğneler ve şırıngalar kullanılarak numuneler arasında çapraz kontaminasyon önlenir. Bu aynı zamanda numunenin temiz olmasını ve sonuçları etkileyebilecek herhangi bir kirletici madde içermemesini sağlar. Ek olarak, her ek fare için hazırlanan şırıngaların ve etiketli konik tüplerin sayısı arttırılmalıdır. Bir diğer önemli adım, kemik iliği hücrelerinin çoğunun çıkarıldığından emin olmak için temiz beyaz bir renk belirginleşene kadar kemiklerin yıkanmasını içerir; Nadir hücreleri tespit etme şansı daha saf bir örnekte artar. Kırmızı kan hücresi lizis protokolünü optimize etmek için bir değişiklik yapıldı; Bu adımda hücrelerin neredeyse yarısı kaybedildiğinden, sürekli olarak yüksek canlılık veren doğru olanı bulmak için birkaç lizis tamponu test edildi. Diğer ortamlarda daha iyi sonuçlar elde etmek için farklı reaktiflerin ve inkübasyon sürelerinin optimize edilmesi gerekebilir.
Bu protokolün en önemli sınırlaması, nadir hücre popülasyonlarını bulmak için akış sitometrisinin kullanılmasıdır. Daha önce de tartışıldığı gibi, kontrollerin ve artımlı sayımların eklenmesi, analizin özgüllüğünü ve doğruluğunu artırmaya yardımcı olur. Diğer bir sınırlama, ilgili popülasyon için uygun belirteçlerin önceden tanımlanması gerektiğidir. Bu nedenle, anahtar belirteçler, akış sitometrisi için antikorlar ve hedef türlerle uyumlu antikorlar hakkında bilgi sahibi olmak gerekir.
Bu yöntemler, mevcut otomatik CTC izolatörünün ve tek hücreli RNA diziliminin maliyetinin bir kısmında tek hücre analizine izin verdikleri için mevcut yöntemlere göre bir gelişmedir. Ek olarak, akış sitometrisi daha kolay kullanılabilir. FACS, manyetik mikroboncuk ayırma kullanarak daha önce bildirilen sonuçlarla karşılaştırıldığında hücreler için daha yüksek canlılık sağlamıştır. Son olarak, bu teknikler, toplu RNA dizilimi, scRNA dizilimi veya hücre kültürü gibi aşağı akış analizleri için hücrelerin ayrılmasına izin verir.
Açıklamalar
Bilinen bir çıkar çatışması yoktur.
Teşekkürler
Josh Monts, Çekirdek Tesis Akış Sitometresi Teknisyeni, Hormel Enstitüsü
Todd Schuster, Çekirdek Tesis Yöneticisi, Hormel Enstitüsü
Derek Gordon, İstatistikçi, Rutgers Üniversitesi
Editoryal yardımı için Clarus Editorial Services, Santa Fe, NM'den Karen Klein'a teşekkür ederiz.
Bu çalışma kısmen, R21 AR075281 Ödül Numarası altında Ulusal Sağlık Enstitüleri Ulusal Artrit ve Kas-İskelet ve Deri Hastalıkları Enstitüsü ve Minnesota Üniversitesi Araştırma Başkan Yardımcısı Ofisi Araştırma, Sanat ve Burs Yardımı Hibe tarafından desteklenmiştir (Öneri #324240). Hormel Enstitüsü'nün desteğini minnetle kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 40 μm Cell Strainer | Falcon | 352340 | Used to filter out any large clumps of cells from bone marrow |
| 5 mL Polystyrene Round-bottom tube | Falcon | 352054 | Tubes used for flow cytometry |
| 500 mL jar with lid | Nalgene | 11-823-32 | Used to wash the mouse |
| 190 proof Ethanol | Decon laboratories Inc | 2801 | Diluted to 70% with dH2O |
| Alexa Fluor 488 Goat anti-rabbit IgG (H+L) | Invitrogen | A11008 | Dilution: 1:1000 |
| Brightline Hemacytometer | Hausser Scientific | 02-671-10 | Used to count alive cells |
| Bovine Serum Albumin | Jackson ImmunoResearch | 001-000-162 | Component of antibody diluent |
| Characterized Fetal Bovine Serum (FBS) | Hyclone | SH30071.03 | Component of staining buffer and harvesting solution |
| Curity gauze sponges | Covidien | 2187 | Used to keep a clean work area when harvesting limbs and bone marrow |
| Curved Forceps | Miltex | 18-784 | Used during harvest |
| Cytokeratin, Wide Spectrum Screening | Dako | Z0622 | Dilution 1:750 *Now discontinued |
| Dulbecco's Phosphate Buffered Saline (DPBS 1x) | Gibco | 14190-144 500mL | Used to stop the red blood cell lysis reaction |
| Ethylenediaminetetraacetic acid | Sigma Aldrich | E9884-100G | Used at 0.5 M |
| Gentamicin sulfate | Lonza | 17-518Z | Component of harvesting solution |
| Hank's Balanced Salt Solution (HBSS 1x) | Gibco | 14175-095 500mL | Component of harvesting solution and staining buffer solution |
| Luer-Lok tip 10 mL syringe | Becton, Dickinson and Co | 309604 | Used with 26G needle to flush bones, used with 20G needle to break up clumps |
| Magic touch 2 ice bucket | BelArt | M16807-2001 | Used to store the specimens on ice |
| Nonfat dry milk | Apex | 20-241 | Component of Antibody Diluent |
| Normal horse serum | Vector | ZE0122 | Component of Antibody Diluent |
| PE anti-human CD 326 (EpCAM) | Biolegend | 324206 | Dilution: 5 µl in 100 µl per 1x106 cells |
| PE anti-mouse CD 326 (EpCAM) | Biolegend | 118205 | Dilution: 3 µl in 100 µl per 1x106 cells |
| PE mouse IgG2b, κ isotype control | Biolegend | 400313 | Dilution: 1 µl in 100 µl per 1x106 cells |
| PE rat anti-human CD49f | BD Biosciences | 555763 | Dilution: 20 µl in 100 µl per 1x106 cells |
| PE rat IgG2am, κ Isotype control | Biolegend | 400508 | Dilution: 1 µl in 100 µl per 1x106 cells |
| Polypropylene Conical Centrifuge Tubes 50 mL | Basix | 14-955-240 | Used in the centrifuge |
| Povidone-Iodine Scrub | Aplicare | 82-227 | Antiseptic used to sterilize the mice |
| PrecisionGlide Needle 20G x 1 1/2 | Becton, Dickinson and Co | 305176 | 20G needle used to break up bone marrow clumps |
| PrecisionGlide Needle 26G x 1/2 | Becton, Dickinson and Co | 305111 | 26G needle used to flush bone marrow from bones |
| PTFE Printed Slides | Electron Microscopy Services | 63422-06 | 8 well slides cells sorted onto for immunofluorescence |
| RBC Lysis buffer 10X | Invitrogen | 00-4300-54 | Dilution 1:10 using sterile deionized water |
| Scissors | Roboz | RS-6762 | Used during harvest |
| Stainless steel surgical blade #4 | Bard-Parker | 371222 | Used during harvest |
| Sterile tray | Polar ware | 10F | Used during harvest |
| StretchEase Powder-free nitrile examination gloves | Denville Scientific | G4161 | Used during harvest |
| Surgical Scalpel handle #4 | Fischer | 12-000-164 | Used with surgical blade |
| TBS 20x | Thermo | Component of TBST, used at 1X | |
| Trypan Blue Stain (0.4%) | Gibco | 15250-061 | Used to count dead cells. Filtered with .45 µm |
| Tween 20 | Sigma Aldrich | P1379-500mL | Component of TBST |
| Tweezers | Miltex | 6-8 | Used during harvest |
| Vectashield Vibrance Antifade Mounting Medium with DAPI | Vector | H-1800 | Nuclear stain for immunofluorescence |
Referanslar
- Larsen, S. B., Cowley, C. J., Fuchs, E. Epithelial cells: liaisons of immunity. Current Opinion in Immunology. 62, 45-53 (2020).
- Blanpain, C., Fuchs, E. Plasticity of epithelial stem cells in tissue regeneration. Science. 344 (6189), 1242281 (2014).
- Coradini, D., Casarsa, C., Oriana, S. Epithelial cell polarity and tumorigenesis: New perspectives for cancer detection and treatment. Acta Pharmacologica Sinica. 32 (5), 552-564 (2011).
- Dmello, C., et al. Multifaceted role of keratins in epithelial cell differentiation and transformation. Journal of Biosciences. 44 (2), 33 (2019).
- Poulet, G., Massias, J., Taly, V. Liquid biopsy: General concepts. Acta Cytologica. 63 (6), 449-455 (2019).
- Eslami-S, Z., Cortés-Hernández, L. E., Alix-Panabières, C. Epithelial cell adhesion molecule: an anchor to isolate clinically relevant circulating tumor cells. Cells. 9 (8), 1836 (2020).
- Morris, R. J. Circulating tumor cells: quintessential precision oncology presenting challenges for biology. NPJ Precision Oncology. 1 (1), 16 (2017).
- Lin, D., et al. Circulating tumor cells: biology and clinical significance. Signal Transduction and Targeted Therapy. 6 (1), 404 (2021).
- Spence, M., Adai, S., Landon, T., Richter, G. Few and far between: Tools and strategies for rare-event detection using flow cytometry. BioprobesJournal of Cell Biology. 71, 14-18 (2015).
- Yu, M., Stott, S., Toner, M., Maheswaran, S., Haber, D. A. Circulating tumor cells: approaches to isolation and characterization. Journal of Cell Biology. 192 (3), 373-382 (2011).
- Ye, Q., Ling, S., Zheng, S., Xu, X. Liquid biopsy in hepatocellular carcinoma: circulating tumor cells and circulating tumor DNA. Molecular Cancer. 18 (1), 114 (2019).
- Park, H., et al. marrow-derived epithelial cells and hair follicle stem cells contribute to development of chronic cutaneous neoplasms. Nature Communications. 9 (1), 5293 (2018).
- Marsman, W. A., et al. Epithelial cells in bone marrow: do they matter. Gut. 54 (12), 1821-1822 (2005).
- Borue, X., et al. marrow-derived cells contribute to epithelial engraftment during wound healing. The American Journal of Pathology. 165 (5), 1767-1772 (2004).
- Chakrabarti, S., et al. marrow-derived cells contribute to the maintenance of thymic stroma including TECs. Journal of Immunology Research. 2022, 6061746 (2022).
- Krause, D. S., et al. Multi-organ, multi-lineage engraftment by a single bone marrow-derived stem cell. Cell. 105 (3), 369-377 (2001).
- Wong, A. P., et al. Targeted cell replacement with bone marrow cells for airway epithelial regeneration. American Journal of Physiology-Lung Cellular and Molecular Physiology. 293 (3), L740-L752 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır