Method Article
정상 인간 및 쥐의 혈액 및 골수에서 상피 세포를 발현하는 EpCAM 및 사이토케라틴에 대한 증거
요약
이 논문은 유세포 분석법과 면역형광 현미경을 사용하여 정상 인간 및 생쥐의 혈액과 골수에서 상피 세포의 존재에 대한 새로운 발견과 함께 재현 가능한 방법을 제시합니다. Krt1-14;mTmG 형질전환 마우스를 생체 내 방법으로 사용하여 이러한 결과를 확인했습니다.
초록
상피 세포는 암 및 기타 질병을 앓고있는 환자의 혈액 및 골수에서 확인되었습니다. 그러나 건강한 개인의 혈액과 골수에서 정상적인 상피 세포의 존재는 아직 일관된 방식으로 확인되지 않았습니다. 여기에 제시된 것은 유세포 분석 및 면역형광(IF) 현미경을 사용하여 건강한 인간 및 쥐의 혈액 및 골수(BM)에서 상피 세포를 분리하는 재현 가능한 방법입니다. 건강한 개인의 상피 세포는 상피 세포 접착 분자(EpCAM)를 사용한 유세포 분석을 통해 먼저 확인 및 분리되었습니다. 이러한 EpCAM+ 세포는 Krt1-14;mTmG 형질전환 마우스에서 면역형광 현미경을 사용하여 케라틴을 발현하는 것으로 확인되었습니다. 인간 혈액 샘플은 0.18% ± 0.0004개의 EpCAM+ 세포를 가졌습니다(SEM; n=7개의 생물학적 복제물, 4개의 실험적 복제물). 인간 BM에서 단핵 세포의 3.53% ± 0.006(SEM; n=3개의 생물학적 복제물, 4개의 실험적 복제물)이 EpCAM+였습니다. 마우스 혈액에서 EpCAM+ 세포는 0.45% ± 0.0006(SEM; n=2개의 생물학적 복제물, 4개의 실험적 복제물)을 구성했고, 마우스 BM± 5.17% 0.001개(SEM; n=3개의 생물학적 복제물, 4개의 실험적 복제물)는 EpCAM+였습니다. 마우스에서 모든 EpCAM+ 세포는 IF 현미경으로 측정한 바와 같이 범사이토케라틴에 면역반응이었습니다. 결과는 Krt1-14;mTmG 형질전환 마우스를 사용하여 확인되었으며, 낮은 수(분석된10 개 6개 세포당 8.6개의 천연 GFP+ 세포, 생존 가능한 세포의 0.085%)이지만 정상 쥐 BM에 존재하는 GFP+ 세포의 유의미한 수(p < 0.0005)는 여러 음성 대조군과 비교하여 무작위성의 결과가 아니었습니다. 또한, 마우스 혈액의 EpCAM+ 세포는 CD45+ 세포보다 더 이질적이었습니다(BM에서 0.58%, 혈액에서 0.13%). 이러한 관찰은 사이토케라틴 단백질을 발현하는 세포가 인간 및 쥐의 혈액 및 BM의 단핵 세포 중에서 재현 가능하게 검출될 수 있다고 결론지었습니다. 우리는 건강한 개인에서 이러한 범 세포케라틴 상피 세포의 기능을 확인하고 결정하는 데 사용할 수 있는 조직 수확, 유세포 분석 및 면역 염색 방법을 보여줍니다.
서문
상피세포는 우리 몸과 환경 사이의 물리적 장벽에서 발견되며 미세 환경의 변화를 인식하고 대응할 수 있습니다1. 그들은 새로운 조직을 뒤집고 손상을 복구하는 방법을 제공하는 증식하는 줄기 세포 틈새를 가지고 있습니다2. 우리 연구실은 피부의 모낭에서 줄기 세포를 연구합니다. 피부는 쉽게 볼 수 있고 세포의 회전율이 일정하기 때문에 상피 조직과 줄기 세포 증식을 연구하기에 좋은 모델입니다. 상피암은 피부와 같은 상피 조직이 환경 발암 물질에 대한 첫 번째 방어선이기 때문에 가장 흔한 형태의 암으로, 높은 회전율과 상피 세포의 증식을 초래한다3. 피부 표피의 최상부 보호층인 표피의 대부분은 각질형성세포로 구성되어 있으며, 각질형성세포는 다양한 유형의 케라틴을 발현하여 지지력과 구조를 제공한다4. 상피암 환자는 종종 혈액과 골수에 케라틴을 발현하는 상피 세포가 있습니다. 액체 생검은 다양한 체액에서 이러한 상피 세포를 검출하고 모니터링하는 비침습적 방법입니다5. 순환 종양 세포(CTC)라고도 하는 순환 상피 세포는 말초 혈액에서 발견되며 암 예후의 바이오마커가 될 수 있을 뿐만 아니라 개별화된 치료 치료를 안내할 수 있습니다. CTC는 또한 질병 진행, 치료 효능 및 전체 환자 생존을 나타낼 수 있습니다 5,6.
상피 세포 접착 분자(EpCAM)는 CTC에 임상적으로 사용되는 마커이며 암 환자에서 상피 기원의 종양을 식별할 수 있습니다. EpCAM은 세포 부착, 이동, 신호 전달, 증식 및 분화에 중요한 역할을 한다6. 순환 상피 세포가 CTC로 분류되려면 사이토케라틴 8, 18, 19에 대해 양성이어야 하고 일반적인 백혈구 마커인 CD45에 대해 음성이어야합니다 6. CTC는 일반적으로 먼저 자성 마이크로비드로 CD45를 고갈시킨 다음 면역형광 현미경을 사용하여 EpCAM 및 사이토케라틴 19를 검사하여 식별한다7. CTC 검출의 주요 한계는 희귀성입니다. 그들은 혈액 내 모든 세포의 0.01 % 미만을 차지하며, 먼 장기에 도달하기 위해 순환 중에 생존하는 사람은 거의 없습니다 8,9,10. 희귀 특성으로 인해 이러한 세포를 분리하고 식별하기 위한 실험 및 기술을 설계할 때 고려해야 합니다. 현재 CTC를 식별하는 데 사용되는 미국 식품의약국(FDA) 승인 자동 단일 세포 분류기는 단 하나뿐이며 EpCAM을 바이오마커로 사용합니다. 다른 방법에는 자기 비드 분리 및 유세포 분석, 또는 이들 방법의 조합이 포함됩니다. 희귀 CTC의 검출을 위해 더 높은 민감도와 특이성을 갖는 새로운 기술이 필요하다11.
유세포 분석은 혈액, 골수 및 기타 조직 샘플에서 희귀 세포 집단을 검출하는 데 선호되는 방법입니다. 이러한 희귀 세포에는 줄기 세포, 순환 내피 세포, CTC 및 잔류 질환 세포가 포함될 수 있습니다. 유세포 분석은 각 세포 유형의 정량적 측정을 가능하게 하고 추가 테스트를 위해 이러한 세포를 분류합니다 7,9. 이러한 희귀 세포의 정확한 평가를 보장하기 위해 증분 계수가 수행되었습니다. 게이팅을 사용하여 추가 분석에서 세포를 제외하는 기능은 세포를 분석할 때 특이성을 높이는 방법입니다. 유세포 분석의 한계는 큰 시료를 분석하는 데 필요한 시간과 세포 식별에 대한 시각적 확인이 부족하다는 것입니다. 이를 극복하기 위해 분류된 세포에 대해 면역형광 현미경을 수행하여 신원을 확인했습니다.
이전에 우리 연구실은 생쥐에서 골수 세포가 모집되어 피부 종양에 기여한다는 것을 보여주었습니다12. 이러한 골수 유래 세포는 범 사이토 케라틴 및 표피 사이토 케라틴에 양성입니다. 종양 진행에서 상피 줄기 세포, 골수 유래 세포 및 사이토케라틴 발현 세포의 역할을 추가로 설명하기 위해 정상 쥐와 인간 혈액 및 골수 샘플에서 EpCAM+ 사이토케라틴 양성 세포를 찾았습니다. 대부분의 실험과 마찬가지로 이 방법은 여러 번 반복하여 개발되었습니다. 이전에는, 형질전환 마우스를 골수에서 K14GFP-발현 세포를 찾기 위해 증분 계수와 함께 사용하였다12. 더 많은 세포가 계수됨에 따라, 대표 결과 섹션의 그림 1 에서 볼 수 있듯이 희귀 세포의 대표 집단을 식별할 수 있었습니다. 정상 혈액 및 골수에서 상피 세포를 조사하는 근거는 CTC에 대한 초기 문헌에 근거한 것으로, 정상적이고 건강한 기증자는 EpCAM+ 세포의 배경 수준을 가지고 있었다13. 앞서 언급했듯이 EpCAM 특성화는 종종 CD45의 고갈로 시작됩니다. 일부 조혈 세포는 추가 조사가 필요한 알려지지 않은 이유로 EpCAM 및 사이토케라틴 발현을 갖기 때문에 이 단계를 생략했습니다. 따라서 세포 계통에 관계없이 EpCAM의 존재 여부에 따라 세포를 분류한 다음 사이토케라틴에 대해 면역염색했습니다. 아래 프로토콜과 그림 2 에 표시된 워크플로우는 보상 및 대조군, 통계적 방법 및 면역형광 이미징과 함께 유세포 분석을 사용하여 이러한 희귀 상피 세포 집단을 분리하고 식별하는 기술을 설명합니다.
프로토콜
모든 동물 프로토콜은 NIH 및 연방 지침에 따라 미네소타 대학 기관 동물 관리 및 사용 위원회의 승인을 받았습니다. 신선한 인간의 혈액과 골수는 상업적인 출처에서 구입했습니다. 샘플은 HIV, B형 간염, C형 간염에 대해 음성인 기증자로부터 승인된 IRB 프로토콜에 따라 회사에서 수집하고 COVID-19 검사를 받았습니다. 모든 샘플은 회사에서 배송하기 전에 먼저 익명화되고 익명화되었습니다. 이들은 상업적으로 획득 되었기 때문에 IRB 승인이 필요하지 않았습니다.
1. 용액 준비
알림: 모든 용액은 무균 환경의 생물학적 후드에서 준비해야 합니다. 인간의 혈액 및 골수 작업에 대한 생물 안전 레벨 2(BSL2) 인증을 획득하십시오.
- 행크잔산염 용액(HBSS) 500mL에 겐타마이신 1mL와 소태아혈청(FBS) 5mL를 첨가하여 골수 채취액을 준비한다.
- HBSS 500mL에 FBS 50mL를 첨가하여 염색 완충액을 준비한다.
- 1x 용해 완충액 10mL와 멸균수 10mL를 결합하여 용해 완충액 90개를 준비합니다.
2. 후드 준비
- 후드를 켜고 적절한 공기 흐름을 얻기 위해 몇 분 동안 작동시키십시오.
- 골수 채취를 수행하기 위해 모든 재료를 수집하십시오. 무균 환경을 유지하기 위해 후드 내부에 70% 에탄올을 뿌립니다. 후드 안으로 들어가기 전에 매번 손을 뿌리십시오.
- 오토클레이브 트레이를 오토클레이브 가위, 조립된 메스, 핀셋, 구부러진 집게와 함께 70% 에탄올로 채워진 작은 컵에 넣어 멸균 상태를 유지합니다.
- 골수 채취 용액 10mL를 50mL 원심분리기 튜브 1개에 넣고 "팔다리"라고 표시합니다. 다른 50mL 원심분리기 튜브에 "골수"라고 표시합니다.
- 골수 채취 용액 10mL를 주사기에 넣은 다음 26G 바늘을 부착합니다.
3. 생쥐에서 골수 채취
- 마우스를CO2 질식을 사용하여 안락사시킨다. 사망은 심장 박동이없고 반응이 없는지 확인하기 위해 발을 꼬집음으로써 확인됩니다. 자궁 경부 탈구는 완전한 안락사의 2 차 수단으로 수행 될 수 있습니다.
- 마우스를 500mL 용기에 넣고 마우스의 절반을 덮을 만큼 충분한 요오드를 추가합니다. 용기를 부드럽게 흔들고 휘젓고 완전히 덮을 수 있도록 합니다. 탈 이온수로 헹굽니다. 요오드 세척을 한 번 더 수행 한 다음 동일한 단계에 따라 70 % 에탄올로 두 번 세척하십시오.
- 마우스를 후드에 놓고 트레이에 등을 대고 놓습니다. 뒷다리를 잡고 팝이 느껴질 때까지 잡아 당깁니다. 이것은 척추에서 다리를 분리하는 것입니다.
- 사타구니 부위 근처의 마우스 피부를 1cm 절개합니다. 닫힌 가위를 절개 부위에 삽입한 다음 피부 아래의 가위를 열어 복막에서 분리합니다.
- 허벅지 주위의 다리 피부를 자른 다음 다리 아래로 피부를 잘라 근육과 뼈를 노출시킵니다.
- 대퇴골을 절단하지 않도록 고관절 주위를 절단하여 뒷다리를 제거하십시오. "팔다리"라고 표시된 튜브에 팔다리를 놓습니다. 두 다리를 제거하면 마우스를 시체 주머니에 넣고 냉동실에 넣으십시오.
알림: 대부분의 골수는 대퇴골에서 얻어지므로 가위를 안내하고 대퇴골 절단을 피하기 위해 절단하기 전에 엉덩이 뼈를 먼저 느껴야 합니다. - 가위를 사용하여 팔다리 중 하나를 따라 근육, 조직 및 지방을 잘라냅니다. 뼈와 평행하게 자릅니다. 그런 다음 메스를 사용하여 뼈를 수직으로 긁는 동작을 사용하여 남아 있는 지방이나 근육을 제거합니다.
- 뼈가 제대로 청소되면 무릎에서 대퇴골과 경골을 분리합니다. 메스를 사용하여 대퇴골과 경골의 양쪽 끝을 잘라내어 골수가 보이지 않는 곳에 절개합니다.
- 준비된 주사기와 바늘을 뼈에 삽입하십시오. 저항이 있으면 더 이상 저항이 없을 때까지 뼈 끝을 조금 더 잘라냅니다.
- "골수"라고 표시된 튜브 위에 뼈를 잡고 뼈를 통해 골수 채취 용액을 배출하여 골수를 튜브로 플러시합니다. 뼈가 모두 하얗거나 비어 있을 때까지 뼈의 다른 쪽 끝에서 반복하여 나머지 골수를 얻습니다.
- 나머지 모든 뼈와 팔다리에 대해 7-9단계를 반복합니다. 모든 골수는 동일한 원추형 튜브로 플러싱됩니다.
- 빈 10mL 주사기와 20G 바늘을 사용하여 주사기에 골수를 5-10회 위아래로 당겨 튜브의 골수 덩어리를 분해합니다.
- 멸균 40μm 필터를 깨끗한 50mL 원심분리기 튜브에 넣고 골수 수확 용액 1mL로 헹굽니다. 그런 다음 골수를 걸러서 남아 있는 덩어리를 제거합니다. 이 튜브에 "Filtered Bone Marrow"라는 라벨을 붙입니다.
- 여과된 골수는 사용할 때까지 냉장고나 얼음 위에 보관하십시오. 수확 당일에 사용해야합니다. 같은 날에 사용하지 않을 경우, 디메틸 설폭사이드(DMSO)와 같은 냉동 보존제를 사용하여 세포를 동결시킨다.
주의 : 이 실험에서 나온 모든 폐기물은 생물학적 위험 폐기물 용기에 적절하게 처리해야 합니다. 모든 날카로운 물건은 적절하게 라벨이 붙은 생물학적 위험 날카로운 물건 용기에 넣어야 합니다.
4. 골수의 적혈구 용해
- 골수 세포를 실온에서 10분 동안 170 x g 로 원심분리합니다. 상층액을 진공 청소기로 청소하고 폐기하십시오. 1x 적혈구 용해 완충액 10mL에 세포를 재현탁하고 4분 동안 배양합니다.
- Dulbecco의 인산염 완충 식염수(DPBS) 30mL를 추가하여 용해 완충액의 반응을 중지합니다. 실온에서 170 x g 에서 8분 동안 세포를 원심분리합니다. 상층액을 진공 청소기로 청소하고 폐기하십시오. 10-20 mL의 염색 완충액에 재현탁합니다.
5. 세포 수
- 500 μl의 세포와 9.5 mL의 골수 수확 용액을 결합하여 1:20 희석액을 얻습니다.
참고: 이것은 세포 수에 사용되며 멸균 상태를 유지할 필요가 없습니다. - 1:20 희석액에서 세포 200μL를 꺼내 트리판 블루 200μL에 넣고 잘 섞습니다.
- 혼합물을 혈구계에 넣고 양쪽의 살아있는 세포와 죽은 세포를 세십시오. 이 표( 보충 파일 1에 표시됨)와 방정식을 사용하여 원래 세포 현탁액을 계산합니다.
밀리리터당 세포: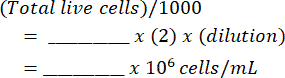
총 셀: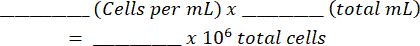
- 4°C에서 10분 동안 170 x g 의 속도로 세포를 스핀다운하고 항체 희석에 대한 제조업체의 제안에 따라 1mL당 10 x 106 세포(100μL당 1 x 10 6개 세포) 의 농도로 재현탁합니다.
- 유세포 분석을 진행합니다(8단계).
6. 생쥐에서 혈액 채취
- CO2 가스 또는 자궁 경부 탈구를 사용하여 마우스를 안락사시킵니다.
- 0.5M 에틸렌디아민테트라아세트산(EDTA)으로 코팅된 1mL 주사기에 부착된 26G 바늘을 사용하여 45° 각도로 심장 채혈을 수행합니다.
- 혈액을 회전시키고 배지 또는 염색 완충액에 다시 현탁합니다.
참고: 세포는 적혈구 용해 및 세포 계수 후 염색 완충액에서 최종 농도로 회전되고 재현탁됩니다. - 적혈구 용해를 수행합니다(4단계).
- 셀 카운트를 수행합니다(5단계).
- 유세포 분석을 진행합니다(8단계).
7. 인간 혈액 및 골수 샘플 처리
- 개인 보호 장비를 착용한 상태에서 BSL2 인증 후드 아래에서 모든 절차를 수행하십시오.
- 전날 밤에 샘플을 수집하고 적혈구 용해를 수행합니다. 단핵 샘플을 얼음 위에서 밤새 운송하기 전에 샘플이 비식별화되고 익명화되었는지 확인하십시오.
- 도착하자마자, 살아있는 세포를 4°C에서 170 x g 에서 10분 동안 스핀 다운합니다.
알림: 이들은 BSL2 샘플이며 현지 지침을 따라야 합니다. - 배지 또는 염색 완충액에 세포를 재현탁합니다.
참고: 세포는 염색 완충액으로 세포 계수 후 최종 농도로 회전하고 재현탁해야 합니다. - 셀 카운트를 수행합니다(5단계).
- 유세포 분석을 진행합니다(8단계).
8. 유세포 분석
- 얼룩
- 보정 대조군(염색되지 않은 대조군, 동형형 대조군, 단일 염색 대조군 및 형광 마이너스 대조군[FMO])을 포함하여 사용된 염색 패널에 따라 세포를 개별적으로 라벨링된 튜브로 나눕니다. 남아 있는 세포를 동결하거나 형광 활성화 세포 분류에 사용합니다. 사용된 항체 희석물을 사용한 염색 패널의 예에 대해서는 표 1 을 참조하십시오.
알림: 추가 형광단이 추가될 때마다 나머지 형광단과 함께 FMO를 해당 형광단의 단일 염색과 함께 추가해야 합니다. 이소타입 대조군은 비특이적 염색을 차단하기 위해 사용될 수 있다. 사용된 각각의 새로운 항체는 최적의 희석을 위해 샘플로 적정해야 합니다. - 제조업체의 권장 희석액에 따라 항체를 추가하고 튜브 바닥을 가볍게 쳐서 잘 섞습니다. 항체 농도는 일반적으로 100 μL 당 1 x 106 세포로 주어진다. 항체 및 대조군을 사용한 희석은 표 1에 제시되어 있다. 항체는 형광단과 결합되며 빛으로부터 보호되어야 합니다.
참고: 피코에리트린(PE)에 결합된 EpCAM을 사용하여 낮은 세포 집단을 시각화하는 것이 가장 좋습니다( 표 1에 표시된 대로 100만 개 세포당 3-5μL로 적정). PE-CD49f는 단일 염색 PE 대조군(100만 세포당 20μL)으로 사용되었는데, 이는 이러한 세포가 PE-EpCAM보다 더 널리 퍼져 있어 보상에 사용하기 쉽기 때문입니다. - 어두운 곳에서 4°C에서 30분 동안 배양합니다.
- 배양 후 튜브를 BSL2 후드로 다시 가져오고 각 튜브에 1mL의 염색 버퍼를 추가합니다.
- 그런 다음 튜브를 4°C에서 170 x g 에서 5-10분 동안 원심분리합니다.
- 원심분리 후 세포가 있는 캡이 있는 튜브를 BSL2 후드로 다시 가져오고 상층액을 흡인합니다. 교차 오염을 방지하기 위해 각 튜브 사이의 흡인 피펫 끝을 교체하십시오.
- 세포 펠릿을 염색 완충액 1mL에 재현탁하고 튜브 바닥을 가볍게 두어 혼합합니다.
- 8.1.4-8.1.7 단계를 반복하여 세포를 두 번 더 세척하십시오.
알림: 세포 손실을 방지하기 위해 피펫을 사용하여 재현탁하지 마십시오. - 유세포 분석 전 최종 재현탁을 위해 500μL의 염색 완충액에 재현탁합니다. 제조업체의 권장 사항에 따라 4′,6-디아미디노-2-페닐인돌(DAPI) 또는 사혈구 판별제를 추가합니다.
- 보정 대조군(염색되지 않은 대조군, 동형형 대조군, 단일 염색 대조군 및 형광 마이너스 대조군[FMO])을 포함하여 사용된 염색 패널에 따라 세포를 개별적으로 라벨링된 튜브로 나눕니다. 남아 있는 세포를 동결하거나 형광 활성화 세포 분류에 사용합니다. 사용된 항체 희석물을 사용한 염색 패널의 예에 대해서는 표 1 을 참조하십시오.
- 유세포 분석기
- 기계를 설정한 후 컨트롤과 FMO를 사용하여 보정 및 게이트를 설정합니다. Hank의 균형 잡힌 소금 용액(HBSS)을 시스액으로 사용하여 깨지기 쉬운 세포를 지지합니다. HBSS를 사용할 수 없는 경우 PBS를 사용합니다.
참고: 사용된 유세포 분석기와 소프트웨어는 재료 표에 나열되어 있습니다. - 샘플을 한 번에 하나씩 로드하고 50,000, 100,000, 500,000 및 100만 개의 이벤트에 대한 데이터 요소를 수집합니다. 사용할 때까지 튜브를 얼음 위에 보관하거나 냉장 보관하십시오.
알림: 샘플 생존력을 보장하기 위해 수집할 때 시간 제한을 설정할 수 있습니다. - 15mL 원심분리기 튜브에서 10% FBS와 함께 3mL의 RPMI로 세포를 수집합니다.
- EpCAM+ 세포에서 면역형광을 수행하는 경우 유세포 분석기를 사용하여 800-1,000개의 세포를 8웰 슬라이드의 각 웰로 분류합니다.
- 면역형광을 염색할 때 사용할 음성 대조군으로 별도의 슬라이드에 EpCAM-세포 집단을 분류합니다.
참고: 세포는 FBS가 들어 있는 15mL 튜브로 분류하고 세포가 터지는 것을 방지하기 위해 세포 원심분리기 또는 피펫을 사용하여 슬라이드로 회전시킬 수도 있습니다. - 슬라이드를 50% 메탄올/50% 아세톤 혼합물에 -20°C에서 10분 동안 고정합니다. 슬라이드를 면역형광으로 염색될 때까지 -20°C에서 보관한다.
- 기계를 설정한 후 컨트롤과 FMO를 사용하여 보정 및 게이트를 설정합니다. Hank의 균형 잡힌 소금 용액(HBSS)을 시스액으로 사용하여 깨지기 쉬운 세포를 지지합니다. HBSS를 사용할 수 없는 경우 PBS를 사용합니다.
- 유세포 분석
- 라이센스가 부여된 유세포 분석 소프트웨어를 엽니다.
- 유세포 분석기에서 획득한 유세포 분석 표준물질(FCS) 파일을 대조군 및 샘플과 함께 로드합니다.
- Create Group(그룹 만들기)을 클릭하고 키워드를 사용하여 샘플과 컨트롤을 그룹에 배치합니다.
참고: 그림 3과 같이 "얼룩 없음" 컨트롤을 사용하여 유세포 분석 소프트웨어에서 게이트합니다. - 얼룩 방지 샘플을 두 번 클릭하여 unated 그래프를 엽니다.
- 그래프 y축을 SSC-A로 설정하고 x축을 FSC-A(전방 산란 영역에 의한 측면 산란 영역)로 설정하여 셀 크기와 내부 복잡성을 나타냅니다.
- 왼쪽 상단 패널에서 다각형 모양을 클릭하고 셀 주위에 게이트를 만듭니다. 주변에 있는 세포는 파편일 가능성이 높으므로 제외해야 합니다. 그림 3A와 같이 이 게이트에 "Cells"라는 레이블을 붙입니다.
- 셀이 게이트되면 다각형 모양 내부를 두 번 클릭하여 새 창에서 다른 그래프를 엽니다.
- 이중항 판별을 위해 새 그래프의 y축을 SSC-A로 설정하고 x축을 SSC-W로 설정합니다. 다각형 도형을 클릭하고 단일 셀 주위에 직사각형을 만듭니다. 그림 3B와 같이 이 레이블을 "단일 셀"로 지정합니다.
- 셀이 게이트되면 다각형 모양 내부를 두 번 클릭하여 새 창에서 다른 그래프를 엽니다.
- y축을 FSC-A로 설정하고 x축을 DAPI-A(또는 데드 셀 판별자가 사용됨)로 설정합니다.
- 그래프 왼쪽에 있는 DAPI 음수 셀 주위에 다각형 게이트를 만듭니다. 그림 3C와 같이 이러한 "Live Cells"에 레이블을 지정합니다.
- 셀이 게이트되면 다각형 모양 내부를 두 번 클릭하여 새 창에서 다른 그래프를 엽니다.
- y축을 SSC-A로, x축을 EpCAM-PE(또는 EpCAM 셀을 식별하는 데 사용되는 형광단)로 설정합니다. 왼쪽의 셀은 EpCAM 음성입니다. 오른쪽에 표시된 세포가 있으면 EpCAM 양성입니다.
- EpCAM-PE 그래프를 사용하여 왼쪽의 셀을 제외하고 오른쪽의 빈 공간만 포함하는 폴리곤 게이트를 만듭니다. 그림 3D와 같이 다각형 내부의 오른쪽에 있는 빈 영역에 "EpCAM"이라는 레이블을 지정합니다.
참고: 이것은 얼룩이 없는 컨트롤이므로 EpCAM 발현이 없어야 합니다. 염색 없음 대조군을 사용하여 어떤 세포가 EpCAM 양성인지 확인합니다. 이렇게 하면 보정에 대한 게이팅 전략이 완료되므로 이 시점에서 모든 그래프가 닫힐 수 있습니다. - 작업 공간 페이지에서 "Cells", "Single Cells", "Live Cells" 및 "EpCAM"을 사용하여 얼룩 없음 계보를 강조 표시합니다. 마우스 오른쪽 버튼을 클릭하고 그룹에 분석 복사를 선택합니다. 이렇게 하면 게이팅 전략이 이전에 만든 그룹 내에서 로드된 다른 모든 샘플에 복사됩니다. 처음에 그룹을 만들지 않은 경우 왼쪽 상단에서 그룹 만들기를 선택하여 지금 만들 수 있습니다.
- 그룹 내의 샘플을 살펴보고 이전에 그린 다각형 게이트를 확인하여 모든 샘플 및 컨트롤에 맞는지 확인합니다. 이것은 셀의 백분율 수와 수를 제공합니다.
- "작업 공간" 위의 왼쪽 상단 모서리에 있는 레이아웃 편집기 버튼 L 을 클릭합니다. 그런 다음 이러한 그래프를 정렬하고 레이아웃 편집기를 사용하여 내보낼 수 있습니다.
- 면역형광시약의 제조
- 소혈청알부민(BSA) 1g, 무지방유 2g, 10x 트리스 완충 식염수(TBS) 10mL, 트윈 100μL, 증류수 90mL를 혼합하여 항체 희석제를 준비합니다.
- 50mL의 20x TBS, 950mL의 증류수 및 200μL의 트윈을 혼합하여 TBST를 준비합니다.
- 10mL의 NHS와 1mL의 항체 희석제를 결합하여 9% 정상 말 혈청(NHS)을 준비합니다(8.4.1단계).
- 10% NHS 1mL와 TBST 9mL를 조합하여 1% NHS를 준비합니다.
- 면역형광 염색
- -20°C에서 슬라이드를 제거하고 실온으로 예열합니다.
- 슬라이드를 증류수로 각각 5분 동안 세 번 세척합니다.
- 슬라이드를 항체 희석제 중 10% NHS 중 실온에서 1시간 동안 차단한다(단계 8.4.3).
- 1차 항체(pan-cytokeratin)를 TBST의 1% NHS에서 1:750으로 희석합니다(단계 8.4.4). 희석된 1차 항체에서 슬라이드를 4°C에서 밤새 인큐베이션한다.
- 다음날, 슬라이드를 1x 세척 완충액(PBS 또는 TBST)으로 각각 5분 동안 3회 세척한다.
- 2차 항체를 TBST의 1% NHS에서 1:1,000으로 희석합니다(단계 8.4.4). 희석된 2차 항체에서 슬라이드를 실온에서 1시간 동안 인큐베이션한다.
- 슬라이드를 1x 세척 버퍼로 각각 5분 동안 세 번 세척합니다. DAPI가 있는 하드셋 마운팅 미디어로 슬라이드를 장착하고 커버슬립합니다. 면봉을 사용하여 커버슬립 아래에 있는 기포를 부드럽게 밀어냅니다.
결과
이러한 방법을 사용하여 정상 인간과 생쥐의 혈액 및 골수에서 희귀 한 상피 세포 집단을 시각화했습니다. 설명된 대로 적절한 보상 및 대조군을 통해 그림 4 및 그림 5에서 볼 수 있듯이 계수된 세포 수에 관계없이 쥐 골수에 있는 세포의 4%-5%가 EpCAM+임을 일관되게 보여주는 결과가 일관되게 나타났습니다. 쥐 혈액 샘플에서 그림 6과 같이 세포의 0.5% 미만이 EpCAM+였습니다. 인간 골수 샘플에서 세포의 2%-5%는 그림 7 및 그림 8과 같이 EpCAM+였습니다. 2%-5%는 큰 범위이지만 각 개별 기증자 내의 백분율은 점진적으로 더 많은 세포가 계산됨에 따라 일관되었습니다. 그림 9에서 볼 수 있듯이 인간 혈액 샘플에서 세포의 약 0.3%가 EpCAM+였습니다. 당사의 대조군 샘플(염색 없음, 이소타입 대조군 및 FMO)은 그림 4 및 그림 7에서 볼 수 있듯이 위양성 EpCAM+ 결과가 거의 없었습니다. 슬라이드 상에 분류된 EpCAM+ 및 EpCAM- 그룹의 세포는 EpCAM+ 샘플에서 범-사이토케라틴에 대해 양성 염색을 보였고, 그림 10에 나타낸 바와 같이, EpCAM-샘플에서 팬-사이토케라틴에 대해 음성이었다. 이러한 결과는 실험이 적절하게 설계되고 재현 가능하다는 것을 나타냅니다.
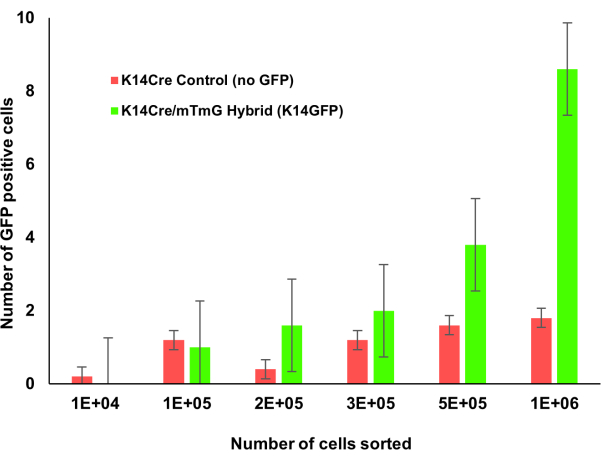
그림 1: Krt14Cre;mTmG 형질전환 마우스(점진적인 골수 카운트). Krt1-14;mTmG 마우스의 골수를 점진적으로 계수하였다. GFP 양성 세포는 케라틴 14 발현을 나타내며 유세포 분석을 사용하여 확인되었습니다. 더 많은 골수 세포가 계산됨에 따라 이 케라틴 14 양성 세포 집단을 더 쉽게 식별할 수 있었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: EpCAM+ 및 사이토케라틴+ 세포에 대한 워크플로우. 골수 및 혈액 세포를 먼저 형광 활성화 세포 분류 (FACS)를 사용하여 분류하여 EpCAM+ 및 EpCAM- 세포를 분리하였다. 이 세포는 두 개의 다른 시험관과 두 개의 다른 슬라이드로 분류되었습니다. 시험관으로 분류된 세포는 세포원심분리기를 사용하여 슬라이드 상에 회전시켰다. 이어서, 슬라이드를 범-사이토케라틴 1차 항체를 사용하여 염색한 다음, 2차 항체로 염색하였다. 슬라이드는 범-사이토케라틴 발현을 관찰하기 위해 형광 현미경을 사용하여 분석되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
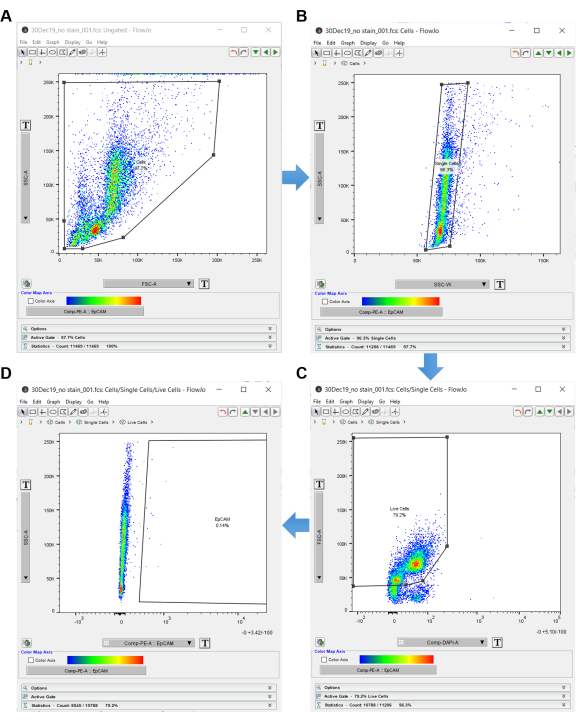
그림 3: 유세포 분석 소프트웨어. 분석 소프트웨어를 사용하여 유세포 분석 데이터를 분석할 때 무염색 제어는 관심 있는 세포를 선택하는 데 사용됩니다. 셀은 먼저 SSC-A 및 FSC-A로 선택되며, 이는 셀의 내부 복잡성과 크기를 보여줍니다. (A) 셀 주위에 다각형 게이트가 그려집니다. (B) 단세포는 SSC-W에 의해 SSC-A를 게이팅하여 획득됩니다. (C) 살아있는 세포는 FSC-A 대 DAPI를 게이팅하여 획득됩니다. (D) EpCAM 음성 세포는 EpCAM 음성 세포의 오른쪽에 게이팅하여 제외됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
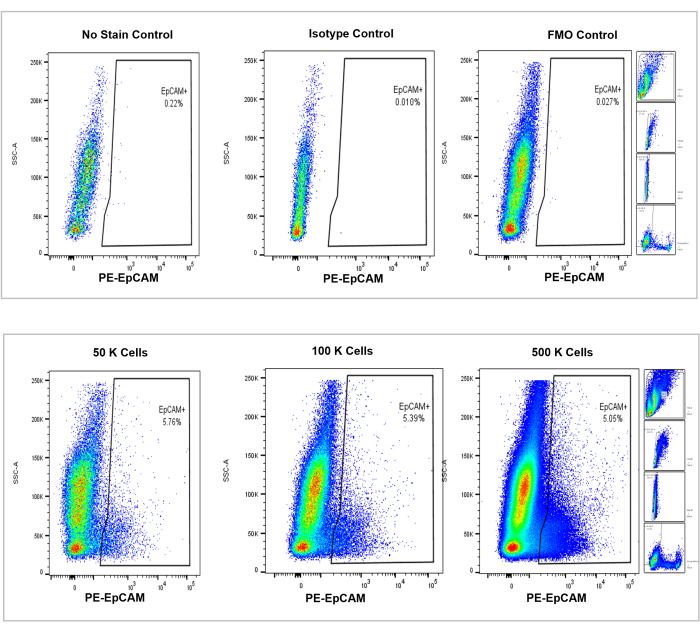
그림 4: 마우스 골수에서 EpCAM+ 세포의 유세포 분석. 얼룩 없음, 등형 및 FMO의 컨트롤은 상단 패널에 표시되며 하단 패널에는 50,000, 100,000 및 500,000 셀의 증분 카운트가 표시됩니다. 이 차트는 계산된 총 셀의 전반적인 증가에도 불구하고 카운트 간 백분율의 일관성을 시각화합니다. 오른쪽 패널은 이전에 유세포 분석 섹션에서 설명한 것과 그림 3에서 볼 수 있듯이 게이팅 전략을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
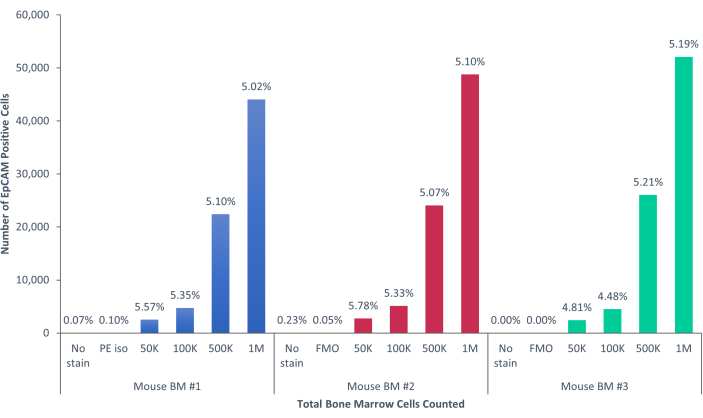
그림 5: 마우스 골수의 EpCAM+ 세포는 인구의 5.17% ± 0.001%를 구성합니다. 3마리의 개별 마우스의 골수 세포를 분석하였다. 적절한 과학적 엄격함을 위해 적절한 통제가 포함되었습니다. 양성 세포의 비율은 마우스가 유전적으로 동일하기 때문에 샘플 전체에서 일관되게 유지되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
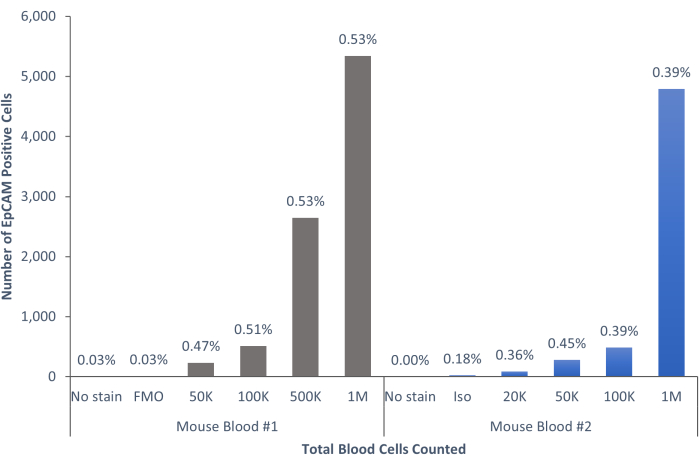
그림 6: 마우스 혈액의 EpCAM+ 세포는 모집단의 0.45% ± 0.0006%를 구성합니다. 두 마리의 개별 마우스의 혈액 세포를 분석했습니다. 결정적인 결과를 얻기 위해 적절한 절차를 따랐음을 보여주기 위해 대조군이 포함되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
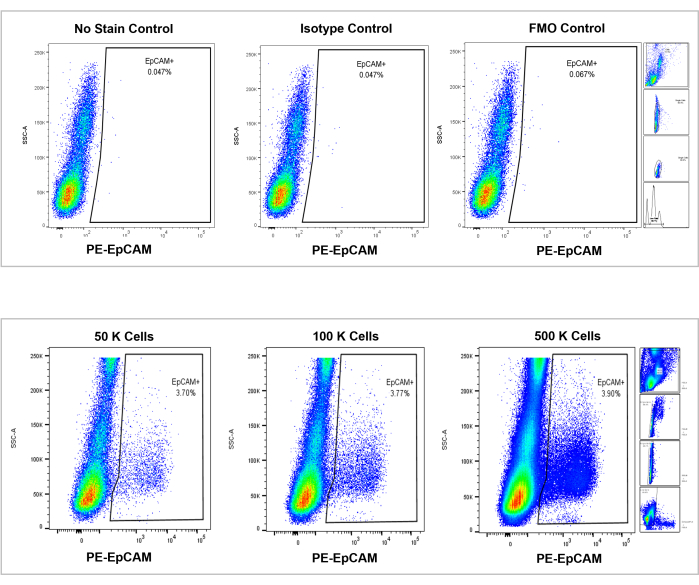
그림 7: EpCAM+ 인간 골수에 대한 유세포 분석. 염색 없음, 등형 및 FMO의 대조군이 상단 패널에 표시되고 50,000, 100,000 및 500,000 세포의 증분 카운트가 하단 패널에 표시됩니다. 이러한 차트는 계산된 총 셀의 전반적인 증가에도 불구하고 카운트 간 백분율의 일관성을 시각화합니다. 오른쪽 패널은 이전에 유세포 분석 섹션에서 설명한 것과 그림 3에서 볼 수 있듯이 게이팅 전략을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: 인간 골수의 EpCAM+ 세포는 인구의 3.53% ± 0.006%를 차지합니다. 3개의 상이한 인간 골수 샘플을 분석하였다. 과학적 엄격함에 대한 적절한 통제가 포함되었습니다. 양성 세포의 비율은 인간 간의 유전적 이질성으로 인해 다양합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
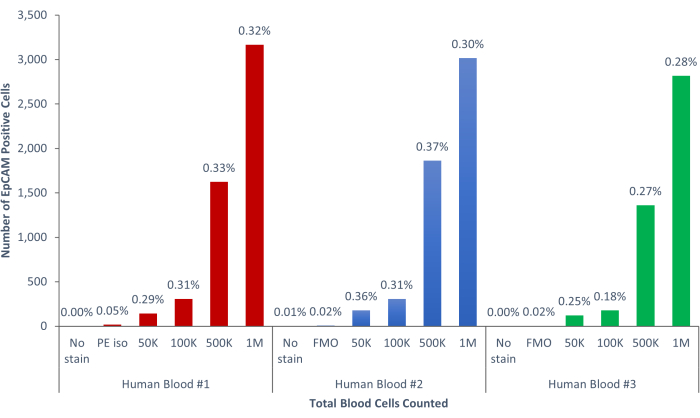
그림 9: 인간 혈액의 EpCAM+ 세포는 인구의 0.18% ± 0.0004%를 구성합니다. 3개의 상이한 인간 혈액 샘플을 분석하였다. 과학적 엄격함에 대한 적절한 통제가 포함되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
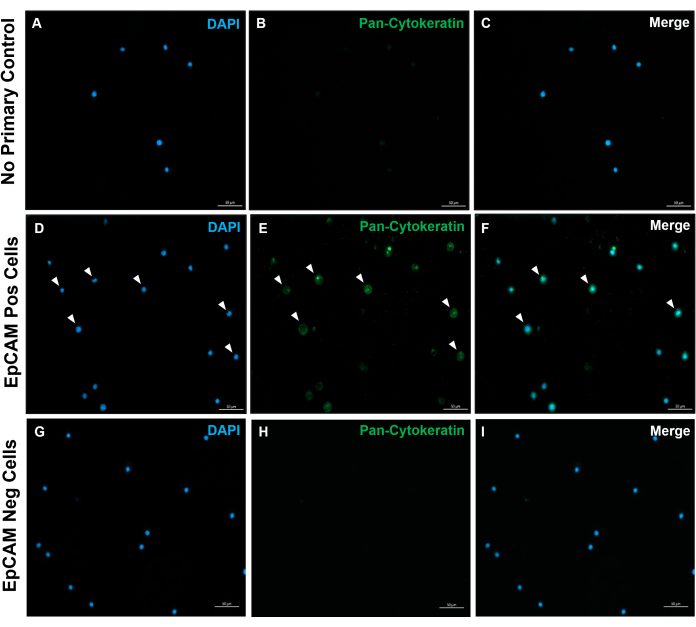
그림 10: EpCAM+ 및 EpCAM- 슬라이드의 면역형광. FACS를 사용하여 EpCAM+ 및 EpCAM- 세포를 분리하였다. 범-사이토케라틴 DAKO 항체를 이용하여 판-사이토케라틴 염색하였다. 정상 혈청에서 1차 항체 대조군은 사용되지 않았으며, 범-사이토케라틴은 다클론 항체입니다. 이러한 결과는 FACS의 정확성을 확인시켜줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 인간의 골수 또는 혈액 | |||
| 항체 | 관 # | # 셀 | AB Conc |
| 염색되지 않은 | 1 | 1x106 | X |
| DAPI만 해당 | 2 | 1x106 | 1uL/mL |
| PE 아이소타입 제어 | 3 | 1x106 | 1 uL |
| CD49f-PE 단일 얼룩 제어 | 4 | 1x106 | 1x10 당 100uL에서 20 uL6 |
| EpCAM-PE 저적정 | 5 | 1x106 | 1x10 당 100uL에서 3 uL6 |
| EpCAM-PE 중간 적정 | 6 | 1x106 | 1x10 당 100uL에서 4 uL6 |
| EpCAM-PE 고적정 | 7 | 1x106 | 1x10 당 100uL에서 5 uL6 |
| 슬라이드의 EpCAM-PE 고정렬 | 8 | 10x106 | 1mL에 50uL |
표 1: 유세포 분석 패널. 혈액 또는 골수 단핵 세포에 대한 유세포 분석 염색 패널의 예. 포함된 대조군은 DAPI 단독, 염색되지 않은 대조군 및 PE 단일 염색 대조군(PE-CD49f가 더 나은 양성 대조군으로 사용됨)입니다. 형광 마이너스 1은 단색(PE)일 뿐이므로 이 패널에 포함되지 않습니다. 플루오레세인 이소티오시아네이트(FITC) 또는 알로피코시아닌(APC)과 같은 형광단 색상을 더 추가할 때 각 FMO 대조군에 대해 하나의 형광단을 제외하여 FMO를 포함해야 합니다.
보충 파일 1: 혈구계를 사용한 생세포 계수. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
골수에 상피 세포가 존재한다는 문헌에 몇 가지 증거가 있습니다. 이전에 논문은 일반적으로 간, 폐, 위장관, 흉선 및 피부와 같은 질병 및 손상의 맥락에서 상피 세포의 역할을 조사했습니다14,15,16,17. 그러나 건강한 개인의 골수에서 이러한 상피 세포의 존재에 대해서는 알려진 바가 많지 않습니다. 이 논문은 정상 혈액 및 골수에서 상피 세포를 식별하고 분리하는 것을 목표로 재현 가능한 방법을 확립하고자합니다. 이 방법은 상피 세포가 존재하는 이유와 질병이 없을 때 혈액과 골수에서 상피 세포가 어떤 역할을 하는지 식별하기 위해 이 분야를 발전시킬 것입니다. 아마도 이러한 세포는 정상적인 조직 유지의 일부이거나 부상 시 활성화될 수 있습니다. 골수는 줄기 세포의 저장소입니다. 그러나 이러한 상피 세포의 혈통이 무엇인지는 불분명합니다. 최근 논문에서는 흉선의 골수 유래 상피 세포에 대해 논의하고 있는데, 이 세포는 먼저 EpCAM과 조혈 마커인 CD45를 발현한 다음 손상 후 시간이 지남에 따라 CD45 발현을 잃는다15. 우리 연구실의 연구에서도 부상이 없는 건강한 혈액 및 골수 내에 CD45+ EpCAM+ 세포가 존재한다는 것이 확인되었다12. 그러나 이러한 세포의 역할은 아직 결정되지 않았습니다.
건강한 골수 내의 상피 세포를 검사하기 위한 재현 가능한 방법이 필요했습니다. 설명된 방법은 이러한 세포를 정상 상태로 추가로 특성화하는 데 도움이 될 것입니다. 이 방법에는 재현성을 유지하기 위한 중요한 단계가 있습니다. 이 프로토콜에서 가장 중요한 단계 중 하나는 마우스에서 골수를 채취하는 동안 후드의 무균 환경을 유지하는 것입니다. 여러 마우스에서 수확하는 경우 각 마우스에 새 바늘과 주사기를 사용하여 샘플 간의 교차 오염을 방지합니다. 이렇게 하면 샘플이 깨끗하고 결과에 영향을 줄 수 있는 오염 물질이 없는지 확인할 수 있습니다. 또한, 각각의 추가 마우스에 대해 준비된 주사기 및 표지 된 원추형 튜브의 수를 늘려야합니다. 또 다른 중요한 단계는 대부분의 골수 세포가 제거되었는지 확인하기 위해 깨끗한 흰색이 분명해질 때까지 뼈를 씻어내는 것입니다. 희귀 세포를 검출할 확률은 더 순수한 샘플에서 증가합니다. 적혈구 용해 프로토콜을 최적화하기 위해 수정이 이루어졌습니다. 이 단계에서 세포의 거의 절반이 손실되었기 때문에 일관되게 높은 생존력을 제공하는 올바른 완충액을 찾기 위해 여러 용해 완충액을 테스트했습니다. 다른 시약과 배양 기간은 다른 설정에서 개선된 결과를 위해 최적화해야 할 수 있습니다.
이 프로토콜의 가장 중요한 한계는 희귀 세포 집단을 찾기 위해 유세포 분석을 사용하는 것입니다. 앞에서 설명한 것처럼 대조군과 증분 카운트를 추가하면 분석의 특이성과 정확성을 높이는 데 도움이 됩니다. 또 다른 한계는 관심 모집단에 대한 적절한 마커가 사전에 식별되어야 한다는 것입니다. 따라서 주요 마커, 유세포 분석을 위한 항체 및 표적 종과 호환되는 항체에 대해 알아야 합니다.
이러한 방법은 기존 자동 CTC 분리기 및 단일 세포 RNA 염기서열 분석보다 훨씬 저렴한 비용으로 단일 세포 분석이 가능하므로 기존 방법보다 개선된 것입니다. 또한 유세포 분석을 더 쉽게 사용할 수 있습니다. FACS는 자성 마이크로비드 분리를 사용하여 이전에 보고된 결과와 비교하여 세포에 대해 더 높은 생존율을 유지했습니다. 마지막으로, 이러한 기술을 통해 벌크 RNA 염기서열 분석, scRNA 염기서열 분석 또는 세포 배양과 같은 다운스트림 분석을 위해 세포를 분리할 수 있습니다.
공개
알려진 이해 상충은 없습니다.
감사의 말
Josh Monts, The Hormel Institute의 핵심 시설 유세포 분석기 기술자
Todd Schuster, The Hormel Institute 핵심 시설 관리자
Derek Gordon, 통계 학자, Rutgers 대학
편집 지원을 해주신 Clarus Editorial Services, Santa Fe, NM의 Karen Klein에게 감사드립니다.
이 연구는 국립 보건원 (National Institutes of Health)의 국립 관절염 및 근골격계 및 피부 질환 연구소 (National Institute of Arthritis and Musculoskeletal and Skin Diseases)가 수상 번호 R21 AR075281과 미네소타 대학교 연구 담당 부사장 (제안 # 324240)의 연구, 예술 및 장학금 보조금으로 부분적으로 지원되었습니다. Hormel Institute의 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 40 μm Cell Strainer | Falcon | 352340 | Used to filter out any large clumps of cells from bone marrow |
| 5 mL Polystyrene Round-bottom tube | Falcon | 352054 | Tubes used for flow cytometry |
| 500 mL jar with lid | Nalgene | 11-823-32 | Used to wash the mouse |
| 190 proof Ethanol | Decon laboratories Inc | 2801 | Diluted to 70% with dH2O |
| Alexa Fluor 488 Goat anti-rabbit IgG (H+L) | Invitrogen | A11008 | Dilution: 1:1000 |
| Brightline Hemacytometer | Hausser Scientific | 02-671-10 | Used to count alive cells |
| Bovine Serum Albumin | Jackson ImmunoResearch | 001-000-162 | Component of antibody diluent |
| Characterized Fetal Bovine Serum (FBS) | Hyclone | SH30071.03 | Component of staining buffer and harvesting solution |
| Curity gauze sponges | Covidien | 2187 | Used to keep a clean work area when harvesting limbs and bone marrow |
| Curved Forceps | Miltex | 18-784 | Used during harvest |
| Cytokeratin, Wide Spectrum Screening | Dako | Z0622 | Dilution 1:750 *Now discontinued |
| Dulbecco's Phosphate Buffered Saline (DPBS 1x) | Gibco | 14190-144 500mL | Used to stop the red blood cell lysis reaction |
| Ethylenediaminetetraacetic acid | Sigma Aldrich | E9884-100G | Used at 0.5 M |
| Gentamicin sulfate | Lonza | 17-518Z | Component of harvesting solution |
| Hank's Balanced Salt Solution (HBSS 1x) | Gibco | 14175-095 500mL | Component of harvesting solution and staining buffer solution |
| Luer-Lok tip 10 mL syringe | Becton, Dickinson and Co | 309604 | Used with 26G needle to flush bones, used with 20G needle to break up clumps |
| Magic touch 2 ice bucket | BelArt | M16807-2001 | Used to store the specimens on ice |
| Nonfat dry milk | Apex | 20-241 | Component of Antibody Diluent |
| Normal horse serum | Vector | ZE0122 | Component of Antibody Diluent |
| PE anti-human CD 326 (EpCAM) | Biolegend | 324206 | Dilution: 5 µl in 100 µl per 1x106 cells |
| PE anti-mouse CD 326 (EpCAM) | Biolegend | 118205 | Dilution: 3 µl in 100 µl per 1x106 cells |
| PE mouse IgG2b, κ isotype control | Biolegend | 400313 | Dilution: 1 µl in 100 µl per 1x106 cells |
| PE rat anti-human CD49f | BD Biosciences | 555763 | Dilution: 20 µl in 100 µl per 1x106 cells |
| PE rat IgG2am, κ Isotype control | Biolegend | 400508 | Dilution: 1 µl in 100 µl per 1x106 cells |
| Polypropylene Conical Centrifuge Tubes 50 mL | Basix | 14-955-240 | Used in the centrifuge |
| Povidone-Iodine Scrub | Aplicare | 82-227 | Antiseptic used to sterilize the mice |
| PrecisionGlide Needle 20G x 1 1/2 | Becton, Dickinson and Co | 305176 | 20G needle used to break up bone marrow clumps |
| PrecisionGlide Needle 26G x 1/2 | Becton, Dickinson and Co | 305111 | 26G needle used to flush bone marrow from bones |
| PTFE Printed Slides | Electron Microscopy Services | 63422-06 | 8 well slides cells sorted onto for immunofluorescence |
| RBC Lysis buffer 10X | Invitrogen | 00-4300-54 | Dilution 1:10 using sterile deionized water |
| Scissors | Roboz | RS-6762 | Used during harvest |
| Stainless steel surgical blade #4 | Bard-Parker | 371222 | Used during harvest |
| Sterile tray | Polar ware | 10F | Used during harvest |
| StretchEase Powder-free nitrile examination gloves | Denville Scientific | G4161 | Used during harvest |
| Surgical Scalpel handle #4 | Fischer | 12-000-164 | Used with surgical blade |
| TBS 20x | Thermo | Component of TBST, used at 1X | |
| Trypan Blue Stain (0.4%) | Gibco | 15250-061 | Used to count dead cells. Filtered with .45 µm |
| Tween 20 | Sigma Aldrich | P1379-500mL | Component of TBST |
| Tweezers | Miltex | 6-8 | Used during harvest |
| Vectashield Vibrance Antifade Mounting Medium with DAPI | Vector | H-1800 | Nuclear stain for immunofluorescence |
참고문헌
- Larsen, S. B., Cowley, C. J., Fuchs, E. Epithelial cells: liaisons of immunity. Current Opinion in Immunology. 62, 45-53 (2020).
- Blanpain, C., Fuchs, E. Plasticity of epithelial stem cells in tissue regeneration. Science. 344 (6189), 1242281 (2014).
- Coradini, D., Casarsa, C., Oriana, S. Epithelial cell polarity and tumorigenesis: New perspectives for cancer detection and treatment. Acta Pharmacologica Sinica. 32 (5), 552-564 (2011).
- Dmello, C., et al. Multifaceted role of keratins in epithelial cell differentiation and transformation. Journal of Biosciences. 44 (2), 33 (2019).
- Poulet, G., Massias, J., Taly, V. Liquid biopsy: General concepts. Acta Cytologica. 63 (6), 449-455 (2019).
- Eslami-S, Z., Cortés-Hernández, L. E., Alix-Panabières, C. Epithelial cell adhesion molecule: an anchor to isolate clinically relevant circulating tumor cells. Cells. 9 (8), 1836 (2020).
- Morris, R. J. Circulating tumor cells: quintessential precision oncology presenting challenges for biology. NPJ Precision Oncology. 1 (1), 16 (2017).
- Lin, D., et al. Circulating tumor cells: biology and clinical significance. Signal Transduction and Targeted Therapy. 6 (1), 404 (2021).
- Spence, M., Adai, S., Landon, T., Richter, G. Few and far between: Tools and strategies for rare-event detection using flow cytometry. BioprobesJournal of Cell Biology. 71, 14-18 (2015).
- Yu, M., Stott, S., Toner, M., Maheswaran, S., Haber, D. A. Circulating tumor cells: approaches to isolation and characterization. Journal of Cell Biology. 192 (3), 373-382 (2011).
- Ye, Q., Ling, S., Zheng, S., Xu, X. Liquid biopsy in hepatocellular carcinoma: circulating tumor cells and circulating tumor DNA. Molecular Cancer. 18 (1), 114 (2019).
- Park, H., et al. marrow-derived epithelial cells and hair follicle stem cells contribute to development of chronic cutaneous neoplasms. Nature Communications. 9 (1), 5293 (2018).
- Marsman, W. A., et al. Epithelial cells in bone marrow: do they matter. Gut. 54 (12), 1821-1822 (2005).
- Borue, X., et al. marrow-derived cells contribute to epithelial engraftment during wound healing. The American Journal of Pathology. 165 (5), 1767-1772 (2004).
- Chakrabarti, S., et al. marrow-derived cells contribute to the maintenance of thymic stroma including TECs. Journal of Immunology Research. 2022, 6061746 (2022).
- Krause, D. S., et al. Multi-organ, multi-lineage engraftment by a single bone marrow-derived stem cell. Cell. 105 (3), 369-377 (2001).
- Wong, A. P., et al. Targeted cell replacement with bone marrow cells for airway epithelial regeneration. American Journal of Physiology-Lung Cellular and Molecular Physiology. 293 (3), L740-L752 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유