Method Article
ראיות לכך ש- EpCAM ו- Cytokeratin מבטאים תאי אפיתל בדם אנושי תקין ובמח עצם
In This Article
Summary
מאמר זה מציג שיטה הניתנת לשחזור עם ממצאים חדשים על נוכחות תאי אפיתל בדם ובמח עצם תקינים של בני אדם ועכברים באמצעות ציטומטריית זרימה ומיקרוסקופ אימונופלואורסצנטי. Krt1-14;mTmG עכברים טרנסגניים שימשו כשיטת in vivo כדי לאשר ממצאים אלה.
Abstract
תאי אפיתל זוהו בדם ובמח העצם של חולי סרטן ומחלות אחרות. עם זאת, נוכחות של תאי אפיתל נורמליים בדם ובמח העצם של אנשים בריאים עדיין לא זוהתה באופן עקבי. מוצגת כאן שיטה הניתנת לשחזור לבידוד תאי אפיתל מדם וממח עצם אנושיים ומורינים בריאים (BM) באמצעות ציטומטריית זרימה ומיקרוסקופ אימונופלואורסנציה (IF). תאי אפיתל אצל אנשים בריאים זוהו ובודדו לראשונה באמצעות ציטומטריית זרימה באמצעות מולקולת היצמדות תאי אפיתל (EpCAM). תאי EpCAM+ אלה אושרו כמבטאים קרטין באמצעות מיקרוסקופ אימונופלואורסצנטי בעכברים טרנסגניים Krt1-14;mTmG. בדגימות דם אנושיות היו 0.18% ± 0.0004 תאי EpCAM+ (SEM; n = 7 משכפלים ביולוגיים, 4 שכפולים ניסיוניים). ב-BM אנושי, 3.53% ±-0.006 (SEM; n=3 העתקים ביולוגיים, 4 שכפולים ניסיוניים) של תאים חד-גרעיניים היו EpCAM+. בדם עכברים, תאי EpCAM+ היוו 0.45% ± 0.0006 (SEM; n=2 משכפלים ביולוגיים, 4 משכפלים ניסיוניים), ובעכבר BM, 5.17% ± 0.001 (SEM; n=3 משכפלים ביולוגיים, 4 שכפולים ניסיוניים) היו EpCAM+. בעכברים, כל תאי EpCAM+ היו תגובתיים חיסונית לפאן-ציטוקרטין, כפי שנקבע במיקרוסקופ IF. התוצאות אושרו באמצעות Krt1-14;mTmG עכברים טרנסגניים, עם נמוך (8.6 תאי GFP+ מקוריים לכל 106 תאים מנותחים; 0.085% של תאים קיימא), אבל מספרים משמעותיים (p < 0.0005) של תאי GFP+ נוכחים BM מורין נורמלי, שלא היו תוצאה של אקראיות בהשוואה לבקרות שליליות מרובות. יתר על כן, תאי EpCAM+ בדם עכברים היו הטרוגניים יותר מאשר תאי CD45+ (0.58% ב- BM; 0.13% בדם). תצפיות אלה מסיקות כי תאים המבטאים חלבוני ציטוקרטין ניתנים לזיהוי באופן שניתן לשכפל בקרב תאים חד-גרעיניים מדם אנושי ודם מורין ו-BM. אנו מדגימים שיטה של קצירת רקמות, ציטומטריית זרימה וצביעת מערכת החיסון שניתן להשתמש בה כדי לזהות ולקבוע את תפקודם של תאי אפיתל פאן-ציטוקרטין אלה אצל אנשים בריאים.
Introduction
תאי אפיתל נמצאים במחסומים הפיזיים בין גופנו לסביבה ומסוגלים לזהות ולהגיב לשינויים במיקרו-סביבה שלהם1. יש להם נישה מתפשטת של תאי גזע המספקת דרך להפוך רקמות חדשות ולתקן נזק2. המעבדה שלנו חוקרת תאי גזע בזקיקי השיער של העור; העור הוא מודל טוב לחקר רקמת אפיתל והתפשטות תאי גזע מכיוון שהוא נראה בקלות ויש תחלופה מתמדת של תאים. סרטן אפיתל הוא הצורה הנפוצה ביותר של סרטן, אולי בשל רקמות אפיתל, כגון העור, להיות קו ההגנה הראשון מפני מסרטנים סביבתיים, המוביל שיעורי תחלופה גבוהים ואת התפשטות תאי אפיתל3. רוב האפידרמיס של העור, שכבת ההגנה העליונה, מורכב מקרטינוציטים, המבטאים סוגים שונים של קרטינים כדי לספק תמיכה ומבנה4. לחולים עם סרטן אפיתל יש לעתים קרובות תאי אפיתל נוכחים בדם ובמח העצם שלהם המבטאים גם קרטינים. ביופסיות נוזליות הן דרך לא פולשנית לזהות ולנטר תאי אפיתל אלה בנוזלי גוף שונים5. תאי אפיתל במחזור, הנקראים גם תאי גידול במחזור הדם (CTCs), נמצאים בדם היקפי ויכולים להיות סמנים ביולוגיים לפרוגנוזה של סרטן, כמו גם להנחות טיפולים פרטניים. CTCs יכולים גם להצביע על התקדמות המחלה, יעילות הטיפול, ואת הישרדות החולה הכוללת 5,6.
מולקולת היצמדות תאי אפיתל (EpCAM) היא סמן המשמש קלינית עבור CTCs ויכולה לזהות גידולים ממקור אפיתל בחולי סרטן. EpCAM ממלא תפקיד בהידבקות, נדידה, איתות, התרבות והתמיינותשל תאים 6. כדי שתא אפיתל במחזור הדם יסווג כ-CTC, עליו להיות חיובי עבור ציטוקרטינים 8, 18 ו-19, ושלילי עבור CD45, סמן לויקוציטים נפוץ6. CTCs מזוהים בדרך כלל על ידי דלדול CD45 הראשון עם microbeads מגנטיים, ואחריו בדיקות עבור EpCAM ו cytokeratin 19 באמצעות מיקרוסקופ immunofluorescence7. המגבלה העיקרית בזיהוי CTCs היא נדירותם; הם מהווים פחות מ -0.01% מכלל התאים בדם, ומעטים מאוד שורדים במחזור הדם ומגיעים לאיברים מרוחקים 8,9,10. יש לקחת בחשבון בתכנון ניסויים וטכניקות לבידוד וזיהוי תאים אלה בשל אופיים הנדיר. נכון לעכשיו, יש רק ממיין חד-תאי אוטומטי אחד שאושר על ידי מנהל המזון והתרופות האמריקאי (FDA) המשמש לזיהוי CTCs, והוא משתמש ב-EpCAM כסמן הביולוגי שלו. שיטות אחרות כוללות הפרדת חרוזים מגנטית וציטומטריית זרימה, או שילוב של שיטות אלה. יש צורך בטכניקות חדשות בעלות רגישות וספציפיות גבוהות יותר לאיתור CTCs נדירים11.
ציטומטריית זרימה היא שיטה מועדפת לאיתור אוכלוסיות תאים נדירות בדם, מח עצם ודגימות רקמה אחרות. תאים נדירים אלה יכולים לכלול תאי גזע, תאי אנדותל במחזור, CTCs ותאי מחלה שיורית. ציטומטריית זרימה מאפשרת מדידות כמותיות של כל סוג תא וממיינת תאים אלה לבדיקות נוספות 7,9. ספירות מצטברות בוצעו כדי להבטיח הערכה מדויקת של תאים נדירים אלה. היכולת להשתמש gating כדי להוציא תאים מניתוח נוסף היא דרך להגדיל את הספציפיות בעת ניתוח תאים. מגבלות ציטומטריית הזרימה הן הזמן הדרוש לניתוח דגימות גדולות והיעדר אישור חזותי לזהות התא. כדי להתגבר על כך, מיקרוסקופ immunofluorescence בוצע על התאים ממוינים כדי לאשר את זהותם.
בעבר הראתה המעבדה שלנו כי בעכברים תאי מח העצם מגויסים ותורמים לגידולי עור12. תאים אלה שמקורם במח העצם חיוביים עבור pan-cytokeratin ו cytokeratin. כדי להבהיר עוד יותר את תפקידם של תאי גזע אפיתליאליים, תאים שמקורם במח עצם ותאים המבטאים ציטוקרטין בהתקדמות הגידול, חיפשו תאים חיוביים לציטוקרטין מסוג EpCAM+ בדגימות דם ומח עצם רגילות ודם אנושי. כמו ברוב הניסויים, שיטה זו פותחה באמצעות חזרות מרובות. בעבר, עכברים טרנסגניים שימשו יחד עם ספירות מצטברות כדי לחפש תאים המבטאים K14GFP במח העצם12. ככל שנספרו יותר תאים, ניתן היה לזהות אוכלוסייה מייצגת של תאים נדירים, כפי שניתן לראות באיור 1 בסעיף התוצאות המייצגות. הרציונל לחקר תאי אפיתל בדם תקין ובמח עצם התבסס על ספרות מוקדמת על CTCs, שם לתורמים בריאים נורמליים היו רמות רקע של תאי EpCAM+13. כאמור, אפיון EpCAM מתחיל לעתים קרובות עם דלדול CD45. שלב זה הושמט מכיוון שלחלק מהתאים ההמטופויטיים יש ביטוי EpCAM וציטוקרטין מסיבות לא ידועות שיש לחקור עוד. לכן, התאים מוינו על בסיס נוכחות או היעדר EpCAM, ללא קשר לשושלת התא, ולאחר מכן הוכתם חיסון עבור ציטוקרטין. הפרוטוקול שלהלן וזרימת העבודה שמוצגת באיור 2 מתארים שיטה שמשתמשת בציטומטריית זרימה עם פיצוי ובקרות, שיטות סטטיסטיות והדמיית אימונופלואורסצנטיות כדי לבודד ולזהות את האוכלוסיות הנדירות האלה של תאי אפיתל.
Protocol
כל הפרוטוקולים של בעלי חיים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת מינסוטה בהתאם להנחיות NIH ופדרליות. דם אנושי טרי ומח עצם נרכשו ממקורות מסחריים. הדגימות נאספו על ידי החברה תחת פרוטוקול IRB מאושר מתורמים שליליים ל- HIV, הפטיטיס B, הפטיטיס C, ונבדקו ל- COVID-19. כל הדגימות הוסרו תחילה מהזיהוי והפכו לאנונימיות לפני שנשלחו על ידי החברה. מכיוון שאלו הושגו באופן מסחרי, לא נדרש אישור IRB.
1. הכנת פתרונות
הערה: כל הפתרונות חייבים להיות מוכנים במכסה מנוע ביולוגי עם סביבה סטרילית. קבל אישור בטיחות ביולוגית רמה 2 (BSL2) לעבודה עם דם אנושי ומח עצם.
- הכינו את תמיסת קציר מח העצם על ידי הוספת 1 מ"ל גנטמיצין ו-5 מ"ל של סרום בקר עוברי (FBS) ל-500 מ"ל של תמיסת מלח האיזון של האנק (HBSS).
- הכן את תמיסת חיץ הצביעה על ידי הוספת 50 מ"ל FBS ל- 500 מ"ל HBSS.
- הכינו חיץ ליזיס 1x על ידי שילוב של 10 מ"ל של חיץ ליזיס 10x עם 90 מ"ל מים סטריליים.
2. הכנת מכסה המנוע
- הפעל את מכסה המנוע ואפשר לו לפעול במשך מספר דקות כדי להשיג זרימת אוויר נאותה.
- לאסוף את כל החומרים לביצוע קציר מח עצם. רססו אותם בתוך מכסה המנוע באתנול 70% כדי לשמור על סביבה סטרילית. רססו את הידיים בכל פעם לפני שהן נלקחות לתוך מכסה המנוע.
- הניחו את המגש האוטומטי במכסה המנוע יחד עם מספריים אוטוקלאביות, אזמל מורכב, פינצטה ומלקחיים מעוקלים בכוס קטנה מלאה באתנול 70% כדי לשמור עליהם סטריליים.
- הוסף 10 מ"ל של תמיסת קציר מח עצם לצינור צנטריפוגה אחד של 50 מ"ל ותייג אותו "גפיים". תייגו צינור צנטריפוגה נוסף בנפח 50 מ"ל כ"מח עצם".
- צייר 10 מ"ל של פתרון קציר מח עצם לתוך מזרק ולאחר מכן לחבר מחט 26 גרם.
3. קצירת מח עצם מעכברים
- הרדימו את העכבר באמצעות חנק CO2 . המוות מאושר על ידי היעדר פעימות לב וצביטה ברגליים כדי להבטיח שאין תגובה. פריקת צוואר הרחם יכולה להתבצע כאמצעי משני להמתת חסד מלאה.
- הכנס את העכבר למיכל של 500 מ"ל והוסף מספיק יוד כדי לכסות מחצית מהעכבר. נערו וערבלו בעדינות את המיכל כדי להבטיח כיסוי יסודי. יש לשטוף במים נטולי יונים. בצע שטיפת יוד אחת נוספת, ולאחר מכן שתי שטיפות עם אתנול 70% בצע את אותם השלבים.
- הניחו את העכבר במכסה המנוע והשכיבו אותו על גבו על המגש. לתפוס את הרגליים האחוריות ולמשוך אותם בנפרד עד פופ מורגש; זאת כדי להפריד את הרגליים מעמוד השדרה.
- בצע חתך של 1 ס"מ על עור העכבר ליד אזור המפשעה. הכנס זוג מספריים סגור לתוך החתך ולאחר מכן פתח את המספריים מתחת לעור כדי להפריד אותו מן הצפק.
- לחתוך את העור על הרגל סביב הירך, ולאחר מכן לחתוך את העור במורד הרגל כדי לחשוף את השרירים והעצמות.
- הסר את הרגליים האחוריות על ידי חיתוך סביב מפרק הירך, להיות בטוח לא לחתוך דרך עצם הירך. הניחו את הגפיים בצינור המסומן כ"גפיים" כאשר שתי הרגליים מוסרות, הכניסו את העכבר לשקית פגר והכניסו אותו למקפיא.
הערה: יש להרגיש תחילה את עצם הירך לפני החיתוך כדי להנחות את המספריים ולהימנע מחיתוך עצם הירך, מכיוון שרוב מח העצם מתקבל מעצם הירך. - התחילו לחתוך את השרירים, הרקמה והשומן לאורך אחת הגפיים באמצעות המספריים. חותכים במקביל לעצם. לאחר מכן, השתמש באזמל והסר את השומן או השריר שנותרו, באמצעות תנועת גירוד בניצב כנגד העצם.
- לאחר ניקוי נכון של העצם, יש להפריד בין עצם הירך לעצם השוקה בברך. השתמש באזמל כדי לבצע חתכים בשני הקצוות של עצם הירך והשוקה, היכן שאין מח עצם גלוי.
- הכנס את המזרק והמחט המוכנים לתוך העצם. אם יש התנגדות, חותכים עוד קצת מקצה העצם עד שאין התנגדות נוספת.
- תוך כדי החזקת העצם מעל הצינור המסומן כ"מח עצם", יש לסלק את תמיסת קצירת מח העצם דרך העצם כדי לשטוף את מח העצם לתוך הצינור. חזור על הפעולה בצד השני של העצם כדי לקבל את שאר מח העצם, עד שהעצם נראית כולה לבנה או ריקה.
- חזור על שלבים 7-9 עבור כל העצמות והגפיים הנותרות; כל מח המוח יישטף לתוך אותו צינור חרוט.
- באמצעות מזרק ריק של 10 מ"ל ומחט של 20 גרם, שוברים את גושי מח העצם בצינור על ידי משיכת מח העצם למעלה ולמטה במזרק 5-10 פעמים.
- הוסף מסנן סטרילי של 40 מיקרומטר לצינור צנטריפוגה נקי של 50 מ"ל ושטוף אותו בתמיסת קציר מח עצם במינון 1 מ"ל. לאחר מכן, סנן את מח העצם כדי להסיר את כל הגושים שנותרו. תייגו צינור זה "מח עצם מסונן".
- אחסנו את מח העצם המסונן במקרר או על קרח עד לשימוש. יש להשתמש בו באותו יום של הקציר. אם לא נעשה שימוש באותו יום, יש להקפיא את התאים באמצעות חומר משמר קריו, כגון דימתיל סולפוקסיד (DMSO).
זהירות: יש להשליך כראוי את כל הפסולת מניסויים אלה למיכל פסולת מסוכן ביולוגית. כל החדים צריכים להיכנס למיכל חדים מסומן כראוי לסיכון ביולוגי.
4. ליזה של תאי דם אדומים של מח עצם
- צנטריפוגה את תאי מח העצם ב 170 x גרם במשך 10 דקות בטמפרטורת החדר. שאבו אבק והשליכו את הסופר-נטנט. להשהות מחדש את התאים ב 10 מ"ל של 1x חוצץ ליזה של תאי דם אדומים ולדגור במשך 4 דקות.
- הוסף 30 מ"ל של מלח חוצץ פוספט של Dulbecco (DPBS) כדי לעצור את התגובה של חיץ הליזיס. צנטריפוגה את התאים במשך 8 דקות ב 170 x גרם בטמפרטורת החדר. שאבו אבק והשליכו את הסופר-נטנט. השהה מחדש ב 10-20 מ"ל של חיץ צביעה.
5. ספירת תאים
- שלב 500 μl של תאים עם 9.5 מ"ל של תמיסת קציר מח עצם כדי לקבל דילול 1:20.
הערה: אפשרות זו תשמש לספירת תאים ואין צורך לשמור אותה סטרילית. - מוציאים 200 μL של תאים מהדילול 1:20, מוסיפים אותם ל-200 μL של טריפאן כחול, ומערבבים היטב.
- מוסיפים את התערובת להמוציטומטר וסופרים את התאים החיים והמתים משני הצדדים. חשב את השעיית התא המקורית באמצעות טבלה זו (המוצגת בקובץ משלים 1) ומשוואות:
תאים למיליליטר: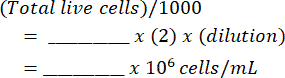
סה"כ תאים: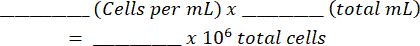
- סובב את התאים ב 170 x גרם במשך 10 דקות ב 4 ° C והשהה מחדש לריכוז של 10 x 10 6 לכל 1 מ"ל (1 x 106 תאים לכל 100 μL), בהתבסס על הצעות היצרן לדילול נוגדנים.
- המשך לציטומטריית זרימה (שלב 8).
6. קצירת דם מעכברים
- הרדימו את העכבר באמצעות גז CO2 או נקע צוואר הרחם.
- בצע שאיבת דם לבבית בזווית של 45° עם מחט 26 G המחוברת למזרק 1 מ"ל המצופה בחומצה אתילאנדיאמין טטראצטית (EDTA) 0.5 M.
- יש לסובב את הדם ולהשהות מחדש במדיה או במאגר הכתמים.
הערה: התאים יסתובבו כלפי מטה ויושהו מחדש לריכוז הסופי בחיץ הצביעה לאחר ליזה של תאי דם אדומים וספירת תאים. - בצע את ליזה תאי הדם האדומים (שלב 4).
- בצע את ספירת התאים (שלב 5).
- המשך לציטומטריית זרימה (שלב 8).
7. עיבוד דגימות דם ומח עצם אנושיות
- בצע את כל ההליכים תחת מכסה מנוע מאושר BSL2 תוך לבישת ציוד מגן אישי.
- אספו את הדגימות בלילה הקודם ובצעו ליזה של תאי דם אדומים. ודא שהדגימות אינן מזוהות ואנונימיות לפני שליחת הדגימות החד-גרעיניות למשך הלילה על קרח.
- עם ההגעה, סובבו את התאים החיים ב 170 x גרם ב 4 °C במשך 10 דקות.
הערה: אלה הן דגימות BSL2 שחייבות לעמוד בהנחיות המקומיות. - השהה מחדש את התאים במדיה או במאגר הצביעה.
הערה: יש לסובב את התאים כלפי מטה ולהשעות אותם מחדש לריכוז הסופי לאחר ספירת התאים עם מאגר צביעה. - בצע את ספירת התאים (שלב 5).
- המשך לציטומטריית זרימה (שלב 8).
8. ציטומטריית זרימה
- צביעה
- חלק את התאים לצינורות המסומנים בנפרד בהתבסס על לוח הצביעה שבו נעשה שימוש, כולל בקרות פיצוי (לא מוכתמות, פקדי איזוטיפ, מוכתמים בודדים ופלואורסצנטיות מינוס [FMOs]). הקפיאו את התאים הנותרים או השתמשו בהם למיון תאים המופעלים על ידי פלואורסצנטיות. ראו טבלה 1 לדוגמה של לוח צביעה עם דילול הנוגדנים בו נעשה שימוש.
הערה: עבור כל פלואורופור נוסף שמתווסף, יש להוסיף FMOs בשילוב עם פלואורופורים נותרים יחד עם כתם יחיד של אותו פלואורופור. ניתן להשתמש בפקדי איזוטיפ כדי לחסום צביעה לא ספציפית. כל נוגדן חדש המשמש צריך להיות titrated עם הדגימות עבור דילול אופטימלי. - מוסיפים נוגדנים בהתאם לדילולים המומלצים על ידי היצרן ומערבבים היטב על ידי הזזת תחתית הצינורות. ריכוזי נוגדנים ניתנים בדרך כלל כ- 1 x 106 תאים לכל 100 μL. דילולים עם נוגדנים ובקרות מוצגים בטבלה 1. נוגדנים מצומדים עם פלואורופורים ויש להגן עליהם מפני אור.
הערה: מומלץ להשתמש ב-EpCAM מצומד לפיקוריתרין (PE) כדי לאפשר הדמיה של אוכלוסיות נמוכות של תאים (טיטרט של 3-5 מיקרוליטר למיליון תאים, כפי שמצוין בטבלה 1). PE-CD49f שימש כבקרת PE כתם יחיד (20 μL לכל מיליון תאים), שכן תאים אלה נפוצים יותר מאשר PE-EpCAM ולכן קל יותר להשתמש בהם לפיצוי. - יש לדגור במשך 30 דקות ב-4°C צלזיוס בחושך.
- לאחר הדגירה, החזירו את הצינורות למכסה המנוע BSL2 והוסיפו 1 מ"ל של חיץ צביעה לכל צינור.
- לאחר מכן, צנטריפוגה את הצינורות ב 170 x גרם ב 4 ° C במשך 5-10 דקות.
- לאחר הצנטריפוגה, הביאו את הצינורות הסגורים עם התאים חזרה למכסה המנוע BSL2 ושאפו החוצה את הסופרנטנט. הקפד לשנות את קצות פיפטת השאיפה בין כל צינור כדי למנוע זיהום צולב.
- השהה מחדש את גלולת התא ב -1 מ"ל של חיץ מכתים והחלק את תחתית הצינורות כדי לערבב.
- שטפו את התאים פעמיים נוספות על ידי חזרה על שלבים 8.1.4-8.1.7.
הערה: אין להשתמש בפיפטות להשעיה מחדש, כדי למנוע אובדן תאים. - יש להשהות מחדש ב-500 מיקרוליטר של חיץ צביעה לצורך ההשעיה הסופית לפני ציטומטריית זרימה. הוסף 4′,6-diamidino-2-phenylindole (DAPI) או מפלה תאים מתים, על פי המלצות היצרן.
- חלק את התאים לצינורות המסומנים בנפרד בהתבסס על לוח הצביעה שבו נעשה שימוש, כולל בקרות פיצוי (לא מוכתמות, פקדי איזוטיפ, מוכתמים בודדים ופלואורסצנטיות מינוס [FMOs]). הקפיאו את התאים הנותרים או השתמשו בהם למיון תאים המופעלים על ידי פלואורסצנטיות. ראו טבלה 1 לדוגמה של לוח צביעה עם דילול הנוגדנים בו נעשה שימוש.
- ציטומטר זרימה
- לאחר הגדרת המכונה, השתמש בפקדים וב- FMOs כדי להגדיר את הפיצוי והשערים. השתמשו בתמיסת המלח המאוזנת של האנק (HBSS) כנוזל נדן כדי לתמוך בתאים השבירים. השתמש ב-PBS אם HBSS אינו זמין.
הערה: ציטומטר הזרימה שבו נעשה שימוש והתוכנה מפורטים בטבלת החומרים. - טען את הדגימות אחת בכל פעם ואסוף נקודות נתונים עבור 50,000, 100,000, 500,000 ומיליון אירועים. יש לשמור את הצינורות על קרח או בקירור עד לשימוש.
הערה: ניתן להגדיר מגבלת זמן בעת האיסוף כדי להבטיח את כדאיות הדגימה. - לאסוף את התאים לתוך 3 מ"ל של RPMI עם 10% FBS בצינורות צנטריפוגות 15 מ"ל.
- אם אתם מבצעים אימונופלואורסנציה בתאי EpCAM+, השתמשו בציטומטר הזרימה כדי למיין 800 עד 1,000 תאים לכל באר של שקופית בת 8 בארות.
- מיין את אוכלוסיית תאי EpCAM לשקופיות נפרדות כבקרה שלילית לשימוש בעת צביעה עבור immunofluorescence.
הערה: ניתן גם למיין את התאים לצינורות של 15 מ"ל המכילים FBS ולסובב אותם על שקופית באמצעות הציטוצנטריפוגה או פיפטה כדי למנוע מהתאים לצוץ. - תקנו את המגלשות בתערובת של 50% מתנול/50% אצטון בטמפרטורה של -20°C למשך 10 דקות. יש לאחסן את המגלשות בטמפרטורה של -20°C עד להכתמה עם immunofluorescence.
- לאחר הגדרת המכונה, השתמש בפקדים וב- FMOs כדי להגדיר את הפיצוי והשערים. השתמשו בתמיסת המלח המאוזנת של האנק (HBSS) כנוזל נדן כדי לתמוך בתאים השבירים. השתמש ב-PBS אם HBSS אינו זמין.
- ניתוח ציטומטריית זרימה
- פתח את התוכנה המורשית לניתוח ציטומטריית זרימה.
- קבצים סטנדרטיים של ציטומטריית זרימת עומס (FCS) שנרכשו מציטומטר הזרימה עם פקדים ודגימות.
- לחץ על צור קבוצה והשתמש במילות מפתח כדי למקם דוגמאות ופקדים בקבוצה.
הערה: השתמש בפקד "ללא כתם" כדי להיכנס לשער בתוכנה לניתוח ציטומטריית זרימה, כפי שמוצג באיור 3. - לחץ פעמיים על הדגימה ללא בקרת כתמים כדי לפתוח גרף כבוי.
- קבעו את ציר y של התרשים ל- SSC-A ואת ציר x ל- FSC-A (אזור פיזור צדדי לפי אזור פיזור קדימה), המציין גודל תא וסיבוכיות פנימית.
- לחץ על צורת המצולע בחלונית השמאלית העליונה וצור שער סביב התאים. הקפידו להוציא את התאים בפריפריה, שכן ככל הנראה מדובר בפסולת. תייגו את השער הזה כ"תאים", כפי שמוצג באיור 3A.
- לאחר גידור התאים, לחץ פעמיים בתוך צורת המצולע כדי לפתוח תרשים נוסף בחלון חדש.
- הגדר את ציר y של הגרף החדש ל- SSC-A ואת ציר ה- x ל- SSC-W להבחנה כפולה. לחץ על צורת המצולע וצור מלבן מסביב לתאים הבודדים. תייגו את זה כ"תאים בודדים", כפי שמוצג באיור 3B.
- לאחר גידור התאים, לחץ פעמיים בתוך צורת המצולע כדי לפתוח תרשים נוסף בחלון חדש.
- הגדר את ציר y ל- FSC-A ואת ציר x ל- DAPI-A (או את מפלה התאים המתים שבהם נעשה שימוש).
- צור שער מצולע מסביב לתאים השליליים של DAPI בצד שמאל של התרשים. תייגו את ה"תאים החיים" האלה, כפי שמוצג באיור 3C.
- לאחר גידור התאים, לחץ פעמיים בתוך צורת המצולע כדי לפתוח תרשים נוסף בחלון חדש.
- הגדר את ציר y ל- SSC-A ואת ציר x ל- EpCAM-PE (או כל פלואורופור המשמש לזיהוי תאי EpCAM). התאים בצד שמאל הם שליליים של EpCAM. אם תאים כלשהם מוצגים מימין, הם חיוביים ל- EpCAM.
- השתמש בגרף EpCAM-PE ליצירת שער מצולע, שאינו כולל את התאים משמאל וכולל רק את השטח הריק מימין. תייג את האזור הריק מימין בתוך המצולע "EpCAM", כפי שמוצג באיור 3D.
הערה: זהו ללא בקרת כתמים, ולכן לא אמור להיות ביטוי EpCAM. השתמש בבקרת ללא כתמים כדי לקבוע אילו תאים חיוביים ל- EpCAM. פעולה זו משלימה את אסטרטגיית הפיצוי, כך שכל הגרפים עשויים להיסגר בשלב זה. - בדף סביבת העבודה, סמן את השושלת ללא כתמים באמצעות "תאים", "תאים בודדים", "תאים חיים" ו- "EpCAM". לחץ באמצעות לחצן העכבר הימני ובחר העתק ניתוח לקבוצה. פעולה זו מעתיקה את אסטרטגיית gating לכל הדגימות הטעונות האחרות בקבוצה הקודמת שנוצרה. אם קבוצה לא נוצרה בתחילה, ניתן ליצור אותה כעת על-ידי בחירה באפשרות צור קבוצה בפינה הימנית העליונה.
- עברו על הדגימות בתוך הקבוצה ובדקו את שערי המצולע שצוירו קודם לכן כדי לוודא שהם מתאימים לכל הדגימות והפקדים. פעולה זו מספקת את אחוז המספר ומספר התאים.
- לחץ על כפתור עורך הפריסה L בפינה השמאלית העליונה מעל "סביבת עבודה". לאחר מכן ניתן לסדר ולייצא גרפים אלה באמצעות עורך הפריסה.
- הכנת ריאגנטים immunofluorescence
- הכינו את דילול הנוגדנים על ידי שילוב של 1 גרם אלבומין בסרום בקר (BSA), 2 גרם חלב דל שומן, 10 מ"ל של מלח חוצץ 10x tris-buffered (TBS), 100 μL של טווין, ו 90 מ"ל של מים מזוקקים.
- הכינו TBST על ידי שילוב של 50 מ"ל של 20x TBS, 950 מ"ל של מים מזוקקים ו-200 μL של טווין.
- הכינו 10% סרום סוסים רגיל (NHS) על ידי שילוב של 1 מ"ל של NHS עם 9 מ"ל של דילול נוגדנים (שלב 8.4.1).
- הכן 1% NHS על ידי שילוב של 1 מ"ל של 10% NHS עם 9 מ"ל של TBST.
- צביעה אימונופלואורסצנטית
- הסר את המגלשות מ -20 ° C ולאפשר להם להתחמם לטמפרטורת החדר.
- שטפו את המגלשות שלוש פעמים במים מזוקקים במשך 5 דקות כל אחת.
- חסום את המגלשות למשך שעה אחת בטמפרטורת החדר ב- 10% NHS בדילול נוגדנים (שלב 8.4.3).
- לדלל את הנוגדן הראשוני (pan-cytokeratin) ל 1:750 ב 1% NHS ב TBST (שלב 8.4.4). לדגור שקופיות בנוגדן הראשוני המדולל לילה ב 4 מעלות צלזיוס.
- למחרת, שטפו את המגלשות שלוש פעמים עם חיץ כביסה 1x (PBS או TBST) למשך 5 דקות כל אחת.
- לדלל את הנוגדן המשני ל 1:1,000 ב 1% NHS ב TBST (שלב 8.4.4). לדגור על המגלשות בנוגדן המשני המדולל במשך שעה אחת בטמפרטורת החדר.
- שטפו את המגלשות שלוש פעמים עם חיץ כביסה אחד למשך 5 דקות כל אחת. הרכיבו וכסו את השקופיות במדיית הרכבה קשיחה באמצעות DAPI. השתמשו במקלון צמר גפן כדי לגלגל בעדינות את כל הבועות מתחת לכיסוי.
תוצאות
באמצעות שיטות אלה הודגמו אוכלוסיות נדירות של תאי אפיתל בדם ובמח העצם של בני אדם ועכברים רגילים. עם הפיצויים והבקרות המתאימים כפי שתואר, התוצאות באופן עקבי שהראו 4%-5% מהתאים במח העצם של מורין היו EpCAM+, ללא קשר למספר התאים שנספרו, כפי שמוצג באיור 4 ובאיור 5. בדגימות דם מורין, פחות מ-0.5% מהתאים היו מסוג EpCAM+, כפי שמוצג באיור 6. בדגימות מח עצם אנושיות, 2%-5% מהתאים היו EpCAM+, כפי שמוצג באיור 7 ובאיור 8. בעוד 2%-5% הוא טווח גדול, האחוזים בתוך כל תורם בודד היו עקביים ככל שיותר תאים נספרו. בדגימות דם אנושיות, כ-0.3% מהתאים היו EpCAM+, כפי שמוצג באיור 9. דגימות הבקרה שלנו (ללא כתמים, בקרת איזוטיפ ו-FMOs) הניבו מעט מאוד תוצאות חיוביות כוזבות של EpCAM+, כפי שניתן לראות באיור 4 ובאיור 7. תאים מקבוצות EpCAM+ ו-EpCAM שמוינו לשקופיות הראו צביעה חיובית עבור pan-cytokeratin בדגימות EpCAM+, והיו שליליים עבור pan-cytokeratin בדגימות EpCAM, כפי שמוצג באיור 10. תוצאות אלה מצביעות על כך שהניסויים תוכננו כראוי וניתנים לשחזור.
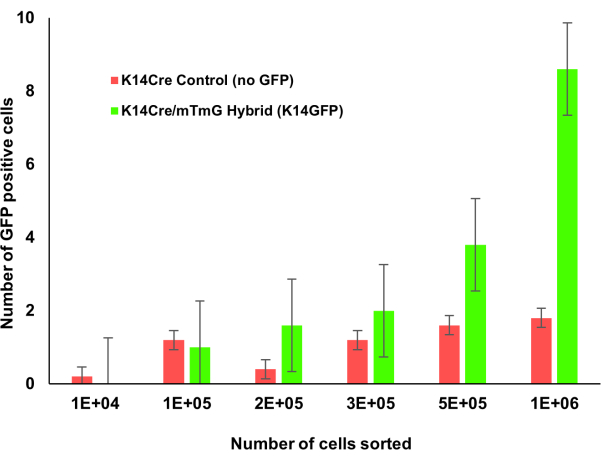
איור 1: Krt14Cre;mTmG עכברים טרנסגניים עם ספירה מצטברת של מח עצם. מח העצם של עכברי Krt1-14;mTmG נספרו בהדרגה. תאים חיוביים ל-GFP מצביעים על ביטוי קרטין 14 וזוהו באמצעות ציטומטריית זרימה. ככל שנספרו יותר תאי מח עצם, אוכלוסיית תאי קרטין 14 חיובית זו הייתה קלה יותר לזיהוי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: זרימת עבודה עבור תאי EpCAM+ וציטוקרטין+. מח העצם ותאי הדם מוינו תחילה באמצעות מיון תאים מופעל פלואורסצנטי (FACS) כדי להפריד בין תאי EpCAM+ ו- EpCAM. תאים אלה מוינו לשתי מבחנות שונות, וכן לשתי שקופיות שונות. התאים שמוינו למבחנות סובבו על שקופיות באמצעות ציטוצנטריפוגה. לאחר מכן הוכתמו השקופיות באמצעות נוגדן ראשוני מסוג pan-cytokeratin, ולאחר מכן הוכתמו בנוגדן משני. השקופיות נותחו באמצעות מיקרוסקופ פלואורסצנטי כדי לצפות בביטוי פאן-ציטוקרטין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
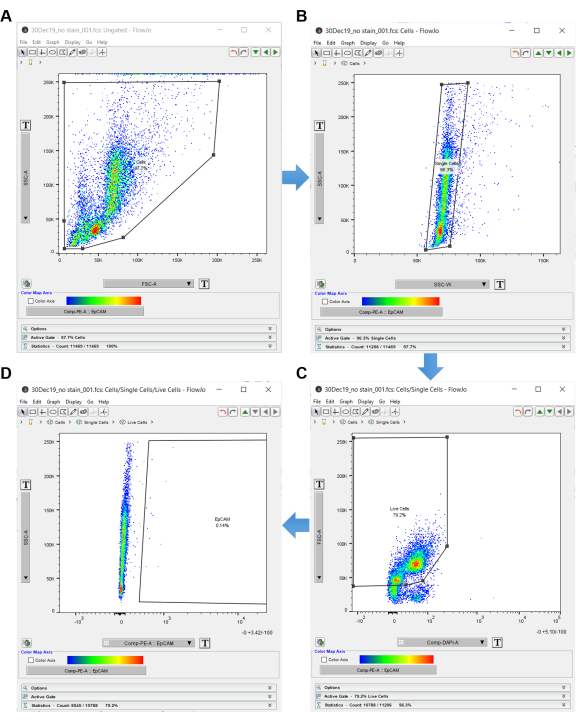
איור 3: תוכנה לניתוח ציטומטריה של זרימה. בעת ניתוח נתוני ציטומטריית זרימה באמצעות תוכנת ניתוח, בקרת ללא כתמים משמשת לבחירת התאים המעניינים. תאים נבחרים תחילה באמצעות SSC-A ו- FSC-A, המציגים את המורכבות הפנימית והגודל של התאים. (A) שער מצולע משורטט סביב התאים. (B) תאים בודדים נרכשים על ידי gating SSC-A על ידי SSC-W. (C) תאים חיים נרכשים על-ידי gating FSC-A לעומת DAPI. (D) תאים שליליים של EpCAM אינם נכללים על-ידי מעבר מימין לתאים השליליים של EpCAM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
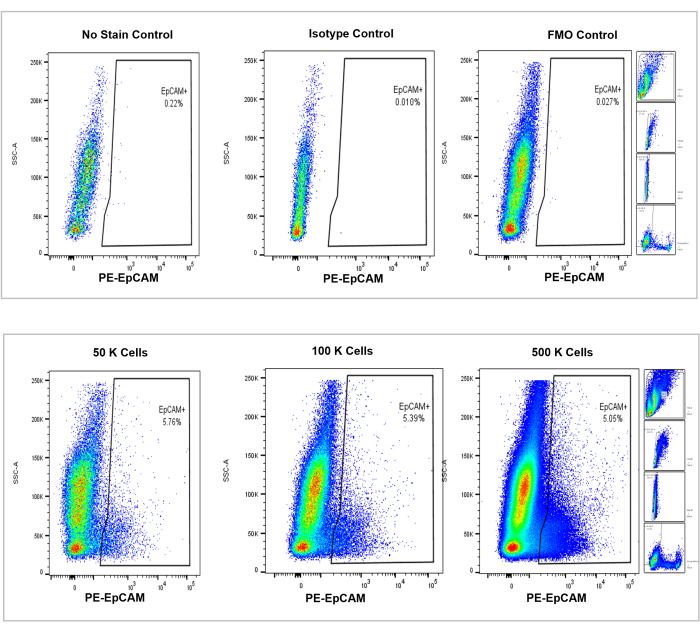
איור 4: ניתוח ציטומטרי של זרימה של תאי EpCAM+ במוח עצם של עכבר. בקרות ללא כתם, איזוטיפ ו-FMOs מוצגות בחלונית העליונה, כאשר הספירות המצטברות של 50,000, 100,000 ו-500,000 תאים מוצגות בחלונית התחתונה. תרשימים אלה ממחישים את העקביות באחוזים בין ספירות, למרות הגידול הכולל בסך התאים שנספרו. הלוחות מימין מציינים את אסטרטגיית ה-gating, כפי שנידונה קודם לכן בסעיף ניתוח ציטומטריית זרימה וכפי שמוצג באיור 3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
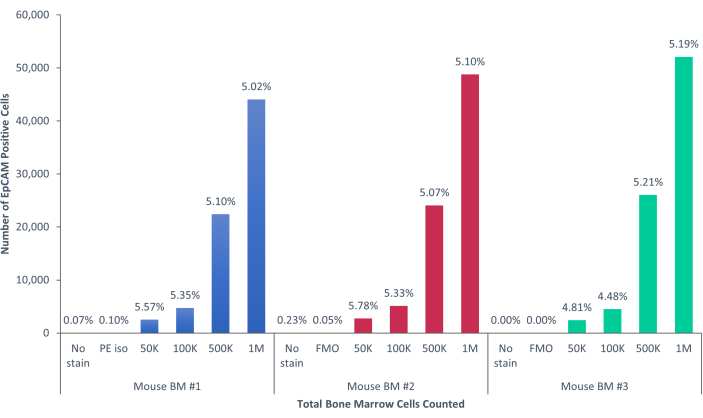
איור 5: תאי EpCAM+ במח עצם של עכבר מהווים 5.17% ±-0.001% מהאוכלוסייה. תאי מח העצם של שלושה עכברים בודדים נותחו. הבקרות המתאימות נכללו לצורך קפדנות מדעית נאותה. אחוז התאים החיוביים נשאר עקבי בין הדגימות, בשל היותם של העכברים זהים גנטית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
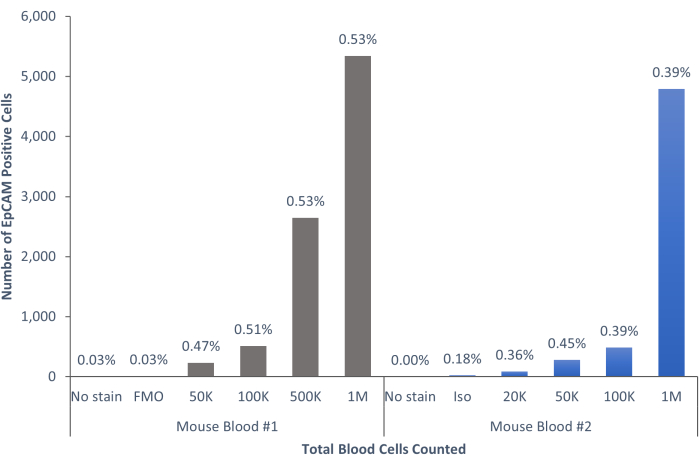
איור 6: תאי EpCAM+ בדם עכברים מהווים 0.45% ±-0.0006% מהאוכלוסייה. תאי הדם של שני עכברים בודדים נותחו. הבקרות נכללו כדי להראות שההליך הנכון בוצע כדי להפיק תוצאות חד משמעיות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
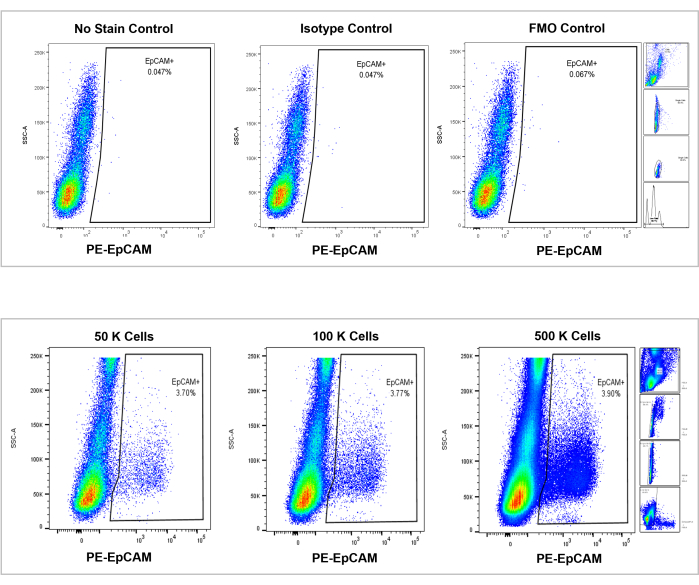
איור 7: ניתוח ציטומטרי של זרימה על מח עצם אנושי EpCAM+. פקדים ללא כתם, איזוטיפ ו- FMOs מוצגים בלוח העליון, והספירות המצטברות של 50,000, 100,000 ו- 500,000 תאים מוצגות בחלונית התחתונה. תרשימים אלה ממחישים את העקביות באחוזים בין ספירות, למרות הגידול הכולל של סך התאים שנספרו. הלוחות מימין מציינים את אסטרטגיית ה-gating, כפי שנידונה קודם לכן בסעיף ניתוח ציטומטריית זרימה וכפי שמוצג באיור 3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 8: תאי EpCAM+ במח עצם אנושי מהווים 3.53% ±-0.006% מהאוכלוסייה. שלוש דגימות שונות של מח עצם אנושי נותחו. נכללו בקרות מתאימות לקפדנות מדעית. אחוז התאים החיוביים משתנה עקב הטרוגניות גנטית בקרב בני אדם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
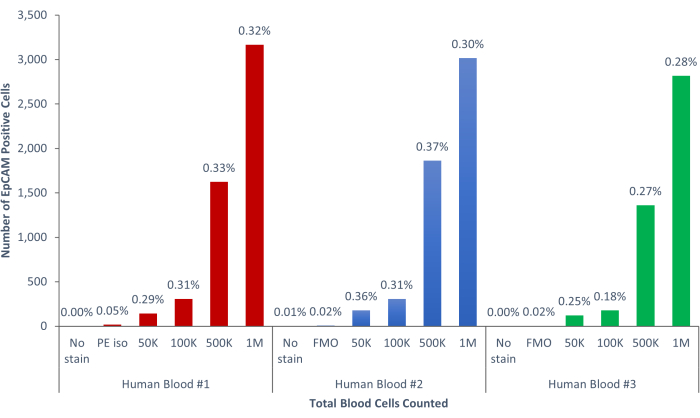
איור 9: תאי EpCAM+ של דם אנושי מהווים 0.18% ±-0.0004% מהאוכלוסייה. שלוש דגימות דם אנושיות שונות נותחו. נכללו בקרות מתאימות לקפדנות מדעית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
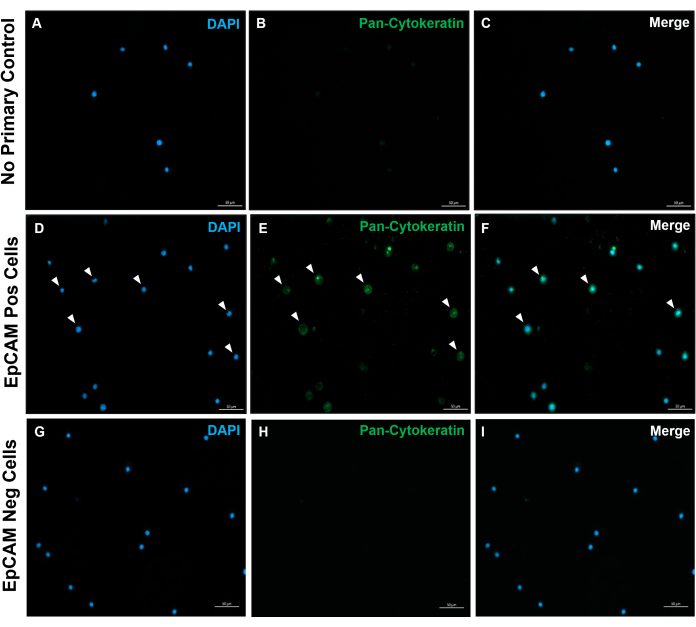
איור 10: אימונופלואורסנציה של שקופיות EpCAM+ ו-EpCAM. FACS שימש להפרדת תאי EpCAM+ ו- EpCAM. Pan-cytokeratin הוכתם על שימוש בנוגדן DAKO pan-cytokeratin. לא נעשה שימוש בבקרת נוגדנים ראשונית בסרום רגיל, שכן הפאן-ציטוקרטין הוא נוגדן רב-שבטי. תוצאות אלה מאשרות את הדיוק של FACS. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| מח עצם אנושי או דם | |||
| נוגדן | צינור # | # של תאים | א.ב. קונק |
| לא מוכתם | 1 | 1x106 | X |
| DAPI בלבד | 2 | 1x106 | 1uL/מ"ל |
| בקרת איזוטיפ PE | 3 | 1x106 | 1 uL |
| בקרת כתמים יחידה CD49f-PE | 4 | 1x106 | 20 uL ב-100uL לכל 1x106 |
| EpCAM-PE טיטרציה נמוכה | 5 | 1x106 | 3 uL ב-100uL לכל 1x106 |
| EpCAM-PE טיטרציה בינונית | 6 | 1x106 | 4 uL ב-100uL לכל 1x106 |
| EpCAM-PE טיטרציה גבוהה | 7 | 1x106 | 5 uL ב-100uL לכל 1x106 |
| מיון גבוה של EpCAM-PE בשקופיות | 8 | 10x106 | 50 uL ב 1 מ"ל |
טבלה 1: לוח צביעת ציטומטריה זרימה. דוגמה ללוח צביעת ציטומטריה של זרימה עבור תאים חד-גרעיניים של דם או מח עצם. הבקרות הכלולות הן DAPI בלבד, בקרה לא מוכתמת ובקרת כתמים יחידה PE (PE-CD49f שימש כבקרה חיובית טובה יותר). פלואורסצנטיות פחות אחת אינה כלולה בלוח זה מכיוון שהיא רק צבע יחיד (PE). בעת הוספת צבעים פלואורופוריים נוספים, כגון פלואורסצאין איזותיוציאנט (FITC) או אלופיקוציאנין (APC), יש לכלול FMOs על ידי אי הכללת פלואורופור אחד עבור כל בקרת FMO.
קובץ משלים 1: ספירת תאים חיים באמצעות המטוציטומטר. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
ישנן עדויות בספרות לנוכחות תאי אפיתל במוח העצם. בעבר, מאמרים חקרו בדרך כלל את תפקידם של תאי אפיתל בהקשר של מחלות ופציעות, כגון בכבד, ריאות, מערכת העיכול (GI), בלוטת התימוס ועור14,15,16,17. עם זאת, לא הרבה ידוע על נוכחותם של תאי אפיתל אלה במוח העצם של אנשים בריאים. מאמר זה מבקש לבסס שיטה הניתנת לשחזור, במטרה לזהות ולבודד תאי אפיתל מדם וממח עצם תקינים. שיטה זו תניע את התחום קדימה כדי לזהות מדוע תאי אפיתל נמצאים ומה תפקידם בדם ובמח העצם בהיעדר מחלה; אולי תאים אלה הם חלק מתחזוקה נורמלית של רקמות או מופעלים בעתות פציעה. מח העצם הוא מאגר של תאי גזע; עם זאת, לא ברור מה השושלת של תאי אפיתל אלה עשוי להיות. מאמר שפורסם לאחרונה דן בתאי אפיתל שמקורם במח עצם בבלוטת התימוס, המבטא תחילה את EpCAM ואת הסמן ההמטופויטי CD45, ולאחר מכן מאבד את ביטוי CD45 שלו עם הזמן לאחר פציעה15. מחקר מהמעבדה שלנו אישר גם את נוכחותם של תאי CD45+ EpCAM+ בתוך דם בריא ומח עצם בהיעדר פציעה12. עם זאת, תפקידם של תאים אלה טרם נקבע.
היה צורך בשיטה ניתנת לשחזור לבדיקת תאי אפיתל בתוך מח העצם הבריא. השיטה המתוארת תסייע באפיון תאים אלה עוד יותר במצבם הרגיל. ישנם שלבים חשובים בשיטה זו כדי לשמור על יכולת השחזור. אחד השלבים הקריטיים ביותר בפרוטוקול זה הוא שמירה על סביבה סטרילית במכסה המנוע בזמן קצירת מח העצם מעכברים. אם קוצרים מעכברים מרובים, נמנע זיהום צולב בין דגימות על ידי שימוש במחטים ומזרקים חדשים לכל עכבר. זה גם מבטיח שהדגימה נקייה וללא מזהמים שעלולים להשפיע על התוצאות. בנוסף, יש להגדיל את מספר המזרקים המוכנים וצינורות חרוטיים מסומנים עבור כל עכבר נוסף. צעד חשוב נוסף כרוך בשטיפת העצמות עד לקבלת צבע לבן נקי כדי להבטיח שרוב תאי מח העצם הוסרו; הסיכוי לגילוי תאים נדירים עולה בדגימה טהורה יותר. בוצע שינוי כדי לייעל את פרוטוקול הליזה של תאי הדם האדומים; מספר חוצצי ליזה נבדקו כדי למצוא את החוצץ הנכון שנתן כדאיות גבוהה באופן עקבי, מכיוון שכמעט מחצית התאים אבדו במהלך שלב זה. ייתכן שיהיה צורך למטב ריאגנטים שונים ותקופות דגירה שונות לקבלת תוצאות משופרות בסביבות אחרות.
המגבלה המשמעותית ביותר של פרוטוקול זה היא שימוש בציטומטריית זרימה למציאת אוכלוסיות תאים נדירות. כפי שנדון קודם לכן, תוספת של פקדים וספירות מצטברות מסייעת להגדיל את הספציפיות והדיוק של הניתוח. מגבלה נוספת היא שיש לזהות מראש סמנים מתאימים לאוכלוסייה המעוניינת בהם. לכן, יש לדעת על סמנים מרכזיים, נוגדנים עבור cytometry זרימה, ונוגדנים תואמים למין היעד.
שיטות אלה מהוות שיפור לעומת השיטות הקיימות מכיוון שהן מאפשרות ניתוח תא בודד בשבריר מהעלות של מבודד CTC אוטומטי קיים וריצוף RNA של תא בודד. בנוסף, ציטומטריית זרימה זמינה יותר. FACS שמר על כדאיות גבוהה יותר עבור התאים בהשוואה לתוצאות שדווחו בעבר באמצעות הפרדת מיקרו-כדוריות מגנטיות. לבסוף, טכניקות אלה מאפשרות הפרדת תאים לצורך ניתוחים במורד הזרם, כגון ריצוף RNA בתפזורת, ריצוף scRNA או תרבית תאים.
Disclosures
לא ידוע על ניגודי עניינים.
Acknowledgements
ג'וש מונטס, טכנאי ציטומטר זרימה במתקן הליבה, מכון הורמל
טוד שוסטר, מנהל מתקני ליבה, מכון הורמל
דרק גורדון, סטטיסטיקאי, אוניברסיטת ראטגרס
ברצוננו להודות לקארן קליין מ-Clarus Editorial Services, Santa Fe, NM על עזרתה בעריכה.
עבודה זו נתמכה בחלקה על ידי המכון הלאומי לדלקת פרקים ומחלות שרירים ושלד ועור של המכונים הלאומיים לבריאות תחת פרס מספר R21 AR075281, ומענק סיוע למחקר, אמנות ומלגה, משרד סגן הנשיא למחקר, אוניברסיטת מינסוטה (הצעה #324240). אנו מודים על תמיכת מכון הורמל.
Materials
| Name | Company | Catalog Number | Comments |
| 40 μm Cell Strainer | Falcon | 352340 | Used to filter out any large clumps of cells from bone marrow |
| 5 mL Polystyrene Round-bottom tube | Falcon | 352054 | Tubes used for flow cytometry |
| 500 mL jar with lid | Nalgene | 11-823-32 | Used to wash the mouse |
| 190 proof Ethanol | Decon laboratories Inc | 2801 | Diluted to 70% with dH2O |
| Alexa Fluor 488 Goat anti-rabbit IgG (H+L) | Invitrogen | A11008 | Dilution: 1:1000 |
| Brightline Hemacytometer | Hausser Scientific | 02-671-10 | Used to count alive cells |
| Bovine Serum Albumin | Jackson ImmunoResearch | 001-000-162 | Component of antibody diluent |
| Characterized Fetal Bovine Serum (FBS) | Hyclone | SH30071.03 | Component of staining buffer and harvesting solution |
| Curity gauze sponges | Covidien | 2187 | Used to keep a clean work area when harvesting limbs and bone marrow |
| Curved Forceps | Miltex | 18-784 | Used during harvest |
| Cytokeratin, Wide Spectrum Screening | Dako | Z0622 | Dilution 1:750 *Now discontinued |
| Dulbecco's Phosphate Buffered Saline (DPBS 1x) | Gibco | 14190-144 500mL | Used to stop the red blood cell lysis reaction |
| Ethylenediaminetetraacetic acid | Sigma Aldrich | E9884-100G | Used at 0.5 M |
| Gentamicin sulfate | Lonza | 17-518Z | Component of harvesting solution |
| Hank's Balanced Salt Solution (HBSS 1x) | Gibco | 14175-095 500mL | Component of harvesting solution and staining buffer solution |
| Luer-Lok tip 10 mL syringe | Becton, Dickinson and Co | 309604 | Used with 26G needle to flush bones, used with 20G needle to break up clumps |
| Magic touch 2 ice bucket | BelArt | M16807-2001 | Used to store the specimens on ice |
| Nonfat dry milk | Apex | 20-241 | Component of Antibody Diluent |
| Normal horse serum | Vector | ZE0122 | Component of Antibody Diluent |
| PE anti-human CD 326 (EpCAM) | Biolegend | 324206 | Dilution: 5 µl in 100 µl per 1x106 cells |
| PE anti-mouse CD 326 (EpCAM) | Biolegend | 118205 | Dilution: 3 µl in 100 µl per 1x106 cells |
| PE mouse IgG2b, κ isotype control | Biolegend | 400313 | Dilution: 1 µl in 100 µl per 1x106 cells |
| PE rat anti-human CD49f | BD Biosciences | 555763 | Dilution: 20 µl in 100 µl per 1x106 cells |
| PE rat IgG2am, κ Isotype control | Biolegend | 400508 | Dilution: 1 µl in 100 µl per 1x106 cells |
| Polypropylene Conical Centrifuge Tubes 50 mL | Basix | 14-955-240 | Used in the centrifuge |
| Povidone-Iodine Scrub | Aplicare | 82-227 | Antiseptic used to sterilize the mice |
| PrecisionGlide Needle 20G x 1 1/2 | Becton, Dickinson and Co | 305176 | 20G needle used to break up bone marrow clumps |
| PrecisionGlide Needle 26G x 1/2 | Becton, Dickinson and Co | 305111 | 26G needle used to flush bone marrow from bones |
| PTFE Printed Slides | Electron Microscopy Services | 63422-06 | 8 well slides cells sorted onto for immunofluorescence |
| RBC Lysis buffer 10X | Invitrogen | 00-4300-54 | Dilution 1:10 using sterile deionized water |
| Scissors | Roboz | RS-6762 | Used during harvest |
| Stainless steel surgical blade #4 | Bard-Parker | 371222 | Used during harvest |
| Sterile tray | Polar ware | 10F | Used during harvest |
| StretchEase Powder-free nitrile examination gloves | Denville Scientific | G4161 | Used during harvest |
| Surgical Scalpel handle #4 | Fischer | 12-000-164 | Used with surgical blade |
| TBS 20x | Thermo | Component of TBST, used at 1X | |
| Trypan Blue Stain (0.4%) | Gibco | 15250-061 | Used to count dead cells. Filtered with .45 µm |
| Tween 20 | Sigma Aldrich | P1379-500mL | Component of TBST |
| Tweezers | Miltex | 6-8 | Used during harvest |
| Vectashield Vibrance Antifade Mounting Medium with DAPI | Vector | H-1800 | Nuclear stain for immunofluorescence |
References
- Larsen, S. B., Cowley, C. J., Fuchs, E. Epithelial cells: liaisons of immunity. Current Opinion in Immunology. 62, 45-53 (2020).
- Blanpain, C., Fuchs, E. Plasticity of epithelial stem cells in tissue regeneration. Science. 344 (6189), 1242281 (2014).
- Coradini, D., Casarsa, C., Oriana, S. Epithelial cell polarity and tumorigenesis: New perspectives for cancer detection and treatment. Acta Pharmacologica Sinica. 32 (5), 552-564 (2011).
- Dmello, C., et al. Multifaceted role of keratins in epithelial cell differentiation and transformation. Journal of Biosciences. 44 (2), 33 (2019).
- Poulet, G., Massias, J., Taly, V. Liquid biopsy: General concepts. Acta Cytologica. 63 (6), 449-455 (2019).
- Eslami-S, Z., Cortés-Hernández, L. E., Alix-Panabières, C. Epithelial cell adhesion molecule: an anchor to isolate clinically relevant circulating tumor cells. Cells. 9 (8), 1836 (2020).
- Morris, R. J. Circulating tumor cells: quintessential precision oncology presenting challenges for biology. NPJ Precision Oncology. 1 (1), 16 (2017).
- Lin, D., et al. Circulating tumor cells: biology and clinical significance. Signal Transduction and Targeted Therapy. 6 (1), 404 (2021).
- Spence, M., Adai, S., Landon, T., Richter, G. Few and far between: Tools and strategies for rare-event detection using flow cytometry. BioprobesJournal of Cell Biology. 71, 14-18 (2015).
- Yu, M., Stott, S., Toner, M., Maheswaran, S., Haber, D. A. Circulating tumor cells: approaches to isolation and characterization. Journal of Cell Biology. 192 (3), 373-382 (2011).
- Ye, Q., Ling, S., Zheng, S., Xu, X. Liquid biopsy in hepatocellular carcinoma: circulating tumor cells and circulating tumor DNA. Molecular Cancer. 18 (1), 114 (2019).
- Park, H., et al. marrow-derived epithelial cells and hair follicle stem cells contribute to development of chronic cutaneous neoplasms. Nature Communications. 9 (1), 5293 (2018).
- Marsman, W. A., et al. Epithelial cells in bone marrow: do they matter. Gut. 54 (12), 1821-1822 (2005).
- Borue, X., et al. marrow-derived cells contribute to epithelial engraftment during wound healing. The American Journal of Pathology. 165 (5), 1767-1772 (2004).
- Chakrabarti, S., et al. marrow-derived cells contribute to the maintenance of thymic stroma including TECs. Journal of Immunology Research. 2022, 6061746 (2022).
- Krause, D. S., et al. Multi-organ, multi-lineage engraftment by a single bone marrow-derived stem cell. Cell. 105 (3), 369-377 (2001).
- Wong, A. P., et al. Targeted cell replacement with bone marrow cells for airway epithelial regeneration. American Journal of Physiology-Lung Cellular and Molecular Physiology. 293 (3), L740-L752 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved