Method Article
المقايسات المستقلة عن الأكسجين لقياس وظيفة الميتوكوندريا في الثدييات
In This Article
Summary
هنا ، نقدم مجموعة من المقايسات لقياس وظيفة الميتوكوندريا مباشرة في خلايا الثدييات بشكل مستقل عن قدرتها على استهلاك الأكسجين الجزيئي.
Abstract
يدعم تدفق الإلكترونات في سلسلة نقل إلكترون الميتوكوندريا (ETC) وظائف التخليق الحيوي والطاقة الحيوية والإشارات متعددة الأوجه في خلايا الثدييات. نظرا لأن الأكسجين (O 2) هو مستقبل الإلكترون الطرفي الأكثر انتشارا ل ETC في الثدييات ، فإن معدل استهلاك O2 يستخدم بشكل متكرر كبديل لوظيفة الميتوكوندريا. ومع ذلك ، توضح الأبحاث الناشئة أن هذه المعلمة لا تشير دائما إلى وظيفة الميتوكوندريا ، حيث يمكن استخدام الفومارات كمستقبل بديل للإلكترون للحفاظ على وظائف الميتوكوندريا في نقص الأكسجة. تجمع هذه المقالة سلسلة من البروتوكولات التي تسمح للباحثين بقياس وظيفة الميتوكوندريا بشكل مستقل عن معدل استهلاك O2. هذه المقايسات مفيدة بشكل خاص عند دراسة وظيفة الميتوكوندريا في بيئات نقص الأكسجين. على وجه التحديد ، نصف طرق قياس إنتاج ATP الميتوكوندريا ، والتخليق الحيوي دي نوفو بيريميدين ، وأكسدة NADH بواسطة المركب I ، وإنتاج الأكسيد الفائق. بالاقتران مع تجارب قياس التنفس الكلاسيكية ، ستوفر هذه المقايسات المتعامدة والاقتصادية للباحثين تقييما أكثر شمولا لوظيفة الميتوكوندريا في نظام اهتمامهم.
Introduction
وظيفة الميتوكوندريا هي مقياس حاسم للصحة الخلوية ، لأنها تحافظ على وظائف التخليق الحيوي والطاقة الحيوية والإشارات الرئيسية في خلايا الثدييات1. تتطلب الغالبية العظمى من وظائف الميتوكوندريا تدفق الإلكترون عبر سلسلة نقل الإلكترون (ETC) ، وتسبب الاضطرابات في تدفق الإلكترون في ETC مرض الميتوكوندريا الحاد2. يتكون ETC من سلسلة من تفاعلات الاختزال والأكسدة (الأكسدة والاختزال) المضمنة في غشاء الميتوكوندريا الداخلي ، وتطلق تفاعلات نقل الإلكترون هذه طاقة حرة يمكن تسخيرها لدعم تخليق ATP ، والعمليات الفسيولوجية مثل توليد الحرارة ، ومسارات التخليق الحيوي مثل التخليق الحيوي de novo pyrimidine ، وتوازن حالة الأكسدة والاختزال للعوامل المساعدة مثل NADH. ينتج مجمع ETC الأول والثالث أنواع الأكسجين التفاعلية (ROS) 3،4،5 ، والتي بدورها تنظم مسارات الإشارات الرئيسية مثل HIF و PI3K و NRF2 و NFκB و MAPK6. وبالتالي ، يتم استخدام مقاييس تدفق الإلكترون في ETC بشكل كلاسيكي كبديل لوظيفة الميتوكوندريا في خلايا الثدييات.
كثيرا ما تستخدم تجارب قياس التنفس لقياس وظيفة الميتوكوندريا في خلايا الثدييات. نظرا لأن O2 هو مستقبل الإلكترون الطرفي الأكثر انتشارا ل ETC في الثدييات ، يتم استخدام اختزاله كوكيل لوظيفة الميتوكوندريا. ومع ذلك ، تظهر الأدلة الناشئة أن الميتوكوندريا في الثدييات يمكن أن تستخدم الفومارات كمستقبل للإلكترون للحفاظ على وظائف الميتوكوندريا التي تعتمد على ETC ، بما في ذلك التخليق الحيوي دي نوفو بيريميدين 7 ، أكسدة NADH7 ، وإزالة السموم من كبريتيد الهيدروجين8. وبالتالي ، في سياقات معينة ، خاصة في بيئات نقص الأكسجين ، لا توفر قياسات معدل استهلاك O2 (OCR) مؤشرا دقيقا أو دقيقا لوظيفة الميتوكوندريا.
هنا ، نوضح سلسلة من المقايسات التي يمكن استخدامها لقياس وظيفة الميتوكوندريا بشكل مستقل عن التعرف الضوئي على الحروف. نحن نقدم مقايسات لقياس أكسدة NADH المعقدة بوساطة I مباشرة ، والتخليق الحيوي لثنائي هيدرو هيدروجيناز دي نوفو بيريميدين ، وتوليف ATP المعقد المعتمد على V ، والاتجاه الصافي لمركب نازعة هيدروجين السكسينات (SDH) ، وأنواع الأكسجين التفاعلية المشتقة من الميتوكوندريا. من المفترض أن يتم إجراء هذه المقايسات على خلايا الثدييات المستزرعة ، على الرغم من أنه يمكن تكييف العديد منها لدراسة وظائف الميتوكوندريا في الجسم الحي. والجدير بالذكر أن المقايسات الموصوفة في هذا البروتوكول هي قياسات مباشرة لوظائف الميتوكوندريا أكثر من التعرف الضوئي على الحروف. علاوة على ذلك ، فإنها تمكن من قياس وظيفة الميتوكوندريا في نقص الأكسجة ، وهو سياق لا يكون فيه التعرف الضوئي على الحروف قياسا إرشاديا. مجتمعة ، ستوفر هذه المقايسات ، جنبا إلى جنب مع تجارب قياس التنفس الكلاسيكية ، للباحثين تقييما أكثر شمولا لوظيفة الميتوكوندريا في خلايا الثدييات.
Protocol
1. مقايسات الانتشار لقياس نشاط المركب I ، ديهيدرو أوروتياز ديهيدروجيناز (DHODH) ، وأنشطة V المعقدة
- خلايا البذر لمقايسات الانتشار
ملاحظة: يستخدم هذا البروتوكول خط خلايا الساركوما العظمية البشرية 143B الذي تم شراؤه تجاريا من ATCC. تم استخدام خط الخلايا هذا بموجب المبادئ التوجيهية لبروتوكول اللجنة المؤسسية للسلامة الأحيائية (IBC) المعتمد.- إزالة لوحات من حاضنة زراعة الأنسجة. نضح الوسط من الألواح ، واغسله بمحلول ملحي مخزن بالفوسفات 1x (PBS) لإزالة أي وسط متبقي. نضح برنامج تلفزيوني ، وقم بتغطية الطبق ب 0.05٪ -0.25٪ تربسين لرفع الخلايا من أسفل اللوحة.
- انتظر 3-5 دقائق حتى يطلق التربسين الخلايا من اللوحة ، ثم قم بإخماد التربسين ب 10 مل من وسط النمو المطلوب الذي يحتوي على 10٪ مصل بقري جنيني (FBS).
- اجمع الخلايا في أنبوب مخروطي ، وأجهزة طرد مركزي عند 1000 × جم لمدة 5 دقائق لحبيبات الخلايا.
- نضح الوسط من الأنبوب دون إزعاج الحبيبات. أعد تعليق الحبيبات بوسط كامل.
- عد الخلايا ، وحدد الحجم اللازم لزرع ما بين 10000 و 25000 خلية في لوحة من 6 آبار.
ملاحظة: يجب تحسين كل خط خلية لعدد الخلايا المراد زرعها. الالتقاء المثالي الذي تم تحقيقه هو ~ 10٪ في بداية التجربة و ~ 80٪ في نهاية التجربة. - ماصة الخلايا في لوحة 6 آبار ، وإضافة 2 مل من الوسط الكامل إلى الآبار. اتركيه لمدة 24 ساعة قبل التغيير إلى ظروف الوسط التجريبي.
ملاحظة: قم بزرع ما لا يقل عن ثلاثة مكررات لكل حالة وآبار كافية لاختبار حالة التحكم غير المعالجة ، وحالة التحكم المعالجة بالمثبطات ، والحالة التجريبية غير المعالجة ، والحالة التجريبية المعالجة بالمثبطات.
- تغيير متوسط لتقييم النشاط الخامس المعقد عن طريق الانتشار
ملاحظة: تعتمد الخلايا التي تتكاثر في وسط يحتوي على الجالاكتوز على نشاط V المعقد لتخليق ATP 9,10. على عكس الجلوكوز ، الذي ينتج صافي اثنين من ATP من تحلل الجلوكوز ، لا ينتج الجالاكتوز أي شيء ، مما يجبر الخلايا على الاعتماد على المركب V لتخليق ATP (الشكل 1). يستخدم مثبط V المركب oligomycin كعنصر تحكم.- اصنع وسطا يحتوي على 10 مللي متر يحتوي على الجلوكوز (انظر الجدول 1).
- اصنع وسطا يحتوي على الجالاكتوز 10 مللي متر (انظر الجدول 1).
- قم بتغيير الوسط في كل بئر إما إلى DMEM المحتوي على الجلوكوز أو DMEM المحتوي على الجالاكتوز. أضف 5 ميكرومتر oligomycin (مثبط V المعقد) إلى الآبار ذات الصلة ونفس الحجم من DMSO إلى الآبار غير المعالجة. مخزون oligomycin هو 10 mM المعاد تعليقه في DMSO. ضع اللوحة مرة أخرى في حاضنة زراعة الأنسجة لمدة 2 أيام.
- تغيير متوسط لتقييم النشاط المعقد الأول حسب الانتشار
ملاحظة: الخلايا التي تتكاثر في وسط خال من البيروفات تعتمد بشكل أكبر على النشاط المعقدI 11,12. بدون البيروفات ، تتطلب الخلايا المستزرعة معقدا I لتسهيل غالبية إعادة أكسدة NADH مرة أخرى إلى NAD + (الشكل 2). يستخدم المركب الأول المثبط روتينون كعنصر تحكم.- اصنع وسط DMEM الخالي من البيروفات المكمل ب 10٪ FBS و 1٪ بنسلين ستربتومايسين.
- اصنع محلول 1 M من البيروفات (انظر الجدول 1).
- قم بتغيير الوسط في كل بئر إما إلى وسط خال من البيروفات أو وسط يحتوي على البيروفات. أضف 2 ميكرومتر روتينون (مثبط المركب I) إلى الآبار المعالجة ونفس الحجم من DMSO إلى الآبار غير المعالجة. مخزون الروتينون هو 25 مليون متر أعيد تعليقه في DMSO. ضع اللوحة مرة أخرى في حاضنة زراعة الأنسجة لمدة 2 أيام.
- تغيير متوسط لتقييم نشاط DHODH عن طريق الانتشار
ملاحظة: تتطلب الخلايا التي تتكاثر في وسائط خالية من اليوريدين نشاط ديهيدرو إستوراتيز (DHODH)11،12،13. في غياب اليوريدين الخارجي ، تقوم الخلايا المستزرعة بتوليف البيريميدين من خلال مسار دي نوفو. يستخدم مثبط DHODH brequinar كعنصر تحكم.- اصنع DMEM الخالي من اليوريدين المكمل ب 10٪ FBS و 1٪ بنسلين ستربتومايسين.
- اصنع محلول مخزون يوريدين 10 ملغ / مل ، ثم قم بإعداد وسط يوريدين 100 ميكروغرام / مل (انظر الجدول 1).
- قم بتغيير الوسط في كل بئر إلى وسط خال من اليوريدين أو وسط يحتوي على اليوريدين. أضف 5 ميكرومتر بريكوينار (مثبط DHODH) إلى الآبار المعالجة ونفس الحجم من DMSO إلى الآبار غير المعالجة. المخزون البريكوينار هو 10 مللي متر أعيد تعليقه في DMSO. ضع اللوحة مرة أخرى في حاضنة زراعة الأنسجة لمدة 2 أيام.
- عد الخلايا لمقايسات الانتشار
- لجميع التجارب ، قم بتجديد الوسط كل 2 أيام. إذا أصبح الوسط أصفر اللون ، فقم بزيادة وتيرة التغييرات المتوسطة. اسمح للخلايا بالتكاثر لمدة تصل إلى 7 أيام ، وأوقف التجربة إذا بدأ أي من الآبار في الظهور متضخما. تعتبر الآبار متضخمة عندما يتجاوز التقاء 80٪.
- نضح الوسط ، واغسله باستخدام 1x PBS ، وقم بتغطية قاع البئر بنسبة 0.25٪ تربسين (500 ميكرولتر لطبق من 6 آبار).
- انتظر 5 دقائق حتى ترفع الخلايا عن الطبق. تحقق من هذا تحت المجهر.
- قم بإخماد التربسين ب 1 مل من DMEM الكامل الذي يحتوي على 10٪ FBS.
- ماصة صعودا وهبوطا لتفتيت كتل الخلية.
- تحضير أكواب كولتر المضادة عن طريق ملء كل منها ب 10 مل من المخزن المؤقت متساوي النغمة (كوب واحد لكل بئر). عد الخلايا على عداد الخلايا وسجل البيانات. إذا كانت القراءة عبارة عن خلايا لكل مليلتر (خلايا / مل) ، فاضرب القيمة المسجلة في 1.5 للحصول على إجمالي عدد الخلايا لكل بئر.
ملاحظة: تكفي طرق عد الخلايا الأخرى مثل مقياس الدم إذا لم يكن لدى المختبر عداد كولتر.
2. 13C4-تتبع النظائر المستقرة الأسبارتات وتحليل LC-MS لقياس نشاط DHODH
- 13تتبع النظائر المستقرة C 4-الأسبارتات في الخلايا الملتصقة
ملاحظة: يمكن مراقبة نشاط DHODH مباشرة عن طريق قياس دمج 13 C 4-aspartate في 13C3-UMP. يستخدم Brequinar كعنصر تحكم لنشاط DHODH (الشكل 3). المستويات الناتجة من 13C3-UMP هي مقياس لنشاط DHODH.- قم بزرع ما بين 250,000 و 500,000 خلية في طبق مكون من 6 آبار لتحقيق التقاء 75٪ في اليوم التالي.
- تحضير محلول مخزون 250 mM 13 C 4-aspartate و 10 mM 13C4-aspartate medium (انظر الجدول 1).
- قم بتغيير الوسط في كل بئر إلى وسط يحتوي على 10 mM 13C 4-aspartate. احتضان لعدد مناسب من الساعات لتحقيق حالة مستقرة لتسمية الخلايا محل الاهتمام.
ملاحظة: يتم تعريف الحالة المستقرة على أنها الإطار الزمني الذي تستقر فيه النسبة المئوية المسماة بالأيض بمرور الوقت14. بالنسبة لخلايا الساركوما العظمية 143B ، يحقق 13C 4-aspartate حالة مستقرة بمقدار 8 ساعات. من أفضل الممارسات تحديد هذا الإطار الزمني قبل التجريب عن طريق إجراء تجربة دورة زمنية مع النظير المستقر محل الاهتمام.
- عزل الأيض من الخلايا الملتصقة
- قبل البدء ، قم بإعداد دلو من الثلج الجاف ، وقم بإعداد 80٪ من MeOH بدرجة HPLC في ماء من فئة HPLC. قم بتبريد هذا المخزن المؤقت في فريزر -80 درجة مئوية طوال الليل أو ضعه مباشرة على الثلج الجاف.
- أخذ طبق واحد في وقت واحد من الحاضنة ، واستنشاق الوسط من الآبار ، وغسل 2x مع 1x PBS. قم بإزالة جميع PBS المتبقية من الآبار قبل الانتقال إلى الخطوة التالية.
ملاحظة: تأكد من إمالة اللوحة أثناء الشفط والماصة على جدار الطبق لمنع تعطل الخلايا الملتصقة. - ضع اللوحة على الثلج الجاف ، وأضف على الفور 800 ميكرولتر من 80٪ MeOH بدرجة LCMS في 20٪ ماء من درجة LCMS إلى كل بئر.
- احتضن الطبق لمدة 15 دقيقة على الأقل في فريزر -80 درجة مئوية لتسهيل تحلل الخلايا.
ملاحظة: في هذه المرحلة ، يمكن إخراج اللوحة التالية من الحاضنة وتكرار الخطوات 2.2.1-2.2.4. استمر في ذلك حتى يتم احتضان جميع الألواح في الفريزر -80 درجة مئوية. - أخرج صفيحة واحدة في الوقت المناسب من الفريزر ، وكشط كل بئر على ثلج جاف باستخدام رافع خلوي ، وانقل المحللة إلى أنبوب طرد مركزي دقيق سعة 1.5 مل. احتفظ بالأنبوب على الثلج الجاف حتى الخطوة التالية.
- دوامة جميع الأنابيب لمدة 10 دقائق عند 4 درجات مئوية ، ثم أجهزة الطرد المركزي عند 4 درجات مئوية لمدة 10 دقائق بأقصى سرعة (17000 × جم على الأقل).
- انقل المادة الطافية إلى أنبوب طرد مركزي دقيق سعة 1.5 مل ، وجففها في مكثف فراغ 4 درجات مئوية مزود بمصيدة باردة -105 درجة مئوية على إعداد تفريغ عالي لمدة 6 ساعات تقريبا أو حتى تتبخر العينات. بمجرد أن يجف المحلل، قم بتخزين كريات الأيض في -80 درجة مئوية حتى تصبح جاهزة لتحضيرها للكروماتوغرافيا السائلة المقترنة بقياس الطيف الكتلي (LCMS).
- قياس الطيف الكتلي للكروماتوغرافيا السائلة (LC-MS) للمستقلبات القطبية
ملاحظة: أي سير عمل كروماتوغرافي وقياس الطيف الكتلي يسمح بالكشف عن الأسبارتات ، والمواد الوسيطة في التخليق الحيوي دي نوفو بيريميدين ، و UMP يكفي14.- قم بإعداد العينات لنظام LCMS على الجليد عن طريق إضافة 100 ميكرولتر من الماء بدرجة HPLC إلى الكريات المجففة والدوامة لمدة 10 دقائق عند 4 درجات مئوية.
- قم بطرد العينات عند 4 درجات مئوية لمدة 10 دقائق بأقصى سرعة (17000 × جم على الأقل) وانقل 25 ميكرولتر في كل قارورة LC-MS.
- حقن 2 ميكرولتر من المحللة في نظام LC-MS. فيما يلي منهجية شائعة الاستخدام:
- تحضير المرحلة المتنقلة A التي تتكون من كربونات الأمونيوم 20 mM (درجة LC-MS) و 0.1٪ هيدروكسيد الأمونيوم (درجة LC-MS) المذابة في مياه LC-MS.
- اختر 100٪ أسيتونيتريل (درجة LC-MS) كمرحلة متنقلة B.
- بالنسبة للكروماتوغرافيا ، اختر عمودا تحليليا 5 ميكرومتر ، 150 مم × 2.1 مم مزودا بعمود حماية 2.1 مم × 20 مم للمركبات المحبة للماء (انظر جدول المواد). اضبط الفرن العمودي على 25 درجة مئوية.
- استخدم إعدادات الكروماتوغرافيا السائلة التالية: معدل تدفق ثابت قدره 0.15 مل / دقيقة ؛ تدرج خطي من 80٪ إلى 20٪ المرحلة المتنقلة B لمدة 20 دقيقة ، متبوعا بتدرج خطي من 20٪ إلى 80٪ المرحلة المتنقلة B لمدة 0.5 دقيقة ، متبوعا بتعليق عند 80٪ المرحلة المتنقلة B لمدة 7.5 دقيقة.
- اختر إعدادات مطياف الكتلة التالية: مسح كامل بين m / z 70 Da و 1,000 Da ؛ قرار 70000 ؛ (أ) هدف AGC المتمثل في 1 × 106؛ ووقت الحقن الأقصى 20 مللي ثانية. قم بتشغيل المصدر في وضع تبديل القطبية. اضبط جهد الرش على 3.0 كيلو فولت ، والشعيرات الدموية المسخنة عند 275 درجة مئوية ، ومسبار HESI عند 350 درجة مئوية ، وتدفق غاز الغمد عند 40 وحدة ، وتدفق الغاز الإضافي عند 15 وحدة ، وتدفق غاز الاجتياح عند وحدة واحدة.
- قم بإجراء تحليل البيانات باستخدام أي برنامج يتفاعل مع سير عمل LCMS.
ملاحظة: البرامج المستخدمة مع سير العمل أعلاه هي XCalibur (الحرارية) و TraceFinder (الحرارية). وفيما يلي الاعتبارات الرئيسية لتحليل البيانات:- أوقات الاحتفاظ المتوقعة: حدد وقت الاحتفاظ بكل مستقلب عن طريق تشغيل المعايير لكل مستقلب مهم باستخدام الطريقة الكروماتوغرافية قبل التجربة.
ملاحظة: أوقات الاحتفاظ ب UMP ونظائرها ، بما في ذلك 13C 3-UMP ، هي نفسها تماما. - M / Z المتوقع للمستقلبات: إذا تأين المستقلب في وضع الأيونات السالبة (مثل UMP) ، فاحسب الكتلة الدقيقة المتوقعة باستخدام الصيغة الجزيئية ل UMP ناقص بروتون [C 9 H14N2O9P]. بالنسبة إلى المستقلبات التي تتأين في وضع الأيونات الموجبة، احسب الكتلة الدقيقة باستخدام الصيغة الجزيئية زائد بروتون.
- دقة الكتلة: عند استخدام مطياف الكتلة orbitrap ، من المتوقع أن يكون للمستقلب محل الاهتمام ونظائره دقة كتلة ±5 mmu. استخدم البرنامج لحساب ذلك ، مع مراعاة M / Z المتوقع و M / Z الفعلي المكتشف.
- تصحيح الوفرة الطبيعية: من المتوقع أن تخضع جميع بيانات التتبع لتصحيح الوفرة الطبيعية لحساب نظائر ~ 1٪ 13C و ~ 0.5٪ 15 N في الطبيعة 15.
- أوقات الاحتفاظ المتوقعة: حدد وقت الاحتفاظ بكل مستقلب عن طريق تشغيل المعايير لكل مستقلب مهم باستخدام الطريقة الكروماتوغرافية قبل التجربة.
3. 13C 5-الجلوتامين تتبع النظائر المستقرة لقياس نشاط SDH
- 13تتبع النظائر المستقرةC 5-الجلوتامين في الخلايا الملتصقة
ملاحظة: يمكن مراقبة نشاط SDH مباشرة عن طريق قياس التحويل البيني لبعض النظائر من الفومارات والسكسينات عند تتبع 13C 5-glutamine 7،16،17. يستخدم مضاد الميسين المثبط الثالث المركب كعنصر تحكم لتغيير الاتجاه الصافي لمركب SDH (الشكل 4).- قم بزرع ما بين 250,000 و 500,000 خلية في طبق مكون من 6 آبار لتحقيق التقاء 75٪ في اليوم التالي.
- تحضير مخزون من 50 mM 13C 5-glutamine (انظر الجدول 1).
- تحضير وسط تتبع يحتوي على 2 mM 13C 5-glutamine (انظر الجدول 1).
- تغيير الوسط في كل بئر إلى وسط يحتوي على 2 mM 13C 5-glutamine. احتضان العدد المناسب من الساعات لتحقيق حالة ثابتة من تسمية الخلايا محل الاهتمام (انظر الملاحظة في الخطوة 2.1.3).
- عزل المستقلبات باتباع البروتوكول في الخطوة 2.2.
- تحليل العينات على LC-MS باتباع سير العمل الموضح في الخطوة 2.3.
- تحليل نشاط SDH بناء على أنماط وضع العلامات
ملاحظة: يمكن مراقبة نشاط أكسدة السكسينات لمركب SDH من خلال تقييم نسبة 13 C 4-fumarate إلى 13 C4-succinate عند تتبع 13C 5-glutamine. يمكن مراقبة نشاط اختزال الفومارات لمركب SDH من خلال تقييم نسبة 13 C 3-succinate إلى 13 C3-fumarate عند تتبع 13C 5-glutamine.- احسب النسبة المئوية لوضع العلامات على 13C 3-fumarate و 13 C 4-fumarate و 13 C3-succinate و 13C 4-succinate. على سبيل المثال ، لتحديد النسبة المئوية ل 13 C 3-fumarate ، قم بتلخيص جميع مناطق الذروة المتكاملة لنظائر الفومارات (فومارات غير موسومة ، 13 C 1-fumarate ، 13 C2-fumarate ، 13 C 3-fumarate ، و 13 C4-fumarate) ، وقسم منطقة الذروة ل 13C 3-fumarate على إجمالي مساحة isotopologue. اضرب في 100.
- لحساب أكسدة السكسينات ، قسم النسبة المئوية 13 C 4-fumarate على النسبة المئوية 13C 4-succinate.
- لحساب اختزال الفومارات ، قسم النسبة المئوية 13 C 3-succinate على النسبة المئوية 13C 3-fumarate.
4. مقايسة النشاط المباشر المعقد الأول
ملاحظة: DCPIP هو مستقبل الإلكترون الاصطناعي. يتغير إلى شكله المختزل عند قبول الإلكترونات من يوبيكوينول. في هذا الفحص ، يتم تقليل يوبيكوينون إلى يوبيكوينول عن طريق الأكسدة المعقدة بوساطة I من NADH إلى NAD +. وبالتالي ، فإن قياس معدل دوران DCPIP المؤكسد في هذا الفحص الخالي من الخلايا هو وكيل للنشاط الأول المعقد 7,18.
- تنقية وقياس الميتوكوندريا من الخلايا
ملاحظة: يمكن استخدام أي بروتوكول لتنقية الميتوكوندريا لهذا الفحص19.- توسيع الخلايا حتى يتم الحصول على 25-100 مليون خلية. نضح الوسط من الأطباق ، واغسله باستخدام 1x PBS ، ونضح PBS ، وجرب الخلايا بنسبة 0.25٪ من التربسين. قم بإخماد التربسين بوسط استزراع ، وحبيبات الخلايا عند 1000 × جم لمدة 5 دقائق.
- اغسل كريات الخلية 2x في 5 مل من 1x PBS, وكرر الطرد المركزي عند 1,000 × جم لمدة 5 دقائق لتكوير الخلايا. قم بتخزين الكريات المغسولة في فريزر -20 درجة مئوية حتى تنقية الميتوكوندريا.
ملاحظة: لا تجمد وتذوب كريات الخلية أكثر من مرة. - تحضير عازلة عزل الميتوكوندريا (انظر الجدول 1).
ملاحظة: لا ينبغي استخدام الكواشف المحتوية على الصوديوم مثل هيدروكسيد الصوديوم لتحضير مخازن عزل الميتوكوندريا ، لأن الصوديوم يشوه إمكانات غشاء الميتوكوندريا20 ويعطل توازن الكالسيوم في الميتوكوندريا21. - إعادة تعليق كريات الخلية إلى 10 ملايين خلية لكل 1 مل من عازلة عزل الميتوكوندريا. على سبيل المثال ، أعد تعليق 100 مليون خلية حبيبية في 10 مل من عازلة عزل الميتوكوندريا.
ملاحظة: تأكد من تعطيل كتل الخلايا دون إدخال فقاعات في المخزن المؤقت. - انقل 2 مل من تعليق الخلية إلى خالط زجاجي مبرد مسبقا بحجم عمل 3-8 مل متوافق مع مدقة Potter-Elvehjem PTFE. تجانس الخلايا مع 10-20 السكتات الدماغية ، ومراقبة الخلايا تحت المجهر لتأكيد تحلل الخلية طوال عملية التجانس. قم بزيادة عدد السكتات الدماغية إذا لزم الأمر لضمان تحلل الخلايا بكفاءة.
ملاحظة: إذا لم يكن تجانس الخلايا بالطريقة المذكورة أعلاه فعالا في تحلل الخلايا ، فانتقل إلى طريقة تحلل المحقنة22. - نقل 2 مل من الخلية المحللة إلى أنبوب الطرد المركزي الدقيق على الجليد ، وكرر الخطوات المذكورة أعلاه حتى يتم تجانس تعليق الخلية بالكامل.
- قم بتجميع النوى وحطام الخلايا عند 650 × جم لمدة 10 دقائق في جهاز طرد مركزي 4 درجات مئوية.
- انقل المادة الطافية إلى أنبوب جديد سعة 2.0 مل ، وكرر الطرد المركزي أعلاه عند 650 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- انقل المادة الطافية إلى أنبوب جديد سعة 2.0 مل ، وقم برش الميتوكوندريا الخام عند 7000 × جم لمدة 10 دقائق في جهاز طرد مركزي 4 درجات مئوية.
- تخلص من المادة الطافية ، وأعد تعليق الحبيبات في 1 مل من محلول عزل الميتوكوندريا. انقل 50 ميكرولتر إلى أنبوب جديد لقياس كمية البروتين. كرر خطوة الطرد المركزي أعلاه على حصيلتي العينة (عينة 50 ميكرولتر والباقي ~ 950 ميكرولتر).
- تخلص من المادة الطافية ، وقم بتخزين الكريات في فريزر -80 درجة مئوية حتى تصبح جاهزة للاستخدام.
- أضف 200 ميكرولتر من محلول RIPA إلى الكريات من الحصة 50 ميكرولتر لاستخراج البروتين ، والدوامة لمدة 10 دقائق ، وأجهزة الطرد المركزي عند 21000 × جم لعزل البروتين. حدد كمية البروتين في حصة 50 ميكرولتر ، واستخدم هذا الرقم لتحديد كمية البروتين المتبقي في عينة 950 ميكرولتر. على سبيل المثال ، إذا كان القياس الكمي للبروتين لقسمة 50 ميكرولتر هو 1 ميكروغرام / ميكرولتر ، فإن البروتين الكلي في حبيبات الميتوكوندريا المتبقية هو 950 ميكروغرام (1 ميكروغرام / ميكرولتر × 950 ميكرولتر).
- إجراء مقايسة النشاط المعقد الأول
ملاحظة: تم استخدام خط خلايا الساركوما العظمية 143B لهذا الفحص ، ولكن يمكن تكييف البروتوكول مع أي خلايا مستزرعة.- إعادة تعليق الميتوكوندريا المنقاة في مخزن إعادة تعليق الميتوكوندريا (انظر الجدول 1) إلى تركيز نهائي قدره 5 ملغ بروتين / مل.
- قم بإجراء خمس دورات تجميد / ذوبان في مجمد -20 درجة مئوية لنفاذية الميتوكوندريا.
- اجعل المخزن المؤقت لفحص النشاط المعقد I (انظر الجدول 1).
- امزج 50 ميكروغرام من مخزون الميتوكوندريا 5 مجم / مل مع 90 ميكرولتر من مخزن النشاط المركب I. قم بإعداد خمس مكررات غير معالجة وخمسة مكررات معالجة بالروتينون (5 ميكرومتر) للتحكم في نشاط I المعقد.
- اقرأ امتصاص خط الأساس عند 600 نانومتر في قارئ لوحة مضبوط على 37 درجة مئوية.
- ابدأ التفاعل عن طريق إضافة NADH إلى تركيز نهائي يبلغ 2 mM ، وتتبع الامتصاص (600 نانومتر) على مدى 1 ساعة ، وقياس كل دقيقتين على الأقل طوال الوقت. يشير الانخفاض في الامتصاص إلى انخفاض DCPIP عبر نشاط I المعقد.
ملاحظة: يجب إضافة NADH باستخدام ماصة متعددة القنوات لضمان بدء تشغيل جميع العينات في نفس الوقت.
5. مقايسة قائمة على LC-MS لقياس مستويات الأكسيد الفائق
ملاحظة: يمكن أن تتغير خصائص مضان MitoSox Red بشكل مستقل عن تفاعله مع الأكسيد الفائق23. يقيس هذا الاختبار المستند إلى LC-MS المنتج مباشرة من تفاعل الأكسيد الفائق مع MitoSox Red. تم تعديل الفحص التالي بشكل طفيف من Xiao et al.24. 2-هيدروكسي ميتويثيديوم (2-OH MitoE2+) هو نتاج تفاعل الأكسيد الفائق (الشكل 5). تم استخدام خط خلية Caki1 لهذا الفحص ، ولكن يمكن تكييف البروتوكول لأي خلايا مستزرعة.
- علاج الخلايا الملتصقة ب MitoSox Red
- قم بزرع ما بين 250,000 و 500,000 خلية في طبق مكون من 6 آبار لتحقيق التقاء 75٪ في اليوم التالي. تأكد من زرع مجموعة من اللوحات لمقايسة LC-MS ومجموعة مكررة من اللوحات لتطبيع عدد الخلايا.
- قم بإعداد DMEM الكامل الذي يحتوي على 10٪ FBS المعطل بالحرارة و 1٪ من البنسلين والستربتومايسين في وسط النسر المعدل من Dulbecco.
- قم بتحديث الوسط في جميع الآبار لجميع الظروف باستخدام 2 مل من DMEM الكامل. تأكد من إضافة أي أدوية أو علاجات ذات أهمية في هذه المرحلة.
- احتضان الخلايا في حاضنة زراعة الأنسجة لمدة 1 ساعة.
- إعداد الضوابط الإيجابية والسلبية. تحضير مخزون 50 مللي متر من هيدرو بيروكسيد ثلاثي بوتيل المخفف في PBS ومخزون 250 مللي متر من N-acetyl cysteine (NAC) المخفف في DMSO (انظر الجدول 1).
ملاحظة: Tertbutyl hydroperoxide (tBuOOH) هو نوع أكسجين تفاعلي قوي يعمل كعنصر تحكم إيجابي ويزيد من كمية 2-OH MitoE2 +. NAC هو أحد مضادات الأكسدة القوية التي ستعمل كعنصر تحكم سلبي وتحييد إنتاج الأكسيد الفائق الناجم عن tBuOOH. - أضف 1 ميكرولتر من tBuOOH إلى آبار التحكم الإيجابية و 1 ميكرولتر من tBuOOH + 100 ميكرولتر من NAC إلى آبار التحكم السلبية.
ملاحظة: استخدام ماصة P2 (نطاق 0.1-2 ميكرولتر) هو الطريقة المثلى لنقل 1 ميكرولتر. - احتضان لمدة 1 ساعة في حاضنة زراعة الأنسجة.
- قم بإعداد مخزون MitoSox Red 1 mM (انظر الجدول 1) ، وأضف 2 ميكرولتر من 1 mM MitoSox Red إلى كل بئر لتحقيق تركيز نهائي قدره 1 ميكرومتر. احتضان لمدة 30 دقيقة في حاضنة زراعة الأنسجة.
- خلال هذه الحضانة النهائية ، عد إحدى اللوحات المكررة للحصول على عدد الخلايا لتطبيع بيانات LC-MS النهائية.
- عزل منتج Mitosox Red المؤكسد من الخلايا الملتصقة
- احصل على دلو من الثلج الجاف ، وضع الأيزوبروبانول البارد من درجة HPLC على الثلج الجاف قبل بدء العزل.
- أخرج طبقا واحدا في كل مرة ، واستنشق الوسط من الآبار ، واغسل 2x ب 1 مل من 1x PBS. استنشاق كل PBS المتبقية من الآبار قبل الانتقال إلى الخطوة التالية.
ملاحظة: تأكد من إمالة اللوحة أثناء الشفط والماصة على جدار الطبق لمنع تعطل الخلايا الملتصقة. - ضع الطبق على الثلج الجاف ، وأضف 800 ميكرولتر من الأيزوبروبانول من فئة HPLC إلى كل بئر.
- احتضن الطبق لمدة 15 دقيقة على الأقل في فريزر -80 درجة مئوية لتسهيل تحلل الخلايا.
ملاحظة: في هذه المرحلة ، يمكن إخراج اللوحة التالية من الحاضنة وتكرار الخطوات 5.2.1-5.2.4. استمر في ذلك حتى يتم احتضان جميع الألواح في الفريزر -80 درجة مئوية. - أخرج صفيحة واحدة في كل مرة من الفريزر ، وكشط كل بئر على ثلج جاف باستخدام رافع خلوي ، وانقل المحللة إلى أنبوب طرد مركزي دقيق سعة 1.5 مل. احتفظ بالأنبوب على الثلج الجاف حتى الخطوة التالية.
- دوامة جميع الأنابيب لمدة 10 دقائق عند 4 درجات مئوية ، ثم أجهزة الطرد المركزي عند 4 درجات مئوية لمدة 10 دقائق بأقصى سرعة (17000 × جم على الأقل).
- انقل المادة الطافية إلى أنبوب طرد مركزي صغير سعة 1.5 مل ، وجففها في مكثف فراغ. بمجرد أن يجف المحلل, قم بتخزين كريات الأيض في -80 درجة مئوية حتى تصبح جاهزة ل LC-MS.
- قياس LC-MS لميتوسوكس الأحمر و 2-هيدروكسي-ميتوإيثيديوم (2-OH MitoE2+)
- قم بإعداد العينات ل LCMS على الجليد عن طريق إضافة 100 ميكرولتر من خليط 3: 3: 1 من درجة HPLC MeOH: الكلوروفورم: الماء. دوامة لمدة 10 دقائق عند 4 درجات مئوية.
- انقل 25 ميكرولتر في كل قارورة LC-MS. قم بتخزين العينة المتبقية في الفريزر -80 درجة مئوية.
- قم بإعداد المخازن المؤقتة للكروماتوغرافيا السائلة التالية: ط) المخزن المؤقت أ: ماء درجة HPLC مع حمض الفورميك 0.1٪ ؛ ب) المخزن المؤقت ب: HPLC الصف الأسيتونيتريل مع 0.1 ٪ حمض الفورميك.
- افتح تطبيق إعداد أداة Thermo XCalibur لبدء تطوير الطريقة.
- ابحث عن مربعين على الشريط الجانبي الأيسر من هذه النافذة - المربع الأول يسمح بتطوير طريقة الكروماتوغرافيا ، والمربع الثاني يسمح بتطوير طريقة قياس الطيف الكتلي.
- تطوير طريقة الكروماتوغرافيا السائلة:
- اضبط معدل تدفق 0.25 مل / دقيقة ، وابدأ الطريقة عند 20٪ B ، وارتفع إلى 95٪ B على مدى 12 دقيقة. خلال الدقيقة التالية ، قم بإسقاط المخزن المؤقت B مرة أخرى إلى 20٪ B ، وحافظ على هذا المستوى لمدة دقيقتين تاليتين.
ملاحظة: آخر دقيقتين من التدفق عند 20٪ B أمر بالغ الأهمية لضغط العمود للانخفاض مرة أخرى إلى الضغط الأولي وموازنة العمود مع نسب المخزن المؤقت المناسبة. سيؤدي عدم تضمين خطوة التوازن هذه إلى تغيير أوقات الاستبقاء لجميع العينات التي يتم تشغيلها لاحقا.
- اضبط معدل تدفق 0.25 مل / دقيقة ، وابدأ الطريقة عند 20٪ B ، وارتفع إلى 95٪ B على مدى 12 دقيقة. خلال الدقيقة التالية ، قم بإسقاط المخزن المؤقت B مرة أخرى إلى 20٪ B ، وحافظ على هذا المستوى لمدة دقيقتين تاليتين.
- قم بإنشاء ملف Tune باستخدام المعلمات التالية:
- افتح تطبيق Tune ، وأنشئ ملف لحن جديد.
- قم بتطبيق أي إعدادات متداخلة من وحدة إعداد الطريقة (راجع الخطوة 5.3.9.3) على ملف الضبط هذا أيضا ، بما في ذلك نطاق المسح والدقة والقطبية وهدف AGC والحد الأقصى لتكنولوجيا المعلومات.
- اضبط غاز الغمد على 30 ، وغاز Aux على 3 ، وغاز Sweep على 3 أيضا. اضبط جهد الرش على 3 كيلو فولت ، ودرجة الحرارة الشعرية على 300 ، ومستوى التردد اللاسلكي للعدسة S على 60.
- تطوير طريقة قياس الطيف الكتلي:
- من القائمة السفلية اليسرى لعمليات الفحص المحتملة ، اسحب واترك Full MS وأفلته في وسط النافذة. تأكد من النقر فوق مربع Full MS بعد الإسقاط لضبط الإعدادات. المدة الإجمالية لطريقة MS هي 13 دقيقة.
ملاحظة: طريقة LC أطول من طريقة MS لأن آخر 2 دقيقة مخصصة لتجديد العمود وليس القياس الكمي للمستقلب. - على الجانب الأيمن من الوحدة ، ضمن خصائص الطريقة ، تأكد من تعيين مدة الطريقة ووقت التشغيل على 13.00 دقيقة.
- قم بإجراء هذا الفحص الكامل في الوضع الإيجابي بدقة 70000 وهدف AGC 1 × 106. اضبط الحد الأقصى لتكنولوجيا المعلومات على 100 مللي ثانية ونطاق المسح الضوئي من 300 م / ض إلى 700 م / ض.
- ضمن Tune Files باتجاه الجزء العلوي من الوحدة ، لاحظ أن ملف tune الذي تم إنشاؤه للتو مرتبط بهذه الطريقة.
- من القائمة السفلية اليسرى لعمليات الفحص المحتملة ، اسحب واترك Full MS وأفلته في وسط النافذة. تأكد من النقر فوق مربع Full MS بعد الإسقاط لضبط الإعدادات. المدة الإجمالية لطريقة MS هي 13 دقيقة.
- قم بتشغيل طريقة اكتشاف MitoSox Red باستخدام حقن عينة 2 ميكرولتر.
النتائج
يمكن تقييم أنشطة DHODH والمركب I والمجمع V باستخدام مقايسات الانتشار. عند الحرمان من اليوريدين من وسط الاستزراع ، تصبح الخلايا أكثر اعتمادا على مسار دي نوفو للتخليق الحيوي للبيريميدين. وهكذا ، عندما تم تحدي الخلايا للتكاثر في وسط خال من اليوريدين ، كانت أكثر حساسية لتثبيط نشاط DHODH بواسطة brequinar من الخلايا المزروعة في وسط يحتوي على اليوريدين (الشكل 6 أ). وبالمثل ، فإن حرمان البيروفات من وسط الاستزراع يجعل الخلايا أكثر اعتمادا على النشاط المعقد الأول للانتشار. وهكذا ، عندما تم تحدي الخلايا للتكاثر في وسط خال من البيروفات ، كانت أكثر حساسية لتثبيط النشاط المركب I بواسطة الروتينون من الخلايا المزروعة في وسط يحتوي على البيروفات (الشكل 6 ب). يمكن تقييم نشاط V المعقد عن طريق تحدي الخلايا للتكاثر في وسط يحتوي على الجالاكتوز بدلا من الجلوكوز. نظرا لأن الجالاكتوز ينتج صافي صفر ATP في تحلل الجلوكوز ، فإن الخلايا التي تنمو في هذا الوقود تعتمد بشكل أكبر على تخليق ATP الميتوكوندريا عبر نشاط V المعقد. وهكذا ، كانت الخلايا التي تتكاثر في وسط يحتوي على الجالاكتوز أكثر حساسية لتثبيط V المعقد بواسطة oligomycin من الخلايا المتكاثرة في وسط يحتوي على الجلوكوز (الشكل 6C).
يمكن قياس نشاط SDH باستخدام تتبع 13C 5-glutamine ومن خلال مراقبة اندماجه في نظائر الفومارات والسكسينات. في الظروف المعالجة بالمركبات ، فضل مجمع SDH النشاط الأمامي ، وكان دمج 13 C 4-succinate في 13 C4-fumarate أعلى من دمج 13 C 3-fumarate في 13C 3-succinate (الشكل 7). في الظروف المعالجة بمضادات الميسين ، فضل مركب SDH النشاط العكسي ، وكان دمج 13 C 3-fumarate في 13 C3-succinate أكبر من دمج 13 C 4-succinate في 13C 4-fumarate (الشكل 7).
يمكن قياس إنتاج الأكسيد الفائق داخل الميتوكوندريا باستخدام مراسل الفلورسنت MitoSox ، الذي يولد 2-هيدروكسي-ميتوإيثيديوم عند التفاعل مع الأكسيد الفائق. في هذه الدراسة ، كان لدى الخلايا المعالجة ب MitoSox في وجود بيروكسيد الهيدروجين tertbutyl مستويات أعلى من 2-hydroxy-mitoethidium بطريقة تم قمعها بإضافة NAC ، وهو مضاد للأكسدة يروي ROS الخلوي (الشكل 8).
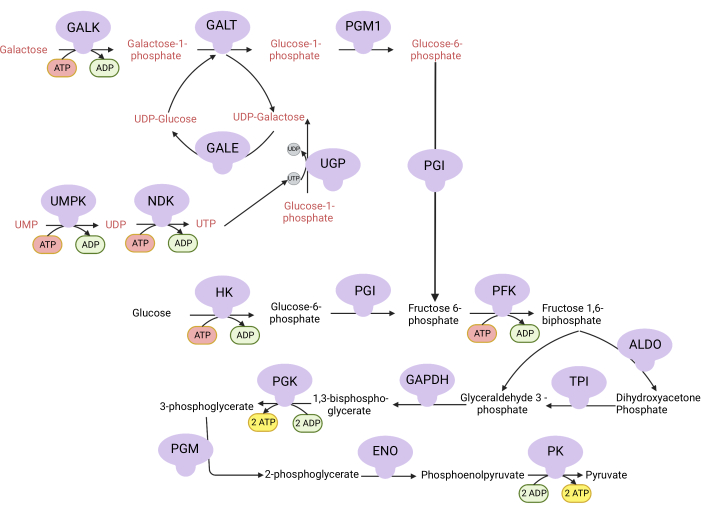
الشكل 1: الأساس الميكانيكي لمقايسة الانتشار V المعقدة. أكسدة الجلوكوز والجالاكتوز عن طريق تحلل السكر. ينتج الجلوكوز صافي اثنين ATP من تحلل الجلوكوز ، في حين أن الجالاكتوز ينتج صافي صفر ATP لأن تخليق UTP مطلوب ل UDP-galactose. وبالتالي ، فإن الخلايا المزروعة في الجالاكتوز تعتمد بشكل أكبر على تخليق ATP الميتوكوندريا بسبب نقص ATP الناتج عن تحلل السكر. الاختصارات: GALK = galactokinase; GALT = الجالاكتوز -1-فوسفات يوريديليل ترانسفيراز ؛ PGM1 = فوسفوغلوكوموتاز 1 ؛ GPI = أيزوميراز الجلوكوز 6 فوسفات ، UGP = UDP-الجلوكوز بيروفوسفوريلاز ؛ GALE = UDP-galactose-4-epimerase ؛ NDK = نيوكليوتيد ثنائي فوسفات كيناز ؛ UMPK = يوريدين أحادي الفوسفات كيناز ؛ هونج كونج = هيكسوكيناز. PFK = فوسفوفركتوكيناز ؛ ألدو = ألدولاز. TPI = إيزوميراز ثلاثي الفوسفات. GAPDH = غليسيرالدهيد-3-فوسفات ديهيدروجيناز. PGK = فوسفوغليسيرات كيناز ؛ PGM = فوسفوغلوكوموتاز. ENO = إنولاز ؛ PK = بيروفات كيناز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
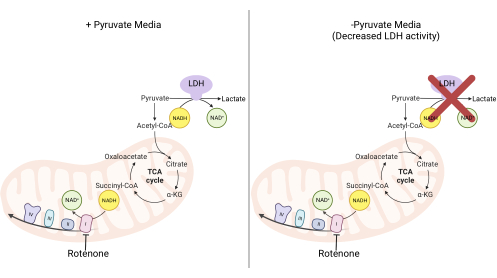
الشكل 2: الأساس الميكانيكي لمقايسة الانتشار المعقدة الأولى. رسم تخطيطي للمسارات الأيضية التي يتم تغييرها عند تثبيط النشاط المعقد I. في الوسائط عالية البيروفات ، يتم تجاوز تثبيط I المعقد عن طريق أكسدة NADH بوساطة LDH. في الوسائط منخفضة البيروفات ، يكون هذا التكيف أقل جدوى ، مما يجعل الخلايا أكثر اعتمادا على نشاط I المعقد لإعادة أكسدة NADH. الاختصارات: LDH = نازعة هيدروجين اللاكتات. دورة TCA = دورة حمض الكربوكسيلية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
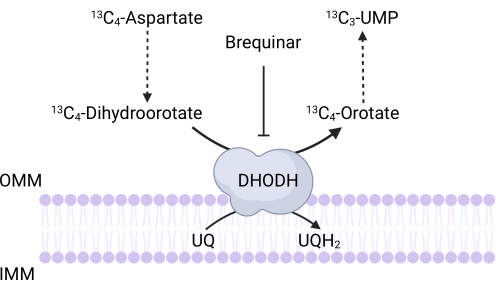
الشكل 3: رسم تخطيطي لتفاعل DHODH عند تتبع 13C 4-الأسبارتات. يمنع Brequinar أكسدة ثنائي هيدرو الدوران إلى orotate ، وبالتالي يمنع تخليق المصب ل UMP. 13تم دمج C 4-الأسبارتات في 13C3-UMP عبر نشاط DHODH. الاختصارات: OMM = غشاء الميتوكوندريا الخارجي. IMM = غشاء الميتوكوندريا الداخلي ؛ DHODH = ديهيدرو أوروتيم ديهيدروجيناز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
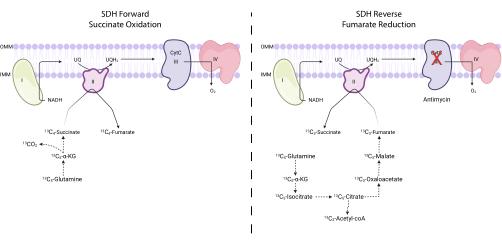
الشكل 4: قياس النشاط المعقد II الأمامي والخلفي عبر تتبع 13C 5-glutamine. لقياس النشاط الأمامي المعقد II (يسار) ، يتم مراقبة دمج 13 C 5-glutamine في 13 C 4-succinate و 13C 4-fumarate. لقياس النشاط المعقد العكسي II (يمين) ، يتم مراقبة دمج 13 C 5-glutamine في 13 C 3-succinate و 13C 3-fumarate. الاختصارات: SDH = سكسينات ديهيدروجيناز. CytC = السيتوكروم C. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
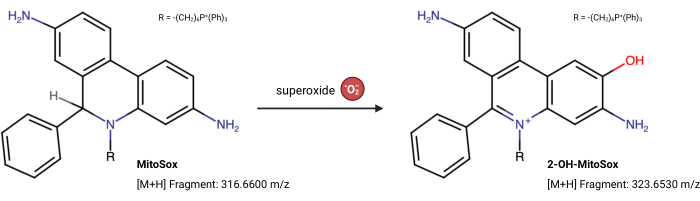
الشكل 5: تفاعل ميتوسوكس الأحمر مع الأكسيد الفائق. تفاعل MitoSox مع أكاسيد الميتوكوندريا الفائقة لتشكيل 2-OH-MitoE2+. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
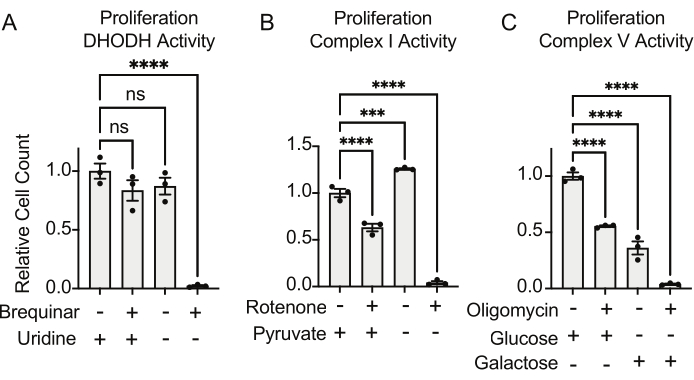
الشكل 6: المقايسات القائمة على الانتشار لقياس وظيفة الميتوكوندريا (أ) تكاثر خلايا الساركوما العظمية 143B المعالجة ب 5 ميكرومتر بريكوينار ، وهو مثبط DHODH ، في وسط يحتوي على ±100 ميكروغرام / مل يوريدين. البيانات هي متوسط ± SEM ؛ N = 3 لكل شرط. (ب) تكاثر خلايا الساركوما العظمية 143B المعالجة ب 2 ميكرومتر روتينون ، وهو مثبط معقد I ، في وسط يحتوي على ±5 مللي مول بيروفات. البيانات هي متوسط ± SEM ؛ N = 3 لكل شرط. (ج) تكاثر خلايا الساركوما العظمية 143B المعالجة ب 5 ميكرومتر oligomycin ، وهو مثبط V معقد ، في وسط إما مع 10 mM الجلوكوز أو 10 mM galactose كمصدر مركزي وحيد للكربون. البيانات هي متوسط ± SEM ؛ N = 3 لكل شرط. * يشير إلى p < 0.05 باستخدام اختبار ANOVA أحادي الاتجاه في Graphpad Prism. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
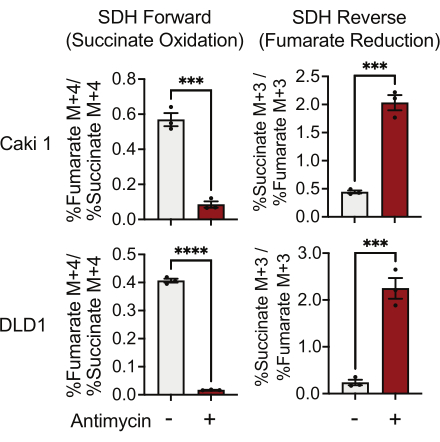
الشكل 7: 13C 5-glutamine تتبع لقياس النشاط الثاني المعقد. أكسدة السكسينات وتقليل الفومارات (عكس SDH) في خلايا DMSO و 500 نانومتر من خلايا Caki1 و DLD1 المعالجة بمضادات الميسين A. تمثل البيانات متوسط ± SEM ؛ N = 3 لكل شرط. يشير إلى p < 0.05 باستخدام اختبار t غير مزاوج في GraphPad Prism. الاختصارات: SDH = أكسدة سكسينات. عكس SDH = تخفيض الفومارات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
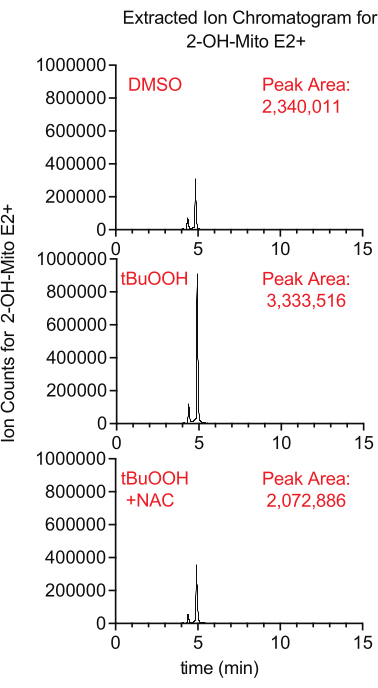
الشكل 8: مقايسة MitoSox المستندة إلى LCMS للكشف عن الأكسيد الفائق. مخطط كروماتوجرام أيوني مستخرج من 2-OH-Mito E2+ معزول من خلايا Caki1 المعالجة ب MitoSox لمدة 30 دقيقة في وجود tBuOOH ± NAC. الاختصارات: LCMS = كروماتوغرافيا سائلة - مطياف الكتلة ؛ NAC = N- أسيتيل سيستين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: تكوين الكواشف والمخازن المؤقتة والوسائط المستخدمة في هذا البروتوكول. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
نظرا لأن الأبحاث الناشئة توضح أن الميتوكوندريا في الثدييات يمكن أن تعمل دون استهلاك الأكسجين الجزيئي ، فمن الأهمية بمكان للباحثين استخدام المقايسات المتعامدة ، بما يتجاوز قياسات التعرف الضوئي على الحروف ، لتحديد وظيفة الميتوكوندريا بدقة. هنا ، قمنا بتجميع سلسلة من المقايسات التي يمكن استخدامها لتقييم أنشطة المعقد I والمركب II والمركب V و DHODH بشكل مباشر عن طريق قياس توازن NAD + / NADH للميتوكوندريا ، واستخدام مستقبلات الإلكترون الطرفي التكيفي ، وإنتاج ATP ، والتخليق الحيوي دي نوفو بيريميدين ، و ROS المشتق من الميتوكوندريا. والجدير بالذكر أن هذه المقايسات تقيس وظيفة الميتوكوندريا بشكل مباشر أكثر من قياسات التعرف الضوئي على الحروف. علاوة على ذلك ، توفر هذه المقايسات للباحثين طرقا قابلة للتتبع لتحديد وظيفة الميتوكوندريا أثناء نقص الأكسجة ، والتي تكون قياسات OCR غير ذات صلة إلى حد كبير بسبب استخدام الفومارات كمستقبل مفضل للإلكترون الطرفي. وأخيرا، فإن الطرق القائمة على الانتشار الموصوفة هنا أكثر فعالية من حيث التكلفة من تجارب قياس التنفس الكلاسيكية، مما يوفر طريقة متاحة على نطاق واسع لدراسة وظيفة الميتوكوندريا في أنظمة الثدييات.
هناك اعتبارات رئيسية عند استخدام هذه المقايسات لقياس وظيفة الميتوكوندريا في الخلايا المزروعة. فيما يتعلق بمقايسات الانتشار ، من المهم ضبط عدد الخلايا المزروعة لمعدل مضاعفة كل خط خلوي. يجب أن يتم زرع الخلايا إلى التقاء 10٪ على الأقل ومع مساحة كافية للسماح بثلاثة إلى أربعة مضاعفة بحيث يمكن تحديد الاختلافات في الانتشار. هناك اعتبار آخر لكل فحص وهو تركيز الجزيئات الصغيرة المستخدمة كضوابط لأنشطة كل مركب من مجمعات ETC. نظرا لأن خطوط الخلايا المختلفة قد تظهر حساسيات مختلفة لهذه المثبطات ، فمن الأهمية بمكان اختبار جرعة هذه الجزيئات الصغيرة لتحديد التركيز الأمثل.
أحد القيود العالمية للمقايسات التي تدرس وظيفة الميتوكوندريا في المختبر ، بما في ذلك قياسات التعرف الضوئي على الحروف وجميع المقايسات الموصوفة هنا ، هو التركيب الأيضي لوسط الثقافة. يميل وسط زراعة الخلايا القياسي إلى تحيز الأنظمة إلى مستويات عالية بشكل سطحي من وظيفة الميتوكوندريا. على سبيل المثال ، تزيد مستويات الجلوتامين فوق الفسيولوجية من anaplerosis في دورة TCA25 ، والتي تغذي تخليق NADH الميتوكوندريا ، وبالتالي تزيد من الفسفرة التأكسدية. وبالمثل ، يتراوح الضغط الجزئي للأكسجين بين 3 مم زئبق و 100 مم زئبق (حوالي 0.1٪ -13٪ O2) في أنسجة الثدييات ولكنه في الغلاف الجوي (140 مم زئبق ، حوالي 21٪) في المختبر26,27. هذا الفائض O2 يزيد من القدرة التنفسية للميتوكوندريا وإنتاج الأكسيدالفائق 28. في الآونة الأخيرة ، بذلت جهود لتصميم وسائط الثقافة لتكون أكثر فسيولوجية 29,30. والجدير بالذكر أن زراعة الخلايا في وسائط شبيهة بالبلازما البشرية تقلل من تنفس الميتوكوندريا في بعض خطوط الخلايا السرطانية30 ، والميتوكوندريا ROS في الخلايا التائية 31 ، وتكيفات الميتوكوندريا مع علاجات السرطان32. وبالتالي ، من الأهمية بمكان أن نضع في اعتبارنا تكوين وسائط الثقافة المستخدمة وفهم كيفية تأثيرها على وظيفة الميتوكوندريا.
هناك قيد مهم وعالمي آخر في تفسير وظيفة الميتوكوندريا وهو احتمال وجود اختلافات في عدد الميتوكوندريا. لذلك ، من الأهمية بمكان قياس محتوى الميتوكوندريا إما من خلال القياس الكمي ل mtDNA33 ، أو قياس كتلة الميتوكوندريا باستخدام الأصباغ غير الحساسة للغشاءالمحتمل 34 ، أو النشاف الغربي لعلامات الميتوكوندريا. هذا عنصر تحكم حرج بحيث لا يتم الخلط بين انخفاض عدد الميتوكوندريا وانخفاض في وظيفة الميتوكوندريا.
هناك أيضا قيود محددة واستكشاف الأخطاء وإصلاحها تنطبق على المقايسات الموضحة هنا. أولا، بالنظر إلى أن الخلايا المتمايزة لا تتكاثر، فإن المقايسات القائمة على الانتشار لن تكون مفيدة لتقييم وظيفة الميتوكوندريا في هذا السياق. أحد القيود الرئيسية لبروتوكول تتبع 13C 4-aspartate لقياس نشاط DHODH هو أن امتصاص الأسبارتات في الخلايا يمكن أن يكون غير فعال للغاية35. للتغلب على هذا القيد المحتمل ، يمكن للباحثين الإفراط في التعبير عن ناقل الأسبارتات ، SLC1A3 ، لتسهيل امتصاص 13C 4-aspartate35.
يتمثل أحد قيود البروتوكول الذي يستخدم تتبع 13C 5-glutamine لقياس نشاط SDH في أن هذا الفحص يتطلب من الخلايا استخدام مسار الكربوكسيل المختزل لإثراء نظائر M + 3 من أجل قياس النشاط العكسي. بعض خطوط الخلايا غير قادرة على تدفق الكربوكسيل المختزل بسبب انخفاض تعبير لياز سترات ATP36 ، أو عدم كفاية تثبيت HIF 37 ، أو نسبة سيترات α-KG: منخفضة جدا38. للتغلب على هذا القيد ، يمكن للمرء استخدام تتبع 13C 4-aspartate لقياس SDH إلى الأمام والعكسالأنشطة 7. في هذا الفحص ، يمكن قياس النشاط الأمامي SDH بنسبة فومارات M + 2: سكسينات M + 2 ورد الفعل العكسي بواسطة سكسينات M + 4: فومارات M + 4. والجدير بالذكر أن هذا التتبع يتحايل على معظم الإنزيمات في مسار الكربوكسيل المختزل.
أحد قيود مقايسة النشاط المعقد I باستخدام تقليل DCPIP كقراءة هو أن الميتوكوندريا ليست سليمة من الناحية الهيكلية. من المؤكد أن عملية تجميد وذوبان الميتوكوندريا لتمكين امتصاص NADH للفحص يمكن أن تشوه السلامة الهيكلية لغشاء الميتوكوندريا39. يجب إجراء هذا الفحص بالتوازي مع فحوصات مثل مقايسة الانتشار المعقدة I للتأكد من أن التغييرات في النشاط المعقد I التي لوحظت صحيحة أيضا مع الخلايا السليمة.
في الدراسات المستقبلية ، يمكن تكييف بعض هذه التقنيات لقياس وظائف الميتوكوندريا في الجسم الحي باستخدام كائنات نموذجية مثل الفئران و Caenorhabditis elegans. تتركز الطرق الحالية المستخدمة لقياس وظيفة الميتوكوندريا في الجسم الحي على OCR على مستوى الكائن الحي ، وتحديدا معدل التبادل التنفسي عند استخدام نماذج الفئران. أحد القيود الواضحة على هذه الطريقة هو أن الأكسجين يخدم العديد من الوظائف البيوكيميائية والإشارات بما يتجاوز دوره كمستقبل للإلكترون الطرفي في كل مكان في الميتوكوندريا ETC. على سبيل المثال ، يتم "استهلاك" الأكسجين من خلال النشاط الحفاز للأنزيمات في عائلة ديوكسيجيناز. على الرغم من أن هذه الإنزيمات تساهم في معدل استهلاك الأكسجين الخلوي ، إلا أنها لا تشارك في وظيفة الميتوكوندريا أو تنظمها أو تعكسها. عادة ما تتحكم تجارب قياس التنفس الكلاسيكية في المختبر في "التعرف الضوئي على الحروف غير الميتوكوندريا" ، في حين أن تجارب نسبة التبادل التنفسي العضوي (RER) لا يمكنها التحكم في ذلك ، مما يحد من تفسير RER كمقياس لوظيفة الميتوكوندريا في الجسم الحي. ومع ذلك ، فمن الممكن تكييف البروتوكولات لقياس نشاط DHODH عبر تتبع 13 C 4-aspartate ، والنشاط المعقد II عبر تتبع 13C 5-glutamine ، والنشاط المعقد I على الميتوكوندريا المنقاة من الأنسجة ، و ROS الميتوكوندريا باستخدام مركبات صديقة LC-MS مثل MitoB من أجل قياس وظيفة الميتوكوندريا في الجسم الحي. توفر هذه المقايسات المباشرة لاستجواب وظائف الميتوكوندريا ، جنبا إلى جنب مع تجارب قياس التنفس الكلاسيكية ، للباحثين تقييما أكثر شمولا ودقة لوظيفة الميتوكوندريا في خلايا وأنسجة الثدييات.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإبلاغ عنه.
Acknowledgements
تم إنشاء الأشكال المنتجة في هذه المخطوطة باستخدام BioRender.com. نحن ممتنون لإيمي ووكر لتقديم ملاحظات حول هذه المقالة. تم دعم JBS من قبل مؤسسة Worcester لمنحة البحوث الطبية الحيوية.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube | Cell Treat | 667443 | |
| 2.0 mL tube | Cell Treat | 229446 | |
| 6-well plate | Cell Treat | 229106 | |
| 12-well plate | Cell Treat | 229112 | |
| 13C4-aspartate | Sigma-Aldrich | 604852 | |
| 13C5-Glutamine | Cambridge Isotope Laboratories | 285978-14-5 | |
| 15 mL centrifuge tube | Cell Treat | 667411 | |
| 50 mL centrifuge tube | Cell Treat | 667421 | |
| 150 mm tissue culture dish | Cell Treat | 229651 | |
| 1x Phosphate-buffered saline | Gibco | 10010049 | |
| 2,6-dichlorophenolindophenol | Honeywell | 33125 | |
| Ammonium Carbonate | Sigma-Aldrich | 37999 | |
| Antimycin | Sigma-Aldrich | A8674 | |
| Ascentis Express C18 | Sigma-Aldrich | 53825-U | |
| Bottle top filter 500 mL, 0.22 µm, PES 9 9 mm membrane diameter | Cell Treat | 229717 | |
| Bovine Serum Albumin | Sigma-Aldrich | A3294 | |
| Brequinar | Sigma-Aldrich | SML0113 | |
| Cell Lifter, Double End Flat and Narrow Blade | Cell Treat | 229305 | |
| CentriVap -105 Cold Trap | Labconco | 7385020 | |
| Complete Protease Inhibitor Tablets | Sigma-Aldrich | 4693116001 | |
| Coulter Counter Cups | Fisher Scientific | 07-000-694 | |
| Decylubiquinone | Sigma-Aldrich | D7911 | |
| DMSO | Invitrogen | D12345 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 11995-065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| EGTA | Sigma-Aldrich | E3889 | |
| Eppendorf Centrifuge 5425R | Eppendorf | 2231000908 | |
| Eppendorf Centrifuge 5910 Ri | Eppendorf | 5943000343 | |
| Galactose | Sigma-Aldrich | G5388 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glucose-free DMEM | Gibco | 11966025 | |
| Glutamine-free DMEM | Thermo Fisher | 11960044 | |
| Heat-Inactivated Fetal Bovine Serum | Sigma-Aldrich | F4135 | |
| Hepes | Sigma-Aldrich | H3375 | |
| HPLC-grade 35% Ammonium hydroxide | Thermo Scientific | 460801000 | |
| HPLC-grade Acetonitrile | Sigma-Aldrich | 900667 | |
| HPLC-grade Chloroform | Sigma-Aldrich | 366927 | |
| HPLC-grade formic acid | Thermo Scientific | 28905 | |
| HPLC-grade Isopropanol | Sigma-Aldrich | 563935 | |
| HPLC-grade MeOH | Sigma-Aldrich | 900688 | |
| HPLC-grade Water | Sigma-Aldrich | 270733 | |
| Human Osteosarcome Cell Line 143B | ATCC | CRL-8303 | |
| Hydrochloric Acid | Sigma-Aldrich | 320331-500ML | |
| Isotone buffer | Beckman Coulter | 8546719 | |
| K2HPO4 | Sigma-Aldrich | P2222 | |
| Mannitol | Sigma-Aldrich | M4125 | |
| MitoSox Red | Invitrogen | M36008 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Oligomycin | Sigma-Aldrich | 75351-5MG | |
| Pencillin Streptomycin | Gibco | 15140-122 | |
| Potter-Elvehjem Tissue Grinder, Size 21 | Kimble | 885502-0021 | |
| Pyruvate | Sigma-Aldrich | P5280 | |
| Pyruvate-free DMEM media | Gibco | 11965175 | |
| Q Exactive Plus Mass Spectrometer | Thermo Scientific | 726030 | |
| ReCO2ver Incubator | Baker | ||
| Refrigerated Centrivap Benchtop Vacuum Concentrator | Labconco | 7310020 | |
| RIPA Buffer | Millipore Sigma | 20188 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| SeQuant ZIC-pHILIC 5μm 150 x 2.1 mm analytical column | Sigma-Aldrich | 1.50460.0001 | |
| SeQuant ZIC-pHILIC guard kit | Millipore Sigma | 1.50438.0001 | |
| Sodium Hydroxide, Pellets | Millipore Sigma | 567530-250GM | |
| Sucrose | Sigma-Aldrich | S0389 | |
| SW, TRACEFINDER 5.1 SP3 | Thermo Scientific | OPTON-31001 | |
| Tert-butyl hydroperoxide solution | Sigma-Aldrich | 458139 | |
| Tris | Sigma-Aldrich | 93352 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25-200-114 | |
| Uridine | Sigma-Aldrich | U3003 | |
| VANQUISH HORIZON / FLEX HPLC | Thermo Scientific | VF-S01-A-02 | |
| Z2 Coulter Particle count and size analyzer | Beckman Coulter | BZ10131270 |
References
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 16080 (2016).
- Chandel, N. S., et al. Reactive oxygen species generated at mitochondrial complex III stabilize hypoxia-inducible factor-1alpha during hypoxia: A mechanism of O2 sensing. Journal of Biological Chemistry. 275 (33), 25130-25138 (2000).
- Cadenas, E., Boveris, A., Ragan, C. I., Stoppani, A. O. M. Production of superoxide radicals and hydrogen peroxide by NADH-ubiquinone reductase and ubiquinol-cytochrome C reductase from beef-heart mitochondria. Archives of Biochemistry and Biophysics. 180 (2), 248-257 (1977).
- Murphy, M. P. How mitochondria produce reactive oxygen species. Biochemical Journal. 417 (1), 1-13 (2009).
- Schieber, M., Chandel, N. S. ROS function in redox signaling and oxidative stress. Current Biology. 24 (10), 453-462 (2014).
- Spinelli, J. B., et al. Fumarate is a terminal electron acceptor in the mammalian electron transport chain. Science. 374 (6572), 1227-1237 (2021).
- Kumar, R., et al. A redox cycle with complex II prioritizes sulfide quinone oxidoreductase-dependent H(2)S oxidation. Journal of Biological Chemistry. 298 (1), 101435 (2022).
- Warburg, O., Geissler, A. W., Lorenz, S. On growth of cancer cells in media in which glucose is replaced by galactose. Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 348 (12), 1686-1687 (1967).
- Marroquin, L. D., Hynes, J., Dykens, J. A., Jamieson, J. D., Will, Y. Circumventing the Crabtree effect: replacing media glucose with galactose increases susceptibility of HepG2 cells to mitochondrial toxicants. Toxicological Sciences. 97 (2), 539-547 (2007).
- Attardi, G., King, M. P. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Bodnar, A. G., Cooper, M., Leonard, J. V., Schapira, A. H. Respiratory-deficient human fibroblasts exhibiting defective mitochondrial DNA replication. Biochemical Journal. 305, 817-822 (1995).
- Gregoire, M., Morais, R., Quilliam, M. A., Gravel, D. On auxotrophy for pyrimidines of respiration-deficient chick embryo cells. European Journal of Biochemistry. 142 (1), 49-55 (1984).
- Mackay, G. M., Zheng, L., vanden Broek, N. J., Gottlieb, E. Analysis of cell metabolism using LC-MS and isotope tracers. Methods in Enzymology. 561, 171-196 (2015).
- Heinrich, P., et al. Correcting for natural isotope abundance and tracer impurity in MS-, MS/MS- and high-resolution-multiple-tracer-data from stable isotope labeling experiments with IsoCorrectoR. Scientific Reports. 8 (1), 17910 (2018).
- Lee, P., Chandel, N. S., Simon, M. C. Cellular adaptation to hypoxia through hypoxia inducible factors and beyond. Nature Reviews Molecular Cell Biology. 21 (5), 268-283 (2020).
- Bisbach, C. M., et al. Succinate can shuttle reducing power from the hypoxic retina to the O(2)-rich pigment epithelium. Cell Reports. 31 (2), 107606 (2020).
- Angebault, C., et al. Idebenone increases mitochondrial complex I activity in fibroblasts from LHON patients while producing contradictory effects on respiration. BMC Research Notes. 4, 557 (2011).
- Liao, P. C., Bergamini, C., Fato, R., Pon, L. A., Pallotti, F. Isolation of mitochondria from cells and tissues. Methods in Cell Biology. 155, 3-31 (2020).
- Iwai, T., et al. Sodium accumulation during ischemia induces mitochondrial damage in perfused rat hearts. Cardiovascular Research. 55 (1), 141-149 (2002).
- Murphy, E., Eisner, D. A. Regulation of intracellular and mitochondrial sodium in health and disease. Circulation Research. 104 (3), 292-303 (2009).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), e52076 (2015).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Xiao, Y., Meierhofer, D. Are hydroethidine-based probes reliable for reactive oxygen species detection. Antioxidants and Redox Signaling. 31 (4), 359-367 (2019).
- DeBerardinis, R. J., et al. Beyond aerobic glycolysis: Transformed cells can engage in glutamine metabolism that exceeds the requirement for protein and nucleotide synthesis. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19345-19350 (2007).
- Keeley, T. P., Mann, G. E. Defining physiological normoxia for improved translation of cell physiology to animal models and humans. Physiological Reviews. 99 (1), 161-234 (2019).
- Ast, T., Mootha, V. K. Oxygen and mammalian cell culture: Are we repeating the experiment of Dr. Ox. Nature Metabolism. 1 (9), 858-860 (2019).
- Gu, C., Jun, J. C. Does hypoxia decrease the metabolic rate. Frontiers in Endocrinology. 9, 668 (2018).
- Voorde, J., et al. Improving the metabolic fidelity of cancer models with a physiological cell culture medium. Scientific Advances. 5 (1), 7314 (2019).
- Cantor, J. R., et al. Physiologic medium rewires cellular metabolism and reveals uric acid as an endogenous inhibitor of UMP synthase. Cell. 169 (2), 258-272 (2017).
- MacPherson, S., et al. Clinically relevant T cell expansion media activate distinct metabolic programs uncoupled from cellular function. Molecular Therapy. Methods and Clinical Development. 24, 380-393 (2022).
- Torres-Quesada, O., Doerrier, C., Strich, S., Gnaiger, E., Stefan, E. Physiological cell culture media tune mitochondrial bioenergetics and drug sensitivity in cancer cell models. Cancers. 14 (16), 3917 (2022).
- Chan, S. W., Chen, J. Z. Measuring mtDNA damage using a supercoiling-sensitive qPCR approach. Methods in Molecular Biology. 554, 183-197 (2009).
- Doherty, E., Perl, A. Measurement of mitochondrial mass by flow cytometry during oxidative stress. Reactive Oxygen Species. 4 (10), 275-283 (2017).
- Birsoy, K., et al. An essential role of the mitochondrial electron transport chain in cell proliferation is to enable aspartate synthesis. Cell. 162 (3), 540-551 (2015).
- Beigneux, A. P., et al. ATP-citrate lyase deficiency in the mouse. Journal of Biological Chemistry. 279 (10), 9557-9564 (2004).
- Gameiro, P. A., et al. In vivo HIF-mediated reductive carboxylation is regulated by citrate levels and sensitizes VHL-deficient cells to glutamine deprivation. Cell Metabolism. 17 (3), 372-385 (2013).
- Fendt, S. M., et al. Reductive glutamine metabolism is a function of the alpha-ketoglutarate to citrate ratio in cells. Nature Communications. 4, 2236 (2013).
- Lee, C. P. Biochemical studies of isolated mitochondria from normal and diseased tissues. Biochimica et Biophysica Acta. 1271 (1), 21-28 (1995).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved