Method Article
Sauerstoffunabhängige Assays zur Messung der mitochondrialen Funktion bei Säugetieren
In diesem Artikel
Zusammenfassung
Hier präsentieren wir eine Zusammenstellung von Assays zur direkten Messung der mitochondrialen Funktion in Säugetierzellen, unabhängig von ihrer Fähigkeit, molekularen Sauerstoff zu verbrauchen.
Zusammenfassung
Der Elektronenfluss in der mitochondrialen Elektronentransportkette (ETC) unterstützt vielfältige biosynthetische, bioenergetische und Signalfunktionen in Säugetierzellen. Da Sauerstoff (O2) der allgegenwärtigste terminale Elektronenakzeptor für die ETC von Säugetieren ist, wird dieO2-Verbrauchsrate häufig als Proxy für die mitochondriale Funktion verwendet. Neue Forschungsergebnisse zeigen jedoch, dass dieser Parameter nicht immer auf die mitochondriale Funktion hinweist, da Fumarat als alternativer Elektronenakzeptor eingesetzt werden kann, um mitochondriale Funktionen bei Hypoxie aufrechtzuerhalten. Dieser Artikel stellt eine Reihe von Protokollen zusammen, die es Forschern ermöglichen, die mitochondriale Funktion unabhängig von derO2-Verbrauchsrate zu messen. Diese Assays sind besonders nützlich, wenn es darum geht, die Funktion der Mitochondrien in hypoxischen Umgebungen zu untersuchen. Insbesondere beschreiben wir Methoden zur Messung der mitochondrialen ATP-Produktion, der de novo Pyrimidinbiosynthese, der NADH-Oxidation durch Komplex I und der Superoxidproduktion. In Kombination mit klassischen Respirometrie-Experimenten werden diese orthogonalen und ökonomischen Assays den Forschern eine umfassendere Bewertung der mitochondrialen Funktion in ihrem interessierenden System ermöglichen.
Einleitung
Die Funktion der Mitochondrien ist eine entscheidende Kennzahl für die Zellgesundheit, da sie wichtige biosynthetische, bioenergetische und Signalfunktionen in Säugetierzellen aufrechterhält1. Die überwiegende Mehrheit der mitochondrialen Funktionen erfordert den Elektronenfluss durch die Elektronentransportkette (ETC), und Störungen des Elektronenflusses im ETC verursachen schwere mitochondriale Erkrankungen2. Die ETC besteht aus einer Reihe von Reduktions- und Oxidationsreaktionen (Redoxreaktionen), die in die innere Mitochondrienmembran eingebettet sind, und diese Elektronentransferreaktionen setzen freie Energie frei, die zur Unterstützung der ATP-Synthese, physiologischer Prozesse wie der Thermogenese, Biosynthesewege wie der de novo Pyrimidinbiosynthese und des Gleichgewichts des Redoxstatus von Co-Faktoren wie NADH genutzt werden kann. Die ETC-Komplexe I und III produzieren reaktive Sauerstoffspezies (ROS)3,4,5, die wiederum wichtige Signalwege wie HIF, PI3K, NRF2, NFκB und MAPK 6 regulieren. Folglich werden Metriken des Elektronenflusses im ETC klassischerweise als Proxy für die mitochondriale Funktion in Säugetierzellen verwendet.
Respirometrie-Experimente werden häufig eingesetzt, um die mitochondriale Funktion in Säugetierzellen zu messen. Da O2 der am weitesten verbreitete terminale Elektronenakzeptor für die ETC von Säugetieren ist, wird seine Reduktion als Proxy für die mitochondriale Funktion verwendet. Neue Erkenntnisse zeigen jedoch, dass Mitochondrien von Säugetieren Fumarat als Elektronenakzeptor einsetzen können, um mitochondriale Funktionen aufrechtzuerhalten, die von der ETC abhängen, einschließlich der de novo Pyrimidinbiosynthese 7, der NADH-Oxidation7 und der Entgiftung von Schwefelwasserstoff8. Daher liefern Messungen derO2-Verbrauchsrate (OCR) in bestimmten Kontexten, insbesondere in hypoxischen Umgebungen, keinen präzisen oder genauen Hinweis auf die mitochondriale Funktion.
Hier skizzieren wir eine Reihe von Assays, die zur Messung der mitochondrialen Funktion unabhängig von der OCR eingesetzt werden können. Wir bieten Assays zur direkten Messung der komplexen I-vermittelten NADH-Oxidation, der Dihydroorotat-Dehydrogenase-vermittelten de novo Pyrimidinbiosynthese, der komplexen V-abhängigen ATP-Synthese, der Nettodirektionalität des Succinat-Dehydrogenase-Komplexes (SDH) und der mitochondrialen ROS an. Diese Assays sind für die Durchführung an kultivierten Säugetierzellen gedacht, obwohl viele angepasst werden können, um mitochondriale Funktionen in vivo zu untersuchen.Bemerkenswert ist, dass die in diesem Protokoll beschriebenen Assays direktere Messungen der mitochondrialen Funktionen sind als die OCR. Darüber hinaus ermöglichen sie die Messung der mitochondrialen Funktion bei Hypoxie, einem Kontext, in dem die OCR keine indikative Messung ist. Zusammengenommen werden diese Assays in Kombination mit klassischen Respirometrie-Experimenten den Forschern eine umfassendere Bewertung der mitochondrialen Funktion in Säugetierzellen ermöglichen.
Protokoll
1. Proliferationsassays zur Messung der Aktivität von Komplex-I-, Dihydroorotat-Dehydrogenase- (DHODH) und Komplex-V-Aktivitäten
- Aussaat von Zellen für Proliferationsassays
HINWEIS: Dieses Protokoll verwendet die humane Osteosarkom-Zelllinie 143B, die kommerziell von ATCC erworben wurde. Diese Zelllinie wurde gemäß den Richtlinien unseres genehmigten Protokolls des Institutional Biosafety Committee (IBC) verwendet.- Nehmen Sie die Platten aus dem Gewebekultur-Inkubator. Saugen Sie das Medium von den Platten ab und waschen Sie es mit 1x phosphatgepufferter Kochsalzlösung (PBS), um übrig gebliebenes Medium zu entfernen. Aspirieren Sie das PBS und bedecken Sie die Schale mit 0,05%-0,25% Trypsin, um die Zellen vom Boden der Platte abzuheben.
- Warten Sie 3-5 Minuten, bis das Trypsin die Zellen von der Platte freigesetzt hat, und löschen Sie dann das Trypsin mit 10 ml des gewünschten Wachstumsmediums, das 10 % fötales Kälberserum (FBS) enthält.
- Sammeln Sie die Zellen in einem konischen Röhrchen und zentrifugieren Sie sie 5 Minuten lang bei 1.000 × g , um die Zellen zu pelletieren.
- Saugen Sie das Medium aus dem Rohr ab, ohne das Pellet zu stören. Resuspendieren Sie das Pellet mit vollständigem Medium.
- Zählen Sie die Zellen und quantifizieren Sie das Volumen, das benötigt wird, um zwischen 10.000 und 25.000 Zellen in einer 6-Well-Platte zu säen.
HINWEIS: Jede Zelllinie muss für die Anzahl der zu säenden Zellen optimiert werden. Die ideale Konfluenz, die erreicht wird, beträgt ~10% zu Beginn des Experiments und ~80% am Ende des Experiments. - Pipettieren Sie die Zellen in eine 6-Well-Platte und geben Sie 2 ml des vollständigen Mediums in die Wells. 24 Stunden ruhen lassen, bevor auf die experimentellen Mediumbedingungen gewechselt wird.
HINWEIS: Säen Sie mindestens drei Replikate pro Bedingung und genügend Vertiefungen, um die unbehandelte Kontrollbedingung, die mit Inhibitoren behandelte Kontrollbedingung, die unbehandelte experimentelle Bedingung und die mit Inhibitoren behandelte experimentelle Bedingung zu testen.
- Mittlere Veränderung zur Beurteilung der komplexen V-Aktivität durch Proliferation
HINWEIS: Zellen, die sich in einem Medium mit Galaktose vermehren, sind für die ATP-Synthese von der Aktivität des Komplexes V abhängig 9,10. Im Gegensatz zu Glukose, die aus der Glykolyse netto zwei ATP liefert, liefert Galaktose keine, was die Zellen dazu zwingt, für die ATP-Synthese vom Komplex V abhängig zu sein (Abbildung 1). Als Kontrolle wird der Komplex-V-Inhibitor Oligomycin verwendet.- Stellen Sie 10 mM glukosehaltiges Medium her (siehe Tabelle 1).
- Stellen Sie 10 mM galaktosehaltiges Medium her (siehe Tabelle 1).
- Wechseln Sie das Medium in jeder Vertiefung entweder zu glukosehaltigem DMEM oder galaktosehaltigem DMEM. Geben Sie 5 μM Oligomycin (den Komplex-V-Inhibitor) in die entsprechenden Vertiefungen und die gleiche Menge DMSO in die unbehandelten Vertiefungen. Der Oligomycin-Bestand wird mit 10 mM in DMSO resuspendiert. Legen Sie die Platte für 2 Tage wieder in den Gewebekultur-Inkubator.
- Mittlere Veränderung zur Beurteilung der Komplex-I-Aktivität durch Proliferation
HINWEIS: Zellen, die sich in einem pyruvatfreien Medium vermehren, sind stärker auf die Aktivität von Komplex Iangewiesen 11,12. Ohne Pyruvat benötigen die kultivierten Zellen Komplex I, um den Großteil der NADH-Reoxidation zurück zu NAD+ zu ermöglichen (Abbildung 2). Als Kontrolle wird der Komplex-I-Inhibitor Rotenon verwendet.- Stellen Sie pyruvatfreies DMEM-Medium her, das mit 10 % FBS und 1 % Penicillin-Streptomycin ergänzt wird.
- Stellen Sie eine 1 M große Pyruvatlösung her (siehe Tabelle 1).
- Wechseln Sie das Medium in jeder Vertiefung entweder zu pyruvatfreiem oder zu pyruvathaltigem Medium. Geben Sie 2 μM Rotenon (den Komplex-I-Inhibitor) in die behandelten Vertiefungen und das gleiche Volumen DMSO in die unbehandelten Vertiefungen. Der Rotenonvorrat ist 25 mM in DMSO resuspendiert. Legen Sie die Platte für 2 Tage wieder in den Gewebekultur-Inkubator.
- Mittlere Veränderung zur Beurteilung der DHODH-Aktivität durch Proliferation
HINWEIS: Zellen, die sich in einem uridinfreien Medium vermehren, erfordern die Aktivität der Dihydroorotat-Dehydrogenase (DHODH)11,12,13. In Abwesenheit von exogenem Uridin synthetisieren die kultivierten Zellen Pyrimidine über den De-novo-Weg. Als Kontrolle wird der DHODH-Inhibitor Brequinar verwendet.- Stellen Sie uridinfreies DMEM her, das mit 10 % FBS und 1 % Penicillin-Streptomycin ergänzt wird.
- Stellen Sie eine 10 mg/ml Uridin-Stammlösung her und bereiten Sie dann ein 100 μg/ml Uridin-Medium vor (siehe Tabelle 1).
- Wechseln Sie das Medium in jeder Vertiefung zu uridinfreiem oder uridinhaltigem Medium. Geben Sie 5 μM Brequinar (den DHODH-Inhibitor) in die behandelten Vertiefungen und die gleiche Menge DMSO in die unbehandelten Vertiefungen. Der brequinare Schaft ist 10 mM in DMSO resuspendiert. Legen Sie die Platte für 2 Tage wieder in den Gewebekultur-Inkubator.
- Zählung der Zellen für Proliferationsassays
- Füllen Sie das Medium für alle Experimente alle 2 Tage auf. Wenn sich das Medium gelb verfärbt, erhöhen Sie die Frequenz der Medienwechsel. Lassen Sie die Zellen bis zu 7 Tage lang vermehren und stoppen Sie das Experiment, wenn einer der Brunnen überwuchert aussieht. Brunnen gelten als überwuchert, wenn der Zusammenfluss 80 % überschreitet.
- Saugen Sie das Medium ab, waschen Sie es mit 1x PBS und bedecken Sie den Boden der Vertiefung mit 0,25 % Trypsin (500 μl für eine 6-Well-Schale).
- Warten Sie 5 Minuten, bis sich die Zellen von der Schüssel abgehoben haben. Überprüfen Sie dies unter dem Mikroskop.
- Das Trypsin wird mit 1 ml vollständigem DMEM mit 10 % FBS abgeschreckt.
- Pipettieren Sie auf und ab, um die Zellklumpen aufzubrechen.
- Bereiten Sie Coulter-Zählbecher vor, indem Sie sie jeweils mit 10 ml Isotonpuffer füllen (ein Becher pro Well). Zählen Sie die Zellen auf einem Zellzähler, und zeichnen Sie die Daten auf. Wenn die Anzeige Zellen pro Milliliter (Zellen/ml) ist, multiplizieren Sie den aufgezeichneten Wert mit 1,5, um die Gesamtzahl der Zellen pro Well zu erhalten.
HINWEIS: Andere Zellzählmethoden wie ein Hämozytometer reichen aus, wenn das Labor nicht über einen Coulter-Zähler verfügt.
2. 13C4-Aspartat-Stabilisotopenverfolgung und LC-MS-Analyse zur Messung der DHODH-Aktivität
- 13C4-Aspartat-Stabilisotopenverfolgung in adhärenten Zellen
HINWEIS: Die DHODH-Aktivität kann direkt überwacht werden, indem der Einbau von 13 C 4-Aspartat in 13C3-UMP gemessen wird. Brequinar wird als Kontrolle für die DHODH-Aktivität verwendet (Abbildung 3). Die resultierenden Konzentrationen von 13C3-UMP sind ein Maß für die DHODH-Aktivität.- Säen Sie zwischen 250.000 und 500.000 Zellen in einer 6-Well-Schale, um am nächsten Tag eine 75%ige Konfluenz zu erreichen.
- Bereiten Sie eine Stammlösung aus 250 mM 13 C 4-Aspartat und 10 mM 13C 4-Aspartat Medium vor (siehe Tabelle 1).
- Wechseln Sie das Medium in jeder Vertiefung in ein Medium, das 10 mM 13C4-Aspartat enthält. Inkubieren Sie für die entsprechende Anzahl von Stunden, um einen stabilen Zustand für die Markierung der interessierenden Zellen zu erreichen.
HINWEIS: Der stationäre Zustand ist definiert als der Zeitrahmen, in dem der Prozentsatz des markierten Metaboliten im Laufe der Zeitstagniert 14. Bei 143B-Osteosarkomzellen erreicht 13C-4-Aspartat nach 8 h einen stationären Zustand. Es empfiehlt sich, diesen Zeitrahmen vor dem Experiment zu bestimmen, indem ein Zeitverlaufsexperiment mit dem interessierenden stabilen Isotop durchgeführt wird.
- Isolierung von Metaboliten aus den adhärenten Zellen
- Bereiten Sie vor Beginn einen Eimer Trockeneis vor und bereiten Sie 80 % MeOH in HPLC-Qualität in HPLC-Wasser vor. Kühlen Sie diesen Puffer über Nacht in einem Gefrierschrank von −80 °C ab oder legen Sie ihn direkt auf Trockeneis.
- Nehmen Sie jeweils eine Platte aus dem Inkubator, saugen Sie das Medium aus den Vertiefungen und waschen Sie es 2x mit 1x PBS. Entfernen Sie alle PBS-Reste aus den Vertiefungen, bevor Sie mit dem nächsten Schritt fortfahren.
Anmerkungen: Achten Sie darauf, die Platte während der Aspiration zu kippen und gegen die Wand der Schale zu pipettieren, um eine Störung der anhaftenden Zellen zu vermeiden. - Stellen Sie die Platte auf Trockeneis und geben Sie sofort 800 μl 80 μl 80 % LCMS-MeOH in 20 % LCMS-Wasser in jede Vertiefung.
- Inkubieren Sie die Platte mindestens 15 Minuten lang in einem Gefrierschrank von −80 °C, um die Zelllyse zu erleichtern.
HINWEIS: An dieser Stelle kann die nächste Platte aus dem Inkubator genommen und die Schritte 2.2.1-2.2.4 wiederholt werden. Fahren Sie damit fort, bis alle Platten im Gefrierschrank −80 °C inkubiert sind. - Nehmen Sie jeweils eine Platte aus dem Gefrierschrank, kratzen Sie jede Vertiefung mit einem Zellheber auf Trockeneis ab und geben Sie das Lysat in ein 1,5-ml-Mikrozentrifugenröhrchen. Bewahren Sie den Schlauch bis zum nächsten Schritt auf Trockeneis auf.
- Alle Röhrchen 10 min bei 4 °C vortexen und dann 10 min bei maximaler Geschwindigkeit (mindestens 17.000 × g) bei 4 °C zentrifugieren.
- Der Überstand wird in ein 1,5-ml-Mikrozentrifugenröhrchen überführt und in einem 4 °C-Vakuumkonzentrator mit einer Kühlfalle von −105 °C bei Hochvakuumeinstellung für ca. 6 h getrocknet oder bis die Proben verdampft sind. Sobald das Lysat getrocknet ist, lagern Sie die Metabolitenpellets bei −80 °C, bis sie für die Flüssigkeitschromatographie in Verbindung mit Massenspektrometrie (LCMS) vorbereitet werden können.
- Flüssigkeitschromatographie-Massenspektrometrie (LC-MS) Messung von polaren Metaboliten
HINWEIS: Jeder chromatographische und massenspektrometrische Arbeitsablauf, der den Nachweis von Aspartat, den Zwischenprodukten in der de novo Pyrimidinbiosynthese und UMP ermöglicht, reicht aus14.- Bereiten Sie die Proben für die LCMS auf Eis vor, indem Sie den getrockneten Pellets 100 μl Wasser in HPLC-Qualität hinzufügen und 10 Minuten lang bei 4 °C wirbeln.
- Zentrifugieren Sie die Proben bei 4 °C für 10 Minuten bei maximaler Geschwindigkeit (mindestens 17.000 × g) und geben Sie 25 μl in jedes LC-MS-Fläschchen.
- Injizieren Sie 2 μl Lysat in das LC-MS-System. Im Folgenden finden Sie eine häufig verwendete Methodik:
- Bereiten Sie die mobile Phase A vor, die 20 mM Ammoniumcarbonat (LC-MS-Qualität) und 0,1 % Ammoniumhydroxid (LC-MS-Qualität) enthält, gelöst in Wasser der LC-MS-Qualität.
- Wählen Sie 100 % Acetonitril (LC-MS-Qualität) als mobile Phase B.
- Wählen Sie für die Chromatographie eine 5 μm, 150 mm x 2,1 mm große Analysesäule, die mit einer 2,1 mm x 20 mm großen Schutzsäule für hydrophile Verbindungen ausgestattet ist (siehe Materialtabelle). Stellen Sie den Säulenofen auf 25 °C ein.
- Verwenden Sie die folgenden Einstellungen für die Flüssigkeitschromatographie: eine konstante Flussrate von 0,15 ml/min; ein linearer Gradient von 80 % bis 20 % Mobile Phase B für 20 min, gefolgt von einem linearen Gradienten von 20 % bis 80 % Mobile Phase B für 0,5 min, gefolgt von einem Halten bei 80 % Mobile Phase B für 7,5 min.
- Wählen Sie die folgenden Massenspektrometereinstellungen: ein vollständiger Scan zwischen m/z 70 Da und 1.000 Da; eine Auflösung von 70.000; ein AGC-Ziel von 1 × 106; und eine maximale Einspritzzeit von 20 ms. Betreiben Sie die Quelle im Polaritätsumschaltmodus. Stellen Sie die Sprühspannung auf 3,0 kV, die beheizte Kapillare auf 275 °C, die HESI-Sonde auf 350 °C, den Mantelgasstrom auf 40 Einheiten, den Hilfsgasfluss auf 15 Einheiten und den Sweep-Gasstrom auf 1 Einheit ein.
- Führen Sie die Datenanalyse mit einer beliebigen Software durch, die mit dem LCMS-Workflow verbunden ist.
HINWEIS: Die Software, die für den oben genannten Workflow verwendet wird, sind XCalibur (Thermo) und TraceFinder (Thermo). Die wichtigsten Überlegungen für die Datenanalyse werden im Folgenden skizziert:- Erwartete Aufbewahrungszeiten: Bestimmen Sie die Retentionszeit jedes Metaboliten, indem Sie vor dem Experiment die Standards für jeden interessierenden Metaboliten mit der chromatographischen Methode ausführen.
ANMERKUNG: Die Retentionszeiten von UMP und seinen Isotopologen, einschließlich 13C3-UMP, sind exakt gleich. - Erwartete M/Z für Metaboliten: Wenn ein Metabolit im negativen Ionenmodus (z. B. UMP) ionisiert, berechnen Sie die erwartete exakte Masse mit der Summenformel UMP minus einem Proton [C 9 H14N2O9P]. Berechnen Sie für Metaboliten, die im positiven Ionenmodus ionisieren, die genaue Masse, indem Sie die Summenformel plus ein Proton verwenden.
- Masse-Genauigkeit: Bei Verwendung eines Orbitrap-Massenspektrometers wird erwartet, dass der interessierende Metabolit und seine Isotopologen eine Massengenauigkeit von ±5 mmu aufweisen. Verwenden Sie eine Software, um dies zu berechnen, wobei die erwartete M/Z und die tatsächlich erkannte M/Z berücksichtigt werden.
- Korrektur der natürlichen Abundanz: Es wird erwartet, dass alle Rückverfolgungsdaten einer Korrektur der natürlichen Häufigkeit unterzogen werden, um die ~1 % 13C und ~ 0,5 % 15 N-Isotope in der Natur zu berücksichtigen 15.
- Erwartete Aufbewahrungszeiten: Bestimmen Sie die Retentionszeit jedes Metaboliten, indem Sie vor dem Experiment die Standards für jeden interessierenden Metaboliten mit der chromatographischen Methode ausführen.
3. 13C-5-Glutamin-Stabilisotopenverfolgung zur Messung derSDH-Aktivität
- 13Verfolgung stabiler C5-Glutamin-Isotope in adhärenten Zellen
HINWEIS: Die SDH-Aktivität kann direkt überwacht werden, indem die Interkonversion bestimmter Isotopologen von Fumarat und Succinat auf 13 C 5-Glutamingemessen wird, um 7,16,17 zu verfolgen. Der Komplex-III-Inhibitor Antimycin wird als Kontrolle verwendet, um die Netto-Richtwirkung des SDH-Komplexes zu verändern (Abbildung 4).- Säen Sie zwischen 250.000 und 500.000 Zellen in einer 6-Well-Schale, um am nächsten Tag eine 75%ige Konfluenz zu erreichen.
- Bereiten Sie einen Vorrat von 50 mM 13C 5-Glutamin vor (siehe Tabelle 1).
- Begleitmedium mit 2 mM 13C 5-Glutamin ist herzustellen (siehe Tabelle 1).
- Wechseln Sie das Medium in jeder Vertiefung zu einem Medium, das 2 mM 13C 5-Glutamin enthält. Inkubieren Sie für die entsprechende Anzahl von Stunden, um einen stabilen Zustand der Markierung der interessierenden Zellen zu erreichen (siehe Hinweis in Schritt 2.1.3).
- Isolieren Sie die Metaboliten gemäß dem Protokoll in Schritt 2.2.
- Analysieren Sie die Proben auf LC-MS gemäß dem in Schritt 2.3 beschriebenen Arbeitsablauf.
- Analyse der SDH-Aktivität auf der Grundlage von Beschriftungsmustern
ANMERKUNG: Die Succinat-Oxidationsaktivität des SDH-Komplexes kann überwacht werden, indem das Verhältnis von 13C4-Fumarat zu 13 C4-Succinat nach 13C5-Glutamin bestimmt wird. Die Fumaratreduktionsaktivität des SDH-Komplexes kann durch die Bestimmung des Verhältnisses von 13 C3-Succinat zu 13C3-Fumarat bei der Verfolgung von 13C5-Glutamin überwacht werden.- Berechnen Sie die prozentuale Markierung von 13 C 3-Fumarat, 13 C 4-Fumarat, 13 C3-Succinat und 13 C4-Succinat. Um z. B. den Prozentsatz von 13 C-3-Fumarat zu bestimmen, summieren Sie alle integrierten Peakflächen für die Fumarat-Isotopologen (unmarkiertes Fumarat, 13 C-1-Fumarat, 13 C-2-Fumarat, 13 C-3-Fumarat und 13C4-Fumarat) und dividieren Sie die Peakfläche für 13 C3-Fumaratdurch die gesamte Isotopologfläche. Multipliziere mit 100.
- Um die Succinatoxidation zu berechnen, dividieren Sie den Prozentsatz 13 C 4-Fumarat durch den Prozentsatz 13C 4-Succinat.
- Um die Fumaratreduktion zu berechnen, dividieren Sie den Prozentsatz 13 C 3-Succinat durch den Prozentsatz 13C 3-Fumarat.
4. Direkter Komplex-I-Aktivitäts-Assay
HINWEIS: DCPIP ist ein künstlicher Elektronenakzeptor; Es wechselt in seine reduzierte Form, wenn es Elektronen aus Ubiquinol aufnimmt. In diesem Assay wird Ubichinon durch die komplexe I-vermittelte Oxidation von NADH zu NAD+ zu Ubiquinol reduziert. Daher ist die Messung des Umsatzes von oxidiertem DCPIP in diesem zellfreien Assay ein Proxy für die Aktivität von Komplex I 7,18.
- Reinigung und Quantifizierung der Mitochondrien aus Zellen
HINWEIS: Für diesen Assay kann jedes mitochondriale Reinigungsprotokoll verwendet werden19.- Erweitern Sie die Zellen, bis 25-100 Millionen Zellen erhalten sind. Das Medium vom Geschirr absaugen, mit 1x PBS waschen, das PBS absaugen und die Zellen mit 0,25% Trypsin tryspinnisieren. Das Trypsin mit Nährmedium abschrecken und die Zellen 5 Minuten lang bei 1.000 × g pelletieren.
- Waschen Sie die Zellpellets 2x in 5 ml 1x PBS und wiederholen Sie die Zentrifugation bei 1.000 × g für 5 Minuten, um die Zellen zu pelletieren. Lagern Sie die gewaschenen Pellets bis zur mitochondrialen Reinigung in einem Gefrierschrank bei −20 °C.
Anmerkungen: Tauen Sie die Zellpellets nicht mehr als einmal ein. - Bereiten Sie einen Mitochondrien-Isolationspuffer vor (siehe Tabelle 1).
HINWEIS: Natriumhaltige Reagenzien wie NaOH sollten nicht zur Herstellung von Mitochondrien-Isolationspuffern verwendet werden, da Natrium das mitochondriale Membranpotential20 angreift und die mitochondriale Kalziumhomöostase21 stört. - Resuspendieren Sie die Zellpellets auf 10 Millionen Zellen pro 1 ml Mitochondrien-Isolationspuffer. Resuspendieren Sie beispielsweise 100 Millionen pelletierte Zellen in 10 ml Mitochondrien-Isolationspuffer.
Anmerkungen: Achten Sie darauf, die Zellklumpen zu unterbrechen, ohne Blasen in den Puffer zu bringen. - Geben Sie 2 ml Zellsuspension in einen vorgekühlten Glashomogenisator mit einem Arbeitsvolumen von 3-8 ml, der mit einem Potter-Elvehjem-PTFE-Stößel kompatibel ist. Homogenisieren Sie die Zellen mit 10-20 Hüben und überwachen Sie die Zellen unter einem Mikroskop, um die Zelllyse während des gesamten Homogenisierungsprozesses zu bestätigen. Erhöhen Sie bei Bedarf die Anzahl der Hübe, um eine effiziente Zelllyse zu gewährleisten.
HINWEIS: Wenn das Homogenisieren der Zellen mit der oben genannten Methode für die Lyse der Zellen nicht wirksam ist, wechseln Sie zu einer Spritzenlysemethode22. - Übertragen Sie 2 ml des Zelllysats in ein Mikrozentrifugenröhrchen auf Eis und wiederholen Sie die obigen Schritte, bis die gesamte Zellsuspension homogenisiert ist.
- Pelletieren Sie die Zellkerne und Zelltrümmer bei 650 × g für 10 min in einer 4 °C-Zentrifuge.
- Den Überstand in ein neues 2,0-ml-Röhrchen geben und die obige Zentrifugation bei 650 × g für 10 min bei 4 °C wiederholen.
- Verschieben Sie den Überstand in ein neues 2,0-ml-Röhrchen und pelletieren Sie die rohen Mitochondrien bei 7.000 × g für 10 Minuten in einer 4 °C-Zentrifuge.
- Verwerfen Sie den Überstand und resuspendieren Sie das Pellet in 1 ml Mitochondrien-Isolationspuffer. Geben Sie 50 μl zur Proteinquantifizierung in ein neues Röhrchen. Wiederholen Sie den obigen Zentrifugationsschritt an den beiden Aliquoten der Probe (die 50-μl-Probe und die restlichen ~950 μl).
- Entsorgen Sie den Überstand und lagern Sie die Pellets bis zur Verwendung in einem Gefrierschrank von −80 °C.
- Fügen Sie den Pellets 200 μl RIPA-Puffer aus dem 50-μl-Aliquot hinzu, um das Protein zu extrahieren, wirbeln Sie 10 Minuten lang vor und zentrifugieren Sie es bei 21.000 × g , um das Protein zu isolieren. Quantifizieren Sie die Proteinmenge in der 50-μl-Aliquote und verwenden Sie diese Zahl, um das verbleibende Protein in der 950-μl-Probe zu quantifizieren. Wenn beispielsweise die Proteinquantifizierung für das 50-μl-Aliquot 1 μg/μl beträgt, beträgt das Gesamtprotein im verbleibenden mitochondrialen Pellet 950 μg (1 μg/μl × 950 μl).
- Durchführung des Komplex-I-Aktivitäts-Assays
HINWEIS: Für diesen Assay wurde die Osteosarkom-Zelllinie 143B verwendet, aber das Protokoll kann für alle kultivierten Zellen angepasst werden.- Resuspendieren Sie gereinigte Mitochondrien im Mitochondrien-Resuspensionspuffer (siehe Tabelle 1) auf eine Endkonzentration von 5 mg Protein/ml.
- Führen Sie fünf Gefrier-/Auftauzyklen in einem Gefrierschrank von −20 °C durch, um die Mitochondrien zu permeabilisieren.
- Erstellen Sie den Assay-Puffer für die komplexe I-Aktivität (siehe Tabelle 1).
- Mischen Sie 50 μg des 5 mg/ml Mitochondrienstamms mit 90 μl Komplex-I-Aktivitätspuffer. Bereiten Sie fünf unbehandelte Replikate und fünf mit Rotenon behandelte (5 μM) Replikate zur Kontrolle der Komplex-I-Aktivität vor.
- Messen Sie die Basislinienabsorption bei 600 nm in einem auf 37 °C eingestellten Plattenleser ab.
- Initiieren Sie die Reaktion, indem Sie NADH zu einer Endkonzentration von 2 mM hinzufügen und die Absorption (600 nm) über einen Zeitraum von 1 h verfolgen, wobei Sie mindestens alle 2 Minuten messen. Die Abnahme der Absorption deutet auf eine Reduktion von DCPIP durch Komplex-I-Aktivität hin.
Anmerkungen: Die NADH sollte mit einer Mehrkanalpipette zugegeben werden, um sicherzustellen, dass alle Proben gleichzeitig initiiert werden.
5. LC-MS-basierter Assay zur Messung des Superoxidgehalts
HINWEIS: Die Fluoreszenzeigenschaften von MitoSox Red können sich unabhängig von seiner Reaktion mit Superoxid23 ändern. Dieser LC-MS-basierte Assay misst direkt das Produkt aus Superoxid, das mit MitoSox-Rot reagiert. Der folgende Assay ist leicht modifiziert von Xiao et al.24. 2-Hydroxy-Mitoethidium (2-OH MitoE2+) ist das Produkt der Superoxidreaktion (Abbildung 5). Für diesen Assay wurde die Caki1-Zelllinie verwendet, aber das Protokoll kann für alle kultivierten Zellen angepasst werden.
- Adhärente Zellen mit MitoSox Red behandeln
- Säen Sie zwischen 250.000 und 500.000 Zellen in einer 6-Well-Schale, um am nächsten Tag eine 75%ige Konfluenz zu erreichen. Stellen Sie sicher, dass Sie einen Satz Platten für den LC-MS-Assay und einen doppelten Satz von Platten für die Normalisierung der Zellzahl anlegen.
- Bereiten Sie ein vollständiges DMEM vor, das 10 % hitzeinaktiviertes FBS und 1 % Penicillin-Streptomycin in Dulbeccos modifiziertem Eagle-Medium enthält.
- Erneuern Sie das Medium in allen Vertiefungen für alle Bedingungen mit 2 ml vollständigem DMEM. Stellen Sie sicher, dass Sie an dieser Stelle alle Medikamente oder Behandlungen hinzufügen, die für Sie von Interesse sind.
- Inkubieren Sie die Zellen 1 h lang in einem Gewebekultur-Inkubator.
- Bereiten Sie Positiv- und Negativkontrollen vor. Bereiten Sie einen Vorrat von 50 mM tert-Butylhydroperoxid, verdünnt in PBS, und einen Vorrat von 250 mM, N-Acetylcystein (NAC), verdünnt in DMSO vor (siehe Tabelle 1).
HINWEIS: Tertbutylhydroperoxid (tBuOOH) ist eine starke reaktive Sauerstoffspezies, die als Positivkontrolle fungiert und die Menge des 2-OH MitoE2+ erhöht. NAC ist ein starkes Antioxidans, das als Negativkontrolle wirkt und die durch tBuOOH verursachte Superoxidproduktion neutralisiert. - Geben Sie 1 μl tBuOOH in die Positivkontrollvertiefungen und 1 μl tBuOOH + 100 μl NAC in die Negativkontrollvertiefungen.
Anmerkungen: Die Verwendung einer P2-Pipette (0,1-2 μl Bereich) ist die optimale Methode, um 1 μl zu übertragen. - 1 h in einem Gewebekultur-Inkubator inkubieren.
- Bereiten Sie 1 mM MitoSox Red-Brühe vor (siehe Tabelle 1) und geben Sie 2 μl 1 mM MitoSox-Rot in jede Vertiefung, um eine Endkonzentration von 1 μM zu erreichen. 30 Minuten in einem Gewebekultur-Inkubator inkubieren.
- Zählen Sie während dieser letzten Inkubation eine der doppelten Platten, um die Zellzahlen zu erfassen und die endgültigen LC-MS-Daten zu normalisieren.
- Isolierung des oxidierten Mitosox-Red-Produkts aus den adhärenten Zellen
- Holen Sie sich einen Eimer Trockeneis und legen Sie kühles Isopropanol in HPLC-Qualität auf das Trockeneis, bevor Sie mit der Isolierung beginnen.
- Nehmen Sie jeweils eine Platte heraus, saugen Sie das Medium aus den Vertiefungen ab und waschen Sie es 2x mit 1 ml 1x PBS. Saugen Sie alle verbleibenden PBS aus den Bohrlöchern ab, bevor Sie mit dem nächsten Schritt fortfahren.
Anmerkungen: Achten Sie darauf, die Platte während der Aspiration zu kippen und gegen die Wand der Schale zu pipettieren, um eine Störung der anhaftenden Zellen zu vermeiden. - Stellen Sie die Platte auf Trockeneis und geben Sie 800 μl Isopropanol in HPLC-Qualität in jede Vertiefung.
- Inkubieren Sie die Platte mindestens 15 Minuten lang in einem Gefrierschrank von −80 °C, um die Zelllyse zu erleichtern.
HINWEIS: An dieser Stelle kann die nächste Platte aus dem Inkubator genommen und die Schritte 5.2.1-5.2.4 wiederholt werden. Fahren Sie damit fort, bis alle Platten im Gefrierschrank −80 °C inkubiert sind. - Nehmen Sie jeweils eine Platte aus dem Gefrierschrank, kratzen Sie jede Vertiefung mit einem Zellenheber auf Trockeneis ab und geben Sie das Lysat in ein 1,5-ml-Mikrozentrifugenröhrchen. Bewahren Sie den Schlauch bis zum nächsten Schritt auf Trockeneis auf.
- Alle Röhrchen 10 min bei 4 °C vortexen und dann 10 min bei maximaler Geschwindigkeit (mindestens 17.000 × g) bei 4 °C zentrifugieren.
- Übertragen Sie den Überstand in ein 1,5-ml-Mikrozentrifugenröhrchen und trocknen Sie ihn in einem Vakuumkonzentrator. Sobald das Lysat getrocknet ist, lagern Sie die Metabolitenpellets bei −80 °C, bis sie für die LC-MS bereit sind.
Ergebnisse
Die Aktivitäten von DHODH, Komplex I und Komplex V können alle mit Hilfe von Proliferationsassays bewertet werden. Nach dem Entzug von Uridin aus dem Nährmedium werden die Zellen für die Pyrimidinbiosynthese abhängiger vom de novo Weg. Wenn Zellen also aufgefordert wurden, sich in einem uridinfreien Medium zu vermehren, reagierten sie empfindlicher auf die Hemmung der DHODH-Aktivität durch Brequinar als Zellen, die in einem uridinhaltigen Medium kultiviert wurden (Abbildung 6A). In ähnlicher Weise macht der Entzug von Pyruvat aus dem Nährmedium die Zellen abhängiger von der Aktivität des Komplexes I für die Proliferation. Wenn Zellen also aufgefordert wurden, sich in einem pyruvatfreien Medium zu vermehren, reagierten sie empfindlicher auf die Hemmung der Komplex-I-Aktivität durch Rotenon als Zellen, die in einem Pyruvat-haltigen Medium kultiviert wurden (Abbildung 6B). Die Aktivität des Komplexes V kann beurteilt werden, indem Zellen aufgefordert werden, sich in einem Medium zu vermehren, das Galaktose anstelle von Glukose enthält. Da Galaktose in der Glykolyse Netto-Null-ATP liefert, sind Zellen, die in diesem Brennstoff wachsen, stärker auf die mitochondriale ATP-Synthese über die Komplex-V-Aktivität angewiesen. Daher waren Zellen, die sich in einem galaktosehaltigen Medium vermehrten, empfindlicher auf die Hemmung des Komplexes V durch Oligomycin als Zellen, die sich in einem glukosehaltigen Medium vermehrten (Abbildung 6C).
Die SDH-Aktivität kann mit Hilfe von 13C-5-Glutamin-Tracing und durch Überwachung des Einbaus in Fumarat- und Succinat-Isotopologen gemessen werden. Unter fahrzeugbehandelten Bedingungen begünstigte der SDH-Komplex die Vorwärtsaktivität, und der Einbau von 13 C 4-Succinat in 13 C4-Fumarat war höher als der Einbau von 13 C 3-Fumarat in 13C 3-Succinat (Abbildung 7). Unter Antimycin-behandelten Bedingungen begünstigte der SDH-Komplex die umgekehrte Aktivität, und der Einbau von 13 C-3-Fumarat in 13 C-3-Succinat war größer als der Einbau von 13 C-4-Succinat in 13 C4-Fumarat (Abbildung 7).
Die Superoxidproduktion in den Mitochondrien kann mit dem Fluoreszenzreporter MitoSox gemessen werden, der bei Reaktion mit Superoxid 2-Hydroxy-Mitoethidium erzeugt. In dieser Studie wiesen Zellen, die mit MitoSox in Gegenwart von Tertbutylwasserstoffperoxid behandelt wurden, höhere Konzentrationen von 2-Hydroxy-Mitoethidium auf, die durch die Zugabe von NAC, einem Antioxidans, das zelluläre ROS löscht, unterdrückt wurde (Abbildung 8).
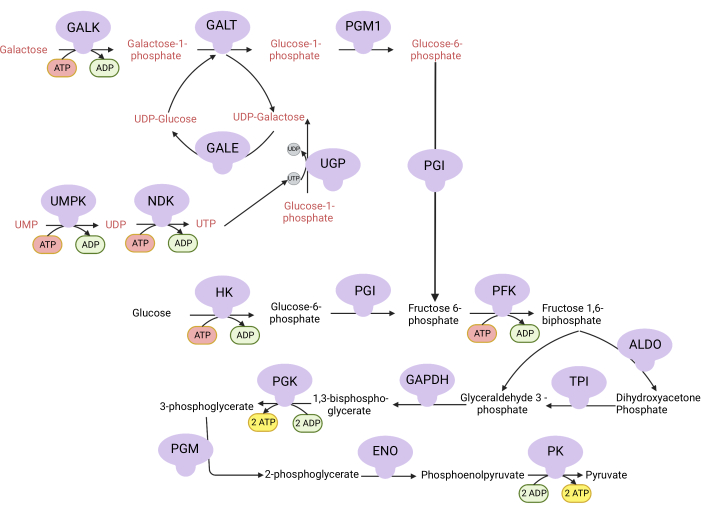
Abbildung 1: Mechanistische Grundlage für den komplexen V-Proliferations-Assay. Oxidation von Glukose und Galaktose durch Glykolyse. Glukose liefert netto zwei ATP aus der Glykolyse, während Galaktose netto null ATP liefert, da die UTP-Synthese für UDP-Galaktose erforderlich ist. Daher sind Zellen, die in Galaktose gezüchtet werden, aufgrund eines Mangels an ATP, das aus der Glykolyse hergestellt wird, stärker von der mitochondrialen ATP-Synthese abhängig. Abkürzungen: GALK = Galactokinase; GALT = Galaktose-1-phosphat-Uridylyltransferase; PGM1 = Phosphoglucomutase 1; GPI = Glucose-6-phosphat-Isomerase, UGP = UDP-Glucose-Pyrophosphorylase; GALE = UDP-Galaktose-4-Epimerase; NDK = Nukleotid-Diphosphat-Kinase; UMPK = Uridinmonophosphat-Kinase; HK = Hexokinase; PFK = Phosphofructokinase; ALDO = Aldolase; TPI = Triosephosphat-Isomerase; GAPDH = Glycerinaldehyd-3-phosphat-Dehydrogenase; PGK = Phosphoglyceratkinase; PGM = Phosphoglucomutase; ENO = enolase; PK = Pyruvatkinase. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
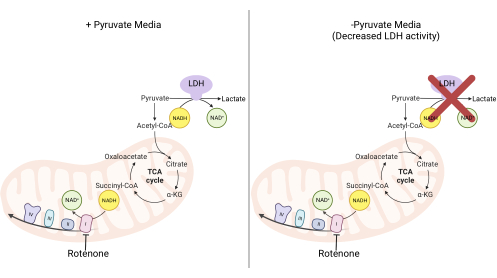
Abbildung 2: Mechanistische Grundlage für den Komplex-I-Proliferationsassay. Schematische Darstellung der Stoffwechselwege, die durch die Hemmung der Komplex-I-Aktivität verändert werden. In Medien mit hohem Pyruvatgehalt wird die Komplex-I-Hemmung durch LDH-vermittelte NADH-Oxidation umgangen. In Medien mit niedrigem Pyruvatgehalt ist diese Anpassung weniger durchführbar, so dass die Zellen stärker auf die Aktivität des Komplexes I angewiesen sind, um NADH zu reoxidieren. Abkürzungen: LDH = Laktatdehydrogenase; TCA-Zyklus = Tricarbonsäure-Zyklus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
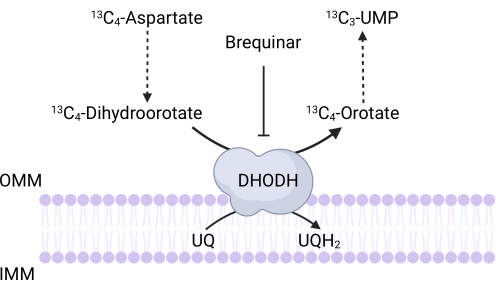
Abbildung 3: Schematische Darstellung der DHODH-Reaktion bei 13C4-Aspartat-Tracing. Brequinar hemmt die Oxidation von Dihydroorotat zu Orotat und verhindert so die nachgeschaltete Synthese von UMP. 13C4-Aspartat wird über DHODH-Aktivität in 13 C3-UMPeingebaut. Abkürzungen: OMM = äußere Mitochondrienmembran; IMM = innere Mitochondrienmembran; DHODH = Dihydroorotat-Dehydrogenase. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
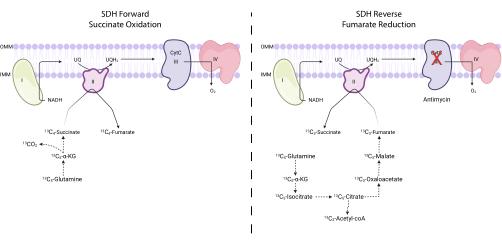
Abbildung 4: Messung der Vorwärts- und Rückwärtsaktivität des Komplexes II mittels 13C 5-Glutamin-Tracing. Um die Aktivität des Vorwärtskomplexes II (links) zu messen, wird der Einbau von 13 C-5-Glutamin in 13 C4-Succinat und 13 C4-Fumarat überwacht. Um die Reverse-Complex-II-Aktivität (rechts) zu messen, wird der Einbau von 13 C-5-Glutamin in 13C-3-Succinat und 13 C3-Fumarat überwacht. Abkürzungen: SDH = Succinat-Dehydrogenase; CytC = Cytochrom C. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
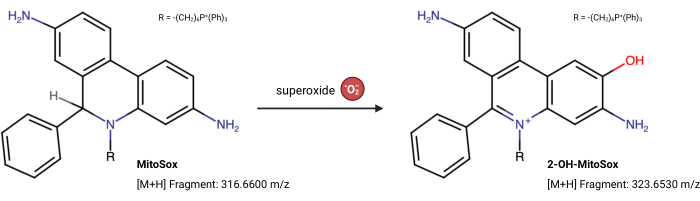
Abbildung 5: MitoSox-Rot-Reaktion mit Superoxid. Die Reaktion von MitoSox mit mitochondrialen Superoxiden zu 2-OH-MitoE2+. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
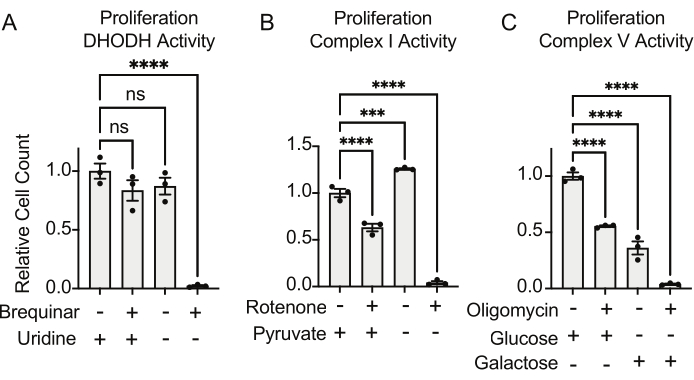
Abbildung 6: Proliferationsbasierte Assays zur Messung der mitochondrialen Funktion (A) Proliferation von 143B-Osteosarkomzellen, die mit 5 μM Brequinar, einem DHODH-Inhibitor, in Medium mit ±100 μg/ml Uridin behandelt wurden. Die Daten sind Mittelwerte ± SEM; N = 3 pro Bedingung. (B) Proliferation von 143B-Osteosarkomzellen, die mit dem 2 μM-Rotenon, einem Komplex-I-Inhibitor, in Medium mit ±5 mM Pyruvat behandelt wurden. Die Daten sind Mittelwerte ± SEM; N = 3 pro Bedingung. (C) Proliferation von 143B-Osteosarkomzellen, die mit dem 5 μM-Oligomycin, einem Komplex-V-Inhibitor, behandelt wurden, in einem Medium mit entweder 10 mM Glukose oder 10 mM Galaktose als einziger zentraler Kohlenstoffquelle. Die Daten sind Mittelwerte ± SEM; N = 3 pro Bedingung. * zeigt p < 0,05 bei Verwendung eines einfaktoriellen ANOVA-Tests in Graphpad Prism an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
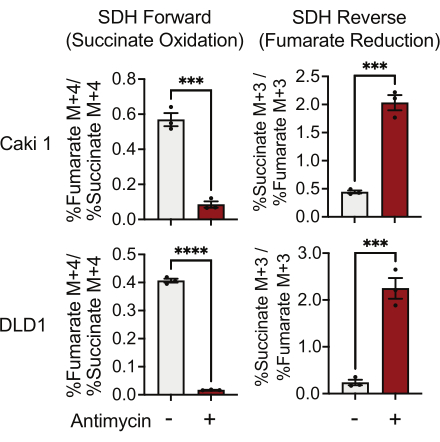
Abbildung 7: 13C 5-Glutamin-Verfolgung zur Messung der Komplex-II-Aktivität. Succinatoxidation und Fumaratreduktion (SDH reverse) in DMSO- und 500 nM Antimycin A-behandelten Caki1- und DLD1-Zellen. Die Daten stellen den Mittelwert ± REM dar. N = 3 pro Bedingung. zeigt p < 0,05 an, wobei ein ungepaarter t-Test in GraphPad Prism verwendet wird. Abkürzungen: SDH = Succinatoxidation; SDH-Umkehr = Fumarat-Reduktion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
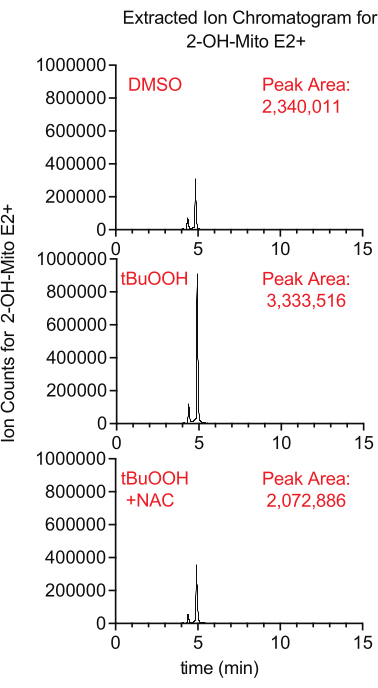
Abbildung 8: LCMS-basierter MitoSox-Assay zum Nachweis von Superoxid. Extrahiertes Ionenchromatogramm von 2-OH-Mito E2+ , isoliert aus Caki1-Zellen, die 30 min lang mit MitoSox behandelt wurden, in Gegenwart von tBuOOH ± NAC. Abkürzungen: LCMS = Flüssigkeitschromatographie-Massenspektrometrie; NAC = N-Acetylcystein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Zusammensetzung der in diesem Protokoll verwendeten Reagenzien, Puffer und Medien. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Da neue Forschungsergebnisse zeigen, dass Mitochondrien von Säugetieren ohne den Verbrauch von molekularem Sauerstoff funktionieren können, ist es für Forscher von größter Bedeutung, orthogonale Assays über OCR-Messungen hinaus zu verwenden, um die mitochondriale Funktion genau zu quantifizieren. Hier haben wir eine Reihe von Assays zusammengestellt, die verwendet werden können, um die Aktivitäten von Komplex I, Komplex II, Komplex V und DHODH direkt zu bewerten, indem das mitochondriale NAD+/NADH-Gleichgewicht, die Nutzung adaptiver terminaler Elektronenakzeptoren, die Produktion von ATP, die de novo Pyrimidinbiosynthese und mitochondriale ROS gemessen werden. Bemerkenswert ist, dass diese Assays die mitochondriale Funktion direkter messen als OCR-Messungen. Darüber hinaus bieten diese Assays den Forschern handhabbare Möglichkeiten zur Quantifizierung der mitochondrialen Funktion während der Hypoxie, für die OCR-Messungen weitgehend irrelevant sind, da Fumarat als bevorzugter terminaler Elektronenakzeptor verwendet wird. Schließlich sind die hier beschriebenen proliferationsbasierten Methoden kostengünstiger als klassische Respirometrie-Experimente und bieten somit eine allgemein zugängliche Möglichkeit, die mitochondriale Funktion in Säugetiersystemen zu untersuchen.
Bei der Verwendung dieser Assays zur Messung der mitochondrialen Funktion in kultivierten Zellen sind wichtige Überlegungen zu berücksichtigen. In Bezug auf die Proliferationsassays ist es wichtig, die Anzahl der ausgesäten Zellen für die Verdopplungsrate jeder Zelllinie anzupassen. Die Zellen sollten zu mindestens 10 % Konfluenz ausgesät sein und genügend Platz für drei bis vier Verdopplungen bieten, damit Unterschiede in der Proliferation quantifiziert werden können. Eine weitere Überlegung für jeden Assay ist die Konzentration der kleinen Moleküle, die als Kontrollen für die Aktivitäten jedes ETC-Komplexes verwendet werden. Da verschiedene Zelllinien unterschiedliche Empfindlichkeiten gegenüber diesen Inhibitoren aufweisen können, ist es wichtig, die Dosis dieser kleinen Moleküle zu testen, um die optimale Konzentration zu ermitteln.
Eine universelle Einschränkung von Assays zur Untersuchung der mitochondrialen Funktion in vitro, einschließlich OCR-Messungen und aller hier beschriebenen Assays, ist die metabolische Zusammensetzung des Nährmediums. Standard-Zellkulturmedium neigt dazu, Systeme in ein oberflächlich hohes Niveau der mitochondrialen Funktion zu verzerren. Zum Beispiel erhöht der supraphysiologische Glutaminspiegel die Anaplerose des TCA-Zyklus25, was die mitochondriale NADH-Synthese antreibt und folglich die oxidative Phosphorylierung erhöht. In ähnlicher Weise liegt der Sauerstoffpartialdruck in Säugetiergeweben zwischen 3 mmHg und 100 mmHg (ca. 0,1%-13%O2), ist aber in vitro atmosphärisch (140 mmHg, ca. 21%) 26,27. Dieser Überschuss an O2 maximiert die mitochondriale Atmungskapazität und die Superoxidproduktion28. In jüngster Zeit wurden Anstrengungen unternommen, Nährmedien physiologischer zu gestalten29,30. Bemerkenswert ist, dass die Kultivierung von Zellen in humanen plasmaähnlichen Medien die mitochondriale Atmung in einigen Krebszelllinien30, die mitochondriale ROS in T-Zellen 31 und die mitochondriale Anpassung an Krebstherapeutika32 verringert. Daher ist es wichtig, auf die Zusammensetzung der verwendeten Nährmedien zu achten und zu verstehen, wie sie sich auf die mitochondriale Funktion auswirken kann.
Eine weitere wichtige und universelle Einschränkung bei der Interpretation der mitochondrialen Funktion ist das Potenzial für Unterschiede in der Anzahl der Mitochondrien. Es ist daher von entscheidender Bedeutung, den mitochondrialen Gehalt entweder durch die Quantifizierung von mtDNA33, die Messung der mitochondrialen Masse mit membranpotentialunempfindlichen Farbstoffen34 oder durch Western Blot von mitochondrialen Markern zu messen. Dies ist eine kritische Kontrolle, damit eine Abnahme der Anzahl der Mitochondrien nicht mit einer Abnahme der Mitochondrienfunktion verwechselt wird.
Es gibt auch spezifische Einschränkungen und Fehlerbehebungen, die für die hier beschriebenen Assays gelten. Da sich differenzierte Zellen nicht vermehren, sind die proliferationsbasierten Assays in diesem Zusammenhang nicht für die Beurteilung der mitochondrialen Funktion geeignet. Eine wesentliche Einschränkung des 13-C-4-Aspartat-Tracing-Protokolls zur Messung der DHODH-Aktivität besteht darin, dass die Aspartataufnahme in Zellen äußerst ineffizient sein kann35. Um diese potenzielle Einschränkung zu überwinden, können Forscher den Aspartattransporter SLC1A3 überexprimieren, um die Aufnahme von 13C4-Aspartat zu erleichtern35.
Eine Einschränkung des Protokolls, das die 13-C-5-Glutamin-Verfolgung zur Messung der SDH-Aktivität verwendet, besteht darin, dass dieser Assay erfordert, dass die Zellen den reduktiven Carboxylierungsweg nutzen, um die M+3-Isotopologenanzureichern, um die umgekehrte Aktivität zu messen. Einige Zelllinien sind aufgrund einer niedrigen ATP-Citrat-Lyase-Expression36, einer unzureichenden HIF-Stabilisierung 37 oder eines zu niedrigen α-KG-Citrat-Verhältnisses 38 nicht in der Lage, einen reduktiven Carboxylierungsfluss durchzuführen38. Um diese Einschränkung zu überwinden, könnte man 13 C4-Aspartat-Tracing verwenden, um die SDH-Vorwärts- und Rückwärtsaktivitäten zu messen 7. In diesem Assay kann die SDH-Vorwärtsaktivität durch das Verhältnis von Fumarat M+2:Succinat M+2 und die Rückreaktion von Succinat M+4:Fumarat M+4 gemessen werden. Bemerkenswert ist, dass durch diese Rückverfolgung die meisten Enzyme im reduktiven Carboxylierungsweg umgangen werden.
Eine Einschränkung des Komplex-I-Aktivitäts-Assays mit DCPIP-Reduktion als Auslese besteht darin, dass die Mitochondrien strukturell nicht intakt sind. Der Prozess des Einfrierens der Mitochondrien, um ihre NADH-Aufnahme für den Assay zu ermöglichen, kann sicherlich die strukturelle Integrität der mitochondrialen Membran beeinträchtigen39. Dieser Assay sollte parallel zu Assays wie dem Komplex-I-Proliferations-Assay durchgeführt werden, um sicherzustellen, dass die beobachteten Veränderungen der Komplex-I-Aktivität auch bei intakten Zellen zutreffen.
In zukünftigen Studien können einige dieser Techniken für die Messung der mitochondrialen Funktionen in vivo an Modellorganismen wie Mäusen und Caenorhabditis elegans angepasst werden.Die aktuellen Methoden, die zur Messung der mitochondrialen Funktion in vivo verwendet werden, konzentrieren sich auf die OCR auf organismischer Ebene, insbesondere auf die respiratorische Austauschrate bei Verwendung von Mausmodellen. Eine klare Einschränkung dieser Methode besteht darin, dass Sauerstoff über seine Rolle als ubiquitärer terminaler Elektronenakzeptor in der mitochondrialen ETC hinaus viele biochemische und Signalfunktionen erfüllt. Zum Beispiel wird Sauerstoff durch die katalytische Aktivität von Enzymen aus der Familie der Dioxygenasen "verbraucht". Obwohl diese Enzyme zum zellulären Sauerstoffverbrauch beitragen, sind sie nicht an der mitochondrialen Funktion beteiligt, regulieren sie nicht und spiegeln sie nicht wider. Klassische Respirometrie-Experimente in vitro kontrollieren in der Regel die "nicht-mitochondriale OCR", während Organismus-Experimente mit dem respiratorischen Austauschverhältnis (RER) dies nicht kontrollieren können, was die Interpretation der RER als Metrik für die mitochondriale Funktion in vivo einschränkt. Es ist jedoch möglich, die Protokolle so anzupassen, dass die DHODH-Aktivität über die 13-C-4-Aspartat-Rückverfolgung, die Komplex-II-Aktivität über die 13-C-5-Glutamin-Rückverfolgung, die Komplex-I-Aktivität auf Mitochondrien, die aus Geweben gereinigt wurden, und diemitochondriale ROS unter Verwendung von LC-MS-freundlichen Verbindungen wie MitoB gemessen werden, um die mitochondriale Funktion in vivo zu messen. Diese direkten Assays zur Untersuchung der mitochondrialen Funktionen in Kombination mit klassischen Respirometrie-Experimenten ermöglichen den Forschern eine umfassendere und genauere Beurteilung der mitochondrialen Funktion in Säugetierzellen und -geweben.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu melden.
Danksagungen
Die in dieser Handschrift entstandenen Figuren sind mit BioRender.com entstanden. Wir danken Amy Walker für ihr Feedback zu diesem Artikel. J.B.S. wurde durch das Worcester Foundation for Biomedical Research Grant unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube | Cell Treat | 667443 | |
| 2.0 mL tube | Cell Treat | 229446 | |
| 6-well plate | Cell Treat | 229106 | |
| 12-well plate | Cell Treat | 229112 | |
| 13C4-aspartate | Sigma-Aldrich | 604852 | |
| 13C5-Glutamine | Cambridge Isotope Laboratories | 285978-14-5 | |
| 15 mL centrifuge tube | Cell Treat | 667411 | |
| 50 mL centrifuge tube | Cell Treat | 667421 | |
| 150 mm tissue culture dish | Cell Treat | 229651 | |
| 1x Phosphate-buffered saline | Gibco | 10010049 | |
| 2,6-dichlorophenolindophenol | Honeywell | 33125 | |
| Ammonium Carbonate | Sigma-Aldrich | 37999 | |
| Antimycin | Sigma-Aldrich | A8674 | |
| Ascentis Express C18 | Sigma-Aldrich | 53825-U | |
| Bottle top filter 500 mL, 0.22 µm, PES 9 9 mm membrane diameter | Cell Treat | 229717 | |
| Bovine Serum Albumin | Sigma-Aldrich | A3294 | |
| Brequinar | Sigma-Aldrich | SML0113 | |
| Cell Lifter, Double End Flat and Narrow Blade | Cell Treat | 229305 | |
| CentriVap -105 Cold Trap | Labconco | 7385020 | |
| Complete Protease Inhibitor Tablets | Sigma-Aldrich | 4693116001 | |
| Coulter Counter Cups | Fisher Scientific | 07-000-694 | |
| Decylubiquinone | Sigma-Aldrich | D7911 | |
| DMSO | Invitrogen | D12345 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 11995-065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| EGTA | Sigma-Aldrich | E3889 | |
| Eppendorf Centrifuge 5425R | Eppendorf | 2231000908 | |
| Eppendorf Centrifuge 5910 Ri | Eppendorf | 5943000343 | |
| Galactose | Sigma-Aldrich | G5388 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glucose-free DMEM | Gibco | 11966025 | |
| Glutamine-free DMEM | Thermo Fisher | 11960044 | |
| Heat-Inactivated Fetal Bovine Serum | Sigma-Aldrich | F4135 | |
| Hepes | Sigma-Aldrich | H3375 | |
| HPLC-grade 35% Ammonium hydroxide | Thermo Scientific | 460801000 | |
| HPLC-grade Acetonitrile | Sigma-Aldrich | 900667 | |
| HPLC-grade Chloroform | Sigma-Aldrich | 366927 | |
| HPLC-grade formic acid | Thermo Scientific | 28905 | |
| HPLC-grade Isopropanol | Sigma-Aldrich | 563935 | |
| HPLC-grade MeOH | Sigma-Aldrich | 900688 | |
| HPLC-grade Water | Sigma-Aldrich | 270733 | |
| Human Osteosarcome Cell Line 143B | ATCC | CRL-8303 | |
| Hydrochloric Acid | Sigma-Aldrich | 320331-500ML | |
| Isotone buffer | Beckman Coulter | 8546719 | |
| K2HPO4 | Sigma-Aldrich | P2222 | |
| Mannitol | Sigma-Aldrich | M4125 | |
| MitoSox Red | Invitrogen | M36008 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Oligomycin | Sigma-Aldrich | 75351-5MG | |
| Pencillin Streptomycin | Gibco | 15140-122 | |
| Potter-Elvehjem Tissue Grinder, Size 21 | Kimble | 885502-0021 | |
| Pyruvate | Sigma-Aldrich | P5280 | |
| Pyruvate-free DMEM media | Gibco | 11965175 | |
| Q Exactive Plus Mass Spectrometer | Thermo Scientific | 726030 | |
| ReCO2ver Incubator | Baker | ||
| Refrigerated Centrivap Benchtop Vacuum Concentrator | Labconco | 7310020 | |
| RIPA Buffer | Millipore Sigma | 20188 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| SeQuant ZIC-pHILIC 5μm 150 x 2.1 mm analytical column | Sigma-Aldrich | 1.50460.0001 | |
| SeQuant ZIC-pHILIC guard kit | Millipore Sigma | 1.50438.0001 | |
| Sodium Hydroxide, Pellets | Millipore Sigma | 567530-250GM | |
| Sucrose | Sigma-Aldrich | S0389 | |
| SW, TRACEFINDER 5.1 SP3 | Thermo Scientific | OPTON-31001 | |
| Tert-butyl hydroperoxide solution | Sigma-Aldrich | 458139 | |
| Tris | Sigma-Aldrich | 93352 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25-200-114 | |
| Uridine | Sigma-Aldrich | U3003 | |
| VANQUISH HORIZON / FLEX HPLC | Thermo Scientific | VF-S01-A-02 | |
| Z2 Coulter Particle count and size analyzer | Beckman Coulter | BZ10131270 |
Referenzen
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 16080 (2016).
- Chandel, N. S., et al. Reactive oxygen species generated at mitochondrial complex III stabilize hypoxia-inducible factor-1alpha during hypoxia: A mechanism of O2 sensing. Journal of Biological Chemistry. 275 (33), 25130-25138 (2000).
- Cadenas, E., Boveris, A., Ragan, C. I., Stoppani, A. O. M. Production of superoxide radicals and hydrogen peroxide by NADH-ubiquinone reductase and ubiquinol-cytochrome C reductase from beef-heart mitochondria. Archives of Biochemistry and Biophysics. 180 (2), 248-257 (1977).
- Murphy, M. P. How mitochondria produce reactive oxygen species. Biochemical Journal. 417 (1), 1-13 (2009).
- Schieber, M., Chandel, N. S. ROS function in redox signaling and oxidative stress. Current Biology. 24 (10), 453-462 (2014).
- Spinelli, J. B., et al. Fumarate is a terminal electron acceptor in the mammalian electron transport chain. Science. 374 (6572), 1227-1237 (2021).
- Kumar, R., et al. A redox cycle with complex II prioritizes sulfide quinone oxidoreductase-dependent H(2)S oxidation. Journal of Biological Chemistry. 298 (1), 101435 (2022).
- Warburg, O., Geissler, A. W., Lorenz, S. On growth of cancer cells in media in which glucose is replaced by galactose. Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 348 (12), 1686-1687 (1967).
- Marroquin, L. D., Hynes, J., Dykens, J. A., Jamieson, J. D., Will, Y. Circumventing the Crabtree effect: replacing media glucose with galactose increases susceptibility of HepG2 cells to mitochondrial toxicants. Toxicological Sciences. 97 (2), 539-547 (2007).
- Attardi, G., King, M. P. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Bodnar, A. G., Cooper, M., Leonard, J. V., Schapira, A. H. Respiratory-deficient human fibroblasts exhibiting defective mitochondrial DNA replication. Biochemical Journal. 305, 817-822 (1995).
- Gregoire, M., Morais, R., Quilliam, M. A., Gravel, D. On auxotrophy for pyrimidines of respiration-deficient chick embryo cells. European Journal of Biochemistry. 142 (1), 49-55 (1984).
- Mackay, G. M., Zheng, L., vanden Broek, N. J., Gottlieb, E. Analysis of cell metabolism using LC-MS and isotope tracers. Methods in Enzymology. 561, 171-196 (2015).
- Heinrich, P., et al. Correcting for natural isotope abundance and tracer impurity in MS-, MS/MS- and high-resolution-multiple-tracer-data from stable isotope labeling experiments with IsoCorrectoR. Scientific Reports. 8 (1), 17910 (2018).
- Lee, P., Chandel, N. S., Simon, M. C. Cellular adaptation to hypoxia through hypoxia inducible factors and beyond. Nature Reviews Molecular Cell Biology. 21 (5), 268-283 (2020).
- Bisbach, C. M., et al. Succinate can shuttle reducing power from the hypoxic retina to the O(2)-rich pigment epithelium. Cell Reports. 31 (2), 107606 (2020).
- Angebault, C., et al. Idebenone increases mitochondrial complex I activity in fibroblasts from LHON patients while producing contradictory effects on respiration. BMC Research Notes. 4, 557 (2011).
- Liao, P. C., Bergamini, C., Fato, R., Pon, L. A., Pallotti, F. Isolation of mitochondria from cells and tissues. Methods in Cell Biology. 155, 3-31 (2020).
- Iwai, T., et al. Sodium accumulation during ischemia induces mitochondrial damage in perfused rat hearts. Cardiovascular Research. 55 (1), 141-149 (2002).
- Murphy, E., Eisner, D. A. Regulation of intracellular and mitochondrial sodium in health and disease. Circulation Research. 104 (3), 292-303 (2009).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), e52076 (2015).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Xiao, Y., Meierhofer, D. Are hydroethidine-based probes reliable for reactive oxygen species detection. Antioxidants and Redox Signaling. 31 (4), 359-367 (2019).
- DeBerardinis, R. J., et al. Beyond aerobic glycolysis: Transformed cells can engage in glutamine metabolism that exceeds the requirement for protein and nucleotide synthesis. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19345-19350 (2007).
- Keeley, T. P., Mann, G. E. Defining physiological normoxia for improved translation of cell physiology to animal models and humans. Physiological Reviews. 99 (1), 161-234 (2019).
- Ast, T., Mootha, V. K. Oxygen and mammalian cell culture: Are we repeating the experiment of Dr. Ox. Nature Metabolism. 1 (9), 858-860 (2019).
- Gu, C., Jun, J. C. Does hypoxia decrease the metabolic rate. Frontiers in Endocrinology. 9, 668 (2018).
- Voorde, J., et al. Improving the metabolic fidelity of cancer models with a physiological cell culture medium. Scientific Advances. 5 (1), 7314 (2019).
- Cantor, J. R., et al. Physiologic medium rewires cellular metabolism and reveals uric acid as an endogenous inhibitor of UMP synthase. Cell. 169 (2), 258-272 (2017).
- MacPherson, S., et al. Clinically relevant T cell expansion media activate distinct metabolic programs uncoupled from cellular function. Molecular Therapy. Methods and Clinical Development. 24, 380-393 (2022).
- Torres-Quesada, O., Doerrier, C., Strich, S., Gnaiger, E., Stefan, E. Physiological cell culture media tune mitochondrial bioenergetics and drug sensitivity in cancer cell models. Cancers. 14 (16), 3917 (2022).
- Chan, S. W., Chen, J. Z. Measuring mtDNA damage using a supercoiling-sensitive qPCR approach. Methods in Molecular Biology. 554, 183-197 (2009).
- Doherty, E., Perl, A. Measurement of mitochondrial mass by flow cytometry during oxidative stress. Reactive Oxygen Species. 4 (10), 275-283 (2017).
- Birsoy, K., et al. An essential role of the mitochondrial electron transport chain in cell proliferation is to enable aspartate synthesis. Cell. 162 (3), 540-551 (2015).
- Beigneux, A. P., et al. ATP-citrate lyase deficiency in the mouse. Journal of Biological Chemistry. 279 (10), 9557-9564 (2004).
- Gameiro, P. A., et al. In vivo HIF-mediated reductive carboxylation is regulated by citrate levels and sensitizes VHL-deficient cells to glutamine deprivation. Cell Metabolism. 17 (3), 372-385 (2013).
- Fendt, S. M., et al. Reductive glutamine metabolism is a function of the alpha-ketoglutarate to citrate ratio in cells. Nature Communications. 4, 2236 (2013).
- Lee, C. P. Biochemical studies of isolated mitochondria from normal and diseased tissues. Biochimica et Biophysica Acta. 1271 (1), 21-28 (1995).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten