Method Article
测量哺乳动物线粒体功能的氧非依赖性测定
摘要
在这里,我们提出了一个测定汇编,以直接测量哺乳动物细胞中的线粒体功能,而与它们消耗分子氧的能力无关。
摘要
线粒体电子传递链(ETC)中的电子流动支持哺乳动物细胞中的多方面生物合成,生物能量和信号传导功能。由于氧(O 2)是哺乳动物ETC最普遍的末端电子受体,因此O2消耗率经常被用作线粒体功能的代表。然而,新兴研究表明,该参数并不总是指示线粒体功能,因为富马酸盐可以用作替代电子受体以维持缺氧时的线粒体功能。本文编制了一系列协议,允许研究人员独立于O2消耗率测量线粒体功能。这些测定在研究缺氧环境中的线粒体功能时特别有用。具体来说,我们描述了测量线粒体ATP产生,从头嘧啶生物合成,复合物I氧化NADH和超氧化物产生的方法。结合经典的呼吸测量实验,这些正交和经济的测定将为研究人员提供更全面的线粒体功能评估他们感兴趣的系统。
引言
线粒体功能是细胞健康的关键指标,因为它维持哺乳动物细胞中关键的生物合成、生物能量和信号功能1。绝大多数线粒体功能需要电子流过电子传递链(ETC),ETC中电子流的中断会导致严重的线粒体疾病2。ETC由嵌入线粒体内膜中的一系列还原和氧化(氧化还原)反应组成,这些电子转移反应释放的自由能可用于支持ATP合成,生理过程(例如产热),生物合成途径(例如从头嘧啶生物合成)以及辅助因子(例如NADH)的氧化还原状态的平衡。ETC复合物I和III产生活性氧(ROS)3,4,5,进而调节信号传导关键途径,如HIF,PI3K,NRF2,NFκB和MAPK6。因此,ETC中的电子流指标通常用作哺乳动物细胞中线粒体功能的代理。
呼吸测量实验经常用于测量哺乳动物细胞中的线粒体功能。由于O2是哺乳动物ETC最普遍的末端电子受体,因此其还原被用作线粒体功能的代表。然而,新出现的证据表明,哺乳动物线粒体可以使用富马酸盐作为电子受体来维持依赖于ETC的线粒体功能,包括从头嘧啶生物合成7,NADH氧化7和硫化氢的解毒8。因此,在某些情况下,特别是在缺氧环境中,O2消耗率(OCR)的测量不能提供线粒体功能的精确或准确的指示。
在这里,我们概述了一系列可用于独立于OCR测量线粒体功能的测定。我们提供直接测量复合物 I 介导的 NADH 氧化、二氢乳清酸脱氢酶介导的 从头 嘧啶生物合成、复合物 V 依赖性 ATP 合成、琥珀酸脱氢酶 (SDH) 复合物的净方向性和线粒体衍生的 ROS 的检测方法。这些测定旨在对培养的哺乳动物细胞进行,尽管许多测定可以适应 研究体内 线粒体功能。值得注意的是,该协议中描述的测定是比OCR更直接的线粒体功能测量。此外,它们能够测量缺氧时的线粒体功能,在这种情况下,OCR 不是指示性测量。总之,这些测定与经典的呼吸测量实验相结合,将为研究人员提供对哺乳动物细胞线粒体功能的更全面的评估。
研究方案
1. 增殖测定以测量复合物I,二氢乳清酸脱氢酶(DHODH)和复合物V活性的活性
- 用于增殖测定的接种细胞
注意:本协议使用从ATCC商业购买的人骨肉瘤细胞系143B。该细胞系是根据我们批准的机构生物安全委员会(IBC)协议的指南使用的。- 从组织培养箱中取出板。从平板中吸出培养基,并用 1x 磷酸盐缓冲盐水 (PBS) 洗涤以去除任何剩余的培养基。吸出PBS,并用0.05%-0.25%胰蛋白酶覆盖培养皿以从板底部提起细胞。
- 等待3-5分钟,让胰蛋白酶从平板中释放细胞,然后用10mL含有10%胎牛血清(FBS)的所需生长培养基淬灭胰蛋白酶。
- 将细胞收集在锥形管中,并以1,000× g 离心5分钟以沉淀细胞。
- 从管中吸出培养基而不干扰沉淀。用完全培养基重悬沉淀。
- 计数细胞,并量化在 6 孔板中接种 10,000 至 25,000 个细胞所需的体积。
注意:每个细胞系都需要针对要接种的细胞数量进行优化。达到的理想汇合度在实验开始时为~10%,在实验结束时为~80%。 - 将细胞移液到 6 孔板中,并向孔中加入 2 mL 完全培养基。静置24小时,然后切换到实验培养基条件。
注意:每个条件至少播种三个重复和足够的孔来测试未处理的对照条件,抑制剂处理的对照条件,未处理的实验条件和抑制剂处理的实验条件。
- 培养基变化以评估增殖的复合V活性
注意:在含有半乳糖的培养基中增殖的细胞依赖于ATP合成的复合V活性9,10。与糖酵解产生净两个ATP的葡萄糖不同,半乳糖不产生任何ATP,迫使细胞依赖于复合物V进行ATP合成(图1)。复合V抑制剂寡霉素用作对照。- 制作10mM含葡萄糖的培养基(见 表1)。
- 制作10 mM含半乳糖的培养基(见 表1)。
- 将每个孔中的培养基更换为含葡萄糖的DMEM或含半乳糖的DMEM。向相关孔中加入5μM寡霉素(复合V抑制剂),向未处理的孔中加入相同体积的DMSO。寡霉素储备液在DMSO中重悬10mM。将板放回组织培养箱中2天。
- 培养基变化以评估增殖的复合物I活性
注意:在无丙酮酸培养基中增殖的细胞更依赖于复合物I活性11,12。在没有丙酮酸的情况下,培养的细胞需要复合物I以促进大部分NADH再氧化回NAD + (图2)。复合物I抑制剂鱼藤酮用作对照。- 制作补充有 10% FBS 和 1% 青霉素链霉素的不含丙酮酸的 DMEM 培养基。
- 制作1M丙酮酸溶液(见 表1)。
- 将每个孔中的培养基更换为不含丙酮酸的培养基或含丙酮酸的培养基。向处理过的孔中加入2μM鱼藤酮(复合物I抑制剂),向未处理的孔中加入相同体积的DMSO。鱼藤酮储备液在DMSO中重悬25mM。将板放回组织培养箱中2天。
- 通过增殖评估DHODH活性的培养基变化
注意:在无尿苷培养基中增殖的细胞需要二氢乳清酸脱氢酶(DHODH)活性11,12,13。在没有外源性尿苷的情况下,培养的细胞通过从头途径合成嘧啶。DHODH抑制剂brequinar用作对照。- 制作补充有 10% FBS 和 1% 青霉素-链霉素的不含尿苷的 DMEM。
- 制备10 mg/mL尿苷储备溶液,然后制备100 μg/mL尿苷培养基(见 表1)。
- 将每个孔中的培养基更换为无尿苷培养基或含尿苷培养基。向处理过的孔中加入5μM的Brequinar(DHODH抑制剂),向未处理的孔中加入相同体积的DMSO。将苞片原液重悬于DMSO中10 mM。将板放回组织培养箱中2天。
- 计数用于增殖测定的细胞
- 对于所有实验,每2天补充一次培养基。如果介质变黄,请增加介质更换的频率。让细胞增殖长达7天,如果任何孔开始看起来杂草丛生,则停止实验。当汇合度超过80%时,井被认为是杂草丛生的。
- 吸出培养基,用 1x PBS 洗涤,并用 0.25% 胰蛋白酶(6 孔培养皿为 500 μL)覆盖孔底部。
- 等待5分钟,直到细胞从培养皿上抬起。在显微镜下检查。
- 用 1 mL 含有 10% FBS 的完整 DMEM 淬灭胰蛋白酶。
- 上下移液以分解细胞团块。
- 准备库尔特柜台杯,在每个杯中填充 10 mL 等酮缓冲液(每孔一杯)。对细胞计数器上的细胞进行计数,并记录数据。如果读数是每毫升细胞数(细胞/mL),则将记录的值乘以1.5,得到每孔的细胞总数。
注意:如果实验室没有库尔特计数器,其他细胞计数方法(如血细胞计数器)就足够了。
2. 13C4-天冬氨酸稳定同位素示踪和LC-MS分析以测量DHODH活性
- 13贴壁细胞中的C4-天冬氨酸稳定同位素示踪
注意:可以通过测量 13C4-天冬氨酸掺入 13C 3-UMP 来直接监测 DHODH 活性。Brequinar用作DHODH活性的对照(图3)。由此产生的13C3-UMP水平是DHODH活性的量度。- 在 6 孔培养皿中接种 250,000 到 500,000 个细胞,第二天达到 75% 的汇合度。
- 制备250mM 13 C 4-天冬氨酸和10 mM 13C4-天冬氨酸培养基的储备溶液(见表1)。
- 将每个孔中的培养基更换为含有10mM 13C4-天冬氨酸的培养基。孵育适当的小时数以达到标记目标细胞的稳定状态。
注意:稳定状态定义为百分比标记的代谢物随时间14稳定的时间范围。对于143B骨肉瘤细胞,13C4-天冬氨酸在8小时内达到稳定状态。最佳做法是在实验之前通过对感兴趣的稳定同位素进行时程实验来确定此时间范围。
- 从贴壁细胞中分离代谢物
- 在开始之前,准备一桶干冰,并在HPLC级水中制备80%HPLC级MeOH。将该缓冲液在-80°C冰箱中冷却过夜或直接放在干冰上。
- 一次从培养箱中取出一个板,从孔中吸出培养基,并用1x PBS洗涤2次。在继续下一步之前,从孔中取出所有残留的PBS。
注意:确保在吸液过程中倾斜板并将移液器靠在培养皿壁上,以防止贴壁细胞的破坏。 - 将板放在干冰上,并立即向每个孔中加入 800 μL 80% LCMS 级 MeOH 和 20% LCMS 级水。
- 将板在-80°C冰箱中孵育至少15分钟以促进细胞裂解。
注意:此时,可以将下一个板从培养箱中取出并重复步骤2.2.1-2.2.4。继续此操作,直到所有板在-80°C冰箱中孵育。 - 一次从冰箱中取出一个板,使用细胞提升器在干冰上刮每个孔,并将裂解物转移到 1.5 mL 微量离心管中。将管子放在干冰上,直到下一步。
- 在4°C下涡旋所有管10分钟,然后在4°C下以最大速度(至少17,000× g)离心10分钟。
- 将上清液转移到1.5mL微量离心管中,并在配备有-105°C冷阱的4°C真空浓缩器中在高真空设置下干燥约6小时或直到样品蒸发。裂解物干燥后,将代谢物沉淀储存在-80°C,直到准备好准备液相色谱与质谱(LCMS)配对。
- 极性代谢物的液相色谱-质谱(LC-MS)测量
注意:任何允许检测天冬氨酸、 从头 嘧啶生物合成中的中间体和UMP的色谱和质谱工作流程就足够了14。- 通过在干燥的沉淀中加入 100 μL HPLC 级水并在 4 °C 下涡旋 10 分钟,在冰上制备 LCMS 样品。
- 将样品在4°C下以最大速度(至少17,000 × g)离心10分钟,并将25μL移动到每个LC-MS小瓶中。
- 将 2 μL 裂解物注入 LC-MS 系统。下面给出了一种常用的方法:
- 制备含有溶解在LC-MS级水中的20 mM碳酸铵(LC-MS级)和0.1%氢氧化铵(LC-MS级)的 流动相A 。
- 选择100%乙腈(LC-MS级)作为 流动相B。
- 对于色谱,选择5 μm、150 mm x 2.1 mm分析柱,配备2.1 mm x 20 mm亲水化合物保护柱(参见 材料表)。将柱炉设置为25°C。
- 使用以下液相色谱设置:恒定流速为 0.15 mL/min;80%至20%流动相B的线性梯度持续20分钟,然后以20%至80%流动相B的线性梯度保持0.5分钟,然后在80%流动相B下保持7.5分钟。
- 选择以下质谱仪设置:m/z 70 Da和1,000 Da之间的全扫描;分辨率为70,000;AGC目标为1×106;最长注入时间为 20 毫秒。在极性开关模式下操作电源。将喷雾电压设置为3.0 kV,加热毛细管设置为275°C,HESI探头设置为350°C,护套气流设置为40个单位,辅助气流设置为15个单位,扫描气流设置为1个单位。
- 使用与LCMS工作流程接口的任何软件执行数据分析。
注意:与上述工作流程一起使用的软件是XCalibur(Thermo)和TraceFinder(Thermo)。数据分析的关键考虑因素概述如下:- 预期保留时间: 通过在实验前使用色谱方法运行每种目标代谢物的标准品来确定每种代谢物的保留时间。
注意:UMP及其同位素异构体(包括13C 3-UMP)的保留时间完全相同。 - 代谢物的预期 M/Z:如果代谢物在负离子模式(例如UMP)下电离,则使用UMP减去质子的分子式[C 9 H14N2O9P]计算预期的精确质量数。对于以正离子模式电离的代谢物,使用分子式加质子计算确切的质量。
- 质量精度: 当使用轨道质谱仪时,目标代谢物及其同位素体预计具有±5 mmu的质量精度。使用软件进行计算,考虑预期的 M/Z 和实际检测到的 M/Z。
- 自然丰度校正:预计所有示踪数据都将经过自然丰度校正,以解释自然界中的~1%13C和~0.5%15 N-同位素15。
- 预期保留时间: 通过在实验前使用色谱方法运行每种目标代谢物的标准品来确定每种代谢物的保留时间。
3. 13C5-谷氨酰胺稳定同位素示踪测量SDH活性
- 13贴壁细胞中的C5-谷氨酰胺稳定同位素示踪
注意:SDH活性可以通过测量富马酸盐和琥珀酸盐的某些同位素在13C5-谷氨酰胺示踪7,16,17上的相互转化来直接监测。复合物III抑制剂抗霉素用作改变SDH复合物净方向性的对照(图4)。- 在 6 孔培养皿中接种 250,000 到 500,000 个细胞,第二天达到 75% 的汇合度。
- 准备50 mM 13C5-谷氨酰胺的储备液(见 表1)。
- 制备含有2 mM 13C5-谷氨酰胺的示踪培养基(见 表1)。
- 将每个孔中的培养基更换为含有2 mM 13C5-谷氨酰胺的培养基。孵育适当的小时数以达到标记目标细胞的稳定状态(参见步骤2.1.3中的注释)。
- 按照步骤2.2中的方案分离代谢物。
- 按照步骤2.3中所述的工作流程分析LC-MS上的样品。
- 基于标记模式分析 SDH 活性
注意:SDH复合物的琥珀酸氧化活性可以通过评估13C 4-富马酸盐与13 C4-琥珀酸酯在13C5-谷氨酰胺示踪时的比率来监测。SDH复合物的富马酸盐还原活性可以通过评估13C 3-琥珀酸与13 C3-富马酸盐在13C5-谷氨酰胺示踪时的比率来监测。- 计算 13C 3-富马酸盐、13 C4-富马酸盐、13C3-琥珀酸和 13C4-琥珀酸的百分比标记。例如,要确定13C 3-富马酸盐的百分比,请将富马酸盐同位素体(未标记的富马酸盐、13 C1-富马酸盐、13 C 2-富马酸盐、13C3-富马酸盐和13C 4-富马酸盐)的所有积分峰面积相加,并将13C3-富马酸盐的峰面积除以总同位素体面积。乘以 100。
- 要计算琥珀酸氧化,请将百分比 13C 4-富马酸盐除以百分比 13C4-琥珀酸。
- 要计算富马酸盐减少量,请将百分比 13C 3-琥珀酸除以百分比 13C3-富马酸盐。
4. 直接复合物I活性测定
注意:DCPIP是一种人造电子受体;当接受来自泛醇的电子时,它会变成还原形式。在该测定中,泛醌通过复杂的I介导的NADH氧化为NAD +还原为泛醇。因此,在这种无细胞测定中测量氧化DCPIP的周转是复合物I活性7,18的代表。
- 从细胞中纯化和量化线粒体
注意:任何线粒体纯化方案都可用于本测定19。- 扩增细胞,直到获得25-1亿个细胞。从培养皿中吸出培养基,用1x PBS洗涤,吸出PBS,并用0.25%胰蛋白酶尝试旋转细胞。用培养基淬灭胰蛋白酶,并以1,000× g 沉淀细胞5分钟。
- 在 5 mL 的 1x PBS 中洗涤细胞沉淀 2 次,并以 1,000 × g 重复离心 5 分钟以沉淀细胞。将洗涤的沉淀储存在-20°C冰箱中,直到线粒体纯化。
注意:不要多次冷冻解冻细胞沉淀。 - 制备线粒体分离缓冲液(见 表1)。
注意:含钠试剂(如NaOH)不应用于制备线粒体分离缓冲液,因为钠会失去线粒体膜电位20 并破坏线粒体钙稳态21。 - 将细胞沉淀重悬至每 1 mL 线粒体分离缓冲液 1000 万个细胞。例如,将 1 亿个沉淀细胞重悬于 10 mL 线粒体分离缓冲液中。
注意:确保破坏细胞团块,而不会将气泡引入缓冲液中。 - 将 2 mL 细胞悬液移至工作体积为 3-8 mL 的预冷玻璃均质器中,该均质器与 Potter-Elvehjem PTFE 杵兼容。用10-20次冲程匀浆细胞,在显微镜下监测细胞以确认整个匀浆过程中的细胞裂解。如果需要,增加中风次数以确保有效的细胞裂解。
注意:如果用上述方法均质细胞对裂解细胞无效,请切换到注射器裂解方法22。 - 将2mL细胞裂解物转移到冰上的微量离心管中,并重复上述步骤,直到整个细胞悬液均质化。
- 在4°C离心机中以650× g 沉淀细胞核和细胞碎片10分钟。
- 将上清液移至新的2.0mL管中,并在4°C下以650× g 重复上述离心10分钟。
- 将上清液移至新的2.0mL管中,并在4°C离心机中以7,000× g 沉淀粗线粒体10分钟。
- 弃去上清液,并将沉淀重悬于1mL线粒体分离缓冲液中。将 50 μL 移入新试管中进行蛋白质定量。对样品的两个等分试样(50 μL 样品和剩余的 ~950 μL)重复上述离心步骤。
- 弃去上清液,并将沉淀储存在-80°C冰箱中直至准备使用。
- 从 50 μL 等分试样向沉淀中加入 200 μL RIPA 缓冲液以提取蛋白质,涡旋 10 分钟,并以 21,000 × g 离心以分离蛋白质。定量 50 μL 等分试样中的蛋白质量,并使用该数字定量 950 μL 样品中的剩余蛋白质。例如,如果 50 μL 等分试样的蛋白质定量为 1 μg/μL,则剩余线粒体沉淀中的总蛋白质为 950 μg(1 μg/μL × 950 μL)。
- 进行复合物I活性测定
注意:143B骨肉瘤细胞系用于此测定,但该方案可以适用于任何培养的细胞。- 将纯化的线粒体重悬于线粒体重悬缓冲液中(见 表1),终浓度为5mg蛋白质/ mL。
- 在-20°C冰箱中进行五个冻融循环以透化线粒体。
- 制作复杂的I活性测定缓冲液(见 表1)。
- 将 50 ug 的 5 mg/mL 线粒体原液与 90 μL 复合物 I 活性缓冲液混合。准备五个未处理的重复和五个鱼藤酮处理的(5μM)重复以控制复合物I活性。
- 在设置为37°C的读板器中读取600nm处的基线吸光度。
- 通过将NADH加入至终浓度为2mM来启动反应,并在1小时内跟踪吸光度(600nm),在整个过程中至少每2分钟测量一次。吸光度的降低表明DCPIP通过复合物I活性降低。
注意:应使用多通道移液器添加NADH,以确保同时启动所有样品。
5. 基于LC-MS的测定法,用于测量超氧化物水平
注意:MitoSox Red的荧光特性可以独立于其与超氧化物23的反应而变化。这种基于 LC-MS 的测定直接测量与 MitoSox Red 反应的超氧化物产物。以下测定法略有修改自Xiao等人24。2-羟基-丝分裂乙鎓(2-OH MitoE2+)是超氧化物反应的产物(图5)。Caki1细胞系用于该测定,但该方案可以适用于任何培养的细胞。
- 用丝裂索红处理贴壁细胞
- 在 6 孔培养皿中接种 250,000 到 500,000 个细胞,第二天达到 75% 的汇合度。确保接种一组用于LC-MS测定的板和一组用于细胞计数标准化的重复板。
- 在Dulbecco的改良Eagle培养基中制备含有10%热灭活FBS和1%青霉素链霉素的完整DMEM。
- 用 2 mL 完整的 DMEM 刷新所有孔中所有条件下的培养基。确保在这一点上添加任何感兴趣的药物或治疗方法。
- 将细胞在组织培养箱中孵育1小时。
- 准备阳性和阴性对照。制备在PBS中稀释的50 mM叔丁基过氧化氢储备液和在DMSO中稀释的250 mMN-乙酰半胱氨酸(NAC)储备液(见 表1)。
注意:叔丁基过氧化氢(tBuOOH)是一种有效的活性氧,可作为阳性对照并增加2-OH MitoE2+的量。NAC是一种有效的抗氧化剂,可作为阴性对照并中和由tBuOOH引起的超氧化物产生。 - 向阳性对照孔中加入 1 μL tBuOOH,向阴性对照孔中加入 1 μL tBuOOH + 100 μL NAC。
注意:使用 P2 移液器(0.1-2 μL 范围)是转移 1 μL 的最佳方法。 - 在组织培养箱中孵育1小时。
- 准备 1 mM 丝裂索红储备液(见表 1),并向每个孔中加入 2 μL 1 mM 丝裂索红,以达到 1 μM 的终浓度。 在组织培养箱中孵育30分钟。
- 在最终孵育期间,对其中一个重复板进行计数以获取细胞计数,以归一化最终LC-MS数据。
- 从贴壁细胞中分离氧化的丝裂红产物
- 取一桶干冰,在开始分离之前将凉爽的HPLC级异丙醇放在干冰上。
- 一次取出一个板,从孔中吸出培养基,并用 1 mL 的 1x PBS 洗涤 2 次。从孔中吸出所有残留的PBS,然后再进行下一步。
注意:确保在吸液过程中倾斜板并将移液器靠在培养皿壁上,以防止贴壁细胞的破坏。 - 将板放在干冰上,并向每个孔中加入 800 μL HPLC 级异丙醇。
- 将板在-80°C冰箱中孵育至少15分钟以促进细胞裂解。
注意:此时,可以将下一个板从培养箱中取出,并重复步骤5.2.1-5.2.4。继续此操作,直到所有板在-80°C冰箱中孵育。 - 一次从冰箱中取出一个板,使用细胞升降器在干冰上刮除每个孔,并将裂解物转移到 1.5 mL 微量离心管中。将管子放在干冰上,直到下一步。
- 在4°C下涡旋所有管10分钟,然后在4°C下以最大速度(至少17,000× g)离心10分钟。
- 将上清液转移到 1.5 mL 微量离心管中,并在真空浓缩器中干燥。裂解物干燥后,将代谢物沉淀储存在-80°C,直到准备好进行LC-MS。
- 丝裂索红和 2-羟基丝分裂乙铔(2-OH MitoE2+)的 LC-MS 测量
- 通过添加 100 μL 3:3:1 的 HPLC 级 MeOH:氯仿:水混合物,在冰上制备 LCMS 样品。在4°C下涡旋10分钟。
- 将 25 μL 移入每个 LC-MS 样品瓶中。将剩余的样品储存在-80°C冰箱中。
- 制备以下液相色谱缓冲液:i)缓冲液A:含有0.1%甲酸的HPLC级水;ii)缓冲液B:HPLC级乙腈与0.1%甲酸。
- 打开赛默飞世尔 XCalibur 仪器设置应用程序,开始开发该方法。
- 在此窗口的左侧边栏上查找两个框 - 第一个框允许色谱方法开发,第二个框允许质谱方法开发。
- 液相色谱方法开发:
- 将流速设置为 0.25 mL/min,并以 20% B 开始方法,在 12 分钟内升至 95% B。在接下来的一分钟内,将缓冲液 B 降至 20% B,并在接下来的 2 分钟内保持该水平。
注意:在20% B下的最后2分钟流量对于柱压回初始压力并使用适当的缓冲比平衡色谱柱至关重要。不包括此平衡步骤将导致所有后续运行样品的保留时间发生变化。
- 将流速设置为 0.25 mL/min,并以 20% B 开始方法,在 12 分钟内升至 95% B。在接下来的一分钟内,将缓冲液 B 降至 20% B,并在接下来的 2 分钟内保持该水平。
- 使用以下参数创建 调整文件 :
- 打开调谐应用,然后创建一个新的 调谐文件。
- 将 方法设置模块 (参见步骤5.3.9.3)中的任何重叠设置也应用于此调谐文件,包括 扫描范围、分辨率、极性、AGC目标和 最大IT。
- 将护套气体设置为 30,将辅助气体设置为 3,将扫掠气体设置为 3。将喷雾电压设置为 3 kV,将毛细管温度设置为 300,将 S 透镜射频电平设置为 60。
- 质谱方法开发:
- 从潜在扫描的左下角列表中,将 完整MS 拖放到窗口中央。确保点击 全 MS 方块 下降后调整设置。 MS方法的总持续时间 为 13分钟。
注意:LC方法比MS方法长,因为最后2分钟用于色谱柱修复,而不是代谢物定量。 - 在模块右侧的“方法 属性”下,确保“ 方法持续时间 ”和“ 运行时间 ”设置为 13.00 分钟。
- 以正模式运行此完全扫描,分辨率为 70,000,AGC 目标为 1 × 106。将最大 IT 设置为 100 毫秒,将扫描范围设置为 300 m/z 到 700 m/z。
- 在模块顶部的“优化文件”下,观察刚刚创建的 优化文件 是否链接到此方法。
- 从潜在扫描的左下角列表中,将 完整MS 拖放到窗口中央。确保点击 全 MS 方块 下降后调整设置。 MS方法的总持续时间 为 13分钟。
- 运行 2 μL 样品进样的 MitoSox Red 检测方法。
结果
DHODH,复合物I和复合物V的活性都可以使用增殖测定进行评估。从培养基中剥夺尿苷后,细胞变得更加依赖于嘧啶生物合成的 从头 途径。因此,当细胞在无尿苷培养基中被激发增殖时,它们比在含有尿苷的培养基中培养的细胞对brequinar抑制DHODH活性更敏感(图6A)。类似地,从培养基中剥夺丙酮酸使细胞更依赖于复合物I活性进行增殖。因此,当细胞在无丙酮酸培养基中被激发增殖时,它们比在含丙酮的培养基中培养的细胞对鱼藤酮对复合物I活性的抑制更敏感(图6B)。复合V活性可以通过挑战细胞在含有半乳糖而不是葡萄糖的培养基中增殖来评估。由于半乳糖在糖酵解中产生净零ATP,因此在这种燃料中生长的细胞更依赖于通过复合V活性合成线粒体ATP。因此,在含半乳糖培养基中增殖的细胞比在含葡萄糖培养基中增殖的细胞对寡霉素的复合物V抑制更敏感(图6C)。
SDH活性可以使用13C5-谷氨酰胺示踪和监测其掺入富马酸盐和琥珀酸盐同位素异构体来测量。在载体处理条件下,SDH复合物有利于前向活性,将13C 4-琥珀酸掺入13 C4-富马酸盐高于将13 C 3-富马酸盐掺入13 C3-琥珀酸盐(图7)。在抗霉素处理的条件下,SDH复合物有利于反向活性,并且将13C 3-富马酸盐掺入13 C3-琥珀酸盐大于将13 C 4-琥珀酸掺入13 C4-富马酸盐(图7)。
线粒体内的超氧化物产生可以使用荧光报告基因MitoSox进行测量,其在与超氧化物反应时产生2-羟基-丝分裂乙铓。在这项研究中,在叔丁基过氧化氢存在下用MitoSox处理的细胞具有更高水平的2-羟基-丝分裂乙锭,其方式通过添加NAC(一种淬灭细胞ROS的抗氧化剂)来抑制(图8)。
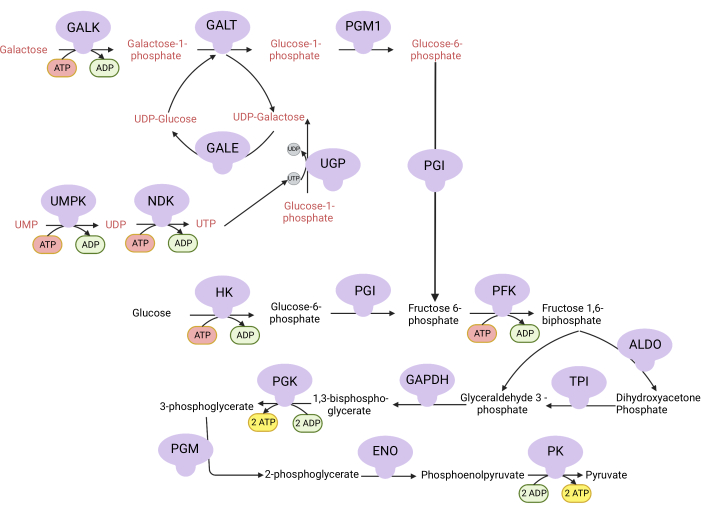
图 1:复杂 V 增殖测定的机理基础。 通过糖酵解氧化葡萄糖和半乳糖。葡萄糖从糖酵解中产生净两个ATP,而半乳糖产生净零ATP,因为UDP-半乳糖需要UTP合成。因此,在半乳糖中生长的细胞由于缺乏糖酵解产生的ATP,更依赖于线粒体ATP的合成。缩写:GALK = 半乳糖激酶;GALT = 半乳糖-1-磷酸尿苷基转移酶;PGM1 = 磷酸葡萄糖变位酶 1;GPI = 葡萄糖-6-磷酸异构酶,UGP = UDP-葡萄糖焦磷酸化酶;GALE = UDP-半乳糖-4-差向异构酶;NDK = 核苷酸二磷酸激酶;UMPK = 尿苷单磷酸激酶;HK = 己糖激酶;PFK = 磷酸果糖激酶;醛缩酶=醛缩酶;TPI = 磷酸三糖异构酶;GAPDH = 甘油醛-3-磷酸脱氢酶;PGK =磷酸甘油酸激酶;PGM = 磷酸葡萄糖变位酶;ENO = 烯醇化酶;PK = 丙酮酸激酶。 请点击此处查看此图的大图。
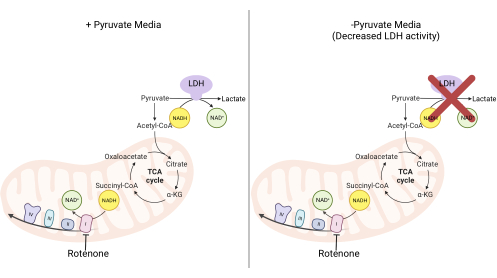
图2:复合物I增殖测定的机理基础。 在抑制复合物I活性时改变的代谢途径示意图。在高丙酮酸培养基中,通过LDH介导的NADH氧化绕过复合物I抑制。在低丙酮酸培养基中,这种适应不太可行,使细胞更依赖复合物I活性来再氧化NADH。缩写:LDH = 乳酸脱氢酶;TCA循环=三羧酸循环。 请点击此处查看此图的大图。
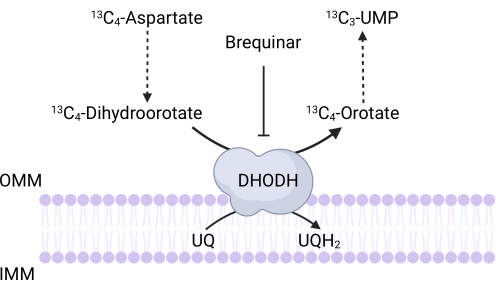
图 3: 13C4-天冬氨酸示踪时的 DHODH 反应示意图。 Brequinar抑制二氢乳清酸氧化为乳清酸,从而阻止UMP的下游合成。 13C4-天冬氨酸通过DHODH活性掺入 13C3-UMP中。缩写:OMM = 线粒体外膜;IMM = 线粒体内膜;DHODH = 二氢乳清酸脱氢酶。 请点击此处查看此图的大图。
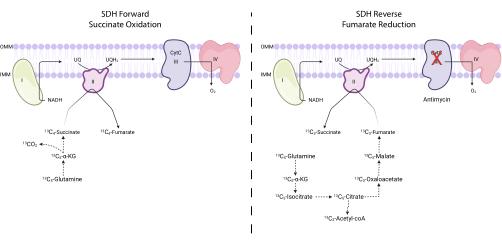
图 4:通过 13C5-谷氨酰胺示踪测量正向和反向复合物 II 活性。为了测量正向复合物II活性(左),监测13C5-谷氨酰胺掺入13 C4-琥珀酸和13C4-富马酸盐。为了测量反向复合物II活性(右),监测13C5-谷氨酰胺掺入13 C 3-琥珀酸和13C3-富马酸盐。缩写:SDH = 琥珀酸脱氢酶;CytC = 细胞色素 C.请点击此处查看此图的大图。
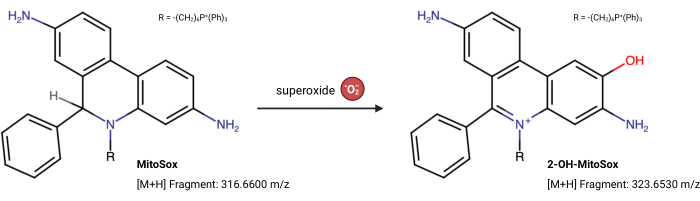
图5:MitoSox Red与超氧化物的反应。 MitoSox与线粒体超氧化物反应形成2-OH-MitoE2+。 请点击此处查看此图的大图。
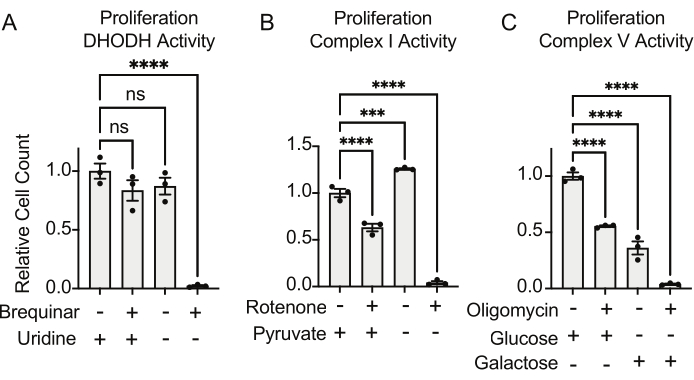
图 6:用于测量线粒体功能的 基于增殖的测定 (A) 用 5 uM brequinar(一种 DHODH 抑制剂)处理的 143B 骨肉瘤细胞在含有 ±100 ug/mL 尿苷的培养基中的增殖。数据是平均± SEM;N = 3 每个条件。(B)用2uM鱼藤酮(一种复合物I抑制剂)处理的143B骨肉瘤细胞在含有±5mM丙酮酸的培养基中增殖。数据是平均± SEM;N = 3 每个条件。(C)用5 uM寡霉素(一种复合V抑制剂)处理的143B骨肉瘤细胞在以10 mM葡萄糖或10 mM半乳糖为唯一中心碳源的培养基中增殖。数据是平均± SEM;N = 3 每个条件。* 表示 p < 0.05,使用在 Graphpad Prism 中进行单因素方差分析检验。 请点击此处查看此图的大图。
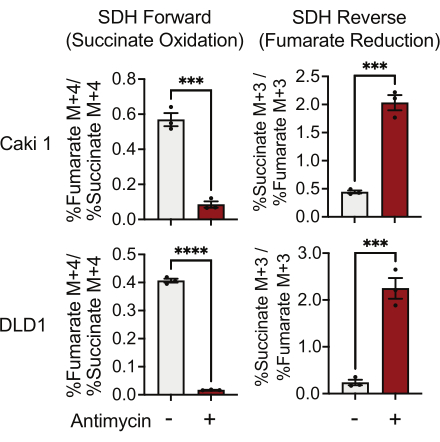
图 7: 13C5-谷氨酰胺示踪以测量复合物 II 活性。 DMSO和500nM抗霉素A处理的Caki1和DLD1细胞中的琥珀酸盐氧化和富马酸盐还原(SDH逆转)。数据代表平均± SEM;N = 3 每个条件。使用 GraphPad Prism 中的未配对 t 检验表示 p < 0.05。缩写:SDH = 琥珀酸氧化;SDH 逆转 = 富马酸盐减少。 请点击此处查看此图的大图。
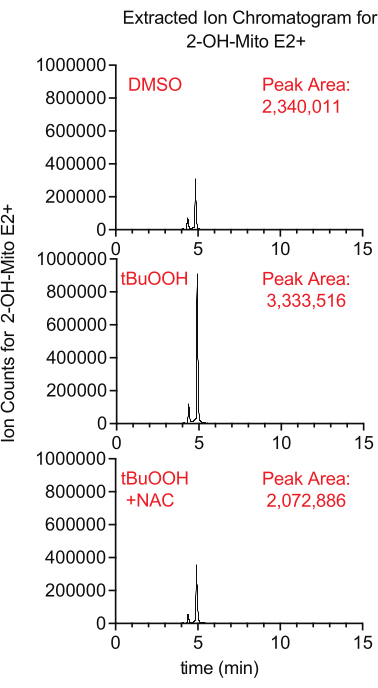
图 8:基于 LCMS 的 MitoSox 检测超氧化物。 在tBuOOH±NAC存在下,从用MitoSox处理的Caki1细胞中分离的2-OH-Mito E2+ 的提取离子色谱图30分钟。缩写:LCMS =液相色谱-质谱;NAC = N-乙酰半胱氨酸。 请点击此处查看此图的大图。
表1:本协议中使用的试剂、缓冲液和培养基的组成。请按此下载此表格。
讨论
随着新兴研究表明哺乳动物线粒体可以在不消耗分子氧的情况下发挥作用,研究人员在OCR测量之外采用正交测定来准确量化线粒体功能至关重要。在这里,我们编制了一系列可用于通过测量线粒体NAD + / NADH平衡,自适应末端电子受体的利用,ATP的产生,从 头 嘧啶生物合成和线粒体衍生的ROS来直接评估复合物I,复合物II,复合物V和DHODH的活性。值得注意的是,这些测定比OCR测量更直接地测量线粒体功能。此外,这些测定为研究人员提供了在缺氧期间量化线粒体功能的易处理方法,由于富马酸盐被用作首选的末端电子受体,因此 OCR 测量在很大程度上无关紧要。最后,这里描述的基于增殖的方法比经典的呼吸测量实验更具成本效益,从而提供了一种广泛可访问的方法来研究哺乳动物系统中的线粒体功能。
利用这些检测来测量培养细胞中的线粒体功能时,有一些关键的考虑因素。关于增殖测定,重要的是调整接种的细胞数量以增加每个细胞系的倍增率。应将细胞接种至至少10%的汇合度,并有足够的空间允许三到四倍,以便可以量化增殖差异。每种测定的另一个考虑因素是用作每个ETC复合物活性对照的小分子的浓度。由于不同的细胞系可能对这些抑制剂表现出不同的敏感性,因此测试这些小分子的剂量以确定最佳浓度至关重要。
体外研究线粒体功能的测定(包括OCR测量和此处描述的所有测定)的普遍局限性是培养基的代谢组成。标准细胞培养基倾向于使系统偏向于表面高水平的线粒体功能。例如,超生理谷氨酰胺水平增加了其TCA循环25的无激素,这促进了线粒体NADH的合成,从而增加了氧化磷酸化。同样,哺乳动物组织中的氧分压范围在3mmHg和100mmHg(约0.1%-13%O2)之间,但在体外是大气压(140mmHg,约21%)26,27。这种过量的O2使线粒体呼吸能力和超氧化物产生最大化28。最近,人们努力设计更生理的培养基29,30。值得注意的是,在人血浆样培养基中培养细胞会降低某些癌细胞系的线粒体呼吸30,T细胞31中的线粒体ROS以及线粒体对癌症治疗的适应32。因此,注意所用培养基的组成并了解其如何影响线粒体功能至关重要。
解释线粒体功能的另一个重要和普遍的限制是线粒体数量差异的可能性。因此,通过定量mtDNA33、用膜电位不敏感染料34测量线粒体质量或线粒体标志物的蛋白质印迹来测量线粒体含量至关重要。这是一个关键的控制,因此线粒体数量的减少不会被误认为线粒体功能的下降。
还有一些适用于此处描述的测定的特定限制和故障排除。首先,鉴于分化的细胞不会增殖,在这种情况下,基于增殖的测定对于评估线粒体功能没有用。用于测量DHODH活性的 13C4-天冬氨酸示踪方案的一个关键限制是细胞中的天冬氨酸摄取效率极低35。为了克服这一潜在的限制,研究人员可以过表达天冬氨酸转运蛋白SLC1A3,以促进 13C4-天冬氨酸摄取35。
使用13C5-谷氨酰胺示踪测量SDH活性的方案的局限性在于,该测定要求细胞利用还原羧化途径来富集M + 3同位素异构体以测量反向活性。由于ATP柠檬酸裂解酶表达低36,HIF稳定性不足37或α-KG:柠檬酸盐比值太低38,一些细胞系无法进行还原羧化通量。为了克服这一限制,可以利用13C4-天冬氨酸示踪来测量SDH正向和反向活动7。在该测定中,SDH正向活性可以通过富马酸盐M + 2:琥珀酸M + 2的比率和琥珀酸盐M + 4:富马酸盐M + 4的反向反应来测量。值得注意的是,这种示踪绕过了还原羧化途径中的大多数酶。
使用DCPIP还原作为读数的复合物I活性测定的局限性是线粒体在结构上不是完整的。冻融线粒体以使NADH吸收用于测定的过程肯定会损害线粒体膜的结构完整性39。该测定应与诸如复合物I增殖测定之类的测定同时进行,以确保观察到的复合物I活性的变化对于完整细胞也是真实的。
在未来的研究中,其中一些技术可以适用于使用模型生物(如小鼠和秀丽隐杆线虫)测量体内线粒体功能。目前用于测量体内线粒体功能的方法集中在生物体水平的OCR,特别是使用小鼠模型时的呼吸交换率。这种方法的一个明显局限性是,氧气除了在线粒体ETC中作为无处不在的末端电子受体的作用外,还具有许多生化和信号功能。例如,氧气被双加氧酶家族中酶的催化活性“消耗”。虽然这些酶有助于细胞耗氧率,但它们不参与、调节或反映线粒体功能。体外经典呼吸测量实验通常控制“非线粒体OCR”,而有机呼吸交换比(RER)实验无法控制这一点,限制了RER作为体内线粒体功能的指标的解释。然而,调整方案以通过13C4-天冬氨酸示踪测量DHODH活性,通过13C5-谷氨酰胺示踪测量复合物II活性,从组织中纯化的线粒体上的复合物I活性,以及使用LC-MS友好化合物(如MitoB)测量线粒体ROS以测量体内线粒体功能.这些询问线粒体功能的直接测定,结合经典的呼吸测量实验,为研究人员提供了对哺乳动物细胞和组织中线粒体功能的更全面和准确的评估。
披露声明
作者没有利益冲突需要报告。
致谢
这份手稿中产生的人物是用 BioRender.com 创作的。我们感谢 Amy Walker 对本文提供反馈。J.B.S.得到了伍斯特生物医学研究基金会资助。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube | Cell Treat | 667443 | |
| 2.0 mL tube | Cell Treat | 229446 | |
| 6-well plate | Cell Treat | 229106 | |
| 12-well plate | Cell Treat | 229112 | |
| 13C4-aspartate | Sigma-Aldrich | 604852 | |
| 13C5-Glutamine | Cambridge Isotope Laboratories | 285978-14-5 | |
| 15 mL centrifuge tube | Cell Treat | 667411 | |
| 50 mL centrifuge tube | Cell Treat | 667421 | |
| 150 mm tissue culture dish | Cell Treat | 229651 | |
| 1x Phosphate-buffered saline | Gibco | 10010049 | |
| 2,6-dichlorophenolindophenol | Honeywell | 33125 | |
| Ammonium Carbonate | Sigma-Aldrich | 37999 | |
| Antimycin | Sigma-Aldrich | A8674 | |
| Ascentis Express C18 | Sigma-Aldrich | 53825-U | |
| Bottle top filter 500 mL, 0.22 µm, PES 9 9 mm membrane diameter | Cell Treat | 229717 | |
| Bovine Serum Albumin | Sigma-Aldrich | A3294 | |
| Brequinar | Sigma-Aldrich | SML0113 | |
| Cell Lifter, Double End Flat and Narrow Blade | Cell Treat | 229305 | |
| CentriVap -105 Cold Trap | Labconco | 7385020 | |
| Complete Protease Inhibitor Tablets | Sigma-Aldrich | 4693116001 | |
| Coulter Counter Cups | Fisher Scientific | 07-000-694 | |
| Decylubiquinone | Sigma-Aldrich | D7911 | |
| DMSO | Invitrogen | D12345 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 11995-065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| EGTA | Sigma-Aldrich | E3889 | |
| Eppendorf Centrifuge 5425R | Eppendorf | 2231000908 | |
| Eppendorf Centrifuge 5910 Ri | Eppendorf | 5943000343 | |
| Galactose | Sigma-Aldrich | G5388 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glucose-free DMEM | Gibco | 11966025 | |
| Glutamine-free DMEM | Thermo Fisher | 11960044 | |
| Heat-Inactivated Fetal Bovine Serum | Sigma-Aldrich | F4135 | |
| Hepes | Sigma-Aldrich | H3375 | |
| HPLC-grade 35% Ammonium hydroxide | Thermo Scientific | 460801000 | |
| HPLC-grade Acetonitrile | Sigma-Aldrich | 900667 | |
| HPLC-grade Chloroform | Sigma-Aldrich | 366927 | |
| HPLC-grade formic acid | Thermo Scientific | 28905 | |
| HPLC-grade Isopropanol | Sigma-Aldrich | 563935 | |
| HPLC-grade MeOH | Sigma-Aldrich | 900688 | |
| HPLC-grade Water | Sigma-Aldrich | 270733 | |
| Human Osteosarcome Cell Line 143B | ATCC | CRL-8303 | |
| Hydrochloric Acid | Sigma-Aldrich | 320331-500ML | |
| Isotone buffer | Beckman Coulter | 8546719 | |
| K2HPO4 | Sigma-Aldrich | P2222 | |
| Mannitol | Sigma-Aldrich | M4125 | |
| MitoSox Red | Invitrogen | M36008 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Oligomycin | Sigma-Aldrich | 75351-5MG | |
| Pencillin Streptomycin | Gibco | 15140-122 | |
| Potter-Elvehjem Tissue Grinder, Size 21 | Kimble | 885502-0021 | |
| Pyruvate | Sigma-Aldrich | P5280 | |
| Pyruvate-free DMEM media | Gibco | 11965175 | |
| Q Exactive Plus Mass Spectrometer | Thermo Scientific | 726030 | |
| ReCO2ver Incubator | Baker | ||
| Refrigerated Centrivap Benchtop Vacuum Concentrator | Labconco | 7310020 | |
| RIPA Buffer | Millipore Sigma | 20188 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| SeQuant ZIC-pHILIC 5μm 150 x 2.1 mm analytical column | Sigma-Aldrich | 1.50460.0001 | |
| SeQuant ZIC-pHILIC guard kit | Millipore Sigma | 1.50438.0001 | |
| Sodium Hydroxide, Pellets | Millipore Sigma | 567530-250GM | |
| Sucrose | Sigma-Aldrich | S0389 | |
| SW, TRACEFINDER 5.1 SP3 | Thermo Scientific | OPTON-31001 | |
| Tert-butyl hydroperoxide solution | Sigma-Aldrich | 458139 | |
| Tris | Sigma-Aldrich | 93352 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25-200-114 | |
| Uridine | Sigma-Aldrich | U3003 | |
| VANQUISH HORIZON / FLEX HPLC | Thermo Scientific | VF-S01-A-02 | |
| Z2 Coulter Particle count and size analyzer | Beckman Coulter | BZ10131270 |
参考文献
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 16080 (2016).
- Chandel, N. S., et al. Reactive oxygen species generated at mitochondrial complex III stabilize hypoxia-inducible factor-1alpha during hypoxia: A mechanism of O2 sensing. Journal of Biological Chemistry. 275 (33), 25130-25138 (2000).
- Cadenas, E., Boveris, A., Ragan, C. I., Stoppani, A. O. M. Production of superoxide radicals and hydrogen peroxide by NADH-ubiquinone reductase and ubiquinol-cytochrome C reductase from beef-heart mitochondria. Archives of Biochemistry and Biophysics. 180 (2), 248-257 (1977).
- Murphy, M. P. How mitochondria produce reactive oxygen species. Biochemical Journal. 417 (1), 1-13 (2009).
- Schieber, M., Chandel, N. S. ROS function in redox signaling and oxidative stress. Current Biology. 24 (10), 453-462 (2014).
- Spinelli, J. B., et al. Fumarate is a terminal electron acceptor in the mammalian electron transport chain. Science. 374 (6572), 1227-1237 (2021).
- Kumar, R., et al. A redox cycle with complex II prioritizes sulfide quinone oxidoreductase-dependent H(2)S oxidation. Journal of Biological Chemistry. 298 (1), 101435 (2022).
- Warburg, O., Geissler, A. W., Lorenz, S. On growth of cancer cells in media in which glucose is replaced by galactose. Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 348 (12), 1686-1687 (1967).
- Marroquin, L. D., Hynes, J., Dykens, J. A., Jamieson, J. D., Will, Y. Circumventing the Crabtree effect: replacing media glucose with galactose increases susceptibility of HepG2 cells to mitochondrial toxicants. Toxicological Sciences. 97 (2), 539-547 (2007).
- Attardi, G., King, M. P. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Bodnar, A. G., Cooper, M., Leonard, J. V., Schapira, A. H. Respiratory-deficient human fibroblasts exhibiting defective mitochondrial DNA replication. Biochemical Journal. 305, 817-822 (1995).
- Gregoire, M., Morais, R., Quilliam, M. A., Gravel, D. On auxotrophy for pyrimidines of respiration-deficient chick embryo cells. European Journal of Biochemistry. 142 (1), 49-55 (1984).
- Mackay, G. M., Zheng, L., vanden Broek, N. J., Gottlieb, E. Analysis of cell metabolism using LC-MS and isotope tracers. Methods in Enzymology. 561, 171-196 (2015).
- Heinrich, P., et al. Correcting for natural isotope abundance and tracer impurity in MS-, MS/MS- and high-resolution-multiple-tracer-data from stable isotope labeling experiments with IsoCorrectoR. Scientific Reports. 8 (1), 17910 (2018).
- Lee, P., Chandel, N. S., Simon, M. C. Cellular adaptation to hypoxia through hypoxia inducible factors and beyond. Nature Reviews Molecular Cell Biology. 21 (5), 268-283 (2020).
- Bisbach, C. M., et al. Succinate can shuttle reducing power from the hypoxic retina to the O(2)-rich pigment epithelium. Cell Reports. 31 (2), 107606 (2020).
- Angebault, C., et al. Idebenone increases mitochondrial complex I activity in fibroblasts from LHON patients while producing contradictory effects on respiration. BMC Research Notes. 4, 557 (2011).
- Liao, P. C., Bergamini, C., Fato, R., Pon, L. A., Pallotti, F. Isolation of mitochondria from cells and tissues. Methods in Cell Biology. 155, 3-31 (2020).
- Iwai, T., et al. Sodium accumulation during ischemia induces mitochondrial damage in perfused rat hearts. Cardiovascular Research. 55 (1), 141-149 (2002).
- Murphy, E., Eisner, D. A. Regulation of intracellular and mitochondrial sodium in health and disease. Circulation Research. 104 (3), 292-303 (2009).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), e52076 (2015).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Xiao, Y., Meierhofer, D. Are hydroethidine-based probes reliable for reactive oxygen species detection. Antioxidants and Redox Signaling. 31 (4), 359-367 (2019).
- DeBerardinis, R. J., et al. Beyond aerobic glycolysis: Transformed cells can engage in glutamine metabolism that exceeds the requirement for protein and nucleotide synthesis. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19345-19350 (2007).
- Keeley, T. P., Mann, G. E. Defining physiological normoxia for improved translation of cell physiology to animal models and humans. Physiological Reviews. 99 (1), 161-234 (2019).
- Ast, T., Mootha, V. K. Oxygen and mammalian cell culture: Are we repeating the experiment of Dr. Ox. Nature Metabolism. 1 (9), 858-860 (2019).
- Gu, C., Jun, J. C. Does hypoxia decrease the metabolic rate. Frontiers in Endocrinology. 9, 668 (2018).
- Voorde, J., et al. Improving the metabolic fidelity of cancer models with a physiological cell culture medium. Scientific Advances. 5 (1), 7314 (2019).
- Cantor, J. R., et al. Physiologic medium rewires cellular metabolism and reveals uric acid as an endogenous inhibitor of UMP synthase. Cell. 169 (2), 258-272 (2017).
- MacPherson, S., et al. Clinically relevant T cell expansion media activate distinct metabolic programs uncoupled from cellular function. Molecular Therapy. Methods and Clinical Development. 24, 380-393 (2022).
- Torres-Quesada, O., Doerrier, C., Strich, S., Gnaiger, E., Stefan, E. Physiological cell culture media tune mitochondrial bioenergetics and drug sensitivity in cancer cell models. Cancers. 14 (16), 3917 (2022).
- Chan, S. W., Chen, J. Z. Measuring mtDNA damage using a supercoiling-sensitive qPCR approach. Methods in Molecular Biology. 554, 183-197 (2009).
- Doherty, E., Perl, A. Measurement of mitochondrial mass by flow cytometry during oxidative stress. Reactive Oxygen Species. 4 (10), 275-283 (2017).
- Birsoy, K., et al. An essential role of the mitochondrial electron transport chain in cell proliferation is to enable aspartate synthesis. Cell. 162 (3), 540-551 (2015).
- Beigneux, A. P., et al. ATP-citrate lyase deficiency in the mouse. Journal of Biological Chemistry. 279 (10), 9557-9564 (2004).
- Gameiro, P. A., et al. In vivo HIF-mediated reductive carboxylation is regulated by citrate levels and sensitizes VHL-deficient cells to glutamine deprivation. Cell Metabolism. 17 (3), 372-385 (2013).
- Fendt, S. M., et al. Reductive glutamine metabolism is a function of the alpha-ketoglutarate to citrate ratio in cells. Nature Communications. 4, 2236 (2013).
- Lee, C. P. Biochemical studies of isolated mitochondria from normal and diseased tissues. Biochimica et Biophysica Acta. 1271 (1), 21-28 (1995).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。