Method Article
哺乳類のミトコンドリア機能を測定するための酸素非依存性アッセイ(英語)
要約
ここでは、分子状酸素を消費する能力とは無関係に、哺乳類細胞のミトコンドリア機能を直接測定するためのアッセイをまとめたものです。
要約
ミトコンドリア電子伝達系(ETC)における電子の流れは、哺乳類細胞における多面的な生合成、生体エネルギー、およびシグナル伝達機能をサポートしています。酸素(O2)は哺乳類ETCにとって最も遍在する末端電子受容体であるため、O2 消費速度はミトコンドリア機能の代理として頻繁に使用される。しかし、新たな研究は、フマル酸塩が低酸素状態でミトコンドリア機能を維持するための代替電子受容体として使用できるため、このパラメーターが必ずしもミトコンドリア機能を示すとは限らないことを示しています。この記事では、研究者がO2 消費速度とは無関係にミトコンドリア機能を測定できるようにする一連のプロトコルをまとめています。これらのアッセイは、低酸素環境におけるミトコンドリア機能を研究する場合に特に有用である。具体的には、ミトコンドリアATP産生、 de novo ピリミジン生合成、複合体IによるNADH酸化、およびスーパーオキシド産生を測定する方法について説明します。従来の呼吸測定実験と組み合わせることで、これらの直交的で経済的なアッセイは、研究者に関心のあるシステムにおけるミトコンドリア機能のより包括的な評価を提供します。
概要
ミトコンドリア機能は、哺乳類細胞の主要な生合成、生体エネルギー、およびシグナル伝達機能を維持するため、細胞の健康の重要な指標です1。ミトコンドリア機能の大部分は電子伝達系(ETC)を通る電子の流れを必要とし、ETCにおける電子の流れの中断は重篤なミトコンドリア病を引き起こします2。ETCは、ミトコンドリア内膜に埋め込まれた一連の還元・酸化(酸化還元)反応で構成されており、これらの電子移動反応は自由エネルギーを放出し、ATP合成、熱発生などの生理過程、de novoピリミジン生合成などの生合成経路、NADHなどの補因子の酸化還元状態のバランスをサポートします。ETC複合体IおよびIIIは活性酸素種(ROS)3,4,5を生成し、HIF、PI3K、NRF2、NFκB、MAPK 6などのシグナル伝達主要経路を調節します。その結果、ETCにおける電子の流れの測定基準は、哺乳類細胞におけるミトコンドリア機能の代理として古典的に使用されている。
呼吸測定実験は、哺乳類細胞のミトコンドリア機能を測定するために頻繁に使用されます。O2は哺乳類ETCにとって最も遍在する末端電子受容体であるため、その還元はミトコンドリア機能の代理として使用されます。しかし、新たな証拠は、哺乳類のミトコンドリアが、de novoピリミジン生合成7、NADH酸化7、硫化水素の解毒8など、ETCに依存するミトコンドリア機能を維持するための電子受容体としてフマル酸塩を使用できることを示しています。したがって、特定の状況、特に低酸素環境において、O2消費速度(OCR)の測定は、ミトコンドリア機能の正確または正確な指標を提供しない。
ここでは、OCRとは無関係にミトコンドリア機能を測定するために使用できる一連のアッセイの概要を説明します。複合体Iを介したNADH酸化、ジヒドロオロチン酸デヒドロゲナーゼを介した de novo ピリミジン生合成、複合体V依存性ATP合成、コハク酸デヒドロゲナーゼ(SDH)複合体の正味の方向性、およびミトコンドリア由来ROSを直接測定するアッセイを提供しています。これらのアッセイは、培養哺乳類細胞に対して実施することを意図しているが、その多くは in vivoでの ミトコンドリア機能の研究に適応させることができる。特に、このプロトコルに記載されているアッセイは、OCRよりもミトコンドリア機能のより直接的な測定です。さらに、それらは、OCRが指標測定ではない状況である低酸素状態でのミトコンドリア機能の測定を可能にします。まとめると、これらのアッセイは、古典的な呼吸測定実験と組み合わせて、哺乳類細胞のミトコンドリア機能のより包括的な評価を研究者に提供します。
プロトコル
1.複合体I、ジヒドロオロチン酸デヒドロゲナーゼ(DHODH)、および複合体V活性を測定するための増殖アッセイ
- 増殖アッセイのための細胞の播種
注:このプロトコルは、ATCCから市販されたヒト骨肉腫細胞株143Bを使用します。この細胞株は、当社が承認した治験バイオセーフティ委員会(IBC)プロトコルのガイドラインに基づいて使用されました。- 組織培養インキュベーターからプレートを取り出します。プレートから培地を吸引し、1xリン酸緩衝生理食塩水(PBS)で洗浄して、残った培地をすべて取り除きます。PBSを吸引し、皿を0.05%〜0.25%のトリプシンで覆い、プレートの底から細胞を持ち上げます。
- トリプシンがプレートから細胞を放出するまで3〜5分待ってから、10%ウシ胎児血清(FBS)を含む10mLの目的の増殖培地でトリプシンを急冷します。
- 細胞をコニカルチューブに集め、1,000 × g で5分間遠心分離して細胞をペレット化します。
- ペレットを乱すことなくチューブから培地を吸引します。ペレットを完全な培地で再懸濁します。
- 細胞をカウントし、6ウェルプレートに10,000〜25,000個の細胞を播種するために必要な量を定量化します。
注:各細胞株は、播種する細胞の数に合わせて最適化する必要があります。達成される理想的な合流点は、実験開始時に~10%、実験終了時に~80%です。 - 細胞を6ウェルプレートにピペットで入れ、2 mLの完全培地をウェルに加えます。実験培地条件に変更する前に、24時間放置します。
注:条件ごとに少なくとも3回の反復と、未処理の対照条件、阻害剤処理された対照条件、未処理の実験条件、および阻害剤処理の実験条件をテストするのに十分なウェルをシードします。
- 増殖による複雑なV活性を評価するための培地変化
注:ガラクトースを含む培地で増殖する細胞は、ATP合成のための複合体V活性に依存しています9,10。解糖系から正味2つのATPを生成するグルコースとは異なり、ガラクトースは何も生成しないため、細胞はATP合成のために複合体Vに依存することを余儀なくされます(図1)。複合体V阻害剤オリゴマイシンを対照として用いる。- 10 mMグルコース含有培地を作ります( 表1を参照)。
- 10 mMガラクトース含有培地を作製する( 表1参照)。
- 各ウェルの培地をグルコース含有DMEMまたはガラクトース含有DMEMのいずれかに変更します。5 μMオリゴマイシン(複合V阻害剤)を適切なウェルに添加し、同量のDMSOを未処理ウェルに追加します。オリゴマイシンストックをDMSOに10 mM再懸濁します。プレートを組織培養インキュベーターに2日間戻します。
- 増殖による複合体I活性を評価するための培地変化
注:ピルビン酸を含まない培地で増殖する細胞は、複合体I活性に大きく依存しています11,12。ピルビン酸を使用しない場合、培養細胞は、NADHの再酸化の大部分をNAD+に戻すために複合体Iを必要とします(図2)。複合体I阻害剤であるロテノンを対照として使用する。- 10%FBSおよび1%ペニシリン-ストレプトマイシンを添加したピルビン酸フリーDMEM培地を作成します。
- ピルビン酸の1 M溶液を作ります( 表1を参照)。
- 各ウェルの培地をピルビン酸フリー培地またはピルビン酸含有培地のいずれかに変更します。処理したウェルに2 μMのロテノン(複合体I阻害剤)を加え、未処理のウェルに同量のDMSOを加えます。ロテノンストックはDMSOに25 mM再懸濁されます。プレートを組織培養インキュベーターに2日間戻します。
- 増殖によるDHODH活性を評価するための培地変化
注:ウリジンを含まない培地で増殖する細胞には、ジヒドロオロテートデヒドロゲナーゼ(DHODH)活性が必要です11、12、13。外因性ウリジンが存在しない場合、培養細胞はde novo経路を介してピリミジンを合成します。DHODH阻害剤ブレキナーを対照として使用する。- ウリジンフリーDMEMに10%FBSと1%ペニシリン-ストレプトマイシンを添加します。
- 10 mg/mLのウリジン原液を作り、次に100 μg/mLのウリジン培地を調製します( 表1を参照)。
- 各ウェルの培地をウリジン非含有培地またはウリジン含有培地に交換する。処理したウェルに5 μMブレキナー(DHODH阻害剤)を加え、未処理のウェルに同量のDMSOを加えます。ブレキナーストックはDMSOに10 mM再懸濁されています。プレートを組織培養インキュベーターに2日間戻します。
- 増殖アッセイのための細胞のカウント
- すべての実験について、2日ごとに培地を補充してください。媒体の色が黄色になった場合は、媒体の交換頻度を増やします。細胞を最大7日間増殖させ、いずれかのウェルが大きくなりすぎたように見えたら実験を中止します。合流点が80%を超えると、ウェルは生い茂ったと見なされます。
- 培地を吸引し、1x PBSで洗浄し、ウェルの底を0.25%トリプシン(6ウェルディッシュの場合は500 μL)で覆います。
- 細胞が皿から浮き上がるまで5分待ちます。顕微鏡で確認してください。
- 10%FBSを含む1 mLの完全なDMEMでトリプシンをクエンチします。
- 上下にピペットで動かして、細胞の塊を分解します。
- コールターカウンターカップに10 mLのアイソトーンバッファー(1ウェルあたり1カップ)を充填して調製します。セルカウンターでセルをカウントし、データを記録します。読み出しがミリリットルあたりの細胞数(セル/ mL)の場合、記録された値に1.5を掛けて、ウェルあたりの細胞の総数を取得します。
注:ラボにコールターカウンターがない場合は、血球計算盤などの他の細胞計数方法で十分です。
2. DHODH活性を測定するための13C4-アスパラギン酸安定同位体追跡とLC-MS分析
- 13名接着細胞におけるC4-アスパラギン酸安定同位体追跡
注:DHODH活性は、13C4-アスパラギン酸の13C3-UMPへの取り込みを測定することによって直接モニターすることができる。ブレキナーはDHODH活性のコントロールとして使用されます(図3)。得られた13C3−UMPのレベルは、DHODH活性の尺度である。- 250,000〜500,000個の細胞を6ウェルディッシュに播種し、翌日に75%のコンフルエントを達成します。
- 250 mM 13 C 4-アスパラギン酸および10 mM 13C4-アスパラギン酸培地のストック溶液を調製します(表1を参照)。
- 各ウェルの培地を10 mM 13C4-アスパラギン酸を含む培地に交換する。目的の細胞を標識するための定常状態を達成するために、適切な時間数インキュベートします。
注:定常状態は、パーセント標識された代謝物が時間の経過とともにプラトーになる時間枠として定義されます14。143B骨肉腫細胞の場合、13C4-アスパラギン酸は8時間で定常状態を達成する。実験の前に、目的の安定同位体でタイムコース実験を行うことにより、この時間枠を決定することがベストプラクティスです。
- 接着細胞からの代謝産物単離
- 開始する前に、ドライアイスの入ったバケツを準備し、HPLCグレードの水で80%HPLCグレードのMeOHを準備します。このバッファーを-80°Cの冷凍庫で一晩冷却するか、ドライアイスに直接置きます。
- インキュベーターから一度に1枚のプレートを取り出し、ウェルから培地を吸引し、1x PBSで2倍洗浄します。次のステップに進む前に、ウェルから残りのPBSをすべて取り除きます。
注意: 接着細胞の破壊を防ぐために、吸引中は必ずプレートを傾け、ピペットで皿の壁に押し付けてください。 - プレートをドライアイスの上に置き、すぐに800 μLの80%LCMSグレードのMeOHを20%LCMSグレードの水に各ウェルに加えます。
- プレートを-80°Cの冷凍庫で少なくとも15分間インキュベートして、細胞溶解を促進します。
注意: この時点で、次のプレートをインキュベーターから取り出し、手順2.2.1〜2.2.4を繰り返します。すべてのプレートが-80°Cの冷凍庫でインキュベートされるまで、これを続けます。 - 冷凍庫から一度に1枚のプレートを取り出し、セルリフターを使用してドライアイスで各ウェルをこすり、ライセートを1.5 mLのマイクロ遠心チューブに移します。次のステップまでチューブをドライアイスの上に置いてください。
- すべてのチューブを4°Cで10分間ボルテックスした後、4°Cで最高速度(少なくとも17,000 × g)で10分間遠心分離します。
- 上清を1.5 mLマイクロ遠心チューブに移し、-105 °Cのコールドトラップを備えた4°Cの真空濃縮器で、高真空設定で約6時間、またはサンプルが蒸発するまで乾燥させます。ライセートが乾燥したら、質量分析(LCMS)と組み合わせた液体クロマトグラフィー用に調製する準備ができるまで、代謝物ペレットを-80°Cで保存します。
- 極性代謝物の液体クロマトグラフィー-質量分析(LC-MS)測定
注:アスパラギン酸、 de novo ピリミジン生合成の中間体、およびUMPの検出を可能にするクロマトグラフィーおよび質量分析ワークフローで十分です14。- 乾燥したペレットに100 μLのHPLCグレードの水を加え、4°Cで10分間ボルテックスすることにより、氷上でLCMSのサンプルを調製します。
- サンプルを4°Cで最高速度(少なくとも17,000 × g)で10分間遠心分離し、25 μLを各LC-MSバイアルに移動します。
- 2 μL のライセートを LC-MS システムに注入します。一般的に使用される方法論を以下に示します。
- 20 mM 炭酸アンモニウム (LC-MS グレード) と 0.1% 水酸化アンモニウム (LC-MS グレード) を LC-MS グレードの水に溶解した 移動相 A を調製します。
- 移動相Bとして100%アセトニトリル(LC-MSグレード)を選択します。
- クロマトグラフィーには、親水性化合物用の 2.1 mm x 20 mm ガードカラムを備えた 5 μm、150 mm x 2.1 mm の分析カラムをお選びください ( 材料表を参照)。カラムオーブンを25°Cに設定します。
- 次の液体クロマトグラフィー設定を使用してください:0.15 mL/minの一定流速。80%から20%の移動相Bで20分間の線形勾配、続いて20%から80%の移動相Bで0.5分間の線形勾配、続いて80%移動相Bで7.5分間保持します。
- 次の質量分析計の設定を選択します:m / z 70 Daと1,000 Daの間のフルスキャン。70,000の解像度。1 × 106のAGC目標。最大射出時間は20msです。電源を極性切り替えモードで動作させます。スプレー電圧を3.0kV、加熱キャピラリーを275°C、HESIプローブを350°C、シースガス流量を40ユニット、補助ガス流量を15ユニット、スイープガス流量を1ユニットに設定します。
- LCMSワークフローとインターフェースする任意のソフトウェアを使用してデータ分析を実行します。
注:上記のワークフローで使用されるソフトウェアは、XCalibur(サーモ)とトレースファインダー(サーモ)です。データ分析の主な考慮事項の概要を以下に示します。- 予想される保存期間: 実験前にクロマトグラフィー法を使用して目的の各代謝物の標準物質を実行することにより、各代謝産物の保持時間を決定します。
注:UMPとその同位体(13C 3-UMPを含む)の保持時間はまったく同じです。 - 代謝物の期待されるM / Z:代謝物がマイナスイオンモード(UMPなど)でイオン化する場合、UMPの分子式からプロトン[C 9 H14N2O9P]を引いたものを使用して、予想される正確な質量を計算します。陽イオンモードでイオン化する代謝物の場合、分子式とプロトンを使用して正確な質量を計算します。
- 質量精度: Orbitrap 質量分析計を使用する場合、目的の代謝物とその同位体は質量精度 ±5 mmu を持つと予想されます。ソフトウェアを使用してこれを計算し、予想されるM/Zと実際に検出されたM/Zを考慮します。
- 自然存在量の補正:すべての追跡データは、自然界の~1%の13Cおよび~0.5%の15のN同位体を説明するために、自然存在量補正を受けることが期待されています15。
- 予想される保存期間: 実験前にクロマトグラフィー法を使用して目的の各代謝物の標準物質を実行することにより、各代謝産物の保持時間を決定します。
3. SDH活性を測定するための13 C5-グルタミン安定同位体追跡
- 13名接着細胞におけるC5-グルタミン安定同位体追跡
注:SDH活性は、13C5-グルタミントレース7、16、17でフマル酸塩とコハク酸塩の特定の同位体の相互変換を測定することによって直接モニターできます。複合体III阻害剤である抗マイシンは、SDH複合体の正味の方向性を変化させるための対照として使用されます(図4)。- 250,000〜500,000個の細胞を6ウェルディッシュに播種し、翌日に75%のコンフルエントを達成します。
- 50 mM 13C5-グルタミンのストックを調製する( 表1参照)。
- 2 mM 13C5-グルタミンを含むトレース培地を調製します( 表1を参照)。
- 各ウェルの培地を2 mM 13C5-グルタミンを含む培地に変更します。目的の細胞を標識する定常状態を達成するために、適切な時間数インキュベートします(ステップ2.1.3の注を参照)。
- ステップ2.2のプロトコルに従って代謝物を分離します。
- ステップ 2.3 で説明したワークフローに従って LC-MS でサンプルを分析します。
- ラベリングパターンに基づくSDH活性の分析
注:SDH複合体のコハク酸酸化活性は、13C5-グルタミントレース時に13 C 4-フマル酸塩と13C4-コハク酸塩の比率を評価することによってモニターできます。SDH複合体のフマル酸還元活性は、13C5-グルタミン追跡時に13C3-コハク酸塩と13C3-フマル酸塩の比率を評価することによってモニターすることができる。- 13C 3-フマル酸塩、13 C 4-フマル酸塩、13 C3-コハク酸塩、および13C4-コハク酸塩の標識率を計算します。 例えば、13C 3-フマル酸塩の割合を決定するには、フマル酸塩同位体(非標識フマル酸塩、13 C1-フマル酸塩、13 C2-フマル酸塩、13 C 3-フマル酸塩、および13 C4-フマル酸塩)のすべての積分ピーク面積を合計し、13C 3-フマル酸塩のピーク面積を総同位体面積で割ります。100を掛けます。
- コハク酸酸化を計算するには、13C 4-フマル酸塩の割合を13C4-コハク酸塩の割合で割ります。
- フマル酸減少を計算するには、13C3-コハク酸塩の割合を13C3-フマル酸塩の割合で割ります。
4. 直接複合体I活性アッセイ
注:DCPIPは人工電子受容体です。ユビキノールから電子を受け入れると還元型に変化します。このアッセイでは、ユビキノンは、NADHのNAD+への複合体Iを介した酸化を介してユビキノールに還元されます。したがって、この無細胞アッセイで酸化型DCPIPの代謝回転を測定することは、複合体I活性の代理となります7,18。
- 細胞からのミトコンドリアの精製と定量
注:任意のミトコンドリア精製プロトコルをこのアッセイに利用することができる19。- 25〜1億個の細胞が得られるまで細胞を拡大します。培地を皿から吸引し、1x PBSで洗浄し、PBSを吸引し、0.25%トリプシンで細胞をトライスピンします。トリプシンを培地でクエンチし、細胞を1,000 × g で5分間ペレット化します。
- 細胞ペレット2xを5 mLの1x PBSで洗浄し、1,000 × g で5分間遠心分離を繰り返して細胞をペレット化します。洗浄したペレットは、ミトコンドリアが精製されるまで-20°Cの冷凍庫に保管します。
注意: 細胞ペレットを複数回凍結解凍しないでください。 - ミトコンドリア単離バッファーを準備します( 表1を参照)。
注:ナトリウムはミトコンドリア膜電位20 を変色させ、ミトコンドリアカルシウム恒常性21を破壊するため、NaOHなどのナトリウム含有試薬はミトコンドリア単離バッファーの調製には使用しないでください。 - 細胞ペレットをミトコンドリア単離バッファー1 mLあたり1,000万細胞に再懸濁します。例えば、1億個のペレット細胞を10 mLのミトコンドリア単離バッファーに再懸濁します。
注:バッファーに気泡を導入せずに細胞塊を破壊してください。 - 2 mLの細胞懸濁液を、ポッターエルベジェムPTFE乳棒と互換性のある作業容量3〜8 mLの予冷ガラスホモジナイザーに移します。細胞を10〜20ストロークでホモジナイズし、顕微鏡下で細胞をモニタリングして、ホモジナイズプロセス全体を通して細胞溶解を確認します。効率的な細胞溶解を確実にするために、必要に応じてストローク数を増やします。
注:上記の方法で細胞を均質化しても細胞の溶解に効果がない場合は、シリンジ溶解法22に切り替えてください。 - 2 mLの細胞ライセートを氷上のマイクロ遠心チューブに移し、細胞懸濁液全体が均質になるまで上記の手順を繰り返します。
- 核と細胞破片を650 × g で4°Cの遠心分離機で10分間ペレット化します。
- 上清を新しい2.0 mLチューブに移し、上記の遠心分離を650 × g で4°Cで10分間繰り返します。
- 上清を新しい2.0 mLチューブに移し、粗ミトコンドリアを7,000 × g で4°Cの遠心分離機で10分間ペレット化します。
- 上清を捨て、ペレットを1 mLのミトコンドリア単離バッファーに再懸濁する。タンパク質定量のために50 μLを新しいチューブに移します。サンプルの2つのアリコート(50 μLのサンプルと残りの~950 μL)に対して上記の遠心分離手順を繰り返します。
- 上清を捨て、ペレットを使用できるようになるまで-80°Cの冷凍庫に保管します。
- 50 μLのアリコートからペレットに200 μLのRIPAバッファーを加えてタンパク質を抽出し、10分間ボルテックスし、21,000 × g で遠心分離してタンパク質を単離します。50 μLアリコート中のタンパク質量を定量し、この数値を使用して950 μLサンプル中の残りのタンパク質を定量します。例えば、50 μLアリコートのタンパク質定量が1 μg/μLの場合、残りのミトコンドリアペレット中の総タンパク質は950 μg(1 μg/μL×950 μL)です。
- 複合体I活性アッセイの実施
注:このアッセイには143B骨肉腫細胞株を使用しましたが、プロトコルは任意の培養細胞に適合させることができます。- 精製ミトコンドリアをミトコンドリア再懸濁バッファー( 表1を参照)に最終濃度5 mgタンパク質/ mLに再懸濁します。
- -20°Cの冷凍庫で5回の凍結融解サイクルを実行し、ミトコンドリアを透過させます。
- 複合体I活性アッセイバッファーを作る( 表1参照)。
- 5 mg/mL ミトコンドリアストック 50 ug を 90 μL の複合体 I 活性バッファーと混合します。複合体I活性を制御するために、5つの未処理の複製物と5つのロテノン処理(5 μM)の複製を準備します。
- 37°Cに設定したプレートリーダーで600 nmでのベースライン吸光度を読み取ります。
- NADHを終濃度2 mMに添加して反応を開始し、1時間のスパンにわたって吸光度(600 nm)を追跡し、全体を通して少なくとも2分ごとに測定します。吸光度の減少は、複合体I活性を介したDCPIPの減少を示す。
注意: NADHは、すべてのサンプルが同時に開始されるように、マルチチャンネルピペットを使用して追加する必要があります。
5. スーパーオキシドレベルを測定するためのLC-MSベースのアッセイ
注:MitoSox Redの蛍光特性は、スーパーオキシド23との反応とは無関係に変化する可能性があります。このLC-MSベースのアッセイは、MitoSox Redと反応するスーパーオキシドからの生成物を直接測定します。以下のアッセイは、Xiaoら24からわずかに変更されています。2-ヒドロキシ-ミトエチジウム(2-OH MitoE2+)は、スーパーオキシド反応の生成物です(図5)。このアッセイにはCaki1細胞株を利用しましたが、プロトコルは任意の培養細胞に適合させることができます。
- 接着細胞をマイトソックスレッドで処理
- 250,000〜500,000個の細胞を6ウェルディッシュに播種し、翌日に75%のコンフルエントを達成します。LC-MSアッセイ用のプレートセットと、細胞数の正規化用のプレートの複製セットを必ずシードしてください。
- ダルベッコの改変イーグル培地に10%の熱不活化FBSと1%のペニシリン-ストレプトマイシンを含む完全なDMEMを調製します。
- すべてのウェルの培地を2 mLの完全DMEMですべての条件でリフレッシュします。この時点で、関心のある薬や治療法を必ず追加してください。
- 細胞を組織培養インキュベーター内で1時間インキュベートします。
- ポジティブコントロールとネガティブコントロールを準備します。PBSで希釈した50 mMのtert-ブチルヒドロペルオキシドストックと、DMSOで希釈した250 mMのN-アセチルシステイン(NAC)ストックを準備します( 表1を参照)。
注:tertブチルヒドロペルオキシド(tBuOOH)は、ポジティブコントロールとして作用し、2-OH MitoE2+の量を増加させる強力な活性酸素種です。NACは、ネガティブコントロールとして作用し、tBuOOHによって引き起こされるスーパーオキシド生成を中和する強力な抗酸化剤です。 - 1 μLのtBuOOHをポジティブコントロールウェルに、1 μLのtBuOOH + 100 μLのNACをネガティブコントロールウェルに追加します。
注:P2ピペット(0.1〜2 μLの範囲)を使用することが、1 μLを移すのに最適な方法です。 - 組織培養インキュベーターで1時間インキュベートします。
- 1 mM MitoSox Red ストックを調製し ( 表 1 を参照)、2 μL の 1 mM MitoSox Red を各ウェルに添加して、最終濃度 1 μM にします。 組織培養インキュベーター内で30分間インキュベートします。
- この最終インキュベーション中に、重複したプレートの1つをカウントして細胞数を取得し、最終的なLC-MSデータを正規化します。
- 接着細胞からの酸化マイトソスレッド生成物の単離
- ドライアイスの入ったバケツを用意し、分離を開始する前に、冷たいHPLCグレードのイソプロパノールをドライアイスの上に置きます。
- プレートを1枚ずつ取り出し、ウェルから培地を吸引し、1 mLの1x PBSで2倍洗浄します。次のステップに進む前に、ウェルからすべての残留PBSを吸引します。
注意: 接着細胞の破壊を防ぐために、吸引中は必ずプレートを傾け、ピペットで皿の壁に押し付けてください。 - プレートをドライアイスの上に置き、各ウェルに800 μLのHPLCグレードイソプロパノールを加えます。
- プレートを-80°Cの冷凍庫で少なくとも15分間インキュベートして、細胞溶解を促進します。
注意: この時点で、次のプレートをインキュベーターから取り出し、手順5.2.1〜5.2.4を繰り返します。すべてのプレートが-80°Cの冷凍庫でインキュベートされるまで、これを続けます。 - 冷凍庫からプレートを1枚ずつ取り出し、セルリフターを使用してドライアイスで各ウェルをこすり、ライセートを1.5 mLのマイクロ遠心チューブに移します。次のステップまでチューブをドライアイスの上に置いてください。
- すべてのチューブを4°Cで10分間ボルテックスした後、4°Cで最高速度(少なくとも17,000 × g)で10分間遠心分離します。
- 上清を1.5 mLマイクロ遠心チューブに移し、真空濃縮器で乾燥させます。ライセートが乾燥したら、LC-MSの準備が整うまで代謝物ペレットを-80°Cで保存します。
- マイトソックスレッドおよび2-ヒドロキシミトエチジウム(2-OH MitoE2+)のLC-MS測定
- HPLCグレードのMeOH:クロロホルム:水の3:3:1混合物100 μLを加えて、氷上でLCMSのサンプルを調製します。4°Cで10分間ボルテックスします。
- 25 μL を各 LC-MS バイアルに移します。残りのサンプルは-80°Cの冷凍庫に保管してください。
- 以下の液体クロマトグラフィーバッファーを調製します:i)バッファーA:0.1%ギ酸を含むHPLCグレードの水;ii)緩衝液B:0.1%ギ酸を含むHPLCグレードアセトニトリル。
- サーモ XCalibur インストゥルメントセットアップアプリを開いて、メソッドの開発を開始します。
- このウィンドウの左側のサイドバーにある2つのボックスを探してください-最初のボックスはクロマトグラフィーメソッド開発を可能にし、2番目のボックスは質量分析メソッド開発を可能にします。
- 液体クロマトグラフィー法開発:
- 流速を0.25 mL/minに設定し、20%Bでメソッドを開始し、12分間で95%Bまで上昇します。次の 1 分間で、バッファー B を 20% B に戻し、次の 2 分間そのレベルを維持します。
注:20%Bでの最後の2分間の流量は、カラム圧力が初期圧力まで低下し、適切なバッファー比でカラムを平衡化するために重要です。この平衡化ステップを含めないと、それ以降に実行されるすべてのサンプルの保持時間がシフトします。
- 流速を0.25 mL/minに設定し、20%Bでメソッドを開始し、12分間で95%Bまで上昇します。次の 1 分間で、バッファー B を 20% B に戻し、次の 2 分間そのレベルを維持します。
- 次のパラメータを使用して チューニングファイル を作成します。
- Tune アプリを開き、新しい tune ファイルを作成します。
- メソッド設定モジュール(ステップ5.3.9.3を参照)の重複する設定(スキャン範囲、分解能、極性、AGCターゲット、最大ITなど)もこのチューンファイルに適用します。
- シースガスを30に、補助ガスを3に、スイープガスも3に設定します。スプレー電圧を3 kV、毛細管温度を300、SレンズのRFレベルを60に設定します。
- 質量分析法の開発:
- 潜在的なスキャンの左下のリストから、Full MSをウィンドウの中央にドラッグアンドドロップします。ドロップ後のフルMSスクエアをクリックして、設定を調整してください。MSメソッドの合計期間は13分です。
注:LC法はMS法よりも長くなりますが、これは最後の2分間がカラムの再調整であり、代謝物の定量ではないためです。 - モジュールの右側の [ メソッドのプロパティ] で、[ メソッドの期間 ] と [ 実行時間 ] が [13.00 分] に設定されていることを確認します。
- このフル スキャンを、解像度 70,000、AGC ターゲット 1 × 106 でポジティブ モードで実行します。[最大 IT] を 100 ミリ秒に設定し、[スキャン範囲] を 300 m/z から 700 m/z に設定します。
- モジュールの上部にある [ チューニング ファイル ] で、作成したチューニング ファイルがこのメソッドにリンクされていることを確認します。
- 潜在的なスキャンの左下のリストから、Full MSをウィンドウの中央にドラッグアンドドロップします。ドロップ後のフルMSスクエアをクリックして、設定を調整してください。MSメソッドの合計期間は13分です。
- MitoSox Red検出のメソッドを2 μLのサンプル注入で実行します。
結果
DHODH、複合体I、および複合体Vの活性はすべて、増殖アッセイを用いて評価することができる。培養液からウリジンが奪われると、細胞はピリミジン生合成のための de novo 経路により依存するようになります。したがって、細胞をウリジンを含まない培地で増殖させるように挑戦した場合、ウリジンを含む培地で培養した細胞よりも、ブレキナーによるDHODH活性の阻害に対してより敏感でした(図6A)。同様に、培養液からのピルビン酸の除去は、細胞を増殖のための複合体I活性により依存させる。したがって、細胞をピルビン酸を含まない培地で増殖させるように挑戦した場合、ピルビン酸含有培地で培養した細胞よりも、ロテノンによる複合体I活性の阻害に対してより感受性がありました(図6B)。複合体V活性は、グルコースの代わりにガラクトースを含む培地中で細胞を増殖させることによって評価することができる。ガラクトースは解糖系で正味ゼロのATPを生成するため、この燃料で増殖する細胞は、複雑なV活性を介したミトコンドリアATP合成により依存しています。したがって、ガラクトース含有培地中で増殖する細胞は、グルコース含有培地中で増殖する細胞よりもオリゴマイシンによる複合体V阻害に対してより感受性であった(図6C)。
SDH活性は、13C5-グルタミントレースを使用し、フマル酸塩およびコハク酸同位体への取り込みをモニタリングすることによって測定できます。ビヒクル処理条件では、SDH複合体は前方活性に有利であり、13C 4-フマル酸塩への13 C4-コハク酸塩の取り込みは、13 C 3-フマル酸塩の13 C3-コハク酸塩への取り込みよりも高かった(図7)。抗マイシン処理条件では、SDH複合体は逆の活性に有利であり、13C 3-フマル酸塩の13 C3-コハク酸塩への取り込みは、13 C 4-コハク酸塩の13C4-フマル酸塩への取り込みよりも大きかった(図7)。
ミトコンドリア内部のスーパーオキシド産生は、スーパーオキシドと反応すると2-ヒドロキシ-ミトエチジウムを生成する蛍光レポーターMitoSoxを用いて測定することができる。この研究では、tertブチル過酸化水素の存在下でMitoSoxで処理された細胞は、細胞のROSを消光する抗酸化物質であるNACの添加によって抑制された方法で、より高いレベルの2-ヒドロキシ-ミトエチジウムを示しました(図8)。
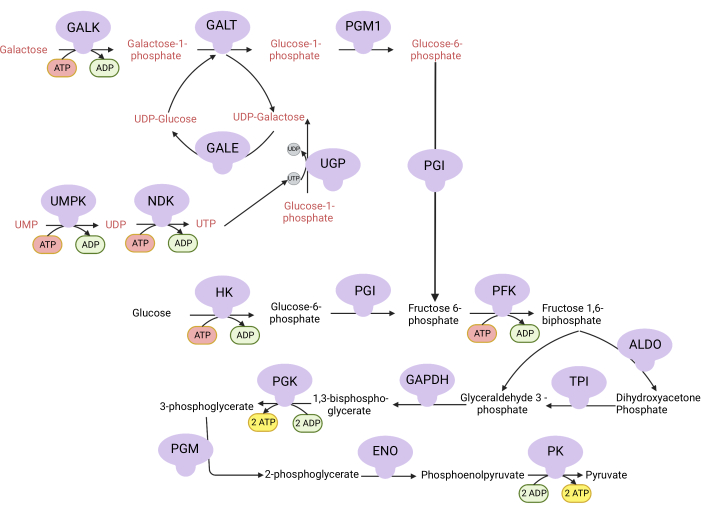
図1:複雑なV増殖アッセイの機構的基礎。 解糖によるグルコースとガラクトースの酸化。グルコースは解糖系から正味2個のATPを生成しますが、ガラクトースはUDP-ガラクトースにはUTP合成が必要であるため、正味ゼロのATPを生成します。したがって、ガラクトースで増殖した細胞は、解糖系から産生されるATPが不足しているため、ミトコンドリアATP合成により依存しています。略語:GALK =ガラクトキナーゼ;GALT = ガラクトース-1-リン酸ウリジリルトランスフェラーゼ;PGM1 = ホスホグルコムターゼ 1;GPI = グルコース-6-リン酸イソメラーゼ、UGP = UDP-グルコースピロホスホリラーゼ;GALE = UDP-ガラクトース-4-エピメラーゼ;NDK = ヌクレオチド二リン酸キナーゼ;UMPK = ウリジン一リン酸キナーゼ;HK = ヘキソキナーゼ;PFK = ホスホフルクトキナーゼ;アルド=アルドラーゼ;TPI = トリオースリン酸イソメラーゼ;GAPDH = グリセルアルデヒド-3-リン酸デヒドロゲナーゼ;PGK = ホスホグリセリン酸キナーゼ;PGM = ホスホグルコムターゼ;ENO = エノレーゼ;PK = ピルビン酸キナーゼ。 この図の拡大版を表示するには、ここをクリックしてください。
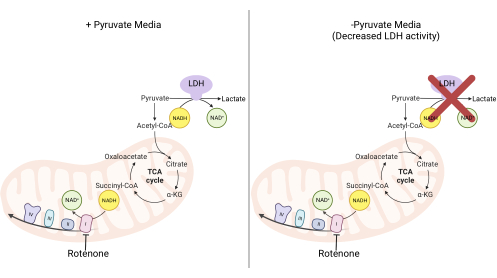
図2:複合体I増殖アッセイの機構的基礎。 複合体I活性の阻害時に変化する代謝経路の概略図。高ピルビン酸培地では、複合体I阻害はLDHを介したNADH酸化によってバイパスされます。低ピルビン酸培地では、この適応はあまり実現不可能であり、細胞はNADHを再酸化するために複合体I活性により依存するようになります。略語:LDH =乳酸デヒドロゲナーゼ;TCAサイクル=トリカルボン酸サイクル。 この図の拡大版を表示するには、ここをクリックしてください。
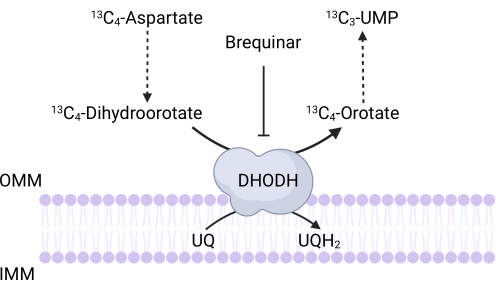
図3:13C4-アスパラギン酸トレース時のDHODH反応の模式図。ブレキナーはジヒドロオロテートのオロチン酸への酸化を阻害し、UMPの下流合成を妨げます。13名C4-アスパラギン酸は、DHODH活性を介して13C3-UMPに組み込まれる。略語:OMM =外側ミトコンドリア膜;IMM = ミトコンドリア内膜;DHODH = ジヒドロオロテートデヒドロゲナーゼ。この図の拡大版を表示するには、ここをクリックしてください。
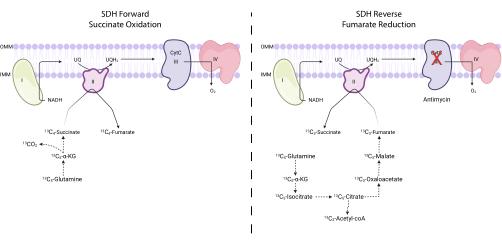
図4:13C5-グルタミントレースによる順方向および逆方向の複合体II活性の測定。複合体IIの前方活性を測定するために(左)、13C4-コハク酸塩および13 C4-フマル酸塩への13C 5-グルタミンの取り込みをモニターした。逆複合体II活性を測定するために(右)、13C 3-コハク酸塩および13 C3-フマル酸塩への13C5-グルタミンの取り込みをモニターした。略語:SDH =コハク酸デヒドロゲナーゼ;CytC = シトクロムC. この図の拡大版を表示するには、ここをクリックしてください。
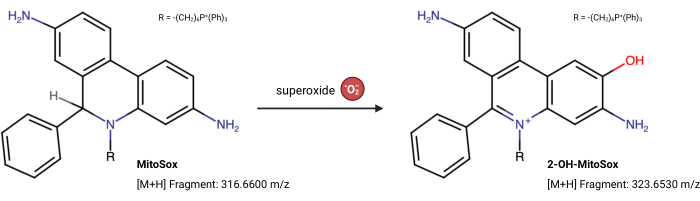
図5:スーパーオキシドとのマイトソックスレッド反応。 MitoSoxとミトコンドリアスーパーオキシドとの反応により、2-OH-MitoE2+が形成されます。 この図の拡大版を表示するには、ここをクリックしてください。
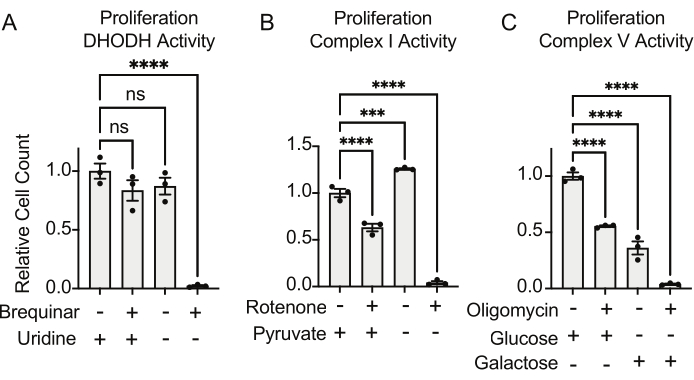
図6:ミトコンドリア機能を測定するための増殖ベースのアッセイ (A)±100 ug/mLウリジンを含む培地でのDHODH阻害剤である5 uMブレキナーで処理した143B骨肉腫細胞の増殖。データはSEM±平均です。条件ごとにN = 3。(B)±5 mMピルビン酸を含む培地中で、複合体I阻害剤である2 uMロテノンで処理した143B骨肉腫細胞の増殖。データはSEM±平均です。条件ごとにN = 3。(C)複合V阻害剤である5 μMオリゴマイシンで処理した143B骨肉腫細胞の、10 mMグルコースまたは10 mMガラクトースのいずれかを唯一の中心炭素源とする培地での増殖。データはSEM±平均です。条件ごとにN = 3。*は、グラフパッドプリズムの一元配置分散分析(ANOVA)検定を使用した p < 0.05を示します。 この図の拡大版を表示するには、ここをクリックしてください。
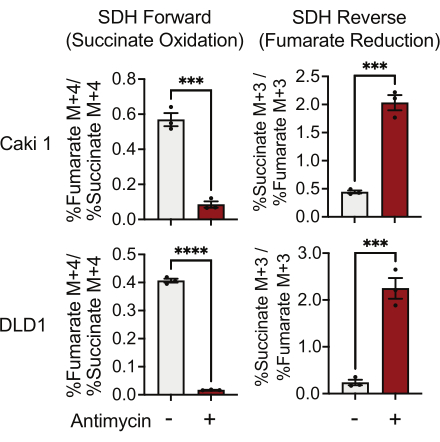
図7:複合体II活性を測定するための13C5-グルタミントレース。DMSOおよび500 nM抗マイシンA処理Caki1およびDLD1細胞におけるコハク酸酸化およびフマル酸還元(SDH逆)。データはSEM±平均を表します。条件ごとにN = 3。は、GraphPad Prismの対応のないt検定を使用してp < 0.05を示します。略語:SDH =コハク酸酸化;SDHリバース=フマル酸還元。この図の拡大版を表示するには、ここをクリックしてください。
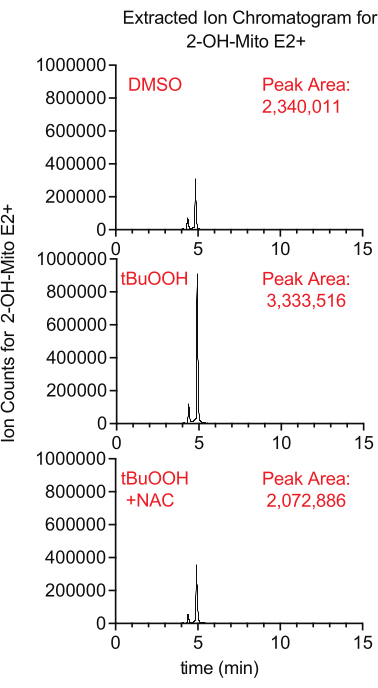
図8:スーパーオキシドを検出するためのLCMSベースのMitoSoxアッセイ。 tBuOOH ± NACの存在下でMitoSoxで30分間処理したCaki1細胞から単離した2-OH-Mito E2+ のイオンクロマトグラムを抽出しました。略語:LCMS =液体クロマトグラフィー - 質量分析;NAC = N-アセチルシステイン。 この図の拡大版を表示するには、ここをクリックしてください。
表1:このプロトコルで使用される試薬、バッファー、および培地の組成。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
新たな研究により、哺乳類のミトコンドリアは分子状酸素を消費せずに機能できることが示されているため、研究者がミトコンドリアの機能を正確に定量化するために、OCR測定を超えて直交アッセイを採用することが最も重要です。ここでは、ミトコンドリアNAD+/NADHバランス、適応末端電子受容体の利用、ATPの産生、 de novo ピリミジン生合成、およびミトコンドリア由来ROSを測定することにより、複合体I、複合体II、複合体V、およびDHODHの活性を直接評価するために使用できる一連のアッセイをまとめました。特に、これらのアッセイは、OCR測定よりもミトコンドリア機能をより直接的に測定します。さらに、これらのアッセイは、低酸素状態のミトコンドリア機能を定量化するための扱いやすい方法を研究者に提供しますが、フマル酸塩が好まれる末端電子受容体として使用されているため、OCR測定はほとんど無関係です。最後に、ここで説明する増殖ベースの方法は、従来の呼吸測定実験よりも費用効果が高いため、哺乳類システムのミトコンドリア機能を研究するための広くアクセス可能な方法を提供します。
これらのアッセイを利用して培養細胞のミトコンドリア機能を測定する際には、重要な考慮事項があります。増殖アッセイに関しては、各細胞株の倍増率に合わせて播種する細胞数を調整することが重要です。細胞は、増殖の違いを定量化できるように、少なくとも10%のコンフルエントに播種し、3〜4倍に十分なスペースを確保する必要があります。各アッセイの別の考慮事項は、各ETC複合体の活性のコントロールとして使用される低分子の濃度です。異なる細胞株はこれらの阻害剤に対して異なる感受性を示す可能性があるため、これらの低分子の用量をテストして最適な濃度を特定することが重要です。
OCR測定およびここに記載されているすべてのアッセイを含む、in vitroでミトコンドリア機能を研究するアッセイの普遍的な制限は、培地の代謝組成です。標準的な細胞培養培地は、システムを表面的に高いレベルのミトコンドリア機能に偏らせる傾向があります。例えば、超生理学的グルタミンレベルは、TCAサイクル25のアナプレローシスを増加させ、ミトコンドリアNADH合成を促進し、その結果、酸化的リン酸化を増加させる。同様に、酸素分圧は、哺乳類組織では3mmHgから100mmHg(約0.1%〜13%O2)の範囲であるが、インビトロでは大気(140mmHg、約21%)である26,27。この過剰のO2は、ミトコンドリア呼吸能力およびスーパーオキシド産生を最大にする28。最近、より生理学的になるように培養培地を設計する努力がなされている29、30。注目すべきことに、ヒト血漿様培地中で細胞を培養すると、一部の癌細胞株30におけるミトコンドリア呼吸、T細胞31におけるミトコンドリアROS、および癌治療へのミトコンドリア適応32が減少する。したがって、使用する培地の組成に注意し、それがミトコンドリア機能にどのように影響するかを理解することが重要です。
ミトコンドリア機能の解釈における別の重要かつ普遍的な制限は、ミトコンドリアの数の違いの可能性である。したがって、mtDNA33の定量、膜電位非感受性色素34によるミトコンドリア質量の測定、またはミトコンドリアマーカーのウェスタンブロッティングのいずれかを通じてミトコンドリア含有量を測定することが重要です。これは、ミトコンドリア数の減少がミトコンドリア機能の低下と間違えられないようにするための重要な制御です。
また、ここで説明するアッセイに適用される特定の制限とトラブルシューティングもあります。第一に、分化した細胞が増殖しないことを考えると、増殖ベースのアッセイは、この文脈でミトコンドリア機能を評価するのに有用ではないであろう。DHODH活性を測定するための13C4-アスパラギン酸トレースプロトコルの主な制限は、細胞内でのアスパラギン酸の取り込みが非常に非効率的である可能性があることです35。この潜在的な限界を克服するために、研究者はアスパラギン酸トランスポーターSLC1A3を過剰発現して、13C4-アスパラギン酸の取り込みを促進することができます35。
SDH活性を測定するために13C5-グルタミントレースを使用するプロトコルの制限は、このアッセイでは、逆活性を測定するために細胞が還元カルボキシル化経路を利用してM+3同位体を濃縮する必要があることです。一部の細胞株は、ATPクエン酸リアーゼ発現が低い36、不十分なHIF安定化37、またはα-KG:クエン酸比が低すぎる38のために、還元的カルボキシル化フラックスができません。この制限を克服するために、13C4-アスパラギン酸トレースを利用してSDHの順方向および逆方向の活動を測定することができます7。このアッセイでは、SDHの前方活性は、フマル酸塩M+2:コハク酸塩M+2の比と、コハク酸M+4:フマル酸塩M+4の逆反応によって測定できます。特に、このトレースは還元的カルボキシル化経路のほとんどの酵素を回避します。
読み出しとしてDCPIP還元を使用する複合体I活性アッセイの制限は、ミトコンドリアが構造的に無傷ではないことである。ミトコンドリアを凍結融解してアッセイのためのNADH取り込みを可能にするプロセスは、ミトコンドリア膜の構造的完全性を確実に損なう可能性がある39。このアッセイは、複合体I増殖アッセイなどのアッセイと並行して実施し、観察された複合体I活性の変化が無傷の細胞にも当てはまることを確認する必要があります。
将来の研究では、これらの技術のいくつかは、マウスやCaenorhabditis elegansなどのモデル生物を使用して、in vivoでミトコンドリア機能を測定するために適用することができます。生体内でミトコンドリア機能を測定するために使用されている現在の方法は、生物レベルのOCR、特にマウスモデルを使用した場合の呼吸交換速度に集中しています。この方法の明らかな制限は、酸素がミトコンドリアETCのユビキタス末端電子受容体としての役割を超えて、多くの生化学的およびシグナル伝達機能を果たすことです。例えば、酸素はジオキシゲナーゼファミリーの酵素の触媒活性によって「消費」される。これらの酵素は細胞の酸素消費速度に寄与しますが、ミトコンドリア機能に参加、調節、または反映しません。in vitroでの古典的な呼吸測定実験は、典型的には「非ミトコンドリアOCR」を制御するが、生物呼吸交換比(RER)実験はこれを制御できず、in vivoでのミトコンドリア機能の指標としてのRERの解釈を制限する。しかし、13C4-アスパラギン酸トレースによるDHODH活性、13C5-グルタミントレースによる複合体II活性、組織から精製したミトコンドリアに対する複合体I活性、およびMitoBなどのLC-MSに優しい化合物を用いたミトコンドリアROSを測定するためにプロトコルを適応させて、in vivoでのミトコンドリア機能を測定することは可能です.ミトコンドリアの機能を調べるためのこれらの直接アッセイは、古典的な呼吸測定実験と組み合わせて、研究者に哺乳類の細胞および組織におけるミトコンドリア機能のより包括的で正確な評価を提供します。
開示事項
著者には、報告すべき利益相反はありません。
謝辞
この原稿で制作された図は、BioRender.com で作成されました。この記事に関するフィードバックを提供してくださった Amy Walker に感謝します。J.B.S.はウースター生物医学研究助成財団の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube | Cell Treat | 667443 | |
| 2.0 mL tube | Cell Treat | 229446 | |
| 6-well plate | Cell Treat | 229106 | |
| 12-well plate | Cell Treat | 229112 | |
| 13C4-aspartate | Sigma-Aldrich | 604852 | |
| 13C5-Glutamine | Cambridge Isotope Laboratories | 285978-14-5 | |
| 15 mL centrifuge tube | Cell Treat | 667411 | |
| 50 mL centrifuge tube | Cell Treat | 667421 | |
| 150 mm tissue culture dish | Cell Treat | 229651 | |
| 1x Phosphate-buffered saline | Gibco | 10010049 | |
| 2,6-dichlorophenolindophenol | Honeywell | 33125 | |
| Ammonium Carbonate | Sigma-Aldrich | 37999 | |
| Antimycin | Sigma-Aldrich | A8674 | |
| Ascentis Express C18 | Sigma-Aldrich | 53825-U | |
| Bottle top filter 500 mL, 0.22 µm, PES 9 9 mm membrane diameter | Cell Treat | 229717 | |
| Bovine Serum Albumin | Sigma-Aldrich | A3294 | |
| Brequinar | Sigma-Aldrich | SML0113 | |
| Cell Lifter, Double End Flat and Narrow Blade | Cell Treat | 229305 | |
| CentriVap -105 Cold Trap | Labconco | 7385020 | |
| Complete Protease Inhibitor Tablets | Sigma-Aldrich | 4693116001 | |
| Coulter Counter Cups | Fisher Scientific | 07-000-694 | |
| Decylubiquinone | Sigma-Aldrich | D7911 | |
| DMSO | Invitrogen | D12345 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 11995-065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| EGTA | Sigma-Aldrich | E3889 | |
| Eppendorf Centrifuge 5425R | Eppendorf | 2231000908 | |
| Eppendorf Centrifuge 5910 Ri | Eppendorf | 5943000343 | |
| Galactose | Sigma-Aldrich | G5388 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glucose-free DMEM | Gibco | 11966025 | |
| Glutamine-free DMEM | Thermo Fisher | 11960044 | |
| Heat-Inactivated Fetal Bovine Serum | Sigma-Aldrich | F4135 | |
| Hepes | Sigma-Aldrich | H3375 | |
| HPLC-grade 35% Ammonium hydroxide | Thermo Scientific | 460801000 | |
| HPLC-grade Acetonitrile | Sigma-Aldrich | 900667 | |
| HPLC-grade Chloroform | Sigma-Aldrich | 366927 | |
| HPLC-grade formic acid | Thermo Scientific | 28905 | |
| HPLC-grade Isopropanol | Sigma-Aldrich | 563935 | |
| HPLC-grade MeOH | Sigma-Aldrich | 900688 | |
| HPLC-grade Water | Sigma-Aldrich | 270733 | |
| Human Osteosarcome Cell Line 143B | ATCC | CRL-8303 | |
| Hydrochloric Acid | Sigma-Aldrich | 320331-500ML | |
| Isotone buffer | Beckman Coulter | 8546719 | |
| K2HPO4 | Sigma-Aldrich | P2222 | |
| Mannitol | Sigma-Aldrich | M4125 | |
| MitoSox Red | Invitrogen | M36008 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Oligomycin | Sigma-Aldrich | 75351-5MG | |
| Pencillin Streptomycin | Gibco | 15140-122 | |
| Potter-Elvehjem Tissue Grinder, Size 21 | Kimble | 885502-0021 | |
| Pyruvate | Sigma-Aldrich | P5280 | |
| Pyruvate-free DMEM media | Gibco | 11965175 | |
| Q Exactive Plus Mass Spectrometer | Thermo Scientific | 726030 | |
| ReCO2ver Incubator | Baker | ||
| Refrigerated Centrivap Benchtop Vacuum Concentrator | Labconco | 7310020 | |
| RIPA Buffer | Millipore Sigma | 20188 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| SeQuant ZIC-pHILIC 5μm 150 x 2.1 mm analytical column | Sigma-Aldrich | 1.50460.0001 | |
| SeQuant ZIC-pHILIC guard kit | Millipore Sigma | 1.50438.0001 | |
| Sodium Hydroxide, Pellets | Millipore Sigma | 567530-250GM | |
| Sucrose | Sigma-Aldrich | S0389 | |
| SW, TRACEFINDER 5.1 SP3 | Thermo Scientific | OPTON-31001 | |
| Tert-butyl hydroperoxide solution | Sigma-Aldrich | 458139 | |
| Tris | Sigma-Aldrich | 93352 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25-200-114 | |
| Uridine | Sigma-Aldrich | U3003 | |
| VANQUISH HORIZON / FLEX HPLC | Thermo Scientific | VF-S01-A-02 | |
| Z2 Coulter Particle count and size analyzer | Beckman Coulter | BZ10131270 |
参考文献
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 16080 (2016).
- Chandel, N. S., et al. Reactive oxygen species generated at mitochondrial complex III stabilize hypoxia-inducible factor-1alpha during hypoxia: A mechanism of O2 sensing. Journal of Biological Chemistry. 275 (33), 25130-25138 (2000).
- Cadenas, E., Boveris, A., Ragan, C. I., Stoppani, A. O. M. Production of superoxide radicals and hydrogen peroxide by NADH-ubiquinone reductase and ubiquinol-cytochrome C reductase from beef-heart mitochondria. Archives of Biochemistry and Biophysics. 180 (2), 248-257 (1977).
- Murphy, M. P. How mitochondria produce reactive oxygen species. Biochemical Journal. 417 (1), 1-13 (2009).
- Schieber, M., Chandel, N. S. ROS function in redox signaling and oxidative stress. Current Biology. 24 (10), 453-462 (2014).
- Spinelli, J. B., et al. Fumarate is a terminal electron acceptor in the mammalian electron transport chain. Science. 374 (6572), 1227-1237 (2021).
- Kumar, R., et al. A redox cycle with complex II prioritizes sulfide quinone oxidoreductase-dependent H(2)S oxidation. Journal of Biological Chemistry. 298 (1), 101435 (2022).
- Warburg, O., Geissler, A. W., Lorenz, S. On growth of cancer cells in media in which glucose is replaced by galactose. Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 348 (12), 1686-1687 (1967).
- Marroquin, L. D., Hynes, J., Dykens, J. A., Jamieson, J. D., Will, Y. Circumventing the Crabtree effect: replacing media glucose with galactose increases susceptibility of HepG2 cells to mitochondrial toxicants. Toxicological Sciences. 97 (2), 539-547 (2007).
- Attardi, G., King, M. P. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Bodnar, A. G., Cooper, M., Leonard, J. V., Schapira, A. H. Respiratory-deficient human fibroblasts exhibiting defective mitochondrial DNA replication. Biochemical Journal. 305, 817-822 (1995).
- Gregoire, M., Morais, R., Quilliam, M. A., Gravel, D. On auxotrophy for pyrimidines of respiration-deficient chick embryo cells. European Journal of Biochemistry. 142 (1), 49-55 (1984).
- Mackay, G. M., Zheng, L., vanden Broek, N. J., Gottlieb, E. Analysis of cell metabolism using LC-MS and isotope tracers. Methods in Enzymology. 561, 171-196 (2015).
- Heinrich, P., et al. Correcting for natural isotope abundance and tracer impurity in MS-, MS/MS- and high-resolution-multiple-tracer-data from stable isotope labeling experiments with IsoCorrectoR. Scientific Reports. 8 (1), 17910 (2018).
- Lee, P., Chandel, N. S., Simon, M. C. Cellular adaptation to hypoxia through hypoxia inducible factors and beyond. Nature Reviews Molecular Cell Biology. 21 (5), 268-283 (2020).
- Bisbach, C. M., et al. Succinate can shuttle reducing power from the hypoxic retina to the O(2)-rich pigment epithelium. Cell Reports. 31 (2), 107606 (2020).
- Angebault, C., et al. Idebenone increases mitochondrial complex I activity in fibroblasts from LHON patients while producing contradictory effects on respiration. BMC Research Notes. 4, 557 (2011).
- Liao, P. C., Bergamini, C., Fato, R., Pon, L. A., Pallotti, F. Isolation of mitochondria from cells and tissues. Methods in Cell Biology. 155, 3-31 (2020).
- Iwai, T., et al. Sodium accumulation during ischemia induces mitochondrial damage in perfused rat hearts. Cardiovascular Research. 55 (1), 141-149 (2002).
- Murphy, E., Eisner, D. A. Regulation of intracellular and mitochondrial sodium in health and disease. Circulation Research. 104 (3), 292-303 (2009).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), e52076 (2015).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Xiao, Y., Meierhofer, D. Are hydroethidine-based probes reliable for reactive oxygen species detection. Antioxidants and Redox Signaling. 31 (4), 359-367 (2019).
- DeBerardinis, R. J., et al. Beyond aerobic glycolysis: Transformed cells can engage in glutamine metabolism that exceeds the requirement for protein and nucleotide synthesis. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19345-19350 (2007).
- Keeley, T. P., Mann, G. E. Defining physiological normoxia for improved translation of cell physiology to animal models and humans. Physiological Reviews. 99 (1), 161-234 (2019).
- Ast, T., Mootha, V. K. Oxygen and mammalian cell culture: Are we repeating the experiment of Dr. Ox. Nature Metabolism. 1 (9), 858-860 (2019).
- Gu, C., Jun, J. C. Does hypoxia decrease the metabolic rate. Frontiers in Endocrinology. 9, 668 (2018).
- Voorde, J., et al. Improving the metabolic fidelity of cancer models with a physiological cell culture medium. Scientific Advances. 5 (1), 7314 (2019).
- Cantor, J. R., et al. Physiologic medium rewires cellular metabolism and reveals uric acid as an endogenous inhibitor of UMP synthase. Cell. 169 (2), 258-272 (2017).
- MacPherson, S., et al. Clinically relevant T cell expansion media activate distinct metabolic programs uncoupled from cellular function. Molecular Therapy. Methods and Clinical Development. 24, 380-393 (2022).
- Torres-Quesada, O., Doerrier, C., Strich, S., Gnaiger, E., Stefan, E. Physiological cell culture media tune mitochondrial bioenergetics and drug sensitivity in cancer cell models. Cancers. 14 (16), 3917 (2022).
- Chan, S. W., Chen, J. Z. Measuring mtDNA damage using a supercoiling-sensitive qPCR approach. Methods in Molecular Biology. 554, 183-197 (2009).
- Doherty, E., Perl, A. Measurement of mitochondrial mass by flow cytometry during oxidative stress. Reactive Oxygen Species. 4 (10), 275-283 (2017).
- Birsoy, K., et al. An essential role of the mitochondrial electron transport chain in cell proliferation is to enable aspartate synthesis. Cell. 162 (3), 540-551 (2015).
- Beigneux, A. P., et al. ATP-citrate lyase deficiency in the mouse. Journal of Biological Chemistry. 279 (10), 9557-9564 (2004).
- Gameiro, P. A., et al. In vivo HIF-mediated reductive carboxylation is regulated by citrate levels and sensitizes VHL-deficient cells to glutamine deprivation. Cell Metabolism. 17 (3), 372-385 (2013).
- Fendt, S. M., et al. Reductive glutamine metabolism is a function of the alpha-ketoglutarate to citrate ratio in cells. Nature Communications. 4, 2236 (2013).
- Lee, C. P. Biochemical studies of isolated mitochondria from normal and diseased tissues. Biochimica et Biophysica Acta. 1271 (1), 21-28 (1995).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved