Method Article
בדיקות שאינן תלויות בחמצן למדידת תפקוד המיטוכונדריה ביונקים
In This Article
Summary
במאמר זה אנו מציגים אוסף של בדיקות למדידה ישירה של תפקוד המיטוכונדריה בתאי יונקים ללא תלות ביכולתם לצרוך חמצן מולקולרי.
Abstract
זרימת האלקטרונים בשרשרת הובלת האלקטרונים במיטוכונדריה (ETC) תומכת בפונקציות ביו-סינתטיות, ביו-אנרגטיות ואיתות רב-פנים בתאי יונקים. מכיוון שחמצן (O 2) הוא מקבל האלקטרונים הסופניים הנפוץ ביותר עבור יונקים ETC, קצב צריכת O2 משמש לעתים קרובות כפרוקסי לתפקוד המיטוכונדריה. עם זאת, מחקרים חדשים מראים כי פרמטר זה אינו תמיד מעיד על תפקוד מיטוכונדריאלי, שכן ניתן להשתמש בפומרט כמקבל אלקטרונים חלופי כדי לקיים תפקודים מיטוכונדריאליים בהיפוקסיה. מאמר זה אוסף סדרה של פרוטוקולים המאפשרים לחוקרים למדוד את תפקוד המיטוכונדריה ללא תלות בקצב הצריכה של O2. בדיקות אלה שימושיות במיוחד כאשר חוקרים תפקוד מיטוכונדריאלי בסביבות היפוקסיות. באופן ספציפי, אנו מתארים שיטות למדידת ייצור ATP מיטוכונדריאלי, ביוסינתזה של דה נובו פירימידין, חמצון NADH על ידי קומפלקס I, וייצור סופראוקסיד. בשילוב עם ניסויי רספירומטריה קלאסיים, בדיקות אורתוגונליות וחסכוניות אלה יספקו לחוקרים הערכה מקיפה יותר של תפקוד המיטוכונדריה במערכת העניין שלהם.
Introduction
תפקוד המיטוכונדריה הוא מדד קריטי לבריאות התאים, שכן הוא מקיים פונקציות ביו-סינתטיות, ביו-אנרגטיות ואיתות מרכזיות בתאי יונקים1. הרוב המכריע של תפקודי המיטוכונדריה דורשים זרימת אלקטרונים דרך שרשרת הובלת האלקטרונים (ETC), ושיבושים בזרימת האלקטרונים ב-ETC גורמים למחלה מיטוכונדריאלית חמורה2. ה-ETC מורכב מסדרה של תגובות חיזור וחמצון (חמצון-חיזור) המוטבעות בקרום המיטוכונדריאלי הפנימי, ותגובות העברת אלקטרונים אלה משחררות אנרגיה חופשית שניתן לרתום לתמיכה בסינתזה של ATP, תהליכים פיזיולוגיים כגון תרמוגנזה, מסלולים ביוסינתטיים כגון ביוסינתזה של פירימידין דה נובו, ואיזון מצב החיזור של קו-פקטורים כגון NADH. קומפלקס ETC I ו- III מייצרים מיני חמצן תגובתי (ROS)3,4,5, אשר, בתורם, מווסתים מסלולי איתות מרכזיים כגון HIF, PI3K, NRF2, NFκB ו- MAPK 6. כתוצאה מכך, מדדים של זרימת אלקטרונים ב-ETC משמשים באופן קלאסי כפרוקסי לתפקוד מיטוכונדריאלי בתאי יונקים.
ניסויי רספירומטריה משמשים לעתים קרובות למדידת תפקוד המיטוכונדריה בתאי יונקים. מכיוון ש-O2 הוא מקבל האלקטרונים הסופיים הנפוץ ביותר עבור היונקים ETC, ההפחתה שלו משמשת כפרוקסי לתפקוד המיטוכונדריה. עם זאת, ראיות חדשות מראות כי מיטוכונדריה של יונקים יכולים להשתמש בפומרט כמקבל אלקטרונים כדי לקיים תפקודים מיטוכונדריאליים התלויים ב-ETC, כולל ביוסינתזה של דה נובו פירימידין 7, חמצון NADH7 וניקוי רעלים של מימן גופרתי 8. לכן, בהקשרים מסוימים, במיוחד בסביבות היפוקסיות, מדידות של שיעור צריכת O2 (OCR) אינן מספקות אינדיקציה מדויקת או מדויקת לתפקוד המיטוכונדריה.
כאן, אנו מתארים סדרה של בדיקות שניתן להשתמש בהן כדי למדוד את תפקוד המיטוכונדריה ללא תלות ב- OCR. אנו מספקים בדיקות למדידה ישירה של חמצון NADH מורכב בתיווך I, ביוסינתזה של דיהידרורוט דהידרוגנאז בתיווך דה נובו פירימידין, סינתזת ATP מורכבת תלוית V, כיווניות נטו של קומפלקס סוקצינאט דהידרוגנאז (SDH) ו-ROS שמקורו במיטוכונדריה. בדיקות אלה נועדו להתבצע על תאי יונקים בתרבית, אם כי רבים מהם יכולים להיות מותאמים לחקר תפקודים מיטוכונדריאליים in vivo. יש לציין כי הבדיקות המתוארות בפרוטוקול זה הן מדידות ישירות יותר של תפקודי מיטוכונדריה מאשר OCR. יתר על כן, הם מאפשרים מדידה של תפקוד מיטוכונדריאלי בהיפוקסיה, הקשר שבו OCR אינו מדידה אינדיקטיבית. יחד, בדיקות אלה, בשילוב עם ניסויי רספירומטריה קלאסיים, יספקו לחוקרים הערכה מקיפה יותר של תפקוד המיטוכונדריה בתאי יונקים.
Protocol
1. מבחני התפשטות למדידת הפעילות של קומפלקס I, דיהידרורוט דהידרוגנאז (DHODH) ופעילויות V מורכבות
- זריעת תאים לבדיקות התפשטות
הערה: פרוטוקול זה משתמש בקו תאי אוסטאוסרקומה אנושי 143B שנרכש באופן מסחרי מ-ATCC. קו תאים זה שימש תחת ההנחיות של פרוטוקול הוועדה המוסדית המאושרת שלנו לבטיחות ביולוגית (IBC).- מוציאים את הצלחות מאינקובטור תרביות הרקמות. שאפו את התווך מהצלחות, ושטפו במי מלח חוצצים פוספט (PBS) כדי להסיר את שאריות המדיום. שאפו את PBS, וכסו את המנה ב-0.05%-0.25% טריפסין כדי להרים את התאים מתחתית הצלחת.
- המתן 3-5 דקות עד שהטריפסין ישחרר את התאים מהצלחת, ולאחר מכן הרוה את הטריפסין עם 10 מ"ל של מדיום הגידול הרצוי המכיל 10% נסיוב בקר עוברי (FBS).
- אספו את התאים בצינור חרוט, וצנטריפוגה ב 1,000 × גרם במשך 5 דקות כדי לגלול את התאים.
- שאפו את המדיום מהצינור מבלי להפריע לכדור. להשעות את הגלולה עם מדיום מלא.
- ספרו את התאים, וכמתו את הנפח הדרוש כדי לזרוע בין 10,000 ל-25,000 תאים בצלחת בעלת 6 בארות.
הערה: כל קו תאים יצטרך להיות ממוטב עבור מספר התאים שיש לזרוע. המפגש האידיאלי שהושג הוא ~10% בתחילת הניסוי ו~80% בסוף הניסוי. - פיפטה את התאים לתוך צלחת 6 בארות, ולהוסיף 2 מ"ל של מדיום שלם לבארות. יש להמתין 24 שעות לפני המעבר לתנאי הניסוי הבינוניים.
הערה: זרעו לפחות שלושה עותקים משוכפלים לכל מצב ומספיק בארות כדי לבדוק את מצב הבקרה הלא מטופל, מצב הבקרה שטופל במעכבים, מצב ניסיוני לא מטופל ומצב ניסיוני שטופל במעכבים.
- שינוי בינוני להערכת פעילות V מורכבת על ידי התפשטות
הערה: תאים המתרבים בתווך עם גלקטוז תלויים בפעילות V מורכבת עבור סינתזת ATP 9,10. שלא כמו גלוקוז, אשר מניב נטו שני ATP מגליקוליזה, גלקטוז אינו מניב אף אחד, מה שמאלץ את התאים להיות תלויים בקומפלקס V עבור סינתזת ATP (איור 1). אוליגומיצין מעכב V מורכב משמש כבקרה.- לייצר 10 mM גלוקוז המכיל מדיום (ראה טבלה 1).
- הכינו תווך המכיל גלקטוז בנפח 10 מילימטר (ראו טבלה 1).
- שנה את התווך בכל באר ל- DMEM המכיל גלוקוז או DMEM המכיל גלקטוז. הוסף אוליגומיצין של 5 מיקרומטר (מעכב V מורכב) לבארות הרלוונטיות ונפח זהה של DMSO לבארות הלא מטופלות. מלאי האוליגומיצין הוא 10 מילימטר מושעה מחדש ב- DMSO. החזירו את הצלחת לאינקובטור תרבית הרקמה למשך יומיים.
- שינוי בינוני להערכת פעילות I מורכבת על ידי התפשטות
הערה: תאים המתרבים בתווך נטול פירובט מסתמכים יותר על פעילות קומפלקס I11,12. ללא פירובט, התאים בתרבית זקוקים לקומפלקס I כדי להקל על רוב החמצון מחדש של NADH בחזרה ל-NAD+ (איור 2). קומפלקס I מעכב rotenone משמש כבקרה.- הפוך מדיום DMEM ללא פירובט בתוספת 10% FBS ו 1% פניצילין-סטרפטומיצין.
- הכינו תמיסת פירובט באורך 1 מ' (ראו טבלה 1).
- שנו את התווך בכל באר למדיום נטול פירובט או למדיום המכיל פירובט. הוסף 2 מיקרומטר רוטנון (קומפלקס I מעכב) לבארות המטופלות ואת אותו נפח של DMSO לבארות הלא מטופלות. מלאי הרוטנון הוא 25 מילימטר מושעה מחדש ב- DMSO. החזירו את הצלחת לאינקובטור תרבית הרקמה למשך יומיים.
- שינוי בינוני להערכת פעילות DHODH על ידי התפשטות
הערה: תאים המתרבים במדיה נטולת אורידין דורשים פעילות דיהידרורוט דהידרוגנאז (DHODH)11,12,13. בהיעדר אורידין אקסוגני, התאים בתרבית מסנתזים פירימידינים דרך מסלול דה נובו. מעכב DHODH brequinar משמש כבקרה.- הפוך DMEM ללא אורידין בתוספת 10% FBS ו 1% פניצילין-סטרפטומיצין.
- הכינו תמיסת ציר אורידין של 10 מ"ג/מ"ל ולאחר מכן הכינו מדיום אורידין של 100 מיקרוגרם/מ"ל (ראו טבלה 1).
- שנה את המדיום בכל באר למדיום ללא אורידין או למדיום המכיל אורידין. הוסף 5 μM brequinar (מעכב DHODH) לבארות המטופלות ואת אותו נפח של DMSO לבארות שאינן מטופלות. מלאי brequinar הוא 10 mM מושעה מחדש DMSO. החזירו את הצלחת לאינקובטור תרבית הרקמה למשך יומיים.
- ספירת התאים לבדיקות התפשטות
- עבור כל הניסויים, לחדש את המדיום כל יומיים. אם המדיום הופך לצהוב בצבע, הגדל את תדירות השינויים בתווך. לאפשר לתאים להתרבות עד 7 ימים, ולהפסיק את הניסוי אם אחת הבארות מתחילה להיראות מגודלת יתר על המידה. בארות נחשבות מגודלות כאשר המפגש עולה על 80%.
- שואפים את המדיום, שוטפים עם 1x PBS, ומכסים את תחתית הבאר עם 0.25% טריפסין (500 μL עבור צלחת 6 באר).
- המתינו 5 דקות עד שהתאים הרימו את המנה. בדוק זאת תחת מיקרוסקופ.
- להרוות את טריפסין עם 1 מ"ל של DMEM מלא המכיל 10% FBS.
- פיפטה למעלה ולמטה כדי לפרק את גושי התא.
- הכינו כוסות דלפק קולטר על ידי מילוי כל אחת מהן ב-10 מ"ל של חיץ איזוטוני (אחת לכל באר). ספור את התאים במונה תאים ורשום את הנתונים. אם הקריאה היא תאים למיליליטר (תאים/מ"ל), הכפל את הערך שנרשם ב- 1.5 כדי לקבל את מספר התאים הכולל לכל באר.
הערה: שיטות אחרות לספירת תאים כגון המוציטומטר יספיקו אם למעבדה אין מונה קולטר.
2. 13C 4-Aspartate מעקב איזוטופים יציבים וניתוח LC-MS למדידת פעילות DHODH
- 13C 4-aspartate מעקב איזוטופ יציב בתאים דבקים
הערה: ניתן לנטר ישירות את פעילות DHODH על ידי מדידת השילוב של 13 C 4-aspartate לתוך 13C 3-UMP. Brequinar משמש כבקרה לפעילות DHODH (איור 3). הרמות המתקבלות של 13C3-UMP הן מדד לפעילות DHODH.- זרעו בין 250,000 ל-500,000 תאים בצלחת של 6 בארות כדי להשיג מפגש של 75% למחרת.
- הכינו תמיסת מלאי של 250 mM 13 C 4-aspartate ו-10 mM 13C4-aspartate בינוני (ראה טבלה 1).
- שנה את המדיום בכל באר למדיום המכיל 10 mM 13C 4-aspartate. לדגור במשך מספר השעות המתאים כדי להשיג מצב יציב עבור תיוג התאים המעניינים.
הערה: המצב היציב מוגדר כמסגרת הזמן שבה אחוז המטבוליטים המסומנים יורד לאורך זמן14. עבור 143B תאי אוסטאוסרקומה, 13C 4-aspartate משיג מצב יציב על ידי 8 שעות. מומלץ לקבוע מסגרת זמן זו לפני הניסוי על ידי ביצוע ניסוי מסלול זמן עם האיזוטופ היציב של עניין.
- בידוד מטבוליטים מהתאים הדבקים
- לפני שתתחילו, הכינו דלי קרח יבש, והכינו 80% MeOH בדרגת HPLC במים ברמת HPLC. קררו את החיץ הזה במקפיא בטמפרטורה של 80°C למשך הלילה או הניחו אותו ישירות על קרח יבש.
- מוציאים צלחת אחת בכל פעם מהאינקובטור, שואפים את המדיום מהבארות, ושוטפים 2x עם 1x PBS. הסר את כל שאריות PBS מהבארות לפני שתעבור לשלב הבא.
הערה: הקפידו להטות את הצלחת בזמן השאיפה ואת הפיפטה כנגד דופן התבשיל כדי למנוע הפרעה לתאים הדבקים. - הניחו את הצלחת על קרח יבש, והוסיפו מיד 800 μL של 80% MeOH בדרגת LCMS במים בדרגת LCMS 20% לכל באר.
- לדגור על הצלחת לפחות 15 דקות במקפיא של -80 מעלות צלזיוס כדי להקל על ליזה של תאים.
הערה: בשלב זה, ניתן להוציא את הצלחת הבאה מהאינקובטור ולחזור על שלבים 2.2.1-2.2.4. המשיכו בכך עד שכל הצלחות ידגרו במקפיא של -80°C. - מוציאים צלחת אחת בכל פעם מהמקפיא, מגרדים כל באר על קרח יבש באמצעות מרים תאים, ומעבירים את הליזט לצינור מיקרוצנטריפוגה בנפח 1.5 מ"ל. שמור את הצינור על קרח יבש עד לשלב הבא.
- מערבלים את כל הצינורות במשך 10 דקות ב 4 ° C, ולאחר מכן צנטריפוגה ב 4 ° C במשך 10 דקות במהירות מקסימלית (לפחות 17,000 × גרם).
- מעבירים את הסופרנאטנט לצינור מיקרוצנטריפוגה בנפח 1.5 מ"ל, ומייבשים ברכז ואקום בטמפרטורה של 4°C המצויד במלכודת קרה של -105°C על גבי ואקום גבוה למשך כ-6 שעות או עד שהדגימות מתאדות. לאחר ייבוש הליזט, אחסנו את כדורי המטבוליט בטמפרטורה של -80°C עד שיהיו מוכנים להכין אותם לכרומטוגרפיה נוזלית בשילוב עם ספקטרומטריית מסות (LCMS).
- מדידת כרומטוגרפיה-ספקטרומטריית מסה נוזלית (LC-MS) של מטבוליטים קוטביים
הערה: כל זרימת עבודה כרומטוגרפית וספקטרומטריית מסות המאפשרת זיהוי של אספרטט, מתווכים בביוסינתזה של דה נובו פירימידין ו- UMP תספיק14.- הכינו את הדגימות עבור LCMS על קרח על ידי הוספת 100 μL של מים בדרגת HPLC לכדוריות ולמערבולות המיובשות למשך 10 דקות ב-4°C.
- צנטריפוגו את הדגימות בטמפרטורה של 4°C למשך 10 דקות במהירות מרבית (לפחות 17,000 × גרם) והעבירו 25 μL לכל בקבוקון LC-MS.
- הזריקו 2 μL של ליזט למערכת LC-MS. להלן מתודולוגיה נפוצה:
- הכינו שלב נייד A הכולל 20 mM אמוניום פחמתי (בדרגת LC-MS) ו-0.1% אמוניום הידרוקסיד (LC-MS Grade) מומס במים בדרגת LC-MS.
- בחר 100% אצטוניטריל (LC-MS Grade) כשלב B נייד.
- עבור הכרומטוגרפיה, בחר עמוד אנליטי בגודל 5 מיקרומטר, 150 מ"מ x 2.1 מ"מ המצויד בעמוד מגן בגודל 2.1 מ"מ x 20 מ"מ עבור תרכובות הידרופיליות (ראה טבלת חומרים). כוונו את תנור העמודים ל-25°C.
- השתמש בהגדרות הכרומטוגרפיה הנוזלית הבאות: קצב זרימה קבוע של 0.15 מ"ל/דקה; שיפוע ליניארי מ-80% ל-20% שלב B נייד למשך 20 דקות, ואחריו שיפוע ליניארי מ-20% ל-80% שלב B נייד למשך 0.5 דקות, ואחריו החזקה בשלב B נייד של 80% למשך 7.5 דקות.
- בחר את הגדרות ספקטרומטר המסות הבאות: סריקה מלאה בין m/z 70 Da ו- 1,000 Da; החלטה של 70,000; יעד AGC של 1 × 106; וזמן הזרקה מקסימלי של 20 אלפיות השנייה. הפעל את המקור במצב מיתוג קוטביות. הגדר את מתח הריסוס ב- 3.0 קילו וולט, את הנימים המחוממים ב- 275 מעלות צלזיוס, את בדיקת HESI ב- 350 מעלות צלזיוס, את זרימת גז הנדן ב- 40 יחידות, את זרימת גז העזר ב- 15 יחידות ואת זרימת הגז המטאטא ביחידה אחת.
- בצע את ניתוח הנתונים באמצעות כל תוכנה המתממשקת לזרימת העבודה LCMS.
הערה: התוכנה המשמשת עם זרימת העבודה לעיל היא XCalibur (Thermo) ו- TraceFinder (Thermo). להלן השיקולים העיקריים לניתוח נתונים:- זמני שמירה צפויים: קבע את זמן השמירה של כל מטבוליט על ידי הפעלת הסטנדרטים עבור כל מטבוליט מעניין באמצעות השיטה הכרומטוגרפית לפני הניסוי.
הערה: זמני השמירה של UMP והאיזוטופולוגים שלו, כולל 13C 3-UMP, זהים בדיוק. - M/Z צפוי עבור מטבוליטים: אם מטבוליט מיינן במצב יון שלילי (כגון UMP), חשב את המסה המדויקת הצפויה באמצעות הנוסחה המולקולרית של UMP פחות פרוטון [C 9 H14N2O9P]. עבור מטבוליטים המייננים במצב יונים חיוביים, חשב את המסה המדויקת באמצעות הנוסחה המולקולרית בתוספת פרוטון.
- דיוק מסה: בעת שימוש בספקטרומטר מסות אורביטרפ, המטבוליט המעניין והאיזוטופולוגים שלו צפויים להיות בעלי דיוק מסה ±5 mmu. השתמש בתוכנה כדי לחשב זאת, תוך התחשבות ב- M/Z הצפוי וב- M/Z שזוהה בפועל.
- תיקון שפע טבעי: כל נתוני העקיבה צפויים לעבור תיקון שפע טבעי כדי להסביר את ~1% 13C ו~0.5% 15 N-איזוטופים בטבע 15.
- זמני שמירה צפויים: קבע את זמן השמירה של כל מטבוליט על ידי הפעלת הסטנדרטים עבור כל מטבוליט מעניין באמצעות השיטה הכרומטוגרפית לפני הניסוי.
3. 13C 5-גלוטמין מעקב איזוטופים יציבים למדידת פעילות SDH
- 13C 5-גלוטמין יציב מעקב איזוטופים בתאים דבקים
הערה: ניתן לנטר ישירות את פעילות SDH על ידי מדידת ההמרה ההדדית של איזוטופולוגים מסוימים של פומרט וסוקצינאט על 13 C 5-גלוטמין מעקב 7,16,17. מעכב קומפלקס III אנטימיצין משמש כבקרה לשינוי כיווניות הרשת של קומפלקס SDH (איור 4).- זרעו בין 250,000 ל-500,000 תאים בצלחת של 6 בארות כדי להשיג מפגש של 75% למחרת.
- הכינו מלאי של 50 mM 13C 5-גלוטמין (ראו טבלה 1).
- הכינו אמצעי מעקב המכיל 2 mM 13C 5-גלוטמין (ראו טבלה 1).
- שנה את המדיום בכל באר למדיום המכיל 2 mM 13C 5-גלוטמין. יש לדגור במשך מספר השעות המתאים כדי להגיע למצב יציב של תיוג התאים המעניינים (ראה הערה בשלב 2.1.3).
- בודד את המטבוליטים בהתאם לפרוטוקול בשלב 2.2.
- נתח את הדגימות ב- LC-MS בהתאם לזרימת העבודה המתוארת בשלב 2.3.
- ניתוח פעילות SDH בהתבסס על דפוסי תיוג
הערה: ניתן לנטר את פעילות החמצון של קומפלקס SDH על ידי הערכת היחס בין 13 C 4-fumarate ל- 13 C 4-succinate על 13C5-גלוטמין מעקב. ניתן לנטר את פעילות הפחתת הפומרט של קומפלקס SDH על ידי הערכת היחס בין 13 C 3-succinate ל 13C3-fumarate על 13C5-גלוטמין מעקב.- חשב את אחוז הסימון של 13 C 3-fumarate, 13 C 4-fumarate, 13 C3-succinate ו- 13 C4-succinate. לדוגמה, כדי לקבוע את האחוז של 13 C 3-fumarate, לסכם את כל אזורי השיא המשולבים עבור איזוטופולוגים fumarate (fumarate לא מסומן, 13 C 1-fumarate, 13 C2-fumarate, 13 C 3-fumarate, ו 13 C4-fumarate), ולחלק את שטח השיא עבור 13C 3-fumarate על ידי שטח איזוטופולוג כולל. הכפל ב- 100.
- כדי לחשב את חמצון סוקצינאט, חלק את אחוז 13 C 4-fumarate באחוז 13C4-succinate.
- כדי לחשב את הפחתת fumarate, לחלק את אחוז 13 C 3-succinate באחוז 13C 3-fumarate.
4. בדיקת פעילות I מורכבת ישירה
הערה: DCPIP הוא קולט אלקטרונים מלאכותי; הוא משתנה לצורתו המופחתת בעת קבלת אלקטרונים מיוביקווינול. בבדיקה זו, יוביקינון מופחת ליוביקינול באמצעות חמצון מורכב בתיווך I של NADH ל-NAD+. לפיכך, מדידת התחלופה של DCPIP מחומצן בבדיקה נטולת תאים זו היא פרוקסי לפעילות I מורכבת 7,18.
- טיהור וכימות המיטוכונדריה מתאים
הערה: ניתן להשתמש בכל פרוטוקול טיהור מיטוכונדריאלי עבור בדיקה זו19.- להרחיב את התאים עד 25-100 מיליון תאים מתקבלים. שאפו את המדיום מהכלים, שטפו עם PBS 1x, שאפו את PBS, ונסו לסובב את התאים עם 0.25% טריפסין. להרוות את הטריפסין עם מדיום תרבית, ו pellet את התאים על 1,000 × גרם במשך 5 דקות.
- שטפו את כדורי התא 2x ב 5 מ"ל של 1x PBS, וחזרו על הצנטריפוגה ב 1,000 × גרם במשך 5 דקות כדי לשטוף את התאים. אחסנו את הכדוריות השטופות במקפיא בטמפרטורה של 20°C עד לטיהור המיטוכונדריה.
הערה: אין להקפיא-להפשיר את כדורי התא יותר מפעם אחת. - הכינו מאגר בידוד מיטוכונדריה (ראו טבלה 1).
הערה: אין להשתמש בריאגנטים המכילים נתרן כגון NaOH להכנת מאגרי בידוד מיטוכונדריה, מכיוון שנתרן מכתים את פוטנציאל קרום המיטוכונדריה20 ומשבש את הומאוסטזיס הסידן המיטוכונדריאלי21. - השהה מחדש את כדורי התא ל-10 מיליון תאים לכל 1 מ"ל של מאגר בידוד מיטוכונדריה. לדוגמה, להשהות מחדש 100 מיליון תאים כדוריים ב-10 מ"ל של מאגר בידוד מיטוכונדריה.
הערה: הקפד לשבש את גושי התאים מבלי להכניס בועות לתוך המאגר. - העבר 2 מ"ל של תרחיף תאים לתוך הומוגנייזר זכוכית מקורר מראש עם נפח עבודה של 3-8 מ"ל התואם למזיק PTFE של Potter-Elvehjem. הומוגנזציה של התאים עם 10-20 שבץ, ניטור התאים תחת מיקרוסקופ כדי לאשר ליזה התא לאורך כל תהליך הומוגניזציה. הגדל את מספר שבץ במידת הצורך כדי להבטיח ליזה תאים יעילה.
הערה: אם הומוגניזציה של התאים בשיטה הנ"ל אינה יעילה להנחת התאים, עבור לשיטת ליזה מזרק22. - מעבירים 2 מ"ל של התא ליזט לתוך צינור מיקרוצנטריפוגה על קרח, ולחזור על השלבים לעיל עד השעיית התא כולו הומוגני.
- הפילו את הגרעינים ואת פסולת התא ב 650 × גרם במשך 10 דקות בצנטריפוגה 4 ° C.
- העבר את הסופרנאטנט לצינור חדש של 2.0 מ"ל, וחזור על הצנטריפוגה לעיל ב 650 × גרם במשך 10 דקות ב 4 ° C.
- העבירו את הסופרנאטנט לצינור חדש של 2.0 מ"ל, ושחררו את המיטוכונדריה הגולמית בטמפרטורה של 7,000 × גרם למשך 10 דקות בצנטריפוגה של 4 מעלות צלזיוס.
- השליכו את הסופרנטנט, והשעו מחדש את הגלולה ב-1 מ"ל של מאגר בידוד מיטוכונדריה. העבר 50 μL לתוך צינור חדש לכימות חלבון. חזור על שלב הצנטריפוגה לעיל על שני aliquots של הדגימה (מדגם 50 μL ואת הנותר ~ 950 μL).
- יש להשליך את הסופרנטנט ולאחסן את הכדוריות במקפיא בטמפרטורה של 80°C עד שהן מוכנות לשימוש.
- הוסף 200 μL של חיץ RIPA לכדוריות מ 50 μL aliquot כדי לחלץ את החלבון, מערבולת במשך 10 דקות, וצנטריפוגה ב 21,000 × גרם כדי לבודד את החלבון. כמת את כמות החלבון ב- aliquot של 50 μL, והשתמש במספר זה כדי לכמת את החלבון הנותר בדגימה של 950 μL. לדוגמה, אם כימות החלבון עבור אליציטוט 50 μL הוא 1 מיקרוגרם/μL, החלבון הכולל בכדורית המיטוכונדריאלית הנותרת הוא 950 מיקרוגרם (1 מיקרוגרם/μL × 950 μL).
- ביצוע בדיקת פעילות I מורכבת
הערה: קו תאי אוסטאוסרקומה 143B שימש לבדיקה זו, אך ניתן להתאים את הפרוטוקול לכל תא בתרבית.- יש להשהות מחדש מיטוכונדריה מטוהרים במאגר תרחיף המיטוכונדריה (ראו טבלה 1) לריכוז סופי של 5 מ"ג חלבון/מ"ל.
- בצעו חמישה מחזורי הקפאה/הפשרה במקפיא של -20°C כדי לחדור למיטוכונדריה.
- הפוך את מאגר בדיקת הפעילות I המורכב (ראה טבלה 1).
- יש לערבב 50 מ"ג ממלאי המיטוכונדריה 5 מ"ג/מ"ל עם 90 מיקרוליטר של מאגר פעילות I מורכב. הכינו חמישה משכפלים לא מטופלים וחמישה שכפולים שטופלו ברוטנון (5 מיקרומטר) כדי לשלוט בפעילות I מורכבת.
- קרא את הספיגה הבסיסית של 600 ננומטר בקורא לוחות המוגדר ל- 37°C.
- התחל את התגובה על-ידי הוספת NADH לריכוז סופי של 2 מילימול, ועקוב אחר הספיגה (600 ננומטר) במשך שעה אחת, מדידת לפחות כל 2 דקות לאורך כל הדרך. הירידה בספיגה מעידה על ירידה ב-DCPIP באמצעות פעילות I מורכבת.
הערה: יש להוסיף את NADH באמצעות פיפטה רב-ערוצית כדי להבטיח שכל הדגימות מופעלות בו-זמנית.
5. בדיקה מבוססת LC-MS למדידת רמות הסופראוקסיד
הערה: התכונות הפלואורסצנטיות של MitoSox Red יכולות להשתנות ללא תלות בתגובה שלו עם סופראוקסיד23. בדיקה מבוססת LC-MS זו מודדת ישירות את המוצר מסופראוקסיד המגיב עם MitoSox Red. הבדיקה הבאה שונה מעט משיאו ואחרים 24. 2-הידרוקסי-מיטואתידיום (2-OH MitoE2+) הוא תוצר של תגובת סופראוקסיד (איור 5). קו התאים Caki1 נוצל לבדיקה זו, אך ניתן להתאים את הפרוטוקול לכל תא בתרבית.
- טיפול בתאים דבקים עם MitoSox Red
- זרעו בין 250,000 ל-500,000 תאים בצלחת של 6 בארות כדי להשיג מפגש של 75% למחרת. הקפד לזרוע קבוצה של צלחות עבור בדיקת LC-MS וקבוצה כפולה של צלחות עבור נורמליזציה של ספירת תאים.
- הכינו DMEM מלא המכיל 10% FBS מומת חום ו-1% פניצילין-סטרפטומיצין בתווך Eagle המותאם של Dulbecco.
- רענן את המדיום בכל הבארות עבור כל התנאים עם 2 מ"ל של DMEM מלא. הקפד להוסיף תרופות או טיפולים מעניינים בשלב זה.
- לדגור על התאים באינקובטור תרבית רקמה למשך שעה אחת.
- הכינו בקרות חיוביות ושליליות. הכינו מלאי של 50 מילימטר של טרט-בוטיל הידרופראוקסיד מדולל ב-PBS ומלאי של 250 מילימטר של N-אצטיל ציסטאין (NAC) מדולל ב-DMSO (ראה טבלה 1).
הערה: Tertbutyl hydroperoxide (tBuOOH) הוא זן חמצן תגובתי רב עוצמה שיפעל כבקרה חיובית ויגדיל את כמות 2-OH MitoE2+. NAC הוא נוגד חמצון רב-עוצמה שיפעל כבקרה שלילית וינטרל את ייצור הסופראוקסיד שנגרם על-ידי tBuOOH. - הוסף 1 μL של tBuOOH לבארות הבקרה החיוביות ו 1 μL של tBuOOH + 100 μL של NAC לבארות הבקרה השליליות.
הערה: שימוש פיפטה P2 (טווח 0.1-2 μL) היא הדרך האופטימלית להעביר 1 μL. - דגירה במשך שעה באינקובטור לתרבית רקמות.
- הכינו מלאי MitoSox Red של 1 mM (ראו טבלה 1), והוסיפו 2 μL של 1 mM MitoSox Red לכל באר כדי להגיע לריכוז סופי של 1 μM. דגרו במשך 30 דקות באינקובטור תרביות רקמות.
- במהלך הדגירה הסופית, ספרו את אחד הלוחות הכפולים כדי לרכוש את ספירת התאים כדי לנרמל את נתוני LC-MS הסופיים.
- בידוד המוצר המחומצן Mitosox Red מהתאים הדבקים
- קחו דלי של קרח יבש, והניחו איזופרופנול קריר ברמת HPLC על הקרח היבש לפני תחילת הבידוד.
- מוציאים צלחת אחת בכל פעם, שואפים את המדיום מהבארות, ושוטפים 2x עם 1 מ"ל של 1x PBS. שאפו את כל שאריות ה-PBS מהבארות לפני שתעברו לשלב הבא.
הערה: הקפידו להטות את הצלחת בזמן השאיפה ואת הפיפטה כנגד דופן הצלחת כדי למנוע הפרעה לתאים הדבקים. - מניחים את הצלחת על קרח יבש, ומוסיפים 800 μL של איזופרופנול באיכות HPLC לכל באר.
- לדגור על הצלחת לפחות 15 דקות במקפיא של -80 מעלות צלזיוס כדי להקל על ליזה של תאים.
הערה: בשלב זה ניתן להוציא את הצלחת הבאה מהאינקובטור ולחזור על שלבים 5.2.1-5.2.4. המשיכו בכך עד שכל הצלחות ידגרו במקפיא של -80°C. - מוציאים צלחת אחת בכל פעם מהמקפיא, מגרדים כל באר על קרח יבש באמצעות מרים תאים, ומעבירים את הליזט לצינור מיקרוצנטריפוגה בנפח 1.5 מ"ל. שמור את הצינור על קרח יבש עד לשלב הבא.
- מערבלים את כל הצינורות במשך 10 דקות ב 4 ° C, ולאחר מכן צנטריפוגה ב 4 ° C במשך 10 דקות במהירות מקסימלית (לפחות 17,000 × גרם).
- מעבירים את הסופרנאטנט לצינור מיקרוצנטריפוגה בנפח 1.5 מ"ל, ומייבשים ברכז ואקום. לאחר התייבשות הליזט, אחסנו את כדוריות המטבוליט בטמפרטורה של -80°C עד שהן מוכנות לשימוש ב-LC-MS.
- מדידת LC-MS של MitoSox Red ו-2-hydroxy-mitoethidium (2-OH MitoE2+)
- הכינו את הדגימות עבור LCMS על קרח על ידי הוספת 100 μL של תערובת 3:3:1 של MeOH:chloroform:water. מערבולת במשך 10 דקות ב 4 °C.
- העבר 25 μL לכל בקבוקון LC-MS. אחסנו את הדגימה הנותרת במקפיא בטמפרטורה של -80°C.
- הכינו את מאגרי הכרומטוגרפיה הנוזלית הבאים: i) חיץ A: מים בדרגת HPLC עם 0.1% חומצה פורמית; ii) חיץ B: אצטוניטריל בדרגת HPLC עם 0.1% חומצה פורמית.
- פתח את היישום Thermo XCalibur Instrument Setup כדי להתחיל לפתח את השיטה.
- חפש שתי תיבות בסרגל הצד השמאלי של חלון זה - התיבה הראשונה מאפשרת פיתוח שיטת כרומטוגרפיה, והתיבה השנייה מאפשרת פיתוח שיטת ספקטרומטריית מסות.
- פיתוח שיטת כרומטוגרפיה נוזלית:
- קבעו קצב זרימה של 0.25 מ"ל/דקה, והתחילו את השיטה ב-20% B, תוך עלייה ל-95% B במשך 12 דקות. במהלך הדקה הבאה, הורידו את מאגר B בחזרה ל-20% B, ושמרו על רמה זו במשך 2 הדקות הבאות.
הערה: 2 הדקות האחרונות של זרימה ב- 20% B הן קריטיות כדי שלחץ העמודה יירד חזרה ללחץ ההתחלתי ויאזן את העמודה עם יחסי המאגר המתאימים. אי הכללת שלב שיווי משקל זה תגרום לשינוי זמני השמירה עבור כל הדגימות המופעלות לאחר מכן.
- קבעו קצב זרימה של 0.25 מ"ל/דקה, והתחילו את השיטה ב-20% B, תוך עלייה ל-95% B במשך 12 דקות. במהלך הדקה הבאה, הורידו את מאגר B בחזרה ל-20% B, ושמרו על רמה זו במשך 2 הדקות הבאות.
- צור קובץ Tune עם הפרמטרים הבאים:
- פתחו את האפליקציה Tune וצרו קובץ כוונון חדש.
- החל הגדרות חופפות ממודול הגדרת השיטה (ראה שלב 5.3.9.3) גם על קובץ כוונון זה, כולל טווח הסריקה, הרזולוציה, הקוטביות, יעד AGC וה - IT המרבי.
- הגדר את גז הנדן ל- 30, את גז ה- Aux ל- 3, ואת גז ה- Sweep ל- 3 גם כן. הגדר את מתח ההתזה ל- 3 kV, את הטמפרטורה הנימי ל- 300 ואת רמת ה- RF של עדשת S ל- 60.
- פיתוח שיטת ספקטרומטריית מסות:
- מהרשימה השמאלית התחתונה של סריקות פוטנציאליות, גרור ושחרר MS מלא למרכז החלון. הקפד ללחוץ על ריבוע MS מלא לאחר השחרור כדי להתאים את ההגדרות. משך שיטת MS הכולל הוא 13 דקות.
הערה: שיטת LC ארוכה יותר משיטת MS מכיוון ששתי הדקות האחרונות מיועדות למיזוג מחדש של עמודות ולא לכימות מטבוליטים. - בצד השמאלי של המודול, תחת מאפיינים של השיטה, ודא שמשך השיטה וזמן ההפעלה מוגדרים ל- 13.00 דקות.
- הפעל סריקה מלאה זו במצב חיובי ברזולוציה של 70,000 ויעד AGC של 1 × 106. הגדר את ה-IT המרבי ל-100 אלפיות השנייה ואת טווח הסריקה מ-300 מ"ש ל-700 מ"ש.
- תחת Tune Files בחלק העליון של המודול, שים לב שקובץ הכוונון שנוצר זה עתה מקושר לשיטה זו.
- מהרשימה השמאלית התחתונה של סריקות פוטנציאליות, גרור ושחרר MS מלא למרכז החלון. הקפד ללחוץ על ריבוע MS מלא לאחר השחרור כדי להתאים את ההגדרות. משך שיטת MS הכולל הוא 13 דקות.
- הפעל את השיטה לזיהוי MitoSox Red עם 2 זריקות דגימה μL.
תוצאות
ניתן להעריך את הפעילויות של DHODH, קומפלקס I ו- V מורכב באמצעות מבחני התפשטות. עם מניעת אורידין ממדיום התרבית, התאים הופכים תלויים יותר במסלול דה נובו לביוסינתזה של פירימידין. לכן, כאשר תאים אותגרו להתרבות בתווך נטול אורידין, הם היו רגישים יותר לעיכוב פעילות DHODH על-ידי ברקינר מאשר תאים שגודלו בתווך המכיל אורידין (איור 6A). באופן דומה, שלילת פירובט ממדיום התרבית הופכת את התאים לתלויים יותר בפעילות I מורכבת לצורך התפשטות. לכן, כאשר תאים אותגרו להתרבות בתווך נטול פירובט, הם היו רגישים יותר לעיכוב של פעילות קומפלקס I על-ידי רוטנון מאשר תאים שגודלו בתרבית בתווך המכיל פירובט (איור 6B). ניתן להעריך את פעילות קומפלקס V על ידי אתגר תאים להתרבות בתווך המכיל גלקטוז במקום גלוקוז. מכיוון שגלקטוז מניב אפס ATP נטו בגליקוליזה, תאים הגדלים בדלק זה מסתמכים יותר על סינתזת ATP מיטוכונדריאלית באמצעות פעילות V מורכבת. לפיכך, תאים שהתרבו בתווך המכיל גלקטוז היו רגישים יותר לעיכוב V מורכב על-ידי אוליגומיצין מאשר תאים שהתרבו בתווך המכיל גלוקוז (איור 6C).
ניתן למדוד את פעילות SDH באמצעות מעקב 13C 5-גלוטמין ועל ידי ניטור שילובו באיזוטופולוגים fumarate ו- succinate. בתנאים שטופלו ברכב, קומפלקס SDH העדיף את הפעילות קדימה, והשילוב של 13 C 4-succinate לתוך 13 C4-fumarate היה גבוה יותר מאשר שילוב של 13 C 3-fumarate לתוך 13C 3-succinate (איור 7). בתנאים שטופלו באנטימיצין, קומפלקס SDH העדיף את הפעילות ההפוכה, והשילוב של 13 C 3-fumarate לתוך 13 C3-succinate היה גדול יותר מאשר שילוב של 13 C 4-succinate לתוך 13C 4-fumarate (איור 7).
ניתן למדוד את ייצור הסופראוקסיד בתוך המיטוכונדריה באמצעות כתב הפלואורסצנטי MitoSox, אשר מייצר 2-הידרוקסי-מיטואתידיום בתגובה עם סופראוקסידיום. במחקר זה, תאים שטופלו במיטוסוקס בנוכחות טרטבוטיל מי חמצן היו רמות גבוהות יותר של 2-הידרוקסי-מיטואתידיום באופן שדוכא על-ידי תוספת של NAC, נוגד חמצון שמרווה ROS תאי (איור 8).
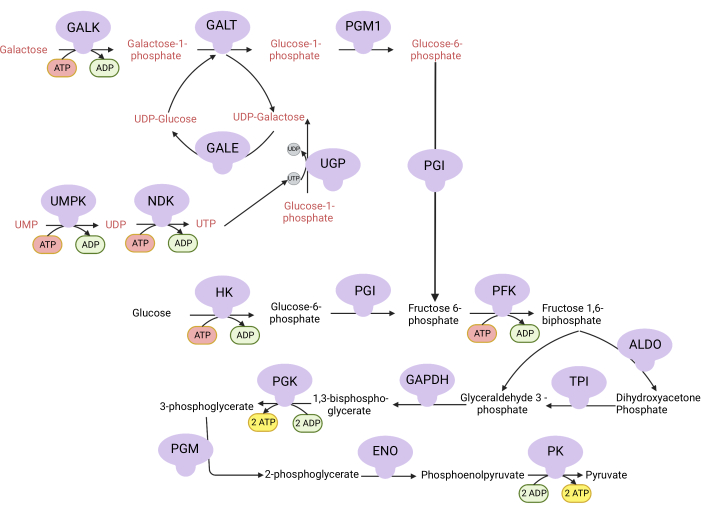
איור 1: הבסיס המכניסטי לבדיקת התפשטות V המרוכבת. חמצון גלוקוז וגלקטוז באמצעות גליקוליזה. גלוקוז מניב נטו שני ATP מגליקוליזה, בעוד שגלקטוז מניב אפס ATP נטו מכיוון שסינתזת UTP נדרשת עבור UDP-גלקטוז. לפיכך, תאים הגדלים בגלקטוז תלויים יותר בסינתזה של ATP מיטוכונדריאלי בשל מחסור ב- ATP המיוצר מגליקוליזה. קיצורים: GALK = galactokinase; GALT = גלקטוז-1-פוספט uridylyltransferase; PGM1 = phosphoglucomutase 1; GPI = גלוקוז-6-פוספט איזומראז, UGP = UDP-גלוקוז pyrophosphorylase; GALE = UDP-גלקטוז-4-אפימראז; NDK = נוקלאוטיד דיפוספט קינאז; UMPK = אורידין מונופוספט קינאז; HK = hexokinase; PFK = phosphofructokinase; ALDO = aldolase; TPI = איזומראז טריוזפוספט; GAPDH = גליצראלדהיד-3-פוספט דהידרוגנאז; PGK = פוספוגליצראט קינאז; PGM = phosphoglucomutase; ENO = אנולאז; PK = פירובט קינאז. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
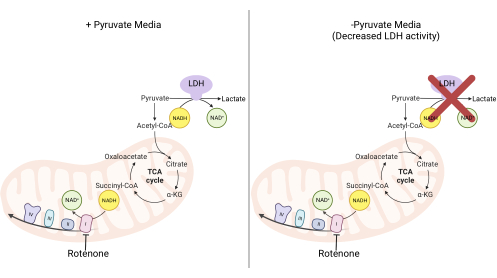
איור 2: הבסיס המכניסטי לבדיקת ההתפשטות המורכבת I. סכמטי של המסלולים המטבוליים המשתנים עם עיכוב פעילות I מורכבת. במדיה עתירת פירובט, מעכב קומפלקס I נעקף באמצעות חמצון NADH בתיווך LDH. במדיה עם מעט פירובט, הסתגלות זו פחות אפשרית, מה שהופך את התאים לתלויים יותר בפעילות I מורכבת כדי לחמצן מחדש NADH. קיצורים: LDH = dehydrogenase לקטט; מחזור TCA = מחזור חומצה טריקרבוקסילית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
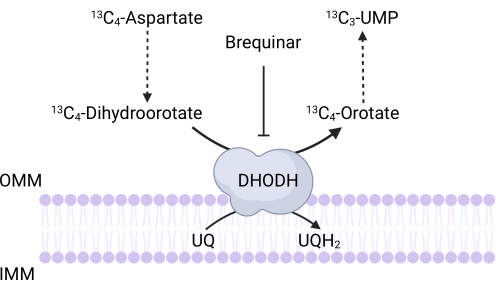
איור 3: סכמטיות של תגובת DHODH במעקב 13C 4-aspartate. Brequinar מעכב חמצון dihydroorotate כדי orotate, ובכך מונע את הסינתזה במורד הזרם של UMP. 13C 4-aspartate משולב לתוך 13C3-UMP באמצעות פעילות DHODH. קיצורים: OMM = קרום מיטוכונדריאלי חיצוני; IMM = קרום מיטוכונדריאלי פנימי; DHODH = dihydroorotate dehydrogenase. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
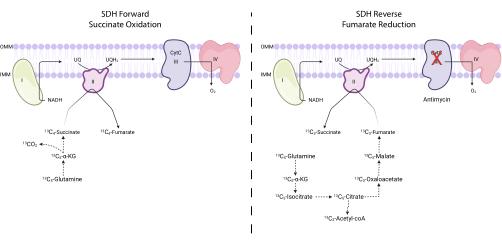
איור 4: מדידת פעילות מורכבת II קדימה ואחורה באמצעות מעקב 13C 5-גלוטמין. כדי למדוד קדימה פעילות מורכבת II (משמאל), שילוב של 13 C 5-גלוטמין לתוך 13 C 4-succinate ו 13C 4-fumarate מנוטר. כדי למדוד פעילות II מורכבת הפוכה (מימין), מנוטר שילוב של 13 C 5-גלוטמין לתוך 13 C 3-succinate ו- 13C 3-fumarate. קיצורים: SDH = succinate dehydrogenase; CytC = cytochrome C. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
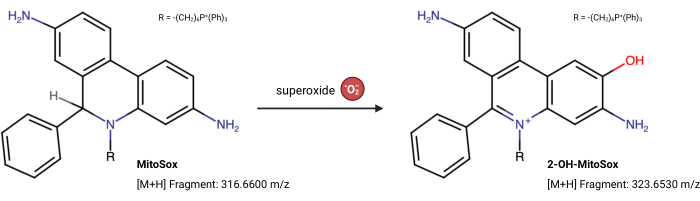
איור 5: תגובת MitoSox Red עם סופראוקסיד. התגובה של MitoSox עם סופראוקסידים מיטוכונדריאליים ליצירת 2-OH-MitoE2+. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
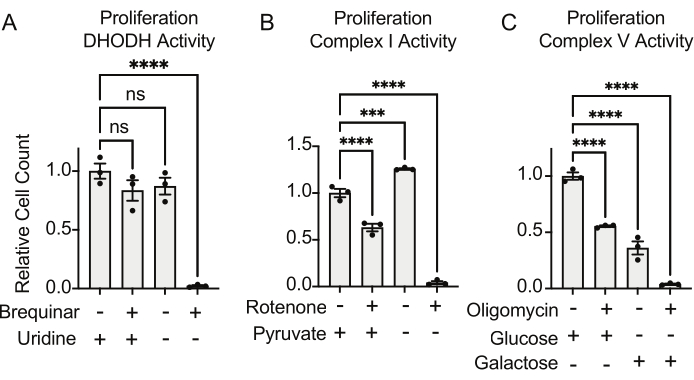
איור 6: בדיקות מבוססות התפשטות למדידת תפקוד מיטוכונדריאלי (A) התפשטות של תאי אוסטאוסרקומה 143B שטופלו בברקינר 5 uM, מעכב DHODH, בתווך עם ±100 מ"ג/מ"ל אורידין. הנתונים הם ± SEM; N = 3 לכל תנאי. (B) התפשטות של תאי אוסטאוסרקומה 143B שטופלו ברוטנון 2 uM, מעכב קומפלקס I, בתווך עם פירובט של ±5 מילימטר. הנתונים הם ± SEM; N = 3 לכל תנאי. (C) התפשטות של תאי אוסטאוסרקומה 143B שטופלו באוליגומיצין 5 uM, מעכב V מורכב, בתווך עם גלוקוז של 10 מילימטר או גלקטוז של 10 מילימטר כמקור הפחמן המרכזי היחיד. הנתונים הם ± SEM; N = 3 לכל תנאי. * מציין p < 0.05 באמצעות בדיקת ANOVA חד-כיוונית בפריזמת Graphpad. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
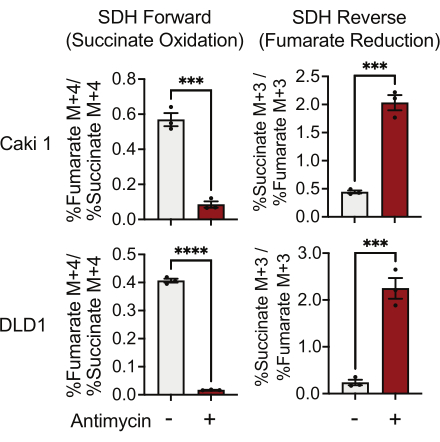
איור 7: מעקב אחר 13C 5-גלוטמין למדידת פעילות II מורכבת. חמצון סוקצינאט והפחתת פומרט (SDH הפוך) ב-DMSO ובתאי Caki1 ו-DLD1 שטופלו באנטימיצין ב-A ב-500 ננומטר. הנתונים מייצגים ממוצע ± SEM; N = 3 לכל תנאי. מציין p < 0.05 באמצעות מבחן t לא מזווג ב- GraphPad Prism. קיצורים: SDH = חמצון סוקצינאט; SDH הפוך = הפחתת fumarate. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
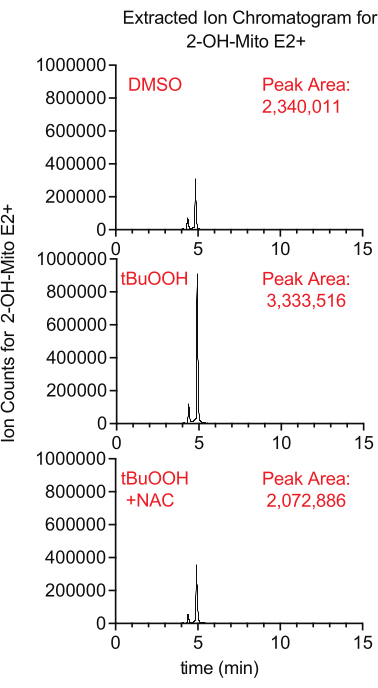
איור 8: בדיקת MitoSox מבוססת LCMS לזיהוי סופראוקסיד. כרומטוגרמת יונים מחולצת של 2-OH-Mito E2+ שבודדה מתאי Caki1 שטופלו ב-MitoSox במשך 30 דקות בנוכחות tBuOOH ±-NAC. קיצורים: LCMS = כרומטוגרפיה נוזלית-ספקטרומטריית מסה; NAC = N-אצטיל ציסטאין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: הרכב ריאגנטים, מאגרים ומדיה המשמשים בפרוטוקול זה. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
מכיוון שמחקרים חדשים מראים כי מיטוכונדריה של יונקים יכולים לתפקד מבלי לצרוך חמצן מולקולרי, יש חשיבות עליונה לחוקרים להשתמש בבדיקות אורתוגונליות, מעבר למדידות OCR, כדי לכמת במדויק את תפקוד המיטוכונדריה. כאן, ריכזנו סדרה של בדיקות שניתן להשתמש בהן כדי להעריך ישירות את הפעילויות של קומפלקס I, קומפלקס II, קומפלקס V ו- DHODH על ידי מדידת מאזן NAD+/NADH במיטוכונדריה, ניצול של קולטי אלקטרונים טרמינליים אדפטיביים, ייצור ATP, ביוסינתזה של דה נובו פירימידין ו-ROS שמקורו במיטוכונדריה. יש לציין כי בדיקות אלה מודדות באופן ישיר יותר את תפקוד המיטוכונדריה מאשר מדידות של זיהוי תווים אופטי (OCR). יתר על כן, בדיקות אלה מספקות לחוקרים דרכים פזיזות לכמת את תפקוד המיטוכונדריה במהלך היפוקסיה, שעבורן מדידות OCR אינן רלוונטיות במידה רבה בשל השימוש בפומרט כמקבל האלקטרונים הסופי המועדף. לבסוף, השיטות מבוססות ההתרבות המתוארות כאן חסכוניות יותר מניסויי רספירומטריה קלאסיים, ובכך מספקות דרך נגישה באופן נרחב לחקר תפקוד המיטוכונדריה במערכות יונקים.
ישנם שיקולים מרכזיים בעת שימוש בבדיקות אלה למדידת תפקוד המיטוכונדריה בתאים בתרבית. לגבי מבחני ההתפשטות, חשוב להתאים את מספר התאים שנזרעו לקצב ההכפלה של כל קו תא. התאים צריכים להיות נזרעים לפחות 10% מפגש עם מספיק מקום כדי לאפשר שלוש עד ארבע הכפלות כך שניתן יהיה לכמת את ההבדלים בהתפשטות. שיקול נוסף עבור כל בדיקה הוא ריכוז המולקולות הקטנות המשמשות כבקרות לפעילות של כל קומפלקס ETC. מכיוון שקווי תאים שונים עשויים להפגין רגישויות שונות למעכבים אלה, חיוני לבדוק את המינון של מולקולות קטנות אלה כדי לזהות את הריכוז האופטימלי.
מגבלה אוניברסלית של בדיקות החוקרות את תפקוד המיטוכונדריה במבחנה, כולל מדידות OCR וכל הבדיקות המתוארות כאן, היא ההרכב המטבולי של מדיום התרבית. מדיום תרביות תאים סטנדרטי נוטה להטות מערכות לרמות גבוהות באופן שטחי של תפקוד מיטוכונדריאלי. לדוגמה, רמות גלוטמין על-פיזיולוגיות מגבירות את האנפלרוזיס של מחזורTCA 25, אשר מזין סינתזת NADH מיטוכונדריאלית, וכתוצאה מכך, מגביר זרחן חמצוני. באופן דומה, הלחץ החלקי של חמצן נע בין 3 מ"מ כספית ל-100 מ"מ כספית (כ-0.1%-13% O2) ברקמות יונקים, אך הוא אטמוספרי (140 מ"מ כספית, כ-21%) במבחנה26,27. עודף O2 זה ממקסם את יכולת הנשימה המיטוכונדריאלית ואת ייצור הסופראוקסיד28. לאחרונה נעשו מאמצים לעצב את מדיית התרבות כך שתהיה פיזיולוגית יותר29,30. יש לציין כי תרבית תאים במדיה דמוית פלזמה אנושית מפחיתה את הנשימה המיטוכונדריאלית בחלק משורות התאים הסרטניים30, ROS מיטוכונדריאלי בתאי T31, והסתגלות מיטוכונדריאלית לטיפולים בסרטן32. לכן, זה קריטי להיות מודעים להרכב של מדיה תרבותית בשימוש ולהבין איך זה עשוי להשפיע על תפקוד המיטוכונדריה.
מגבלה חשובה ואוניברסלית נוספת בפענוח תפקוד המיטוכונדריה היא הפוטנציאל להבדלים במספר המיטוכונדריה. לכן, חיוני למדוד את תכולת המיטוכונדריה באמצעות כימות של mtDNA33, מדידת המסה המיטוכונדריאלית עם צבעים רגישים לפוטנציאל הממברנה34, או כתמים מערביים של סמנים מיטוכונדריאליים. זוהי בקרה קריטית כדי שלא יטעו לחשוב שירידה במספר המיטוכונדריה היא ירידה בתפקוד המיטוכונדריה.
קיימות גם מגבלות ספציפיות ופתרון בעיות החלות על הבדיקות המתוארות כאן. ראשית, בהתחשב בכך שתאים ממוינים אינם מתרבים, הבדיקות מבוססות ההתרבות לא יהיו שימושיות להערכת תפקוד המיטוכונדריה בהקשר זה. מגבלה מרכזית של פרוטוקול מעקב 13C 4-aspartate למדידת פעילות DHODH היא שספיגת אספרטט בתאים יכולה להיות מאוד לא יעילה35. כדי להתגבר על מגבלה פוטנציאלית זו, החוקרים יכולים לבטא יתר על המידה את טרנספורטר האספרטט, SLC1A3, כדי להקל על ספיגה של 13C 4-aspartate35.
מגבלה של הפרוטוקול המשתמש במעקב 13C 5-גלוטמין למדידת פעילות SDH היא שבדיקה זו דורשת מתאים לנצל את מסלול הקרבוקסילציה הרדוקטיבי כדי להעשיר את איזוטופולוגים M+3 על מנת למדוד את הפעילות ההפוכה. קווי תאים מסוימים אינם מסוגלים לשטף קרבוקסילציה רדוקטיבי עקב ביטוי ATP ציטראט ליאז נמוך36, ייצוב HIF לא מספיק 37, או יחס α-KG:ציטראט נמוך מדי38. כדי להתגבר על מגבלה זו, ניתן להשתמש במעקב 13C 4-aspartate כדי למדוד את פעילויות SDH קדימה ואחורה7. בבדיקה זו, ניתן למדוד את הפעילות קדימה של SDH על ידי היחס של fumarate M+2:succinate M+2 ואת התגובה ההפוכה על ידי succinate M+4:fumarate M+4. יש לציין כי מעקב זה עוקף את רוב האנזימים במסלול הקרבוקסילציה הרדוקטיבי.
מגבלה של בדיקת פעילות I מורכבת באמצעות הפחתת DCPIP כקריאה היא שהמיטוכונדריה אינם שלמים מבחינה מבנית. תהליך ההפשרה בהקפאה של המיטוכונדריה כדי לאפשר ספיגת NADH שלהם לבדיקה יכול בהחלט להכתים את השלמות המבנית של קרום המיטוכונדריה39. בדיקה זו צריכה להתבצע במקביל לבדיקות כגון בדיקת התפשטות I מורכבת כדי להבטיח שהשינויים בפעילות I מורכבת שנצפתה נכונים גם עם תאים שלמים.
במחקרים עתידיים, חלק מהטכניקות הללו יכולות להיות מותאמות למדידת תפקודים מיטוכונדריאליים in vivo באמצעות אורגניזמים מודל כגון עכברים ו- Caenorhabditis elegans. השיטות הנוכחיות המשמשות למדידת תפקוד המיטוכונדריה in vivo מתמקדות בזיהוי תווים אופטי (OCR) ברמת האורגניזם, במיוחד בקצב החליפין של דרכי הנשימה בעת שימוש במודלים של עכברים. מגבלה ברורה של שיטה זו היא שהחמצן משמש פונקציות ביוכימיות ואיתות רבות מעבר לתפקידו כקולט אלקטרונים טרמינליים הנמצאים בכל מקום במיטוכונדריה וכו'. לדוגמה, חמצן "נצרך" על ידי הפעילות הקטליטית של אנזימים ממשפחת הדיאוקסיגנאז. למרות שאנזימים אלה תורמים לקצב צריכת החמצן בתאים, הם אינם משתתפים, מווסתים או משקפים את תפקוד המיטוכונדריה. ניסויי רספירומטריה קלאסיים במבחנה בדרך כלל שולטים ב"OCR לא מיטוכונדריאלי", בעוד שניסויי יחס חילופי נשימה אורגניזם (RER) אינם יכולים לשלוט בכך, ומגבילים את הפרשנות של RER כמדד לתפקוד מיטוכונדריאלי in vivo. עם זאת, ניתן להתאים את הפרוטוקולים למדידת פעילות DHODH באמצעות מעקב 13 C 4-aspartate, פעילות מורכבת II באמצעות מעקב 13C5-גלוטמין, פעילות I מורכבת על מיטוכונדריה מטוהרת מרקמות, ו-ROS מיטוכונדריאלי באמצעות תרכובות ידידותיות LC-MS כגון MitoB על מנת למדוד את תפקוד המיטוכונדריה in vivo . בדיקות ישירות אלה לחקירת תפקודי מיטוכונדריה, בשילוב עם ניסויי רספירומטריה קלאסיים, מספקים לחוקרים הערכה מקיפה ומדויקת יותר של תפקוד המיטוכונדריה בתאים וברקמות של יונקים.
Disclosures
למחברים אין ניגודי עניינים לדווח עליהם.
Acknowledgements
האיורים המופיעים בכתב יד זה נוצרו BioRender.com. אנו אסירי תודה לאיימי ווקר על מתן משוב על מאמר זה. J.B.S. נתמך על ידי קרן וורצ'סטר למחקר ביו-רפואי Grant.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube | Cell Treat | 667443 | |
| 2.0 mL tube | Cell Treat | 229446 | |
| 6-well plate | Cell Treat | 229106 | |
| 12-well plate | Cell Treat | 229112 | |
| 13C4-aspartate | Sigma-Aldrich | 604852 | |
| 13C5-Glutamine | Cambridge Isotope Laboratories | 285978-14-5 | |
| 15 mL centrifuge tube | Cell Treat | 667411 | |
| 50 mL centrifuge tube | Cell Treat | 667421 | |
| 150 mm tissue culture dish | Cell Treat | 229651 | |
| 1x Phosphate-buffered saline | Gibco | 10010049 | |
| 2,6-dichlorophenolindophenol | Honeywell | 33125 | |
| Ammonium Carbonate | Sigma-Aldrich | 37999 | |
| Antimycin | Sigma-Aldrich | A8674 | |
| Ascentis Express C18 | Sigma-Aldrich | 53825-U | |
| Bottle top filter 500 mL, 0.22 µm, PES 9 9 mm membrane diameter | Cell Treat | 229717 | |
| Bovine Serum Albumin | Sigma-Aldrich | A3294 | |
| Brequinar | Sigma-Aldrich | SML0113 | |
| Cell Lifter, Double End Flat and Narrow Blade | Cell Treat | 229305 | |
| CentriVap -105 Cold Trap | Labconco | 7385020 | |
| Complete Protease Inhibitor Tablets | Sigma-Aldrich | 4693116001 | |
| Coulter Counter Cups | Fisher Scientific | 07-000-694 | |
| Decylubiquinone | Sigma-Aldrich | D7911 | |
| DMSO | Invitrogen | D12345 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 11995-065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| EGTA | Sigma-Aldrich | E3889 | |
| Eppendorf Centrifuge 5425R | Eppendorf | 2231000908 | |
| Eppendorf Centrifuge 5910 Ri | Eppendorf | 5943000343 | |
| Galactose | Sigma-Aldrich | G5388 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glucose-free DMEM | Gibco | 11966025 | |
| Glutamine-free DMEM | Thermo Fisher | 11960044 | |
| Heat-Inactivated Fetal Bovine Serum | Sigma-Aldrich | F4135 | |
| Hepes | Sigma-Aldrich | H3375 | |
| HPLC-grade 35% Ammonium hydroxide | Thermo Scientific | 460801000 | |
| HPLC-grade Acetonitrile | Sigma-Aldrich | 900667 | |
| HPLC-grade Chloroform | Sigma-Aldrich | 366927 | |
| HPLC-grade formic acid | Thermo Scientific | 28905 | |
| HPLC-grade Isopropanol | Sigma-Aldrich | 563935 | |
| HPLC-grade MeOH | Sigma-Aldrich | 900688 | |
| HPLC-grade Water | Sigma-Aldrich | 270733 | |
| Human Osteosarcome Cell Line 143B | ATCC | CRL-8303 | |
| Hydrochloric Acid | Sigma-Aldrich | 320331-500ML | |
| Isotone buffer | Beckman Coulter | 8546719 | |
| K2HPO4 | Sigma-Aldrich | P2222 | |
| Mannitol | Sigma-Aldrich | M4125 | |
| MitoSox Red | Invitrogen | M36008 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Oligomycin | Sigma-Aldrich | 75351-5MG | |
| Pencillin Streptomycin | Gibco | 15140-122 | |
| Potter-Elvehjem Tissue Grinder, Size 21 | Kimble | 885502-0021 | |
| Pyruvate | Sigma-Aldrich | P5280 | |
| Pyruvate-free DMEM media | Gibco | 11965175 | |
| Q Exactive Plus Mass Spectrometer | Thermo Scientific | 726030 | |
| ReCO2ver Incubator | Baker | ||
| Refrigerated Centrivap Benchtop Vacuum Concentrator | Labconco | 7310020 | |
| RIPA Buffer | Millipore Sigma | 20188 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| SeQuant ZIC-pHILIC 5μm 150 x 2.1 mm analytical column | Sigma-Aldrich | 1.50460.0001 | |
| SeQuant ZIC-pHILIC guard kit | Millipore Sigma | 1.50438.0001 | |
| Sodium Hydroxide, Pellets | Millipore Sigma | 567530-250GM | |
| Sucrose | Sigma-Aldrich | S0389 | |
| SW, TRACEFINDER 5.1 SP3 | Thermo Scientific | OPTON-31001 | |
| Tert-butyl hydroperoxide solution | Sigma-Aldrich | 458139 | |
| Tris | Sigma-Aldrich | 93352 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25-200-114 | |
| Uridine | Sigma-Aldrich | U3003 | |
| VANQUISH HORIZON / FLEX HPLC | Thermo Scientific | VF-S01-A-02 | |
| Z2 Coulter Particle count and size analyzer | Beckman Coulter | BZ10131270 |
References
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 16080 (2016).
- Chandel, N. S., et al. Reactive oxygen species generated at mitochondrial complex III stabilize hypoxia-inducible factor-1alpha during hypoxia: A mechanism of O2 sensing. Journal of Biological Chemistry. 275 (33), 25130-25138 (2000).
- Cadenas, E., Boveris, A., Ragan, C. I., Stoppani, A. O. M. Production of superoxide radicals and hydrogen peroxide by NADH-ubiquinone reductase and ubiquinol-cytochrome C reductase from beef-heart mitochondria. Archives of Biochemistry and Biophysics. 180 (2), 248-257 (1977).
- Murphy, M. P. How mitochondria produce reactive oxygen species. Biochemical Journal. 417 (1), 1-13 (2009).
- Schieber, M., Chandel, N. S. ROS function in redox signaling and oxidative stress. Current Biology. 24 (10), 453-462 (2014).
- Spinelli, J. B., et al. Fumarate is a terminal electron acceptor in the mammalian electron transport chain. Science. 374 (6572), 1227-1237 (2021).
- Kumar, R., et al. A redox cycle with complex II prioritizes sulfide quinone oxidoreductase-dependent H(2)S oxidation. Journal of Biological Chemistry. 298 (1), 101435 (2022).
- Warburg, O., Geissler, A. W., Lorenz, S. On growth of cancer cells in media in which glucose is replaced by galactose. Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 348 (12), 1686-1687 (1967).
- Marroquin, L. D., Hynes, J., Dykens, J. A., Jamieson, J. D., Will, Y. Circumventing the Crabtree effect: replacing media glucose with galactose increases susceptibility of HepG2 cells to mitochondrial toxicants. Toxicological Sciences. 97 (2), 539-547 (2007).
- Attardi, G., King, M. P. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Bodnar, A. G., Cooper, M., Leonard, J. V., Schapira, A. H. Respiratory-deficient human fibroblasts exhibiting defective mitochondrial DNA replication. Biochemical Journal. 305, 817-822 (1995).
- Gregoire, M., Morais, R., Quilliam, M. A., Gravel, D. On auxotrophy for pyrimidines of respiration-deficient chick embryo cells. European Journal of Biochemistry. 142 (1), 49-55 (1984).
- Mackay, G. M., Zheng, L., vanden Broek, N. J., Gottlieb, E. Analysis of cell metabolism using LC-MS and isotope tracers. Methods in Enzymology. 561, 171-196 (2015).
- Heinrich, P., et al. Correcting for natural isotope abundance and tracer impurity in MS-, MS/MS- and high-resolution-multiple-tracer-data from stable isotope labeling experiments with IsoCorrectoR. Scientific Reports. 8 (1), 17910 (2018).
- Lee, P., Chandel, N. S., Simon, M. C. Cellular adaptation to hypoxia through hypoxia inducible factors and beyond. Nature Reviews Molecular Cell Biology. 21 (5), 268-283 (2020).
- Bisbach, C. M., et al. Succinate can shuttle reducing power from the hypoxic retina to the O(2)-rich pigment epithelium. Cell Reports. 31 (2), 107606 (2020).
- Angebault, C., et al. Idebenone increases mitochondrial complex I activity in fibroblasts from LHON patients while producing contradictory effects on respiration. BMC Research Notes. 4, 557 (2011).
- Liao, P. C., Bergamini, C., Fato, R., Pon, L. A., Pallotti, F. Isolation of mitochondria from cells and tissues. Methods in Cell Biology. 155, 3-31 (2020).
- Iwai, T., et al. Sodium accumulation during ischemia induces mitochondrial damage in perfused rat hearts. Cardiovascular Research. 55 (1), 141-149 (2002).
- Murphy, E., Eisner, D. A. Regulation of intracellular and mitochondrial sodium in health and disease. Circulation Research. 104 (3), 292-303 (2009).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), e52076 (2015).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Xiao, Y., Meierhofer, D. Are hydroethidine-based probes reliable for reactive oxygen species detection. Antioxidants and Redox Signaling. 31 (4), 359-367 (2019).
- DeBerardinis, R. J., et al. Beyond aerobic glycolysis: Transformed cells can engage in glutamine metabolism that exceeds the requirement for protein and nucleotide synthesis. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19345-19350 (2007).
- Keeley, T. P., Mann, G. E. Defining physiological normoxia for improved translation of cell physiology to animal models and humans. Physiological Reviews. 99 (1), 161-234 (2019).
- Ast, T., Mootha, V. K. Oxygen and mammalian cell culture: Are we repeating the experiment of Dr. Ox. Nature Metabolism. 1 (9), 858-860 (2019).
- Gu, C., Jun, J. C. Does hypoxia decrease the metabolic rate. Frontiers in Endocrinology. 9, 668 (2018).
- Voorde, J., et al. Improving the metabolic fidelity of cancer models with a physiological cell culture medium. Scientific Advances. 5 (1), 7314 (2019).
- Cantor, J. R., et al. Physiologic medium rewires cellular metabolism and reveals uric acid as an endogenous inhibitor of UMP synthase. Cell. 169 (2), 258-272 (2017).
- MacPherson, S., et al. Clinically relevant T cell expansion media activate distinct metabolic programs uncoupled from cellular function. Molecular Therapy. Methods and Clinical Development. 24, 380-393 (2022).
- Torres-Quesada, O., Doerrier, C., Strich, S., Gnaiger, E., Stefan, E. Physiological cell culture media tune mitochondrial bioenergetics and drug sensitivity in cancer cell models. Cancers. 14 (16), 3917 (2022).
- Chan, S. W., Chen, J. Z. Measuring mtDNA damage using a supercoiling-sensitive qPCR approach. Methods in Molecular Biology. 554, 183-197 (2009).
- Doherty, E., Perl, A. Measurement of mitochondrial mass by flow cytometry during oxidative stress. Reactive Oxygen Species. 4 (10), 275-283 (2017).
- Birsoy, K., et al. An essential role of the mitochondrial electron transport chain in cell proliferation is to enable aspartate synthesis. Cell. 162 (3), 540-551 (2015).
- Beigneux, A. P., et al. ATP-citrate lyase deficiency in the mouse. Journal of Biological Chemistry. 279 (10), 9557-9564 (2004).
- Gameiro, P. A., et al. In vivo HIF-mediated reductive carboxylation is regulated by citrate levels and sensitizes VHL-deficient cells to glutamine deprivation. Cell Metabolism. 17 (3), 372-385 (2013).
- Fendt, S. M., et al. Reductive glutamine metabolism is a function of the alpha-ketoglutarate to citrate ratio in cells. Nature Communications. 4, 2236 (2013).
- Lee, C. P. Biochemical studies of isolated mitochondria from normal and diseased tissues. Biochimica et Biophysica Acta. 1271 (1), 21-28 (1995).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved