Method Article
فحص عالي الإنتاجية للحصول على نتائج بلورية لعلم بلورات البروتين
In This Article
Summary
يفصل هذا البروتوكول فحص التبلور عالي الإنتاجية ، بدءا من إعداد لوحة المقايسة الدقيقة 1,536 إلى نهاية نافذة زمنية تجريبية مدتها 6 أسابيع. يتم تضمين تفاصيل حول إعداد العينة ، والتصوير الذي تم الحصول عليه ، وكيف يمكن للمستخدمين إجراء التحليلات باستخدام واجهة مستخدم رسومية مدعومة بالذكاء الاصطناعي لتحديد ظروف التبلور الجزيئي بسرعة وكفاءة.
Abstract
علم البلورات بالأشعة السينية هو الأسلوب الأكثر استخداما لتمييز الهياكل الجزيئية الكبيرة ، لكن الخطوة الحاسمة المتمثلة في بلورة البروتين إلى شبكة مرتبة قابلة للحيود لا تزال صعبة. يتم تعريف تبلور الجزيئات الحيوية إلى حد كبير تجريبيا ، ويمكن أن تكون هذه العملية كثيفة العمالة ومانعة للباحثين في المؤسسات المحدودة الموارد. في المركز الوطني للتبلور عالي الإنتاجية (HTX) ، تم تنفيذ طرق قابلة للتكرار بدرجة عالية لتسهيل نمو البلورات ، بما في ذلك إعداد آلي عالي الإنتاجية يبلغ 1536 بئرا من الألواح الدقيقة تحت الزيت مصمم لأخذ عينات واسعة من معلمات التبلور. تتم مراقبة الصفائح باستخدام أحدث طرق التصوير على مدار 6 أسابيع لتوفير نظرة ثاقبة لنمو البلورات ، وكذلك لتمييز ضربات الكريستال القيمة بدقة. علاوة على ذلك ، فإن تنفيذ خوارزمية تسجيل الذكاء الاصطناعي المدربة لتحديد نتائج الكريستال ، إلى جانب واجهة مفتوحة المصدر وسهلة الاستخدام لعرض الصور التجريبية ، يبسط عملية تحليل صور نمو البلورات. هنا ، يتم وصف الإجراءات والأجهزة الرئيسية لإعداد الكوكتيلات وألواح التبلور ، وتصوير الألواح ، وتحديد النتائج بطريقة تضمن التكاثر وتزيد من احتمالية التبلور الناجح.
Introduction
حتى في عصر التقدم الهائل في أساليب البيولوجيا الهيكلية ، لا يزال علم البلورات بالأشعة السينية طريقة موثوقة وشائعة لتوليد نماذج هيكلية عالية الجودة للجزيئات الكبيرة. أكثر من 85٪ من جميع النماذج الهيكلية ثلاثية الأبعاد المودعة في بنك بيانات البروتين (PDB) هي من الطرق الهيكلية القائمة على الكريستال (اعتبارا من يناير 2023). 1 علاوة على ذلك ، يظل علم البلورات بالأشعة السينية لا غنى عنه لحل هياكل البروتين ، وهو عنصر حاسم في عملية اكتشاف الأدويةوتطويرها 2. على الرغم من أن تبلور البروتين ظل تقنية البيولوجيا الهيكلية السائدة لأكثر من نصف قرن ، إلا أن طرق التنبؤ باحتمالية التبلور بناء على الخصائص الفيزيائية3 أو التسلسل 4,5 لا تزال في مهدها.
التنبؤ بظروف التبلور أكثر غموضا. تم إحراز تقدم محدود للتنبؤ بظروف التبلور المحتملة حتى بالنسبة للبروتيناتالنموذجية 6,7. حاولت دراسات أخرى تحديد ظروف التبلور بناء على تماثل البروتين والظروف المستخرجة من PDB8،9،10. ومع ذلك ، فإن القدرة التنبؤية التي يمكن العثور عليها في PDB محدودة ، حيث يتم إيداع شروط التبلور النهائية الناجحة فقط ، والتي ، بالضرورة ، تفوت تجارب التحسين الشاملة في كثير من الأحيان المطلوبة لضبط نمو البلورات. علاوة على ذلك ، تفتقر العديد من إدخالات PDB إلى البيانات الوصفية التي تحتوي على هذه التفاصيل ، بما في ذلك صيغ الكوكتيل وتنسيق التبلور ودرجة الحرارة والوقت اللازم لبلورة11,12. لذلك ، بالنسبة للعديد من البروتينات ذات الأهمية ، فإن الطريقة الأكثر سهولة لتحديد ظروف التبلور هي تجريبيا ، باستخدام أكبر عدد ممكن من الظروف عبر مجموعة واسعة من الاحتمالات الكيميائية.
تم استكشاف العديد من الأساليب لجعل فحص التبلور مثمرا وشاملا قدر الإمكان لإحداث تأثير كبير ، بما في ذلك المصفوفات المتفرقة 13 ، والفحص العاملي غير المكتمل 14 ، والمواد المضافة 15،16 ، والبذر 17 ، وعوامل النواة 18. طور المركز الوطني HTX في معهد هاوبتمان وودوارد للبحوث الطبية (HWI) خط أنابيب فعالا لفحص التبلور باستخدام نهج الدفعات الدقيقةتحت النفط 19 ، والذي يستخدم طرق معالجة السوائل والتصوير الآلي لتبسيط تحديد ظروف التبلور الأولية باستخدام الحد الأدنى نسبيا من أحجام العينات والكوكتيل (الشكل 1). تعتمد المجموعة المكونة من 1536 كوكتيلا فريدا على الظروف التي تم تحديدها مسبقا على أنها مواتية لنمو بلورات البروتين وهي مصممة لتكون متنوعة كيميائيا من أجل أخذ عينات من مجموعة كبيرة من ظروف التبلور المحتملة20،21،22. يزيد أخذ العينات الواسع لظروف التبلور من احتمال ملاحظة واحد أو أكثر من خيوط التبلور.
ظهرت في الأدبيات تحليلات رسمية قليلة لعدد الحالات اللازمة للفحص. ركزت إحدى الدراسات على تخطيط أخذ العينات لشاشات مختلفة ووجدت أن أخذ العينات العشوائية للمكونات (على غرار عامل غير مكتمل) يمثل طريقة أخذ العينات الأكثر شمولاوكفاءة 23. أشارت دراسة أخرى للفحص إلى أنه كانت هناك العديد من الحالات التي أسفرت فيها الشاشة الشاملة للغاية البالغ عددها 1,536 عن إصابة بلورة واحدة فقطب 24 ، وأبرزت دراسة حديثة جدا أن معظم الشاشات التجارية تقلل من مساحة التبلور المعروفة بأنها مرتبطة بفحص25. لن تسفر جميع خيوط التبلور عن بلورة ذات جودة حيود مناسبة لجمع البيانات بسبب الاضطراب المتأصل داخل البلورة أو قيود الحيود أو العيوب البلورية ؛ لذلك ، فإن صب شبكة أوسع للظروف له فائدة إضافية تتمثل في توفير أشكال بلورية بديلة للتحسين.
شكل تجارب بلورة البروتين له أيضا تأثير على نجاح الشاشة. نشر البخار هو الإعداد الأكثر استخداما لتطبيقات التبلور عالية الإنتاجية ويستخدم في أحدث مراكز التبلور ، بما في ذلك مراكز الفحص عالية الإنتاجية EMBL Hamburg و Institut Pasteur26،27،28. يستخدم مركز HTX طريقة الدفعة الدقيقة تحت النفط. على الرغم من أنها أقل استخداما ، إلا أنها طريقة قوية تقلل من استهلاك كوكتيلات العينة والتبلور20،21،22. تتمثل إحدى مزايا طريقة الدفعة الدقيقة تحت الزيت ، خاصة عند استخدام زيت البارافين عالي اللزوجة ، في حدوث تبخر طفيف فقط داخل القطرة أثناء التجربة ، مما يعني أن تركيز التوازن يتحقق عند خلط القطرة. إذا لوحظت نتائج تبلور إيجابية في طريقة الدفعة الدقيقة تحت الزيت ، فإن تكاثر هذه الظروف عادة ما يكون أكثر وضوحا من إعدادات انتشار البخار ، حيث يحدث التبلور في نقطة غير محددة أثناء التوازن بين قطرة التبلور والخزان. إن استنساخ الضربات أمر مرغوب فيه لنهج التبلور عالي الإنتاجية ، والتي تنتج بلورات بروتينية صغيرة للغاية تحتاج عادة إلى تحسينها لتجارب الأشعة السينية أحادية البلورة.
تتكون شاشة التبلور عالية الإنتاجية للبروتينات القابلة للذوبان من الكوكتيلات التي يتم إعدادها داخليا ، والشاشات التجارية الجاهزة ، والشاشات التجارية المعدلة داخليا22. تم تطوير الكوكتيلات في البداية باستخدام استراتيجية عاملية غير مكتملة باستخدام كوكتيلات التبلور الناجحة سابقا20. تشمل الكواشف الموجودة في الشاشة المتوفرة تجاريا صفائف من البوليمرات وأملاح التبلور و PEG ومجموعات الأيونات والشاشات التي تستخدم مصفوفة متفرقة ونهج عاملية غير مكتملة. هناك أيضا كواشف يتم تعديلها قبل تضمينها في الشاشة: شاشة مضافة ، وشاشة الأس الهيدروجيني والعازلة ، وشاشة مضافة سائلة أيونية ، وشاشة بوليمر.
تم الاستفادة من قوة ظروف واستراتيجيات التبلور المعروفة في 1,536 كوكتيل تبلور ، إلى جانب فوائد نظام microbatch-under-oil لإنشاء خط أنابيب يستخدم المعالجة الآلية للسوائل ، والتصوير الآلي للحقول الساطعة ، والتصوير غير الخطي من الدرجة الثانية للبلورات الشريانية (SONICC). توفر أتمتة كل من معالجة السوائل والتصوير فوائد ساعات عمل أقل في المختبر الرطب وقابلية استنساخ أعلى. تتطلب الطبيعة عالية الإنتاجية لفحص التبلور الآلي أتمتة عملية مراقبة نمو البلورات. يتم تحقيق هذه التطورات من خلال أحدث تقنيات التصوير للمساعدة في تحديد نتائج الكريستال الإيجابية. يتم استخدام كل من التصوير القياسي للألواح ، بالإضافة إلى طرق الفوتون المتعددة للكشف المحسن ، عبر نظام تصوير بلوري مع SONICC (الشكل 2). تجمع SONICC بين الفحص المجهري للجيل التوافقي الثاني (SHG)29 والفحص المجهري الفلوري المثار ثنائي الفوتون فوق البنفسجي (UV-TPEF)30 للكشف عن البلورات الصغيرة جدا ، وكذلك تلك التي تحجبها الراسبات. يعلم تصوير SONICC ما إذا كانت الآبار تحتوي على البروتين (عبر UV-TPEF) والبلورات (عبر SHG). بالإضافة إلى التحديد الإيجابي لبلورات البروتين ، يمكن أيضا الحصول على معلومات إضافية باستخدام أحدث طرق التصوير. يعمل التصوير بالكوكتيل فقط قبل إضافة العينة كعنصر تحكم سلبي ؛ يمكن لهذه الصور تحديد مظهر البئر قبل إضافة العينة ، بما في ذلك من حيث بلورات الملح والحطام. بالإضافة إلى ذلك ، يساعد التصوير SHG و UV-TPEF على تمييز بلورات البروتين عن بلورات الملح ويمكن استخدامه لتصور المواد المعقدة للحمض النوويالبروتيني 31.
تؤدي تجارب التبلور عالية الإنتاجية التي تخضع للمراقبة المتكررة عبر التصوير إلى حجم كبير جدا من الصور التي تحتاج إلى فحص. تم تطوير طرق تسجيل الكريستال الآلية لتقليل العبء على المستخدم وزيادة احتمالية تحديد ضربات الكريستال الإيجابية. شارك مركز HTX في تطوير خوارزمية تسجيل MAchine للتعرف على نتائج التبلور (MARCO) ، وهي بنية شبكة عصبية تلافيفية عميقة مدربة طورها اتحاد من الشركاء الأكاديميين وغير الربحيين والحكوميين والصناعة لتصنيف صور بئر برايتفيلد32. تم تدريب الخوارزمية على ما يقرب من نصف مليون صورة برايت فيلد من تجارب التبلور من مؤسسات متعددة باستخدام طرق تبلور مختلفة وأجهزة تصوير مختلفة. تنتج الخوارزمية درجة احتمالية تشير إلى ما إذا كانت صورة معينة تقع في أربع فئات صور محتملة: "بلوري" و "واضح" و "راسب" و "آخر". تم الإبلاغ عن دقة تصنيف MARCO بنسبة 94.5٪. يتم تحسين اكتشاف الكريستال بشكل أكبر من خلال برنامج ينفذ الخوارزمية ويوفر واجهة مستخدم رسومية (GUI) لعرض الصور بسهولة ويمكن الوصول إليها ، ويتم تمكينها من خلال إمكانات التسجيل التي تدعم الذكاء الاصطناعي32,33. تم تصميم واجهة المستخدم الرسومية MARCO Polo للعمل بسلاسة مع إعداد نظام التصوير وإدارة البيانات في مركز HTX لتحديد النتائج في شاشة 1,536 بئرا ، مع مشاركة بشرية لفحص مخرجات القوائم التي تم فرزها. بالإضافة إلى ذلك ، نظرا لأن البرامج مفتوحة المصدر متاحة على GitHub ، فإن واجهة المستخدم الرسومية متاحة بسهولة للتعديل لتعكس الاحتياجات المحددة لمجموعات المختبرات الأخرى.
هنا ، يتم وصف عملية إعداد تجربة microbatch عالية الإنتاجية تحت النفط باستخدام معالجة السوائل الروبوتية لتقديم كل من الكوكتيل والبروتين. يحتوي مركز HTX على مجموعة فريدة من الأجهزة والموارد التي لا توجد في المؤسسات الأخرى ، بهدف توفير خدمات الفحص والموارد التعليمية للمستخدمين المهتمين. إن إظهار أساليب وقدرات التقنيات عالية الإنتاجية التي تدعم الروبوتات سيمكن المجتمع من معرفة التقنيات المتاحة واتخاذ القرارات لجهود تحديد الهيكل الخاصة بهم.
Protocol
1. إعداد أو شراء الكوكتيلات لستة عشر كتلة بئر عميقة 96 بئرا
- قم بإعداد الكوكتيلات الكيميائية التي يتم إنشاؤها داخليا عن طريق الاستغناء عنها في كتل الآبار العميقة (DW) المكونة من 96 بئرا. استخدم معالج سائل آلي لتوزيع وخلط محاليل المخزون من الأملاح والمخازن المؤقتة والبوليمرات والماء.
- قم بإعداد الكوكتيلات الكيميائية المعدلة داخليا باستخدام معالج سائل آلي أو ماصة متعددة القنوات لإضافة مكونات إضافية إلى شاشات كتلة DW ذات 96 بئرا والتي تم شراؤها تجاريا.
- شراء كتل DW المتاحة تجاريا.
- قم بتخزين كتل DW ذات 96 بئرا عند -20 درجة مئوية لمدة 12-18 شهرا.
ملاحظة: الكوكتيلات المعدة في الخطوة 1.1. و 1.2. املأ كتل DW 10/16 96 بئرا ، و 5/16 96 بئرا DW كما تم شراؤها. تم إعداد كتلة DW واحدة من 96 بئرا في الشاشة في وقت توزيع لوحة 1536 بئرا لتجنب ترسيب الشاشة المضافة (انظر القسم 3).
2. توزيع الكوكتيلات على أطباق 384 بئر
- قم بإذابة كتل DW المكونة من 96 بئرا عند 4 درجات مئوية طوال الليل. أحضر إلى درجة حرارة الغرفة (20-23 درجة مئوية) قبل البدء في تحضير ألواح 384 بئر.
ملاحظة: درجة حرارة الغرفة مناسبة لإعداد أطباق الكوكتيل. الشاغل الرئيسي في إعداد هذه الأطباق هو تجنب الرواسب ، والتي يمكن أن تسد أجهزة مناولة السوائل وتؤدي إلى تغييرات غير متوقعة في تركيزات مكونات الكوكتيل. - امزج الكتل جيدا عن طريق الانقلاب حسب الحاجة لإذابة أي راسب معتم مستمر. إذا كانت أي آبار تحتوي على راسب ، فقم بتسخين الكتل إلى 30 درجة مئوية حتى تذوب.
- قم بتوصيل 50 ميكرولتر من محلول الكوكتيل من أربع كتل DW سعة 96 بئرا إلى لوحة واحدة ذات 384 بئرا باستخدام روبوت مناولة السوائل مزود بحقنة 96 أو رأس ماصة. يتم ختم كتل DW الأربعة المكونة من 96 بئرا في لوحة 384 بئرا بحيث يتم ملء الأرباع (على سبيل المثال ، A1 من 96-DW1 إلى A1 من 384-plate1 ، A1 من 96-DW2 إلى B1 من 384-plate1 ، إلخ.) (الشكل 3).
- تسليم 15 من 16 كتلة DW 96 بئرا إلى 384 لوحة بئر للتخزين.
- قم بتخزين الألواح المكونة من 384 بئرا في درجة حرارة -20 درجة مئوية لمدة تصل إلى 6 أشهر لاستخدامها في تحضير ألواح البئر البالغ عددها 1536 بئرا.
3. تحضير ألواح 1536 بئرا بكوكتيلات الزيت والتبلور
- قم بتوصيل 5 ميكرولتر من زيت البارافين إلى كل بئر من لوحة 1536 بئرا باستخدام نظام آلي لمعالجة السوائل مع القدرة على الشفط والتسليم البطيء. قم بتخزين ألواح الزيت على حرارة 4 درجات مئوية لمدة تصل إلى 6 أشهر.
- قم بإذابة ألواح البئر البالغ عددها 384 بئرا من القسم 2 عند 4 درجات مئوية طوال الليل. اقلب الألواح لخلط المحاليل وإذابة الراسب. احتضان الألواح عند 30 درجة مئوية لإذابة الرواسب الثابتة.
- لتحضير مكونات الشاشة المضافة ، استخدم كتلة DW النهائية المكونة من 96 بئرا والتي تحتوي على 0.1 M HEPES pH 6.8 ، 30٪ PEG3350 للخلط مع شاشة المضافات التجارية باستخدام إما روبوت معالجة السوائل أو ماصة متعددة القنوات.
- قم بإعداد محاليل الغربال المضافة عن طريق توزيع خليط 1: 1 من محلول PEG3350 المخزن مؤقتا المحضر في الخطوة 3.3 والشاشة المضافة إلى حجم نهائي يبلغ 50 ميكرولتر في لوحة 384 بئر مناسبة.
- استخدم روبوتا لمعالجة السوائل مزودا بحقنة 384 أو رأس ماصة لتوصيل 200 نانولتر من محلول الكوكتيل إلى كل بئر من لوحة البئر البالغ عددها 1536 بئرا. قم بختم أربع لوحات من 384 بئرا في لوحة 1536 بئرا بحيث يتم ملء الأرباع (على سبيل المثال ، A1 من 384 لوحة 1 إلى A1 من لوحة 1536 بئر ، A2 من 384 لوحة 1 إلى A3 من لوحة 1536 بئر ، إلخ.) (الشكل 3).
- أجهزة الطرد المركزي لوحات في 150 × غرام لمدة 5 دقائق قبل تخزينها في 4 درجات مئوية لمدة تصل إلى 4 أسابيع.
4. تقديم عينة
- لإرسال عينة ، أرسل بريدا إلكترونيا للحجز قبل الموعد النهائي للحجز لتشغيل العرض القادم. قم بتضمين عدد تجارب الفحص والاسم والباحث الرئيسي والمؤسسة ، بالإضافة إلى أي متطلبات معالجة خاصة للعينة. يتم إجراء عمليات الفحص مرة واحدة شهريا تقريبا ، مما ينتج عنه 12 جولة سنويا.
- أكمل نموذج تقديم العينة قبل شحن العينة.
- بالنسبة للمستخدمين الجدد ، اختر كلمة مرور سيتم استخدامها لتنزيل صور التبلور في القسم 7.
- بالنسبة للمستخدمين الراسخين، استخدم كلمة مرور موجودة أو قم بتغيير كلمة المرور في هذه الخطوة.
- أرسل العينة في أنبوب سعة 1.5 مل. تأكد من أن الجزيء متجانس ومركز بشكل كاف لتعزيز التبلور. استخدم اختبار ما قبل التبلور ، الذي يتكون عادة من كبريتات الأمونيوم أو PEG 4,000 ، للتحقق من تركيز العينة المناسب من خلال ملاحظة ما إذا كانت تركيزات العينة المختبرة تؤدي إلى قطرات واضحة أو ترسب34.
ملاحظة: تشمل اختبارات الجودة المناسبة التي يمكن إجراؤها قبل تقديم العينة للتحقق من النقاء والتجانس SDS-PAGE ، وترشيح الهلام ، وتشتت الضوء الديناميكي (DLS) ، من بين أمور أخرى. يمكن أن يتأثر التبلور بوجود شوائب طفيفة. مطلوب حاليا حجم عينة يبلغ 500 ميكرولتر لإعداد لوحة واحدة من 1536 بئرا. الاختبار جار لتقليل متطلبات حجم العينة.- تجنب استخدام تركيزات عازلة أكبر من 50 مللي مول ، وكذلك الفوسفات ، والتي قد تتبلور داخل الشاشة.
- تجنب عوامل الذوبان المفرطة ، بما في ذلك تركيزات الجلسرين التي تزيد عن 10٪ وزن / حجم.
- قم بتعبئة العينة للحفاظ على درجة حرارة مناسبة بأمان باستخدام الثلج الجاف أو الثلج الرطب أو عبوات التبريد في حاوية مغلقة.
- أولوية عينة السفينة بين عشية وضحاها من الاثنين إلى الأربعاء أثناء التشغيل.
- أرسل رقم التتبع بالبريد الإلكتروني بمجرد شحن العينة.
5. إعداد العينة في لوحات 1536 بئر المعدة
- قم بفك العينات واحتضانها على الفور عند درجة الحرارة التي طلبها المستخدم.
- بمجرد إذابتها ، قم بطرد العينة عند 10000 × جم لمدة 2 دقيقة في درجة حرارة الغرفة. راقب العينة بصريا لتحديد هطول الأمطار ولونها وحالتها قبل الإعداد.
- قم بتسخين صفيحة 1536 بئرا إلى 23 درجة مئوية وأجهزة طرد مركزي عند 150 × جم لمدة 5 دقائق. تخيل لوحة الكوكتيل فقط باستخدام تصوير برايت فيلد كعنصر تحكم سلبي.
ملاحظة: يتم تصوير جميع اللوحات بتصوير برايت فيلد قبل إعداد العينة، مما يتيح تحديد الآبار التي تحتوي بالفعل على بلورات أو حطام قبل إضافة العينة كعنصر تحكم سلبي. علاوة على ذلك ، فإنه يتيح تحديد الآبار التي لم يتم فيها تسليم كوكتيل التبلور. يؤدي تسخين اللوحة إلى درجة حرارة الغرفة إلى التخلص من التكثيف على سطح اللوحة ، مما يؤدي إلى صور واضحة. - قم بتوزيع 200 nL من العينة على كل بئر في لوحة 1,536 بئر باستخدام روبوت معالجة السوائل. لوحة الطرد المركزي عند 150 × جم وألواح الحضانة عند 4 درجات مئوية أو 14 درجة مئوية أو 23 درجة مئوية.
ملاحظة: يمكن إعداد تجارب Microbatch تحت الزيت يدويا عن طريق توزيع البروتين والكوكتيل تحت الزيت المطلوب. ومع ذلك ، يوصى باستخدام ما لا يقل عن 1 ميكرولتر من كل بروتين وكوكتيل لتحقيق نتائج قابلة للتكرار.
6. مراقبة 1536 لوحة بئر لتشكيل الكريستال
- بعد إضافة العينة إلى لوحات 1536 بئرا ، صورة مع تصوير برايت فيلد في اليوم 1 والأسبوع 1 والأسبوع 2 والأسبوع 3 والأسبوع 4 والأسبوع 6.
- قم بإجراء تصوير SONICC باستخدام SHG و UV-TPEF في نقطة زمنية مدتها 4 أسابيع للألواح التي يتم تحضينها عند 23 درجة مئوية وفي نقطة زمنية مدتها 6 أسابيع للألواح التي يتم تحضينها عند 14 درجة مئوية أو 4 درجات مئوية.
ملاحظة: تمت جدولة توقيت التصوير بالموجات فوق الصوتية بالرأس في 4 أسابيع و 6 أسابيع للوحة الفحص المجهري عالية الإنتاجية 1536 لأنه عادة ما تظهر البلورات في تلك النقاط الزمنية. للتعديل على دفعة صغيرة من 96 بئرا تحت تجارب انتشار الزيت أو البخار ، ينصح بإجراء تصوير SONICC في وقت مبكر من النافذة الزمنية. - الوصول إلى الصور التجريبية التي تم نقلها تلقائيا إلى حساب المستخدم باستخدام نظام LIMS داخلي. قم بإخطار المستخدمين عبر برنامج البريد الإلكتروني الآلي htslab بأن التصوير قد حدث.
7. تحليل الصور
- استرجع صور العرض من موقع بروتوكول نقل الملفات HWI لكل ملف .rar.
ملاحظة: ينتج عن إخراج الصورة من الشاشة 1536 عددا من الملفات التي تحتوي على صور برايت فيلد وصور SHG وصور UV-TPEF. كل طريقة تصوير أو نقطة زمنية هي ملف .rar منفصل. يحتوي كل ملف .rar ، عند تفريغه ، على صورة من كل بئر من لوحة 1536 بئرا في نقطة زمنية محددة باستخدام طريقة تصوير محددة.- استخدم عميل FileZilla أو خيارات أخرى للوصول إلى بيانات بروتوكول نقل الملفات.
ملاحظة: عميل FileZilla هو الطريقة الموصى بها لإدارة وحدة تخزين نقل الملفات الكبيرة لتقليل الأعطال الحسابية.- إذا كان عميل فايلزيلا بحاجة إلى تثبيت على كمبيوتر المستخدم، قم بتنزيل برنامج فايلزيلا.
- إذا كان FileZilla Client مثبتا بالفعل أو عند التثبيت ، فانقر فوق رمز FileZilla لفتح البرنامج.
- قم بتسجيل الدخول إلى خادم ftp البعيد من FileZilla عن طريق إدخال موقع ftp المضيف واسم المستخدم وكلمة المرور.
- قم بتنزيل ملفات .rar إلى الدليل المطلوب.
- استخدم عميل FileZilla أو خيارات أخرى للوصول إلى بيانات بروتوكول نقل الملفات.
- استخدم واجهة المستخدم الرسومية مفتوحة المصدر التي تدعم الذكاء الاصطناعي لعرض صور التبلور وتسجيلها وتحليلها.
ملاحظة: يمكن استخدام واجهة المستخدم الرسومية على معظم أنظمة تشغيل Windows و Mac و Linux (OS) ، وتوجد إرشادات خاصة بنظام التشغيل للتنزيل على موقع GitHub. MARCO Polo عبارة عن واجهة مستخدم رسومية مفتوحة المصدر تتضمن بيانات وصفية من شاشة التبلور عالية الإنتاجية 1,536 التي تم تنفيذها في مركز HTX. إنه متاح لأي شخص للتنزيل من GitHub للتعديل ليعكس الاحتياجات المحددة لمجموعات المختبرات الأخرى.- افتح ملف .rar في واجهة المستخدم الرسومية بعد تنزيل الملف (انظر الشكل التكميلي S1).
- انقر فوق استيراد ، وحدد الصور من القائمة المنسدلة ، ثم حدد من أرشيف / دليل Rar.
- انقر فوق استعراض بحثا عن مجلد في النافذة المنبثقة ، ثم انتقل إلى المجلد الذي يحتوي على الصور.
- حدد الملف (الملفات) المطلوب ، وقم بالاستيراد إلى واجهة المستخدم الرسومية بالنقر فوق فتح. انتظر حتى يظهر الملف (الملفات) في نافذة المسارات المحددة. حدد ملفا واحدا أو أكثر لتنزيله في واجهة المستخدم الرسومية ، وانقر فوق استيراد تشغيل.
- اعرض صورة البئر الأول في نافذة عارض عرض الشرائح في واجهة المستخدم الرسومية بالنقر فوق رمز > الموجود على يسار اسم العينة ثم تحديد القراءة المناسبة بالنقر المزدوج عليها (يتم سرد القراءات حسب تاريخ ونوع image-brightfield أو UV-TPEF أو SHG).
- قم بتكبير الصورة عن طريق تغيير حجم النافذة بأكملها. يتضمن مربع تفاصيل الصورة معلومات حول الصورة ، بما في ذلك معلومات التسجيل (فارغة حتى يتم تسجيل القراءة). يحتوي مربع تفاصيل الكوكتيل على بيانات وصفية حول مكونات الكوكتيل .
- انتقل إلى البئر التالي بالنقر فوق الزر " التالي" في لوحة التنقل أو الضغط على مفتاح السهم الأيمن على لوحة المفاتيح. انتقل إلى بئر معين عن طريق إدخال رقم البئر في نافذة حسب رقم البئر .
- اعرض جميع القراءات (لتلك التي تم استيرادها إلى واجهة المستخدم الرسومية) عن طريق تحديد المربع إظهار كافة التواريخ .
- اعرض جميع الأطياف (لتلك التي تم استيرادها إلى واجهة المستخدم الرسومية) عن طريق تحديد المربع إظهار كافة الأطياف . انقر فوق الزر "تبديل الطيف " لعرض كل صورة طيف على حدة.
- افتح ملف .rar في واجهة المستخدم الرسومية بعد تنزيل الملف (انظر الشكل التكميلي S1).
- سجل الصور البلورية باستخدام خوارزمية MARCO عن طريق تمييز تشغيل معين أولا من القائمة الموجودة على الجانب الأيسر من النافذة. بعد ذلك ، انقر فوق الزر "تصنيف التشغيل المحدد ". اعرض معلومات تسجيل MARCO في نافذة تفاصيل الصورة بمجرد تسجيل قراءة التصوير لجميع الآبار البالغ عددها 1536 بئرا.
ملاحظة: يستغرق التصنيف عادة ما بين 2-5 دقائق ، اعتمادا على سرعة الكمبيوتر والذاكرة المتاحة. تقوم الخوارزمية بإنشاء درجات تصنف المحتويات إلى فئات "بلورية" أو "واضحة" أو "راسبة" أو "أخرى". تعكس القيم الرقمية المرتبطة بتصنيف كل بئر احتمالية احتواء البئر على كائنات من تلك الفئة.- اعرض مجموعة فرعية من الصور المسجلة عن طريق تحديد المربع (المربعات) المطلوب في لوحة تصفية الصور والنقر فوق الزر إرسال عوامل التصفية . على سبيل المثال ، اعرض فقط الصور المصنفة بواسطة MARCO على أنها بلورات عن طريق تحديد مربعات البلورات و MARCO والنقر فوق إرسال عوامل التصفية.
- سجل الصور البلورية يدويا لإنشاء مجموعة "سجل الإنسان". قم بتعيين درجة إلى بئر بالنقر فوق الزر المناسب (توجد أزرار "بلورة" أو "مسح" أو "ترسب" أو "أخرى" في لوحة التصنيف أسفل النافذة). بدلا من ذلك ، استخدم لوحة الأرقام على لوحة المفاتيح لتعيين النتيجة (1 = "بلوري" ، 2 = "واضح" ، 3 = "راسب" ، 4 = "أخرى"). تعيين صورة من قبل الإنسان على أنها "مفضلة" عن طريق تحديد المفضلة؟ تابوت.
ملاحظة: اعرض فقط الصور المصنفة من قبل الإنسان على أنها بلورات عن طريق تحديد مربعات البلورات والإنسان والنقر فوق إرسال عوامل التصفية. يؤدي النقر فوق مربع المفضلة في لوحة التصفية إلى تضييق نطاق الصور التي تم إرجاعها ، وإرجاع الصور البلورية التي سجلها الإنسان والتي هي أيضا مفضلة. - استخدم علامة التبويب عارض اللوحات لعرض آبار متعددة في وقت واحد. في علامة التبويب عارض اللوحة الثانية في لوحة التحكم ، حدد 16 أو 64 أو 96 صورة من القائمة المنسدلة في قسم الصور لكل لوحة . استخدم علامة التبويب تصفية الصور للصور الرمادية التي لا تهمك. حدد مربع تطبيق عامل التصفية لتصفية الصور.
ملاحظة: على سبيل المثال ، حدد المربعين "البشري" و "البلوري" ، ولن يكون من السهل رؤية سوى الآبار التي تم تسجيلها كبلورة من قبل الإنسان.- انتقل في علامة التبويب عارض اللوحة ، بالنقر فوق الزر "التالي" لعرض المجموعة التالية من صور 16/64/96. بشكل افتراضي ، تكون الصور التي تم تسجيلها على أنها بلورات حمراء ، وتلك التي تم تسجيلها على أنها واضحة باللون الأزرق ، وتلك التي تم تسجيلها على أنها راسب باللون الأخضر ، وتلك التي تم تسجيلها على أنها أخرى برتقالية. قم بتغيير الألوان باستخدام القوائم المنسدلة.
- حدد المعلومات المراد عرضها على الآبار عن طريق تحديد مربعات مختلفة في علامة التبويب التسميات .
- انقر فوق حفظ العرض لحفظ ملف صورة للعرض الحالي.
- انقر فوق Swap Spectrum للتبديل بين صور brightfield و SHG و UV-TPEF للحصول على صورة متعددة الآبار.
- انقر فوق تصدير ، وحدد نوع الملف المناسب من القائمة المنسدلة لتصدير الملفات المسجلة لاستخدامها في برامج أخرى.
ملاحظة: تتوافق ملفات CSV (القيم المفصولة بفواصل) مع برامج جداول البيانات مثل Microsoft Excel أو جداول بيانات Google. يمكن فتح ملفات JSON (تدوين كائن جافا سكريبت) مع معظم برامج تحرير النصوص. يمكن استخدام PPTX (عرض PowerPoint التقديمي) لعرض الصور من Polo ، بما في ذلك مقارنة صور brightfield و UV-TPEF و SHG. يتم حفظ الملفات بتنسيق .xtal لإعادة فتحها في واجهة المستخدم الرسومية MARCO Polo.- احفظ ملفا بتنسيق .xtal بالنقر فوق ملف في أعلى الصفحة ثم تحديد إما حفظ تشغيل أو حفظ تشغيل باسم. أدخل اسم الملف وموقع الدليل.
- افتح ملفات بتنسيق .xtal بالنقر فوق استيراد وتحديد الصور ثم من التشغيل المحفوظ. استعرض للوصول إلى موقع الملف المناسب ، وانقر فوق اسم الملف ، ثم انقر فوق فتح.
النتائج
تتكون نتائج تجربة فحص الكريستال التي يبلغ عددها 1536 بئرا من سبع مجموعات كاملة من صور برايت فيلد تم جمعها في اليوم 0 (التحكم السلبي) ، واليوم 1 ، والأسبوع 1 ، والأسبوع 2 ، والأسبوع 3 ، والأسبوع 4 ، والأسبوع 6 (الشكل 4). يتم جمع صور SONICC عند نقطة زمنية مدتها 4 أسابيع للألواح المحتضنة عند 23 درجة مئوية وفي نقطة زمنية مدتها 6 أسابيع للألواح المحتضنة عند 4 درجات مئوية أو 14 درجة مئوية. إجمالا ، بمجرد شحن العينة ، يمكن للمستخدمين توقع إعداد لوحاتهم في غضون يوم 1 من الوصول. سيتم تحميل الصور عند جمعها. تنتهي تجربة فحص التبلور بعد 6 أسابيع.
يسمح إعداد اللوحة المكونة من 1536 بئرا بإجراء جميع تجارب الفحص داخل نفس اللوحة ، مما يحد من استهلاك العينة ويسهل التصوير والمقارنة المباشرة بين طرق التصوير. يتم عرض النتائج التمثيلية للمسار الزمني لنمو البلورة لحالة كوكتيل واحدة في الشكل 4. يسمح التصوير الآلي للوحة طوال فترة التجربة بتحديد البلورات سريعة النمو والبطيئة النمو عن طريق التصوير الساطع. يسمح التصوير بالأشعة فوق البنفسجية TPEF و SHG بالتحقق المتقاطع من النتائج التي لوحظها التصوير الساطع ويشير إلى أن البلورات المرصودة بروتينية وبلورية ، على التوالي (الشكل 5 أ ، ب). علاوة على ذلك ، يتيح التصوير بالموجات فوق الصوتية تحديد البلورات التي تحجبها بصريا الرواسب أو الأفلام (الشكل 5C) أو البلورات الدقيقة التي قد يتم الخلط بينها وبين الراسبات (الشكل 5D). بالنسبة لبعض البلورات ، لا يتم استبعاد عدم وجود إشارة SHG ، لأن بعض مجموعات النقاط لا تنتج إشارة SHG35,36 ، كما يتضح من بلورة الثوماتين رباعية الزوايا في الشكل 5C. وعلى العكس من ذلك، ينبغي توقع عدم وجود إشارة للأشعة فوق البنفسجية - TPEF للبروتينات التي تفتقر إلى بقايا التربتوفان. تسهل مراقبة إشارات UV-TPEF و SHG أيضا تحديد بلورات الملح غير البروتينية ، والتي ستظهر في برايتفيلد وتظهر إشارة SHG إيجابية قوية ولكنها ستفتقر إلى إشارة UV-TPEF (الشكل 5E).
يتم تبسيط تحليل الصور لإعداد اللوحة باستخدام واجهة المستخدم الرسومية MARCO Polo ، والتي تجمع أيضا نقل بيانات ftp من خوادم HWI (كبديل لنقل الملفات باستخدام FileZilla). تسمح واجهة المستخدم الرسومية MARCO Polo بعرض اللوحة والصور بسهولة ويقوم بتسجيل الصور الحسابية باستخدام خوارزمية MARCO بحيث يمكن تنزيل نتائج الصور وعرضها وتحليلها بسرعة من مركز HTX. خوارزمية تسجيل MARCO ، كما تم تنفيذها في واجهة المستخدم الرسومية MARCO Polo ، قادرة على تسجيل الصور من لوحة 1536 بئرا بأكملها في أقل من 5 دقائق. يمكن بعد ذلك فرز الصور التي تم وضع علامة عليها على أنها بلورية بواسطة خوارزمية MARCO بواسطة واجهة المستخدم الرسومية Polo للعرض. نظرا لأنه تم تحسين خوارزمية MARCO لتحديد الكريستال وتقليل السلبيات الخاطئة حتى لا تفوت أي نتائج إيجابية ، يمكن أن يؤدي التسجيل إلى علامات إيجابية خاطئة. ومع ذلك ، فإن قدرة MARCO على الحد من مجموعة الصور التي تحتاج إلى فحص من خلال تركيز الانتباه على الآبار ذات الاحتمال الكبير لاحتواء البلورات تؤدي إلى انخفاض كبير في عبء معالجة البيانات للمستخدمين. إن التنفيذ المريح للخوارزمية في منصة عرض MARCO Polo سهلة الاستخدام ، مع قدرتها على فرز الصور بناء على درجات MARCO ، يحسن بشكل كبير من قدرة المستخدم على تحليل مجموعة البيانات بسرعة وتحديد نتائج الكريستال بدقة.
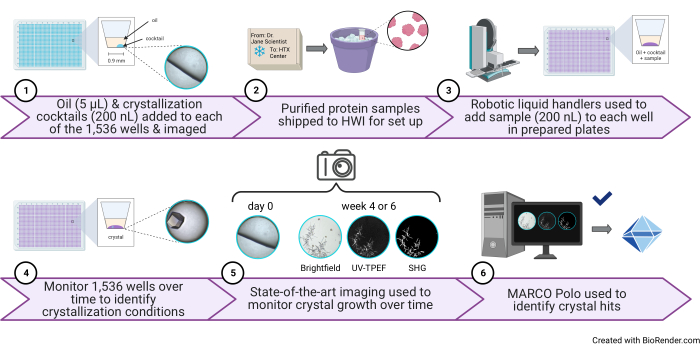
الشكل 1: رسم تخطيطي لتجربة فحص تبلور عالية الإنتاجية تبلغ 1536 بئرا تم إجراؤها في مركز HTX. (1) في هذه الخطوة ، تتم إضافة 5 ميكرولتر من زيت البارافين و 200 نانولتر من الكوكتيل إلى كل بئر (خطوة البروتوكول 3.1 والخطوة 3.5). يظهر رسم كاريكاتوري لبئر واحد يحتوي فقط على الزيت والكوكتيل وصورة تمثيلية على اليمين. (2) تصل العينات إلى مركز HTX (خطوة البروتوكول 5.1). 3) في هذه الخطوة ، تتم إضافة 200 نانولتر من العينة إلى كل بئر (خطوة البروتوكول 5.4). (4) تتم مراقبة جميع الآبار البالغ عددها 1536 بئرا بمرور الوقت باستخدام التصوير الساطع ، 5) بالإضافة إلى طرق UV-TPEF و SHG (خطوة البروتوكول 6). 6) يتم استخدام واجهة المستخدم الرسومية مفتوحة المصدر التي تدعم الذكاء الاصطناعي لعرض صور التبلور وتسجيلها وتحليلها (خطوة البروتوكول 7). الاختصارات: HTX = تبلور عالي الإنتاجية ؛ UV-TPEF = مضان متحمس للأشعة فوق البنفسجية ثنائية الفوتون ؛ SHG = الجيل التوافقي الثاني ؛ الذكاء الاصطناعي = الذكاء الاصطناعي. واجهة المستخدم الرسومية = واجهة مستخدم رسومية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: لوحة واحدة من 1536 بئرا تحتوي على تجارب فحص ، تم تصويرها باستخدام التصوير الساطع والأشعة فوق البنفسجية TPEF و SHG. يتم عرض لوحات 1,536 بئرا مع قرش أمريكي للمقياس (أعلى). يتم تصوير كل تجربة فحص مرة واحدة قبل الإعداد وست مرات بعد إضافة العينة باستخدام تصوير برايت فيلد (إجمالي سبع مجموعات صور برايت فيلد ، على اليسار). تخضع الصفائح للتصوير بالأشعة فوق البنفسجية UV-TPEF (في الوسط) و SHG (على اليمين) في 4 أسابيع أو 6 أسابيع. الاختصارات: UV-TPEF = UV-two-الفوتون متحمس مضان. SHG = الجيل التوافقي الثاني. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
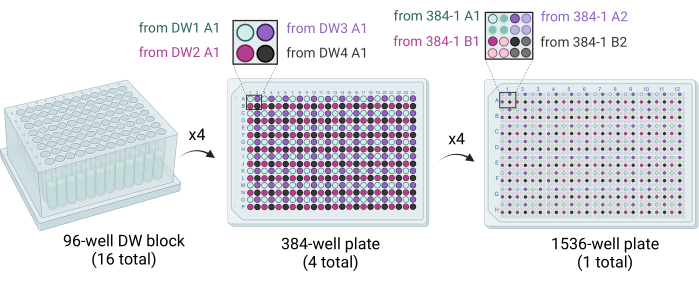
الشكل 3: رسم تخطيطي يوضح كيفية إنشاء ألواح الآبار البالغ عددها 1536 بئرا. يتم استخدام ستة عشر كتلة DW ذات 96 بئرا للقضاء على أربع لوحات 384 بئرا ، مع ملء كل ربع من كل لوحة 384 بئرا عن طريق توزيع كوكتيلات التبلور. تملأ أربع كتل DW ذات 96 بئرا لوحة واحدة من 384 بئرا (في المنتصف). يتم استخدام أربع لوحات من 384 بئرا للقضاء على اللوحة المفردة المكونة من 1536 بئرا (يمين). اختصار: DW = بئر عميق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
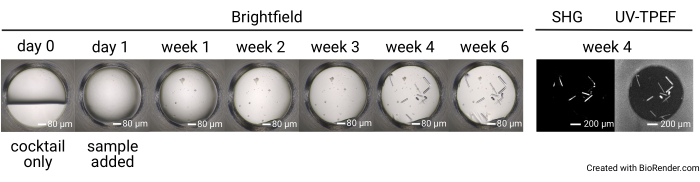
الشكل 4: مسار زمني تمثيلي لبئر واحد في تجربة فحص 1536 بئرا. يتم تصوير اللوحات قبل إعداد العينة (اليوم 0) ، وكذلك مع تصوير برايت فيلد في اليوم 1 والأسبوع 1 والأسبوع 2 والأسبوع 3 والأسبوع 4 والأسبوع 6. يتم تصوير الصفائح المحتضنة عند 23 درجة مئوية باستخدام SONICC في الأسبوع 4. قضبان المقياس = 80 ميكرومتر (برايتفيلد) ، 200 ميكرومتر (SHG ، UV-TPEF). الاختصارات: SONICC = التصوير غير الخطي من الدرجة الثانية للبلورات الشريانية ؛ UV-TPEF = مضان متحمس للأشعة فوق البنفسجية ثنائية الفوتون ؛ SHG = الجيل التوافقي الثاني. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
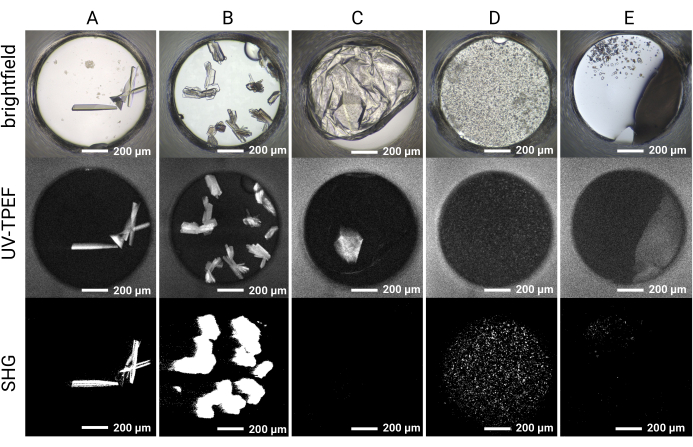
الشكل 5: نتائج التصوير التمثيلي لتجارب فحص الكريستال HT 1,536. يتم عرض نتائج التصوير Brightfield و UV-TPEF و SHG لخمسة آبار نموذجية. (أ، ب) بلورات البروتين التي لوحظها التصوير برايتفيلد والأشعة فوق البنفسجية TPEF و SHG واضحة بوضوح في جميع طرق التصوير الثلاثة. (ج) يمكن رؤية بلورة بروتينية محجوبة بفيلم في التصوير الساطع عن طريق التصوير بالأشعة فوق البنفسجية TPEF ؛ لا يتم ملاحظة البلورة بواسطة تصوير SHG بسبب عدم توافق مجموعة النقاط. (د) مثال على البلورات الدقيقة التي تم التحقق منها بواسطة التصوير بالأشعة فوق البنفسجية TPEF و SHG والتي يمكن اعتبارها راسبة. (ه) مثال على بلورات الملح التي تظهر بلورية بواسطة التصوير الساطع و SHG ولكنها لا تظهر إشارة UV-TPEF. قضبان المقياس = 200 ميكرومتر. قطر البئر = 0.9 مم. الاختصارات: UV-TPEF = UV-two-الفوتون متحمس مضان. SHG = الجيل التوافقي الثاني. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي S1: فتح ملفات الصور في MARCO Polo. يمكن فتح ملفات الصور داخل واجهة المستخدم الرسومية MARCO Polo بالانتقال إلى ملف استيراد |علامة التبويب "الصور" في الجزء العلوي (أ). لاحظ أنه يمكن أيضا نقل الملفات عبر أداة From FTP مباشرة في MARCO Polo (a) أو يمكن نقلها عبر FileZilla كما هو موضح في خطوة البروتوكول 7.2. لاستيراد الملفات التي تم تنزيلها بالفعل، اختر الصور | من أرشيف / دليل rar. في النافذة المنبثقة التي تظهر، حدد استعراض للوصول إلى المجلد (ب)، وانتقل إلى دليل الملفات حيث يتم حفظ ملفات صور اللوحة. بمجرد أن تكون الملفات في نافذة المسارات المحددة (ج) ، قم بتمييز ملف ، وانقر فوق استيراد عمليات (د). ستحدد واجهة المستخدم الرسومية MARCO Polo البيانات الوصفية الصحيحة لملف الكوكتيل لاستيرادها مع الصور. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
تصف الطريقة خط أنابيب عالي الإنتاجية لفحص بلورة البروتين الذي يتطلب أقل من 500 ميكرولتر من العينة ل 1536 تجربة تبلور فردية في شكل دفعة صغيرة تحت النفط. يعتمد خط الأنابيب على روبوتات معالجة السوائل للمساعدة بسرعة وبشكل متكرر في الإعداد التجريبي ، بالإضافة إلى مورد تحليل الصور الحسابية MARCO Polo ، والذي تم تخصيصه لتحليل صور لوحة 1,536 بئرا باستخدام خوارزمية MARCO لتحديد وعزل ضربات الكريستال.
الحجم الصغير لقطرات الفحص الفردية (إجمالي 400 نانولتر مع نسبة 1: 1 من العينة: كوكتيل) يعني أن أحجام العينات الصغيرة للغاية مطلوبة لتحديد ظروف التبلور الإيجابية. تنتج أحجام القطرات الصغيرة هذه بالضرورة بلورات صغيرة لا يمكن صيدها بواسطة الحلقات التقليدية. تم تطوير طرق للحصاد من 1536 لوحة37 ؛ بالإضافة إلى ذلك ، تم استخدام الألواح ذات البلورات مباشرة في مصادر السنكروترون لجمع البيانات في الموقع 38. إذا تم تطوير طريقة قوية لحصاد هذه البلورات ، فإن التقدم في تكنولوجيا السنكروترون والحزم الدقيقة التركيز ستمكن من الحصول على مجموعات بيانات مفيدة. بالإضافة إلى ذلك ، يمكن استخدام البلورات التي تم الحصول عليها كبذور لجهود التحسين.
من الواضح أن التصوير بالموجات فوق الصوتية الصوتية مفيد في تحديد كل من بلورات البروتين الصغيرة وبلورات البروتين المخبأة تحت الراسب. على الرغم من هذه المزايا ، ليست كل أنواع العينات قابلة للتصوير SHG و UV-TPEF. على سبيل المثال ، ستظهر البروتينات التي تحتوي على القليل من بقايا التربتوفان العطرية أو لا تحتوي على أي منها إشارة غامضة للأشعة فوق البنفسجية. علاوة على ذلك ، لن يتم اكتشاف البلورات في مجموعات فضائية محددة ، بما في ذلك المجموعات المركزية المتماثلة أو المجموعة النقطية 432 ، بواسطة تصوير SHG. تتداخل العينات التي تحتوي على الفلوروفورات أحيانا مع إشارة SHG ، مما يؤدي إلى إلغاء الإشارة أو زيادة شدتها ، مما يعني أن التفسير الدقيق لإشارات SHG مطلوب للبروتينات المحتوية على المعادن والبروتينات التي تحتوي على شقوق الفلورسنت. ومع ذلك ، في كثير من الحالات ، من الممكن ترشيد عدم وجود إشارة SHG أو UV-TPEF ، ولا ينبغي أن يؤدي عدم وجود هذه الإشارات بالضرورة إلى استبعاد وجود بلورة بروتينية.
يوفر تنسيق microbatch-under-oil بديلا لطريقة انتشار البخار الأكثر شيوعا المستخدمة في علم البلورات عالي الإنتاجية. والأهم من ذلك أن شكل التبلور يؤثر على التحديد39، مما يوفر الأساس المنطقي لاستخدام أشكال التبلور المختلفة لجهود الفرز عالية الإنتاجية. يساعد التصوير الآلي والطرائق التي تدعم SONICC في التعرف السريع على بلورات البروتين طوال الدورة الزمنية التجريبية التي تبلغ مدتها 6 أسابيع. وأخيرا، تتيح واجهة المستخدم الرسومية MARCO Polo للمستخدمين تحليل الصور بسرعة من 1,536 حالة لتحديد الآبار الواعدة للتحسين. توفر القدرات في مركز HTX ، بما في ذلك الإعداد التجريبي عالي الإنتاجية الذي يدعم الروبوتات ، إلى جانب أحدث أدوات التصوير والحوسبة للتحليلات ، مساهمة كبيرة في مجتمع البيولوجيا الهيكلية من خلال تمكين الباحثين من معالجة عنق الزجاجة الأساسي بشكل فعال في العمل الهيكلي القائم على البلورات: إيجاد ظروف التبلور.
Disclosures
ليس للمؤلفين مصالح مالية متنافسة أو تضارب مصالح آخر.
Acknowledgements
نود أن نعرب عن امتناننا لمستخدمينا على تكليف عيناتهم الثمينة لنا بفحص الكريستال ، وكذلك لتقديم ملاحظات وطلبات نقدية ساعدتنا في تحسين وتطوير مواردنا لخدمة مجتمع البيولوجيا الهيكلية بشكل أفضل. نود أيضا أن نعرب عن تقديرنا لإيثان هولمان والدكتورة ليزا جيه كيف والدكتورة إيريكا دوجويد ، الذين قادوا تطوير واجهة المستخدم الرسومية MARCO Polo. نود أن نشكر زملاء HWI على دعمهم واقتراحاتهم ، وخاصة الدكتورة ديانا سي إف مونتيرو. نحن نعترف بدعم التمويل من المعاهد الوطنية للصحة ، R24GM141256.
Materials
| Name | Company | Catalog Number | Comments |
| 1536 Well Imp@ct LBR LoBase | Greiner Bio-One | 790 801 | |
| Acetic acid | Hampton Research | HR2-853 | |
| AlumaSeal II Sealing Film | Hampton Research | HR8-069 | |
| Ammonium bromide | Molecular Dimensions | MD2-100-247 | |
| Ammonium chloride | Hampton Research | HR2-691 | |
| Ammonium hydroxide | Hampton Research | HR2-855 | |
| Ammonium nitrate | Hampton Research | HR2-665 | |
| Ammonium phosphate dibasic | Hampton Research | HR2-629 | |
| Ammonium phosphate monobasic | Hampton Research | HR2-555 | |
| Ammonium sulfate | Hampton Research | HR2-541 | |
| Ammonium thiocyanate | Molecular Dimensions | MD2-100-301 | |
| Bicine pH 9.0 | Hampton Research | HR2-723 | |
| Bis-tris propane pH 7.0 | Hampton Research | HR2-993-08 | |
| Calcium acetate | Hampton Research | HR2-567 | |
| Calcium chloride dihydrate | Hampton Research | HR2-557 | |
| CAPS pH 10.0 | Rigaku Reagents | none given | |
| ClearSeal Film | Hampton Research | HR4-521 | |
| Cobalt sulfate heptahydrate | Molecular Dimensions | MD2-100-42 | |
| Crystal Screen HT screen | Hampton Research | HR2-130 | |
| Formulator | Formulatrix | ||
| Glycerol | Hampton Research | HR2-623 | |
| Gryphon liquid handling robot | Art Robbins Instruments | ||
| HEPES pH 7.0 | Hampton Research | HR2-902-03 | |
| HEPES pH 7.5 | Hampton Research | HR2-902-08 | |
| HWI HTX Center sample submission form | https://hwi.buffalo.edu/high-throughput-crystallization-screening-center-sample-submission-form/ | ||
| Hydrochloric acid | Hampton Research | HR2-581 | |
| Index HT screen | Hampton Research | HR2-134 | |
| Ionic Liquid screen | Hampton Research | HR2-214 | |
| Lithium bromide | Molecular Dimensions | MD2-100-312 | |
| Lithium chloride | Hampton Research | HR2-631 | |
| Lithium sulfate monohydrate | Hampton Research | HR2-545 | |
| Magnesium acetate tetrahydrate | Hampton Research | HR2-561 | |
| Magnesium chloride hexahydrate | Hampton Research | HR2-559 | |
| Magnesium nitrate hexahydrate | Hampton Research | HR2-657 | |
| Magnesium sulfate heptahydrate | Hampton Research | HR2-821 | |
| Manganese chloride tetrahydrate | Millipore Sigma | 63535-50G | |
| Manganese sulfate monohydrate | Molecular Dimensions | MD2-100-310 | |
| MARCO Polo GUI download | https://hauptman-woodward.github.io/Marco_Polo/ | ||
| Matrix Platemate 2 x 3 liquid handling robot | Thermo Scientific | ||
| MES pH 6.0 | Hampton Research | HR2-943-09 | |
| Mosquito liquid handling robot | SPTLabtech | ||
| Paraffin Oil/White Mineral Oil Saybolt Viscosity 340-365 at 100 °F | Sigma Aldrich | PX0045-3 | |
| PEG 1000 | Hampton Research | HR2-523 | |
| PEG 2000 | Hampton Research | HR2-592 | |
| PEG 20000 | Hampton Research | HR2-609 | |
| PEG 3350 | Hampton Research | HR2-527 | |
| PEG 400 | Hampton Research | HR2-603 | |
| PEG 4000 | Hampton Research | HR2-529 | |
| PEG 6000 | Hampton Research | HR2-533 | |
| PEG 8000 | Hampton Research | HR2-535 | |
| PEG/Ion HT screen | Hampton Research | HR2-139 | |
| PEGRx HT screen | Hampton Research | HR2-086 | |
| Plate reservations | htslab@hwi.buffalo.edu | ||
| Potassium acetate | Hampton Research | HR2-671 | |
| Potassium bromide | Hampton Research | HR2-779 | |
| Potassium carbonate | Molecular Dimensions | MD2-100-311 | |
| Potassium chloride | Hampton Research | HR2-649 | |
| Potassium nitrate | Hampton Research | HR2-663 | |
| Potassium phosphate dibasic | Hampton Research | HR2-635 | |
| Potassium phosphate-monobasic | Hampton Research | HR2-553 | |
| Potassium phosphate-tribasic | Molecular Dimensions | MD2-100-309 | |
| Potassium thiocyanate | Hampton Research | HR2-695 | |
| Rock Imager 1000 with SONICC | Formulatrix | ||
| Rock Imager 54 | Formulatrix | ||
| Rubidium chloride | Millipore Sigma | R2252-10G | |
| SaltRx HT screen | Hampton Research | HR2-136 | |
| Silver Bullets screen | Hampton Research | HR2-096 | |
| Slice pH screen | Hampton Research | HR2-070 | |
| Sodium acetate pH 5.0 | Hampton Research | HR2-933-15 | |
| Sodium bromide | Hampton Research | HR2-699 | |
| Sodium chloride | Hampton Research | HR2-637 | |
| Sodium citrate pH 4.2 | Hampton Research | HR2-935-01 | |
| Sodium citrate pH 5.6 | Hampton Research | HR2-735 | |
| Sodium hydroxide | Hampton Research | HR2-583 | |
| Sodium molybdate dihydrate | Molecular Dimensions | MD2-100-207 | |
| Sodium nitrate | Hampton Research | HR2-661 | |
| Sodium phosphate monobasic | Hampton Research | HR2-551 | |
| Sodium thiosulfate pentahydrate | Molecular Dimensions | MD-100-307 | |
| StockOptions Polymer screen | Hampton Research | HR2-227 | |
| Tacsimate pH 7 | Hampton Research | HR2-755 | |
| TAPS pH 9.0 | bioWORLD | 40121071 | |
| Tris pH 8 | Hampton Research | HR2-900-11 | |
| Tris pH 8.5 | Hampton Research | HR2-725 | |
| ViaFLO 384 | Integra | ||
| ViaFLO 384 384 channel pipettor head (0.5-12.5µL) | Integra | ||
| ViaFLO 384 96 channel pipettor head (300µL) | Integra | ||
| Zinc acetate dihydrate | Hampton Research | HR2-563 |
References
- PDB data distribution by experimental method and molecular type. RCSB Protein Data Bank Available from: https://www.rcsb.org/stats/summary (2022)
- Maveyraud, L., Mourey, L. Protein X-ray crystallography and drug discovery. Molecules. 25 (5), 1030 (2020).
- Dupeux, F., Röwer, M., Seroul, G., Blot, D., Márquez, J. A. A thermal stability assay can help to estimate the crystallization likelihood of biological samples. Acta Crystallographica Section D: Biological Crystallography. 67 (11), 915-919 (2011).
- Elbasir, A., et al. DeepCrystal: A deep learning framework for sequence-based protein crystallization prediction. Bioinformatics. 35 (13), 2216-2225 (2019).
- Zucker, F. H., et al. Prediction of protein crystallization outcome using a hybrid method. Journal of Structural Biology. 171 (1), 64-73 (2010).
- George, A., Wilson, W. W. Predicting protein crystallization from a dilute solution property. Acta Crystallographica Section D: Biological Crystallography. 50 (4), 361-365 (1994).
- Jia, Y., Liu, X. -. Y. From surface self-assembly to crystallization: prediction of protein crystallization conditions. The Journal of Physical Chemistry B. 110 (13), 6949-6955 (2006).
- Slabinski, L., et al. XtalPred: A web server for prediction of protein crystallizability. Bioinformatics. 23 (24), 3403-3405 (2007).
- Abrahams, G. J., Newman, J. BLASTing away preconceptions in crystallization trials. Acta Crystallographica Section F: Structural Biology Communications. 75 (3), 184-192 (2019).
- Rosa, N., et al. Tools to ease the choice and design of protein crystallisation experiments. Crystals. 10 (2), 95 (2020).
- Newman, J., et al. On the need for an international effort to capture, share and use crystallization screening data. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 68 (3), 253-258 (2012).
- Lynch, M. L., Dudek, M. F., Bowman, S. E. A searchable database of crystallization cocktails in the PDB: analyzing the chemical condition space. Patterns. 1 (4), 100024 (2020).
- Jancarik, J., Kim, S. -. H. Sparse matrix sampling: a screening method for crystallization of proteins. Journal of Applied Crystallography. 24 (4), 409-411 (1991).
- Carter, C. W. Efficient factorial designs and the analysis of macromolecular crystal growth conditions. Methods. 1 (1), 12-24 (1990).
- McPherson, A., Cudney, B. Searching for silver bullets: An alternative strategy for crystallizing macromolecules. Journal of Structural Biology. 156 (3), 387-406 (2006).
- McPherson, A., Nguyen, C., Cudney, R., Larson, S. The role of small molecule additives and chemical modification in protein crystallization. Crystal Growth & Design. 11 (5), 1469-1474 (2011).
- Luft, J. R., DeTitta, G. T. A method to produce microseed stock for use in the crystallization of biological macromolecules. Acta Crystallographica Section D: Biological Crystallography. 55 (5), 988-993 (1999).
- Thakur, A. S., et al. Improved success of sparse matrix protein crystallization screening with heterogeneous nucleating agents. PLoS One. 2 (10), 1091 (2007).
- Chayen, N. E., Stewart, P. D. S., Blow, D. M. Microbatch crystallization under oil-a new technique allowing many small-volume crystallization trials. Journal of Crystal Growth. 122 (1-4), 176-180 (1992).
- Luft, J. R., et al. A deliberate approach to screening for initial crystallization conditions of biological macromolecules. Journal of Structural Biology. 142 (1), 170-179 (2003).
- Luft, J. R., Snell, E. H., DeTitta, G. T. Lessons from high-throughput protein crystallization screening: 10 years of practical experience. Expert Opinion on Drug Discovery. 6 (5), 465-480 (2011).
- Lynch, M. L., Snell, M. E., Potter, S. A., Snell, E. H., Bowman, S. E. 20 years of crystal hits: Progress and promise in ultrahigh-throughput crystallization screening. Acta Crystallographica Section D: Biological Crystallography. , (2023).
- Segelke, B. W. Efficiency analysis of sampling protocols used in protein crystallization screening. Journal of Crystal Growth. 232 (1-4), 553-562 (2001).
- Luft, J. R., Newman, J., Snell, E. H. Crystallization screening: the influence of history on current practice. Acta Crystallographica Section F. 70 (7), 835-853 (2014).
- Mlynek, G., Kostan, J., Leeb, S., Djinovic-Carugo, K. Tailored suits fit better: Customized protein crystallization screens. Crystal Growth & Design. 20 (2), 984-994 (2019).
- Mueller-Dieckmann, J. The open-access high-throughput crystallization facility at EMBL Hamburg. Acta Crystallographica Section D: Biological Crystallography. 62 (12), 1446-1452 (2006).
- Weber, P., et al. High-throughput crystallization pipeline at the crystallography core facility of the Institut Pasteur. Molecules. 24 (24), 4451 (2019).
- Lin, Y. What's happened over the last five years with high-throughput protein crystallization screening. Expert Opinion on Drug Discovery. 13 (8), 691-695 (2018).
- Haupert, L. M., Simpson, G. J. Screening of protein crystallization trials by second order nonlinear optical imaging of chiral crystals (SONICC). Methods. 55 (4), 379-386 (2011).
- Madden, J. T., DeWalt, E. L., Simpson, G. J. Two-photon excited UV fluorescence for protein crystal detection. Acta Crystallographica Section D: Biological Crystallography. 67 (10), 839-846 (2011).
- Fleming, A. M., et al. Second harmonic generation interrogation of the endonuclease APE1 binding interaction with G-quadruplex DNA. Analytical Chemistry. 94 (43), 15027-15032 (2022).
- Bruno, A. E., et al. Classification of crystallization outcomes using deep convolutional neural networks. PLoS One. 13 (6), 0198883 (2018).
- Holleman, E. T., Duguid, E., Keefe, L. J., Bowman, S. E. Polo: An open-source graphical user interface for crystallization screening. Journal of Applied Crystallography. 54 (2), 673-679 (2021).
- Niesen, F. H., et al. An approach to quality management in structural biology: Biophysical selection of proteins for successful crystallization. Journal of Structural Biology. 162 (3), 451-459 (2008).
- Padayatti, P., Palczewska, G., Sun, W., Palczewski, K., Salom, D. Imaging of protein crystals with two-photon microscopy. Biochemistry. 51 (8), 1625-1637 (2012).
- Haupert, L. M., DeWalt, E. L., Simpson, G. J. Modeling the SHG activities of diverse protein crystals. Acta Crystallographica Section D: Biological Crystallography. 68 (11), 1513-1521 (2012).
- Luft, J. R., Grant, T. D., Wolfley, J. R., Snell, E. H. A new view on crystal harvesting. Journal of Applied Crystallography. 47 (3), 1158-1161 (2014).
- Bruno, A. E., Soares, A. S., Owen, R. L., Snell, E. H. The use of haptic interfaces and web services in crystallography: An application for a 'screen to beam' interface. Journal of Applied Crystallography. 49 (6), 2082-2090 (2016).
- Baldock, P., Mills, V., Stewart, P. S. A comparison of microbatch and vapour diffusion for initial screening of crystallization conditions. Journal of Crystal Growth. 168 (1-4), 170-174 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved