A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التقدم في التحليل الطيفي بالأشعة تحت الحمراء النانوية لاستكشاف الأنظمة البوليمرية متعددة المراحل
In This Article
Summary
يصف هذا البروتوكول تطبيق مجهر القوة الذرية والتحليل الطيفي بالأشعة تحت الحمراء النانوية لتقييم أداء التحليل الطيفي بالأشعة تحت الحمراء الحرارية الضوئية في توصيف العينات متعددة البوليمرات ثلاثية الأبعاد.
Abstract
تشمل الأنظمة البوليمرية متعددة الأطوار المجالات المحلية ذات الأبعاد التي يمكن أن تختلف من بضع عشرات من النانومتر إلى عدة ميكرومترات. يتم تقييم تكوينها بشكل شائع باستخدام التحليل الطيفي بالأشعة تحت الحمراء ، والذي يوفر بصمة متوسطة للمواد المختلفة الموجودة في الحجم الذي تم فحصه. ومع ذلك ، لا يقدم هذا النهج أي تفاصيل حول ترتيب المراحل في المادة. المناطق البينية بين مرحلتين بوليمريتين ، غالبا في النطاق النانوي ، يصعب الوصول إليها أيضا. يراقب التحليل الطيفي بالأشعة تحت الحمراء النانوية الحرارية الضوئية الاستجابة المحلية للمواد المثارة بضوء الأشعة تحت الحمراء باستخدام المسبار الحساس لمجهر القوة الذرية (AFM). في حين أن هذه التقنية مناسبة لاستجواب الميزات الصغيرة ، مثل البروتينات الفردية على الأسطح الذهبية البكر ، فإن توصيف المواد متعددة المكونات ثلاثية الأبعاد أكثر مراوغة. ويرجع ذلك إلى الحجم الكبير نسبيا من المواد التي تخضع للتمدد الحراري الضوئي ، والتي يتم تحديدها من خلال التركيز بالليزر على العينة والخصائص الحرارية للمكونات البوليمرية ، مقارنة بالمنطقة النانوية التي تم فحصها بواسطة طرف AFM. باستخدام حبة البوليسترين (PS) وفيلم كحول البولي فينيل (PVA) ، نقوم بتقييم البصمة المكانية لمطيافية الأشعة تحت الحمراء الحرارية الضوئية النانوية لتحليل السطح كدالة لموضع PS في فيلم PVA. يتم التحقيق في تأثير موضع الميزة على صور الأشعة تحت الحمراء النانوية ، ويتم الحصول على الأطياف. يتم توفير بعض وجهات النظر حول التطورات المستقبلية في مجال التحليل الطيفي بالأشعة تحت الحمراء النانوية الحرارية الضوئية ، مع الأخذ في الاعتبار توصيف الأنظمة المعقدة ذات الهياكل البوليمرية المدمجة.
Introduction
أصبح مجهر القوة الذرية (AFM) ضروريا لتصوير وتوصيف مورفولوجيا مجموعة متنوعة من العينات بدقةالمقياس النانوي 1،2،3. من خلال قياس انحراف ناتئ AFM الناتج عن تفاعل الطرف الحاد مع سطح العينة ، تم تطوير بروتوكولات التصوير الوظيفي النانوية لقياسات الصلابة المحلية والتصاق عينة الطرف 4,5. بالنسبة للمواد المكثفة اللينة وتحليل البوليمر ، فإن قياسات AFM التي تستكشف الخصائص الميكانيكية النانوية والكيميائية النانوية للمجالات المحلية مطلوبة بشدة بعد6،7،8. قبل ظهور التحليل الطيفي بالأشعة تحت الحمراء النانوية (nanoIR) ، تم تعديل أطراف AFM كيميائيا لتقييم وجود مجالات مختلفة من منحنى قوة AFM وخصم طبيعة تفاعل عينة الطرف. على سبيل المثال ، تم استخدام هذا النهج للكشف عن تحويل المجالات الدقيقة للبولي (ثلاثي بوتيل أكريلات) على سطح الأغشية الرقيقة من البوليسترين المعالج بكتلة بولي (ثلاثي بوتيل أكريلات) عند المستوى الفرعي 50 نانومتر9.
كان لمزيج ضوء الأشعة تحت الحمراء (IR) مع AFM تأثير كبير على مجال علوم البوليمر6. التحليل الطيفي بالأشعة تحت الحمراء التقليدي هو تقنية مستخدمة على نطاق واسع لدراسة التركيب الكيميائي للمواد البوليمرية10,11 ، لكنه يفشل في توفير معلومات عن المراحل الفردية وسلوك الطور البيني ، حيث أن المناطق صغيرة جدا مقارنة بحجم شعاع الأشعة تحت الحمراء المستخدم لفحص العينة. وتنطبق المشكلة على التحليل الطيفي بالأشعة تحت الحمراء ، حيث إنه مقيد بحد الحيود البصري6. هذه القياسات متوسط مساهمات المنطقة بأكملها متحمسة لضوء الأشعة تحت الحمراء. تظهر الإشارات الناتجة عن وجود مراحل نانوية داخل المنطقة التي تم فحصها إما بصمات معقدة يجب فك التفافها أثناء المعالجة اللاحقة أو تضيع بسبب مستوى إشارة أقل من المستوى القابل للاكتشاف. وبالتالي ، من الضروري تطوير أدوات قادرة على الدقة المكانية النانوية والحساسية العالية للأشعة تحت الحمراء لاستكشاف الميزات الكيميائية النانوية في الوسائط المعقدة.
تم تطوير مخططات لتحقيق التحليل الطيفي للأشعة تحت الحمراء النانوية ، أولا باستخدام طرف AFM معدني كهوائي نانوي12،13 ، ومؤخرا استغلال قدرة الكابولي AFM على مراقبة التغيرات في التمدد الحراري الضوئي الذي يحدث أثناء إضاءة الأشعة تحت الحمراء للعينة12،14،15. يستخدم هذا الأخير مصدر ضوء الأشعة تحت الحمراء النبضي القابل للضبط على نطاق امتصاص للمادة التي تم فحصها ، مما يؤدي إلى امتصاص العينة للإشعاع والخضوع للتمدد الحراري الضوئي. هذا النهج مناسب تماما للمواد العضوية والبوليمرية. يجعل الإثارة النبضية التأثير قابلا للكشف بواسطة ناتئ AFM الملامس لسطح العينة في شكل تذبذب. ثم يتم مراقبة سعة أحد رنين التلامس للنظام الملاحظ في طيف التردد كدالة لطول موجة الإضاءة ، والتي تشكل طيف امتصاص الأشعة تحت الأشعة تحت طرف AFM15. تقتصر الدقة المكانية للتصوير بالأشعة تحت الحمراء النانوية والتحليل الطيفي على التأثيرات المختلفة للتمدد الحراري الضوئي للمادة. تم تقييم أن التحليل الطيفي للأشعة تحت الحمراء النانوية الحرارية الضوئية باستخدام وضع الاتصال AFM يمكنه الحصول على خصائص أطياف الامتصاص الاهتزازي للمواد ذات الدقة المكانية بمقياس 50 نانومتر14 ، مع العمل الأخير الذي يوضح الكشف عن المونومرات ودايمرات α-synuclein 16,17. ومع ذلك ، فإن الدراسات الكمية لأداء قياسات الأشعة تحت الحمراء النانوية على المواد البوليمرية غير المتجانسة المجمعة في تكوينات مختلفة ، مثل حالة الممتصات ذات الأبعاد المحدودة المضمنة في حجم الأفلام البوليمرية المختلفة ، لا تزال محدودة.
تهدف هذه المقالة إلى إنشاء مجموعة بوليمرية ذات ميزة مضمنة ذات بعد معروف لتقييم حساسية التمدد الحراري الضوئي والدقة المكانية للأشعة تحت الحمراء النانوية أثناء تحليل السطح. يغطي البروتوكول تحضير فيلم رقيق من بوليمر كحول البولي فينيل (PVA) على ركيزة سيليكون ووضع حبة بوليسترين ثلاثية الأبعاد (PS) على فيلم PVA أو مضمن فيه ، والذي يشكل تشكيل نظام النموذج. يتم وصف التصوير بالأشعة تحت الحمراء النانوية وقياسات التحليل الطيفي في سياق تقييم الإشارات الناتجة عن نفس حبة PS الموضوعة على أو أسفل فيلم PVA. يتم تقييم تأثير موضع الخرزة على إشارات nanoIR. تتم مناقشة طرق تقييم البصمة المكانية للحبة في خريطة nanoIR ، ويتم النظر في تأثيرات العديد من المعلمات.
Protocol
1. صنع محلول كحول البولي فينيل (PVA)
- قم بقياس الماء وكريات بوليمر PVA (انظر جدول المواد) لإنشاء محلول 10 مل بنسبة 20٪ PVA إلى الماء بالوزن.
- سخني الماء في الأواني الزجاجية على طبق ساخن على حرارة 100 درجة مئوية.
- ضع كريات بوليمر PVA في الماء الساخن. أدخل قضيب تحريك مغناطيسي.
- خففي الحرارة إلى 80 درجة مئوية وقلبي حتى يذوب PVA تماما.
- قم بتغطية الجزء العلوي من الأواني الزجاجية لمنع التلوث.
- بمجرد إذابته بالكامل ، ضع محلول PVA بنسبة 20٪ في حاوية تخزين مناسبة للتخزين في درجة حرارة الغرفة.
2. تحضير رقائق السيليكون المطلية ب PVA (Si)
- قطع رقاقة السيليكون (Si) (انظر جدول المواد) إلى ~ 10 × 10 مم2 مربعات.
- قم بتنظيف الركيزة Si باستخدام كحول الأيزوبروبيل واتركها تجف.
- ضع رقاقة Si النظيفة على ظرف معطف الدوران (انظر جدول المواد).
- يلقي قطرة ما يقرب من 10 ميكرولتر من محلول PVA على مركز الركيزة Si. حاول تجنب تكوين الفقاعة.
- قم بتغطية ركيزة Si بفيلم PVA موحد عن طريق طلاء الدوران لمدة 30 ثانية بمعدل 1500 دورة في الدقيقة (rpm).
ملاحظة: يخلق الحجم المحدد لمعلمات الطلاء السائل والمغزلي طبقة موحدة من PVA عبر سطح الركيزة بسماكة كافية لمنع التجفيف السريع بين طلاء الدوران ووضع حبات PS على سطح PVA في الخطوة التالية.
- أخرج العينة من طبقة الدوران وضعها في حاوية عينة نظيفة لمنع التلوث قبل نقل حبات PS.
3. وضع حبات PS على السطح المطلي ب PVA
- نظف ركيزة Si باستخدام كحول الأيزوبروبيل واتركها تجف.
- باستخدام ماصة ، ضع 1 ميكرولتر من حبات PS المعلقة في الماء على مركز الركيزة.
- دع الماء يتبخر عن طريق وضع العينة في حجرة تخزين تحتوي على مجفف طين البنتونيت.
ملاحظة: تحافظ هذه الخطوة على العينة عن طريق تقليل التعرض للرطوبة. - ضع الركيزة المطلية ب PVA (الخطوة 2.4) والركيزة مع حبات PS المجففة (الخطوة 3.3) تحت المجهر الضوئي. اعتمادا على حجمها ، ستكون حبة واحدة مرئية باستخدام مناظير بسيطة أو تتطلب تكبيرا بصريا أعلى.
- قم بفك الخرزات برفق باستخدام ملاقط متناهية الصغر (انظر جدول المواد). استخدم فرشاة رسم الشعر الناعم لجمع بعض الخرز السائب واضغط برفق على شعر فرشاة الرسم فوق الرقاقة المطلية حديثا ب PVA. يجب أن تسمح عمليات المسح المتعددة للخرز بالتراكم داخل شعر الفرشاة. اضغط على الجزء العلوي من شعر فرشاة الرسم لإزعاج مسحوق حبة PS لتحرير الخرز على سطح PVA اللزج.
ملاحظة: من المهم أن تكون فرشاة الرسم عالية الجودة ونظيفة لتجنب إطلاق الألياف والملوثات على سطح فيلم PVA. يعد التحرك بسرعة خلال هذه الخطوة أمرا ضروريا حتى لا يجف PVA تماما. - كرر هذه الخطوة حتى يتم التأكد من خلال الفحص المجهري الضوئي أن حبات PS الفردية تلتصق بسطح PVA.
- قم بتخزين العينة في حاوية نظيفة. اترك العينة تجف تماما.
ملاحظة: يجب ترك العينة تبرد وتجف تماما قبل إجراء المزيد من محاولات التحليل. يمكن لقياسات ارتفاع AFM أو قياسات ملف تعريف السطح تقييم سمك أفلام PVA المتتالية.
4. تحميل العينة لتوصيف AFM
ملاحظة: يعتمد البروتوكول الموصوف على إجراءات التشغيل القياسية لمنصة nanoIR2 (انظر جدول المواد) ، ولكن يجب تكييفه وفقا لنموذج AFM المستخدم للقياس.
- قم بتركيب عينة حبة PVA و PS على مرحلة AFM باستخدام قرص AFM معدني وعلامات تبويب لاصقة ، بحيث يتم إرفاق العينة بإحكام بحامل العينة.
- قم بتركيب مسبار nanoIR (على سبيل المثال ، FORTGG) على حامل مسبار AFM.
ملاحظة: يبلغ طول الكابولي AFM 225 ميكرومتر وعرضه 27 ميكرومتر وسمكه 2.7 ميكرومتر ، ونصف قطر طرفه أقل من 10 نانومتر. الكابولي مطلي بفيلم ذهبي بسمك 45 نانومتر على كلا الجانبين للحد من استجابته لإضاءة الأشعة تحت الحمراء العلوية للعينة (انظر جدول المواد). بالنسبة لقياسات التحليل الطيفي للأشعة تحت الحمراء النانوية ، يفضل استخدام ناتئ تم تخزينه في بيئة خالية من polydimethylsiloxane قبل الاستخدام. - قم بمحاذاة ليزر القراءة في الطرف الحر من شعاع الكابولي عن طريق تدوير مقابض محاذاة الليزر (تعديلات x و y لموضع الليزر والضبط الرأسي لموضع الكاشف).
- تعظيم إشارة SUM للكاشف.
- اضبط موضع الكاشف عن طريق تدوير مقبض الانحراف بحيث يتم محاذاة الليزر مع مركز الكاشف الحساس للموضع لنظام قراءة AFM ، المقابل لإشارة انحراف عمودي تبلغ ~ 0 فولت.
- انقر على أيقونة التحميل في لوحة تحكم AFM "Probe".
- اتبع المطالبات داخل شاشة المعالج. استخدم أسهم التركيز لتحديد المستوى البؤري للناتئ nanoIR. استخدم عناصر التحكم في إزاحة XY لوضع الكابولي في وسط الشاشة (محاذاة مع الصليب الأبيض).
- بعد ذلك ، انقر فوق أسهم التركيز للعثور على المستوى البؤري لسطح العينة.
- استخدم العرض البصري للنظام وعناصر التحكم في الإزاحة XY لوضع طرف الكابولي فوق حبة الاهتمام وانقر فوق التالي.
- على شاشة المشاركة ، اضبط "المواجهة" على 50 ميكرومتر وانقر على نهج فقط.
- ابدأ إجراء Engage للاقتراب من طرف التصوير.
5. إنشاء صور طبوغرافية ونانوية لعينة البوليمر المتعدد
- الحصول على صور التضاريس في "وضع الاتصال" القياسي. بمجرد تعيين موضع الكابولي فيما يتعلق بخرزة PS ، ابدأ النهج بالنقر فوق رمز المشاركة في لوحة تحكم AFM "Probe". يتم استخدام نقطة ضبط تعشيق لفرق انحراف 0.2 فولت للدراسة بأكملها هنا ، المقابلة لقوة ~ 100 nN.
في لوحة تحكم AFM "Scan" ، اضبط معدل المسح الضوئي على 0.8 هرتز ، وحجم المسح الضوئي (الارتفاع والعرض) ، وعدد النقاط لكل سطر وعدد الخطوط لكل صورة لاستخدامها في التصوير (تم استخدام 512 × 512 هنا). انقر فوق مسح ضوئي للحصول على صورة الطبوغرافيا.
ملاحظة: تتم معايرة الكابولي18 عن طريق تحديد حساسية الانحراف (بالنانومتر / الخامس) من منحنى مسافة الانحراف الذي تم الحصول عليه مع تفاعل الكابولي مع ركيزة الياقوت (الشكل التكميلي 1 أ). يتم تحديد صلابة الكابولي من الضبط الحراري19 (الشكل التكميلي 1B). يتم تركيب رنين الكابولي باستخدام وظيفة لورنتزيان. يتم تحديد صلابة الكابولي (في N / m) باستخدام نظرية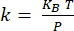 التقسيم المتساوي ، حيث KBهو ثابت بولتزمان ، T هي درجة الحرارة (T = 295K) ، و P هي مساحة طيف الطاقة للتقلبات الحرارية للناتئ المحدد من خلال دمج ملاءمة لورنتزيان لبيانات الضبط الحراري20.
التقسيم المتساوي ، حيث KBهو ثابت بولتزمان ، T هي درجة الحرارة (T = 295K) ، و P هي مساحة طيف الطاقة للتقلبات الحرارية للناتئ المحدد من خلال دمج ملاءمة لورنتزيان لبيانات الضبط الحراري20. - بالنسبة لقياسات nanoIR ، ضع طرف AFM على الميزة المهمة المحددة من صورة الطبوغرافيا.
- حدد رمز الشوكة الرنانة في لوحة تحكم nanoIR لتحديد ترددات رنين التلامس للناتئ. اضبط رقما موجيا للإضاءة من شأنه أن يثير التمدد الحراري الضوئي في المادة. اضبط نطاقا من تردد نبضات الليزر لاكتساح وضبط دورة عمل ليزر nanoIR. حدد اكتساب ضمن "نافذة ضبط نبض الليزر".
- حدد رنين التلامس الثاني لنظام عينة الطرف لقياسات nanoIR عن طريق وضع شريط العلامة (الخط الرأسي الأخضر) في ذروة رنين التلامس الثاني.
ملاحظة: يمكن أن يختلف اختيار وضع رنين التلامس حسب نوع الكابولي والعينة. - انقر فوق تحسين لمحاذاة مركز المنطقة البؤرية لليزر بالأشعة تحت الحمراء مع موضع طرف الكابولي. تتم المحاذاة عند رقم موجي محدد لإضاءة الأشعة تحت الحمراء ، يتوافق مع نطاق امتصاص للمادة التي تم فحصها. يتم وضع الكابولي في مركز بصمة الليزر (الشكل التكميلي 2).
ملاحظة: يمكن أن تختلف المحاذاة باختلاف الأرقام الموجية حسب طراز الليزر. - الحصول على خلفية لإضاءة الليزر بالأشعة تحت الحمراء. يتكون هذا من قياس ناتج الليزر التعاقبي الكمومي بالأشعة تحت الحمراء (QCL) في نطاق الطول الموجي للانبعاث عند تردد النبضة المحدد (الشكل التكميلي 3). هذا مهم لتصحيح خلفية أطياف nanoIR.
- احصل على طيف nanoIR عن طريق تحديد نطاق الرقم الموجي (هنا ، يتم ضبط Start و Stop على 1,530 cm-1 و 1,800 cm-1 ، على التوالي) ، وحجم الخطوة (2 cm-1) ، وعدد المتوسطات المستخدمة للقياس. قم بإجراء تصحيح الخلفية للأطياف المعروضة بقسمة السعة الحرارية الضوئية المقاسة بالخلفية الموهنة ، والتي تتكون من ضرب الخلفية التي تم جمعها في الخطوة 5.2.4 في النسبة المئوية للطاقة المختارة للقياس.
- بالنسبة للتصوير بالأشعة تحت الحمراء النانوية، حدد المنطقة محل الاهتمام للتصوير.
- قم بتمكين الضبط التلقائي للحلقة المقفلة الطور (PLL) في "نافذة ضبط نبض الليزر" (يمكن الوصول إليها عن طريق رمز شوكة الرنانة ).
- اضبط الحد الأدنى والحد الأقصى للتردد لإنشاء نطاق مسح متمركز في وضع الرنين الثاني في لوحة التحكم العامة.
- قم بتصفير المرحلة بالنقر فوق الصفر في لوحة تحكم PLL ثم انقر فوق "موافق " في "نافذة ضبط نبض الليزر".
- حدد تمكين التصوير بالأشعة تحت الحمراء عن طريق وضع علامة اختيار في المربع داخل لوحة تحكم nanoIR.
- في لوحة تحكم "عرض التصوير" ، اختر الارتفاع (عرض التصوير 1) والسعة 2 (عرض التصوير 2) والمرحلة 2 (عرض التصوير 3) للحصول على الصور الطبوغرافية والكيميائية للعينة. قم بتعيين اتجاه الاكتساب إلى تتبع (أو تتبع). غالبا ما يكون الخط مناسبا للخط مطلوبا لمراقبة الصورة الطبوغرافية للعينة التي يتم الحصول عليها. يجب ضبط ملاءمة الالتقاط على بلا.
ملاحظة: يمكن ضبط تفضيلات المسح الضوئي، مثل اتجاه المسح الضوئي الذي تم التقاطه أو لوحة الألوان المستخدمة، حسب الحاجة. - في لوحة تحكم AFM "Scan" ، حدد رمز المسح الضوئي .
- لحفظ الصورة ، حدد رمز الآن أو نهاية الإطار في لوحة التحكم "التقاط".
- لتصدير البيانات ، انقر بزر الماوس الأيمن فوق أسماء ملفات الصور أو الطيف داخل قوائم البيانات. حدد تصدير واختر تنسيق الملف المراد تصديره. احفظ الملف في موقع مجلد الكمبيوتر المطلوب.
النتائج
تم ترسيب حبات PS ((C8H8) n) على ركيزة Si نظيفة (الشكل 1A) وعلى PVA ((CH2CHOH) n) (الشكل 1B ، C). بسبب ضعف التصاق الخرزة على Si ، لا يمكن الحصول على تصوير nanoIR في وضع الاتصال لهذه العينة. بدلا من ذلك ، باستخدام العرض البصري للعينة على nanoIR ، تم ?...
Discussion
يمكن أن يوفر AFM جنبا إلى جنب مع التحليل الطيفي للأشعة تحت الحمراء النانوية معلومات كيميائية نانوية باستخدام ناتئ في وضع التلامس ومصدر ضوء الأشعة تحت الحمراء القابل للضبط النبضي. تعد الأنظمة النموذجية ، مثل تضمين ممتص بأبعاد محدودة في حجم مادة بوليمرية ، مهمة لتحسين فهم آليات تكوين الصورة ...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم (NSF CHE-1847830).
Materials
| Name | Company | Catalog Number | Comments |
| 10|0 2200 Golden Taklon Round | Zem | ||
| 5357-8NM Tweezers | Pelco | ||
| Adhesive Tabs | Ted Pella | 16079 | |
| AFM metal specimen disks | Ted Pella | 16208 | |
| Binocular | AmScope | ||
| Cantilever for nanoIR measurements | AppNano | FORTGG | |
| Cell culture dishes | Greiner bio-one GmbH | ||
| Desiccator | |||
| Floating optical table | Newport | RS 4000 | |
| Hotplate | VWR | ||
| Isopropanol | |||
| Kimwipes | KIMTECH | ||
| Magnetic stir bar | |||
| Microparticles based on polystyrene size: 5 µm | SIGMA-ALDRICH | 79633 | |
| nanoIR2 microscope | Bruker | Contact mode NanoIR2 | |
| Nitrogen Tank | Airgas | ||
| Petri dishes | Greiner bio-one GmbH | ||
| Polyvinyl Alcohol | SIGMA-ALDRICH | 363170 | this polymer was only 87%-89% hydrolyzed, which explains the presence of residual C=O at 1730 cm-1 |
| Quantum Cascade Laser | Daylight Solutions | 1550-1800 cm-1 range | |
| Silicon wafer | MEMC St. Peters | #901319343000 | |
| Spin coater | Oscilla |
References
- Dufrêne, Y. F., Viljoen, A., Mignolet, J., Mathelié-Guinlet, M. AFM in cellular and molecular microbiology. Cellular Microbiology. 23 (7), e13324 (2021).
- Sharma, A., Rout, C. S. Probe-based techniques for 2D layered materials. Advanced Analytical Techniques for Characterization of 2D Materials. , 1-14 (2022).
- Zhong, J., Yan, J. Seeing is believing: atomic force microscopy imaging for nanomaterial research. RSC Advances. 6 (2), 1103-1121 (2016).
- Olubowale, O. H., et al. 34;May the force be with you!" Force-volume mapping with atomic force microscopy. ACS Omega. 6 (40), 25860-25875 (2021).
- Dokukin, M. E., Sokolov, I. Quantitative mapping of the elastic modulus of soft materials with HarmoniX and PeakForce QNM AFM modes. Langmuir. 28 (46), 16060-16071 (2012).
- Nguyen-Tri, P., et al. Recent applications of advanced atomic force microscopy in polymer science: a review. Polymers. 12 (5), 1142 (2020).
- Vitry, P., et al. Mode-synthesizing atomic force microscopy for 3D reconstruction of embedded low-density dielectric nanostructures. Nano Research. 8 (7), 2199-2205 (2015).
- Coste, R., Pernes, M., Tetard, L., Molinari, M., Chabbert, B. Effect of the interplay of composition and environmental humidity on the nanomechanical properties of hemp fibers. ACS Sustainable Chemistry & Engineering. 8 (16), 6381-6390 (2020).
- Schönherr, H., Feng, C. L., Tomczak, N., Vancso, G. J. Compositional mapping of polymer surfaces by chemical force microscopy down to the nanometer scale: reactions in block copolymer microdomains. Macromolecular Symposia. 230 (1), 149-157 (2005).
- Holland-Moritz, K., Siesler, H. W. Infrared spectroscopy of polymers. Applied Spectroscopy Reviews. 11 (1), 1-55 (1976).
- Bhargava, R., Wang, S. Q., Koenig, J. L. FTIR microscpectrscopy of polymeric systems. Liquid Chromatography/FTIR Microspectroscopy/Microwave Assisted Synthesis. , 137-191 (2003).
- Rao, V. J., et al. AFM-IR and IR-SNOM for the characterization of small molecule organic semiconductors. The Journal of Physical Chemistry C. 124 (9), 5331-5344 (2020).
- Wang, H., Wang, L., Xu, X. G. Scattering-type scanning near-field optical microscopy with low-repetition-rate pulsed light source through phase-domain sampling. Nature Communications. 7 (1), 13212 (2016).
- Dazzi, A., Prater, C. B. AFM-IR: Technology and applications in nanoscale infrared spectroscopy and chemical imaging. Chemical Reviews. 117 (7), 5146-5173 (2017).
- Mathurin, J., et al. Photothermal AFM-IR spectroscopy and imaging: Status, challenges, and trends. Journal of Applied Physics. 131 (1), 010901 (2022).
- Miller, A., et al. Enhanced surface nanoanalytics of transient biomolecular processes. Science Advances. 9 (2), 3151 (2023).
- Emin, D., et al. Small soluble α-synuclein aggregates are the toxic species in Parkinson's disease. Nature Communications. 13 (1), 5512 (2022).
- Jardine, K., Dove, A., Tetard, L. AFM force measurements to explore grain contacts with relevance for planetary materials. The Planetary Science Journal. 3 (12), 273 (2022).
- Sader, J. E., Chon, J. W. M., Mulvaney, P. Calibration of rectangular atomic force microscope cantilevers. Review of Scientific Instruments. 70 (10), 3967-3969 (1999).
- Higgins, M. J., et al. Noninvasive determination of optical lever sensitivity in atomic force microscopy. Review of Scientific Instruments. 77 (1), 013701 (2006).
- Smith, B. The infrared spectra of polymers III: hydrocarbon polymers. Spectroscopy. 36 (11), 22-25 (2021).
- Korbag, I., Mohamed Saleh, S. Studies on the formation of intermolecular interactions and structural characterization of polyvinyl alcohol/lignin film. International Journal of Environmental Studies. 73 (2), 226-235 (2016).
- Tetard, L., Passian, A., Farahi, R. H., Thundat, T., Davison, B. H. Opto-nanomechanical spectroscopic material characterization. Nature Nanotechnology. 10 (10), 870-877 (2015).
- Bai, Y., Yin, J., Cheng, J. -. X. Bond-selective imaging by optically sensing the mid-infrared photothermal effect. Science Advances. 7 (20), (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved