Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Avances en espectroscopía infrarroja a nanoescala para explorar sistemas poliméricos multifásicos
En este artículo
Resumen
Este protocolo describe la aplicación de la microscopía de fuerza atómica y la espectroscopia infrarroja a nanoescala para evaluar el rendimiento de la espectroscopia infrarroja fototérmica a nanoescala en la caracterización de muestras multipoliméricas tridimensionales.
Resumen
Los sistemas poliméricos multifásicos abarcan dominios locales con dimensiones que pueden variar desde unas pocas decenas de nanómetros hasta varios micrómetros. Su composición se evalúa comúnmente mediante espectroscopía infrarroja, que proporciona una huella dactilar promedio de los diversos materiales contenidos en el volumen sondeado. Sin embargo, este enfoque no ofrece ningún detalle sobre la disposición de las fases en el material. Las regiones interfaciales entre dos fases poliméricas, a menudo en el rango de nanoescala, también son difíciles de acceder. La espectroscopia infrarroja fototérmica a nanoescala monitorea la respuesta local de los materiales excitados por la luz infrarroja con la sonda sensible de un microscopio de fuerza atómica (AFM). Si bien la técnica es adecuada para interrogar características pequeñas, como proteínas individuales en superficies de oro prístinas, la caracterización de materiales multicomponentes tridimensionales es más difícil de alcanzar. Esto se debe a un volumen relativamente grande de material que experimenta expansión fototérmica, definido por la focalización láser en la muestra y por las propiedades térmicas de los constituyentes poliméricos, en comparación con la región a nanoescala sondeada por la punta AFM. Utilizando una perla de poliestireno (PS) y una película de alcohol polivinílico (PVA), evaluamos la huella espacial de la espectroscopia infrarroja fototérmica a nanoescala para el análisis de superficies en función de la posición de PS en la película de PVA. Se investiga el efecto de la posición de la característica en las imágenes infrarrojas a nanoescala y se adquieren espectros. Se ofrecen algunas perspectivas sobre los futuros avances en el campo de la espectroscopia infrarroja fototérmica a nanoescala, considerando la caracterización de sistemas complejos con estructuras poliméricas embebidas.
Introducción
La microscopía de fuerza atómica (AFM) se ha vuelto esencial para obtener imágenes y caracterizar la morfología de una amplia variedad de muestras con resolución a nanoescala 1,2,3. Al medir la deflexión de un voladizo AFM resultante de la interacción de la punta afilada con la superficie de la muestra, se han desarrollado protocolos de imágenes funcionales a nanoescala para mediciones locales de rigidez y adhesión punta-muestra 4,5. Para el análisis de materia condensada blanda y polímeros, las mediciones de AFM que exploran las propiedades nanomecánicas y nanoquímicas de los dominios locales son muy buscadas 6,7,8. Antes de la aparición de la espectroscopia infrarroja a nanoescala (nanoIR), las puntas de AFM se modificaron químicamente para evaluar la presencia de diferentes dominios de la curva de fuerza de AFM y deducir la naturaleza de la interacción punta-muestra. Por ejemplo, este enfoque se utilizó para revelar la transformación de microdominios de acrilato de poli(terc-butilo) en la superficie de películas delgadas de copolímero de poliestireno-bloque-poli(acrilato de terc-butilo) tratadas con ciclohexano en el nivel9 de sub 50 nm.
La combinación de luz infrarroja (IR) con AFM ha tenido un impacto significativo en el campo de la ciencia de los polímeros6. La espectroscopia IR convencional es una técnica ampliamente utilizada para estudiar la estructura química de materiales poliméricos 10,11, pero no proporciona información sobre las fases individuales y el comportamiento de las interfases, ya que las regiones son demasiado pequeñas en comparación con el tamaño del haz IR utilizado para sondear la muestra. El problema se mantiene con la microespectroscopía IR, ya que está restringida por el límite de difracción óptica6. Tales mediciones promedian las contribuciones de toda la región excitada por la luz infrarroja; Las señales resultantes de la presencia de fases a nanoescala dentro de la región sondeada exhiben huellas dactilares complejas que deben ser deconvolutadas durante el posprocesamiento o se pierden debido a un nivel de señal por debajo del nivel detectable. Por lo tanto, es esencial desarrollar herramientas capaces de una resolución espacial a nanoescala y una alta sensibilidad IR para explorar las características químicas a nanoescala en medios complejos.
Se han desarrollado esquemas para lograr espectroscopía nanoIR, primero utilizando una punta metálica de AFM como nanoantena 12,13 y, más recientemente, explotando la capacidad del voladizo AFM para monitorear los cambios en la expansión fototérmica incurridos durante la iluminación IR de la muestra 12,14,15. Este último utiliza una fuente de luz infrarroja pulsada y sintonizable sintonizada con una banda de absorción del material sondeado, lo que hace que la muestra absorba la radiación y sufra una expansión fototérmica. Este enfoque es muy adecuado para materiales orgánicos y poliméricos. La excitación pulsada hace que el efecto sea detectable por el voladizo AFM en contacto con la superficie de la muestra en forma de oscilación. A continuación, se monitoriza la amplitud de una de las resonancias de contacto del sistema observadas en el espectro de frecuencias en función de la longitud de onda de iluminación, que constituye el espectro de absorción nanoIR del material situado debajo de la punta AFM15. La resolución espacial de las imágenes y espectroscopía nanoIR está limitada por varios efectos de la expansión fototérmica del material. Se ha evaluado que la espectroscopia fototérmica nanoIR utilizando AFM en modo de contacto puede adquirir las propiedades de los espectros de absorción vibracional de materiales con una resolución espacial a escala inferior a 50 nm14, con trabajos recientes que demuestran la detección de monómeros y dímeros de α-sinucleína 16,17. Sin embargo, los estudios cuantitativos del rendimiento de las mediciones de nanoIR en materiales poliméricos heterogéneos ensamblados en diversas configuraciones, como el caso de los absorbentes de dimensiones finitas incrustados en el volumen de varias películas poliméricas, siguen siendo limitados.
Este artículo tiene como objetivo crear un ensamblaje polimérico con una característica incrustada de una dimensión conocida para evaluar la sensibilidad de la expansión fototérmica y la resolución espacial de nanoIR durante el análisis de superficies. El protocolo cubre la preparación de una película delgada de polímero de alcohol polivinílico (PVA) sobre un sustrato de silicio y la colocación de una perla tridimensional de poliestireno (PS) sobre o incrustada en la película de PVA, que constituye la formación del sistema modelo. Las mediciones de imágenes y espectroscopía de nanoinfrarrojos se describen en el contexto de la evaluación de las señales generadas por la misma perla de PS colocada sobre o debajo de la película de PVA. Se evalúa la influencia de la posición de la perla en las señales nanoIR. Se discuten los métodos para evaluar la huella espacial de la cuenta en el mapa nanoIR y se consideran los efectos de varios parámetros.
Protocolo
1. Fabricación de una solución de alcohol polivinílico (PVA)
- Mida el agua y los gránulos de polímero PVA (consulte la Tabla de materiales) para crear una solución de 10 ml con una proporción de PVA a agua del 20 % en peso.
- Calentar el agua de la cristalería sobre una placa calefactora a 100 °C.
- Coloque los gránulos de polímero PVA en el agua caliente. Inserte una barra agitadora magnética.
- Reduzca el fuego a 80 °C y revuelva hasta que el PVA se disuelva por completo.
- Cubra la parte superior de la cristalería para evitar la contaminación.
- Una vez que esté completamente disuelta, coloque la solución de PVA al 20% en un recipiente de almacenamiento adecuado para almacenarla a temperatura ambiente.
2. Preparación de obleas de silicio (Si) recubiertas de PVA
- Corta una oblea de silicio (Si) (ver Tabla de Materiales) en ~10 x 10 mm2 cuadrados.
- Limpie el sustrato de Si con alcohol isopropílico y déjelo secar.
- Coloque la oblea de Si limpia en el mandril de la máquina de recubrimiento giratorio (consulte la Tabla de materiales).
- Coloque aproximadamente 10 μL de solución de PVA en el centro del sustrato de Si. Trate de evitar la formación de burbujas.
- Cubra el sustrato de Si con una película uniforme de PVA mediante recubrimiento giratorio durante 30 s a 1.500 rotaciones por minuto (rpm).
NOTA: El volumen especificado de líquido y los parámetros de recubrimiento por centrifugación crean una capa uniforme de PVA a través de la superficie del sustrato con un espesor suficiente para evitar un secado rápido entre el recubrimiento por centrifugación y la colocación de las perlas de PS sobre la superficie de PVA en el siguiente paso.
- Retire la muestra de la máquina de recubrimiento por centrifugación y colóquela en un recipiente de muestra limpio para evitar la contaminación antes de transferir las perlas de PS.
3. Colocación de las perlas de PS en la superficie recubierta de PVA
- Limpie un sustrato de Si con alcohol isopropílico y déjelo secar.
- Con una pipeta, coloque 1 μL de perlas de PS suspendidas en agua en el centro del sustrato.
- Deje que el agua se evapore colocando la muestra en un compartimento de almacenamiento que contenga desecante de arcilla bentonita.
NOTA: Este paso preserva la muestra al reducir la exposición a la humedad. - Coloque el sustrato recubierto de PVA (paso 2.4) y el sustrato con las perlas de PS secas (paso 3.3) bajo un microscopio óptico. Dependiendo de su tamaño, una sola cuenta será visible con binoculares simples o requerirá un mayor aumento óptico.
- Afloje suavemente las cuentas con unas pinzas ultrafinas (consulte la tabla de materiales). Use un pincel de pelo fino para recoger algunas cuentas sueltas y golpee ligeramente los pelos del pincel sobre la oblea recién recubierta de PVA. Los barridos múltiples deben permitir que las cuentas se acumulen dentro de los pelos del cepillo. Golpee la parte superior de los pelos del pincel para alterar el polvo de perlas de PS para liberar perlas sobre la superficie pegajosa de PVA.
NOTA: Es importante que el pincel sea de alta calidad y esté limpio para evitar la liberación de fibras y contaminantes en la superficie de la película de PVA. Moverse rápidamente durante este paso es esencial para que el PVA no se seque por completo. - Repita este paso hasta que se confirme mediante inspección por microscopía óptica que las perlas individuales de PS se adhieren a la superficie de PVA.
- Guarde la muestra en un recipiente limpio. Deje que la muestra se seque por completo.
NOTA: Se debe dejar que la muestra se enfríe y se seque por completo antes de realizar más intentos de análisis. Las mediciones de altura de AFM o las mediciones de perfilador de superficies pueden evaluar el espesor de películas sucesivas de PVA.
4. Carga de la muestra para la caracterización de AFM
NOTA: El protocolo descrito se basa en los procedimientos operativos estándar de una plataforma nanoIR2 (ver Tabla de Materiales), pero debe adaptarse de acuerdo con el modelo AFM utilizado para la medición.
- Monte la muestra de perlas de PVA y PS en la platina AFM utilizando un disco metálico AFM y lengüetas adhesivas, de modo que la muestra quede firmemente unida al portamuestras.
- Monte una sonda nanoIR (por ejemplo, FORTGG) en el soporte de la sonda AFM.
NOTA: El voladizo AFM mide 225 μm de largo, 27 μm de ancho y 2,7 μm de grosor, con un radio de punta de menos de 10 nm. El voladizo está recubierto con una película de oro de 45 nm de espesor en ambos lados para limitar su respuesta a la iluminación IR de la parte superior de la muestra (consulte la Tabla de materiales). Para las mediciones de espectroscopía nanoIR, utilice preferiblemente un voladizo que se haya almacenado en un entorno libre de polidimetilsiloxano antes de su uso. - Alinee el láser de lectura en el extremo libre del haz en voladizo girando las perillas de alineación del láser (ajustes x e y de la posición del láser y ajuste vertical de la posición del detector).
- Maximice la señal SUM del detector.
- Ajuste la posición del detector girando la perilla de deflexión de modo que el láser esté alineado con el centro del detector sensible a la posición del sistema de lectura AFM, correspondiente a una señal de deflexión vertical de ~0 V.
- Haga clic en el icono Cargar en el panel de control "Sonda" de AFM.
- Siga las indicaciones de la pantalla del asistente. Utilice las flechas de enfoque para determinar el plano focal del voladizo nanoIR. Utilice los controles de desplazamiento XY para colocar el voladizo en el centro de la pantalla (alineado con la cruz blanca).
- A continuación, haga clic en las flechas de enfoque para encontrar el plano focal de la superficie de la muestra.
- Utilice la vista óptica del sistema y los controles de desplazamiento XY para colocar la punta en voladizo sobre el cordón de interés y haga clic en Siguiente.
- En la pantalla de activación, establezca el "distanciamiento" en 50 μm y haga clic en Solo aproximación.
- Inicie el procedimiento Engage para acercarse a la punta para obtener imágenes.
5. Creación de imágenes topográficas y nanoIR de la muestra multipolímero
- Adquiera imágenes topográficas en el "Modo de contacto" estándar. Una vez ajustada la posición del voladizo con respecto al cordón PS, inicie la aproximación haciendo clic en el icono de enganche en el panel de control "Sonda" de AFM. Para todo el estudio se utiliza un punto de ajuste de acoplamiento de un diferencial de deflexión de 0,2 V, correspondiente a una fuerza de ~100 nN.
En el panel de control "Escanear" de AFM, establezca la velocidad de escaneo en 0,8 Hz, el tamaño de escaneo (alto y ancho) y el número de puntos por línea y el número de líneas por imagen que se utilizarán para la obtención de imágenes (aquí se utilizó 512 x 512). Haga clic en Escanear para adquirir la imagen de topografía.
NOTA: La calibración del voladizo18 se realiza determinando la sensibilidad a la deflexión (en nm/V) a partir de la pendiente de la curva de distancia-deflexión obtenida con el voladizo interactuando con un sustrato de zafiro (Figura suplementaria 1A). La rigidez en voladizo se determina a partir del ajuste térmico19 (Figura suplementaria 1B). La resonancia del voladizo se ajusta mediante una función lorentziana. La rigidez del voladizo (en N/m) se determina mediante el teorema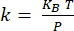 de equipartición , donde KBes la constante de Boltzmann, T es la temperatura (T = 295K) y P es el área del espectro de potencia de las fluctuaciones térmicas del voladizo determinada integrando el ajuste lorentziano de los datos de ajuste térmico20.
de equipartición , donde KBes la constante de Boltzmann, T es la temperatura (T = 295K) y P es el área del espectro de potencia de las fluctuaciones térmicas del voladizo determinada integrando el ajuste lorentziano de los datos de ajuste térmico20. - Para las mediciones de nanoinfrarrojos, coloque la punta AFM en la entidad de interés identificada a partir de la imagen topográfica.
- Seleccione el icono del diapasón en el panel de control nanoIR para determinar las frecuencias de resonancia de contacto del voladizo. Establezca un número de onda de iluminación que excite la expansión fototérmica en el material. Establezca un rango de frecuencia de pulso láser para barrer y configure el ciclo de trabajo del láser nanoIR. Seleccione Adquirir dentro de la "Ventana de sintonización de pulso láser".
- Seleccione la segunda resonancia de contacto del sistema de punta-muestra para las mediciones de nanoIR colocando la barra de marcador (línea vertical verde) en el pico de la segunda resonancia de contacto.
NOTA: La selección del modo de resonancia de contacto puede variar según el tipo de voladizo y la muestra. - Haga clic en Optimizar para alinear el centro de la región focal del láser IR con la posición de la punta en voladizo. La alineación se realiza en un número de onda de iluminación IR seleccionado, correspondiente a una banda de absorción del material sondeado. El voladizo se coloca en el centro de la huella láser (Figura complementaria 2).
NOTA: La alineación puede variar para diferentes números de onda según el modelo de láser. - Adquiera un fondo de la iluminación láser IR. Consiste en medir la salida del láser de cascada cuántica IR (QCL) en el rango de longitud de onda de emisión a la frecuencia de pulso seleccionada (Figura suplementaria 3). Esto es importante para la corrección de fondo de los espectros nanoIR.
- Adquiera el espectro nanoIR seleccionando el rango de números de onda (aquí, Start y Stop se establecen en 1.530 cm-1 y 1.800 cm-1, respectivamente), el tamaño del paso (2 cm-1) y el número de promedios utilizados para la medición. Realice la corrección de fondo de los espectros mostrados dividiendo la amplitud fototérmica medida por el fondo atenuado, que consiste en multiplicar el fondo recogido en el paso 5.2.4 por el porcentaje de potencia seleccionado para la medición.
- Para la obtención de imágenes nanoIR, seleccione la región de interés para la obtención de imágenes.
- Habilite el ajuste automático de bucle de bloqueo de fase (PLL) en la "Ventana de ajuste de pulso láser" (a la que se accede mediante el icono del diapasón ).
- Ajuste la frecuencia mínima y máxima para crear un rango de barrido centrado en el segundo modo de resonancia en el panel de control general.
- Ponga a cero la fase haciendo clic en cero en el panel de control PLL y luego haga clic en OK en la "ventana Laser Pulse Tun".
- Seleccione Imágenes IR habilitadas colocando una marca de verificación en la casilla dentro del panel de control nanoIR.
- En el panel de control "Vista de imágenes", elija Altura (Vista de imágenes 1), Amplitud 2 (Vista de imágenes 2) y Fase 2 (Vista de imágenes 3) para adquirir las imágenes topográficas y químicas de la muestra. Establezca la dirección de adquisición en Trazar (o Volver a trazar). A menudo se requiere una línea de ajuste de línea para observar la imagen topográfica de la muestra que se está adquiriendo. El ajuste de captura debe establecerse en Ninguno.
NOTA: Las preferencias de escaneo, como la dirección de escaneo capturada o la paleta de colores utilizada, se pueden ajustar según sea necesario. - En el panel de control "Escanear" de AFM, seleccione el icono Escanear .
- Para guardar la imagen, seleccione el icono Ahora o Fin del fotograma en el panel de control "Capturar".
- Para exportar los datos, haga clic con el botón derecho en los nombres de los archivos de imagen o espectro dentro de las listas de datos. Seleccione Exportar y elija el formato del archivo que desea exportar. Guarde el archivo en la ubicación de la carpeta de la computadora deseada.
Resultados
Las perlas de PS ((C8H8)n) se depositaron sobre un sustrato limpio de Si (Figura 1A) y sobre PVA ((CH2CHOH)n) (Figura 1B, C). Debido a la mala adherencia de la perla en el Si, no se pudieron adquirir imágenes nanoIR en modo de contacto para esta muestra. En su lugar, utilizando la vista óptica de la muestra en nanoIR, la sonda AFM recubierta de oro se acopló en la parte superior de la per...
Discusión
El AFM combinado con la espectroscopia nanoIR puede proporcionar información química a nanoescala utilizando un voladizo en modo de contacto y una fuente de luz IR sintonizable pulsada. Los sistemas de modelos, como la incrustación de un absorbedor con dimensiones finitas en el volumen de un material polimérico, son importantes para mejorar la comprensión de los mecanismos de formación de imágenes y determinar el rendimiento de la herramienta. En el caso de la configuración PS/PVA que aquí se presenta, se llevó...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Fundación Nacional de Ciencias (NSF CHE-1847830).
Materiales
| Name | Company | Catalog Number | Comments |
| 10|0 2200 Golden Taklon Round | Zem | ||
| 5357-8NM Tweezers | Pelco | ||
| Adhesive Tabs | Ted Pella | 16079 | |
| AFM metal specimen disks | Ted Pella | 16208 | |
| Binocular | AmScope | ||
| Cantilever for nanoIR measurements | AppNano | FORTGG | |
| Cell culture dishes | Greiner bio-one GmbH | ||
| Desiccator | |||
| Floating optical table | Newport | RS 4000 | |
| Hotplate | VWR | ||
| Isopropanol | |||
| Kimwipes | KIMTECH | ||
| Magnetic stir bar | |||
| Microparticles based on polystyrene size: 5 µm | SIGMA-ALDRICH | 79633 | |
| nanoIR2 microscope | Bruker | Contact mode NanoIR2 | |
| Nitrogen Tank | Airgas | ||
| Petri dishes | Greiner bio-one GmbH | ||
| Polyvinyl Alcohol | SIGMA-ALDRICH | 363170 | this polymer was only 87%-89% hydrolyzed, which explains the presence of residual C=O at 1730 cm-1 |
| Quantum Cascade Laser | Daylight Solutions | 1550-1800 cm-1 range | |
| Silicon wafer | MEMC St. Peters | #901319343000 | |
| Spin coater | Oscilla |
Referencias
- Dufrêne, Y. F., Viljoen, A., Mignolet, J., Mathelié-Guinlet, M. AFM in cellular and molecular microbiology. Cellular Microbiology. 23 (7), e13324 (2021).
- Sharma, A., Rout, C. S. Probe-based techniques for 2D layered materials. Advanced Analytical Techniques for Characterization of 2D Materials. , 1-14 (2022).
- Zhong, J., Yan, J. Seeing is believing: atomic force microscopy imaging for nanomaterial research. RSC Advances. 6 (2), 1103-1121 (2016).
- Olubowale, O. H., et al. 34;May the force be with you!" Force-volume mapping with atomic force microscopy. ACS Omega. 6 (40), 25860-25875 (2021).
- Dokukin, M. E., Sokolov, I. Quantitative mapping of the elastic modulus of soft materials with HarmoniX and PeakForce QNM AFM modes. Langmuir. 28 (46), 16060-16071 (2012).
- Nguyen-Tri, P., et al. Recent applications of advanced atomic force microscopy in polymer science: a review. Polymers. 12 (5), 1142 (2020).
- Vitry, P., et al. Mode-synthesizing atomic force microscopy for 3D reconstruction of embedded low-density dielectric nanostructures. Nano Research. 8 (7), 2199-2205 (2015).
- Coste, R., Pernes, M., Tetard, L., Molinari, M., Chabbert, B. Effect of the interplay of composition and environmental humidity on the nanomechanical properties of hemp fibers. ACS Sustainable Chemistry & Engineering. 8 (16), 6381-6390 (2020).
- Schönherr, H., Feng, C. L., Tomczak, N., Vancso, G. J. Compositional mapping of polymer surfaces by chemical force microscopy down to the nanometer scale: reactions in block copolymer microdomains. Macromolecular Symposia. 230 (1), 149-157 (2005).
- Holland-Moritz, K., Siesler, H. W. Infrared spectroscopy of polymers. Applied Spectroscopy Reviews. 11 (1), 1-55 (1976).
- Bhargava, R., Wang, S. Q., Koenig, J. L. FTIR microscpectrscopy of polymeric systems. Liquid Chromatography/FTIR Microspectroscopy/Microwave Assisted Synthesis. , 137-191 (2003).
- Rao, V. J., et al. AFM-IR and IR-SNOM for the characterization of small molecule organic semiconductors. The Journal of Physical Chemistry C. 124 (9), 5331-5344 (2020).
- Wang, H., Wang, L., Xu, X. G. Scattering-type scanning near-field optical microscopy with low-repetition-rate pulsed light source through phase-domain sampling. Nature Communications. 7 (1), 13212 (2016).
- Dazzi, A., Prater, C. B. AFM-IR: Technology and applications in nanoscale infrared spectroscopy and chemical imaging. Chemical Reviews. 117 (7), 5146-5173 (2017).
- Mathurin, J., et al. Photothermal AFM-IR spectroscopy and imaging: Status, challenges, and trends. Journal of Applied Physics. 131 (1), 010901 (2022).
- Miller, A., et al. Enhanced surface nanoanalytics of transient biomolecular processes. Science Advances. 9 (2), 3151 (2023).
- Emin, D., et al. Small soluble α-synuclein aggregates are the toxic species in Parkinson's disease. Nature Communications. 13 (1), 5512 (2022).
- Jardine, K., Dove, A., Tetard, L. AFM force measurements to explore grain contacts with relevance for planetary materials. The Planetary Science Journal. 3 (12), 273 (2022).
- Sader, J. E., Chon, J. W. M., Mulvaney, P. Calibration of rectangular atomic force microscope cantilevers. Review of Scientific Instruments. 70 (10), 3967-3969 (1999).
- Higgins, M. J., et al. Noninvasive determination of optical lever sensitivity in atomic force microscopy. Review of Scientific Instruments. 77 (1), 013701 (2006).
- Smith, B. The infrared spectra of polymers III: hydrocarbon polymers. Spectroscopy. 36 (11), 22-25 (2021).
- Korbag, I., Mohamed Saleh, S. Studies on the formation of intermolecular interactions and structural characterization of polyvinyl alcohol/lignin film. International Journal of Environmental Studies. 73 (2), 226-235 (2016).
- Tetard, L., Passian, A., Farahi, R. H., Thundat, T., Davison, B. H. Opto-nanomechanical spectroscopic material characterization. Nature Nanotechnology. 10 (10), 870-877 (2015).
- Bai, Y., Yin, J., Cheng, J. -. X. Bond-selective imaging by optically sensing the mid-infrared photothermal effect. Science Advances. 7 (20), (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados