Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Fortschritte in der nanoskaligen Infrarotspektroskopie zur Erforschung mehrphasiger Polymersysteme
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Anwendung der Rasterkraftmikroskopie und der nanoskaligen Infrarotspektroskopie zur Bewertung der Leistungsfähigkeit der photothermischen nanoskaligen Infrarotspektroskopie bei der Charakterisierung dreidimensionaler multipolymerer Proben.
Zusammenfassung
Mehrphasige polymere Systeme umfassen lokale Domänen mit Abmessungen, die von einigen zehn Nanometern bis zu mehreren Mikrometern variieren können. Ihre Zusammensetzung wird üblicherweise mit Hilfe der Infrarotspektroskopie beurteilt, die einen durchschnittlichen Fingerabdruck der verschiedenen Materialien liefert, die in dem untersuchten Volumen enthalten sind. Dieser Ansatz bietet jedoch keine Details über die Anordnung der Phasen im Material. Grenzflächenbereiche zwischen zwei polymeren Phasen, oft im Nanobereich, sind ebenfalls schwer zugänglich. Die photothermische nanoskalige Infrarotspektroskopie überwacht die lokale Reaktion von Materialien, die durch Infrarotlicht angeregt werden, mit der empfindlichen Sonde eines Rasterkraftmikroskops (AFM). Während sich die Technik für die Untersuchung kleiner Merkmale, wie z. B. einzelner Proteine auf makellosen Goldoberflächen, eignet, ist die Charakterisierung von dreidimensionalen Mehrkomponentenmaterialien schwieriger zu fassen. Dies ist auf ein relativ großes Materialvolumen zurückzuführen, das einer photothermischen Ausdehnung unterliegt, die durch die Laserfokussierung auf die Probe und durch die thermischen Eigenschaften der polymeren Bestandteile definiert wird, verglichen mit dem nanoskaligen Bereich, der von der AFM-Spitze untersucht wird. Unter Verwendung eines Polystyrol (PS)-Kügelchens und eines Polyvinylalkohol (PVA)-Films bewerten wir den räumlichen Fußabdruck der photothermischen nanoskaligen Infrarotspektroskopie für die Oberflächenanalyse in Abhängigkeit von der Position von PS in der PVA-Schicht. Der Einfluss der Merkmalsposition auf die nanoskaligen Infrarotbilder wird untersucht und Spektren aufgenommen. Es werden einige Perspektiven auf die zukünftigen Fortschritte auf dem Gebiet der photothermischen nanoskaligen Infrarotspektroskopie unter Berücksichtigung der Charakterisierung komplexer Systeme mit eingebetteten Polymerstrukturen aufgezeigt.
Einleitung
Die Rasterkraftmikroskopie (AFM) ist unerlässlich geworden, um die Morphologie einer Vielzahl von Proben mit einer Auflösung im Nanobereichabzubilden und zu charakterisieren 1,2,3. Durch die Messung der Durchbiegung eines AFM-Cantilevers, die sich aus der Wechselwirkung der scharfen Spitze mit der Probenoberfläche ergibt, wurden nanoskalige funktionelle Bildgebungsprotokolle für lokale Steifigkeitsmessungen und Spitzen-Proben-Adhäsion entwickelt 4,5. Für die Analyse weicher kondensierter Materie und Polymere sind AFM-Messungen zur Erforschung der nanomechanischen und nanochemischen Eigenschaften lokaler Domänen sehr gefragt 6,7,8. Vor dem Aufkommen der nanoskaligen Infrarotspektroskopie (nanoIR) wurden AFM-Spitzen chemisch modifiziert, um das Vorhandensein verschiedener Domänen aus der AFM-Kraftkurve zu beurteilen und die Art der Wechselwirkung zwischen Spitze und Probe abzuleiten. Zum Beispiel wurde dieser Ansatz verwendet, um die Transformation von Mikrodomänen von Poly(tert-butylacrylat) an der Oberfläche von mit Cyclohexan behandelten Polystyrol-Block-Poly(tert-butylacrylat)blockcopolymer-Dünnschichten auf der Ebene unter 50 nm 9 zuenthüllen.
Die Kombination von Infrarotlicht (IR) mit AFM hat einen erheblichen Einfluss auf das Gebiet der Polymerwissenschaft6. Die konventionelle IR-Spektroskopie ist eine weit verbreitete Technik zur Untersuchung der chemischen Struktur von Polymermaterialien10,11, liefert jedoch keine Informationen über einzelne Phasen und das Verhalten zwischen den Phasen, da die Bereiche im Vergleich zur Größe des IR-Strahls, der zur Untersuchung der Probe verwendet wird, zu klein sind. Das Problem besteht bei der IR-Mikrospektroskopie, da sie durch die optische Beugungsgrenze6 begrenzt ist. Solche Messungen mitteln die Beiträge der gesamten Region, die durch das IR-Licht angeregt wird; Die Signale, die aus dem Vorhandensein von nanoskaligen Phasen innerhalb des untersuchten Bereichs resultieren, weisen entweder komplexe Fingerabdrücke auf, die während der Nachbearbeitung entfaltet werden sollten, oder gehen aufgrund eines Signalpegels unterhalb des detektierbaren Niveaus verloren. Daher ist es wichtig, Werkzeuge zu entwickeln, die in der Lage sind, nanoskalige räumliche Auflösung und hohe IR-Empfindlichkeit zu erreichen, um nanoskalige chemische Eigenschaften in komplexen Medien zu untersuchen.
Es wurden Schemata entwickelt, um NanoIR-Spektroskopie zu erreichen, wobei zunächst eine metallische AFM-Spitze als Nanoantenne12,13 verwendet wurde und in jüngerer Zeit die Fähigkeit des AFM-Cantilevers ausgenutzt wurde, Änderungen der photothermischen Ausdehnung zu überwachen, die während der IR-Beleuchtung der Probe12, 14, 15 auftreten. Letzteres verwendet eine gepulste, abstimmbare IR-Lichtquelle, die auf eine Absorptionsbande des untersuchten Materials abgestimmt ist, wodurch die Probe Strahlung absorbiert und eine photothermische Ausdehnung erfährt. Dieser Ansatz eignet sich gut für organische und polymere Materialien. Durch die gepulste Anregung wird der Effekt durch den AFM-Cantilever in Kontakt mit der Probenoberfläche in Form einer Schwingung detektierbar. Die Amplitude einer der Kontaktresonanzen des Systems, die im Frequenzspektrum beobachtet wird, wird dann als Funktion der Beleuchtungswellenlänge überwacht, die das NanoIR-Absorptionsspektrum des Materials unter der AFM-Spitze15 bildet. Die räumliche Auflösung der NanoIR-Bildgebung und -Spektroskopie wird durch verschiedene Effekte der photothermischen Ausdehnung des Materials begrenzt. Es wurde evaluiert, dass die photothermische NanoIR-Spektroskopie unter Verwendung von Kontaktmodus-AFM die Eigenschaften von Schwingungsabsorptionsspektren von Materialien mit einer räumlichen Auflösung von unter 50 nmerfassen kann 14, wobei jüngste Arbeiten die Detektion von Monomeren und Dimeren von α-Synuclein16,17 demonstrieren. Quantitative Studien zur Leistung von NanoIR-Messungen an heterogenen polymeren Materialien, die in verschiedenen Konfigurationen zusammengesetzt sind, wie z. B. im Fall von Absorbern endlicher Abmessungen, die in das Volumen verschiedener Polymerfilme eingebettet sind, sind jedoch nach wie vor begrenzt.
Dieser Artikel zielt darauf ab, eine polymere Baugruppe mit einem eingebetteten Merkmal einer bekannten Dimension zu erstellen, um die Empfindlichkeit der photothermischen Ausdehnung und der räumlichen Auflösung von nanoIR während der Oberflächenanalyse zu bewerten. Das Protokoll umfasst die Herstellung eines dünnen Films aus Polyvinylalkohol (PVA)-Polymer auf einem Siliziumsubstrat und das Aufbringen einer dreidimensionalen Polystyrolperle (PS) auf oder eingebettet in die PVA-Folie, die die Bildung des Modellsystems darstellt. NanoIR-Bildgebungs- und Spektroskopiemessungen werden im Zusammenhang mit der Auswertung der Signale beschrieben, die von derselben PS-Perle erzeugt werden, die auf oder unter der PVA-Folie positioniert ist. Der Einfluss der Raupenposition auf die nanoIR-Signale wird evaluiert. Methoden zur Bewertung des räumlichen Fußabdrucks des Kügelchens in der nanoIR-Karte werden diskutiert und die Auswirkungen verschiedener Parameter betrachtet.
Protokoll
1. Herstellung von Polyvinylalkohol (PVA)-Lösung
- Messen Sie Wasser und PVA-Polymer-Pellets (siehe Materialtabelle), um eine 10-ml-Lösung mit einem PVA-Wasser-Verhältnis von 20 Gew.-% herzustellen.
- Erhitzen Sie das Wasser in den Gläsern auf einer auf 100 °C eingestellten Kochplatte.
- Geben Sie die PVA-Polymer-Pellets in das erhitzte Wasser. Setzen Sie einen magnetischen Rührstab ein.
- Die Hitze auf 80 °C reduzieren und rühren, bis sich das PVA vollständig aufgelöst hat.
- Decken Sie die Oberseite der Gläser ab, um eine Kontamination zu vermeiden.
- Sobald sie sich vollständig aufgelöst hat, geben Sie die 20%ige PVA-Lösung in einen geeigneten Aufbewahrungsbehälter und lagern Sie sie bei Raumtemperatur.
2. Herstellung von PVA-beschichteten Silizium (Si)-Wafern
- Schneiden Sie einen Silizium (Si)-Wafer (siehe Materialtabelle) in ~10 x 10 mm2 Quadrate.
- Reinigen Sie das Si-Substrat mit Isopropylalkohol und lassen Sie es trocknen.
- Legen Sie den sauberen Si-Wafer auf das Futter des Spin Coaters (siehe Materialtabelle).
- Etwa 10 μl PVA-Lösung werden in die Mitte des Si-Substrats gegossen. Versuchen Sie, Blasenbildung zu vermeiden.
- Beschichten Sie das Si-Substrat mit einer gleichmäßigen PVA-Folie durch Schleuderbeschichtung für 30 s bei 1.500 Umdrehungen pro Minute (U/min).
HINWEIS: Das angegebene Flüssigkeitsvolumen und die Spin-Coating-Parameter erzeugen eine gleichmäßige PVA-Schicht auf der Oberfläche des Substrats mit ausreichender Dicke, um ein schnelles Trocknen zwischen der Spin-Beschichtung und dem Aufbringen der PS-Kügelchen auf die PVA-Oberfläche im nächsten Schritt zu verhindern.
- Nehmen Sie die Probe aus dem Spin Coater und geben Sie sie in einen sauberen Probenbehälter, um eine Kontamination zu vermeiden, bevor Sie die PS-Kügelchen umfüllen.
3. Platzieren der PS-Perlen auf der PVA-beschichteten Oberfläche
- Reinigen Sie ein Si-Substrat mit Isopropylalkohol und lassen Sie es trocknen.
- Geben Sie mit einer Pipette 1 μl in Wasser schwebende PS-Kügelchen in die Mitte des Substrats.
- Lassen Sie das Wasser verdampfen, indem Sie die Probe in ein Lagerfach mit Bentonit-Ton-Trockenmittel geben.
HINWEIS: Dieser Schritt konserviert die Probe, indem die Feuchtigkeitsbelastung reduziert wird. - Das PVA-beschichtete Substrat (Schritt 2.4) und das Substrat mit den getrockneten PS-Kügelchen (Schritt 3.3) werden unter ein Lichtmikroskop gelegt. Je nach Größe ist eine einzelne Perle mit einem einfachen Fernglas sichtbar oder erfordert eine höhere optische Vergrößerung.
- Lockern Sie die Perlen vorsichtig mit einer ultrafeinen Pinzette (siehe Materialtabelle). Verwenden Sie einen feinen Haarpinsel, um ein paar lose Perlen zu sammeln, und klopfen Sie die Haare des Pinsels leicht über die frisch PVA-beschichtete Waffel. Mehrere Sweeps sollten es den Perlen ermöglichen, sich in den Haaren des Pinsels anzusammeln. Klopfen Sie auf die Oberseite der Pinselhaare, um das PS-Perlenpulver zu stören und Perlen auf der klebrigen PVA-Oberfläche freizusetzen.
HINWEIS: Es ist wichtig, dass der Pinsel von hoher Qualität und sauber ist, um zu vermeiden, dass Fasern und Verunreinigungen auf die Oberfläche der PVA-Folie gelangen. Bei diesem Schritt ist es wichtig, sich schnell zu bewegen, damit der PVA nicht vollständig austrocknet. - Wiederholen Sie diesen Schritt, bis durch die optische mikroskopische Inspektion bestätigt wird, dass einzelne PS-Kügelchen an der PVA-Oberfläche haften.
- Bewahren Sie die Probe in einem sauberen Behälter auf. Lassen Sie die Probe vollständig trocknen.
HINWEIS: Die Probe sollte vollständig abkühlen und trocknen, bevor weitere Analyseversuche durchgeführt werden. AFM-Höhenmessungen oder Oberflächenprofiler-Messungen können die Dicke aufeinanderfolgender PVA-Schichten beurteilen.
4. Laden der Probe für die AFM-Charakterisierung
HINWEIS: Das beschriebene Protokoll basiert auf den Standardarbeitsanweisungen einer nanoIR2-Plattform (siehe Materialtabelle), sollte jedoch entsprechend dem für die Messung verwendeten AFM-Modell angepasst werden.
- Montieren Sie die PVA- und PS-Bead-Probe mit einer metallischen AFM-Scheibe und Klebelaschen auf dem AFM-Tisch, so dass die Probe fest mit dem Probenhalter verbunden ist.
- Montieren Sie eine nanoIR-Sonde (z. B. FORTGG) auf dem AFM-Sondenhalter.
HINWEIS: Der AFM-Cantilever ist 225 μm lang, 27 μm breit und 2,7 μm dick, mit einem Spitzenradius von weniger als 10 nm. Der Cantilever ist beidseitig mit einer 45 nm dicken Goldschicht beschichtet, um seine Reaktion auf die IR-Beleuchtung der Probe auf der Oberseite zu begrenzen (siehe Materialtabelle). Verwenden Sie für NanoIR-Spektroskopie-Messungen vorzugsweise einen Cantilever, der vor der Verwendung in einer polydimethylsiloxanfreien Umgebung gelagert wurde. - Richten Sie den ausgelesenen Laser am freien Ende des Cantilever-Strahls aus, indem Sie die Laserausrichtungsknöpfe drehen (x- und y-Einstellungen der Laserposition und vertikale Einstellung der Detektorposition).
- Maximieren Sie das SUM-Signal des Detektors.
- Stellen Sie die Position des Detektors durch Drehen des Umlenkknopfes so ein, dass der Laser auf die Mitte des positionsempfindlichen Detektors des AFM-Auslesesystems ausgerichtet ist, was einem vertikalen Ablenkungssignal von ~0 V entspricht.
- Klicken Sie auf das Symbol Laden in der AFM-Systemsteuerung "Sonde".
- Folgen Sie den Anweisungen auf dem Bildschirm des Assistenten. Verwenden Sie die Fokuspfeile , um die Fokusebene des nanoIR-Cantilevers zu bestimmen. Verwenden Sie die Steuerelemente für die XY-Verschiebung, um den Ausleger in der Mitte des Bildschirms zu positionieren (ausgerichtet am weißen Kreuz).
- Klicken Sie anschließend auf die Fokuspfeile , um die Fokusebene der Oberfläche der Probe zu finden.
- Verwenden Sie die optische Ansicht des Systems und die XY-Verschiebungssteuerung, um die Kragarmspitze über der gewünschten Sicke zu positionieren, und klicken Sie auf Weiter.
- Stellen Sie auf dem Engage-Bildschirm den "Standoff" auf 50 μm ein und klicken Sie auf Approach Only.
- Starten Sie den Engage-Vorgang , um sich der Spitze für die Bildgebung zu nähern.
5. Erstellung topographischer und nanoIR-Bilder der Multipolymerprobe
- Erfassen Sie Topographiebilder im Standard-"Kontaktmodus". Sobald die Position des Auslegers in Bezug auf die PS-Wulst festgelegt ist, starten Sie die Annäherung, indem Sie auf das Engage-Symbol im AFM-Bedienfeld "Sonde" klicken. Für die gesamte Studie wird hier ein Eingriffssollwert einer Auslenkungsdifferenz von 0,2 V verwendet, was einer Kraft von ~100 nN entspricht.
Stellen Sie im AFM-Bedienfeld "Scan" die Scanrate auf 0,8 Hz, die Scangröße (Höhe und Breite) sowie die Anzahl der Punkte pro Zeile und die Anzahl der Zeilen pro Bild ein, die für die Bildgebung verwendet werden sollen (hier wurde 512 x 512 verwendet). Klicken Sie auf Scannen, um das Topographiebild aufzunehmen.
ANMERKUNG: Die Kalibrierung des Cantilevers18 erfolgt durch Bestimmen der Durchbiegungsempfindlichkeit (in nm/V) aus der Steigung der Ablenkentfernungskurve, die mit dem Ausleger in Wechselwirkung mit einem Saphirsubstrat erhalten wird (Ergänzende Abbildung 1A). Die Cantilever-Steifigkeit wird aus der thermischen Abstimmung19 bestimmt (ergänzende Abbildung 1B). Die Resonanz des Auslegers wird über eine Lorentz'sche Funktion angepasst. Die Cantilever-Steifigkeit (in N/m) wird mit Hilfe des Äquipartitionssatzes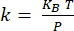 bestimmt, wobei KBdie Boltzmann-Konstante, T die Temperatur (T = 295 K) und P der Bereich des Leistungsspektrums der thermischen Fluktuationen des Cantilevers ist, der durch Integration der Lorentzschen Anpassung der thermischen Abstimmungsdaten20 bestimmt wird.
bestimmt, wobei KBdie Boltzmann-Konstante, T die Temperatur (T = 295 K) und P der Bereich des Leistungsspektrums der thermischen Fluktuationen des Cantilevers ist, der durch Integration der Lorentzschen Anpassung der thermischen Abstimmungsdaten20 bestimmt wird. - Positionieren Sie bei NanoIR-Messungen die AFM-Spitze auf dem interessierenden Merkmal, das aus dem Topographiebild identifiziert wurde.
- Wählen Sie das Stimmgabelsymbol im nanoIR-Bedienfeld, um die Kontaktresonanzfrequenzen des Cantilevers zu bestimmen. Stellen Sie eine Beleuchtungswellenzahl ein, die die photothermische Ausdehnung im Material anregt. Stellen Sie einen Bereich der Laserpulsfrequenz für den Sweep ein und stellen Sie das Tastverhältnis des nanoIR-Lasers ein. Wählen Sie im "Laserpuls-Tune-Fenster" die Option "Erfassen " aus.
- Wählen Sie die zweite Kontaktresonanz des Spitze-Proben-Systems für NanoIR-Messungen aus, indem Sie den Markierungsbalken (grüne vertikale Linie) auf der Spitze der zweiten Kontaktresonanz positionieren.
HINWEIS: Die Auswahl des Kontaktresonanzmodus kann je nach Art des Cantilevers und der Probe variieren. - Klicken Sie auf Optimieren , um die Mitte des IR-Laser-Fokusbereichs an der Position der Cantilever-Spitze auszurichten. Die Ausrichtung erfolgt bei einer ausgewählten IR-Beleuchtungswellenzahl, die einer Absorptionsbande des untersuchten Materials entspricht. Der Ausleger befindet sich in der Mitte des Laser-Footprints (ergänzende Abbildung 2).
HINWEIS: Die Ausrichtung kann je nach Lasermodell für unterschiedliche Wellenzahlen variieren. - Verschaffen Sie sich einen Überblick über den Hintergrund der IR-Laserbeleuchtung. Diese besteht darin, die Leistung des IR-Quantenkaskadenlasers (QCL) im Wellenlängenbereich der Emission bei der gewählten Pulsfrequenz zu messen (ergänzende Abbildung 3). Dies ist wichtig für die Hintergrundkorrektur der nanoIR-Spektren.
- Erfassen Sie das nanoIR-Spektrum, indem Sie den Wellenzahlbereich ( hier werden Start und Stopp auf 1.530 cm-1 bzw. 1.800 cm-1 eingestellt), die Schrittweite (2 cm-1) und die Anzahl der für die Messung verwendeten Mittelwerte auswählen. Die Hintergrundkorrektur der angezeigten Spektren wird durchgeführt, indem die gemessene photothermische Amplitude durch den abgeschwächten Hintergrund dividiert wird, was aus der Multiplikation des in Schritt 5.2.4 erfassten Hintergrunds mit dem für die Messung ausgewählten Prozentsatz der Leistung besteht.
- Wählen Sie für die NanoIR-Bildgebung den Bereich aus, der für die Bildgebung von Interesse ist .
- Aktivieren Sie die automatische Abstimmung des Phasenregelkreises (PLL) im "Laser Pulse Tune Window" (Zugriff über das Stimmgabelsymbol ).
- Passen Sie die minimale und maximale Frequenz an, um einen Sweep-Bereich zu erstellen, der im zweiten Resonanzmodus im allgemeinen Bedienfeld zentriert ist.
- Nullen Sie die Phase, indem Sie im PLL-Bedienfeld auf Null klicken und dann im "Laser Pulse Tune-Fenster" auf OK klicken.
- Wählen Sie IR-Bildgebung aktiviert , indem Sie ein Häkchen in das Kästchen im nanoIR-Bedienfeld setzen.
- Wählen Sie im Bedienfeld "Imaging-Ansicht" die Option "Höhe " ("Imaging-Ansicht 1"), "Amplitude 2 " ("Imaging-Ansicht 2") und "Phase 2 " (Imaging-Ansicht 3), um die topografischen und chemischen Bilder der Probe zu erfassen. Legen Sie die Erfassungsrichtung auf Trace (oder Retrace) fest. Eine Linienanpassungslinie ist häufig erforderlich, um das Topographiebild der zu erfassenden Probe zu beobachten. Die Erfassungsanpassung sollte auf Keine festgelegt werden.
HINWEIS: Scaneinstellungen, wie z. B. die erfasste Scanrichtung oder die verwendete Farbpalette, können nach Bedarf angepasst werden. - Wählen Sie in der AFM-Systemsteuerung "Scannen" das Symbol Scannen aus.
- Um das Bild zu speichern, wählen Sie das Symbol "Jetzt " oder "Ende des Rahmens " in der Systemsteuerung "Aufnehmen".
- Um die Daten zu exportieren, klicken Sie mit der rechten Maustaste auf die Bild- oder Spektrumdateinamen in den Datenlisten. Wählen Sie Exportieren und wählen Sie das Format der zu exportierenden Datei aus. Speichern Sie die Datei im gewünschten Computerordner.
Ergebnisse
PS ((C8H8)n)-Kügelchen wurden auf einem sauberen Si-Substrat (Abbildung 1A) und auf PVA ((CH2CHOH)n) (Abbildung 1B, C) abgeschieden. Aufgrund der schlechten Adhäsion des Kügelchens auf Si konnte für diese Probe keine nanoIR-Bildgebung im Kontaktmodus aufgenommen werden. Stattdessen wurde die goldbeschichtete AFM-Sonde unter Verwendung der optischen Ansicht der Probe auf nanoIR im Kontakt...
Diskussion
AFM in Kombination mit NanoIR-Spektroskopie kann chemische Informationen im Nanobereich liefern, indem ein Cantilever im Kontaktmodus und eine gepulste, abstimmbare IR-Lichtquelle verwendet werden. Modellsysteme, wie z.B. die Einbettung eines Absorbers mit endlichen Abmessungen in das Volumen eines polymeren Materials, sind wichtig, um das Verständnis der Bildentstehungsmechanismen zu verbessern und die Leistungsfähigkeit des Werkzeugs zu bestimmen. Im Fall der hier vorgestellten PS/PVA-Konfiguration wurde eine Optimie...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde von der National Science Foundation unterstützt (NSF CHE-1847830).
Materialien
| Name | Company | Catalog Number | Comments |
| 10|0 2200 Golden Taklon Round | Zem | ||
| 5357-8NM Tweezers | Pelco | ||
| Adhesive Tabs | Ted Pella | 16079 | |
| AFM metal specimen disks | Ted Pella | 16208 | |
| Binocular | AmScope | ||
| Cantilever for nanoIR measurements | AppNano | FORTGG | |
| Cell culture dishes | Greiner bio-one GmbH | ||
| Desiccator | |||
| Floating optical table | Newport | RS 4000 | |
| Hotplate | VWR | ||
| Isopropanol | |||
| Kimwipes | KIMTECH | ||
| Magnetic stir bar | |||
| Microparticles based on polystyrene size: 5 µm | SIGMA-ALDRICH | 79633 | |
| nanoIR2 microscope | Bruker | Contact mode NanoIR2 | |
| Nitrogen Tank | Airgas | ||
| Petri dishes | Greiner bio-one GmbH | ||
| Polyvinyl Alcohol | SIGMA-ALDRICH | 363170 | this polymer was only 87%-89% hydrolyzed, which explains the presence of residual C=O at 1730 cm-1 |
| Quantum Cascade Laser | Daylight Solutions | 1550-1800 cm-1 range | |
| Silicon wafer | MEMC St. Peters | #901319343000 | |
| Spin coater | Oscilla |
Referenzen
- Dufrêne, Y. F., Viljoen, A., Mignolet, J., Mathelié-Guinlet, M. AFM in cellular and molecular microbiology. Cellular Microbiology. 23 (7), e13324 (2021).
- Sharma, A., Rout, C. S. Probe-based techniques for 2D layered materials. Advanced Analytical Techniques for Characterization of 2D Materials. , 1-14 (2022).
- Zhong, J., Yan, J. Seeing is believing: atomic force microscopy imaging for nanomaterial research. RSC Advances. 6 (2), 1103-1121 (2016).
- Olubowale, O. H., et al. 34;May the force be with you!" Force-volume mapping with atomic force microscopy. ACS Omega. 6 (40), 25860-25875 (2021).
- Dokukin, M. E., Sokolov, I. Quantitative mapping of the elastic modulus of soft materials with HarmoniX and PeakForce QNM AFM modes. Langmuir. 28 (46), 16060-16071 (2012).
- Nguyen-Tri, P., et al. Recent applications of advanced atomic force microscopy in polymer science: a review. Polymers. 12 (5), 1142 (2020).
- Vitry, P., et al. Mode-synthesizing atomic force microscopy for 3D reconstruction of embedded low-density dielectric nanostructures. Nano Research. 8 (7), 2199-2205 (2015).
- Coste, R., Pernes, M., Tetard, L., Molinari, M., Chabbert, B. Effect of the interplay of composition and environmental humidity on the nanomechanical properties of hemp fibers. ACS Sustainable Chemistry & Engineering. 8 (16), 6381-6390 (2020).
- Schönherr, H., Feng, C. L., Tomczak, N., Vancso, G. J. Compositional mapping of polymer surfaces by chemical force microscopy down to the nanometer scale: reactions in block copolymer microdomains. Macromolecular Symposia. 230 (1), 149-157 (2005).
- Holland-Moritz, K., Siesler, H. W. Infrared spectroscopy of polymers. Applied Spectroscopy Reviews. 11 (1), 1-55 (1976).
- Bhargava, R., Wang, S. Q., Koenig, J. L. FTIR microscpectrscopy of polymeric systems. Liquid Chromatography/FTIR Microspectroscopy/Microwave Assisted Synthesis. , 137-191 (2003).
- Rao, V. J., et al. AFM-IR and IR-SNOM for the characterization of small molecule organic semiconductors. The Journal of Physical Chemistry C. 124 (9), 5331-5344 (2020).
- Wang, H., Wang, L., Xu, X. G. Scattering-type scanning near-field optical microscopy with low-repetition-rate pulsed light source through phase-domain sampling. Nature Communications. 7 (1), 13212 (2016).
- Dazzi, A., Prater, C. B. AFM-IR: Technology and applications in nanoscale infrared spectroscopy and chemical imaging. Chemical Reviews. 117 (7), 5146-5173 (2017).
- Mathurin, J., et al. Photothermal AFM-IR spectroscopy and imaging: Status, challenges, and trends. Journal of Applied Physics. 131 (1), 010901 (2022).
- Miller, A., et al. Enhanced surface nanoanalytics of transient biomolecular processes. Science Advances. 9 (2), 3151 (2023).
- Emin, D., et al. Small soluble α-synuclein aggregates are the toxic species in Parkinson's disease. Nature Communications. 13 (1), 5512 (2022).
- Jardine, K., Dove, A., Tetard, L. AFM force measurements to explore grain contacts with relevance for planetary materials. The Planetary Science Journal. 3 (12), 273 (2022).
- Sader, J. E., Chon, J. W. M., Mulvaney, P. Calibration of rectangular atomic force microscope cantilevers. Review of Scientific Instruments. 70 (10), 3967-3969 (1999).
- Higgins, M. J., et al. Noninvasive determination of optical lever sensitivity in atomic force microscopy. Review of Scientific Instruments. 77 (1), 013701 (2006).
- Smith, B. The infrared spectra of polymers III: hydrocarbon polymers. Spectroscopy. 36 (11), 22-25 (2021).
- Korbag, I., Mohamed Saleh, S. Studies on the formation of intermolecular interactions and structural characterization of polyvinyl alcohol/lignin film. International Journal of Environmental Studies. 73 (2), 226-235 (2016).
- Tetard, L., Passian, A., Farahi, R. H., Thundat, T., Davison, B. H. Opto-nanomechanical spectroscopic material characterization. Nature Nanotechnology. 10 (10), 870-877 (2015).
- Bai, Y., Yin, J., Cheng, J. -. X. Bond-selective imaging by optically sensing the mid-infrared photothermal effect. Science Advances. 7 (20), (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten