Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Avancées dans la spectroscopie infrarouge à l’échelle nanométrique pour explorer les systèmes polymériques multiphasiques
Dans cet article
Résumé
Ce protocole décrit l’application de la microscopie à force atomique et de la spectroscopie infrarouge à l’échelle nanométrique pour évaluer les performances de la spectroscopie infrarouge photothermique à l’échelle nanométrique dans la caractérisation d’échantillons multipolymères tridimensionnels.
Résumé
Les systèmes polymères multiphasiques englobent des domaines locaux dont les dimensions peuvent varier de quelques dizaines de nanomètres à plusieurs micromètres. Leur composition est généralement évaluée à l’aide de la spectroscopie infrarouge, qui fournit une empreinte digitale moyenne des différents matériaux contenus dans le volume sondé. Cependant, cette approche n’offre aucun détail sur la disposition des phases dans le matériau. Les régions interfaciales entre deux phases polymériques, souvent de l’ordre du nanomètre, sont également difficiles d’accès. La spectroscopie infrarouge photothermique à l’échelle nanométrique surveille la réponse locale des matériaux excités par la lumière infrarouge à l’aide de la sonde sensible d’un microscope à force atomique (AFM). Bien que la technique soit adaptée à l’interrogation de petites caractéristiques, telles que des protéines individuelles sur des surfaces d’or vierges, la caractérisation de matériaux multicomposants tridimensionnels est plus insaisissable. Cela est dû à un volume relativement important de matériau subissant une dilatation photothermique, définie par la focalisation laser sur l’échantillon et par les propriétés thermiques des constituants polymères, par rapport à la région à l’échelle nanométrique sondée par la pointe AFM. À l’aide d’une bille de polystyrène (PS) et d’un film d’alcool polyvinylique (PVA), nous évaluons l’empreinte spatiale de la spectroscopie infrarouge photothermique à l’échelle nanométrique pour l’analyse de surface en fonction de la position du PS dans le film PVA. L’effet de la position de la caractéristique sur les images infrarouges à l’échelle nanométrique est étudié et les spectres sont acquis. Quelques perspectives sur les avancées futures dans le domaine de la spectroscopie infrarouge photothermique à l’échelle nanométrique sont fournies, en considérant la caractérisation de systèmes complexes avec des structures polymériques intégrées.
Introduction
La microscopie à force atomique (AFM) est devenue essentielle pour imager et caractériser la morphologie d’une grande variété d’échantillons avec une résolution à l’échelle nanométrique 1,2,3. En mesurant la déflexion d’un porte-à-faux AFM résultant de l’interaction de la pointe pointue avec la surface de l’échantillon, des protocoles d’imagerie fonctionnelle à l’échelle nanométrique pour les mesures de rigidité locale et l’adhérence pointe-échantillon ont été développés 4,5. Pour l’analyse de la matière condensée molle et des polymères, les mesures AFM explorant les propriétés nanomécaniques et nanochimiques des domaines locaux sont très recherchées 6,7,8. Avant l’émergence de la spectroscopie infrarouge à l’échelle nanométrique (nanoIR), les pointes de l’AFM ont été modifiées chimiquement pour évaluer la présence de différents domaines de la courbe de force de l’AFM et en déduire la nature de l’interaction pointe-échantillon. Par exemple, cette approche a été utilisée pour mettre en évidence la transformation de microdomaines de poly(tert-acrylate de butyle) à la surface de couches minces de copolymère à blocs de polystyrène traité au cyclohexane à un niveau inférieur à 50 nm9.
La combinaison de la lumière infrarouge (IR) et de l’AFM a eu un impact significatif sur le domaine de la science des polymères6. La spectroscopie IR conventionnelle est une technique largement utilisée pour étudier la structure chimique des matériaux polymères 10,11, mais elle ne fournit pas d’informations sur les phases individuelles et le comportement interphasé, car les régions sont trop petites par rapport à la taille du faisceau IR utilisé pour sonder l’échantillon. Le problème est vrai avec la microspectroscopie IR, car elle est limitée par la limite de diffraction optique6. De telles mesures font la moyenne des contributions de l’ensemble de la région excitée par la lumière infrarouge ; Les signaux résultant de la présence de phases à l’échelle nanométrique à l’intérieur de la région sondée présentent soit des empreintes digitales complexes qui doivent être déconvoluées lors du post-traitement, soit sont perdus en raison d’un niveau de signal inférieur au niveau détectable. Par conséquent, il est essentiel de développer des outils capables d’une résolution spatiale à l’échelle nanométrique et d’une sensibilité IR élevée pour explorer les caractéristiques chimiques à l’échelle nanométrique dans des milieux complexes.
Des schémas permettant de réaliser la spectroscopie nanoIR ont été développés, d’abord en utilisant une pointe métallique de l’AFM comme nanoantenne12,13, et plus récemment en exploitant la capacité du porte-à-faux de l’AFM à surveiller les changements de dilatation photothermique encourus lors de l’illumination IR de l’échantillon 12,14,15. Ce dernier utilise une source de lumière infrarouge pulsée et accordable réglée sur une bande d’absorption du matériau sondé, ce qui fait que l’échantillon absorbe le rayonnement et subit une dilatation photothermique. Cette approche est bien adaptée aux matériaux organiques et polymères. L’excitation pulsée rend l’effet détectable par le porte-à-faux AFM en contact avec la surface de l’échantillon sous la forme d’une oscillation. L’amplitude de l’une des résonances de contact du système observée dans le spectre de fréquences est alors surveillée en fonction de la longueur d’onde de l’éclairage, qui constitue le spectre d’absorption nanoIR du matériau sous la pointe15 de l’AFM. La résolution spatiale de l’imagerie et de la spectroscopie nanoIR est limitée par divers effets de la dilatation photothermique du matériau. Il a été évalué que la spectroscopie photothermique nanoIR utilisant le mode contact AFM peut acquérir les propriétés des spectres d’absorption vibrationnelle de matériaux avec une résolution spatiale inférieure à 50 nm14, avec des travaux récents démontrant la détection de monomères et de dimères de α-synucléine 16,17. Cependant, les études quantitatives de la performance des mesures nanoIR sur des matériaux polymères hétérogènes assemblés dans diverses configurations, comme dans le cas d’absorbeurs de dimensions finies embarqués dans le volume de divers films polymères, restent limitées.
Cet article vise à créer un assemblage polymère avec une caractéristique embarquée d’une dimension connue pour évaluer la sensibilité de la dilatation photothermique et la résolution spatiale du nanoIR lors de l’analyse de surface. Le protocole couvre la préparation d’un film mince de polymère d’alcool polyvinylique (PVA) sur un substrat de silicium et la mise en place d’un cordon de polystyrène (PS) tridimensionnel sur ou noyé dans le film PVA, qui constitue la formation du système modèle. Les mesures d’imagerie et de spectroscopie nanoIR sont décrites dans le contexte de l’évaluation des signaux générés par la même bille de PS positionnée sur ou sous le film PVA. L’influence de la position de la bille sur les signaux nanoIR est évaluée. Les méthodes d’évaluation de l’empreinte spatiale de la bille dans la carte nanoIR sont discutées, et les effets de plusieurs paramètres sont pris en compte.
Protocole
1. Fabrication d’une solution d’alcool polyvinylique (PVA)
- Mesurez l’eau et les pastilles de polymère PVA (voir le tableau des matériaux) pour créer une solution de 10 ml à un rapport PVA/eau de 20 % en poids.
- Faites chauffer l’eau de la verrerie sur une plaque chauffante réglée à 100 °C.
- Placez les granulés de polymère PVA dans l’eau chauffée. Insérez une barre d’agitation magnétique.
- Réduisez le feu à 80 °C et remuez jusqu’à ce que le PVA se dissolve complètement.
- Couvrez le dessus de la verrerie pour éviter toute contamination.
- Une fois complètement dissoute, placez la solution de PVA à 20 % dans un récipient de stockage approprié pour le stockage à température ambiante.
2. Préparation de plaquettes de silicium (Si) revêtues de PVA
- Découpez une plaquette de silicium (Si) (voir tableau des matériaux) en2 carrés de ~10 x 10 mm.
- Nettoyez le substrat de Si à l’aide d’alcool isopropylique et laissez-le sécher.
- Placez la plaquette de Si propre sur le mandrin de l’enrobeuse par centrifugation (voir le tableau des matériaux).
- Déposer environ 10 μL de solution de PVA au centre du substrat de Si. Essayez d’éviter la formation de bulles.
- Enduire le substrat de Si d’un film PVA uniforme par revêtement par centrifugation pendant 30 s à 1 500 tours par minute (tr/min).
REMARQUE : Le volume spécifié de liquide et les paramètres de revêtement par centrifugation créent une couche uniforme de PVA sur la surface du substrat avec une épaisseur suffisante pour empêcher un séchage rapide entre le revêtement par centrifugation et le placement des billes PS sur la surface du PVA à l’étape suivante.
- Retirez l’échantillon de l’enrobeuse par centrifugation et placez-le dans un récipient d’échantillon propre pour éviter toute contamination avant de transférer les billes de PS.
3. Mise en place des billes PS sur la surface revêtue de PVA
- Nettoyez un substrat de Si avec de l’alcool isopropylique et laissez-le sécher.
- À l’aide d’une pipette, placez 1 μL de billes de PS en suspension dans l’eau au centre du substrat.
- Laissez l’eau s’évaporer en plaçant l’échantillon dans un compartiment de stockage contenant un déshydratant à base d’argile bentonite.
REMARQUE : Cette étape préserve l’échantillon en réduisant l’exposition à l’humidité. - Placez le substrat revêtu de PVA (étape 2.4) et le substrat avec les billes de PS séchées (étape 3.3) sous un microscope optique. En fonction de leur taille, une seule perle sera visible à l’aide de simples jumelles ou nécessitera un grossissement optique plus élevé.
- Détachez délicatement les perles à l’aide d’une pince à épiler ultrafine (voir le tableau des matériaux). Utilisez un pinceau à poils fins pour recueillir quelques perles libres et tapotez légèrement les poils du pinceau sur la gaufrette fraîchement enduite de PVA. Plusieurs balayages devraient permettre aux perles de s’accumuler dans les poils de la brosse. Tapotez le dessus des poils du pinceau pour perturber la poudre de billes PS afin de libérer les perles sur la surface collante du PVA.
REMARQUE : Il est important que le pinceau soit de haute qualité et propre pour éviter de libérer des fibres et des contaminants sur la surface du film PVA. Il est essentiel de se déplacer rapidement lors de cette étape afin que le PVA ne sèche pas complètement. - Répétez cette étape jusqu’à ce qu’il soit confirmé par inspection par microscopie optique que les billes individuelles de PS adhèrent à la surface PVA.
- Conservez l’échantillon dans un récipient propre. Laissez l’échantillon sécher complètement.
REMARQUE : L’échantillon doit être laissé refroidir et sécher complètement avant d’effectuer d’autres tentatives d’analyse. Les mesures de hauteur AFM ou les mesures de profilage de surface permettent d’évaluer l’épaisseur de films PVA successifs.
4. Chargement de l’échantillon pour la caractérisation AFM
NOTE : Le protocole décrit est basé sur les procédures d’exploitation standard d’une plate-forme nanoIR2 (voir le tableau des matériaux), mais doit être adapté en fonction du modèle AFM utilisé pour la mesure.
- Montez l’échantillon de billes PVA et PS sur la platine AFM à l’aide d’un disque AFM métallique et de languettes adhésives, de sorte que l’échantillon soit fermement fixé au porte-échantillon.
- Montez une sonde nanoIR (par exemple, FORTGG) sur le support de sonde AFM.
REMARQUE : Le porte-à-faux AFM mesure 225 μm de long, 27 μm de large et 2,7 μm d’épaisseur, avec un rayon de pointe inférieur à 10 nm. Le porte-à-faux est recouvert d’un film d’or de 45 nm d’épaisseur sur les deux faces afin de limiter sa réponse à l’éclairage IR de la face supérieure de l’échantillon (voir tableau des matériaux). Pour les mesures de spectroscopie nanoIR, il est préférable d’utiliser un porte-à-faux qui a été stocké dans un environnement exempt de polydiméthylsiloxane avant utilisation. - Alignez le laser de lecture à l’extrémité libre du faisceau en porte-à-faux en tournant les boutons d’alignement du laser (réglages x et y de la position du laser et réglage vertical de la position du détecteur).
- Maximisez le signal SUM du détecteur.
- Ajustez la position du détecteur en tournant le bouton de déviation de manière à ce que le laser soit aligné avec le centre du détecteur sensible à la position du système de lecture AFM, ce qui correspond à un signal de déviation verticale de ~0 V.
- Cliquez sur l’icône Charger dans le panneau de configuration « Sonde » de l’AFM.
- Suivez les instructions dans l’écran de l’assistant. Utilisez les flèches de mise au point pour déterminer le plan focal du porte-à-faux nanoIR. Utilisez les commandes de déplacement XY pour positionner le porte-à-faux au centre de l’écran (aligné avec la croix blanche).
- Ensuite, cliquez sur les flèches de mise au point pour trouver le plan focal de la surface de l’échantillon.
- Utilisez la vue optique du système et les commandes de déplacement XY pour positionner la pointe en porte-à-faux au-dessus du cordon d’intérêt et cliquez sur Suivant.
- Sur l’écran d’engagement, réglez l'« entretoise » sur 50 μm et cliquez sur Approche uniquement.
- Lancez la procédure d’engagement pour vous approcher de la pointe pour l’imagerie.
5. Création d’images topographiques et nanoIR de l’échantillon multipolymère
- Acquérez des images topographiques en « Mode Contact » standard. Une fois que la position du porte-à-faux par rapport au talon PS est réglée, lancez l’approche en cliquant sur l’icône d’enclenchement dans le panneau de commande « Sonde » de l’AFM. Une consigne d’engagement d’un différentiel de déflexion de 0,2 V est utilisée pour l’ensemble de l’étude, ce qui correspond à une force de ~100 nN.
Dans le panneau de commande « Balayage » de l’AFM, réglez la fréquence de balayage sur 0,8 Hz, la taille de numérisation (hauteur et largeur), ainsi que le nombre de points par ligne et le nombre de lignes par image à utiliser pour l’imagerie (512 x 512 a été utilisé ici). Cliquez sur Scan pour acquérir l’image topographique.
NOTA : L’étalonnage du porte-à-faux18 s’effectue en déterminant la sensibilité à la déflexion (en nm/V) à partir de la pente de la courbe de distance de déflexion obtenue avec le porte-à-faux interagissant avec un substrat en saphir (figure supplémentaire 1A). La rigidité en porte-à-faux est déterminée à partir du réglage thermique19 (figure supplémentaire 1B). La résonance du porte-à-faux est réglée à l’aide d’une fonction lorentzienne. La rigidité en porte-à-faux (en N/m) est déterminée à l’aide du théorème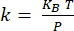 d’équipartition , où KBest la constante de Boltzmann, T est la température (T = 295K) et P est l’aire du spectre de puissance des fluctuations thermiques du porte-à-faux déterminée en intégrant l’ajustement lorentzien des données d’accord thermique20.
d’équipartition , où KBest la constante de Boltzmann, T est la température (T = 295K) et P est l’aire du spectre de puissance des fluctuations thermiques du porte-à-faux déterminée en intégrant l’ajustement lorentzien des données d’accord thermique20. - Pour les mesures nanoIR, positionnez la pointe AFM sur l’entité d’intérêt identifiée à partir de l’image topographique.
- Sélectionnez l’icône du diapason dans le panneau de commande nanoIR pour déterminer les fréquences de résonance de contact du porte-à-faux. Définissez un nombre d’onde d’illumination qui excitera la dilatation photothermique dans le matériau. Définissez une plage de fréquence d’impulsion laser pour balayer et définir le cycle de service du laser nanoIR. Sélectionnez Acquérir dans la « Fenêtre de réglage de l’impulsion laser ».
- Sélectionnez la deuxième résonance de contact du système pointe-échantillon pour les mesures nanoIR en positionnant la barre de marquage (ligne verticale verte) au sommet de la résonance du deuxième contact.
REMARQUE : La sélection du mode de résonance de contact peut varier en fonction du type de porte-à-faux et de l’échantillon. - Cliquez sur Optimiser pour aligner le centre de la région focale du laser IR avec la position de la pointe en porte-à-faux. L’alignement se fait à un nombre d’onde d’illumination IR sélectionné, correspondant à une bande d’absorption du matériau sondé. Le porte-à-faux est positionné au centre de l’empreinte laser (Figure supplémentaire 2).
REMARQUE : L’alignement peut varier pour différents nombres d’onde en fonction du modèle de laser. - Acquérir un arrière-plan de l’éclairage laser IR. Il s’agit de mesurer la sortie du laser IR à cascade quantique (QCL) dans la gamme de longueurs d’onde d’émission à la fréquence d’impulsion sélectionnée (Figure supplémentaire 3). Ceci est important pour la correction de l’arrière-plan des spectres nanoIR.
- Acquérez le spectre nanoIR en sélectionnant la plage de numéros d’onde (ici, Start et Stop sont réglés sur 1 530 cm-1 et 1 800 cm-1, respectivement), la taille du pas (2 cm-1) et le nombre de moyennes utilisées pour la mesure. Effectuer la correction de l’arrière-plan des spectres affichés en divisant l’amplitude photothermique mesurée par l’effet de fond atténué, ce qui consiste à multiplier le bruit de fond recueilli à l’étape 5.2.4 par le pourcentage de puissance sélectionné pour la mesure.
- Pour l’imagerie nanoIR, sélectionnez la région d’intérêt pour l’imagerie.
- Activez le réglage automatique de la boucle à verrouillage de phase (PLL) dans la « Fenêtre de réglage de l’impulsion laser » (accessible par l’icône du diapason ).
- Ajustez la fréquence minimale et maximale pour créer une plage de balayage centrée sur le deuxième mode de résonance dans le panneau de commande général.
- Mettez la phase à zéro en cliquant sur zéro dans le panneau de configuration PLL, puis cliquez sur OK dans la fenêtre « Laser Pulse Tune ».
- Sélectionnez IR Imaging Enabled (Imagerie IR activée ) en cochant la case située dans le panneau de configuration nanoIR.
- Dans le panneau de configuration « Vue d’imagerie », choisissez Hauteur (vue d’imagerie 1), Amplitude 2 (vue d’imagerie 2) et Phase 2 (vue d’imagerie 3) pour acquérir les images topographiques et chimiques de l’échantillon. Définissez le sens d’acquisition sur Trace (ou Retrace). Une ligne d’ajustement linéaire est souvent nécessaire pour observer l’image topographique de l’échantillon en cours d’acquisition. L’ajustement de capture doit être défini sur Aucun.
REMARQUE : Les préférences de numérisation, telles que la direction de numérisation capturée ou la palette de couleurs utilisée, peuvent être ajustées selon les besoins. - Dans le panneau de configuration « Scan » de l’AFM, sélectionnez l’icône Scan .
- Pour enregistrer l’image, sélectionnez l’icône Maintenant ou Fin de l’image dans le panneau de configuration « Capturer ».
- Pour exporter les données, cliquez avec le bouton droit de la souris sur les noms des fichiers d’image ou de spectre dans les listes de données. Sélectionnez Exporter et choisissez le format du fichier à exporter. Enregistrez le fichier dans le dossier de l’ordinateur souhaité.
Résultats
Des billes de PS ((C8H8)n) ont été déposées sur un substrat de Si propre (Figure 1A) et sur du PVA ((CH2CHOH)n) (Figure 1B,C). En raison de la faible adhérence de la bille sur Si, l’imagerie nanoIR en mode contact n’a pas pu être acquise pour cet échantillon. Au lieu de cela, en utilisant la vue optique de l’échantillon sur nanoIR, la sonde AFM recouverte d’or a été engagé...
Discussion
L’AFM combinée à la spectroscopie nanoIR peut fournir des informations chimiques à l’échelle nanométrique à l’aide d’un porte-à-faux en mode contact et d’une source de lumière IR accordable pulsée. Les systèmes modèles, tels que l’intégration d’un absorbeur de dimensions finies dans le volume d’un matériau polymère, sont importants pour améliorer la compréhension des mécanismes de formation d’images et déterminer les performances de l’outil. Dans le cas de la configuration PS/PVA pr?...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ces travaux ont été soutenus par la National Science Foundation (NSF CHE-1847830).
matériels
| Name | Company | Catalog Number | Comments |
| 10|0 2200 Golden Taklon Round | Zem | ||
| 5357-8NM Tweezers | Pelco | ||
| Adhesive Tabs | Ted Pella | 16079 | |
| AFM metal specimen disks | Ted Pella | 16208 | |
| Binocular | AmScope | ||
| Cantilever for nanoIR measurements | AppNano | FORTGG | |
| Cell culture dishes | Greiner bio-one GmbH | ||
| Desiccator | |||
| Floating optical table | Newport | RS 4000 | |
| Hotplate | VWR | ||
| Isopropanol | |||
| Kimwipes | KIMTECH | ||
| Magnetic stir bar | |||
| Microparticles based on polystyrene size: 5 µm | SIGMA-ALDRICH | 79633 | |
| nanoIR2 microscope | Bruker | Contact mode NanoIR2 | |
| Nitrogen Tank | Airgas | ||
| Petri dishes | Greiner bio-one GmbH | ||
| Polyvinyl Alcohol | SIGMA-ALDRICH | 363170 | this polymer was only 87%-89% hydrolyzed, which explains the presence of residual C=O at 1730 cm-1 |
| Quantum Cascade Laser | Daylight Solutions | 1550-1800 cm-1 range | |
| Silicon wafer | MEMC St. Peters | #901319343000 | |
| Spin coater | Oscilla |
Références
- Dufrêne, Y. F., Viljoen, A., Mignolet, J., Mathelié-Guinlet, M. AFM in cellular and molecular microbiology. Cellular Microbiology. 23 (7), e13324 (2021).
- Sharma, A., Rout, C. S. Probe-based techniques for 2D layered materials. Advanced Analytical Techniques for Characterization of 2D Materials. , 1-14 (2022).
- Zhong, J., Yan, J. Seeing is believing: atomic force microscopy imaging for nanomaterial research. RSC Advances. 6 (2), 1103-1121 (2016).
- Olubowale, O. H., et al. 34;May the force be with you!" Force-volume mapping with atomic force microscopy. ACS Omega. 6 (40), 25860-25875 (2021).
- Dokukin, M. E., Sokolov, I. Quantitative mapping of the elastic modulus of soft materials with HarmoniX and PeakForce QNM AFM modes. Langmuir. 28 (46), 16060-16071 (2012).
- Nguyen-Tri, P., et al. Recent applications of advanced atomic force microscopy in polymer science: a review. Polymers. 12 (5), 1142 (2020).
- Vitry, P., et al. Mode-synthesizing atomic force microscopy for 3D reconstruction of embedded low-density dielectric nanostructures. Nano Research. 8 (7), 2199-2205 (2015).
- Coste, R., Pernes, M., Tetard, L., Molinari, M., Chabbert, B. Effect of the interplay of composition and environmental humidity on the nanomechanical properties of hemp fibers. ACS Sustainable Chemistry & Engineering. 8 (16), 6381-6390 (2020).
- Schönherr, H., Feng, C. L., Tomczak, N., Vancso, G. J. Compositional mapping of polymer surfaces by chemical force microscopy down to the nanometer scale: reactions in block copolymer microdomains. Macromolecular Symposia. 230 (1), 149-157 (2005).
- Holland-Moritz, K., Siesler, H. W. Infrared spectroscopy of polymers. Applied Spectroscopy Reviews. 11 (1), 1-55 (1976).
- Bhargava, R., Wang, S. Q., Koenig, J. L. FTIR microscpectrscopy of polymeric systems. Liquid Chromatography/FTIR Microspectroscopy/Microwave Assisted Synthesis. , 137-191 (2003).
- Rao, V. J., et al. AFM-IR and IR-SNOM for the characterization of small molecule organic semiconductors. The Journal of Physical Chemistry C. 124 (9), 5331-5344 (2020).
- Wang, H., Wang, L., Xu, X. G. Scattering-type scanning near-field optical microscopy with low-repetition-rate pulsed light source through phase-domain sampling. Nature Communications. 7 (1), 13212 (2016).
- Dazzi, A., Prater, C. B. AFM-IR: Technology and applications in nanoscale infrared spectroscopy and chemical imaging. Chemical Reviews. 117 (7), 5146-5173 (2017).
- Mathurin, J., et al. Photothermal AFM-IR spectroscopy and imaging: Status, challenges, and trends. Journal of Applied Physics. 131 (1), 010901 (2022).
- Miller, A., et al. Enhanced surface nanoanalytics of transient biomolecular processes. Science Advances. 9 (2), 3151 (2023).
- Emin, D., et al. Small soluble α-synuclein aggregates are the toxic species in Parkinson's disease. Nature Communications. 13 (1), 5512 (2022).
- Jardine, K., Dove, A., Tetard, L. AFM force measurements to explore grain contacts with relevance for planetary materials. The Planetary Science Journal. 3 (12), 273 (2022).
- Sader, J. E., Chon, J. W. M., Mulvaney, P. Calibration of rectangular atomic force microscope cantilevers. Review of Scientific Instruments. 70 (10), 3967-3969 (1999).
- Higgins, M. J., et al. Noninvasive determination of optical lever sensitivity in atomic force microscopy. Review of Scientific Instruments. 77 (1), 013701 (2006).
- Smith, B. The infrared spectra of polymers III: hydrocarbon polymers. Spectroscopy. 36 (11), 22-25 (2021).
- Korbag, I., Mohamed Saleh, S. Studies on the formation of intermolecular interactions and structural characterization of polyvinyl alcohol/lignin film. International Journal of Environmental Studies. 73 (2), 226-235 (2016).
- Tetard, L., Passian, A., Farahi, R. H., Thundat, T., Davison, B. H. Opto-nanomechanical spectroscopic material characterization. Nature Nanotechnology. 10 (10), 870-877 (2015).
- Bai, Y., Yin, J., Cheng, J. -. X. Bond-selective imaging by optically sensing the mid-infrared photothermal effect. Science Advances. 7 (20), (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon