Method Article
التنميط الدقيق للبوليمر (MAPP) لتحليل الجليكان عالي الإنتاجية
In This Article
Summary
التنميط الدقيق للبوليمر (MAPP) هو تقنية عالية الإنتاجية للتحليل التركيبي للجليكان في العينات البيولوجية.
Abstract
التنميط البوليمر Microarray (MAPP) هو نهج قوي وقابل للتكرار لتحديد التركيب والوفرة النسبية للجليكان والجليكوكونتيورات بشكل منهجي ضمن مجموعة متنوعة من العينات البيولوجية ، بما في ذلك الأنسجة النباتية والطحالب والمواد الغذائية والعينات البشرية والحيوانية والميكروبية. تدعم تقنية Microarray فعالية هذه الطريقة من خلال توفير منصة فحص مصغرة وعالية الإنتاجية ، مما يسمح بآلاف التفاعلات بين الجليكان والمجسات الجزيئية الموجهة للجليكان المحددة للغاية ليتم توصيفها بشكل متزامن ، باستخدام كميات صغيرة فقط من التحليلات. يتم تجزئة الجليكان المكون كيميائيا وإنزيميا ، قبل استخلاصه بالتتابع من العينة وتجميده مباشرة على أغشية النيتروسليلوز. يتم تحديد تركيبة الجليكان من خلال ربط مجسات جزيئية محددة تتعرف على الجليكان بالجزيئات المبتزة والمطبوعة. MAPP مكمل لتقنيات تحليل الجليكان التقليدية ، مثل السكاريد الأحادي وتحليل الارتباط وقياس الطيف الكتلي. ومع ذلك ، توفر المجسات الجزيئية التي تتعرف على الجليكان نظرة ثاقبة للتكوينات الهيكلية للجليكان ، والتي يمكن أن تساعد في توضيح التفاعلات البيولوجية والأدوار الوظيفية.
Introduction
الجليكان منتشر في كل مكان في جميع مجالات الحياة ويظهر تنوعا لا مثيل له في البنية والوظيفة مقارنة بالجزيئات الكبيرة الأخرى1. ومع ذلك ، نظرا لتعقيدها ، والتباين في التخليق الحيوي والروابط الجليكوسيدية ، وندرة الطرق المناسبة لتشريح هياكل الجليكان ، فإن فهمنا لهذا التنوع في الهياكل والوظائف محدود نسبيا2.
العديد من تقنيات تحليل الجليكان مدمرة وتتطلب تكسير الجليكان إلى السكريات الأحادية المكونة لها ، والتي يمكن أن تحجب السياقات ثلاثية الأبعاد والبيولوجية ذات الصلة3. على العكس من ذلك ، فإن الأجسام المضادة وحيدة النسيلة (mAbs) ، ووحدات ربط الكربوهيدرات (CBMs) ، والمحاضرات ، والغلوتينين الفيروسي ، والالتصاقات الميكروبية ، والمعروفة مجتمعة باسم المجسات الجزيئية التي تتعرف على الجليكان (GRMPs)4 ، تتعرف على حوامل محددة وترتبط بها ويمكن استخدامها كأدوات للكشف والتمييز بين الجليكان داخل مصفوفات معقدة متعددة الجليكان 5,6.
هنا ، نقدم تنميط بوليمر microarray (MAPP) ، وهي طريقة سريعة ومتعددة الاستخدامات وغير مدمرة لتحليل الجليكان والتي تنطبق على مجموعة واسعة من العينات البيولوجية. تهدف الطريقة إلى توفير تقنية قوية وعالية الإنتاجية لتحليل الجليكان من أنظمة بيولوجية وصناعية / تجارية متنوعة. يوحد MAPP خصوصية التعرف على المجسات الجزيئية الموجهة بالجليكان مع تقنية فحص microarray القابلة للتكرار وعالية الأداء للسماح بآلاف التفاعلات الجزيئية بالتوازي. ناتج هذا النهج هو نظرة تشخيصية حول التركيب والوفرة النسبية للجليكان داخل عينة أو نسيج مهم.
يمكن استخدام MAPP كطريقة مستقلة قائمة بذاتها ، أو بالاقتران مع تقنيات كيميائية حيوية أخرى ، مثل الفحص المجهري المناعي7،8،9 والسكريات الأحادية أو تحليل الارتباط10،11. يمكن أيضا استخدام هذه التقنية لرسم خريطة لخصائص الخاتمة ل GRMPs الجديدة ، باستخدام المصفوفات المطبوعة بمعايير قليلة السكاريد النقية والمحددة جيدامن الناحية الهيكلية 12. الميزة الرئيسية ل MAPP على الطرق الأخرى ، مثل مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) ، هي توافقها مع أحجام العينات الصغيرة13,14. علاوة على ذلك ، يقدم MAPP تحليلا عالي الإنتاجية15 ويوفر شكلا فعالا لحفظ العينات ، حيث تكون العينات المطبوعة جافة ومستقرة عند تجميدها على النيتروسليلوز16.
يعتمد ربط GRMPs بشكل عام على وجود عدد من بقايا السكر المتجاورة التي تشكل مجتمعة موقع ربط (حاتم) فريد لفئة معينة من عديد السكاريد (زيلان ، مانان ، زيلوجلوكان ، إلخ.) 17. في المقابل ، يمكن أن تكون بقايا السكر الفردية (الزيلوز ، المانوز ، الجلوكوز) التي يتم قياسها كميا باستخدام معظم التقنيات الكيميائية الحيوية ، على سبيل المثال تكوين السكريات الأحادية أو تحليل المثيلة ، مكونات لفئات متعددة من السكريات وبالتالي يصعب تعيينها18.
تم تطوير MAPP استجابة لفجوة تقنية ، وهي القدرة على التحليل السريع لجليكان متعدد من مجموعة متنوعة من المصادر باستخدام كميات صغيرة من المواد. تستفيد MAPP من الذخيرة الواسعة من GRMPs التي تم تطويرها وتميزها على مدى العقود الثلاثة الماضية12،19،20،21،22،23،24،25،26،27،28،29،30،31،32. كان تطوير MAPP عملية تكرارية ، حيث يتم تحسين التقنية وتحسينها بشكل مطرد. يوجد الآن مجموعة كبيرة من الأدبيات التي تصف تطبيق MAPP على مختلف الأنظمة الطبيعية والصناعية حيث تلعب الجليكان أدوارا مركزية 5،6،9،10،21،33،34،35،36،37،38،39. هنا ، نصف الحالة الراهنة لفن MAPP.
Protocol
يتم تلخيص المراحل التجريبية الرئيسية لطريقة MAPP في الشكل 1.
1. إعداد العينات
ملاحظة: هنا ، يتم تطبيق الطريقة على الأنسجة النباتية لأغراض توضيحية. كانت النباتات المختارة هي Coffea arabica و Allium sativum var. ophioscorodon والعديد من أصناف المانجو التايلاندية (Aokrong و Kam و Rad و Chokanan و Mamkamdang و Talabnak و Mahachanok و Nga). تم اختيار النباتات لأهميتها التجارية. ويؤدي تجهيزها للاستهلاك البشري إلى توليد نفايات صناعية زراعية غير مستغلة حاليا، مما قد يوفر مصدرا للمنتجات ذات القيمة المضافة، بما في ذلك الغليكان النقي. وهكذا، تم تطبيق MAPP لتوصيف تكوين الغليكان للكتلة الحيوية لنباتات النفايات لأغراض التنقيب البيولوجي.
- افصل المادة النباتية إلى أنسجة مختلفة (مثل الجذر والساق والأوراق).
- جفف أنسجة النبات في فرن الهواء الساخن على حرارة 40 درجة مئوية لمدة 12-24 ساعة (تقليل / زيادة الوقت وفقا للعينة). بدلا من ذلك ، قم بتجميد العينات في النيتروجين السائل ثم تجففها بالتجميد لمدة ~ 4 أيام.
- قم بتجانس العينات إلى مسحوق ناعم باستخدام مدقة وملاط أو محلل أنسجة ميكانيكي (انظر جدول المواد) مع محمل كروي في كل أنبوب.
ملاحظة: بالنسبة للأنسجة النباتية الطازجة ، يوصى بالتجفيف أو التجفيد قبل التجانس. بشكل عام ، التجانس مع المدقة والملاط كاف لمعظم العينات الجافة. بالنسبة للعينات المرنة بشكل خاص ، مثل الحبوب والبقوليات والمواد الغذائية المصنعة مثل المعكرونة ، يمكن أن يؤدي التجميد المفاجئ في النيتروجين السائل إلى زيادة سرعة وكفاءة تجانس العينة. لقد وجدنا أن التجانس الميكانيكي متوافق مع جميع أنواع العينات تقريبا ، وهو أسرع بكثير وأقل كثافة في العمل ، ويقلل بشكل فعال من مخاطر التلوث المتبادل للعينة من الاستخدام المتكرر لنفس المعدات (أي المدقة والملاط).
2. تحضير بقايا الكحول غير القابلة للذوبان (AIR)
- أضف 1.5 مل من 70٪ (v / v) من الإيثانول إلى 50-100 مجم من مادة العينة المجففة بالهواء والمتجانسة.
- دوامة جيدا لخلط ثم أجهزة الطرد المركزي في 10000 × غرام لمدة 10 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية الناتجة باستخدام ماصة واحتفظ بالحبيبات.
- إلى الحبيبات المتبقية ، أضف 1.5 مل من الميثانول والكلوروفورم (1: 1 [v / v]). دوامة ، أجهزة الطرد المركزي ، والتخلص من المادة الطافية ، وفقا للخطوة 2.2.
- إلى الحبيبات المتبقية ، أضف 1.5 مل من الأسيتون بنسبة 100٪. دوامة ، أجهزة الطرد المركزي ، والتخلص من المادة الطافية ، وفقا للخطوة 2.2.
- ضع الحبيبات الناتجة إما طوال الليل في غطاء دخان للسماح للأسيتون المتبقي بالتبخر أو في جهاز طرد مركزي مفرغ حتى يجف.
ملاحظة: يمكن تخزين مواد AIR في درجة الحرارة المحيطة حتى الحاجة إليها.
3. استخراج الجليكان
ملاحظة: إذا أمكن ، قم بإجراء جميع خطوات الاستخراج في محلل الأنسجة مع محمل كروي في كل أنبوب للمساعدة في التعليق. في حالة عدم توفر محلل الأنسجة ، يمكن إجراء عمليات الاستخراج بدلا من ذلك مع التحريك أو الاهتزاز المستمر. قد يكون من الضروري تمديد وقت الاستخراج إذا لم يكن ذلك ممكنا.
- إلى 10 ملغ من مادة AIR ، أضف 30 ميكرولتر / ملغ من 50 mM حمض cyclohexanediaminetetraacetic (CDTA ؛ انظر جدول المواد) ، درجة الحموضة 7.5.
- يهز عند 27 هرتز لمدة دقيقتين ، يليه 10 هرتز لمدة 2 ساعة.
- أجهزة الطرد المركزي عند 10000 × جم لمدة 10 دقائق عند 4 درجات مئوية. احتفظ بالمادة الطافية الناتجة ، وأضفها إلى أنبوب طرد مركزي دقيق معقم ، وقم بتخزينها عند 4 درجات مئوية على شاكر دوار.
- إلى الحبيبات المتبقية ، أضف 30 ميكرولتر / مجم 4 M NaOH + 0.1٪ (وزن / حجم) هيدروكسيد الصوديوم4.
تنبيه: NaBH4 سام إذا تم ابتلاعه. استخدم معدات الحماية الشخصية (PPE). تعامل مع غطاء الدخان. تجنب تكون الغبار. تجنب استنشاق الغبار. لا تسمح للمنتج بالتلامس مع الماء. - كرر الخطوات من 3.2 إلى 3.3. اغسل الحبيبات المتبقية مرتين أو ثلاث مرات باستخدام dH2O لإزالة NaOH المتبقي.
- أضف 30 ميكرولتر / مجم من السليولاز (يفضل GH5 endo-1،4-β-glucanase ، في محلول إنزيم مناسب - على النحو الموصى به من قبل الشركة المصنعة ؛ انظر جدول المواد) إلى الحبيبات واحتضانها عند درجة حرارة الإنزيم المثلى لمدة 16 ساعة.
- أجهزة الطرد المركزي العينات عند 10000 × جم لمدة 10 دقائق عند 4 درجات مئوية. احتفظ بالمادة الطافية ، وانقلها لتنظيف أنابيب الطرد المركزي الدقيقة ، وقم بتخزينها في درجة حرارة 4 درجات مئوية على شاكر دوار. بمجرد استخراجها ، يجب طباعة العينات في أسرع وقت ممكن.
- أجهزة الطرد المركزي جميع المستخلصات المخزنة مرة أخرى عند 10000 × جم لمدة 10 دقائق عند 4 درجات مئوية.
ملاحظة: يجب أن تكون العينات خالية من الجسيمات والحطام. قم بتمرير مرشح دوران 0.2 ميكرومتر قبل طباعة microarray إذا لزم الأمر. لا تتوافق العينات اللزجة بشكل خاص مع تحليل microarray حيث يمكن انسداد الشعيرات الدموية للصفيف الدقيق ورأس الطباعة بسهولة. كقاعدة عامة ، يجب أن يكون المستخدمون قادرين على ماصة جميع العينات المخصصة للطباعة باستخدام ماصة قياسية منخفضة الحجم.
4. إعداد المعايير
- تحضير محاليل 1 ملغم / مل لمعايير الجليكان المحددة (الجدول 1) في dH2O. معقمة في حالة استخدام pachyman كمعيار ، قم بالذوبان في 4 M NaOH بدلا من ذلك وقم بتحييده بحمض الخليك الجليدي بعد الذوبان.
- قم بتخزين المعايير المعدة طوال الليل عند 4 درجات مئوية على شاكر دوار للسماح بالذوبان الكامل.
- أجهزة الطرد المركزي جميع المعايير لمدة 10 دقائق عند 10000 × غرام عند 4 درجات مئوية لتكوير أي حطام. يتم استخدام الطافي الناتج للطباعة اللاحقة.
5. طباعة ميكروأري
- قم بإعداد تخفيف 1:20 (v / v) للحبر الهندي الأسود / حبر السحب في المخزن المؤقت لنظام الجلسرين (GSB ؛ الجمع بين 47٪ جلسرين ، 52.9٪ dH2O ، 0.06٪ Triton X-100 ، و 0.04٪ مبيد حيوي [0.15٪ -0.17٪ نترات نحاسية و 1.4٪ -2.0٪ نترات المغنيسيوم في الماء] وتعقيم المرشح) (انظر جدول المواد) وأجهزة الطرد المركزي لمدة 10 دقائق عند 15000 × جم (درجة حرارة الغرفة).
ملاحظة: يعد محلول الحبر ضروريا لإنشاء حد علوي وسفلي حول العينات المطبوعة ، بحيث يمكن اكتشاف المصفوفات الدقيقة المطبوعة بصريا على الغشاء. ومع ذلك ، من المحتمل أن يحتوي محلول الحبر على رواسب. يجب أن تكون جميع المحاليل خالية من الجسيمات للطباعة ، لذا تجنب إزعاج الرواسب عند سحب الماصة. تخلص من المنتج الطازج وتحضيره عندما لا يكون ذلك ممكنا. لا يمكن ترشيح المحلول بسهولة لإزالة الجسيمات. - أضف 40 ميكرولتر من محلول الحبر و GSB إلى القسم الأول من أول لوحة 384 بئر (الشكل 2).
- أضف 25 ميكرولتر من GSB إلى جميع آبار التخفيف 1 (D1). أضف 40 ميكرولتر من GSB إلى جميع آبار التخفيف 2 و 3 و 4 (D2-D4).
- قم بتخفيف عينات الجليكان المستخرجة وركائز الجليكان المحددة 1: 1 (v / v) باستخدام GSB عن طريق إضافة 25 ميكرولتر من عينة الجليكان المستخرجة إلى آبار D1 بالترتيب.
- قم بتخفيف كل عينة بشكل متسلسل أربع مرات عن طريق أخذ 10 ميكرولتر من العينة من بئر D1 وإضافتها إلى بئر D2. نضح بلطف مع ماصة لخلط.
- كرر العملية عن طريق أخذ 10 ميكرولتر من العينة من بئر D2 وإضافتها إلى بئر D3.
- كرر لبئر D4. بعد الخلط ، تخلص من 10 ميكرولتر من بئر D4 بحيث يحتوي كل بئر على حجم نهائي يبلغ 40 ميكرولتر.
- أضف 40 ميكرولتر من محلول الحبر وGSB إلى الكتلة النهائية للوحة النهائية.
- قم بتغطية الألواح بغطاء لاصق وجهاز طرد مركزي لمدة 10 دقائق عند 3000 × جم (درجة حرارة الغرفة). تأكد من عدم بقاء فقاعات بعد الطرد المركزي وكرر إذا لزم الأمر.
- باستخدام روبوت طباعة ميكروأري كهرضغطية غير متصل ، اطبع العينات على غشاء النيتروسليلوز (انظر جدول المواد) باتباع الخطوات أدناه.
ملاحظة: فيما يلي الإجراءات الموصى بها للحصول على جودة طباعة مثالية ؛ ومع ذلك ، فإن المعلمات المحددة المطلوبة ستعتمد في النهاية على الأداة المستخدمة. ننصح المستخدمين بالاتصال بالشركة المصنعة للجهاز لمناقشة التخصيصات المناسبة وإعدادات الطباعة المطلوبة لأجهزتهم.- قبل الطباعة ، أفرغ خزان النفايات العازل واملأ الخزان العازل النظيف ب GSB نظيف ، حسب الضرورة. قم بتشغيل الجهاز واتركه يستقر لمدة >10 دقائق إذا كان يحتوي على نظام متكامل للتحكم في الرطوبة ودرجة الحرارة. قم بتشغيل microarrayer وتهيئة النظام.
ملاحظة: يوصى بإجراء اختبار لتحديد الضغط الداخلي للأداة. إذا كان الضغط منخفضا جدا ، فقد يكون من الضروري إجراء تطهير عالي الضغط. مرة أخرى ، اتصل بالشركة المصنعة للأداة لمناقشة التشغيل المحدد للأداة المحددة. - قم بتطهير رأس الطباعة والشعيرات الدموية عدة مرات باستخدام GSB لإزالة الحطام والملوثات المحتملة. قم بإجراء اختبار طباعة إما عن طريق تحميل لوحة من GSB وحدها أو إعداد الجهاز للطباعة من الخزان المؤقت النظيف مباشرة ، وتجاوز شفط العينة من لوحة محملة.
ملاحظة: ليس من الضروري إجراء اختبار الطباعة باستخدام غشاء النيتروسليلوز. تعد شرائح المجهر النظيف كافية وتوفر ميزة أنه يمكن تقييم حجم البقعة وشكلها وجودتها بصريا قبل طباعة العينة. - عند طباعة عينات الجليكان المستخرجة ، قم ببرمجة النظام للشطف باستخدام GSB نظيف بين كل عينة.
ملاحظة: عادة ما يكون حجم العينة لكل بقعة مطبوعة من 100 مل إلى 10 نانولتر، ويتراوح حجم البقعة من 20 ميكرومتر إلى 100 ميكرومتر، اعتمادا على حجم العينة المحدد. تستغرق طباعة 100 صفيف دقيق من مصدر واحد لوحة 384 بئرا حوالي 40 دقيقة ، بما في ذلك شطف النظام. سيكون حجم المصفوفات الدقيقة الناتجة حوالي 1 سم2 . ستزيد اللوحات الإضافية من طول الصفيف بحوالي 1 سم لكل لوحة. يظهر رسم تخطيطي لتصميم microarray المطبوع في الشكل 3. بمجرد طباعتها ، تكون المصفوفات الدقيقة جاهزة للاستخدام على الفور ويمكن تخزينها لعدة سنوات. في حالة الحاجة إلى تكرار مهمة الطباعة لأي سبب من الأسباب ، بسبب التبخر المحتمل للعينات أثناء الطباعة ، يوصى بتحميل لوحة عينة جديدة والتخلص من اللوحة الأصلية. - مرة واحدة في الأسبوع ، قم بتنظيف رأس الطباعة والشعيرات الدموية جيدا. قم بذلك عن طريق تحميل 384 بئرا تحتوي على تخفيف 1:20 من NaOH المركز في GSB وإجراء طباعة من 40 دقيقة إلى 1 ساعة على شرائح المجهر. يجب على المستخدمين التأكد من أن حل التنظيف هذا متوافق مع أجهزتهم قبل المتابعة.
- قبل الطباعة ، أفرغ خزان النفايات العازل واملأ الخزان العازل النظيف ب GSB نظيف ، حسب الضرورة. قم بتشغيل الجهاز واتركه يستقر لمدة >10 دقائق إذا كان يحتوي على نظام متكامل للتحكم في الرطوبة ودرجة الحرارة. قم بتشغيل microarrayer وتهيئة النظام.
- احفظ ملف الشبكة الفريد (ملف .gal) الذي تم إنتاجه للمصفوفة الدقيقة المطبوعة الجاهزة للتحليل النهائي.
6. فحص ميكروأري
- اقطع المصفوفات الدقيقة المطبوعة الفردية والمتطابقة من غشاء النيتروسليلوز وضعها في وعاء بحجم مناسب للفحص (على سبيل المثال ، صفيحة عيار 12 أو 24 بئرا) (انظر جدول المواد). يجب أن تكون المصفوفة مسطحة على قاعدة الوعاء. مطلوب ميكروأري واحد لكل مسبار ويمثل نسخة تقنية واحدة.
- لتقليل الارتباط غير النوعي ، احتضان المصفوفات الدقيقة لمدة 1 ساعة في المخزن المؤقت المانع MP-TBST (1x محلول ملحي مخزن Tris ، درجة الحموضة 7.5 ، + 0.1٪ [v / v] TWEEN 20 [TBST] وتستكمل ب 5٪ [w / v] مسحوق الحليب منزوع الدسم ؛ انظر جدول المواد) على شاكر دوار / هزاز. تأكد من أن وحدة التخزين كافية لغمر الصفيف بأكمله.
- بعد الحضانة ، قم بإزالة MP-TBST واستبدله بحجم جديد من MP-TBST.
- احتضان المصفوفات بأجسام مضادة وحيدة النسيلة (mAbs) أو CBMs الموسومة به ، أو غيرها من GRMPs (على سبيل المثال ، المحاضرات) ، مخففة 1: 10-1: 1,000 (كما هو محدد من قبل الشركة المصنعة ؛ انظر جدول المواد) في MP-TBST لمدة 2 ساعة على شاكر دوار / هزاز.
- بعد الحضانة ، قم بإزالة محلول المسبار الجزيئي وقم بتغطية المصفوفات في TBST نظيفة ، مما يضمن غمر المصفوفات بالكامل. لإزالة محلول المسبار المتبقي ، قم بإزالة TBST على الفور واستبدله بوحدة تخزين جديدة. ضع المصفوفات على شاكر دوار / هزاز لمدة 5 دقائق. بعد 5 دقائق ، قم بإزالة TBST ، واستبدله بكمية جديدة ، وضعه على شاكر دوار / هزاز لمدة 5 دقائق.
ملاحظة: يجب تكرار هذه العملية ثلاث مرات ، لا تشمل الإضافة الأولية والإزالة الفورية ل TBST. - احتضان المصفوفات بأجسام مضادة ثانوية مترافقة من الفوسفاتيز القلوي (مضاد للفأر ، مضاد للفئران ، مضاد للأرانب ، مضاد لهيس ، حسب الاقتضاء ؛ انظر جدول المواد) مخفف 1: 1000 في MP-TBST لمدة 2 ساعة على شاكر هزاز / دوار.
ملاحظة: الأجسام المضادة الثانوية المترافقة بالفجل البيروكسيديز مناسبة أيضا ، وتستخدم جنبا إلى جنب مع رباعي ميثيل البنزيدين (TMB) / ركيزة بيروكسيد الهيدروجين لتطوير اللون. - بعد الحضانة ، كرر إجراء الغسيل ، وفقا للخطوة 6.5 ، لإزالة الأجسام المضادة الثانوية غير المرتبطة على وجه التحديد.
- قم بتغطية المصفوفات في محلول تطوير ألوان نيترو بلو تيترازوليوم (NBT) / 5-برومو-4-كلورو-3-إندوليل-فوسفات (BCIP) (انظر جدول المواد) للكشف الكروموجيني عن ارتباط الأجسام المضادة. اتركيه حتى تظهر بقع راسبة أرجوانية في مواقع ارتباط المستضد (عادة 5-30 دقيقة ، ولكن يجب مراقبة المصفوفات عن كثب لتجنب التشبع الزائد ، حيث يمكن أن يحدث التفاعل بسرعة).
تنبيه: BCIP ضار عند ملامسته للجلد وقد يسبب تهيج الجهاز التنفسي. استخدم معدات الوقاية الشخصية. تجنب تكون الغبار. تجنب استنشاق الغبار. - لإنهاء التفاعل ، اغمر المصفوفات في ماء الصنبور النظيف واغسلها على نطاق واسع.
- ضع المصفوفات بين الورق النشاف طوال الليل في درجة حرارة الغرفة حتى تجف.
- تخلص من المصفوفات ذات العيوب الواضحة وكرر بروتوكول الفحص في مثل هذه الحالات (الشكل 4).
7. التحليل والقياس الكمي
- امسح المصفوفات المطورة ضوئيا بدقة 2400 نقطة في البوصة (dpi) باستخدام ماسح ضوئي لسطح المكتب. تحويل الصور إلى ملفات TIFF ثم إلى سلبيات.
- باستخدام برنامج تحليل microarray (انظر جدول المواد) ، قم بتراكب ملف شبكة .gal الفريد على كل صورة microarray لحساب كثافة لون البقعة المنتجة في كل موقع ربط مستضد وطرح الخلفية المحلية.
- تصدير بيانات الشبكة كملف .txt. يمكن بعد ذلك استيرادها يدويا إلى ورقة Excel لتحليلها.
- قم بإنشاء قيمة متوسطة لشدة إشارة البقعة لكل عينة عن طريق حساب متوسط شدة البقعة أولا عبر كل تخفيف للعينة ثم عبر أي مكررات بيولوجية مضمنة.
- قم بتعيين قيمة 100 لأعلى متوسط كثافة إشارة موضعية وقم بتطبيع البيانات المتبقية وفقا لذلك.
ملاحظة: يمكن بعد ذلك تقديم متوسط شدة إشارة البقعة المعيارية كخريطة حرارية لوفرة حاتمة الجليكان النسبية باستخدام وظيفة التنسيق الشرطي في Excel33 ، أو باستخدام الدالة geom_tile في حزمة R ggplot240,41.
النتائج
تم تطبيق MAPP لتحديد تكوين الجليكان لنفايات الكتلة الحيوية الزراعية ، والتي تضم قشور المانجو من العديد من الأصناف التايلاندية الشمالية ، ولب الكرز Coffea arabica ونفايات معالجة حبوب البن ، وأنسجة الجذر والساق والأوراق من الثوم الأسود التايلاندي ، Allium sativum var. ophioscorodon. تستخدم العديد من السكريات المشتقة من النباتات في صناعة المواد الغذائية كمكونات وظيفية42,43. وبالتالي ، كان الهدف من هذه التجربة هو استنتاج ما إذا كانت مواد النفايات الزراعية الصناعية الوفيرة وغير المستغلة حاليا قد توفر مصدرا للسكريات النقية ذات القيمة المضافة.
يتم استخدام مادة AIR بشكل روتيني لإعداد العينات المخصصة لتحليل الجليكان44. هناك العديد من المزايا لاستخدام AIR. تعمل المعالجة بالمذيبات على إزالة CAZymes الداخلية والمستقلبات والسكريات الصغيرة والدهون والأصباغ بشكل فعال ، مما ينتج عنه عينات غنية بالسكريات والبروتينات الهيكلية34. علاوة على ذلك ، يعد إنتاج AIR طريقة سريعة وفعالة لزيادة طول عمر العينة ، حيث إنه قابل للحرارة ويمكن تخزينه لعدة سنوات.
تم استخراج ثلاثة أجزاء مختلطة من الجليكان المكون بالتتابع من مادة AIR النباتية باستخدام CDTA و NaOH والسليولاز. مخلب CDTA أيونات الكالسيوم2+ ، والتي تسمح بإزالة البكتين المتشابك Ca2+ من جدران الخلايا النباتية45. تسمح الظروف القلوية بإطلاق الهيميسيلولوز في الغالب ، مثل المنان والزيلان و β جلوكان ، بسبب اضطراب الترابط الهيدروجيني وتصبن روابط الإستر بين الألياف الدقيقة السليلوز والهيميسيلولوز ، واللجنين والهيميسيلولوز ، على التوالي46. تم استخدام endo-1،4-β-glucanase المؤتلف من Bacillus spp. لتحلل المناطق غير المتبلورة من الألياف الدقيقة السليلوز الهيكلية ، وإطلاق الجليكان المتبقي المرتبط بالسليلوز داخل جدران الخلايا47. على الرغم من أن هذه الطريقة تفصل الجليكان بشكل فعال إلى هذه المجموعات الثلاث الواسعة ، تجدر الإشارة إلى أن العينات ليست نقية. بحكم طبيعة طريقة الاستخراج ، فإن الهيميسيلولوز ، إذا كان موجودا في العينة ، سيتم استخراجه حتما واكتشافه لاحقا بدرجات متفاوتة في كسور CDTA والسليولاز. وبالمثل ، سيتم اكتشاف بعض البكتين في استخراج NaOH إذا كان موجودا في العينة.
تم استخدام روبوت طباعة ميكروأري غير متصل وكهرضغطية لشل حركة أجزاء الجليكان المستخرجة على النيتروسليلوز عبر المرفق غير التساهمي11 ، لتشكيل 300 مصفوفة دقيقة متطابقة. كما تم تضمين معايير الجليكان المحددة (الجدول 1) في المصفوفات الدقيقة المطبوعة كعناصر تحكم موجبة (الشكل 5). يتوافق ملف تعريف ربط MAPP الذي تم الحصول عليه لمعايير الجليكان المحددة مع خصوصيات الخاتمة التي تم الإبلاغ عنها مسبقا. على سبيل المثال ، أظهر LM21 ارتباطا قويا بمتعددات السكاريد متعددة (galactomannan و glucomannan) ، بينما أظهر LM22 ارتباطا ضعيفا فقط بالجالاكتومانان25. وبالمثل ، فإن LM19 مرتبط بشكل تفضيلي ب homogalacturonan48 منزوع الأسترة و LM15 مرتبط ببذور التمر الهندي xyloglucan23.
تم الكشف عن الوفرة النسبية ل 16 حاتمة ، تشخيص عديد السكاريد ذات جدار الخلية النباتية غير السليلوزية ، من خلال ارتباط الأجسام المضادة وحيدة النسيلة الموجهة بالجليكان (الجدول 2) بالمستخلصات المطبوعة (الشكل 6). تم الكشف عن غالبية الجليكان المستخرج ضمن جزء NaOH القلوي. تم تسجيل إشارات ربط قوية ل mAbs LM10 و LM11 ، تمثل زيلان / أرابينوكسيلان ، داخل قشور جميع أصناف المانجو التي تم اختبارها. ضمن عينات الثوم ، يرتبط LM10 و LM11 بشكل تفضيلي بمستخلص أنسجة الجذر (Garlic R) ويظهران ارتباطا ضعيفا فقط بمستخلص أنسجة الأوراق (Garlic L). LM19 ، الذي يمثل جزئيا ميثيل أسترة أو غير أسترة homogalacturonan ، مرتبط بقوة ببعض مستخلصات أصناف المانجو (Aokrong و Talabnak) ، ولكنه مرتبط بشكل ضعيف فقط ، أو كان ارتباطه غير قابل للكشف ، في أصناف أخرى (Chokanan ، Mamkamdang ، Mahachanok ، و Nga). بالإضافة إلى ذلك ، يرتبط LM19 فقط بكسور لب البن ولا يرتبط بمواد نفايات معالجة حبوب البن ، التي كان يعتقد سابقا أنها تتكون من بكتين البن شبه المنقى (بيانات غير منشورة).
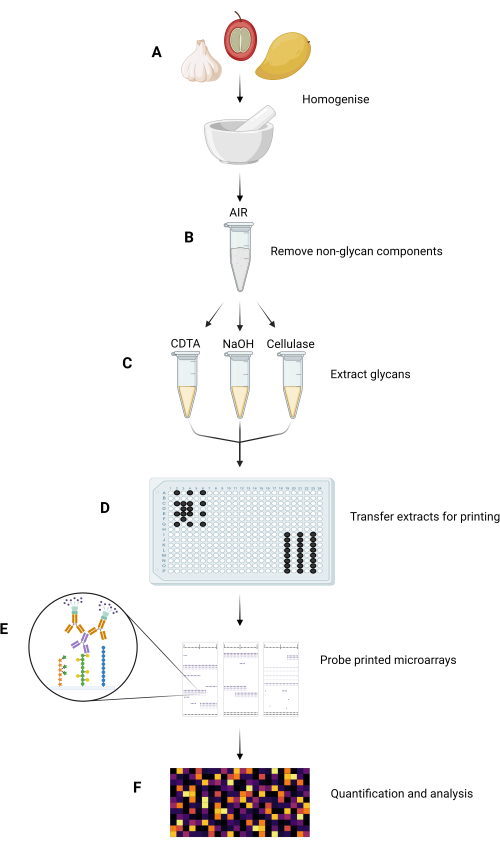
الشكل 1: الخطوات التجريبية الرئيسية في طريقة MAPP. (أ) تجانس العينات لتكوين مساحيق دقيقة. (ب) تعالج العينات المتجانسة لعزل AIRs الخاصة بها. (ج) يتم استخلاص الجليكان المكون بالتتابع باستخدام نظام استخلاص مخصص. (د) تنقل كسور الجليكان المستخرجة والحبر وGSB إلى 384 صفيحة بئر، وفقا لتخطيط اللوحة، لطباعتها على النيتروسليلوز. (ه) يتم فحص المصفوفات الدقيقة المطبوعة باستخدام GRMPs مختارة. (F) يتم تحديد ارتباط GRMP بكسور الجليكان المطبوعة وتحليلها قبل تقديم البيانات كخريطة حرارية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
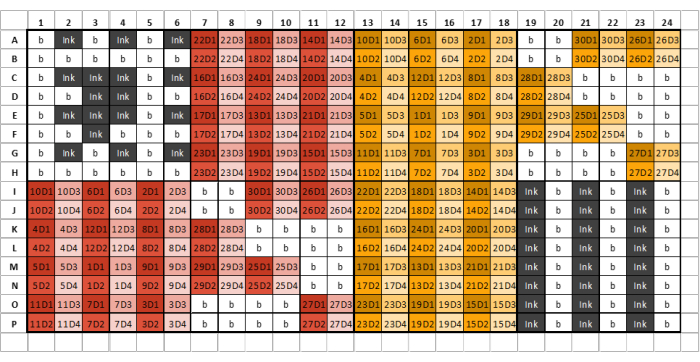
الشكل 2: مثال على تخطيط لوحة 384 بئرا لتحميل العينة والحبر و GSB مع أربعة تخفيفات لكل عينة / معيار جليكان مستخرج. تشير الألوان المختلفة إلى العينات الناشئة عن كواشف الاستخراج المختلفة ، بينما تمثل الظلال المختلفة التخفيفات التسلسلية. يمثل الرقم الأول في الكود رقم العينة ، بينما يمثل رقم النهاية رقم التخفيف (يشير D1 إلى التخفيف واحد ، ويشير D2 إلى التخفيف اثنين ، وهكذا). على سبيل المثال ، يمثل المسمى جيدا "12D3" عينة الجليكان 12 ، والتخفيف ثلاثة. يجب تقسيم لوحات البئر إلى ثمانية أقسام متطابقة تتكون من ستة أعمدة وثمانية صفوف. يجب أن يحتوي القسم الأول من اللوحة الأولى على الحبر والمخزن المؤقت فقط ويشبه تخطيط اللوحة المثالي. يمكن بعد ذلك تحميل عينات الجليكان المستخرجة في أقسام اللوحة اللاحقة وفقا لتخطيط اللوحة. لا ينبغي تحميل كواشف الاستخراج المختلفة في نفس قسم اللوحة. إذا لم تكن هناك عينات كافية لملء قسم كامل ، فقم بملء جميع الآبار المتبقية في هذا القسم بمخزن مؤقت ؛ لا تترك أي آبار فارغة. إذا كانت هناك حاجة إلى لوحات متعددة ، فيجب أن يحتوي القسم التالي بعد تحميل جميع العينات على ثلاثة أعمدة متناوبة من الحبر و GSB - قد لا يكون هذا هو القسم الثامن ، اعتمادا على عدد العينات التي تتم طباعتها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
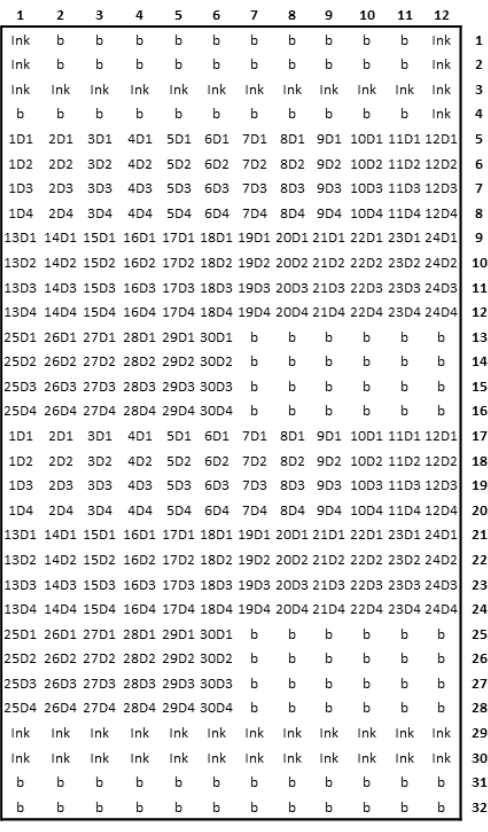
الشكل 3: تمثيل تخطيطي لتصميم المصفوفات الدقيقة المطبوعة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
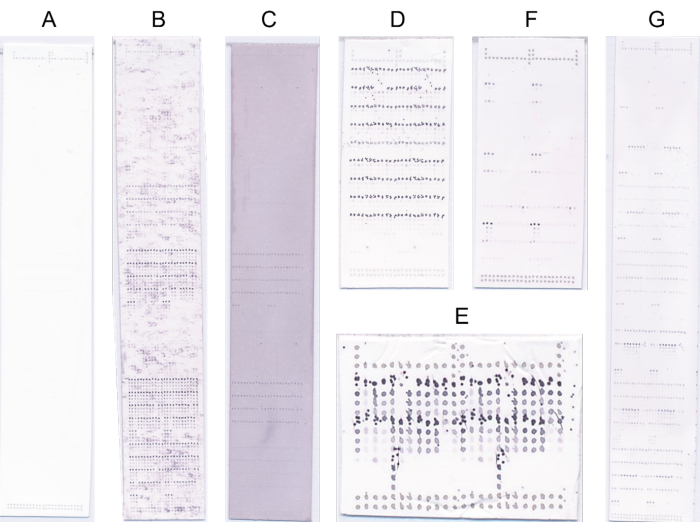
الشكل 4: المصفوفات الدقيقة التمثيلية. (أ) غير ملزم. ( ب) إشارة الربط محجوبة بإشارة خلفية عالية. (ج) تلطيخ أزرق / أرجواني معمم بسبب التشبع الزائد مع NBT / BCIP. د: الفحص المعيب بسبب ارتفاع تركيز الركيزة. ( ه) الطباعة المعيبة بسبب رأس الطباعة غير النظيف. (و) ملزمة قوية لعدد قليل من العينات. (ز) ملزمة قوية للعديد من العينات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
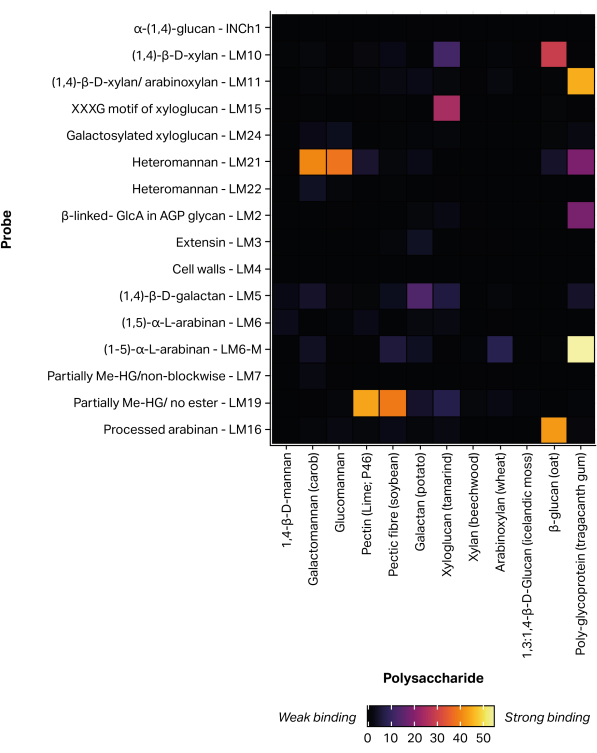
الشكل 5: ارتباط الأجسام المضادة وحيدة النسيلة بمعايير الجليكان المحددة ، مضمن للتحقق من صحة عملية الطباعة والفحص. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
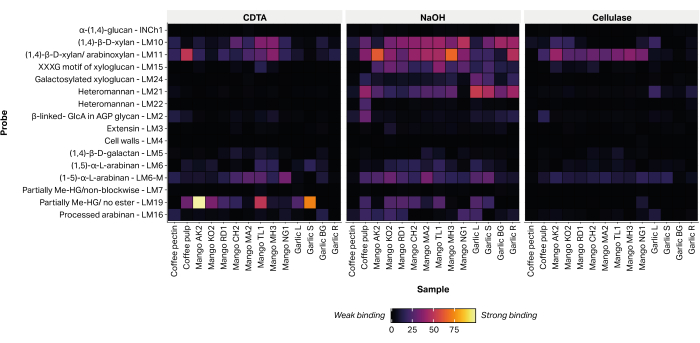
الشكل 6: MAPP من الجليكان المستخرج من نفايات الكتلة الحيوية الزراعية. تشمل العينات نفايات لب البن (لب البن وبكتين البن) ، وقشور المانجو من عدة أصناف تايلاندية (AO ، Aokrong. كو ، كام ؛ RD ، راد ؛ CH ، تشوكانان. ماجستير ، مامكامدانغ ؛ TL ، تالابناك ؛ MH ، ماهاتشانوك ؛ NG ، Nga) وأوراق الثوم الأسود (الثوم L) ، الساق (الثوم S) ، البصلة (الثوم BG) ، والجذور (الثوم R) ، باستخدام CDTA ، هيدروكسيد الصوديوم ، والسليولاز (Bacillus spp. cellulase 5A). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: معايير عديد السكاريد التجارية المحددة المستخدمة في تحليل MAPP كضوابط إيجابية. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: الأجسام المضادة وحيدة النسيلة الموجهة للجليكان المختارة لاستجواب المصفوفات الدقيقة للجليكان النباتية المستخرجة. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
تقنية MAPP الموصوفة هنا هي الآن طريقة راسخة لتحليل الجليكان. تم وصف المبادئ الأساسية لأول مرة في 200711 ، لكن التقنية خضعت للتطوير المستمر من أجل الاستفادة من أحدث الابتكارات في تقنية microarray ، وتطوير المسبار الجزيئي ، والتقدم في فهمنا للكيمياء الحيوية للجليكان. بشكل عام ، يعد تحليل الجليكان ، وخاصة السكريات ، أكثر صعوبة من البروتينات والنيوكليوتيدات بسبب تعقيدها الهيكلي وعدم تجانسها45 ، فضلا عن حقيقة أنه لا يمكن تسلسلها أو تصنيعها بسهولة1. في كثير من الحالات ، لا يمكن لتقنية واحدة فك تشفير تعقيد الجليكان بشكل قاطع. وبالتالي ، غالبا ما يتم استخدام MAPP مع طرق أخرى. هذا هو أحد أسباب اختيار إعداد AIR عادة كنقطة انطلاق ل MAPP ، نظرا لأن AIR متوافق مع معظم طرق تحليل glycan الأخرى34 ، مما يسهل المقارنة اللاحقة لمجموعات البيانات.
بسبب تجانس العينة قبل إعداد AIR ، يتم فقدان بعض المعلومات المكانية دائما. ومع ذلك ، نظرا لأن السكريات يتم إطلاقها بالتتابع من العينات ، فإن وجود الحواتم في الكسور التي تم الحصول عليها يوفر معلومات حول البنية الجزيئية وتكوين تلك العينة17. وبالتالي ، فإن اختيار نظام استخراج مناسب أمر بالغ الأهمية لنجاح الطريقة. تحدد المعلمات المتعددة مدى ملاءمة طريقة الاستخراج: التركيب الخلوي ، والوقت ، ودرجة الحرارة ، ودرجة الحموضة ، والضغط ، والقوة الأيونية للمذيب ، ودقة عينة الجسيمات الصلبة49. يوصى باستخدام مجموعة من المذيبات الأكثر عدوانية بشكل متزايد لزيادة احتمالية استخراج الجليكان المكون بنجاح وبناء صورة تركيبية تمثيلية للعينة. بالنسبة لمعظم العينات ، تكون CDTA و NaOH و cellulase كافية لإزالة التخزين المشتق من النبات والسكريات ذات الجدار الخلوي33،50،51،52. بالنسبة لبعض عينات الأنسجة ، ثبت أن نظام الاستخراج الهجين الذي يتضمن أيضا CaCl2 و HCl و Na2CO3 ناجح53 ، بينما قد تتطلب عينات الطحالب الدقيقة البحرية إضافة حمض الإيثيلين ديامينيترايتيك (EDTA) 10.
يجب أن تتضمن المصفوفات الدقيقة مجموعة من معايير الجليكان النقية والمحددة لاستخدامها كعناصر تحكم إيجابية5. يجب تعديل المعايير المدرجة وفقا لطبيعة العينة. بمجرد طباعتها ، يجب اختيار GRMPs المناسبة. إن توليد الورم الهجين mAbs إلى هياكل السكاريد يمثل تحديا54. يصعب رفع الأجسام المضادة المرتبطة بالجليكان ويمكن أن يكون لها تقارب منخفض55. لحسن الحظ ، يمكن الحصول على معلومات تسلسل الجينات ل CBMs بسهولة نسبية للتعبير المؤتلف4 وهندسة خصائص ارتباطها56,57. في حين تم تطوير كتالوج مثير للإعجاب من GRMPs ، مع توفر معظمها الآن من مصادر تجارية ، بالنسبة لتنوع هياكل الجليكان الموجودة في الطبيعة ، تم إنتاج نسبة صغيرة فقط وتميزها بنجاح58. هذا يمكن أن يحد من القدرة على اكتشاف والتمييز بين هياكل معينة. ينصح بإجراء تجربة فحص أولية باستخدام واحد أو اثنين من المجسات الممثلة لكل بنية جليكان رئيسية من المتوقع أن تكون موجودة ، والتي تتميز خصوصية الارتباط بها بشكل جيد. في تجارب التحقيق اللاحقة ، يمكن توسيع قائمة المسبار لتغطية مجموعة أوسع من الجليكان والتعمق في الهياكل الدقيقة.
على الرغم من كونها عادية ، إلا أن ضمان غسل المصفوفات الدقيقة جيدا بعد كل خطوة حضانة أمر أساسي لنجاح إجراء الفحص. من المحتمل أن تؤدي الإزالة غير الفعالة للمجسات غير المرتبطة على وجه التحديد إلى حجب النتيجة عن طريق التسبب في إشارة خلفية عالية بعد تطور اللون. في هذه الحالة ، من الضروري تكرار إجراء الفحص ، بدءا من مصفوفة دقيقة جديدة. علاوة على ذلك ، يجب لمس المصفوفات باعتدال وفقط عن طريق إمساك الحواف بالملقط ؛ غشاء النيتروسليلوز هش ويتلف بسهولة. يتجمع حل تطوير الألوان في الشقوق والتجاعيد ، مما يتسبب في التشبع الزائد ، مما يعيق تحليل المصفوفة.
MAPP سريع وقابل للتكيف ومريح. تتوافق هذه الطريقة مع الجليكان الحيواني أو الميكروبي أو النباتي المشتق من أي نظام بيولوجي أو صناعي ، طالما يمكن استخراجها وشل حركتها على النيتروسليلوز ، والتي يمتلك المرء مجسات جزيئية مناسبة لها. توفر البيانات التي تم إنشاؤها رؤية تفصيلية وشبه كمية وتركيبية ، والتي لا يمكن الحصول عليها بسهولة عبر طرق تحليل الجليكان الأخرى.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
يود المؤلفون أن يشكروا ArrayJet على مشورة الخبراء فيما يتعلق بروبوتات microarray . تود SS و JS الاعتراف بالدعم المقدم من الصندوق الأساسي 2022 (FF65 / 004) ، جامعة شيانغ ماي.
Materials
| Name | Company | Catalog Number | Comments |
| 1,3:1,4-β-D-Glucan, Lichenan (icelandic moss) | Megazyme | P-LICHN | |
| 1,4-β-D-Mannan | Megazyme | P-MANCB | |
| 384-well microtiter plate | Greiner Bio-One | M1686 | |
| 5-bromo-4-chloro-3-indolyl-phosphate (BCIP) | Melford | B74100-1.0 | |
| Acetone | Sigma | 270725 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 115-055-003 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Rat IgG (H+L) | Jackson ImmunoResearch | 112-055-003 | |
| Alkaline Phosphatase AffiniPure Rabbit Anti-His Tag | Jackson ImmunoResearch | 300-055-240 | |
| Arabinoxylan (wheat) | Megazyme | P-WAXYL | |
| Array-Pro Analyzer Software | Media Cybernetics | Version 6.3 | |
| Bacillus sp. Cellulase 5A (BCel5A) | NZYTech | CZ0564 | |
| BAM antibodies | SeaProbes | Various | |
| Black drawing ink (indian ink) | Winsor & Newton | GWD030 | |
| Carbohydrate binding modules | NZYTech | Various | |
| CCRC antibodies | CarboSource | Various | |
| CDTA | Sigma | 319945 | |
| Chloroform | Sigma | PHR1552 | |
| Ethanol | Sigma | 1.11727 | |
| Galactan (potato) | Megazyme | P-GALPOT | |
| Galactomannan (carob) | Megazyme | P-GALML | |
| Glycerol solution | Sigma | 49781-5L | |
| Gum tragacanth (legumes) | Sigma-Aldrich | G1128 | |
| INCh antibodies | INRA | Various | |
| LM and JIM antibodies | PlantProbes | Various | |
| Marathon Argus Microarray Printer | ArrayJet | ||
| Methanol | Sigma | 34860 | |
| Monoclonal antibodies | Biosupplies Australia | Various | |
| NaBH4 | Sigma | 452882 | |
| NaOH | Sigma | S5881 | |
| Nitro-blue tetrazolium (NBT) | Melford | N66000-1.0 | |
| Nitrocellulose membrane | Thermo Fisher Scientific | 88018 | |
| Pectin (degree of methyl esterification 46%) | Danisco | NA | |
| ProClin 200 | Sigma | 48171-U | |
| Rhamnogalacturonan (soybean pectic fibre) | Megazyme | P-RHAGN | |
| Rotating mixer | Fisher Scientific | 88-861-050 | |
| Rotating/rocking Shaker | Cole-Parmer | ||
| Skimmed milk powder | Marvel | ||
| Spin filter | Costar Spin-X | 8160 | |
| Stainless steel beads | Qiagen | 69989 | |
| TissueLyser II | Qiagen | 85300 | |
| Tris | Sigma | 93362 | |
| Triton X-100 | Sigma | T8787-250ML | |
| Tween 20 | Sigma | P9416-100ML | |
| Xylan (beechwood) | Megazyme | P-XYLNBE | |
| Xyloglucan (tamarind) | Megazyme | P-XYGLN | |
| β-Glucan (oat) | Megazyme | P-BGOM |
References
- Amicucci, M. J., et al. A nonenzymatic method for cleaving polysaccharides to yield oligosaccharides for structural analysis. Nature Communications. 11 (1), 3963 (2020).
- Gagneux, P., Panin, V., Hennet, T., Aebi, M., Varki, A. Evolution of glycan diversity. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Willats, W. G. T., McCartney, L., Knox, J. P. Pectin cell biology: complexity in context. Advances in Pectin and Pectinase Research. , 147-157 (2003).
- Cummings, R. D., et al. Glycan-recognizing probes as tools. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Bakshani, C. R., et al. Analysis of glycans in a Burnt-on/Baked-on (BoBo) model food soil using Microarray Polymer Profiling (MAPP) and immunofluorescence microscopy. Food Chemistry. 410, 135379 (2023).
- Salmeán, A. A., Willats, W. G. T., Ribeiro, S., Andersen, T. J., Ellegaard, M. Over 100-year preservation and temporal fluctuations of cell wall polysaccharides in marine sediments. Frontiers in Plant Science. 13, 785902 (2022).
- Cid, M., et al. Recognition of the helical structure of β-1,4-galactan by a new family of carbohydrate-binding modules. Journal of Biological Chemistry. 285 (46), 35999-36009 (2010).
- Runavot, J. -. L., et al. Non-cellulosic polysaccharides from cotton fibre are differently impacted by textile processing. PLoS One. 9 (12), e115150 (2014).
- Ahl, L. I., et al. Analyses of aloe polysaccharides using carbohydrate microarray profiling. Journal of AOAC International. 101 (6), 1720-1728 (2018).
- Vidal-Melgosa, S., et al. Diatom fucan polysaccharide precipitates carbon during algal blooms. Nature Communications. 12 (1), 1150 (2021).
- Moller, I., et al. High-throughput mapping of cell-wall polymers within and between plants using novel microarrays. The Plant Journal. 50 (6), 1118-1128 (2007).
- Ruprecht, C., et al. A synthetic glycan microarray enables epitope mapping of plant cell wall glycan-directed antibodies. Plant Physiology. 175 (3), 1094-1104 (2017).
- Cummings, R. D., et al. Principles of glycan recognition. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Gao, C., et al. Glycan microarrays as chemical tools for identifying glycan recognition by immune proteins. Frontiers in Chemistry. 7, 833 (2019).
- Vidal-Melgosa, S., et al. A new versatile microarray-based method for high throughput screening of carbohydrate-active enzymes. Journal of Biological Chemistry. 290 (14), 9020-9036 (2015).
- Willats, W. G. T., Rasmussen, S. E., Kristensen, T., Mikkelsen, J. D., Knox, J. P. Sugar-coated microarrays: A novel slide surface for the high-throughput analysis of glycans. Proteomics. 2 (12), 1666-1671 (2002).
- Sørensen, I., et al. The charophycean green algae provide insights into the early origins of plant cell walls. The Plant Journal. 68 (2), 201-211 (2011).
- Liu, D., Tang, W., Yin, J. -. Y., Nie, S. -. P., Xie, M. -. Y. Monosaccharide composition analysis of polysaccharides from natural sources: Hydrolysis condition and detection method development. Food Hydrocolloids. 116, 106641 (2021).
- Pattathil, S., et al. A comprehensive toolkit of plant cell wall glycan-directed monoclonal antibodies. Plant Physiology. 153 (2), 514-525 (2010).
- Verhertbruggen, Y., et al. Developmental complexity of arabinan polysaccharides and their processing in plant cell walls. The Plant Journal. 59 (3), 413-425 (2009).
- Rydahl, M. G., et al. Development of novel monoclonal antibodies against starch and ulvan - implications for antibody production against polysaccharides with limited immunogenicity. Scientific Reports. 7 (1), 9326 (2017).
- McCartney, L., Marcus, S. E., Knox, J. P. Monoclonal antibodies to plant cell wall xylans and arabinoxylans. The Journal of Histochemistry and Cytochemistry. 53 (4), 543-546 (2005).
- Marcus, S. E., et al. Pectic homogalacturonan masks abundant sets of xyloglucan epitopes in plant cell walls. BMC Plant Biology. 8, 60 (2008).
- Pedersen, H. L., et al. Versatile high resolution oligosaccharide microarrays for plant glycobiology and cell wall research. The Journal of Biological Chemistry. 287 (47), 39429-39438 (2012).
- Marcus, S. E., et al. Restricted access of proteins to mannan polysaccharides in intact plant cell walls. The Plant Journal. 64 (2), 191-203 (2010).
- Smallwood, M., Martin, H., Knox, J. P. An epitope of rice threonine-and hydroxyproline-rich glycoprotein is common to cell wall and hydrophobic plasma-membrane glycoproteins. Planta. 196 (3), 510-522 (1995).
- Smallwood, M., Yates, E. A., Willats, W. G. T., Martin, H., Knox, J. P. Immunochemical comparison of membrane-associated and secreted arabinogalactan-proteins in rice and carrot. Planta. 198 (3), 452-459 (1996).
- Wisniewski, J. P., Rathbun, E. A., Knox, J. P., Brewin, N. J. Involvement of diamine oxidase and peroxidase in insolubilization of the extracellular matrix: implications for pea nodule initiation by Rhizobium leguminosarum. Molecular Plant-Microbe Interactions. 13 (4), 413-420 (2000).
- Jones, L., Seymour, G. B., Knox, J. P. Localization of pectic galactan in tomato cell walls using a monoclonal antibody specific to (1[->]4)-β-D-galactan. Plant Physiology. 113 (4), 1405-1412 (1997).
- Willats, W. G., Marcus, S. E., Knox, J. P. Generation of a monoclonal antibody specific to (1→5)-α-L-arabinan. Carbohydrate Research. 308 (15), 149-152 (1998).
- Cornuault, V., et al. LM6-M: a high avidity rat monoclonal antibody to pectic α-1, 5-L-arabinan. BioRxiv. , 161604 (2017).
- Sutherland, P., Hallett, I., Jones, M. Probing cell wall structure and development by the use of antibodies: a personal perspective. New Zealand Journal of Forestry Science. 39, 197-205 (2009).
- Mikkelsen, M. D., et al. Ancient origin of fucosylated xyloglucan in charophycean green algae. Communications Biology. 4 (1), 754 (2021).
- Fangel, J. U., Jones, C. Y., Ulvskov, P., Harholt, J., Willats, W. G. T. Analytical implications of different methods for preparing plant cell wall material. Carbohydrate Polymers. 261, 117866 (2021).
- Moore, J. P., et al. Analysis of plant cell walls using high-throughput profiling techniques with multivariate methods. The Plant Cell Wall: Methods and Protocols. , 327-337 (2020).
- Gao, Y., Fangel, J. U., Willats, W. G. T., Moore, J. P. Tracking polysaccharides during white winemaking using glycan microarrays reveals glycoprotein-rich sediments. Food Research International. 123, 662-673 (2019).
- Solden, L. M., et al. Interspecies cross-feeding orchestrates carbon degradation in the rumen ecosystem. Nature Microbiology. 3 (11), 1274-1284 (2018).
- Fangel, J. U., et al. Tracking polysaccharides through the brewing process. Carbohydrate Polymers. 196, 465-473 (2018).
- Mravec, J., et al. Pea border cell maturation and release involve complex cell wall structural dynamics. Plant Physiology. 174 (2), 1051-1066 (2017).
- Wickham, H. . ggplot2: elegant graphics for data analysis. , (2009).
- Gu, Z. Complex heatmap visualization. iMeta. 1 (3), 43 (2022).
- Nasrollahzadeh, M., Nezafat, Z., Shafiei, N., Soleimani, F. . Polysaccharides in Food Industry. , (2021).
- Shao, P., et al. Recent advances in improving stability of food emulsion by plant polysaccharides. Food Research International. 137, 109376 (2020).
- Sanz, M. L., Martínez-Castro, I. Recent developments in sample preparation for chromatographic analysis of carbohydrates. Journal of Chromatography. A. 1153 (1-2), 74-89 (2007).
- Bethke, G., Glazebrook, J. Cyclohexane diamine tetraacetic acid (CDTA) extraction of plant cell wall pectin. Bio-Protocol. 4 (24), e1357 (2014).
- Lu, Y., He, Q., Fan, G., Cheng, Q., Song, G. Extraction and modification of hemicellulose from lignocellulosic biomass: A review. Green Processing and Synthesis. 10 (1), 779-804 (2021).
- Jayasekara, S., Ratnayake, R. Microbial cellulases: an overview and applications. Cellulose. 22, 92 (2019).
- Verhertbruggen, Y., Marcus, S. E., Haeger, A., Ordaz-Ortiz, J. J., Knox, J. P. An extended set of monoclonal antibodies to pectic homogalacturonan. Carbohydrate Research. 344 (14), 1858-1862 (2009).
- Villares, A., Mateo-Vivaracho, L., Guillamón, E. Structural features and healthy properties of polysaccharides occurring in mushrooms. Agriculture. 2 (4), 452-471 (2012).
- Kračun, S. K., et al. Carbohydrate microarray technology applied to high-throughput mapping of plant cell wall glycans using comprehensive microarray polymer profiling (CoMPP). Methods in Molecular Biology. 1503, 147-165 (2017).
- Rajasundaram, D., et al. Understanding the relationship between cotton fiber properties and non-cellulosic cell wall polysaccharides. PLoS One. 9 (11), e112168 (2014).
- Michalak, L., et al. Microbiota-directed fibre activates both targeted and secondary metabolic shifts in the distal gut. Nature Communications. 11 (1), 5773 (2020).
- Salmeán, A. A., Hervé, C., Jørgensen, B., Willats, W. G., Mravec, J. Microarray glycan profiling reveals algal fucoidan epitopes in diverse marine metazoans. Frontiers in Marine Science. 4, 293 (2017).
- Knox, J. P. Revealing the structural and functional diversity of plant cell walls. Current Opinion in Plant Biology. 11 (3), 308-313 (2008).
- Manimala, J. C., Roach, T. A., Li, Z., Gildersleeve, J. C. High-throughput carbohydrate microarray profiling of 27 antibodies demonstrates widespread specificity problems. Glycobiology. 17 (8), 17-23 (2007).
- Stephen, P., Tseng, K. -. L., Liu, Y. -. N., Lyu, P. -. C. Circular permutation of the starch-binding domain: inversion of ligand selectivity with increased affinity. Chemical Communications. 48 (20), 2612-2614 (2012).
- Gunnarsson, L. C., Dexlin, L., Karlsson, E. N., Holst, O., Ohlin, M. Evolution of a carbohydrate binding module into a protein-specific binder. Biomolecular Engineering. 23 (2-3), 111-117 (2006).
- Moller, I., et al. High-throughput screening of monoclonal antibodies against plant cell wall glycans by hierarchical clustering of their carbohydrate microarray binding profiles. Glycoconjugate Journal. 25 (1), 37-48 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved