Method Article
Microarray-Polymer-Profiling (MAPP) für die Hochdurchsatz-Glykananalyse
In diesem Artikel
Zusammenfassung
Das Microarray-Polymer-Profiling (MAPP) ist eine Hochdurchsatztechnik für die Analyse der Zusammensetzung von Glykanen in biologischen Proben.
Zusammenfassung
Microarray-Polymer-Profiling (MAPP) ist ein robuster und reproduzierbarer Ansatz zur systematischen Bestimmung der Zusammensetzung und relativen Häufigkeit von Glykanen und Glykokonjugaten in einer Vielzahl biologischer Proben, einschließlich Pflanzen- und Algengewebe, Lebensmittelmaterialien sowie menschlichen, tierischen und mikrobiellen Proben. Die Microarray-Technologie untermauert die Wirksamkeit dieser Methode, indem sie eine miniaturisierte Hochdurchsatz-Screening-Plattform bereitstellt, die es ermöglicht, Tausende von Wechselwirkungen zwischen Glykanen und hochspezifischen, auf Glykane gerichteten molekularen Sonden gleichzeitig mit nur geringen Mengen an Analyten zu charakterisieren. Die Bestandteile der Glykane werden chemisch und enzymatisch fraktioniert, bevor sie nacheinander aus der Probe extrahiert und direkt auf Nitrozellulosemembranen immobilisiert werden. Die Zusammensetzung des Glykans wird bestimmt, indem spezifische Glykan-erkennende molekulare Sonden an die erpressten und gedruckten Moleküle gebunden werden. MAPP ist komplementär zu herkömmlichen Glykananalysetechniken, wie z. B. Monosaccharid- und Kopplungsanalyse und Massenspektrometrie. Molekulare Sonden, die Glykane erkennen, bieten jedoch Einblicke in die strukturellen Konfigurationen von Glykanen, was bei der Aufklärung biologischer Wechselwirkungen und funktioneller Rollen helfen kann.
Einleitung
Glykane sind in allen Bereichen des Lebens allgegenwärtig und weisen im Vergleich zu anderen Makromolekülen eine beispiellose Vielfalt in Struktur und Funktion auf1. Aufgrund ihrer Komplexität, der Variabilität in der Biosynthese und der glykosidischen Bindungen sowie des Mangels an geeigneten Methoden zur Analyse von Glykanstrukturen ist unser Verständnis dieser Vielfalt an Strukturen und Funktionen jedoch relativ begrenzt2.
Viele Glykananalysetechniken sind zerstörerisch und erfordern die Zerlegung von Glykanen in ihre Bestandteile Monosaccharide, was relevante dreidimensionale und biologische Zusammenhänge verschleiern kann3. Umgekehrt erkennen und binden monoklonale Antikörper (mAbs), Kohlenhydratbindungsmodule (CBMs), Lektine, virale Agglutinine und mikrobielle Adhäsine, die zusammen als Glykan-erkennende molekulare Sonden (GRMPs)4 bezeichnet werden, spezifische Epitope und können als Werkzeuge zum Nachweis und zur Unterscheidung zwischen Glykanen innerhalb komplexer Multi-Glykan-Matrizen verwendet werden 5,6.
Hier stellen wir das Microarray-Polymer-Profiling (MAPP) vor, eine schnelle, vielseitige und zerstörungsfreie Methode zur Glykananalyse, die auf ein breites Spektrum biologischer Proben anwendbar ist. Die Methode zielt darauf ab, eine robuste Hochdurchsatztechnologie für die Analyse von Glykanen aus verschiedenen biologischen und industriellen/kommerziellen Systemen bereitzustellen. MAPP vereint die Erkennungsspezifität von Glykan-gerichteten molekularen Sonden mit reproduzierbarer, leistungsstarker Microarray-Screening-Technologie, um Tausende von molekularen Wechselwirkungen parallel zu profilieren. Das Ergebnis dieses Ansatzes ist ein diagnostischer Einblick in die Zusammensetzung und relative Häufigkeit von Glykanen in einer Probe oder einem Gewebe von Interesse.
MAPP kann als eigenständige, eigenständige Methode oder in Verbindung mit anderen biochemischen Techniken wie der Immunfluoreszenzmikroskopie 7,8,9 und der Monosaccharid- oder Kopplungsanalyse10,11 verwendet werden. Die Technik kann auch verwendet werden, um Epitopspezifitäten neuartiger GRMPs zu kartieren, indem Arrays verwendet werden, die mit reinen und strukturell gut definierten Oligosaccharidstandards gedruckt werden12. Ein großer Vorteil von MAPP gegenüber anderen Methoden, wie z.B. dem Enzyme-Linked Immunosorbent Assay (ELISA), ist seine Kompatibilität mit kleinen Probenvolumina13,14. Darüber hinaus bietet MAPP eine Analyse mit deutlich höherem Durchsatz15 und eine effektive Form der Probenkonservierung, da gedruckte Proben trocken und stabil sind, wenn sie auf Nitrozellulose16 immobilisiert werden.
Die Bindung von GRMPs hängt im Allgemeinen vom Vorhandensein einer Reihe zusammenhängender Zuckerreste ab, die zusammen eine Bindungsstelle (Epitop) bilden, die für eine bestimmte Polysaccharidklasse (Xylan, Mannan, Xyloglucan usw.) einzigartig ist. 17. Im Gegensatz dazu können die einzelnen Zuckerreste (Xylose, Mannose, Glukose), die mit den meisten biochemischen Techniken, z. B. Monosaccharidzusammensetzung oder Methylierungsanalyse, quantifiziert werden, Bestandteile mehrerer Polysaccharidklassen sein und daher schwer zuzuordnensein 18.
MAPP wurde als Reaktion auf eine Technologielücke entwickelt, nämlich die Fähigkeit, mehrere Glykane aus einer Vielzahl von Quellen mit kleinen Materialmengen schnell zu analysieren. MAPP greift auf das umfangreiche Repertoire an GRMPs zurück, die in den letzten drei Jahrzehnten entwickelt und charakterisiert wurden: 12,19,20,21,22,23,24,25,26,27,28,29,30,31,32. Die Entwicklung von MAPP war ein iterativer Prozess, bei dem die Technik stetig verfeinert und optimiert wurde. Es gibt mittlerweile eine umfangreiche Literatur, die die Anwendung von MAPP auf verschiedene natürliche und industrielle Systeme beschreibt, in denen Glykane eine zentrale Rolle spielen 5,6,9,10,21,33,34,35,36,37,38,39. Hier beschreiben wir den aktuellen Stand der Technik für MAPP.
Protokoll
Die wichtigsten Versuchsschritte der MAPP-Methode sind in Abbildung 1 zusammengefasst.
1. Vorbereitung der Proben
HINWEIS: Hier wird die Methode zu Veranschaulichungszwecken auf Pflanzengewebe angewendet. Bei den ausgewählten Pflanzen handelte es sich um Coffea arabica, Allium sativum var. ophioscorodon und mehrere thailändische Mangosorten (Aokrong, Kam, Rad, Chokanan, Mamkamdang, Talabnak, Mahachanok und Nga). Die Pflanzen wurden aufgrund ihrer kommerziellen Bedeutung ausgewählt. Bei ihrer Verarbeitung für den menschlichen Verzehr fallen derzeit ungenutzte agroindustrielle Abfälle an, die eine Quelle für Mehrwertprodukte, einschließlich reiner Glykane, darstellen können. Daher wurde MAPP zur Charakterisierung der Glykanzusammensetzung der Abfallpflanzenbiomasse für Bioprospektionszwecke eingesetzt.
- Trenne das Pflanzenmaterial in verschiedene Gewebe (z. B. Wurzel, Stängel und Blätter).
- Trocknen Sie das Pflanzengewebe in einem Heißluftofen bei 40 °C für 12-24 h (verringern/erhöhen Sie die Zeit entsprechend der Probe). Alternativ können Sie die Proben in flüssigem Stickstoff einfrieren und anschließend ~4 Tage lang gefrieren.
- Homogenisieren Sie die Proben mit einem Stößel und Mörser oder einem mechanischen Gewebelyser (siehe Materialtabelle) mit einem Kugellager in jedem Röhrchen zu einem feinen Pulver.
HINWEIS: Für frisches Pflanzengewebe wird eine Trocknung oder Gefriertrocknung vor der Homogenisierung empfohlen. Im Allgemeinen ist die Homogenisierung mit einem Stößel und Mörser für die meisten trockenen Proben ausreichend. Bei besonders widerstandsfähigen Proben wie Getreide, Hülsenfrüchten und verarbeiteten Lebensmitteln wie Nudeln kann das Einfrieren in flüssigem Stickstoff die Geschwindigkeit und Effizienz der Probenhomogenisierung erhöhen. Wir haben festgestellt, dass die mechanische Homogenisierung mit fast allen Probentypen kompatibel ist, wesentlich schneller und weniger arbeitsintensiv ist und das Risiko einer Kreuzkontamination der Proben durch wiederholte Verwendung derselben Geräte (d. h. Stößel und Mörser) effektiv minimiert.
2. Herstellung von alkoholunlöslichen Rückständen (AIR)
- 1,5 ml 70%iges (v/v) Ethanol werden zu 50-100 mg luftgetrocknetem und homogenisiertem Probenmaterial gegeben.
- Zum Mischen gründlich vortexen und dann bei 10.000 x g für 10 min bei Raumtemperatur zentrifugieren. Verwerfen Sie den entstandenen Überstand mit einer Pipette und bewahren Sie das Pellet auf.
- Dem restlichen Pellet werden 1,5 ml Methanol und Chloroform (1:1 [v/v]) hinzugefügt. Wirbeln, zentrifugieren und verwerfen Sie den Überstand gemäß Schritt 2.2.
- Dem restlichen Pellet 1,5 ml 100%iges Aceton hinzufügen. Wirbeln, zentrifugieren und verwerfen Sie den Überstand gemäß Schritt 2.2.
- Geben Sie das resultierende Pellet entweder über Nacht in einen Abzug, damit das restliche Aceton verdampfen kann, oder in eine Vakuumzentrifuge, bis es trocken ist.
HINWEIS: AIR-Material kann bei Raumtemperatur gelagert werden, bis es benötigt wird.
3. Glykan-Extraktion
HINWEIS: Wenn möglich, führen Sie alle Extraktionsschritte in einem Gewebelyser mit einem Kugellager in jedem Röhrchen durch, um die Resuspension zu unterstützen. Wenn kein Gewebelyser zur Verfügung steht, können Extraktionen stattdessen unter kontinuierlichem Rühren oder Schütteln durchgeführt werden. Es kann notwendig sein, die Extraktionszeit zu verlängern, wenn dies nicht möglich ist.
- Zu 10 mg AIR-Material werden 30 μl/mg 50 mM Cyclohexandiamintetraessigsäure (CDTA; siehe Materialtabelle) mit einem pH-Wert von 7,5 zugegeben.
- Bei 27 Hz für 2 Minuten schütteln, gefolgt von 10 Hz für 2 Stunden.
- Bei 10.000 x g für 10 min bei 4 °C zentrifugieren. Der entstandene Überstand wird zurückgehalten, in ein steriles Mikrozentrifugenröhrchen gegeben und bei 4 °C auf einem Rotationsschüttler gelagert.
- Dem restlichen Pellet werden 30 μl/mg 4 M NaOH + 0,1 % (w/v) NaBH4 zugegeben.
ACHTUNG: NaBH4 ist giftig, wenn es verschluckt wird. Verwenden Sie persönliche Schutzausrüstung (PSA). Griff unter einem Abzug. Vermeiden Sie Staubbildung. Vermeiden Sie es, Staub einzuatmen. Achten Sie darauf, dass das Produkt nicht mit Wasser in Berührung kommt. - Wiederholen Sie die Schritte 3.2 bis 3.3. Waschen Sie das restliche Pellet zwei- bis dreimal mit dH2O, um die restliche NaOH zu entfernen.
- 30 μl/mg Cellulase (vorzugsweise GH5-Endo-1,4-β-glucanase, in geeignetem Enzympuffer - wie vom Hersteller empfohlen; siehe Materialtabelle) in das Pellet geben und bei der enzymoptimalen Temperatur für 16 h inkubieren.
- Die Proben werden bei 10.000 x g für 10 min bei 4 °C zentrifugiert. Den Überstand zurückhalten, in saubere Mikrozentrifugenröhrchen umfüllen und bei 4 °C auf einem Rotationsschüttler lagern. Nach der Extraktion müssen die Proben so schnell wie möglich gedruckt werden.
- Alle gelagerten Extrakte werden erneut bei 10.000 x g für 10 min bei 4 °C zentrifugiert.
HINWEIS: Die Proben müssen frei von Partikeln und Ablagerungen sein. Durchlaufen Sie bei Bedarf einen 0,2-μm-Spinfilter vor dem Microarray-Druck. Besonders viskose Proben sind mit der Microarray-Analyse nicht kompatibel, da die Mikroarrayer-Kapillaren und der Druckkopf leicht verstopfen können. In der Regel sollten Anwender in der Lage sein, alle für den Druck bestimmten Proben mit einer Standardpipette mit geringem Volumen zu pipettieren.
4. Erstellung von Normen
- 1 mg/ml-Lösungen definierter Glykanstandards (Tabelle 1) in sterilem dH2O herstellen. Bei Verwendung von Pachyman als Standard stattdessen in 4 M NaOH auflösen und nach der Solubilisierung mit Eisessig neutralisieren.
- Lagern Sie die vorbereiteten Standards über Nacht bei 4 °C auf einem Rotationsschüttler, um eine vollständige Solubilisierung zu ermöglichen.
- Zentrifugieren Sie alle Standards 10 Minuten lang bei 10.000 x g bei 4 °C, um alle Ablagerungen zu pelletieren. Der resultierende Überstand wird für den anschließenden Druck verwendet.
5. Microarray-Druck
- Bereiten Sie eine 1:20 (v/v) Verdünnung von schwarzer Tusche/Zeichentinte in Glycerinsystempuffer (GSB; kombinieren Sie 47 % Glycerin, 52,9 %dH2O, 0,06 % Triton X-100 und 0,04 % Biozid [0,15 %-0,17 % Kupfernitrat und 1,4 %-2,0 % Magnesiumnitrat in Wasser] und filtern Sie sie) (siehe Materialtabelle) und zentrifugieren Sie 10 Minuten lang bei 15.000 x g (Raumtemperatur).
HINWEIS: Die Tintenlösung ist erforderlich, um einen oberen und unteren Rand um die gedruckten Proben zu erstellen, damit die gedruckten Microarrays auf der Membran visuell erkannt werden können. Es ist jedoch wahrscheinlich, dass die Tintenlösung Sedimente enthält. Alle Lösungen müssen für den Druck frei von Partikeln sein, daher sollte das Sediment beim Pipettieren nicht gestört werden. Entsorgen und frisch zubereiten, wenn dies nicht mehr möglich ist. Die Lösung kann nicht einfach gefiltert werden, um Partikel zu entfernen. - Geben Sie 40 μl Tintenlösung und GSB in den ersten Abschnitt der ersten 384-Well-Platte (Abbildung 2).
- Geben Sie 25 μl GSB in alle Verdünnungsvertiefungen 1 (D1). Geben Sie 40 μl GSB in alle Verdünnungsvertiefungen 2, 3 und 4 (D2-D4).
- Verdünnen Sie die extrahierten Glykanproben und definierten Glykansubstrate 1:1 (v/v) mit GSB, indem Sie der Reihe nach 25 μl der extrahierten Glykanprobe in die D1-Vertiefungen geben.
- Verdünnen Sie jede Probe viermal, indem Sie 10 μl der Probe aus der D1-Vertiefung entnehmen und in die D2-Vertiefung geben. Zum Mischen vorsichtig mit einer Pipette absaugen.
- Wiederholen Sie den Vorgang, indem Sie 10 μl Probe aus der D2-Vertiefung entnehmen und in die D3-Vertiefung geben.
- Wiederholen Sie den Vorgang für die D4-Welle. Nach dem Mischen 10 μl aus der D4-Vertiefung entsorgen, so dass jede Vertiefung ein Endvolumen von 40 μl enthält.
- Geben Sie 40 μl Tintenlösung und GSB in den letzten Block der endgültigen Platte.
- Die Platten mit einer selbstklebenden Plattenabdeckung abdecken und 10 min bei 3.000 x g (Raumtemperatur) zentrifugieren. Stellen Sie sicher, dass nach der Zentrifugation keine Blasen zurückbleiben, und wiederholen Sie den Vorgang bei Bedarf.
- Drucken Sie die Proben mit einem berührungslosen piezoelektrischen Microarray-Druckroboter auf die Nitrozellulosemembran (siehe Materialtabelle), indem Sie die folgenden Schritte ausführen.
HINWEIS: Im Folgenden finden Sie Maßnahmen, die für eine optimale Druckqualität empfohlen werden. Welche Parameter im Einzelnen benötigt werden, hängt jedoch letztlich vom verwendeten Instrument ab. Wir empfehlen Benutzern, sich an den Gerätehersteller zu wenden, um die entsprechenden Anpassungen und Druckeinstellungen für ihr Gerät zu besprechen.- Entleeren Sie vor dem Drucken den Abfallpufferbehälter und füllen Sie den sauberen Pufferbehälter nach Bedarf mit sauberem GSB. Schalten Sie das Gerät ein und lassen Sie es >10 Minuten lang stabilisieren, wenn es über ein integriertes Feuchtigkeits- und Temperaturkontrollsystem verfügt. Schalten Sie den Microarrayer ein und initialisieren Sie das System.
HINWEIS: Es wird empfohlen, einen Test durchzuführen, um den Innendruck des Geräts zu bestimmen. Wenn der Druck zu niedrig ist, kann es notwendig sein, eine Hochdruckspülung durchzuführen. Wenden Sie sich auch hier an den Gerätehersteller, um die spezifische Funktionsweise des jeweiligen Geräts zu besprechen. - Spülen Sie den Druckkopf und die Kapillaren mehrmals mit GSB, um Schmutz und potenzielle Verunreinigungen zu entfernen. Führen Sie einen Testdrucklauf durch, indem Sie entweder nur eine GSB-Platte einlegen oder das Gerät so einstellen, dass es direkt aus dem sauberen Pufferreservoir druckt, wobei die Probenaspiration von einer geladenen Platte umgangen wird.
HINWEIS: Es ist nicht erforderlich, den Testdruck mit einer Nitrozellulosemembran durchzuführen. Saubere Objektträger sind ausreichend und bieten den Vorteil, dass die Punktgröße, -form und -qualität vor dem Musterdruck visuell beurteilt werden können. - Wenn Sie extrahierte Glykanproben drucken, programmieren Sie das System so, dass zwischen den einzelnen Proben sauberes GSB gespült wird.
HINWEIS: In der Regel beträgt das Probenvolumen pro gedrucktem Spot 100 pL bis 10 nL, und die Spotgröße liegt je nach gewähltem Probenvolumen zwischen 20 μm und 100 μm. Das Drucken von 100 Microarrays von einer 384-Well-Platte aus einer Quelle dauert ca. 40 Minuten, einschließlich Systemspülung. Die resultierenden Microarrays werden etwa 1 cm2 groß sein. Zusätzliche Platten erhöhen die Länge des Arrays um ca. 1 cm pro Platte. Ein Schema des gedruckten Microarray-Designs ist in Abbildung 3 dargestellt. Einmal gedruckt, sind die Microarrays sofort einsatzbereit und können mehrere Jahre gelagert werden. Sollte der Druckauftrag aus irgendeinem Grund wiederholt werden müssen, da die Proben während des Drucks möglicherweise verdunsten, wird empfohlen, eine neue Musterplatte einzulegen und die Originalplatte zu verwerfen. - Reinigen Sie einmal pro Woche den Druckkopf und die Kapillaren gründlich. Laden Sie dazu eine 384-Well-Vertiefung mit einer 1:20-Verdünnung konzentrierter NaOH in GSB und führen Sie einen 40-minütigen bis 1-stündigen Drucklauf auf Objektträger durch. Benutzer sollten sicherstellen, dass diese Reinigungslösung mit ihrem Gerät kompatibel ist, bevor sie fortfahren.
- Entleeren Sie vor dem Drucken den Abfallpufferbehälter und füllen Sie den sauberen Pufferbehälter nach Bedarf mit sauberem GSB. Schalten Sie das Gerät ein und lassen Sie es >10 Minuten lang stabilisieren, wenn es über ein integriertes Feuchtigkeits- und Temperaturkontrollsystem verfügt. Schalten Sie den Microarrayer ein und initialisieren Sie das System.
- Speichern Sie die eindeutige Grid-Datei (.gal-Datei), die für das gedruckte Microarray erstellt wurde, für die nachgelagerte Analyse.
6. Microarray-Sondierung
- Schneiden Sie einzelne, identische gedruckte Microarrays aus der Nitrozellulosemembran aus und legen Sie sie zur Sondierung in ein entsprechend großes Gefäß (z. B. eine 12- oder 24-Well-Mikrotiterplatte) (siehe Materialtabelle). Das Array sollte flach auf dem Boden des Gefäßes aufliegen. Pro Sonde wird ein Microarray benötigt, das ein technisches Replikat darstellt.
- Um die unspezifische Bindung zu reduzieren, inkubieren Sie die Microarrays 1 h lang in MP-TBST-Blocking-Puffer (1x Tris-gepufferte Kochsalzlösung, pH 7,5, + 0,1 % [v/v] TWEEN 20 [TBST] und ergänzt mit 5 % [w/v] Magermilchpulver; siehe Materialtabelle) auf einem rotierenden/schaukelnden Schüttler. Stellen Sie sicher, dass das Volume ausreicht, um das gesamte Array unter Wasser zu setzen.
- Entfernen Sie nach der Inkubation das MP-TBST und ersetzen Sie es durch ein frisches Volumen MP-TBST.
- Inkubieren Sie die Arrays mit monoklonalen Antikörpern (mAbs) oder His-markierten CBMs oder anderen GRMPs (z. B. Lektinen), verdünnt 1:10-1:1.000 (wie vom Hersteller angegeben; siehe Materialtabelle) in MP-TBST für 2 h auf einem rotierenden/schaukelnden Schüttler.
- Entfernen Sie nach der Inkubation die molekulare Sondenlösung und bedecken Sie die Arrays mit sauberem TBST, wobei Sie sicherstellen müssen, dass die Arrays vollständig eingetaucht sind. Um Reste der Sondenlösung zu entfernen, entfernen Sie sofort die TBST und ersetzen Sie sie durch ein neues Volumen. Legen Sie die Arrays für 5 Minuten auf einen rotierenden/schaukelnden Shaker. Nach 5 Minuten die TBST entfernen, durch ein neues Volumen ersetzen und 5 Minuten lang auf einen rotierenden/schaukelnden Shaker stellen.
HINWEIS: Dieser Vorgang sollte dreimal wiederholt werden, ohne die anfängliche Zugabe und sofortige Entfernung von TBST. - Inkubieren Sie die Arrays mit alkalischen Phosphatase-konjugierten sekundären Antikörpern (Anti-Maus, Anti-Ratte, Anti-Kaninchen, Anti-His, je nach Bedarf; siehe Materialtabelle), verdünnt 1:1.000 in MP-TBST für 2 h auf einem schaukelnden/rotierenden Schüttler.
HINWEIS: Meerrettichperoxidase-konjugierte Sekundärantikörper sind ebenfalls geeignet, wenn sie in Verbindung mit Tetramethylbenzidin (TMB)/Wasserstoffperoxidsubstrat zur Farbentwicklung verwendet werden. - Wiederholen Sie nach der Inkubation den Waschvorgang gemäß Schritt 6.5, um nicht spezifisch gebundene Sekundärantikörper zu entfernen.
- Bedecken Sie die Arrays mit Nitroblau-Tetrazolium (NBT)/5-Brom-4-chlor-3-indolyl-phosphat (BCIP)-Farbentwicklungslösung (siehe Materialtabelle) für den chromogenen Nachweis der Antikörperbindung. Lassen Sie es warten, bis sich violette Niederschlagsflecken an den Antigenbindungsstellen entwickeln (in der Regel 5-30 Minuten, die Arrays sollten jedoch genau überwacht werden, um eine Übersättigung zu vermeiden, da die Reaktion schnell auftreten kann).
VORSICHT: BCIP ist bei Hautkontakt schädlich und kann Atemwegsreizungen verursachen. Verwenden Sie PSA. Vermeiden Sie Staubbildung. Vermeiden Sie es, Staub einzuatmen. - Um die Reaktion zu beenden, tauchen Sie die Arrays in sauberes Leitungswasser und waschen Sie sie ausgiebig.
- Legen Sie die Arrays zwischen Löschpapier über Nacht bei Raumtemperatur zum Trocknen.
- Verwerfen Sie die Arrays mit offensichtlichen Defekten und wiederholen Sie in solchen Fällen das Prüfprotokoll (Abbildung 4).
7. Analyse und Quantifizierung
- Scannen Sie die entwickelten Arrays mit einer Auflösung von 2.400 dpi (Dots per Inch) mit einem Desktop-Scanner. Konvertieren Sie die Bilder in TIFF-Dateien und dann in Negative.
- Verwenden Sie eine Microarray-Analysesoftware (siehe Materialtabelle), um die eindeutige .gal-Gitterdatei über jedes Microarray-Bild zu legen, um die Farbintensität des an jeder Antigenbindungsstelle erzeugten Flecks zu berechnen und den lokalen Hintergrund zu subtrahieren.
- Exportieren Sie die Rasterdaten als .txt Datei. Diese können dann zur Analyse manuell in eine Excel-Tabelle importiert werden.
- Generieren Sie einen mittleren Punktsignalintensitätswert für jede Probe, indem Sie die Punktintensität zuerst über jede Probenverdünnung und dann über alle enthaltenen biologischen Replikate mitteln.
- Weisen Sie der höchsten mittleren Punktsignalintensität einen Wert von 100 zu und normalisieren Sie die restlichen Daten entsprechend.
Hinweis: Normalisierte mittlere Spotsignalintensitäten können dann als Heatmap der relativen Glykanepitophäufigkeit unter Verwendung der bedingten Formatierungsfunktion in Excel33 oder mithilfe der geom_tile Funktion in R ggplot2-Paket40,41 dargestellt werden.
Ergebnisse
MAPP wurde angewendet, um die Glykanzusammensetzung von landwirtschaftlichen Biomasseabfällen zu bestimmen, bestehend aus Mangoschalen verschiedener nordthailändischer Sorten, Coffea arabica-Kirschfleisch und Kaffeebohnenverarbeitungsabfällen sowie Wurzel-, Stängel- und Blattgewebe aus thailändischem schwarzem Knoblauch, Allium sativum var. ophioscorodon. Mehrere pflanzliche Polysaccharide werden in der Lebensmittelindustrie als funktionelle Inhaltsstoffe verwendet42,43. Ziel dieses Experiments war es daher, abzuleiten, ob diese reichlich vorhandenen und derzeit wenig genutzten agroindustriellen Abfallstoffe eine Quelle für wertschöpfende reine Polysaccharide darstellen können.
AIR-Material wird routinemäßig zur Vorbereitung von Proben verwendet, die für die Glykananalyse bestimmtsind 44. Die Verwendung von AIR bietet mehrere Vorteile. Die Behandlung mit Lösungsmitteln entfernt effektiv endogene CAZyme, Metaboliten, kleine Saccharide, Lipide und Pigmente, was zu Proben führt, die mit Polysacchariden und Strukturproteinen angereichert sind34. Darüber hinaus ist die Herstellung von AIR eine schnelle und effektive Möglichkeit, die Langlebigkeit der Proben zu erhöhen, da sie thermostabil ist und mehrere Jahre gelagert werden kann.
Drei gemischte Fraktionen von konstituierenden Glykanen wurden nacheinander aus pflanzlichem AIR-Material unter Verwendung von CDTA, NaOH und Cellulase extrahiert. CDTA chelatisiertCa2+ -Ionen, die die Entfernung vonCa2+ -vernetzten entesterten Pektinen aus pflanzlichen Zellwänden ermöglichen45. Alkalische Bedingungen ermöglichen die Freisetzung von überwiegend Hemicellulosen wie Mannan, Xylan und β-Glucan aufgrund der Störung von Wasserstoffbrückenbindungen und der Verseifung von Esterbindungen zwischen Cellulose-Mikrofibrillen und Hemicellulose bzw. Lignin und Hemicellulose46. Eine rekombinante Endo-1,4-β-Glucanase aus Bacillus spp. wurde verwendet, um amorphe Regionen der strukturellen Cellulose-Mikrofibrillen abzubauen, wobei an Cellulose gebundene Restglykane innerhalb der Zellwände freigesetztwurden 47. Obwohl diese Methode Glykane effektiv in diese drei großen Gruppen trennt, sollte beachtet werden, dass die Proben nicht rein sind. Es liegt in der Natur der Extraktionsmethode, dass Hemicellulose, wenn sie in der Probe vorhanden ist, unweigerlich extrahiert und anschließend in unterschiedlichem Maße in den CDTA- und Cellulase-Fraktionen nachgewiesen wird. Ebenso wird bei der NaOH-Extraktion etwas Pektin nachgewiesen, wenn es in der Probe vorhanden ist.
Ein berührungsloser, piezoelektrischer Microarray-Druckroboter wurde verwendet, um extrahierte Glykanfraktionen über eine nicht-kovalente Bindung11 auf Nitrozellulose zu immobilisieren, wodurch 300 identische Microarrays gebildet wurden. Definierte Glykanstandards (Tabelle 1) wurden ebenfalls als Positivkontrollen in die gedruckten Microarrays aufgenommen (Abbildung 5). Das für die ausgewählten Glykanstandards erhaltene MAPP-Bindungsprofil entspricht den zuvor berichteten Epitopspezifitäten. Zum Beispiel zeigte LM21 eine starke Bindung an mehrere Mannan-Polysaccharide (Galactomannan und Glucomannan), während LM22 nur eine schwache Bindung an Galactomannan25 zeigte. In ähnlicher Weise bindet LM19 bevorzugt an entestertes Homogalacturonan48 und LM15 an Tamarindensamen Xyloglucan23.
Die relative Häufigkeit von 16 Epitopen, die für nicht-zellulosehaltige pflanzliche Zellwandpolysaccharide diagnostisch sind, wurde durch die Bindung von Glykan-gerichteten monoklonalen Antikörpern (Tabelle 2) an gedruckte Extrakte (Abbildung 6) nachgewiesen. Die Mehrzahl der extrahierten Glykane wurde innerhalb der alkalischen NaOH-Fraktion nachgewiesen. Starke Bindungssignale wurden für die mAbs LM10 und LM11, die Xylan/Arabinoxylan repräsentieren, in den Schalen aller getesteten Mangosorten aufgezeichnet. In den Knoblauchproben banden LM10 und LM11 bevorzugt an Wurzelgewebeextrakt (Knoblauch R) und zeigten nur eine schwache Bindung an den Blattgewebeextrakt (Knoblauch L). LM19, das teilweise methylverestertes oder unverestertes Homogalacturonan darstellt, bindet stark an einige Mangosortenextrakte (Aokrong und Talabnak), aber nur schwach oder seine Bindung war nicht nachweisbar in anderen Sorten (Chokanan, Mamkamdang, Mahachanok und Nga). Darüber hinaus bindet LM19 nur an die Fraktionen des Kaffeefruchtfleisches und nicht an das Abfallmaterial der Kaffeebohnenverarbeitung, von dem bisher angenommen wurde, dass es aus halbgereinigtem Kaffeepektin besteht (unveröffentlichte Daten).
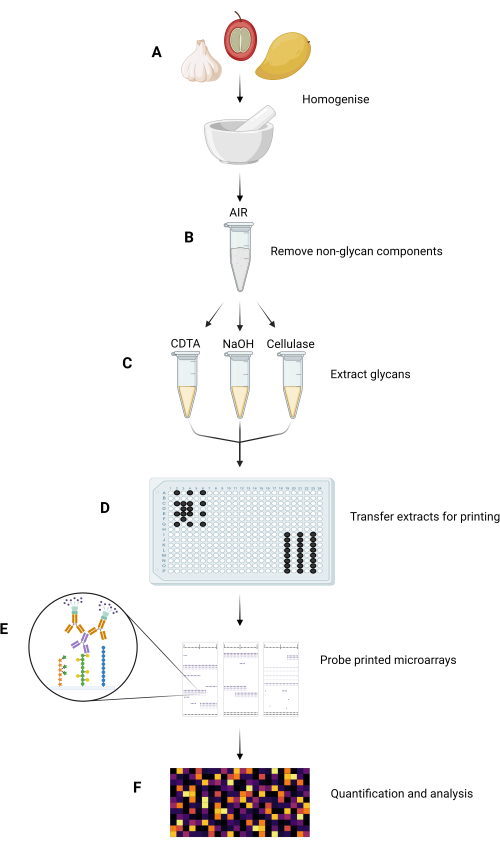
Abbildung 1: Die wichtigsten experimentellen Schritte der MAPP-Methode. (A) Die Proben werden zu feinen Pulvern homogenisiert. (B) Die homogenisierten Proben werden verarbeitet, um ihre AIRs zu isolieren. (C) Die konstituierenden Glykane werden nacheinander unter Verwendung eines maßgeschneiderten Extraktionsverfahrens extrahiert. (D) Die extrahierten Glykanfraktionen, Tinte und GSB werden in 384-Well-Platten gemäß dem Plattenlayout überführt, um sie auf Nitrozellulose zu drucken. (E) Die gedruckten Microarrays werden mit ausgewählten GRMPs untersucht. (F) Die Bindung von GRMP an die gedruckten Glykanfraktionen wird quantifiziert und analysiert, bevor die Daten als Heatmap dargestellt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
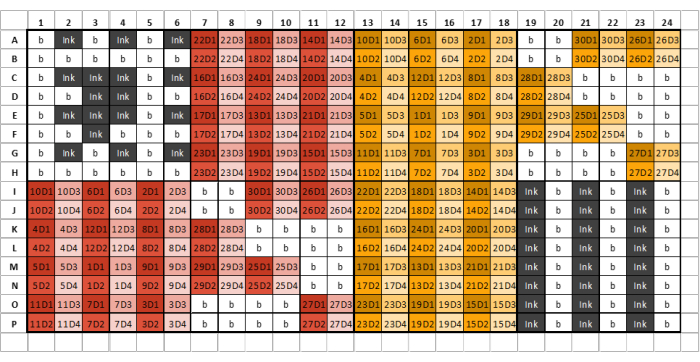
Abbildung 2: Beispiel für ein 384-Well-Plattenlayout für die Beladung von Probe, Tinte und GSB mit vier Verdünnungen pro extrahierter Glykanprobe/Standard. Unterschiedliche Farben kennzeichnen Proben, die aus unterschiedlichen Extraktionsreagenzien stammen, während unterschiedliche Farbtöne serielle Verdünnungen darstellen. Die erste Zahl im Code steht für die Probennummer, während die Endnummer für die Verdünnungszahl steht (D1 steht für Verdünnung eins, D2 für Verdünnung zwei usw.). Zum Beispiel stellt eine gut beschriftete "12D3" die Glykanprobe 12 dar, die Verdünnung drei. Brunnenplatten sollten in acht identische Abschnitte unterteilt werden, die aus sechs Spalten und acht Reihen bestehen. Der erste Abschnitt der ersten Platte sollte nur Tinte und Puffer enthalten und dem Beispielplattenlayout ähneln. Extrahierte Glykanproben können dann entsprechend dem Plattenlayout in nachfolgende Plattenabschnitte geladen werden. Unterschiedliche Extraktionsreagenzien sollten nicht in denselben Plattenabschnitt geladen werden. Wenn nicht genügend Proben vorhanden sind, um einen ganzen Abschnitt zu füllen, füllen Sie alle verbleibenden Vertiefungen in diesem Abschnitt mit Puffer. Lassen Sie keine Vertiefungen leer. Wenn mehrere Platten benötigt werden, sollte der nächste Abschnitt, nachdem alle Proben eingelegt wurden, drei abwechselnde Spalten mit Tinte und GSB enthalten - dies kann nicht der achte Abschnitt sein, abhängig von der Anzahl der zu druckenden Proben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
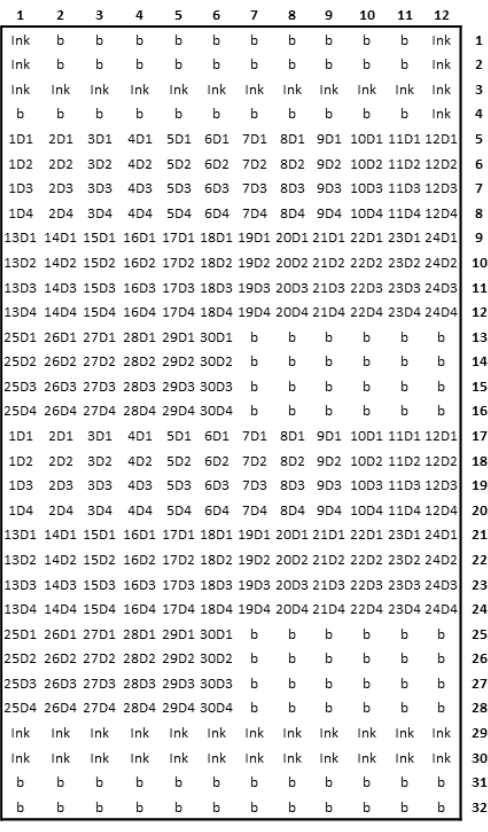
Abbildung 3: Schematische Darstellung des gedruckten Microarray-Designs. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
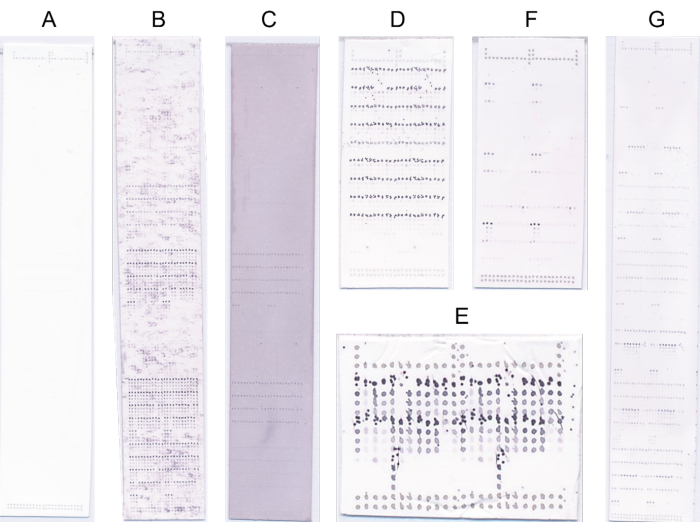
Abbildung 4: Repräsentative Microarrays. (A) Keine Bindung. (B) Das Bindungssignal wird durch ein hohes Hintergrundsignal verdeckt. (C) Generalisierte blaue/violette Färbung aufgrund von Übersättigung mit NBT/BCIP. (D) Fehlerhafte Sondierung aufgrund hoher Substratkonzentration. (E) Fehlerhafter Druck aufgrund des unsauberen Druckkopfes. (F) Starke Bindung an wenige Proben. (G) Starke Bindung an viele Proben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
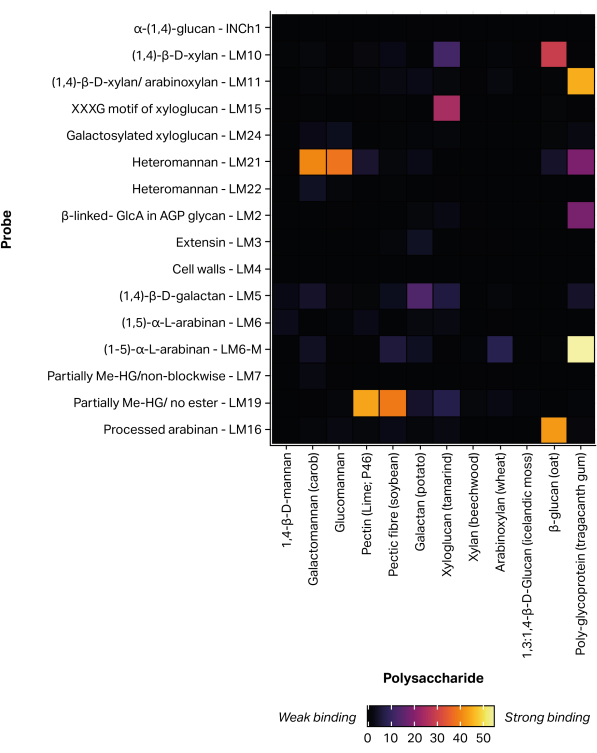
Abbildung 5: Bindung monoklonaler Antikörper an definierte Glykanstandards, die zur Validierung des Druck- und Sondierungsprozesses enthalten sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
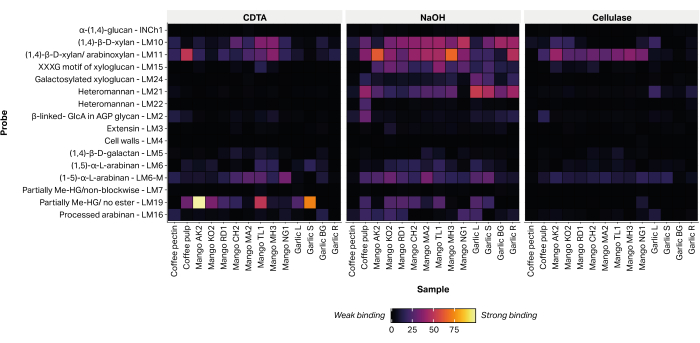
Abbildung 6: MAPP von Glykanen, die aus landwirtschaftlichen Biomasseabfällen extrahiert werden. Zu den Proben gehören Kaffeefruchtfleischabfälle (Kaffeemark und Kaffeepektin), Mangoschalen verschiedener thailändischer Sorten (AO, Aokrong; KO, Kam; RD, Rad; CH, Chokanan; MA, Mamkamdang; TL, Talabnak; MH, Mahachanok; NG, Nga) und schwarze Knoblauchblätter (Knoblauch L), Stängel (Knoblauch S), Knolle (Knoblauch BG) und Wurzeln (Knoblauch R) unter Verwendung von CDTA, NaOH und Cellulase (Bacillus spp. cellulase 5A). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Definierte kommerzielle Polysaccharid-Standards, die in der MAPP-Analyse als Positivkontrollen verwendet werden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Glykan-gerichtete monoklonale Antikörper, ausgewählt für die Untersuchung von extrahierten pflanzlichen Glykan-Microarrays. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Die hier beschriebene MAPP-Technik ist mittlerweile eine etablierte Methode zur Glykananalyse. Die Grundprinzipien wurden erstmals 2007 beschrieben11, aber die Technik wurde kontinuierlich weiterentwickelt, um von den neuesten Innovationen in der Microarray-Technologie, der Entwicklung molekularer Sonden und den Fortschritten in unserem Verständnis der Glykanbiochemie zu profitieren. Im Allgemeinen sind Glykane, insbesondere Polysaccharide, aufgrund ihrer strukturellen Komplexität und Heterogenität schwieriger zu analysieren als Proteine und Nukleotide45 sowie der Tatsache, dass sie nicht ohne weiteres sequenziert oder synthetisiert werden können1. In vielen Fällen kann keine einzelne Technik die Komplexität der Glykane schlüssig entschlüsseln. daher wird MAPP oft mit anderen Methoden verwendet. Dies ist einer der Gründe, warum die AIR-Präparation in der Regel als Ausgangspunkt für MAPP gewählt wird, da AIR mit den meisten anderen Glykananalysemethoden kompatibel ist34, was den anschließenden Vergleich von Datensätzen erleichtert.
Aufgrund der Homogenisierung der Probe vor der AIR-Präparation gehen unweigerlich einige räumliche Informationen verloren. Da Polysaccharide jedoch nacheinander aus Proben freigesetzt werden, liefert das Vorhandensein von Epitopen in den erhaltenen Fraktionen Informationen über die molekulare Architektur und Zusammensetzung dieser Probe17. Daher ist die Auswahl eines geeigneten Extraktionsregimes entscheidend für den Erfolg der Methode. Mehrere Parameter bestimmen die Eignung des Extraktionsverfahrens: Zellstruktur, Zeit, Temperatur, pH-Wert, Druck, Ionenstärke des Lösungsmittels und Feinheit der festen Partikelprobe49. Es wird empfohlen, eine Reihe von zunehmend aggressiveren Lösungsmitteln zu verwenden, um die Wahrscheinlichkeit einer erfolgreichen Extraktion der Glykane zu maximieren und ein repräsentatives Bild der Zusammensetzung der Probe zu erstellen. Für die meisten Proben reichen CDTA, NaOH und Cellulase aus, um pflanzliche Speicher- und Zellwandpolysaccharide zu entfernen 33,50,51,52. Für einige Gewebeproben hat sich ein hybrides Extraktionsverfahren, das auchCaCl2, HCl und Na2CO3 umfasst, als erfolgreich erwiesen53, während marine Mikroalgenproben die Zugabe von Ethylendiamintetraessigsäure (EDTA) erfordern können10.
Microarrays sollten eine Reihe reiner, definierter Glykanstandards enthalten, die als Positivkontrollen verwendet werdenkönnen 5. Die eingeschlossenen Standards sollten entsprechend der Art der Probe geändert werden. Nach dem Drucken müssen die entsprechenden GRMPs ausgewählt werden. Die Generierung von Hybridom-mAbs zu Polysaccharidstrukturen ist eine Herausforderung54; Glykan-bindende Antikörper sind schwer zu züchten und können eine geringe Affinitätaufweisen 55. Glücklicherweise können Gensequenzinformationen für CBMs relativ einfach für die rekombinante Expression4 und die Entwicklung ihrer Bindungsspezifitäten gewonnen werden56,57. Obwohl ein beeindruckender Katalog von GRMPs entwickelt wurde, von denen die meisten heute aus kommerziellen Quellen verfügbar sind, wurde im Vergleich zur Vielfalt der in der Natur vorkommenden Glykanstrukturen nur ein kleiner Teil hergestellt und erfolgreich charakterisiert58. Dies kann die Fähigkeit einschränken, bestimmte Strukturen zu erkennen und zwischen ihnen zu unterscheiden. Es ist ratsam, ein erstes Sondierungsexperiment mit einer oder zwei Sonden durchzuführen, die für jede erwartete Hauptglykanstruktur repräsentativ sind, für die die Bindungsspezifität gut charakterisiert ist. In anschließenden Sondenexperimenten kann die Sondenliste erweitert werden, um ein breiteres Spektrum von Glykanen abzudecken und tiefer in feine Strukturen einzudringen.
Obwohl es sich um eine einfache Angelegenheit handelt, ist die Sicherstellung, dass die Microarrays nach jedem Inkubationsschritt gründlich gewaschen werden, von grundlegender Bedeutung für den Erfolg des Sondierungsverfahrens. Die ineffektive Entfernung von unspezifisch gebundenen Sonden verschleiert wahrscheinlich das Ergebnis, indem sie nach der Farbentwicklung ein hohes Hintergrundsignal verursacht. In diesem Fall ist es notwendig, den Sondierungsvorgang zu wiederholen, beginnend mit einem neuen Microarray. Des Weiteren sollten Arrays sparsam und nur durch Festhalten der Kanten mit einer Pinzette berührt werden; Die Nitrozellulosemembran ist spröde und leicht zu beschädigen. Die Farbentwicklungslösung sammelt sich in Rissen und Knicken an, was zu einer Übersättigung führt, die die Array-Analyse behindert.
MAPP ist schnell, anpassungsfähig und komfortabel. Diese Methode ist kompatibel mit tierischen, mikrobiellen oder pflanzlichen Glykanen, die aus jedem biologischen oder industriellen System stammen, solange sie extrahiert und auf Nitrozellulose immobilisiert werden können und für die man über geeignete molekulare Sonden verfügt. Die generierten Daten liefern detaillierte, semi-quantitative Einblicke in die Zusammensetzung, die mit anderen Glykan-Analysemethoden nicht ohne weiteres gewonnen werden können.
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Die Autoren möchten ArrayJet für ihre fachkundige Beratung in Bezug auf Microarray-Robotik danken. SS und JS bedanken sich für die Unterstützung durch den Fundamental Fund 2022 (FF65/004), Chiang Mai University.
Materialien
| Name | Company | Catalog Number | Comments |
| 1,3:1,4-β-D-Glucan, Lichenan (icelandic moss) | Megazyme | P-LICHN | |
| 1,4-β-D-Mannan | Megazyme | P-MANCB | |
| 384-well microtiter plate | Greiner Bio-One | M1686 | |
| 5-bromo-4-chloro-3-indolyl-phosphate (BCIP) | Melford | B74100-1.0 | |
| Acetone | Sigma | 270725 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 115-055-003 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Rat IgG (H+L) | Jackson ImmunoResearch | 112-055-003 | |
| Alkaline Phosphatase AffiniPure Rabbit Anti-His Tag | Jackson ImmunoResearch | 300-055-240 | |
| Arabinoxylan (wheat) | Megazyme | P-WAXYL | |
| Array-Pro Analyzer Software | Media Cybernetics | Version 6.3 | |
| Bacillus sp. Cellulase 5A (BCel5A) | NZYTech | CZ0564 | |
| BAM antibodies | SeaProbes | Various | |
| Black drawing ink (indian ink) | Winsor & Newton | GWD030 | |
| Carbohydrate binding modules | NZYTech | Various | |
| CCRC antibodies | CarboSource | Various | |
| CDTA | Sigma | 319945 | |
| Chloroform | Sigma | PHR1552 | |
| Ethanol | Sigma | 1.11727 | |
| Galactan (potato) | Megazyme | P-GALPOT | |
| Galactomannan (carob) | Megazyme | P-GALML | |
| Glycerol solution | Sigma | 49781-5L | |
| Gum tragacanth (legumes) | Sigma-Aldrich | G1128 | |
| INCh antibodies | INRA | Various | |
| LM and JIM antibodies | PlantProbes | Various | |
| Marathon Argus Microarray Printer | ArrayJet | ||
| Methanol | Sigma | 34860 | |
| Monoclonal antibodies | Biosupplies Australia | Various | |
| NaBH4 | Sigma | 452882 | |
| NaOH | Sigma | S5881 | |
| Nitro-blue tetrazolium (NBT) | Melford | N66000-1.0 | |
| Nitrocellulose membrane | Thermo Fisher Scientific | 88018 | |
| Pectin (degree of methyl esterification 46%) | Danisco | NA | |
| ProClin 200 | Sigma | 48171-U | |
| Rhamnogalacturonan (soybean pectic fibre) | Megazyme | P-RHAGN | |
| Rotating mixer | Fisher Scientific | 88-861-050 | |
| Rotating/rocking Shaker | Cole-Parmer | ||
| Skimmed milk powder | Marvel | ||
| Spin filter | Costar Spin-X | 8160 | |
| Stainless steel beads | Qiagen | 69989 | |
| TissueLyser II | Qiagen | 85300 | |
| Tris | Sigma | 93362 | |
| Triton X-100 | Sigma | T8787-250ML | |
| Tween 20 | Sigma | P9416-100ML | |
| Xylan (beechwood) | Megazyme | P-XYLNBE | |
| Xyloglucan (tamarind) | Megazyme | P-XYGLN | |
| β-Glucan (oat) | Megazyme | P-BGOM |
Referenzen
- Amicucci, M. J., et al. A nonenzymatic method for cleaving polysaccharides to yield oligosaccharides for structural analysis. Nature Communications. 11 (1), 3963 (2020).
- Gagneux, P., Panin, V., Hennet, T., Aebi, M., Varki, A. Evolution of glycan diversity. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Willats, W. G. T., McCartney, L., Knox, J. P. Pectin cell biology: complexity in context. Advances in Pectin and Pectinase Research. , 147-157 (2003).
- Cummings, R. D., et al. Glycan-recognizing probes as tools. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Bakshani, C. R., et al. Analysis of glycans in a Burnt-on/Baked-on (BoBo) model food soil using Microarray Polymer Profiling (MAPP) and immunofluorescence microscopy. Food Chemistry. 410, 135379 (2023).
- Salmeán, A. A., Willats, W. G. T., Ribeiro, S., Andersen, T. J., Ellegaard, M. Over 100-year preservation and temporal fluctuations of cell wall polysaccharides in marine sediments. Frontiers in Plant Science. 13, 785902 (2022).
- Cid, M., et al. Recognition of the helical structure of β-1,4-galactan by a new family of carbohydrate-binding modules. Journal of Biological Chemistry. 285 (46), 35999-36009 (2010).
- Runavot, J. -. L., et al. Non-cellulosic polysaccharides from cotton fibre are differently impacted by textile processing. PLoS One. 9 (12), e115150 (2014).
- Ahl, L. I., et al. Analyses of aloe polysaccharides using carbohydrate microarray profiling. Journal of AOAC International. 101 (6), 1720-1728 (2018).
- Vidal-Melgosa, S., et al. Diatom fucan polysaccharide precipitates carbon during algal blooms. Nature Communications. 12 (1), 1150 (2021).
- Moller, I., et al. High-throughput mapping of cell-wall polymers within and between plants using novel microarrays. The Plant Journal. 50 (6), 1118-1128 (2007).
- Ruprecht, C., et al. A synthetic glycan microarray enables epitope mapping of plant cell wall glycan-directed antibodies. Plant Physiology. 175 (3), 1094-1104 (2017).
- Cummings, R. D., et al. Principles of glycan recognition. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Gao, C., et al. Glycan microarrays as chemical tools for identifying glycan recognition by immune proteins. Frontiers in Chemistry. 7, 833 (2019).
- Vidal-Melgosa, S., et al. A new versatile microarray-based method for high throughput screening of carbohydrate-active enzymes. Journal of Biological Chemistry. 290 (14), 9020-9036 (2015).
- Willats, W. G. T., Rasmussen, S. E., Kristensen, T., Mikkelsen, J. D., Knox, J. P. Sugar-coated microarrays: A novel slide surface for the high-throughput analysis of glycans. Proteomics. 2 (12), 1666-1671 (2002).
- Sørensen, I., et al. The charophycean green algae provide insights into the early origins of plant cell walls. The Plant Journal. 68 (2), 201-211 (2011).
- Liu, D., Tang, W., Yin, J. -. Y., Nie, S. -. P., Xie, M. -. Y. Monosaccharide composition analysis of polysaccharides from natural sources: Hydrolysis condition and detection method development. Food Hydrocolloids. 116, 106641 (2021).
- Pattathil, S., et al. A comprehensive toolkit of plant cell wall glycan-directed monoclonal antibodies. Plant Physiology. 153 (2), 514-525 (2010).
- Verhertbruggen, Y., et al. Developmental complexity of arabinan polysaccharides and their processing in plant cell walls. The Plant Journal. 59 (3), 413-425 (2009).
- Rydahl, M. G., et al. Development of novel monoclonal antibodies against starch and ulvan - implications for antibody production against polysaccharides with limited immunogenicity. Scientific Reports. 7 (1), 9326 (2017).
- McCartney, L., Marcus, S. E., Knox, J. P. Monoclonal antibodies to plant cell wall xylans and arabinoxylans. The Journal of Histochemistry and Cytochemistry. 53 (4), 543-546 (2005).
- Marcus, S. E., et al. Pectic homogalacturonan masks abundant sets of xyloglucan epitopes in plant cell walls. BMC Plant Biology. 8, 60 (2008).
- Pedersen, H. L., et al. Versatile high resolution oligosaccharide microarrays for plant glycobiology and cell wall research. The Journal of Biological Chemistry. 287 (47), 39429-39438 (2012).
- Marcus, S. E., et al. Restricted access of proteins to mannan polysaccharides in intact plant cell walls. The Plant Journal. 64 (2), 191-203 (2010).
- Smallwood, M., Martin, H., Knox, J. P. An epitope of rice threonine-and hydroxyproline-rich glycoprotein is common to cell wall and hydrophobic plasma-membrane glycoproteins. Planta. 196 (3), 510-522 (1995).
- Smallwood, M., Yates, E. A., Willats, W. G. T., Martin, H., Knox, J. P. Immunochemical comparison of membrane-associated and secreted arabinogalactan-proteins in rice and carrot. Planta. 198 (3), 452-459 (1996).
- Wisniewski, J. P., Rathbun, E. A., Knox, J. P., Brewin, N. J. Involvement of diamine oxidase and peroxidase in insolubilization of the extracellular matrix: implications for pea nodule initiation by Rhizobium leguminosarum. Molecular Plant-Microbe Interactions. 13 (4), 413-420 (2000).
- Jones, L., Seymour, G. B., Knox, J. P. Localization of pectic galactan in tomato cell walls using a monoclonal antibody specific to (1[->]4)-β-D-galactan. Plant Physiology. 113 (4), 1405-1412 (1997).
- Willats, W. G., Marcus, S. E., Knox, J. P. Generation of a monoclonal antibody specific to (1→5)-α-L-arabinan. Carbohydrate Research. 308 (15), 149-152 (1998).
- Cornuault, V., et al. LM6-M: a high avidity rat monoclonal antibody to pectic α-1, 5-L-arabinan. BioRxiv. , 161604 (2017).
- Sutherland, P., Hallett, I., Jones, M. Probing cell wall structure and development by the use of antibodies: a personal perspective. New Zealand Journal of Forestry Science. 39, 197-205 (2009).
- Mikkelsen, M. D., et al. Ancient origin of fucosylated xyloglucan in charophycean green algae. Communications Biology. 4 (1), 754 (2021).
- Fangel, J. U., Jones, C. Y., Ulvskov, P., Harholt, J., Willats, W. G. T. Analytical implications of different methods for preparing plant cell wall material. Carbohydrate Polymers. 261, 117866 (2021).
- Moore, J. P., et al. Analysis of plant cell walls using high-throughput profiling techniques with multivariate methods. The Plant Cell Wall: Methods and Protocols. , 327-337 (2020).
- Gao, Y., Fangel, J. U., Willats, W. G. T., Moore, J. P. Tracking polysaccharides during white winemaking using glycan microarrays reveals glycoprotein-rich sediments. Food Research International. 123, 662-673 (2019).
- Solden, L. M., et al. Interspecies cross-feeding orchestrates carbon degradation in the rumen ecosystem. Nature Microbiology. 3 (11), 1274-1284 (2018).
- Fangel, J. U., et al. Tracking polysaccharides through the brewing process. Carbohydrate Polymers. 196, 465-473 (2018).
- Mravec, J., et al. Pea border cell maturation and release involve complex cell wall structural dynamics. Plant Physiology. 174 (2), 1051-1066 (2017).
- Wickham, H. . ggplot2: elegant graphics for data analysis. , (2009).
- Gu, Z. Complex heatmap visualization. iMeta. 1 (3), 43 (2022).
- Nasrollahzadeh, M., Nezafat, Z., Shafiei, N., Soleimani, F. . Polysaccharides in Food Industry. , (2021).
- Shao, P., et al. Recent advances in improving stability of food emulsion by plant polysaccharides. Food Research International. 137, 109376 (2020).
- Sanz, M. L., Martínez-Castro, I. Recent developments in sample preparation for chromatographic analysis of carbohydrates. Journal of Chromatography. A. 1153 (1-2), 74-89 (2007).
- Bethke, G., Glazebrook, J. Cyclohexane diamine tetraacetic acid (CDTA) extraction of plant cell wall pectin. Bio-Protocol. 4 (24), e1357 (2014).
- Lu, Y., He, Q., Fan, G., Cheng, Q., Song, G. Extraction and modification of hemicellulose from lignocellulosic biomass: A review. Green Processing and Synthesis. 10 (1), 779-804 (2021).
- Jayasekara, S., Ratnayake, R. Microbial cellulases: an overview and applications. Cellulose. 22, 92 (2019).
- Verhertbruggen, Y., Marcus, S. E., Haeger, A., Ordaz-Ortiz, J. J., Knox, J. P. An extended set of monoclonal antibodies to pectic homogalacturonan. Carbohydrate Research. 344 (14), 1858-1862 (2009).
- Villares, A., Mateo-Vivaracho, L., Guillamón, E. Structural features and healthy properties of polysaccharides occurring in mushrooms. Agriculture. 2 (4), 452-471 (2012).
- Kračun, S. K., et al. Carbohydrate microarray technology applied to high-throughput mapping of plant cell wall glycans using comprehensive microarray polymer profiling (CoMPP). Methods in Molecular Biology. 1503, 147-165 (2017).
- Rajasundaram, D., et al. Understanding the relationship between cotton fiber properties and non-cellulosic cell wall polysaccharides. PLoS One. 9 (11), e112168 (2014).
- Michalak, L., et al. Microbiota-directed fibre activates both targeted and secondary metabolic shifts in the distal gut. Nature Communications. 11 (1), 5773 (2020).
- Salmeán, A. A., Hervé, C., Jørgensen, B., Willats, W. G., Mravec, J. Microarray glycan profiling reveals algal fucoidan epitopes in diverse marine metazoans. Frontiers in Marine Science. 4, 293 (2017).
- Knox, J. P. Revealing the structural and functional diversity of plant cell walls. Current Opinion in Plant Biology. 11 (3), 308-313 (2008).
- Manimala, J. C., Roach, T. A., Li, Z., Gildersleeve, J. C. High-throughput carbohydrate microarray profiling of 27 antibodies demonstrates widespread specificity problems. Glycobiology. 17 (8), 17-23 (2007).
- Stephen, P., Tseng, K. -. L., Liu, Y. -. N., Lyu, P. -. C. Circular permutation of the starch-binding domain: inversion of ligand selectivity with increased affinity. Chemical Communications. 48 (20), 2612-2614 (2012).
- Gunnarsson, L. C., Dexlin, L., Karlsson, E. N., Holst, O., Ohlin, M. Evolution of a carbohydrate binding module into a protein-specific binder. Biomolecular Engineering. 23 (2-3), 111-117 (2006).
- Moller, I., et al. High-throughput screening of monoclonal antibodies against plant cell wall glycans by hierarchical clustering of their carbohydrate microarray binding profiles. Glycoconjugate Journal. 25 (1), 37-48 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten