Method Article
고처리량 글라이칸 분석을 위한 마이크로어레이 폴리머 프로파일링(MAPP)
요약
마이크로어레이 폴리머 프로파일링(MAPP)은 생물학적 샘플에서 글라이칸의 조성 분석을 위한 고처리량 기술입니다.
초록
마이크로어레이 폴리머 프로파일링(MAPP)은 식물 및 조류 조직, 식품 재료, 인간, 동물 및 미생물 샘플을 포함한 다양한 생물학적 샘플 내에서 글리칸 및 글리코콘접합체의 조성 및 상대적 풍부도를 체계적으로 결정하는 견고하고 재현 가능한 접근 방식입니다. 마이크로어레이 기술은 소형화된, 높 처리량 검열 플랫폼을 제공해서 이 방법의 효험을 뒷받침해, 글리칸과 높게 특정한 글라이칸 지시한 분자 조사 사이 상호 작용의 수천이 단지 소량의 분석물을 사용하여 동시에 성격을 나타내는 것을 허용하. 구성 글라이칸은 화학적, 효소적으로 분획된 후 샘플에서 순차적으로 추출되어 니트로셀룰로오스 멤브레인에 직접 고정됩니다. 글라이칸 조성은 특정 글라이칸 인식 분자 프로브를 갈취 및 인쇄된 분자에 부착하여 결정됩니다. MAPP는 단당류 및 결합 분석 및 질량 분석법과 같은 기존의 글라이칸 분석 기법을 보완합니다. 그러나 글라이칸 인식 분자 프로브는 글라이칸의 구조적 구성에 대한 통찰력을 제공하여 생물학적 상호 작용 및 기능적 역할을 설명하는 데 도움이 될 수 있습니다.
서문
글라이칸은 모든 생명 영역에서 어디에나 존재하며 다른 거대분자에 비해 구조와 기능에서 비교할 수 없는 다양성을 나타냅니다1. 그러나 생합성 및 글리코시드 결합의 복잡성, 가변성, 글라이칸 구조를 해부하기 위한 적절한 방법의 부족으로 인해 구조 및 기능의 다양성에 대한 이해는 상대적으로 제한적입니다2.
많은 글라이칸 분석 기법은 파괴적이며, 글라이칸을 구성 단당류로 분해해야 하며, 이는 관련 3차원 및 생물학적 맥락을 모호하게 할 수 있습니다3. 반대로, 단클론 항체(mAb), 탄수화물 결합 모듈(CBM), 렉틴, 바이러스 응집소 및 미생물 부착물(총칭하여 글라이칸 인식 분자 프로브(GRMP)4)로 알려진 미생물 부착은 특정 에피토프를 인식하고 결합하며 복잡한 다중 글라이칸 매트릭스 내에서 글라이칸을 검출하고 구별하는 도구로 사용할 수 있습니다 5,6.
여기에서는 광범위한 생물학적 샘플에 적용할 수 있는 글라이칸 분석을 위한 빠르고 다재다능하며 비파괴적인 방법인 마이크로어레이 폴리머 프로파일링(MAPP)을 제시합니다. 이 방법은 다양한 생물학적 및 산업/상업 시스템의 글라이칸을 분석하기 위한 강력하고 처리량이 높은 기술을 제공하는 것을 목표로 합니다. MAPP은 글라이칸 유도 분자 프로브의 인식 특이성과 재현 가능한 고성능 마이크로어레이 스크리닝 기술을 결합하여 수천 개의 분자 상호 작용을 병렬로 프로파일링할 수 있도록 합니다. 이 접근법의 결과는 관심 있는 샘플 또는 조직 내에서 글라이칸의 조성 및 상대적 풍부도에 대한 진단적 통찰력입니다.
MAPP는 독립적이고 독립적인 방법으로 사용되거나 면역형광 현미경 검사(immunofluorescence microscopy)7,8,9 및 단당류 또는 결합 분석(linkage analysis)10,11과 같은 다른 생화학적 기법과 함께 사용할 수 있다. 이 기술은 또한 순수하고 구조적으로 잘 정의된 올리고당 표준물질로 인쇄된 어레이를 사용하여 새로운 GRMP의 에피토프 특이성을 매핑하는 데 사용할 수 있습니다12. 효소 결합 면역흡착 분석법(enzyme-linked immunosorbent assay, ELISA)과 같은 다른 방법에 비해 MAPP의 주요 장점은 소량의 시료와의 호환성이다13,14. 더욱이, MAPP는 상당히 높은 처리량의 분석(15)을 제공하며, 인쇄된 시료가 니트로셀룰로오스(16)에 고정될 때 건조하고 안정적이기 때문에 효과적인 형태의 시료 보존을 제공한다.
GRMP의 결합은 일반적으로 특정 다당류 부류(자일란, 만난, 자일로글루칸 등)에 고유한 결합 부위(에피토프)를 집합적으로 형성하는 여러 연속 당 잔기의 존재에 따라 달라집니다. 17. 대조적으로, 대부분의 생화학적 기술(예: 단당류 조성 또는 메틸화 분석)을 사용하여 정량화되는 개별 당 잔류물(자일로스, 만노스, 포도당)은 여러 다당류 계열의 성분이 될 수 있으므로 할당하기 어려울 수 있습니다18.
MAPP는 기술 격차, 즉 소량의 물질을 사용하여 다양한 소스의 여러 글라이칸을 신속하게 분석할 수 있는 능력에 대응하여 개발되었습니다. MAPP는 지난 30년 동안 개발되고 특성화된 GRMP의 광범위한 레퍼토리를 활용합니다 12,19,20,21,22,23,24,25,26,27,28,29,30,31,32. MAPP의 개발은 반복적인 과정이었으며, 이 기술은 꾸준히 개선되고 최적화되었다. 현재 글라이칸이 중심적인 역할을 하는 다양한 자연 및 산업 시스템에 대한 MAPP의 적용을 설명하는 상당한 양의 문헌이 있습니다 5,6,9,10,21,33,34,35,36,37,38,39. 여기서는 MAPP의 최신 기술에 대해 설명합니다.
프로토콜
MAPP 방법의 주요 실험 단계는 그림 1에 요약되어 있습니다.
1. 샘플 준비
참고: 여기서, 이 방법은 예시 목적으로 식물 조직에 적용된다. 선택된 식물은 Coffea arabica, Allium sativum var. ophioscorodon 및 여러 태국 망고 품종 (Aokrong, Kam, Rad, Chokanan, Mamkamdang, Talabnak, Mahachanok 및 Nga)이었습니다. 식물은 상업적 중요성을 위해 선택되었습니다. 인간이 소비하기 위한 가공은 현재 충분히 활용되지 않는 농업 산업 폐기물을 생성하며, 이는 순수 글리칸을 포함한 부가가치 제품의 공급원을 제공할 수 있습니다. 따라서, MAPP는 바이오프로스펙팅 목적으로 폐기물 플랜트 바이오매스의 글리칸 조성을 특성화하기 위해 적용되었다.
- 식물 재료를 다른 조직(예: 뿌리, 줄기 및 잎)으로 분리합니다.
- 식물 조직을 40°C의 열풍 오븐에서 12-24시간 동안 건조시킵니다(샘플에 따라 시간 감소/증가). 또는 샘플을 액체 질소에 스냅 얼린 후 ~4일 동안 동결건조합니다.
- 각 튜브에 볼 베어링이 있는 유봉과 모르타르 또는 기계 조직 용해기( 재료 표 참조)를 사용하여 샘플을 미세한 분말로 균질화합니다.
알림: 신선한 식물 조직의 경우 균질화 전에 건조 또는 동결 건조하는 것이 좋습니다. 일반적으로 유봉과 모르타르를 사용한 균질화는 대부분의 건조 샘플에 충분합니다. 곡물, 콩류 및 파스타와 같은 가공 식품과 같이 특히 탄력적인 시료의 경우 액체 질소에서 급속 냉동하면 시료 균질화의 속도와 효율성을 높일 수 있습니다. 기계적 균질화는 거의 모든 시료 유형과 호환되고, 훨씬 더 빠르고 노동 집약적이며, 동일한 장비(예: 유봉 및 모르타르)의 반복적인 사용으로 인한 시료 교차 오염 위험을 효과적으로 최소화한다는 것을 발견했습니다.
2. 알코올 불용성 잔류물(AIR)의 제조
- 70%(v/v) 에탄올 1.5mL를 50-100mg의 공기 건조 및 균질화된 시료 물질에 첨가합니다.
- 와류를 완전히 혼합한 후 실온에서 10분 동안 10,000 x g 으로 원심분리합니다. 피펫을 사용하여 생성된 상층액을 버리고 펠릿을 보관합니다.
- 나머지 펠릿에 1.5mL의 메탄올과 클로로포름(1:1 [v/v])을 추가합니다. 2.2 단계에 따라 와류, 원심 분리 및 상층액을 폐기합니다.
- 나머지 펠릿에 1.5mL의 100% 아세톤을 추가합니다. 2.2 단계에 따라 와류, 원심 분리 및 상층액을 폐기합니다.
- 생성된 펠릿을 흄 후드에 밤새 넣어 잔류 아세톤이 증발하도록 하거나 건조될 때까지 진공 원심분리기에 넣습니다.
알림: AIR 재료는 필요할 때까지 주변 온도에서 보관할 수 있습니다.
3. 글라이칸 추출
알림: 가능하면 재부유를 돕기 위해 각 튜브에 볼 베어링이 있는 조직 용해기에서 모든 추출 단계를 수행하십시오. 조직 용해기를 사용할 수 없는 경우 연속 교반 또는 진탕으로 대신 추출을 수행할 수 있습니다. 이것이 가능하지 않은 경우 추출 시간을 연장해야 할 수도 있습니다.
- 10mg의 AIR 물질에 pH 7.5의 50mM 시클로헥산디아민테트라아세트산(CDTA, 재료 표 참조) 30μL/mg을 추가합니다.
- 27Hz에서 2분 동안 흔든 다음 10Hz에서 2시간 동안 흔듭니다.
- 10,000 x g 에서 4°C에서 10분 동안 원심분리합니다. 생성된 상층액을 유지하고 멸균 마이크로 원심분리기 튜브에 첨가한 다음 회전식 셰이커에서 4°C에 보관합니다.
- 잔류 펠릿에 30 μL/mg 4 M NaOH + 0.1 % (w/v) NaBH4를 첨가합니다.
주의: NaBH4 는 삼키면 독성이 있습니다. 개인 보호 장비(PPE)를 사용하십시오. 흄 후드 아래에서 다루십시오. 먼지가 생기지 않도록 하십시오. 먼지를 흡입하지 마십시오. 제품이 물에 닿지 않도록 하세요. - 3.2단계부터 3.3단계까지 반복합니다. 잔류 펠릿을 dH2O로 2-3 회 세척하여 잔류 NaOH를 제거한다.
- 펠릿에 30μL/mg 셀룰라아제(바람직하게는 GH5 엔도-1,4-β-글루카나아제, 제조업체에서 권장하는 적절한 효소 완충액, 재료 표 참조)를 펠릿에 첨가하고 효소 최적 온도에서 16시간 동안 배양합니다.
- 샘플을 10,000 x g 에서 4°C에서 10분 동안 원심분리합니다. 상층액을 유지하고 깨끗한 마이크로 원심분리기 튜브로 옮긴 다음 회전식 셰이커에서 4°C에서 보관합니다. 추출된 샘플은 가능한 한 빨리 인쇄해야 합니다.
- 저장된 모든 추출물을 다시 10,000 x g 에서 4°C에서 10분 동안 원심분리합니다.
알림: 샘플에는 미립자와 이물질이 없어야 합니다. 필요한 경우 마이크로어레이 인쇄 전에 0.2μm 스핀 필터를 통과시킵니다. 특히 점성이 있는 샘플은 마이크로어레이 모세관과 프린트 헤드가 쉽게 막힐 수 있기 때문에 마이크로어레이 분석과 호환되지 않습니다. 일반적으로 사용자는 표준 저용량 피펫으로 인쇄하려는 모든 샘플을 피펫팅할 수 있어야 합니다.
4. 표준의 준비
- 멸균 dH2O에서 정의된 글라이칸 표준물질(표 1)의 1mg/mL 용액을 준비합니다. 파키만을 표준으로 사용하는 경우 대신 4M NaOH에 용해시키고 가용화 후 빙초산으로 중화합니다.
- 준비된 표준물질을 회전식 쉐이커에서 4°C에서 하룻밤 동안 보관하여 완전히 용해되도록 합니다.
- 모든 표준물질을 4°C에서 10,000 x g 에서 10분 동안 원심분리하여 파편을 펠릿화합니다. 결과 상층액은 후속 인쇄에 사용됩니다.
5. 마이크로어레이 인쇄
- 글리세롤 시스템 완충액(GSB, 47% 글리세롤, 52.9% dH2O, 0.06% Triton X-100 및 0.04% 살생물제[물에 0.15%-0.17% 질산구리 및 1.4%-2.0% 질산마그네슘 혼합] 및 필터 멸균)에 검은색 인도 잉크/드로잉 잉크의 1:20(v/v) 희석액을 준비하고 15,000 x g(실온)에서 10분 동안 원심분리합니다.
참고: 잉크 용액은 인쇄된 샘플의 주위에 상단과 하단 테두리를 만들어야 인쇄된 마이크로어레이가 멤브레인에서 육안으로 감지될 수 있습니다. 그러나 잉크 용액에는 침전물이 포함될 수 있습니다. 모든 용액에는 인쇄를 위한 미립자가 없어야 하므로 피펫팅 시 침전물을 건드리지 마십시오. 이것이 더 이상 가능하지 않으면 버리고 새로 준비하십시오. 이 용액은 미립자를 제거하기 위해 쉽게 여과할 수 없습니다. - 40μL의 잉크 용액과 GSB를 첫 번째 384웰 플레이트의 첫 번째 섹션에 추가합니다(그림 2).
- 모든 희석 1(D1) 웰에 25μL의 GSB를 추가합니다. 모든 희석 2, 3 및 4(D2-D4) 웰에 40μL의 GSB를 추가합니다.
- 추출된 글라이칸 시료 25μL를 D1 웰에 순서대로 추가하여 추출된 글라이칸 시료와 정의된 글라이칸 기질을 GSB로 1:1(v/v)로 희석합니다.
- D1 웰에서 샘플의 10μL를 채취하고 D2 웰에 추가하여 각 샘플을 4번 순차적으로 희석합니다. 피펫으로 부드럽게 흡인하여 혼합합니다.
- D2 웰에서 10μL의 샘플을 채취하여 D3 웰에 추가하여 프로세스를 반복합니다.
- D4 웰에 대해 반복합니다. 혼합 후 D4 웰에서 10μL를 버리면 각 웰에 최종 부피가 40μL가 포함됩니다.
- 40μL의 잉크 용액과 GSB를 최종 플레이트의 최종 블록에 추가합니다.
- 접착판 덮개로 플레이트를 덮고 3,000 x g (실온)에서 10분 동안 원심분리합니다. 원심분리 후 기포가 남아 있지 않은지 확인하고 필요한 경우 반복합니다.
- 비접촉식 압전 마이크로어레이 인쇄 로봇을 사용하여 아래 단계에 따라 샘플을 니트로셀룰로오스 멤브레인( 재료 표 참조)에 인쇄합니다.
참고: 다음은 최적의 인쇄 품질을 위해 권장되는 작업입니다. 그러나 필요한 특정 매개변수는 궁극적으로 사용되는 기기에 따라 다릅니다. 사용자는 기기 제조업체에 문의하여 장치에 필요한 적절한 사용자 정의 및 인쇄 설정에 대해 논의하는 것이 좋습니다.- 인쇄하기 전에 폐기물 버퍼 저장소를 비우고 필요에 따라 깨끗한 버퍼 저장소에 깨끗한 GSB를 채웁니다. 기기를 켜고 습도 및 온도 제어 시스템이 통합된 경우 >10분 동안 안정화되도록 합니다. 마이크로어레이를 켜고 시스템을 초기화합니다.
알림: 기기의 내부 압력을 결정하기 위해 테스트를 실행하는 것이 좋습니다. 압력이 너무 낮으면 고압 퍼지를 수행해야 할 수 있습니다. 다시 말하지만, 기기 제조업체에 연락하여 특정 기기의 특정 작동에 대해 논의하십시오. - GSB로 프린트 헤드와 모세관을 여러 번 퍼지하여 이물질과 잠재적 오염 물질을 제거합니다. GSB 플레이트만 로드하거나 로드된 플레이트의 샘플 흡인을 우회하여 깨끗한 버퍼 저장소에서 직접 인쇄하도록 기기를 설정하여 테스트 인쇄를 수행합니다.
알림: 니트로셀룰로오스 멤브레인을 사용하여 테스트 인쇄를 수행할 필요는 없습니다. 깨끗한 현미경 슬라이드로 충분하며 샘플 인쇄 전에 스폿 크기, 모양 및 품질을 육안으로 평가할 수 있다는 장점이 있습니다. - 추출된 글라이칸 샘플을 인쇄할 때 각 샘플 사이에 깨끗한 GSB로 플러시하도록 시스템을 프로그래밍합니다.
참고: 일반적으로 인쇄된 스폿당 시료 부피는 100pL - 10nL이며, 스폿 크기는 선택한 시료 부피에 따라 20μm에서 100μm 사이입니다. 하나의 소스 384웰 플레이트에서 100개의 마이크로어레이를 인쇄하는 데 시스템 플러싱을 포함하여 약 40분이 걸립니다. 결과 마이크로 어레이의 크기는 약 1cm2 입니다. 플레이트를 추가하면 어레이의 길이가 플레이트당 약 1cm 늘어납니다. 인쇄된 마이크로어레이 설계의 개략도는 그림 3에 나와 있습니다. 일단 인쇄되면, 마이크로어레이는 즉시 사용할 준비가 되어 있으며 몇 년 동안 보관할 수 있습니다. 어떤 이유로든 인쇄 작업을 반복해야 하는 경우, 인쇄 중 샘플이 증발할 가능성이 있으므로 새 샘플 플레이트를 로드하고 원래 플레이트를 폐기하는 것이 좋습니다. - 일주일에 한 번 프린트 헤드와 모세관을 철저히 청소하십시오. GSB에 농축된 NaOH를 1:20 희석한 384웰을 로드하고 현미경 슬라이드에 40분에서 1시간 동안 인쇄하여 이 작업을 수행합니다. 사용자는 계속하기 전에 이 세척 용액이 기기와 호환되는지 확인해야 합니다.
- 인쇄하기 전에 폐기물 버퍼 저장소를 비우고 필요에 따라 깨끗한 버퍼 저장소에 깨끗한 GSB를 채웁니다. 기기를 켜고 습도 및 온도 제어 시스템이 통합된 경우 >10분 동안 안정화되도록 합니다. 마이크로어레이를 켜고 시스템을 초기화합니다.
- 다운스트림 분석을 위해 인쇄된 마이크로어레이용으로 생성된 고유한 그리드 파일(.gal 파일)을 저장합니다.
6. 마이크로어레이 프로빙
- 니트로셀룰로오스 멤브레인에서 개별적으로 동일한 인쇄된 마이크로어레이를 잘라내어 프로빙을 위해 적절한 크기의 용기(예: 12웰 또는 24웰 마이크로타이터 플레이트)에 넣습니다( 재료 표 참조). 어레이는 용기 바닥에 평평하게 놓여야 합니다. 프로브 당 하나의 마이크로 어레이가 필요하며 하나의 기술 복제를 나타냅니다.
- 비특이적 결합을 줄이려면 MP-TBST 차단 완충액(1x Tris-완충 식염수, pH 7.5, + 0.1% [v/v] TWEEN 20 [TBST]에서 마이크로어레이를 1시간 동안 배양하고 회전/로킹 셰이커에서 5% [w/v] 탈지유 분말, 재료 표 참조)을 보충합니다. 볼륨이 전체 어레이를 잠글 수 있을 만큼 충분한지 확인합니다.
- 배양 후 MP-TBST를 제거하고 새로운 용량의 MP-TBST로 교체합니다.
- MP-TBST에서 1:10-1:1,000(제조업체 지정, 재료 표 참조)으로 1:10-1:1,000(제조업체 지정, 재료 표 참조)을 회전/로킹 셰이커에서 2시간 동안 희석한 단클론 항체(mAb) 또는 His-태그 CBM 또는 기타 GRMP(예: 렉틴)로 어레이를 배양합니다.
- 배양 후 분자 프로브 용액을 제거하고 깨끗한 TBST로 어레이를 덮어 어레이가 완전히 잠기도록 합니다. 잔류 프로브 용액을 제거하려면 즉시 TBST를 제거하고 새 볼륨으로 교체하십시오. 어레이를 회전/흔들리는 셰이커에 5분 동안 놓습니다. 5분 후 TBST를 제거하고 새 볼륨으로 교체한 다음 회전/흔들리는 셰이커에 5분 동안 놓습니다.
알림: 이 프로세스는 TBST의 초기 추가 및 즉시 제거를 제외하고 세 번 반복해야 합니다. - MP-TBST에서 1:1,000으로 1:1,000으로 희석한 알칼리-인산가수분해효소 접합 2차 항체(적절한 경우 항-마우스, 항-쥐, 항-토끼, 항-His, 적절한 경우, 재료 표 참조)로 어레이를 배양합니다.
참고: 양 고추냉이 과산화효소 접합 2차 항체도 적합하며, 발색을 위해 테트라메틸 벤지딘(TMB)/과산화수소 기질과 함께 사용됩니다. - 배양 후 6.5단계에 따라 세척 절차를 반복하여 비특이적으로 결합된 2차 항체를 제거합니다.
- 항체 결합의 발색 검출을 위해 니트로 블루 테트라졸륨(NBT)/5-브로모-4-클로로-3-인돌릴-포스페이트(BCIP) 발색 용액( 재료 표 참조)으로 어레이를 덮습니다. 항원 결합 부위에 보라색 침전물 반점이 생길 때까지 그대로 두십시오(일반적으로 5-30분, 그러나 반응이 빠르게 발생할 수 있으므로 과포화를 피하기 위해 어레이를 면밀히 모니터링해야 함).
주의 : BCIP는 피부에 닿으면 유해하며 호흡기 자극을 유발할 수 있습니다. PPE를 사용하십시오. 먼지가 생기지 않도록 하십시오. 먼지를 흡입하지 마십시오. - 반응을 종료하려면 어레이를 깨끗한 수돗물에 담그고 광범위하게 세척하십시오.
- 주위 온도에서 밤새 압지 사이에 어레이를 놓아 건조시킵니다.
- 명백한 결함이 있는 어레이는 폐기하고 이러한 경우 프로빙 프로토콜을 반복합니다(그림 4).
7. 분석 및 정량화
- 데스크탑 스캐너를 사용하여 2,400dpi(인치당 도트 수) 해상도로 개발된 어레이를 스캔합니다. 이미지를 TIFF 파일로 변환한 다음 네거티브로 변환합니다.
- 마이크로어레이 분석 소프트웨어( 재료 표 참조)를 사용하여 고유한 .gal 그리드 파일을 각 마이크로어레이 이미지에 오버레이하여 각 항원 결합 부위에서 생성된 스폿의 색상 강도를 계산하고 로컬 배경을 뺍니다.
- 그리드 데이터를 .txt 파일로 내보냅니다. 그런 다음 분석을 위해 Excel 시트로 수동으로 가져올 수 있습니다.
- 먼저 각 시료 희석에 대해 스폿 강도를 평균화한 다음 포함된 생물학적 복제에 대해 스폿 강도를 평균화하여 각 시료에 대한 평균 스폿 신호 강도 값을 생성합니다.
- 가장 높은 평균 스폿 신호 강도에 값 100을 할당하고 그에 따라 나머지 데이터를 정규화합니다.
참고: 정규화된 평균 스폿 신호 강도는 Excel33의 조건부 서식 함수를 사용하거나 R ggplot2 패키지40,41의 geom_tile 함수를 사용하여 상대 글리칸 에피토프 풍부도의 히트맵으로 표시할 수 있습니다.
결과
MAPP는 태국 북부 여러 품종의 망고 껍질, 아라비카 체리 펄프 및 커피 콩 가공 폐기물, 태국 흑마늘의 뿌리, 줄기 및 잎 조직으로 구성된 농업 바이오매스 폐기물의 글라이칸 조성을 측정하기 위해 적용되었습니다. 여러 식물 유래 다당류는 식품 산업에서 기능성 성분으로 사용됩니다42,43. 따라서 이 실험의 목적은 이러한 풍부하고 현재 충분히 활용되지 않는 농업 산업 폐기물이 부가가치 순수 다당류의 공급원을 제공할 수 있는지 여부를 추론하는 것이었습니다.
AIR 물질은 글라이칸 분석(44)을 위한 시료를 준비하기 위해 일상적으로 사용된다. AIR를 사용하면 몇 가지 이점이 있습니다. 용매로 처리하면 내인성 CAZymes, 대사 산물, 소당류, 지질 및 색소를 효과적으로 제거하여 다당류 및 구조 단백질이 풍부한 샘플을 얻을 수 있습니다34. 또한 AIR를 생산하는 것은 내열성이 있고 몇 년 동안 보관할 수 있기 때문에 시료 수명을 늘리는 빠르고 효과적인 방법입니다.
구성 글라이칸의 3가지 혼합 분획을 CDTA, NaOH 및 셀룰라아제를 사용하여 식물 AIR 물질로부터 순차적으로 추출했습니다. CDTA는 Ca2+ 이온을 킬레이트화하여 식물 세포벽으로부터 Ca2+ 가교 탈에스테르화된 펙틴을 제거할 수 있다(45). 알칼리성 조건은 셀룰로오스 마이크로피브릴과 헤미셀룰로오스, 리그닌과 헤미셀룰로오스 사이의 에스테르 결합의 파괴 및 에스테르 결합의 비누화로 인해 만난, 자일란 및 β-글루칸과 같은 주로 헤미셀룰로오스가 방출될 수 있도록 합니다(46). 바실러스 종(Bacillus spp.)으로부터의 재조합 엔도-1,4-β-글루카나제(endo-1,4--glucanase)를 사용하여 구조적 셀룰로오스 마이크로피브릴의 비정질 영역을 분해하고, 세포벽 내에서 셀룰로오스에 결합된 잔류 글리칸을 방출하였다(47). 이 방법은 글라이칸을 이 세 가지 광범위한 그룹으로 효과적으로 분리하지만 샘플이 순수하지 않다는 점에 유의해야 합니다. 추출 방법의 특성상 헤미셀룰로오스가 샘플에 존재하는 경우 필연적으로 추출되고 이후에 CDTA 및 셀룰라아제 분획에서 다양한 정도로 검출됩니다. 마찬가지로, 샘플에 존재하는 경우 NaOH 추출에서 일부 펙틴이 검출됩니다.
비접촉식, 압전 마이크로어레이 프린팅 로봇을 사용하여 추출된 글리칸 분획물을 비공유 부착물(11)을 통해 니트로셀룰로오스에 고정시켜 300개의 동일한 마이크로어레이를 형성하였다. 정의된 글라이칸 표준물질(표 1)도 포지티브 대조군으로 인쇄된 마이크로어레이에 포함되었습니다(그림 5). 선택된 글라이칸 표준물질에 대해 얻어진 MAPP 결합 프로파일은 이전에 보고된 에피토프 특이성에 해당한다. 예를 들어, LM21은 여러 만난 다당류(갈락토만난 및 글루코만난)에 강한 결합을 보인 반면, LM22는 갈락토만난25에 약한 결합만을 나타냈습니다. 유사하게, LM19는 탈에스테르화된 호모갈락투로난48에 우선적으로 결합하고, LM15는 타마린드 종자 자일로글루칸23에 결합한다.
비셀룰로오스 식물 세포벽 다당류를 진단하는 16개의 에피토프의 상대적 풍부도는 인쇄된 추출물에 글리칸 지향 단클론 항체(표 2)를 부착하여 검출되었습니다(그림 6). 추출된 글라이칸의 대부분은 알칼리성 NaOH 분획 내에서 검출되었습니다. 테스트된 모든 망고 품종의 껍질 내에서 자일란/아라비녹실란을 나타내는 mAb LM10 및 LM11에 대한 강력한 결합 신호가 기록되었습니다. 마늘 샘플 내에서 LM10 및 LM11은 뿌리 조직 추출물(마늘 R)에 우선적으로 결합하고 잎 조직 추출물(마늘 L)에 약한 결합만 나타냈습니다. LM19는 부분적으로 메틸 에스테르화 또는 비에스테르화된 호모갈락투로난을 나타내며 일부 망고 품종 추출물(Aokrong 및 Talabnak)에 강하게 결합하지만 다른 품종(Chokanan, Mamkamdang, Mahachanok 및 Nga)에서는 약하게만 결합되거나 결합이 검출되지 않았습니다. 또한, LM19는 커피 펄프 분획물에만 결합하고 커피 원두 가공 폐기물 물질에는 결합하지 않았으며, 이전에는 반정제 커피 펙틴으로 구성된 것으로 생각되었습니다(미공개 데이터).
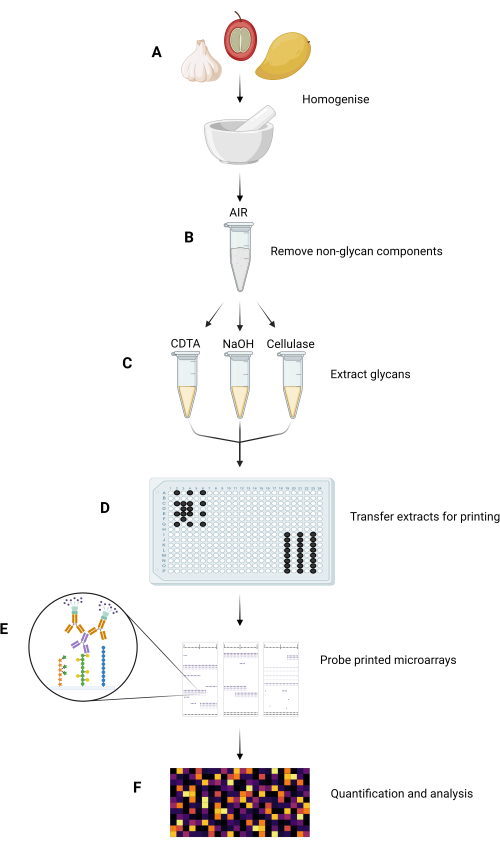
그림 1: MAPP 방법의 주요 실험 단계. (A) 샘플은 균질화되어 미세 분말을 형성합니다. (B) 균질화된 샘플은 AIR을 분리하기 위해 처리됩니다. (C) 구성 글라이칸은 맞춤형 추출 방식을 사용하여 순차적으로 추출됩니다. (D) 추출된 글라이칸 분획물, 잉크 및 GSB는 니트로셀룰로오스에 인쇄하기 위해 플레이트 레이아웃에 따라 384웰 플레이트로 전사됩니다. (E) 인쇄된 마이크로어레이는 선택된 GRMP로 프로브됩니다. (F) 인쇄된 글라이칸 분획에 대한 GRMP 결합은 데이터가 히트맵으로 표시되기 전에 정량화되고 분석됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
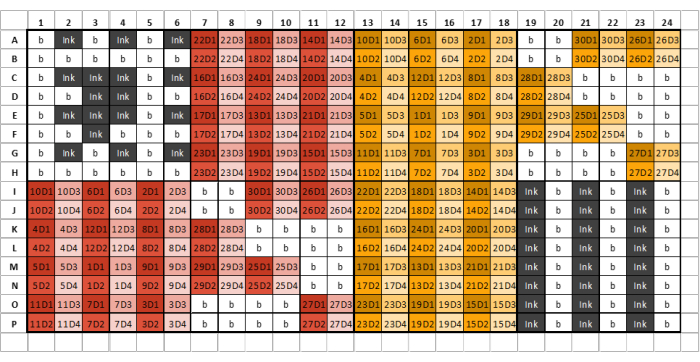
그림 2: 추출된 글라이칸 시료/표준물질당 4개의 희석액을 사용하여 시료, 잉크 및 GSB 로딩을 위한 384웰 플레이트 레이아웃의 예. 다른 색상은 다른 추출 시약에서 발생하는 샘플을 나타내고, 다른 음영은 연속 희석을 나타냅니다. 코드의 첫 번째 숫자는 샘플 번호를 나타내고 끝 숫자는 희석 번호를 나타냅니다(D1은 희석 1, D2는 희석 2 등). 예를 들어, 잘 표시된 '12D3'은 글라이칸 샘플 12, 희석 3을 나타냅니다. 웰 플레이트는 6개의 열과 8개의 행으로 구성된 8개의 동일한 섹션으로 나뉘어야 합니다. 첫 번째 플레이트의 첫 번째 섹션에는 잉크와 버퍼만 포함되어야 하며 예제 플레이트 레이아웃과 유사해야 합니다. 추출된 글라이칸 샘플은 플레이트 레이아웃에 따라 후속 플레이트 섹션에 로드할 수 있습니다. 다른 추출 시약을 동일한 플레이트 섹션에 로드해서는 안 됩니다. 샘플이 부족하여 전체 섹션을 채울 수 없는 경우 해당 섹션의 나머지 모든 웰을 완충액으로 채웁니다. 우물을 비워 두지 마십시오. 여러 개의 플레이트가 필요한 경우 모든 샘플을 로드한 후 다음 섹션에는 3개의 교대 잉크 열이 포함되어야 하며 GSB(인쇄되는 샘플 수에 따라 섹션 8이 아닐 수 있음)가 포함되어야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
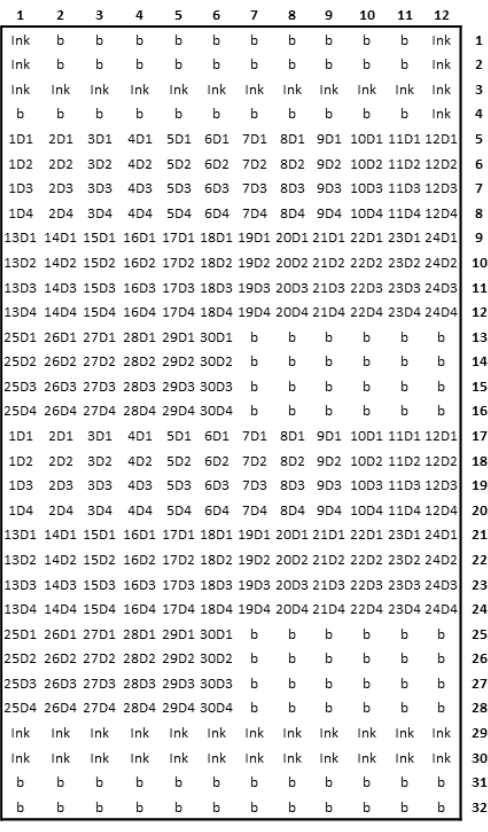
그림 3: 인쇄된 마이크로어레이 설계의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
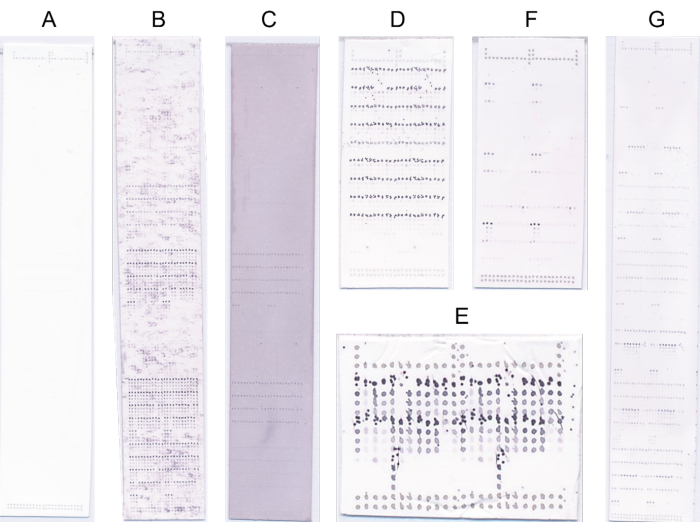
그림 4: 대표적인 마이크로어레이. (A) 바인딩이 없습니다. (B) 바인딩 신호는 높은 배경 신호에 의해 가려집니다. (C) NBT/BCIP의 과포화로 인한 일반화된 청색/보라색 염색. (D) 높은 기판 농도로 인한 프로빙 결함. (E) 프린트 헤드가 깨끗하지 않아 인쇄가 잘못되었습니다. (F) 소수의 샘플에 대한 강력한 결합. (G) 많은 샘플에 대한 강력한 결합. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
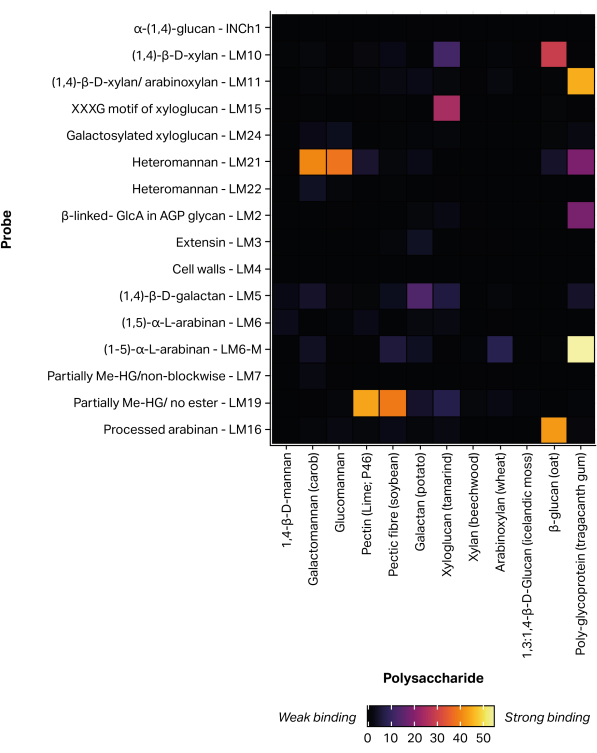
그림 5: 정의된 글라이칸 표준물질에 대한 단클론 항체 결합, 프린팅 및 프로빙 공정을 검증하기 위해 포함됨. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
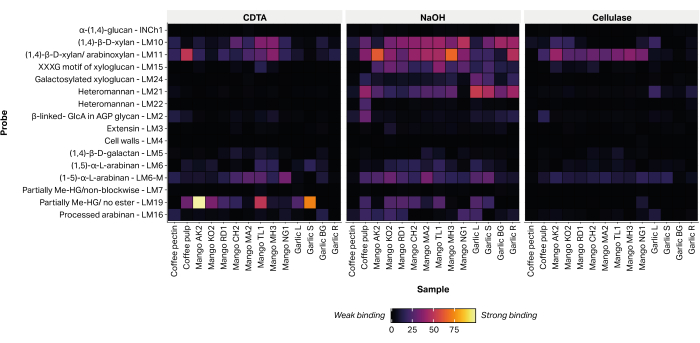
그림 6: 농업 바이오매스 폐기물에서 추출한 글라이칸의 MAPP. 샘플에는 커피 펄프 폐기물(커피 펄프 및 커피 펙틴), 여러 태국 품종의 망고 껍질(AO, Aokrong; KO, 캄; RD, 라드; CH, 초카난; MA, 맘캄당; TL, 탈라브낙; MH, 마하차녹; NG, Nga) 및 흑마늘 잎(Garlic L), 줄기(Garlic S), 구근(Garlic BG) 및 뿌리(Garlic R)를 CDTA, NaOH 및 셀룰라아제(Bacillus spp. cellulase 5A)를 사용합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: MAPP 분석에 사용되는 상업용 다당류 표준물질을 양성 대조군으로 정의함. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 추출된 식물 글라이칸 마이크로어레이의 조사를 위해 선택된 글라이칸 지향 단클론 항체. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
여기에 설명된 MAPP 기법은 이제 글라이칸 분석을 위한 잘 정립된 방법입니다. 기본 원리는 2007년11에서 처음 기술되었습니다, 그러나 기술은 마이크로어레이 기술, 분자 탐침 발달에 있는 최신 혁신, 및 글리칸 생화학의 우리의 이해에 있는 전진을 이용하기 위하여 지속적인 발달을 겪었습니다. 일반적으로 글라이칸, 특히 다당류는 구조적 복잡성과 이질성(heterogeneity)45 뿐만 아니라 쉽게 염기서열을 분석하거나 합성할 수 없다는 사실 때문에 단백질 및 뉴클레오티드보다 분석하기가 더 어렵다1. 대부분의 경우, 단일 기술로는 글라이칸 복잡성을 결정적으로 해독할 수 없습니다. 따라서 MAPP는 종종 다른 방법과 함께 사용됩니다. 이것은 AIR 준비가 MAPP의 출발점으로 통상적으로 선택되는 이유 중 하나인데, 그 이유는 AIR가 대부분의 다른 글라이칸 분석 방법(34)과 호환되어, 데이터셋의 후속 비교를 용이하게 하기 때문이다.
AIR 준비 전 시료의 균질화로 인해 일부 공간 정보가 항상 손실됩니다. 그러나, 다당류가 샘플로부터 순차적으로 방출됨에 따라, 얻어진 분획물에서 에피토프의 존재는 그 샘플의 분자 구조 및 조성에 관한 정보를 제공한다17. 따라서 적절한 추출 방식을 선택하는 것이 분석법의 성공에 매우 중요합니다. 여러 파라미터가 추출 방법의 적합성을 결정한다: 세포 구조, 시간, 온도, pH, 압력, 용매의 이온 강도 및 고체 미립자 시료의 입도(49). 구성 성분 글라이칸을 성공적으로 추출하고 시료의 대표적인 조성 그림을 구축할 가능성을 극대화하기 위해 점점 더 공격적인 용매를 사용하는 것이 좋습니다. 대부분의 샘플에서 CDTA, NaOH 및 셀룰라아제는 식물 유래 저장 및 세포벽 다당류 33,50,51,52를 제거하기에 충분합니다. 일부 조직 샘플의 경우 CaCl2, HCl 및 Na2CO3 를 포함하는 하이브리드 추출 방식이 성공적인 것으로 나타났습니다53 해양 미세 조류 샘플은 에틸렌 디아민 테트라 아세트산 (EDTA) 10을 첨가해야 할 수 있습니다.
마이크로어레이는 양성 대조군으로 사용할 수 있는 순수하고 정의된 글라이칸 표준물질의 범위를 포함해야 한다5. 포함된 표준물질은 샘플의 특성에 따라 수정해야 합니다. 인쇄가 완료되면 적절한 GRMP를 선택해야 합니다. 다당류 구조에 대한 하이브리도마 mAb의 생성은 도전적입니다54; 글라이칸-결합 항체는 올리기 어렵고 낮은 친화도를 가질 수 있다55. 다행히도, CBM에 대한 유전자 서열 정보는 재조합 발현4 및 이들의 결합 특이성 엔지니어링(56,57)에 대해 비교적 쉽게 얻을 수 있다. 인상적인 GRMP 카탈로그가 개발되었지만, 자연에 존재하는 글라이칸 구조의 다양성에 비해 현재 대부분은 상업적 출처에서 구할 수 있지만, 극히 일부만이 생산되어 성공적으로 특성화되었습니다58. 이로 인해 특정 구조를 감지하고 구별하는 기능이 제한될 수 있습니다. 결합 특이성이 잘 특성화되어 있을 것으로 예상되는 각 주요 글라이칸 구조를 대표하는 하나 또는 두 개의 프로브를 사용하여 초기 프로브 실험을 수행하는 것이 좋습니다. 후속 프로빙 실험에서 프로브 목록을 확장하여 더 넓은 범위의 글라이칸을 포함하고 미세 구조를 더 깊이 파고들 수 있습니다.
평범하지만, 각 배양 단계 후에 마이크로어레이를 철저히 세척하는 것은 프로빙 절차의 성공에 기본입니다. 비특이적으로 결합된 프로브를 비효율적으로 제거하면 색상 발광 후 높은 배경 신호를 유발하여 결과를 모호하게 만들 수 있습니다. 이 경우 새 마이크로어레이부터 시작하여 프로빙 절차를 반복해야 합니다. 또한 어레이는 드물게 접촉해야 하며 집게로 가장자리를 고정해야 합니다. 니트로셀룰로오스 멤브레인은 부서지기 쉽고 쉽게 손상됩니다. 색상 현상 솔루션은 균열과 주름에 모여 과포화를 일으켜 어레이 분석을 방해합니다.
MAPP는 빠르고, 적응력이 뛰어나며, 편리하다. 이 방법은 생물학적 또는 산업 시스템에서 파생된 동물, 미생물 또는 식물 글라이칸을 추출하여 니트로셀룰로오스에 고정할 수 있고 적절한 분자 프로브가 있는 한 호환됩니다. 생성된 데이터는 다른 글라이칸 분석 방법을 통해 쉽게 얻을 수 없는 상세한 반정량적 조성 통찰력을 제공합니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
저자는 마이크로어레이 로봇 공학에 대한 전문적인 조언을 해준 ArrayJet에 감사의 뜻을 전합니다. SS와 JS는 치앙마이 대학교의 Fundamental Fund 2022(FF65/004)의 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 1,3:1,4-β-D-Glucan, Lichenan (icelandic moss) | Megazyme | P-LICHN | |
| 1,4-β-D-Mannan | Megazyme | P-MANCB | |
| 384-well microtiter plate | Greiner Bio-One | M1686 | |
| 5-bromo-4-chloro-3-indolyl-phosphate (BCIP) | Melford | B74100-1.0 | |
| Acetone | Sigma | 270725 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 115-055-003 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Rat IgG (H+L) | Jackson ImmunoResearch | 112-055-003 | |
| Alkaline Phosphatase AffiniPure Rabbit Anti-His Tag | Jackson ImmunoResearch | 300-055-240 | |
| Arabinoxylan (wheat) | Megazyme | P-WAXYL | |
| Array-Pro Analyzer Software | Media Cybernetics | Version 6.3 | |
| Bacillus sp. Cellulase 5A (BCel5A) | NZYTech | CZ0564 | |
| BAM antibodies | SeaProbes | Various | |
| Black drawing ink (indian ink) | Winsor & Newton | GWD030 | |
| Carbohydrate binding modules | NZYTech | Various | |
| CCRC antibodies | CarboSource | Various | |
| CDTA | Sigma | 319945 | |
| Chloroform | Sigma | PHR1552 | |
| Ethanol | Sigma | 1.11727 | |
| Galactan (potato) | Megazyme | P-GALPOT | |
| Galactomannan (carob) | Megazyme | P-GALML | |
| Glycerol solution | Sigma | 49781-5L | |
| Gum tragacanth (legumes) | Sigma-Aldrich | G1128 | |
| INCh antibodies | INRA | Various | |
| LM and JIM antibodies | PlantProbes | Various | |
| Marathon Argus Microarray Printer | ArrayJet | ||
| Methanol | Sigma | 34860 | |
| Monoclonal antibodies | Biosupplies Australia | Various | |
| NaBH4 | Sigma | 452882 | |
| NaOH | Sigma | S5881 | |
| Nitro-blue tetrazolium (NBT) | Melford | N66000-1.0 | |
| Nitrocellulose membrane | Thermo Fisher Scientific | 88018 | |
| Pectin (degree of methyl esterification 46%) | Danisco | NA | |
| ProClin 200 | Sigma | 48171-U | |
| Rhamnogalacturonan (soybean pectic fibre) | Megazyme | P-RHAGN | |
| Rotating mixer | Fisher Scientific | 88-861-050 | |
| Rotating/rocking Shaker | Cole-Parmer | ||
| Skimmed milk powder | Marvel | ||
| Spin filter | Costar Spin-X | 8160 | |
| Stainless steel beads | Qiagen | 69989 | |
| TissueLyser II | Qiagen | 85300 | |
| Tris | Sigma | 93362 | |
| Triton X-100 | Sigma | T8787-250ML | |
| Tween 20 | Sigma | P9416-100ML | |
| Xylan (beechwood) | Megazyme | P-XYLNBE | |
| Xyloglucan (tamarind) | Megazyme | P-XYGLN | |
| β-Glucan (oat) | Megazyme | P-BGOM |
참고문헌
- Amicucci, M. J., et al. A nonenzymatic method for cleaving polysaccharides to yield oligosaccharides for structural analysis. Nature Communications. 11 (1), 3963 (2020).
- Gagneux, P., Panin, V., Hennet, T., Aebi, M., Varki, A. Evolution of glycan diversity. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Willats, W. G. T., McCartney, L., Knox, J. P. Pectin cell biology: complexity in context. Advances in Pectin and Pectinase Research. , 147-157 (2003).
- Cummings, R. D., et al. Glycan-recognizing probes as tools. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Bakshani, C. R., et al. Analysis of glycans in a Burnt-on/Baked-on (BoBo) model food soil using Microarray Polymer Profiling (MAPP) and immunofluorescence microscopy. Food Chemistry. 410, 135379 (2023).
- Salmeán, A. A., Willats, W. G. T., Ribeiro, S., Andersen, T. J., Ellegaard, M. Over 100-year preservation and temporal fluctuations of cell wall polysaccharides in marine sediments. Frontiers in Plant Science. 13, 785902 (2022).
- Cid, M., et al. Recognition of the helical structure of β-1,4-galactan by a new family of carbohydrate-binding modules. Journal of Biological Chemistry. 285 (46), 35999-36009 (2010).
- Runavot, J. -. L., et al. Non-cellulosic polysaccharides from cotton fibre are differently impacted by textile processing. PLoS One. 9 (12), e115150 (2014).
- Ahl, L. I., et al. Analyses of aloe polysaccharides using carbohydrate microarray profiling. Journal of AOAC International. 101 (6), 1720-1728 (2018).
- Vidal-Melgosa, S., et al. Diatom fucan polysaccharide precipitates carbon during algal blooms. Nature Communications. 12 (1), 1150 (2021).
- Moller, I., et al. High-throughput mapping of cell-wall polymers within and between plants using novel microarrays. The Plant Journal. 50 (6), 1118-1128 (2007).
- Ruprecht, C., et al. A synthetic glycan microarray enables epitope mapping of plant cell wall glycan-directed antibodies. Plant Physiology. 175 (3), 1094-1104 (2017).
- Cummings, R. D., et al. Principles of glycan recognition. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Gao, C., et al. Glycan microarrays as chemical tools for identifying glycan recognition by immune proteins. Frontiers in Chemistry. 7, 833 (2019).
- Vidal-Melgosa, S., et al. A new versatile microarray-based method for high throughput screening of carbohydrate-active enzymes. Journal of Biological Chemistry. 290 (14), 9020-9036 (2015).
- Willats, W. G. T., Rasmussen, S. E., Kristensen, T., Mikkelsen, J. D., Knox, J. P. Sugar-coated microarrays: A novel slide surface for the high-throughput analysis of glycans. Proteomics. 2 (12), 1666-1671 (2002).
- Sørensen, I., et al. The charophycean green algae provide insights into the early origins of plant cell walls. The Plant Journal. 68 (2), 201-211 (2011).
- Liu, D., Tang, W., Yin, J. -. Y., Nie, S. -. P., Xie, M. -. Y. Monosaccharide composition analysis of polysaccharides from natural sources: Hydrolysis condition and detection method development. Food Hydrocolloids. 116, 106641 (2021).
- Pattathil, S., et al. A comprehensive toolkit of plant cell wall glycan-directed monoclonal antibodies. Plant Physiology. 153 (2), 514-525 (2010).
- Verhertbruggen, Y., et al. Developmental complexity of arabinan polysaccharides and their processing in plant cell walls. The Plant Journal. 59 (3), 413-425 (2009).
- Rydahl, M. G., et al. Development of novel monoclonal antibodies against starch and ulvan - implications for antibody production against polysaccharides with limited immunogenicity. Scientific Reports. 7 (1), 9326 (2017).
- McCartney, L., Marcus, S. E., Knox, J. P. Monoclonal antibodies to plant cell wall xylans and arabinoxylans. The Journal of Histochemistry and Cytochemistry. 53 (4), 543-546 (2005).
- Marcus, S. E., et al. Pectic homogalacturonan masks abundant sets of xyloglucan epitopes in plant cell walls. BMC Plant Biology. 8, 60 (2008).
- Pedersen, H. L., et al. Versatile high resolution oligosaccharide microarrays for plant glycobiology and cell wall research. The Journal of Biological Chemistry. 287 (47), 39429-39438 (2012).
- Marcus, S. E., et al. Restricted access of proteins to mannan polysaccharides in intact plant cell walls. The Plant Journal. 64 (2), 191-203 (2010).
- Smallwood, M., Martin, H., Knox, J. P. An epitope of rice threonine-and hydroxyproline-rich glycoprotein is common to cell wall and hydrophobic plasma-membrane glycoproteins. Planta. 196 (3), 510-522 (1995).
- Smallwood, M., Yates, E. A., Willats, W. G. T., Martin, H., Knox, J. P. Immunochemical comparison of membrane-associated and secreted arabinogalactan-proteins in rice and carrot. Planta. 198 (3), 452-459 (1996).
- Wisniewski, J. P., Rathbun, E. A., Knox, J. P., Brewin, N. J. Involvement of diamine oxidase and peroxidase in insolubilization of the extracellular matrix: implications for pea nodule initiation by Rhizobium leguminosarum. Molecular Plant-Microbe Interactions. 13 (4), 413-420 (2000).
- Jones, L., Seymour, G. B., Knox, J. P. Localization of pectic galactan in tomato cell walls using a monoclonal antibody specific to (1[->]4)-β-D-galactan. Plant Physiology. 113 (4), 1405-1412 (1997).
- Willats, W. G., Marcus, S. E., Knox, J. P. Generation of a monoclonal antibody specific to (1→5)-α-L-arabinan. Carbohydrate Research. 308 (15), 149-152 (1998).
- Cornuault, V., et al. LM6-M: a high avidity rat monoclonal antibody to pectic α-1, 5-L-arabinan. BioRxiv. , 161604 (2017).
- Sutherland, P., Hallett, I., Jones, M. Probing cell wall structure and development by the use of antibodies: a personal perspective. New Zealand Journal of Forestry Science. 39, 197-205 (2009).
- Mikkelsen, M. D., et al. Ancient origin of fucosylated xyloglucan in charophycean green algae. Communications Biology. 4 (1), 754 (2021).
- Fangel, J. U., Jones, C. Y., Ulvskov, P., Harholt, J., Willats, W. G. T. Analytical implications of different methods for preparing plant cell wall material. Carbohydrate Polymers. 261, 117866 (2021).
- Moore, J. P., et al. Analysis of plant cell walls using high-throughput profiling techniques with multivariate methods. The Plant Cell Wall: Methods and Protocols. , 327-337 (2020).
- Gao, Y., Fangel, J. U., Willats, W. G. T., Moore, J. P. Tracking polysaccharides during white winemaking using glycan microarrays reveals glycoprotein-rich sediments. Food Research International. 123, 662-673 (2019).
- Solden, L. M., et al. Interspecies cross-feeding orchestrates carbon degradation in the rumen ecosystem. Nature Microbiology. 3 (11), 1274-1284 (2018).
- Fangel, J. U., et al. Tracking polysaccharides through the brewing process. Carbohydrate Polymers. 196, 465-473 (2018).
- Mravec, J., et al. Pea border cell maturation and release involve complex cell wall structural dynamics. Plant Physiology. 174 (2), 1051-1066 (2017).
- Wickham, H. . ggplot2: elegant graphics for data analysis. , (2009).
- Gu, Z. Complex heatmap visualization. iMeta. 1 (3), 43 (2022).
- Nasrollahzadeh, M., Nezafat, Z., Shafiei, N., Soleimani, F. . Polysaccharides in Food Industry. , (2021).
- Shao, P., et al. Recent advances in improving stability of food emulsion by plant polysaccharides. Food Research International. 137, 109376 (2020).
- Sanz, M. L., Martínez-Castro, I. Recent developments in sample preparation for chromatographic analysis of carbohydrates. Journal of Chromatography. A. 1153 (1-2), 74-89 (2007).
- Bethke, G., Glazebrook, J. Cyclohexane diamine tetraacetic acid (CDTA) extraction of plant cell wall pectin. Bio-Protocol. 4 (24), e1357 (2014).
- Lu, Y., He, Q., Fan, G., Cheng, Q., Song, G. Extraction and modification of hemicellulose from lignocellulosic biomass: A review. Green Processing and Synthesis. 10 (1), 779-804 (2021).
- Jayasekara, S., Ratnayake, R. Microbial cellulases: an overview and applications. Cellulose. 22, 92 (2019).
- Verhertbruggen, Y., Marcus, S. E., Haeger, A., Ordaz-Ortiz, J. J., Knox, J. P. An extended set of monoclonal antibodies to pectic homogalacturonan. Carbohydrate Research. 344 (14), 1858-1862 (2009).
- Villares, A., Mateo-Vivaracho, L., Guillamón, E. Structural features and healthy properties of polysaccharides occurring in mushrooms. Agriculture. 2 (4), 452-471 (2012).
- Kračun, S. K., et al. Carbohydrate microarray technology applied to high-throughput mapping of plant cell wall glycans using comprehensive microarray polymer profiling (CoMPP). Methods in Molecular Biology. 1503, 147-165 (2017).
- Rajasundaram, D., et al. Understanding the relationship between cotton fiber properties and non-cellulosic cell wall polysaccharides. PLoS One. 9 (11), e112168 (2014).
- Michalak, L., et al. Microbiota-directed fibre activates both targeted and secondary metabolic shifts in the distal gut. Nature Communications. 11 (1), 5773 (2020).
- Salmeán, A. A., Hervé, C., Jørgensen, B., Willats, W. G., Mravec, J. Microarray glycan profiling reveals algal fucoidan epitopes in diverse marine metazoans. Frontiers in Marine Science. 4, 293 (2017).
- Knox, J. P. Revealing the structural and functional diversity of plant cell walls. Current Opinion in Plant Biology. 11 (3), 308-313 (2008).
- Manimala, J. C., Roach, T. A., Li, Z., Gildersleeve, J. C. High-throughput carbohydrate microarray profiling of 27 antibodies demonstrates widespread specificity problems. Glycobiology. 17 (8), 17-23 (2007).
- Stephen, P., Tseng, K. -. L., Liu, Y. -. N., Lyu, P. -. C. Circular permutation of the starch-binding domain: inversion of ligand selectivity with increased affinity. Chemical Communications. 48 (20), 2612-2614 (2012).
- Gunnarsson, L. C., Dexlin, L., Karlsson, E. N., Holst, O., Ohlin, M. Evolution of a carbohydrate binding module into a protein-specific binder. Biomolecular Engineering. 23 (2-3), 111-117 (2006).
- Moller, I., et al. High-throughput screening of monoclonal antibodies against plant cell wall glycans by hierarchical clustering of their carbohydrate microarray binding profiles. Glycoconjugate Journal. 25 (1), 37-48 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유