Method Article
Perfil de polímeros de microarrays (MAPP) para análisis de glicanos de alto rendimiento
En este artículo
Resumen
El perfil de polímeros de microarrays (MAPP) es una técnica de alto rendimiento para el análisis de la composición de glicanos en muestras biológicas.
Resumen
El perfil de polímeros de micromatrices (MAPP) es un enfoque robusto y reproducible para determinar sistemáticamente la composición y la abundancia relativa de glicanos y glicoconjugados dentro de una variedad de muestras biológicas, incluidos tejidos de plantas y algas, materiales alimenticios y muestras humanas, animales y microbianas. La tecnología de microarrays respalda la eficacia de este método al proporcionar una plataforma de cribado miniaturizada y de alto rendimiento, que permite caracterizar de forma concomitante miles de interacciones entre glicanos y sondas moleculares dirigidas por glicanos altamente específicas, utilizando solo pequeñas cantidades de analitos. Los glicanos constituyentes se fraccionan química y enzimáticamente, antes de ser extraídos secuencialmente de la muestra e inmovilizados directamente en membranas de nitrocelulosa. La composición de glicanos está determinada por la unión de sondas moleculares específicas de reconocimiento de glicanos a las moléculas extorsionadas e impresas. La MAPP es complementaria a las técnicas convencionales de análisis de glicanos, como el análisis de monosacáridos y ligamientos y la espectrometría de masas. Sin embargo, las sondas moleculares de reconocimiento de glicanos proporcionan información sobre las configuraciones estructurales de los glicanos, lo que puede ayudar a dilucidar las interacciones biológicas y los roles funcionales.
Introducción
Los glicanos son ubicuos en todos los dominios de la vida y exhiben una diversidad incomparable en estructura y función en comparación con otrasmacromoléculas. Sin embargo, debido a su complejidad, variabilidad en la biosíntesis y enlaces glucosídicos, y la escasez de métodos apropiados para diseccionar las estructuras de los glicanos, nuestra comprensión de esta diversidad en las estructuras y funciones es relativamente limitada2.
Muchas técnicas de análisis de glicanos son destructivas y requieren la descomposición de los glicanos en sus monosacáridos constituyentes, lo que puede oscurecer contextos tridimensionales y biológicos relevantes3. Por el contrario, los anticuerpos monoclonales (mAb), los módulos de unión a carbohidratos (CBM), las lectinas, las aglutininas virales y las adhesinas microbianas, conocidas colectivamente como sondas moleculares de reconocimiento de glicanos (GRMP)4, reconocen y se unen a epítopos específicos y pueden utilizarse como herramientas para detectar y discriminar entre glicanos dentro de matrices complejas de multiglicanos 5,6.
Aquí, presentamos el perfil de polímeros de microarrays (MAPP), un método rápido, versátil y no destructivo para el análisis de glicanos que es aplicable a un amplio espectro de muestras biológicas. El método tiene como objetivo proporcionar una tecnología robusta y de alto rendimiento para analizar glicanos de diversos sistemas biológicos e industriales/comerciales. MAPP une la especificidad de reconocimiento de las sondas moleculares dirigidas por glicanos con la tecnología de cribado de microarrays reproducible y de alto rendimiento para permitir que miles de interacciones moleculares se perfilen en paralelo. El resultado de este enfoque es la comprensión diagnóstica de la composición y la abundancia relativa de glicanos dentro de una muestra o tejido de interés.
La MAPP se puede utilizar como un método independiente o en conjunto con otras técnicas bioquímicas, como la microscopía de inmunofluorescencia 7,8,9 y el análisis de monosacáridos o ligamiento10,11. La técnica también se puede utilizar para mapear las especificidades de los epítopos de los nuevos GRMP, utilizando matrices impresas con patrones de oligosacáridos puros y estructuralmente bien definidos12. Una de las principales ventajas de la MAPP sobre otros métodos, como el ensayo de inmunoabsorción ligado a enzimas (ELISA), es su compatibilidad con pequeños volúmenes de muestra13,14. Además, MAPP ofrece un análisis de rendimiento significativamente mayor15 y proporciona una forma eficaz de conservación de muestras, ya que las muestras impresas son secas y estables cuando se inmovilizan en nitrocelulosa16.
La unión de los GRMP generalmente depende de la presencia de una serie de residuos de azúcar contiguos que colectivamente forman un sitio de unión (epítopo) que es exclusivo de una clase particular de polisacáridos (xilano, manano, xiloglucano, etc.) 17. Por el contrario, los residuos individuales de azúcar (xilosa, manosa, glucosa) que se cuantifican utilizando la mayoría de las técnicas bioquímicas, por ejemplo, la composición de monosacáridos o el análisis de metilación, pueden ser componentes de múltiples clases de polisacáridos y, por lo tanto, difíciles de asignar18.
MAPP se ha desarrollado en respuesta a una brecha tecnológica, a saber, la capacidad de analizar rápidamente múltiples glicanos de una variedad de fuentes utilizando pequeñas cantidades de material. MAPP capitaliza el extenso repertorio de GRMP que se han desarrollado y caracterizado en las últimas tres décadas 12,19,20,21,22,23,24,25,26,27,28,29,30,31,32. El desarrollo de MAPP ha sido un proceso iterativo, en el que la técnica se ha ido perfeccionando y optimizando constantemente. En la actualidad existe un cuerpo sustancial de literatura que describe la aplicación de MAPP a varios sistemas naturales e industriales donde los glicanos juegan un papel central 5,6,9,10,21,33,34,35,36,37,38,39. A continuación, describimos el estado actual de la técnica de MAPP.
Protocolo
Las principales etapas experimentales del método MAPP se resumen en la Figura 1.
1. Preparación de muestras
NOTA: Aquí, el método se aplica a los tejidos vegetales con fines ilustrativos. Las plantas seleccionadas fueron Coffea arabica, Allium sativum var. ophioscorodon, y varias variedades de mango tailandés (Aokrong, Kam, Rad, Chokanan, Mamkamdang, Talabnak, Mahachanok y Nga). Las plantas fueron seleccionadas por su importancia comercial. Su procesamiento para consumo humano genera residuos agroindustriales actualmente subutilizados, que pueden proporcionar una fuente de productos de valor agregado, incluidos los glicanos puros. Por lo tanto, se aplicó MAPP para caracterizar la composición de glicanos de la biomasa vegetal residual con fines de bioprospección.
- Separe el material vegetal en diferentes tejidos (por ejemplo, raíz, tallo y hojas).
- Secar los tejidos vegetales en un horno de aire caliente a 40 °C durante 12-24 h (disminuir/aumentar el tiempo de acuerdo con la muestra). Alternativamente, congele las muestras en nitrógeno líquido y posteriormente liofílices durante ~ 4 días.
- Homogeneizar las muestras hasta obtener un polvo fino utilizando un mortero o un lisador mecánico de tejidos (ver Tabla de Materiales) con un rodamiento de bolas en cada tubo.
NOTA: Para el tejido vegetal fresco, se recomienda secar o liofilizar antes de la homogeneización. Generalmente, la homogeneización con un mortero es suficiente para la mayoría de las muestras secas. En el caso de muestras especialmente resistentes, como cereales, legumbres y alimentos procesados como la pasta, la congelación instantánea en nitrógeno líquido puede aumentar la velocidad y la eficiencia de la homogeneización de las muestras. Hemos descubierto que la homogeneización mecánica es compatible con casi todos los tipos de muestras, es considerablemente más rápida y requiere menos mano de obra, y minimiza eficazmente el riesgo de contaminación cruzada de la muestra por el uso repetido del mismo equipo (es decir, mortero).
2. Preparación de residuos insolubles en alcohol (AIRE)
- Añadir 1,5 ml de etanol al 70% (v/v) a 50-100 mg de material de muestra secado al aire y homogeneizado.
- Agitar bien para mezclar y luego centrifugar a 10.000 x g durante 10 minutos a temperatura ambiente. Deseche el sobrenadante resultante con una pipeta y conserve el gránulo.
- Al gránulo restante, agregue 1,5 ml de metanol y cloroformo (1:1 [v/v]). Vórtice, centrifugar y desechar el sobrenadante, según el paso 2.2.
- Al gránulo restante, agregue 1,5 ml de acetona al 100%. Vórtice, centrifugar y desechar el sobrenadante, según el paso 2.2.
- Coloque el gránulo resultante durante la noche en una campana extractora para permitir que la acetona residual se evapore o en una centrífuga al vacío hasta que se seque.
NOTA: El material AIR se puede almacenar a temperatura ambiente hasta que se requiera.
3. Extracción de glicanos
NOTA: Si es posible, realice todos los pasos de extracción en un lisador de tejido con un rodamiento de bolas en cada tubo para ayudar a la resuspensión. Si no se dispone de un lisador de tejido, se pueden realizar extracciones con agitación o agitación continua. Puede ser necesario extender el tiempo de extracción si esto no es posible.
- A 10 mg de material AIR, añadir 30 μL/mg de 50 mM de ácido ciclohexanodiaminotetraacético (CDTA; ver Tabla de Materiales), pH 7,5.
- Agitar a 27 Hz durante 2 min, seguido de 10 Hz durante 2 h.
- Centrifugar a 10.000 x g durante 10 min a 4 °C. Conserve el sobrenadante resultante, agréguelo a un tubo de microcentrífuga estéril y guárdelo a 4 °C en un agitador rotativo.
- Al gránulo residual, añadir 30 μL/mg 4 M NaOH + 0,1 % (p/v) de NaBH4.
PRECAUCIÓN: El NaBH4 es tóxico si se ingiere. Use equipo de protección personal (EPP). Manéjelo debajo de una campana extractora. Evite la formación de polvo. Evite respirar polvo. No permita que el producto entre en contacto con el agua. - Repita los pasos 3.2 a 3.3. Lave el gránulo residual dos o tres veces con dH2O para eliminar el NaOH residual.
- Añadir 30 μL/mg de celulasa (preferiblemente GH5 endo-1,4-β-glucanasa, en tampón enzimático adecuado, según lo recomendado por el fabricante; ver Tabla de Materiales) al gránulo e incubar a la temperatura óptima de la enzima durante 16 h.
- Centrifugar las muestras a 10.000 x g durante 10 min a 4 °C. Conserve el sobrenadante, transfiéralo a tubos de microcentrífuga limpios y guárdelo a 4 °C en un agitador rotativo. Una vez extraídas, las muestras deben imprimirse lo antes posible.
- Centrifugar de nuevo todos los extractos almacenados a 10.000 x g durante 10 min a 4 °C.
NOTA: Las muestras deben estar libres de partículas y residuos. Pase a través de un filtro de espín de 0,2 μm antes de la impresión de microarrays si es necesario. Las muestras especialmente viscosas son incompatibles con el análisis de microarrays, ya que los capilares del microarray y el cabezal de impresión pueden obstruirse fácilmente. Como regla general, los usuarios deben poder pipetear todas las muestras destinadas a la impresión con una pipeta estándar de bajo volumen.
4. Elaboración de normas
- Preparar soluciones de 1 mg/ml de patrones de glicanos definidos (Tabla 1) endH2O. estériles. Si usa pachyman como estándar, disuelva en NaOH 4 M en su lugar y neutralice con ácido acético glacial después de la solubilización.
- Almacene los patrones preparados durante la noche a 4 °C en un agitador giratorio para permitir una solubilización completa.
- Centrifugar todos los patrones durante 10 min a 10.000 x g a 4 °C para granular cualquier residuo. El sobrenadante resultante se utiliza para la impresión posterior.
5. Impresión de microarrays
- Prepare una dilución 1:20 (v/v) de tinta china negra/tinta de dibujo en tampón del sistema de glicerol (GSB; combine glicerol al 47 %, 52,9 %dH2O, Triton X-100 al 0,06 % y biocida al 0,04 % [nitrato cúprico al 0,15 %-0,17 % y nitrato de magnesio al 1,4 %-2,0 % en agua] y esterilize con filtro) (consulte la tabla de materiales) y centrifugue durante 10 minutos a 15.000 x g (temperatura ambiente).
NOTA: La solución de tinta es necesaria para crear un borde superior e inferior alrededor de las muestras impresas, de modo que los microarrays impresos puedan detectarse visualmente en la membrana. Sin embargo, es probable que la solución de tinta contenga sedimentos. Todas las soluciones deben estar libres de partículas para la impresión, por lo que debe evitar perturbar el sedimento al pipetear. Deseche y prepare fresco cuando esto ya no sea posible. La solución no se puede filtrar fácilmente para eliminar las partículas. - Agregue 40 μL de solución de tinta y GSB a la primera sección de la primera placa de 384 pocillos (Figura 2).
- Agregue 25 μL de GSB a todos los pocillos de dilución 1 (D1). Agregue 40 μL de GSB a todos los pocillos de dilución 2, 3 y 4 (D2-D4).
- Diluir las muestras de glicanos extraídos y los sustratos de glicanos definidos 1:1 (v/v) con GSB añadiendo 25 μL de muestra de glicanos extraídos a los pocillos D1 en orden.
- Diluir en serie cada muestra cuatro veces tomando 10 μL de la muestra del pocillo D1 y añadiéndola al pocillo D2. Aspirar suavemente con una pipeta para mezclar.
- Repita el proceso tomando 10 μL de muestra del pocillo D2 y añadiéndola al pocillo D3.
- Repita para el pozo D4. Después de mezclar, deseche 10 μL del pocillo D4 para que cada pocillo contenga un volumen final de 40 μL.
- Agregue 40 μL de solución de tinta y GSB al bloque final de la placa final.
- Cubrir las placas con una cubierta adhesiva y centrifugar durante 10 min a 3.000 x g (temperatura ambiente). Asegúrese de que no queden burbujas después de la centrifugación y repita si es necesario.
- Utilizando un robot de impresión de microarrays piezoeléctricos sin contacto, imprima las muestras en la membrana de nitrocelulosa (consulte la Tabla de materiales) siguiendo los pasos que se indican a continuación.
NOTA: A continuación se muestran las acciones recomendadas para una calidad de impresión óptima; Sin embargo, los parámetros específicos requeridos dependerán en última instancia del instrumento utilizado. Recomendamos a los usuarios que se pongan en contacto con el fabricante del instrumento para analizar las personalizaciones y los ajustes de impresión adecuados necesarios para su dispositivo.- Antes de imprimir, vacíe el depósito intermedio de residuos y llene el depósito intermedio limpio con GSB limpio, según sea necesario. Encienda el instrumento y deje que se estabilice durante >10 minutos si tiene un sistema integrado de control de humedad y temperatura. Encienda el microarrayer e inicialice el sistema.
NOTA: Se recomienda realizar una prueba para determinar la presión interna del instrumento. Si la presión es demasiado baja, puede ser necesario realizar una purga de alta presión. Nuevamente, comuníquese con el fabricante del instrumento para discutir el funcionamiento específico del instrumento específico. - Purgue el cabezal de impresión y los capilares varias veces con GSB para eliminar la suciedad y los posibles contaminantes. Realice una tirada de impresión de prueba cargando solo una placa de GSB o configurando el instrumento para imprimir directamente desde el depósito de búfer limpio, evitando la aspiración de la muestra de una placa cargada.
NOTA: No es necesario realizar la impresión de prueba utilizando una membrana de nitrocelulosa; Los portaobjetos de microscopio limpios son suficientes y ofrecen la ventaja de que el tamaño, la forma y la calidad del punto se pueden evaluar visualmente antes de la impresión de la muestra. - Al imprimir muestras de glicanos extraídas, programe el sistema para que se enjuague con GSB limpio entre cada muestra.
NOTA: Normalmente, el volumen de muestra por punto impreso es de 100 pL a 10 nL, y el tamaño del punto oscila entre 20 μm y 100 μm, dependiendo del volumen de muestra seleccionado. La impresión de 100 microarrays a partir de una placa de 384 pocillos de una fuente tarda aproximadamente 40 minutos, incluido el lavado del sistema. Los microarrays resultantes tendrán un tamaño aproximado de 1 cm2 . Las placas adicionales aumentarán la longitud de la matriz en aproximadamente 1 cm por placa. En la Figura 3 se muestra un esquema del diseño del microarray impreso. Una vez impresos, los microarrays están listos para su uso inmediato y pueden almacenarse durante varios años. En caso de que sea necesario repetir el trabajo de impresión por cualquier motivo, debido a la posible evaporación de las muestras durante la impresión, se recomienda cargar una nueva placa de muestra y desechar la placa original. - Una vez a la semana, limpie a fondo el cabezal de impresión y los capilares. Para ello, cargue un pocillo de 384 pocillos que contenga una dilución 1:20 de NaOH concentrado en GSB y realice una tirada de impresión de 40 minutos a 1 hora en portaobjetos de microscopio. Los usuarios deben asegurarse de que esta solución de limpieza sea compatible con su instrumento antes de continuar.
- Antes de imprimir, vacíe el depósito intermedio de residuos y llene el depósito intermedio limpio con GSB limpio, según sea necesario. Encienda el instrumento y deje que se estabilice durante >10 minutos si tiene un sistema integrado de control de humedad y temperatura. Encienda el microarrayer e inicialice el sistema.
- Guarde el archivo de cuadrícula único (archivo .gal) producido para el microarray impreso listo para el análisis posterior.
6. Sondeo de microarrays
- Recorte microarrays impresos individuales e idénticos de la membrana de nitrocelulosa y colóquelos en un recipiente de tamaño adecuado para el sondeo (por ejemplo, una placa de microtitulación de 12 o 24 pocillos) (consulte la Tabla de materiales). La matriz debe quedar plana sobre la base del recipiente. Se requiere un microarray por sonda y representa una réplica técnica.
- Para reducir la unión inespecífica, incubar los microarrays durante 1 h en tampón de bloqueo MP-TBST (1x solución salina tamponada con Tris, pH 7,5, + 0,1% [v/v] TWEEN 20 [TBST] y suplementada con 5% [p/v] de leche desnatada en polvo; ver Tabla de Materiales) en un agitador giratorio/oscilante. Asegúrese de que el volumen sea suficiente para sumergir toda la matriz.
- Después de la incubación, retire el MP-TBST y reemplácelo con un volumen nuevo de MP-TBST.
- Incubar las matrices con anticuerpos monoclonales (mAbs) o CBM marcados con His, u otros GRMP (por ejemplo, lectinas), diluidos 1:10-1:1.000 (según lo especificado por el fabricante; ver Tabla de Materiales) en MP-TBST durante 2 h en un agitador giratorio/oscilante.
- Después de la incubación, retire la solución de la sonda molecular y cubra las matrices con TBST limpio, asegurándose de que las matrices estén completamente sumergidas. Para eliminar la solución residual de la sonda, retire inmediatamente el TBST y reemplácelo con un volumen nuevo. Coloque las matrices en una coctelera giratoria durante 5 minutos. Después de 5 minutos, retire el TBST, reemplácelo con un volumen nuevo y colóquelo en una coctelera giratoria / oscilante durante 5 minutos.
NOTA: Este proceso debe repetirse tres veces, sin incluir la adición inicial y la eliminación inmediata de TBST. - Incubar las matrices con anticuerpos secundarios conjugados alcalino-fosfatasa (anti-ratón, anti-rata, anti-conejo, anti-His, según corresponda; ver Tabla de Materiales) diluidos 1:1.000 en MP-TBST durante 2 h en un agitador oscilante/giratorio.
NOTA: Los anticuerpos secundarios conjugados con peroxidasa de rábano picante también son adecuados, utilizados junto con sustrato de tetrametilbencidina (TMB)/peróxido de hidrógeno para el desarrollo del color. - Después de la incubación, repita el procedimiento de lavado, según el paso 6.5, para eliminar los anticuerpos secundarios no unidos específicamente.
- Cubra las matrices con una solución de desarrollo de color de tetrazolio nitro-azul (NBT)/5-bromo-4-cloro-3-indolil-fosfato (BCIP) (consulte la Tabla de materiales) para la detección cromogénica de la unión de anticuerpos. Dejar hasta que se desarrollen manchas precipitadas de color púrpura en los sitios de unión al antígeno (normalmente de 5 a 30 minutos, sin embargo, las matrices deben vigilarse de cerca para evitar la sobresaturación, ya que la reacción puede ocurrir rápidamente).
PRECAUCIÓN: El BCIP es dañino cuando entra en contacto con la piel y puede causar irritación respiratoria. Usar EPP. Evite la formación de polvo. Evite respirar polvo. - Para terminar la reacción, sumerja las matrices en agua limpia del grifo y lávelas abundantemente.
- Coloque las matrices entre papel secante durante la noche a temperatura ambiente para que se sequen.
- Deseche las matrices con defectos evidentes y repita el protocolo de sondeo en tales casos (Figura 4).
7. Análisis y cuantificación
- Escanee las matrices desarrolladas con una resolución de 2.400 puntos por pulgada (ppp) utilizando un escáner de escritorio. Convierte las imágenes a archivos TIFF y luego a negativos.
- Utilizando un software de análisis de microarrays (ver Tabla de Materiales), superponga el archivo de cuadrícula .gal único en cada imagen de microarray para calcular la intensidad de color de la mancha producida en cada sitio de unión al antígeno y restar el fondo local.
- Exporte los datos de la cuadrícula como un archivo .txt. A continuación, se pueden importar manualmente a una hoja de Excel para su análisis.
- Genere un valor medio de intensidad de la señal puntual para cada muestra promediando la intensidad puntual primero en cada dilución de muestra y, a continuación, en cualquier réplica biológica incluida.
- Asigne un valor de 100 a la intensidad media más alta de la señal puntual y normalice los datos restantes en consecuencia.
NOTA: Las intensidades medias normalizadas de la señal puntual se pueden presentar como un mapa de calor de la abundancia relativa de epítopos de glicanos utilizando la función de formato condicional en Excel33 o utilizando la función geom_tile en el paquete R ggplot240,41.
Resultados
Se aplicó MAPP para determinar la composición de glicanos de residuos de biomasa agrícola, que comprenden cáscaras de mango de varias variedades del norte de Tailandia, pulpa de cereza Coffea arabica y residuos de procesamiento de granos de café, y tejido de raíces, tallos y hojas de ajo negro tailandés, Allium sativum var. Varios polisacáridos de origen vegetal se utilizan en la industria alimentaria como ingredientes funcionales 42,43. Por lo tanto, el objetivo de este experimento fue deducir si estos materiales de desecho agroindustriales abundantes y actualmente subutilizados pueden proporcionar una fuente de polisacáridos puros de valor agregado.
El material AIR se emplea habitualmente para preparar muestras destinadas al análisis de glicanos44. El uso de AIR tiene varias ventajas; El tratamiento con disolventes elimina eficazmente las CAZimas endógenas, los metabolitos, los pequeños sacáridos, los lípidos y los pigmentos, lo que da lugar a muestras enriquecidas con polisacáridos y proteínas estructurales34. Además, la producción de AIR es una forma rápida y eficaz de aumentar la longevidad de las muestras, ya que es termoestable y puede almacenarse durante varios años.
Se extrajeron secuencialmente tres fracciones mixtas de glicanos constituyentes del material AIR vegetal utilizando CDTA, NaOH y celulasa. CDTA quela iones Ca2+ , que permiten la eliminación de las pectinas desesterificadas reticuladas de Ca2+ de las paredes celulares de las plantas45. Las condiciones alcalinas permiten que se liberen predominantemente hemicelulosas, como manano, xilano y β-glucano, debido a la interrupción de los enlaces de hidrógeno y la saponificación de los enlaces éster entre las microfibrillas de celulosa y la hemicelulosa, y la lignina y la hemicelulosa, respectivamente46. Se utilizó una endo-1,4-β-glucanasa recombinante de Bacillus spp. para degradar regiones amorfas de las microfibrillas estructurales de celulosa, liberando glicanos residuales unidos a la celulosa dentro de las paredes celulares47. Aunque este método separa efectivamente los glicanos en estos tres grandes grupos, debe tenerse en cuenta que las muestras no son puras; por la propia naturaleza del método de extracción, la hemicelulosa, si está presente en la muestra, se extraerá inevitablemente y posteriormente se detectará en diversos grados en las fracciones de CDTA y celulasa. Asimismo, se detectará algo de pectina en la extracción de NaOH si está presente en la muestra.
Se utilizó un robot de impresión de microarrays piezoeléctricos sin contacto para inmovilizar las fracciones de glicanos extraídas en nitrocelulosa a través del accesorio no covalente11, formando 300 microarrays idénticos. Los patrones de glicanos definidos (Tabla 1) también se incluyeron en los microarrays impresos como controles positivos (Figura 5). El perfil de unión a MAPP obtenido para los patrones de glicanos seleccionados corresponde a las especificidades de epítopos previamente informadas. Por ejemplo, LM21 exhibió una fuerte unión a múltiples polisacáridos de manano (galactomanano y glucomanano), mientras que LM22 exhibió solo una unión débil al galactomanano25. De manera similar, LM19 se unió preferentemente al homogalacturonanodesesterificado 48 y LM15 se unió al xiloglucano23 de la semilla de tamarindo.
La abundancia relativa de 16 epítopos, diagnósticos de polisacáridos no celulósicos de la pared celular de las plantas, se detectó mediante la unión de anticuerpos monoclonales dirigidos por glicanos (Tabla 2) a extractos impresos (Figura 6). La mayoría de los glicanos extraídos se detectaron dentro de la fracción alcalina de NaOH. Se registraron fuertes señales de unión para los anticuerpos monoclonales LM10 y LM11, que representan xilano/arabinoxilano, dentro de las cáscaras de todas las variedades de mango ensayadas. Dentro de las muestras de ajo, LM10 y LM11 se unieron preferentemente al extracto de tejido radicular (Garlic R) y exhibieron solo una unión débil al extracto de tejido foliar (Garlic L). LM19, que representa el homogalacturonano parcialmente metilesterificado o no esterificado, unido fuertemente a algunos extractos de variedades de mango (Aokrong y Talabnak), pero unido sólo débilmente, o su unión era indetectable, en otras variedades (Chokanan, Mamkamdang, Mahachanok y Nga). Además, LM19 se unió solo a las fracciones de pulpa de café y no se unió al material de desecho del procesamiento del grano de café, que anteriormente se pensaba que estaba compuesto de pectina de café semipurificada (datos no publicados).
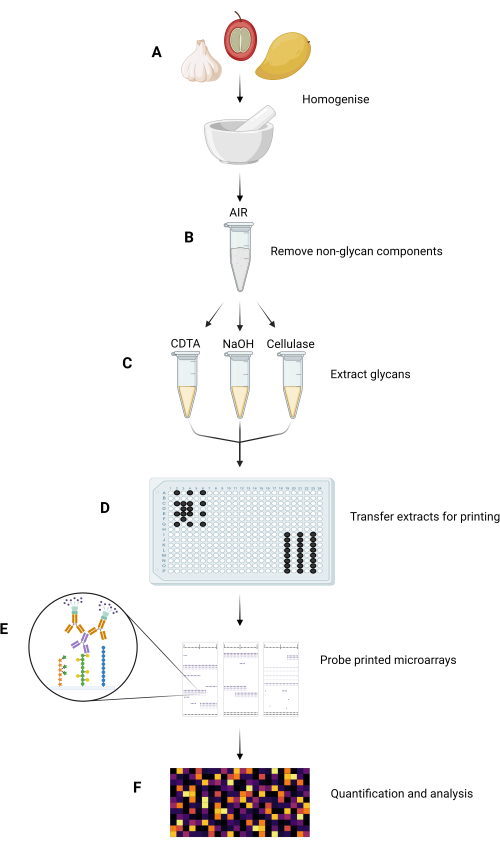
Figura 1: Principales pasos experimentales en el método MAPP. (A) Las muestras se homogeneizan para formar polvos finos. (B) Las muestras homogeneizadas se procesan para aislar sus AIR. (C) Los glicanos constituyentes se extraen secuencialmente utilizando un régimen de extracción personalizado. (D) Las fracciones de glicanos extraídas, la tinta y el GSB se transfieren a placas de 384 pocillos, de acuerdo con el diseño de la placa, para imprimirlas en nitrocelulosa. (E) Los microarrays impresos se sondean con GRMP seleccionados. (F) La unión de GRMP a las fracciones de glicanos impresas se cuantifica y analiza antes de que los datos se presenten como un mapa de calor. Haga clic aquí para ver una versión más grande de esta figura.
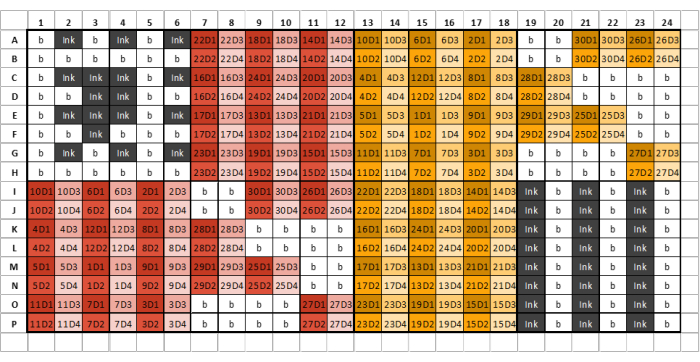
Figura 2: Ejemplo de un diseño de placa de 384 pocillos para la carga de muestras, tinta y GSB con cuatro diluciones por muestra/patrón de glicano extraído. Los diferentes colores denotan muestras que surgen de diferentes reactivos de extracción, mientras que los diferentes tonos representan diluciones en serie. El primer número del código representa el número de muestra, mientras que el número final representa el número de dilución (D1 denota la dilución uno, D2 denota la dilución dos, y así sucesivamente). Por ejemplo, un pocillo etiquetado como '12D3' representa la muestra de glicano 12, dilución tres. Las placas de pocillos deben dividirse en ocho secciones idénticas que comprendan seis columnas y ocho filas. La primera sección de la primera plancha debe contener solo tinta y tampón y parecerse al diseño de la plancha de ejemplo. Las muestras de glicanos extraídas se pueden cargar en secciones de placa posteriores de acuerdo con el diseño de la placa. No se deben cargar diferentes reactivos de extracción en la misma sección de placa. Si no hay suficientes muestras para llenar una sección completa, llene todos los pocillos restantes de esa sección con tampón; No deje ningún pozo vacío. Si se requieren varias placas, la siguiente sección después de que se hayan cargado todas las muestras debe contener tres columnas alternas de tinta y GSB, esta puede no ser la sección ocho, dependiendo del número de muestras que se impriman. Haga clic aquí para ver una versión más grande de esta figura.
Figura 3: Representación esquemática del diseño de microarrays impresos. Haga clic aquí para ver una versión más grande de esta figura.
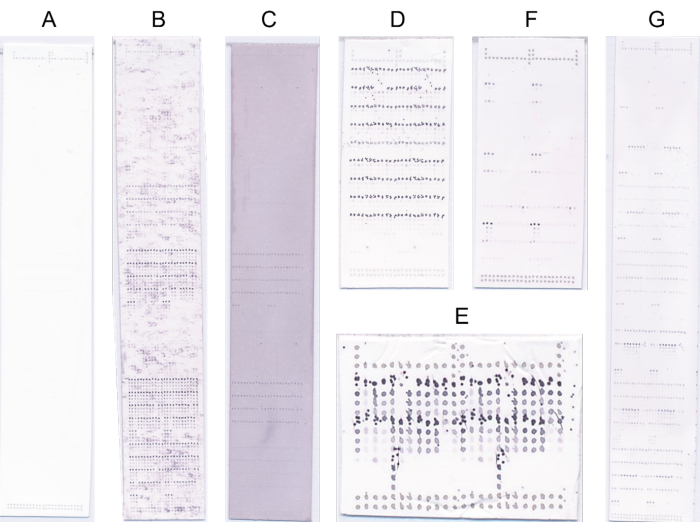
Figura 4: Microarrays representativos. (A) Sin encuadernación. (B) La señal de enlace está oscurecida por una señal de fondo alta. (C) Tinción azul/púrpura generalizada debido a sobresaturación con NBT/BCIP. (D) Sondeo defectuoso debido a la alta concentración de sustrato. (E) Impresión defectuosa debido al cabezal de impresión sucio. (F) Fuerte unión a pocas muestras. (G) Fuerte unión a muchas muestras. Haga clic aquí para ver una versión más grande de esta figura.
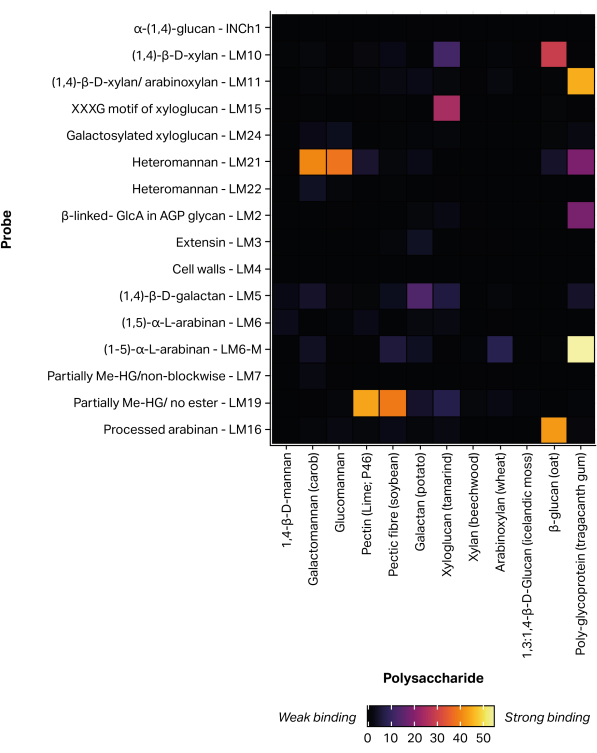
Figura 5: Unión de anticuerpos monoclonales a estándares de glicanos definidos, incluidos para validar el proceso de impresión y sondeo. Haga clic aquí para ver una versión más grande de esta figura.
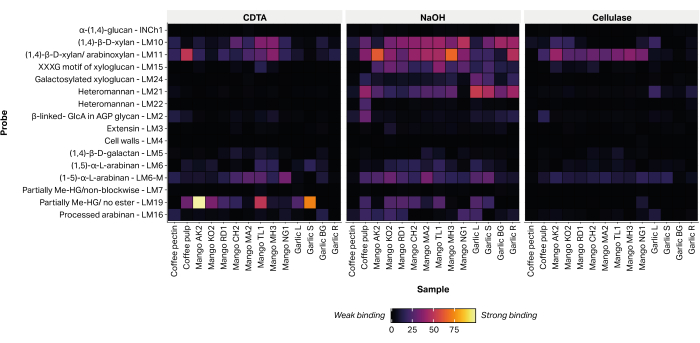
Figura 6: MAPP de glicanos extraídos de residuos de biomasa agrícola. Las muestras incluyen residuos de pulpa de café (pulpa de café y pectina de café), cáscaras de mango de varias variedades tailandesas (AO, Aokrong; KO, Kam; RD, Rad; CH, Chokanan; MA, Mamkamdang; TL, Talabnak; MH, Mahachanok; NG, Nga) y hojas de ajo negro (Garlic L), tallo (Garlic S), bulbo (Garlic BG) y raíces (Garlic R), utilizando CDTA, NaOH y celulasa (Bacillus spp. celulase 5A). Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Estándares de polisacáridos comerciales definidos utilizados en el análisis MAPP como controles positivos. Haga clic aquí para descargar esta tabla.
Tabla 2: Anticuerpos monoclonales dirigidos a glicanos seleccionados para la interrogación de microarrays de glicanos vegetales extraídos. Haga clic aquí para descargar esta tabla.
Discusión
La técnica MAPP descrita aquí es ahora un método bien establecido para el análisis de glicanos. Los principios básicos se describieron por primera vez en 200711, pero la técnica ha sido objeto de un desarrollo continuo con el fin de capitalizar las últimas innovaciones en tecnología de microarrays, el desarrollo de sondas moleculares y los avances en nuestra comprensión de la bioquímica de los glicanos. En general, los glicanos, especialmente los polisacáridos, son más difíciles de analizar que las proteínas y los nucleótidos debido a su complejidad estructural y heterogeneidad45, así como al hecho de que no pueden ser fácilmente secuenciados o sintetizados1. En muchos casos, ninguna técnica por sí sola puede descifrar la complejidad de los glicanos de manera concluyente; por lo tanto, MAPP se usa a menudo con otros métodos. Esta es una de las razones por las que se suele elegir la preparación de AIR como punto de partida para MAPP, ya que AIR es compatible con la mayoría de los otros métodos de análisis de glicanos34, lo que facilita la posterior comparación de conjuntos de datos.
Debido a la homogeneización de la muestra antes de la preparación del AIR, invariablemente se pierde parte de la información espacial. Sin embargo, como los polisacáridos se liberan secuencialmente de las muestras, la presencia de epítopos en las fracciones obtenidas proporciona información sobre la arquitectura molecular y la composición de esa muestra17. Por lo tanto, la selección de un régimen de extracción adecuado es fundamental para el éxito del método. Múltiples parámetros determinan la idoneidad del método de extracción: estructura celular, tiempo, temperatura, pH, presión, fuerza iónica del solvente y finura de la muestra de partículas sólidas49. Se recomienda utilizar una gama de disolventes cada vez más agresivos para maximizar la probabilidad de extraer con éxito los glicanos constituyentes y construir una imagen representativa de la composición de la muestra. Para la mayoría de las muestras, el CDTA, el NaOH y la celulasa son suficientes para eliminar el almacenamiento derivado de plantas y los polisacáridos de la pared celular 33,50,51,52. Para algunas muestras de tejido, se ha demostrado que un régimen de extracción híbrido que también incluye CaCl2, HCl y Na2CO3 es exitoso53, mientras que las muestras de microalgas marinas pueden requerir la adición de ácido etilendiaminotetraacético (EDTA)10.
Los microarrays deben incluir una gama de patrones de glicanos puros y definidos que se utilizarán como controles positivos5. Los estándares incluidos deben modificarse de acuerdo con la naturaleza de la muestra. Una vez impreso, es necesario seleccionar los GRMP adecuados. La generación de híbridomas mAbs a estructuras polisacáridas es un reto54; Los anticuerpos de unión a glicanos son difíciles de criar y pueden tener baja afinidad55. Afortunadamente, la información de la secuencia génica de los CBM se puede obtener con relativa facilidad para la expresión recombinante4 y la ingeniería de sus especificidades de unión56,57. Si bien se ha desarrollado un impresionante catálogo de GRMP, la mayoría de los cuales están disponibles en fuentes comerciales, en relación con la diversidad de estructuras de glicanos existentes en la naturaleza, solo se ha producido y caracterizado con éxito una pequeña proporción58. Esto puede limitar la capacidad de detectar y discriminar entre ciertas estructuras. Es aconsejable realizar un experimento de sondeo inicial utilizando una o dos sondas representativas de cada estructura de glicanos principales que se prevé que estén presentes, para las cuales la especificidad de unión está bien caracterizada. En experimentos de sondeo posteriores, la lista de sondas puede ampliarse para cubrir una gama más amplia de glicanos y profundizar en las estructuras finas.
Aunque es mundano, asegurarse de que los microarrays se laven a fondo después de cada paso de incubación es fundamental para el éxito del procedimiento de sondeo. Es probable que la eliminación ineficaz de sondas no unidas específicamente oscurezca el resultado al causar una señal de fondo alta después del desarrollo del color. En este caso, es necesario repetir el procedimiento de sondeo, comenzando con un nuevo microarray. Además, las matrices deben tocarse con moderación y solo sujetando los bordes con fórceps; La membrana de nitrocelulosa es frágil y se daña fácilmente. La solución de desarrollo de color se acumula en grietas y pliegues, lo que provoca una sobresaturación, lo que impide el análisis de la matriz.
MAPP es rápido, adaptable y conveniente. Este método es compatible con glicanos animales, microbianos o vegetales derivados de cualquier sistema biológico o industrial, siempre que puedan ser extraídos e inmovilizados sobre nitrocelulosa, y para lo cual se disponga de sondas moleculares adecuadas. Los datos generados proporcionan información detallada, semicuantitativa y de composición, que no se puede obtener fácilmente a través de otros métodos de análisis de glicanos.
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Los autores desean agradecer a ArrayJet por su asesoramiento experto en robótica de microarrays. SS y JS desean agradecer el apoyo del Fondo Fundamental 2022 (FF65/004) de la Universidad de Chiang Mai.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,3:1,4-β-D-Glucan, Lichenan (icelandic moss) | Megazyme | P-LICHN | |
| 1,4-β-D-Mannan | Megazyme | P-MANCB | |
| 384-well microtiter plate | Greiner Bio-One | M1686 | |
| 5-bromo-4-chloro-3-indolyl-phosphate (BCIP) | Melford | B74100-1.0 | |
| Acetone | Sigma | 270725 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 115-055-003 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Rat IgG (H+L) | Jackson ImmunoResearch | 112-055-003 | |
| Alkaline Phosphatase AffiniPure Rabbit Anti-His Tag | Jackson ImmunoResearch | 300-055-240 | |
| Arabinoxylan (wheat) | Megazyme | P-WAXYL | |
| Array-Pro Analyzer Software | Media Cybernetics | Version 6.3 | |
| Bacillus sp. Cellulase 5A (BCel5A) | NZYTech | CZ0564 | |
| BAM antibodies | SeaProbes | Various | |
| Black drawing ink (indian ink) | Winsor & Newton | GWD030 | |
| Carbohydrate binding modules | NZYTech | Various | |
| CCRC antibodies | CarboSource | Various | |
| CDTA | Sigma | 319945 | |
| Chloroform | Sigma | PHR1552 | |
| Ethanol | Sigma | 1.11727 | |
| Galactan (potato) | Megazyme | P-GALPOT | |
| Galactomannan (carob) | Megazyme | P-GALML | |
| Glycerol solution | Sigma | 49781-5L | |
| Gum tragacanth (legumes) | Sigma-Aldrich | G1128 | |
| INCh antibodies | INRA | Various | |
| LM and JIM antibodies | PlantProbes | Various | |
| Marathon Argus Microarray Printer | ArrayJet | ||
| Methanol | Sigma | 34860 | |
| Monoclonal antibodies | Biosupplies Australia | Various | |
| NaBH4 | Sigma | 452882 | |
| NaOH | Sigma | S5881 | |
| Nitro-blue tetrazolium (NBT) | Melford | N66000-1.0 | |
| Nitrocellulose membrane | Thermo Fisher Scientific | 88018 | |
| Pectin (degree of methyl esterification 46%) | Danisco | NA | |
| ProClin 200 | Sigma | 48171-U | |
| Rhamnogalacturonan (soybean pectic fibre) | Megazyme | P-RHAGN | |
| Rotating mixer | Fisher Scientific | 88-861-050 | |
| Rotating/rocking Shaker | Cole-Parmer | ||
| Skimmed milk powder | Marvel | ||
| Spin filter | Costar Spin-X | 8160 | |
| Stainless steel beads | Qiagen | 69989 | |
| TissueLyser II | Qiagen | 85300 | |
| Tris | Sigma | 93362 | |
| Triton X-100 | Sigma | T8787-250ML | |
| Tween 20 | Sigma | P9416-100ML | |
| Xylan (beechwood) | Megazyme | P-XYLNBE | |
| Xyloglucan (tamarind) | Megazyme | P-XYGLN | |
| β-Glucan (oat) | Megazyme | P-BGOM |
Referencias
- Amicucci, M. J., et al. A nonenzymatic method for cleaving polysaccharides to yield oligosaccharides for structural analysis. Nature Communications. 11 (1), 3963 (2020).
- Gagneux, P., Panin, V., Hennet, T., Aebi, M., Varki, A. Evolution of glycan diversity. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Willats, W. G. T., McCartney, L., Knox, J. P. Pectin cell biology: complexity in context. Advances in Pectin and Pectinase Research. , 147-157 (2003).
- Cummings, R. D., et al. Glycan-recognizing probes as tools. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Bakshani, C. R., et al. Analysis of glycans in a Burnt-on/Baked-on (BoBo) model food soil using Microarray Polymer Profiling (MAPP) and immunofluorescence microscopy. Food Chemistry. 410, 135379 (2023).
- Salmeán, A. A., Willats, W. G. T., Ribeiro, S., Andersen, T. J., Ellegaard, M. Over 100-year preservation and temporal fluctuations of cell wall polysaccharides in marine sediments. Frontiers in Plant Science. 13, 785902 (2022).
- Cid, M., et al. Recognition of the helical structure of β-1,4-galactan by a new family of carbohydrate-binding modules. Journal of Biological Chemistry. 285 (46), 35999-36009 (2010).
- Runavot, J. -. L., et al. Non-cellulosic polysaccharides from cotton fibre are differently impacted by textile processing. PLoS One. 9 (12), e115150 (2014).
- Ahl, L. I., et al. Analyses of aloe polysaccharides using carbohydrate microarray profiling. Journal of AOAC International. 101 (6), 1720-1728 (2018).
- Vidal-Melgosa, S., et al. Diatom fucan polysaccharide precipitates carbon during algal blooms. Nature Communications. 12 (1), 1150 (2021).
- Moller, I., et al. High-throughput mapping of cell-wall polymers within and between plants using novel microarrays. The Plant Journal. 50 (6), 1118-1128 (2007).
- Ruprecht, C., et al. A synthetic glycan microarray enables epitope mapping of plant cell wall glycan-directed antibodies. Plant Physiology. 175 (3), 1094-1104 (2017).
- Cummings, R. D., et al. Principles of glycan recognition. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Gao, C., et al. Glycan microarrays as chemical tools for identifying glycan recognition by immune proteins. Frontiers in Chemistry. 7, 833 (2019).
- Vidal-Melgosa, S., et al. A new versatile microarray-based method for high throughput screening of carbohydrate-active enzymes. Journal of Biological Chemistry. 290 (14), 9020-9036 (2015).
- Willats, W. G. T., Rasmussen, S. E., Kristensen, T., Mikkelsen, J. D., Knox, J. P. Sugar-coated microarrays: A novel slide surface for the high-throughput analysis of glycans. Proteomics. 2 (12), 1666-1671 (2002).
- Sørensen, I., et al. The charophycean green algae provide insights into the early origins of plant cell walls. The Plant Journal. 68 (2), 201-211 (2011).
- Liu, D., Tang, W., Yin, J. -. Y., Nie, S. -. P., Xie, M. -. Y. Monosaccharide composition analysis of polysaccharides from natural sources: Hydrolysis condition and detection method development. Food Hydrocolloids. 116, 106641 (2021).
- Pattathil, S., et al. A comprehensive toolkit of plant cell wall glycan-directed monoclonal antibodies. Plant Physiology. 153 (2), 514-525 (2010).
- Verhertbruggen, Y., et al. Developmental complexity of arabinan polysaccharides and their processing in plant cell walls. The Plant Journal. 59 (3), 413-425 (2009).
- Rydahl, M. G., et al. Development of novel monoclonal antibodies against starch and ulvan - implications for antibody production against polysaccharides with limited immunogenicity. Scientific Reports. 7 (1), 9326 (2017).
- McCartney, L., Marcus, S. E., Knox, J. P. Monoclonal antibodies to plant cell wall xylans and arabinoxylans. The Journal of Histochemistry and Cytochemistry. 53 (4), 543-546 (2005).
- Marcus, S. E., et al. Pectic homogalacturonan masks abundant sets of xyloglucan epitopes in plant cell walls. BMC Plant Biology. 8, 60 (2008).
- Pedersen, H. L., et al. Versatile high resolution oligosaccharide microarrays for plant glycobiology and cell wall research. The Journal of Biological Chemistry. 287 (47), 39429-39438 (2012).
- Marcus, S. E., et al. Restricted access of proteins to mannan polysaccharides in intact plant cell walls. The Plant Journal. 64 (2), 191-203 (2010).
- Smallwood, M., Martin, H., Knox, J. P. An epitope of rice threonine-and hydroxyproline-rich glycoprotein is common to cell wall and hydrophobic plasma-membrane glycoproteins. Planta. 196 (3), 510-522 (1995).
- Smallwood, M., Yates, E. A., Willats, W. G. T., Martin, H., Knox, J. P. Immunochemical comparison of membrane-associated and secreted arabinogalactan-proteins in rice and carrot. Planta. 198 (3), 452-459 (1996).
- Wisniewski, J. P., Rathbun, E. A., Knox, J. P., Brewin, N. J. Involvement of diamine oxidase and peroxidase in insolubilization of the extracellular matrix: implications for pea nodule initiation by Rhizobium leguminosarum. Molecular Plant-Microbe Interactions. 13 (4), 413-420 (2000).
- Jones, L., Seymour, G. B., Knox, J. P. Localization of pectic galactan in tomato cell walls using a monoclonal antibody specific to (1[->]4)-β-D-galactan. Plant Physiology. 113 (4), 1405-1412 (1997).
- Willats, W. G., Marcus, S. E., Knox, J. P. Generation of a monoclonal antibody specific to (1→5)-α-L-arabinan. Carbohydrate Research. 308 (15), 149-152 (1998).
- Cornuault, V., et al. LM6-M: a high avidity rat monoclonal antibody to pectic α-1, 5-L-arabinan. BioRxiv. , 161604 (2017).
- Sutherland, P., Hallett, I., Jones, M. Probing cell wall structure and development by the use of antibodies: a personal perspective. New Zealand Journal of Forestry Science. 39, 197-205 (2009).
- Mikkelsen, M. D., et al. Ancient origin of fucosylated xyloglucan in charophycean green algae. Communications Biology. 4 (1), 754 (2021).
- Fangel, J. U., Jones, C. Y., Ulvskov, P., Harholt, J., Willats, W. G. T. Analytical implications of different methods for preparing plant cell wall material. Carbohydrate Polymers. 261, 117866 (2021).
- Moore, J. P., et al. Analysis of plant cell walls using high-throughput profiling techniques with multivariate methods. The Plant Cell Wall: Methods and Protocols. , 327-337 (2020).
- Gao, Y., Fangel, J. U., Willats, W. G. T., Moore, J. P. Tracking polysaccharides during white winemaking using glycan microarrays reveals glycoprotein-rich sediments. Food Research International. 123, 662-673 (2019).
- Solden, L. M., et al. Interspecies cross-feeding orchestrates carbon degradation in the rumen ecosystem. Nature Microbiology. 3 (11), 1274-1284 (2018).
- Fangel, J. U., et al. Tracking polysaccharides through the brewing process. Carbohydrate Polymers. 196, 465-473 (2018).
- Mravec, J., et al. Pea border cell maturation and release involve complex cell wall structural dynamics. Plant Physiology. 174 (2), 1051-1066 (2017).
- Wickham, H. . ggplot2: elegant graphics for data analysis. , (2009).
- Gu, Z. Complex heatmap visualization. iMeta. 1 (3), 43 (2022).
- Nasrollahzadeh, M., Nezafat, Z., Shafiei, N., Soleimani, F. . Polysaccharides in Food Industry. , (2021).
- Shao, P., et al. Recent advances in improving stability of food emulsion by plant polysaccharides. Food Research International. 137, 109376 (2020).
- Sanz, M. L., Martínez-Castro, I. Recent developments in sample preparation for chromatographic analysis of carbohydrates. Journal of Chromatography. A. 1153 (1-2), 74-89 (2007).
- Bethke, G., Glazebrook, J. Cyclohexane diamine tetraacetic acid (CDTA) extraction of plant cell wall pectin. Bio-Protocol. 4 (24), e1357 (2014).
- Lu, Y., He, Q., Fan, G., Cheng, Q., Song, G. Extraction and modification of hemicellulose from lignocellulosic biomass: A review. Green Processing and Synthesis. 10 (1), 779-804 (2021).
- Jayasekara, S., Ratnayake, R. Microbial cellulases: an overview and applications. Cellulose. 22, 92 (2019).
- Verhertbruggen, Y., Marcus, S. E., Haeger, A., Ordaz-Ortiz, J. J., Knox, J. P. An extended set of monoclonal antibodies to pectic homogalacturonan. Carbohydrate Research. 344 (14), 1858-1862 (2009).
- Villares, A., Mateo-Vivaracho, L., Guillamón, E. Structural features and healthy properties of polysaccharides occurring in mushrooms. Agriculture. 2 (4), 452-471 (2012).
- Kračun, S. K., et al. Carbohydrate microarray technology applied to high-throughput mapping of plant cell wall glycans using comprehensive microarray polymer profiling (CoMPP). Methods in Molecular Biology. 1503, 147-165 (2017).
- Rajasundaram, D., et al. Understanding the relationship between cotton fiber properties and non-cellulosic cell wall polysaccharides. PLoS One. 9 (11), e112168 (2014).
- Michalak, L., et al. Microbiota-directed fibre activates both targeted and secondary metabolic shifts in the distal gut. Nature Communications. 11 (1), 5773 (2020).
- Salmeán, A. A., Hervé, C., Jørgensen, B., Willats, W. G., Mravec, J. Microarray glycan profiling reveals algal fucoidan epitopes in diverse marine metazoans. Frontiers in Marine Science. 4, 293 (2017).
- Knox, J. P. Revealing the structural and functional diversity of plant cell walls. Current Opinion in Plant Biology. 11 (3), 308-313 (2008).
- Manimala, J. C., Roach, T. A., Li, Z., Gildersleeve, J. C. High-throughput carbohydrate microarray profiling of 27 antibodies demonstrates widespread specificity problems. Glycobiology. 17 (8), 17-23 (2007).
- Stephen, P., Tseng, K. -. L., Liu, Y. -. N., Lyu, P. -. C. Circular permutation of the starch-binding domain: inversion of ligand selectivity with increased affinity. Chemical Communications. 48 (20), 2612-2614 (2012).
- Gunnarsson, L. C., Dexlin, L., Karlsson, E. N., Holst, O., Ohlin, M. Evolution of a carbohydrate binding module into a protein-specific binder. Biomolecular Engineering. 23 (2-3), 111-117 (2006).
- Moller, I., et al. High-throughput screening of monoclonal antibodies against plant cell wall glycans by hierarchical clustering of their carbohydrate microarray binding profiles. Glycoconjugate Journal. 25 (1), 37-48 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados