Method Article
ハイスループット糖鎖分析のためのマイクロアレイポリマープロファイリング(MAPP)
要約
マイクロアレイポリマープロファイリング(MAPP)は、生体サンプル中の糖鎖の組成分析のためのハイスループット技術です。
要約
マイクロアレイポリマープロファイリング(MAPP)は、植物や藻類の組織、食品素材、ヒト、動物、微生物のサンプルなど、さまざまな生体サンプル中の糖鎖や複合糖質の組成と相対存在量を体系的に測定するための頑健で再現性の高いアプローチです。マイクロアレイ技術は、小型化されたハイスループットスクリーニングプラットフォームを提供することで、この方法の有効性を支えており、糖鎖と特異性の高い糖鎖指向性分子プローブとの間の何千もの相互作用を、少量の分析種のみを使用して同時に特性評価することができます。構成糖鎖は化学的および酵素的に分画された後、サンプルから順次抽出され、ニトロセルロースメンブレンに直接固定化されます。糖鎖組成は、特定の糖鎖認識分子プローブを強奪および印刷された分子に結合させることによって決定されます。MAPPは、単糖類や結合解析、質量分析などの従来の糖鎖解析手法を補完するものです。しかし、糖鎖を認識する分子プローブは、糖鎖の構造構造に関する洞察を提供し、生物学的相互作用と機能的役割の解明に役立ちます。
概要
糖鎖は生命のあらゆる領域に遍在しており、他の高分子と比較して構造と機能において比類のない多様性を示します1。しかし、糖鎖の複雑さ、生合成やグリコシド結合のばらつき、糖鎖構造を解剖するための適切な方法が不足しているため、この構造と機能の多様性に関する理解は比較的限られています2。
多くの糖鎖分析技術は破壊的であり、糖鎖をその構成単糖類に分解する必要があり、関連する3次元的および生物学的な文脈を不明瞭にする可能性があります3。逆に、モノクローナル抗体(mAb)、糖鎖結合モジュール(CBM)、レクチン、ウイルス凝集素、微生物接着剤は、糖鎖認識分子プローブ(GRMP)と総称される4、特定のエピトープを認識して結合し、複雑なマルチグリカンマトリックス内の糖鎖を検出および識別するためのツールとして使用できます5,6。
ここでは、幅広い生体サンプルに適用可能な、迅速で汎用性の高い非破壊的な糖鎖分析法であるマイクロアレイポリマープロファイリング(MAPP)を紹介します。この分析法は、多様な生物学的および工業/商業系由来の糖鎖を分析するための頑健でハイスループットな技術を提供することを目的としています。MAPPは、糖鎖指向性分子プローブの認識特異性と再現性のある高性能マイクロアレイスクリーニング技術を融合させ、数千の分子間相互作用を並行してプロファイリングすることを可能にします。このアプローチのアウトプットは、対象サンプルまたは組織内の糖鎖の組成と相対存在量に関する診断的洞察です。
MAPPは、独立したスタンドアロンの方法として、または免疫蛍光顕微鏡法7,8,9および単糖または連鎖分析10,11などの他の生化学的手法と組み合わせて使用できます。この手法は、純粋で構造的に明確に定義されたオリゴ糖標準試料で印刷されたアレイを使用して、新規GRMPのエピトープ特異性をマッピングするためにも使用できます12。酵素結合免疫吸着アッセイ(ELISA)などの他の方法に対するMAPPの主な利点は、少量のサンプルとの適合性です13,14。さらに、MAPPは、非常にハイスループットな分析15を提供し、印刷されたサンプルがニトロセルロース16に固定化されると乾燥して安定しているため、サンプル保存の効果的な形態を提供します。
GRMPの結合は、一般に、特定の多糖類(キシラン、マンナン、キシログルカンなど)に特有の結合部位(エピトープ)を集合的に形成する多数の連続した糖残基の存在に依存しています。17.対照的に、単糖組成やメチル化分析などのほとんどの生化学的手法を使用して定量化される個々の糖残基(キシロース、マンノース、グルコース)は、複数の多糖類クラスの成分である可能性があるため、割り当てが困難です18。
MAPPは、少量の材料でさまざまなソースからの複数の糖鎖を迅速に分析できるという技術ギャップに対応して開発されました。MAPPは、過去30年間に開発され、特徴付けられてきたGRMPの広範なレパートリーを活用しています12,19,20,21,22,23,24,25,26,27,28,29,30,31,32.MAPPの開発は反復的なプロセスであり、技術は着実に洗練され、最適化されてきました。現在、糖鎖が中心的な役割を果たすさまざまな自然および産業システムへのMAPPの応用を説明するかなりの文献があります5、6、9、10、21、33、34、35、36、37、38、39。ここでは、MAPPの現状について述べる。
プロトコル
MAPP法の主な実験段階を 図1にまとめます。
1. サンプルの調製
注:ここでは、例示の目的で、この方法を植物組織に適用する。選ばれた植物は、 アラビカコーヒーノキ、 Allium sativum var. ophioscorodon、 およびいくつかのタイのマンゴー品種(Aokrong、Kam、Rad、Chokanan、Mamkamdang、Talabnak、Mahachanok、Nga)でした。植物は商業的重要性のために選ばれました。人間が消費するためのそれらの処理は、現在十分に活用されていない農業産業廃棄物を生成し、純粋な糖鎖を含む付加価値製品の供給源を提供する可能性があります。したがって、MAPPは、バイオプロスペクティングの目的で廃植物バイオマスの糖鎖組成を特徴付けるために適用されました。
- 植物材料を異なる組織(根、茎、葉など)に分離します。
- 植物組織を40°Cの熱風オーブンで12〜24時間乾燥させます(サンプルに応じて時間を増減します)。あるいは、サンプルを液体窒素で急速凍結し、その後~4日間凍結乾燥します。
- 乳棒と乳鉢、または各チューブにボールベアリングを備えた機械式組織ライザー( 材料表を参照)を使用して、サンプルを微粉末に均質化します。
注:新鮮な植物組織の場合、均質化する前に乾燥または凍結乾燥することをお勧めします。一般に、乳棒と乳鉢による均質化は、ほとんどの乾燥サンプルで十分です。穀物、豆類、パスタなどの加工食品など、特に弾力性のあるサンプルの場合、液体窒素で急速凍結することで、サンプルの均質化の速度と効率を高めることができます。機械的均質化は、ほぼすべてのサンプルタイプに適合し、かなり高速で労働集約的ではなく、同じ機器(乳棒や乳鉢など)の繰り返し使用によるサンプルのクロスコンタミネーションのリスクを効果的に最小限に抑えることがわかりました。
2. アルコール不溶性残渣(AIR)の調製
- 1.5 mLの70%(v/v)エタノールを、50〜100 mgの風乾および均質化したサンプル材料に加えます。
- 完全にボルテックスして混合し、室温で10,000 x g で10分間遠心分離します。得られた上清をピペットで廃棄し、ペレットを保持します。
- 残りのペレットに、1.5 mLのメタノールとクロロホルム(1:1 [v/v])を加えます。上清をボルテックスし、遠心分離し、ステップ2.2に従って廃棄します。
- 残りのペレットに、1.5 mLの100%アセトンを加えます。上清をボルテックスし、遠心分離し、ステップ2.2に従って廃棄します。
- 得られたペレットをドラフトで一晩置いて残留アセトンを蒸発させるか、真空遠心分離機で乾燥させます。
注意: AIR材料は、必要になるまで周囲温度で保管できます。
3. 糖鎖抽出
注:可能であれば、再懸濁を助けるために、各チューブにボールベアリングを備えた組織ライザーですべての抽出ステップを実行してください。組織ライザーが利用できない場合は、代わりに連続攪拌または振とうで抽出を行うことができます。これが不可能な場合は、抽出時間を延長する必要があります。
- 10 mg の AIR 材料に、pH 7.5 の 50 mM シクロヘキサンジアミン四酢酸(CDTA、 材料表を参照)を 30 μL/mg 添加します。
- 27Hzで2分間振とうし、続いて10Hzで2時間振とうします。
- 10,000 x g で4°Cで10分間遠心分離します。 得られた上清を保持し、滅菌微量遠心チューブに加え、ロータリーシェーカーで4°Cで保存します。
- 残渣ペレットに、30 μL/mg 4 M NaOH + 0.1 % (w/v) NaBH4 を添加します。
注意: NaBH4 は飲み込むと有毒です。個人用保護具(PPE)を使用してください。ドラフトの下で取り扱ってください。ほこりの形成を避けてください。ほこりを吸い込まないでください。製品を水に接触させないでください。 - 手順 3.2 から 3.3 を繰り返します。残留ペレットをdH2Oで2〜3回洗浄して、残留NaOHを除去します。
- 30 μL/mg セルラーゼ(できればGH5 エンド-1,4-β-グルカナーゼ、メーカーが推奨する適切な酵素バッファー中、材料 表を参照)をペレットに加え、酵素の最適温度で 16 時間インキュベートします。
- サンプルを10,000 x g で4°Cで10分間遠心分離します。上清を保持し、洗浄された微量遠心チューブに移し、ロータリーシェーカーで4°Cで保存します。抽出したら、サンプルをできるだけ早く印刷する必要があります。
- 保存したすべての抽出物を、4°Cで10分間、10,000 x g で再度遠心分離します。
注意: サンプルには微粒子や破片があってはなりません。必要に応じて、マイクロアレイ印刷の前に0.2μmスピンフィルターを通過させます。特に粘性のあるサンプルは、マイクロアレイのキャピラリーとプリントヘッドが目詰まりしやすいため、マイクロアレイ分析と互換性がありません。原則として、ユーザーは標準的な少量のピペットで印刷するすべてのサンプルをピペットでピペットできる必要があります。
4. 規格の作成
- 定義された糖鎖標準試料(表1)の溶液1 mg/mLを滅菌dH2Oで調製します。パキマンを標準物質として使用する場合は、代わりに 4 M NaOH に溶解し、可溶化後に氷酢酸で中和します。
- 調製した標準試料をロータリーシェーカーで4°Cで一晩保存し、完全に可溶化させます。
- すべての標準試料を 10,000 x g で 4 °C で 10 分間遠心分離し、破片をペレット化します。得られた上清は、その後の印刷に使用されます。
5. マイクロアレイの印刷
- グリセロール系バッファー(GSB;47%グリセロール、52.9%dH2O、0.06%Triton X-100、および0.04%殺生物剤[水中0.15%-0.17%硝酸第二銅および1.4%-2.0%硝酸マグネシウム]を混合)で1:20(v / v)希釈液を調製し、ろ過滅菌)( 材料表を参照)し、15,000 x g (室温)で10分間遠心分離します。
注:インク溶液は、印刷されたマイクロアレイをメンブレン上で視覚的に検出できるように、印刷されたサンプルの周囲に上下の境界線を作成するために必要です。ただし、インク溶液には沈殿物が含まれている可能性があります。すべての溶液には印刷用の微粒子が含まれていない必要があるため、ピペッティング時に沈殿物を乱さないようにしてください。これが不可能になったら、廃棄して新鮮なものを準備します。溶液は、微粒子を除去するために簡単にろ過することはできません。 - 40 μL のインク溶液と GSB を最初の 384 ウェルプレートの最初のセクションに加えます(図 2)。
- 25 μL の GSB をすべての希釈 1(D1)ウェルに添加します。40 μL の GSB をすべての希釈倍率 2、3、4(D2-D4)ウェルに加えます。
- 抽出した糖鎖サンプルと定義糖鎖基質を 25 μL の糖鎖サンプルを D1 ウェルに順番に添加し、GSB で 1:1 (v/v) に希釈します。
- D1ウェルから10 μLのサンプルを採取し、D2ウェルに添加して、各サンプルを4回段階希釈します。ピペットで静かに吸引して混ぜます。
- D2ウェルから10 μLのサンプルを採取し、それをD3ウェルに添加して、このプロセスを繰り返します。
- D4ウェルについても繰り返します。混合後、D4ウェルから10 μLを廃棄し、各ウェルに最終容量40 μLが含まれるようにします。
- 40 μLのインク溶液とGSBを最終プレートの最終ブロックに加えます。
- プレートを粘着プレートカバーで覆い、3,000 x g (室温)で10分間遠心分離します。遠心分離後に気泡が残っていないことを確認し、必要に応じて繰り返します。
- 非接触圧電マイクロアレイ印刷ロボットを使用して、以下の手順に従ってサンプルをニトロセルロースメンブレン( 材料表を参照)に印刷します。
注意: 以下は、最適な印刷品質のために推奨されるアクションです。ただし、必要な特定のパラメータは、最終的に使用する機器によって異なります。ユーザーは、機器の製造元に連絡して、デバイスに必要な適切なカスタマイズと印刷設定について話し合うことをお勧めします。- 印刷する前に、廃液バッファーリザーバーを空にし、必要に応じてクリーンバッファーリザーバーにクリーンなGSBを充填します。機器の電源を入れ、湿度と温度の制御システムが統合されている場合は、>10分間安定させます。マイクロアレイ装置のスイッチを入れ、システムを初期化します。
注意: 機器の内圧を決定するためのテストを実行することをお勧めします。圧力が低すぎる場合は、高圧パージを実行する必要がある場合があります。繰り返しになりますが、機器の製造元に連絡して、特定の機器の特定の操作について話し合ってください。 - プリントヘッドとキャピラリーをGSBで数回パージして、破片や潜在的な汚染物質を取り除きます。GSBのプレートを単独でロードするか、ロードされたプレートからのサンプル吸引をバイパスして、クリーンバッファーリザーバーから直接プリントするように機器を設定して、テストプリントを実行します。
注意: ニトロセルロースメンブレンを使用してテスト印刷を実行する必要はありません。きれいな顕微鏡スライドで十分であり、サンプル印刷前にスポットサイズ、形状、品質を目視で評価できるという利点があります。 - 抽出した糖鎖サンプルをプリントする際は、各サンプル間でクリーンなGSBでフラッシュするようにシステムをプログラムしてください。
注:通常、印刷スポットあたりのサンプル量は100 pL〜10 nLで、スポットサイズは選択したサンプル量に応じて20 μm〜100 μmの範囲です。1 つのソース 384 ウェルプレートから 100 個のマイクロアレイをプリントするには、システムフラッシングを含めて約 40 分かかります。結果として得られるマイクロアレイのサイズは約1cm2 になります。プレートを追加すると、プレートあたりアレイの長さが約1cm長くなります。印刷されたマイクロアレイ設計の概略図を 図3に示します。印刷後、マイクロアレイはすぐに使用でき、数年間保存することができます。印刷中にサンプルが蒸発する可能性があるため、何らかの理由で印刷ジョブを繰り返す必要がある場合は、新しいサンプルプレートをロードし、元のプレートを廃棄することをお勧めします。 - 週に一度、プリントヘッドとキャピラリーを徹底的に清掃してください。これを行うには、GSBに1:20希釈の濃NaOHを含む384ウェルをロードし、顕微鏡スライドに40分から1時間のプリントを実行します。ユーザーは、先に進む前に、この洗浄液が機器と互換性があることを確認する必要があります。
- 印刷する前に、廃液バッファーリザーバーを空にし、必要に応じてクリーンバッファーリザーバーにクリーンなGSBを充填します。機器の電源を入れ、湿度と温度の制御システムが統合されている場合は、>10分間安定させます。マイクロアレイ装置のスイッチを入れ、システムを初期化します。
- 印刷されたマイクロアレイ用に作成された一意のグリッドファイル(.galファイル)を保存し、下流の分析の準備を整えます。
6. マイクロアレイの調査
- ニトロセルロースメンブレンから個々の同一の印刷されたマイクロアレイを切り取り、プロービング用の適切なサイズの容器(12ウェルまたは24ウェルマイクロタイタープレートなど)に入れます( 材料表を参照)。アレイは容器の底面に平らに置く必要があります。プローブごとに 1 つのマイクロアレイが必要で、1 つのテクニカル レプリケートに相当します。
- 非特異的結合を低減するには、マイクロアレイをMP-TBSTブロッキングバッファー(1x Tris緩衝生理食塩水、pH 7.5、+ 0.1% [v/v] TWEEN 20 [TBST]、5%[w/v]脱脂粉乳を添加、 材料表を参照)中で1時間インキュベートします。ボリュームがアレイ全体を水没させるのに十分であることを確認してください。
- インキュベーション後、MP-TBSTを取り外し、新しい容量のMP-TBSTと交換します。
- 1:10-1:1,000(メーカー指定、 材料表参照)に希釈したモノクローナル抗体(mAb)またはHisタグCBM、またはその他のGRMP(レクチンなど)と、MP-TBST中で回転/揺動シェーカー上で2時間インキュベートします。
- インキュベーション後、分子プローブ溶液を除去し、アレイを清潔なTBSTで覆い、アレイが完全に水没していることを確認します。プローブの残留液を除去するには、すぐにTBSTを取り外し、新しいボリュームと交換します。アレイを回転/揺動シェーカーに5分間置きます。5分後、TBSTを取り外し、新しいボリュームと交換し、回転/ロッキングシェーカーの上に5分間置きます。
メモ: このプロセスは、TBST の最初の追加と即時の削除を含めずに、3 回繰り返す必要があります。 - アルカリホスファターゼ標識二次抗体(必要に応じて、抗マウス、抗ラット、抗ウサギ、抗His、材料 表を参照)をMP-TBSTで1:1,000希釈したアレイを、ロッキング/回転シェーカーで2時間インキュベートします。
注:西洋ワサビペルオキシダーゼ標識二次抗体も適しており、発色のためにテトラメチルベンジジン(TMB)/過酸化水素基質と組み合わせて使用します。 - インキュベーション後、ステップ6.5に従って洗浄手順を繰り返し、非特異的に結合した二次抗体を除去します。
- 抗体結合の発色検出のために、アレイをニトロブルーテトラゾリウム(NBT)/5-ブロモ-4-クロロ-3-インドリルホスフェート(BCIP)発色溶液( 材料表を参照)で覆います。抗原結合部位に紫色の沈殿物スポットが発生するまで放置します(通常は5〜30分ですが、反応が急速に起こる可能性があるため、過飽和を避けるためにアレイを注意深く監視する必要があります)。
注意: BCIPは皮膚に接触すると有害であり、呼吸器への刺激を引き起こす可能性があります。PPEを使用します。ほこりの形成を避けてください。ほこりを吸い込まないでください。 - 反応を終了するには、アレイをきれいな水道水に浸し、広範囲に洗浄します。
- あぶらとり紙の間にアレイを置き、常温で一晩乾燥させます。
- 明らかな欠陥のあるアレイを廃棄し、そのような場合はプローブプロトコルを繰り返します(図4)。
7. 分析と定量化
- デスクトップスキャナーを使用して、現像したアレイを2,400ドット/インチ(dpi)の解像度でスキャンします。画像をTIFFファイルに変換してから、ネガに変換します。
- マイクロアレイ解析ソフトウェア( 材料表参照)を使用して、各マイクロアレイ画像に固有の.galグリッドファイルを重ね合わせ、各抗原結合部位で生成されたスポットの色強度を計算し、局所的な背景を差し引きます。
- グリッド データを.txt ファイルとしてエクスポートします。これらは、分析のためにExcelシートに手動でインポートできます。
- まず各サンプル希釈液でスポット強度を平均し、次に含まれる生物学的複製全体でスポット強度を平均することにより、各サンプルの平均スポットシグナル強度値を生成します。
- 最大平均スポット信号強度に値 100 を割り当て、それに応じて残りのデータを正規化します。
注:正規化された平均スポットシグナル強度は、Excel33の条件付き書式関数、またはR ggplot2パッケージ40,41のgeom_tile関数を使用して、相対的な糖鎖エピトープ存在量のヒートマップとして表示できます。
結果
MAPPは、タイ北部のいくつかの品種のマンゴーの皮、コーヒーノキのアラビカチェリー果肉とコーヒー豆の加工廃棄物、およびタイの黒ニンニク、Allium sativum var. ophioscorodonの根、茎、葉の組織を含む農業バイオマス廃棄物の糖鎖組成を決定するために適用されました。いくつかの植物由来の多糖類は、機能性成分として食品業界で使用されています42,43。したがって、この実験の目的は、これらの豊富で現在十分に活用されていない農業産業廃棄物が、付加価値のある純粋な多糖類の供給源を提供するかどうかを推測することでした。
AIR材料は、糖鎖分析用のサンプルを調製するために日常的に用いられている44。AIR を使用することには、いくつかの利点があります。溶媒による処理は、内因性のCAZyme、代謝物、小さな糖類、脂質、および色素を効果的に除去し、多糖類と構造タンパク質を豊富に含むサンプルをもたらします34。さらに、AIRの製造は、熱安定性があり、数年間保存できるため、サンプルの寿命を延ばすための迅速かつ効果的な方法です。
構成糖鎖の 3 つの混合画分を、CDTA、NaOH、およびセルラーゼを使用して植物 AIR 材料から順次抽出しました。CDTAはCa2+ イオンをキレート化し、植物細胞壁からCa2+ 架橋脱エステル化ペクチンを除去することを可能にする45。アルカリ性条件では、セルロースミクロフィブリルとヘミセルロース、およびリグニンとヘミセルロースの間のエステル結合の水素結合と鹸化の破壊により、マンナン、キシラン、β-グルカンなどの主にヘミセルロースが放出されます46。 バチルス 属菌由来の組換えエンド-1,4-β-グルカナーゼを用いて、構造セルロースミクロフィブリルの非晶質領域を分解し、細胞壁内のセルロースに結合した残存糖鎖を放出した47。この方法では、糖鎖をこれら3つの大まかなグループに効果的に分離できますが、サンプルは純粋ではないことに注意する必要があります。抽出方法の性質上、ヘミセルロースがサンプル中に存在する場合、必然的に抽出され、その後、CDTAおよびセルラーゼ画分でさまざまな程度で検出されます。同様に、サンプル中にペクチンが存在する場合、NaOH抽出でペクチンが検出されます。
非接触圧電マイクロアレイ印刷ロボットを使用して、抽出した糖鎖画分を非共有結合結合11を介してニトロセルロース上に固定化し、300個の同一のマイクロアレイを形成した。定義された糖鎖標準試料(表 1)も、ポジティブコントロールとして印刷されたマイクロアレイに含めました(図 5)。選択した糖鎖標準試料について得られたMAPP結合プロファイルは、以前に報告されたエピトープ特異性に対応しています。例えば、LM21は複数のマンナン多糖類(ガラクトマンナンとグルコマンナン)に強い結合を示したが、LM22はガラクトマンナン25に弱い結合しか示さなかった。同様に、LM19は脱エステル化ホモガラクツロナン48に優先的に結合し、LM15はタマリンド種子キシログルカン23に結合する。
非セルロース性植物細胞壁多糖類の診断である 16 種類のエピトープの相対存在量は、糖鎖指向性モノクローナル抗体(表 2)を印刷された抽出物(図 6)に付着させることで検出しました。抽出された糖鎖の大部分は、アルカリ性NaOH画分内で検出されました。キシラン/アラビノキシランを表すモノクローナル抗体 LM10 および LM11 について、試験したすべてのマンゴー品種の皮に強い結合シグナルが記録されました。ニンニクサンプル中、LM10およびLM11は根組織抽出物(ニンニクR)に優先的に結合し、葉組織抽出物(ニンニクL)には弱い結合のみを示した。LM19は、部分的にメチルエステル化または非エステル化ホモガラクツロナンを表し、一部のマンゴー品種抽出物(AokrongおよびTalabnak)に強く結合しましたが、他の品種(Chokanan、Mamkamdang、Mahachanok、およびNga)では結合が弱く、またはその結合は検出されませんでした。また、LM19はコーヒー果肉画分にのみ結合し、コーヒー豆加工廃材には結合せず、従来は半精製コーヒーペクチンで構成されていると考えられていた(未発表データ)。
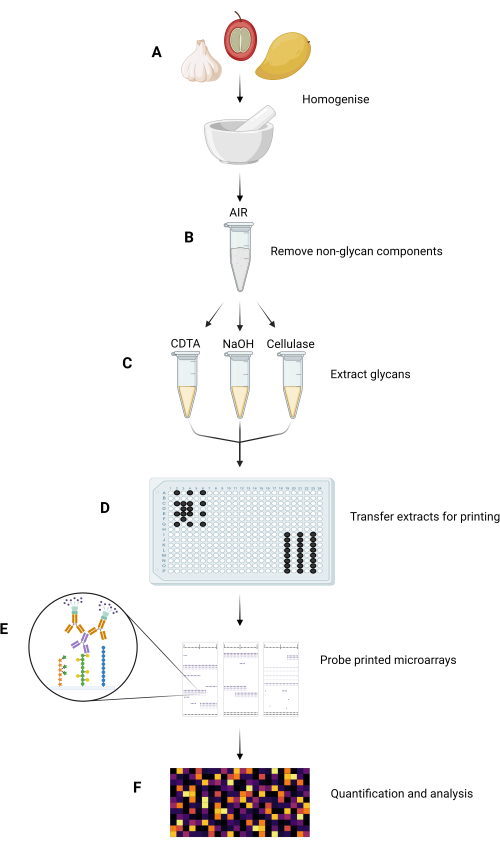
図1:MAPP法の主な実験ステップ。 (A)試料を均質化し、微粉末とする。(B)均質化されたサンプルを処理してAIRを分離します。(C)構成糖鎖は、テーラーメイドされた抽出レジームを使用して逐次抽出されます。(D)抽出した糖鎖画分、インク、およびGSBを、プレートレイアウトに従って384ウェルプレートに転写し、ニトロセルロースにプリントします。(E)プリントされたマイクロアレイは、選択されたGRMPでプローブされます。 (F)プリントされた糖鎖画分へのGRMP結合は、データがヒートマップとして提示される前に定量化され、分析されます。 この図の拡大版をご覧になるには、ここをクリックしてください。
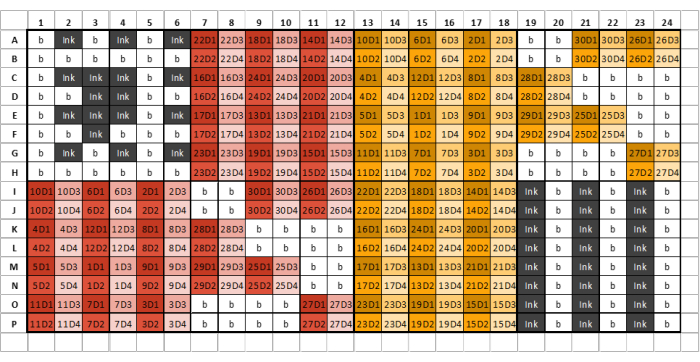
図 2:抽出した糖鎖サンプル/標準試料ごとに 4 希釈でサンプル、インク、GSB をローディングするための 384 ウェルプレートレイアウトの例。 異なる色は異なる抽出試薬から生じるサンプルを示し、異なる色合いは段階希釈を表します。コードの最初の数字はサンプル番号を表し、終了番号は希釈数を表します (D1 は希釈 1、D2 は希薄 2 など)。例えば、「12D3」とラベル付けされたウェルは、糖鎖試料12、希釈率3を表します。ウェルプレートは、6列8列からなる8つの同一のセクションに分割する必要があります。最初のプレートの最初のセクションには、インクとバッファーのみが含まれ、プレートのレイアウト例に似ている必要があります。抽出された糖鎖サンプルは、プレートレイアウトに従って後続のプレートセクションにロードできます。異なる抽出試薬を同じプレートセクションにロードしないでください。切片全体を充満させるにはサンプルが不十分な場合は、その切片に残っているすべてのウェルをバッファーで満たします。井戸を空のままにしないでください。複数のプレートが必要な場合は、すべてのサンプルがロードされた後の次のセクションには、インクとGSBの3つの交互の列が含まれている必要があります-これは、印刷されるサンプルの数によっては、セクション8ではない場合があります。 この図の拡大版をご覧になるには、ここをクリックしてください。
図3:印刷されたマイクロアレイ設計の概略図。 この図の拡大版をご覧になるには、ここをクリックしてください。
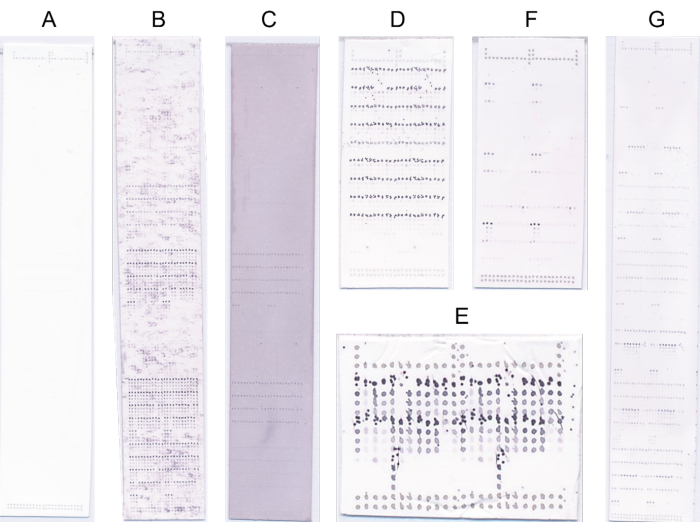
図4:代表的なマイクロアレイ。 (A)バインディングなし。(B)結合シグナルは、高いバックグラウンドシグナルによって不明瞭になります。(C)NBT/BCIPによる過飽和による青/紫の染色全般。(D)基板濃度が高いことによるプロービングの不良。(E)プリントヘッドの汚れによる印刷不良。(F)少数のサンプルに強く結合します。(G)多くのサンプルに強く結合します。 この図の拡大版をご覧になるには、ここをクリックしてください。
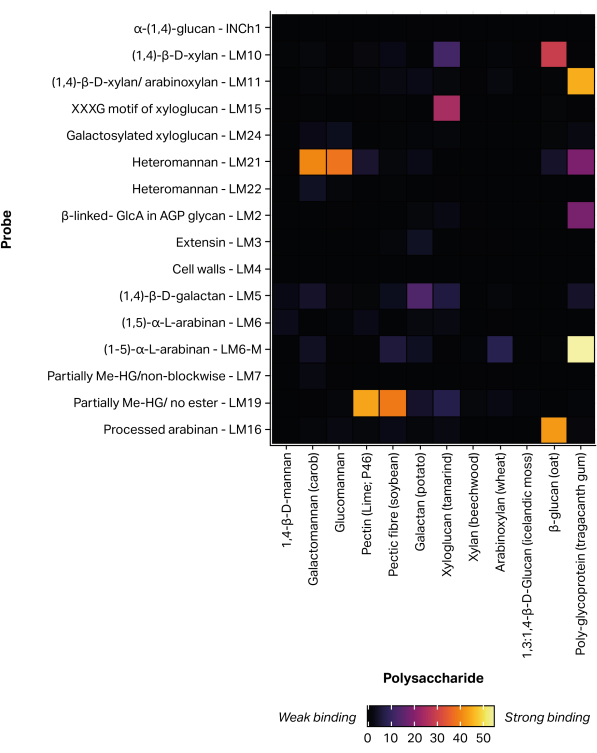
図5:定義された糖鎖標準に結合するモノクローナル抗体は、プリンティングおよびプロービングプロセスのバリデーションに含まれています。 この図の拡大版をご覧になるには、ここをクリックしてください。
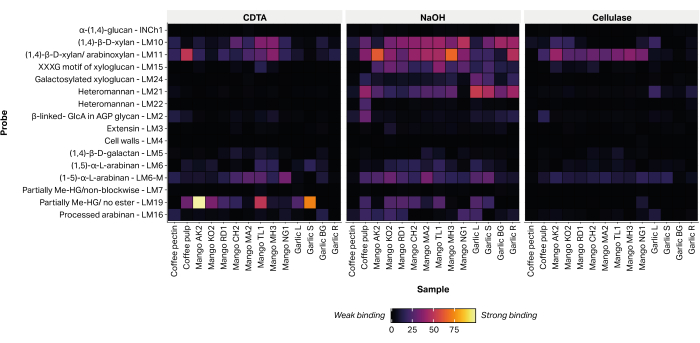
図6:農業バイオマス廃棄物から抽出した糖鎖のMAPPです。 サンプルには、コーヒーパルプ廃棄物(コーヒーパルプとコーヒーペクチン)、いくつかのタイ品種(AO、Aokrong;コウ、カム;RD、ラド;CH、チョカナン;マサチューセッツ州、マムカムダン;TL、タラブナック;MH、マハチャノク;NG、Nga)および黒ニンニクの葉(ニンニクL)、茎(ニンニクS)、球根(ニンニクBG)、および根(ニンニクR)を、CDTA、NaOH、およびセルラーゼ(バチルス 属セルラーゼ5A)を使用します。 この図の拡大版をご覧になるには、ここをクリックしてください。
表 1:ポジティブコントロールとして MAPP 分析に使用した市販の多糖類標準試料。この表をダウンロードするには、ここをクリックしてください。
表2:抽出した植物糖鎖マイクロアレイの調査用に選択された糖鎖指向モノクローナル抗体。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
ここで説明するMAPP法は、現在、糖鎖分析法として確立されています。基本原理は2007年に初めて記載されましたが、マイクロアレイ技術、分子プローブ開発、糖鎖生化学の理解の進歩における最新の革新を活用するために、この技術は継続的に開発されてきました。一般に、糖鎖、特に多糖類は、その構造の複雑さと不均一性45、および容易に配列決定や合成ができないという事実により、タンパク質やヌクレオチドよりも分析が困難です1。多くの場合、糖鎖の複雑さを決定的に解読できる単一の手法はありません。したがって、MAPP は他の方法でよく使用されます。これは、AIRが他のほとんどの糖鎖分析法と互換性があり34、その後のデータセットの比較を容易にするため、AIR調製が通常MAPPの出発点として選択される理由の1つである。
AIR調製前のサンプルの均質化により、一部の空間情報は常に失われます。しかしながら、多糖類が試料から逐次放出されるので、得られた画分中のエピトープの存在は、その試料の分子構造および組成に関する情報を提供する17。したがって、適切な抽出レジームを選択することは、分析法の成功に不可欠です。複数のパラメータが抽出方法の適合性を決定する:細胞構造、時間、温度、pH、圧力、溶媒のイオン強度、および固体粒子試料の細かさ49。構成糖鎖の抽出に成功し、サンプルの代表的な組成図を構築する可能性を最大限に高めるために、より攻撃的な溶媒を幅広く使用することをお勧めします。ほとんどのサンプルでは、CDTA、NaOH、およびセルラーゼは、植物由来の貯蔵および細胞壁多糖類を除去するのに十分です33,50,51,52。一部の組織サンプルでは、CaCl2、HCl、およびNa2CO3も含むハイブリッド抽出レジームが成功することが示されていますが53、海洋微細藻類サンプルではエチレンジアミン四酢酸(EDTA)の添加が必要な場合があります10。
マイクロアレイには、ポジティブコントロールとして使用される、さまざまな純粋で定義された糖鎖標準を含める必要があります5。付属の標準試料は、サンプルの性質に応じて変更する必要があります。印刷したら、適切なGRMPを選択する必要があります。多糖構造へのハイブリドーマモノクローナル抗体の生成は困難である54。糖鎖結合抗体は産生が難しく、親和性が低い可能性がある55。幸いなことに、CBMの遺伝子配列情報は、組換え体発現4とその結合特異性工学について比較的容易に得ることができる56,57。GRMPの印象的なカタログが開発され、そのほとんどが商業的な供給源から入手可能であるが、自然界に存在する糖鎖構造の多様性と比較して、ごく一部しか製造されず、うまく特性評価されている58。これにより、特定の構造を検出して識別する能力が制限される可能性があります。結合特異性が十分に特徴付けられている、存在すると予想される各主要な糖鎖構造を代表する1つまたは2つのプローブを使用して、最初のプロービング実験を行うことが望ましい。その後のプロービング実験では、プローブリストを拡張して、より広い範囲の糖鎖をカバーし、微細構造をより深く掘り下げることができます。
平凡ではありますが、各インキュベーションステップの後にマイクロアレイを完全に洗浄することは、プロービング手順の成功の基本です。非特異的に結合したプローブの除去が効果的でないと、発色後に高いバックグラウンドシグナルが発生し、結果が不明瞭になる可能性があります。この場合、新しいマイクロアレイから始めて、プロービング手順を繰り返す必要があります。さらに、アレイは控えめに、鉗子で端を保持することによってのみ触れる必要があります。ニトロセルロースメンブレンは脆く、損傷しやすいです。発色液は亀裂やしわに溜まり、過飽和を引き起こし、アレイ分析を妨げます。
MAPPは迅速で、適応性があり、便利です。この方法は、ニトロセルロースに抽出して固定化でき、適切な分子プローブがある限り、あらゆる生物学的または産業システムに由来する動物、微生物、または植物の糖鎖に適合します。生成されたデータは、他の糖鎖分析法 では 容易に得られない、詳細で半定量的な組成の洞察を提供します。
開示事項
著者らは、利益相反がないことを宣言します。
謝辞
著者らは、マイクロアレイロボット工学に関する専門家のアドバイスをしてくれたArrayJetに感謝の意を表したい。SSとJSは、チェンマイ大学ファンダメンタルファンド2022(FF65/004)からのご支援に感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| 1,3:1,4-β-D-Glucan, Lichenan (icelandic moss) | Megazyme | P-LICHN | |
| 1,4-β-D-Mannan | Megazyme | P-MANCB | |
| 384-well microtiter plate | Greiner Bio-One | M1686 | |
| 5-bromo-4-chloro-3-indolyl-phosphate (BCIP) | Melford | B74100-1.0 | |
| Acetone | Sigma | 270725 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 115-055-003 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Rat IgG (H+L) | Jackson ImmunoResearch | 112-055-003 | |
| Alkaline Phosphatase AffiniPure Rabbit Anti-His Tag | Jackson ImmunoResearch | 300-055-240 | |
| Arabinoxylan (wheat) | Megazyme | P-WAXYL | |
| Array-Pro Analyzer Software | Media Cybernetics | Version 6.3 | |
| Bacillus sp. Cellulase 5A (BCel5A) | NZYTech | CZ0564 | |
| BAM antibodies | SeaProbes | Various | |
| Black drawing ink (indian ink) | Winsor & Newton | GWD030 | |
| Carbohydrate binding modules | NZYTech | Various | |
| CCRC antibodies | CarboSource | Various | |
| CDTA | Sigma | 319945 | |
| Chloroform | Sigma | PHR1552 | |
| Ethanol | Sigma | 1.11727 | |
| Galactan (potato) | Megazyme | P-GALPOT | |
| Galactomannan (carob) | Megazyme | P-GALML | |
| Glycerol solution | Sigma | 49781-5L | |
| Gum tragacanth (legumes) | Sigma-Aldrich | G1128 | |
| INCh antibodies | INRA | Various | |
| LM and JIM antibodies | PlantProbes | Various | |
| Marathon Argus Microarray Printer | ArrayJet | ||
| Methanol | Sigma | 34860 | |
| Monoclonal antibodies | Biosupplies Australia | Various | |
| NaBH4 | Sigma | 452882 | |
| NaOH | Sigma | S5881 | |
| Nitro-blue tetrazolium (NBT) | Melford | N66000-1.0 | |
| Nitrocellulose membrane | Thermo Fisher Scientific | 88018 | |
| Pectin (degree of methyl esterification 46%) | Danisco | NA | |
| ProClin 200 | Sigma | 48171-U | |
| Rhamnogalacturonan (soybean pectic fibre) | Megazyme | P-RHAGN | |
| Rotating mixer | Fisher Scientific | 88-861-050 | |
| Rotating/rocking Shaker | Cole-Parmer | ||
| Skimmed milk powder | Marvel | ||
| Spin filter | Costar Spin-X | 8160 | |
| Stainless steel beads | Qiagen | 69989 | |
| TissueLyser II | Qiagen | 85300 | |
| Tris | Sigma | 93362 | |
| Triton X-100 | Sigma | T8787-250ML | |
| Tween 20 | Sigma | P9416-100ML | |
| Xylan (beechwood) | Megazyme | P-XYLNBE | |
| Xyloglucan (tamarind) | Megazyme | P-XYGLN | |
| β-Glucan (oat) | Megazyme | P-BGOM |
参考文献
- Amicucci, M. J., et al. A nonenzymatic method for cleaving polysaccharides to yield oligosaccharides for structural analysis. Nature Communications. 11 (1), 3963 (2020).
- Gagneux, P., Panin, V., Hennet, T., Aebi, M., Varki, A. Evolution of glycan diversity. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Willats, W. G. T., McCartney, L., Knox, J. P. Pectin cell biology: complexity in context. Advances in Pectin and Pectinase Research. , 147-157 (2003).
- Cummings, R. D., et al. Glycan-recognizing probes as tools. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Bakshani, C. R., et al. Analysis of glycans in a Burnt-on/Baked-on (BoBo) model food soil using Microarray Polymer Profiling (MAPP) and immunofluorescence microscopy. Food Chemistry. 410, 135379 (2023).
- Salmeán, A. A., Willats, W. G. T., Ribeiro, S., Andersen, T. J., Ellegaard, M. Over 100-year preservation and temporal fluctuations of cell wall polysaccharides in marine sediments. Frontiers in Plant Science. 13, 785902 (2022).
- Cid, M., et al. Recognition of the helical structure of β-1,4-galactan by a new family of carbohydrate-binding modules. Journal of Biological Chemistry. 285 (46), 35999-36009 (2010).
- Runavot, J. -. L., et al. Non-cellulosic polysaccharides from cotton fibre are differently impacted by textile processing. PLoS One. 9 (12), e115150 (2014).
- Ahl, L. I., et al. Analyses of aloe polysaccharides using carbohydrate microarray profiling. Journal of AOAC International. 101 (6), 1720-1728 (2018).
- Vidal-Melgosa, S., et al. Diatom fucan polysaccharide precipitates carbon during algal blooms. Nature Communications. 12 (1), 1150 (2021).
- Moller, I., et al. High-throughput mapping of cell-wall polymers within and between plants using novel microarrays. The Plant Journal. 50 (6), 1118-1128 (2007).
- Ruprecht, C., et al. A synthetic glycan microarray enables epitope mapping of plant cell wall glycan-directed antibodies. Plant Physiology. 175 (3), 1094-1104 (2017).
- Cummings, R. D., et al. Principles of glycan recognition. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Gao, C., et al. Glycan microarrays as chemical tools for identifying glycan recognition by immune proteins. Frontiers in Chemistry. 7, 833 (2019).
- Vidal-Melgosa, S., et al. A new versatile microarray-based method for high throughput screening of carbohydrate-active enzymes. Journal of Biological Chemistry. 290 (14), 9020-9036 (2015).
- Willats, W. G. T., Rasmussen, S. E., Kristensen, T., Mikkelsen, J. D., Knox, J. P. Sugar-coated microarrays: A novel slide surface for the high-throughput analysis of glycans. Proteomics. 2 (12), 1666-1671 (2002).
- Sørensen, I., et al. The charophycean green algae provide insights into the early origins of plant cell walls. The Plant Journal. 68 (2), 201-211 (2011).
- Liu, D., Tang, W., Yin, J. -. Y., Nie, S. -. P., Xie, M. -. Y. Monosaccharide composition analysis of polysaccharides from natural sources: Hydrolysis condition and detection method development. Food Hydrocolloids. 116, 106641 (2021).
- Pattathil, S., et al. A comprehensive toolkit of plant cell wall glycan-directed monoclonal antibodies. Plant Physiology. 153 (2), 514-525 (2010).
- Verhertbruggen, Y., et al. Developmental complexity of arabinan polysaccharides and their processing in plant cell walls. The Plant Journal. 59 (3), 413-425 (2009).
- Rydahl, M. G., et al. Development of novel monoclonal antibodies against starch and ulvan - implications for antibody production against polysaccharides with limited immunogenicity. Scientific Reports. 7 (1), 9326 (2017).
- McCartney, L., Marcus, S. E., Knox, J. P. Monoclonal antibodies to plant cell wall xylans and arabinoxylans. The Journal of Histochemistry and Cytochemistry. 53 (4), 543-546 (2005).
- Marcus, S. E., et al. Pectic homogalacturonan masks abundant sets of xyloglucan epitopes in plant cell walls. BMC Plant Biology. 8, 60 (2008).
- Pedersen, H. L., et al. Versatile high resolution oligosaccharide microarrays for plant glycobiology and cell wall research. The Journal of Biological Chemistry. 287 (47), 39429-39438 (2012).
- Marcus, S. E., et al. Restricted access of proteins to mannan polysaccharides in intact plant cell walls. The Plant Journal. 64 (2), 191-203 (2010).
- Smallwood, M., Martin, H., Knox, J. P. An epitope of rice threonine-and hydroxyproline-rich glycoprotein is common to cell wall and hydrophobic plasma-membrane glycoproteins. Planta. 196 (3), 510-522 (1995).
- Smallwood, M., Yates, E. A., Willats, W. G. T., Martin, H., Knox, J. P. Immunochemical comparison of membrane-associated and secreted arabinogalactan-proteins in rice and carrot. Planta. 198 (3), 452-459 (1996).
- Wisniewski, J. P., Rathbun, E. A., Knox, J. P., Brewin, N. J. Involvement of diamine oxidase and peroxidase in insolubilization of the extracellular matrix: implications for pea nodule initiation by Rhizobium leguminosarum. Molecular Plant-Microbe Interactions. 13 (4), 413-420 (2000).
- Jones, L., Seymour, G. B., Knox, J. P. Localization of pectic galactan in tomato cell walls using a monoclonal antibody specific to (1[->]4)-β-D-galactan. Plant Physiology. 113 (4), 1405-1412 (1997).
- Willats, W. G., Marcus, S. E., Knox, J. P. Generation of a monoclonal antibody specific to (1→5)-α-L-arabinan. Carbohydrate Research. 308 (15), 149-152 (1998).
- Cornuault, V., et al. LM6-M: a high avidity rat monoclonal antibody to pectic α-1, 5-L-arabinan. BioRxiv. , 161604 (2017).
- Sutherland, P., Hallett, I., Jones, M. Probing cell wall structure and development by the use of antibodies: a personal perspective. New Zealand Journal of Forestry Science. 39, 197-205 (2009).
- Mikkelsen, M. D., et al. Ancient origin of fucosylated xyloglucan in charophycean green algae. Communications Biology. 4 (1), 754 (2021).
- Fangel, J. U., Jones, C. Y., Ulvskov, P., Harholt, J., Willats, W. G. T. Analytical implications of different methods for preparing plant cell wall material. Carbohydrate Polymers. 261, 117866 (2021).
- Moore, J. P., et al. Analysis of plant cell walls using high-throughput profiling techniques with multivariate methods. The Plant Cell Wall: Methods and Protocols. , 327-337 (2020).
- Gao, Y., Fangel, J. U., Willats, W. G. T., Moore, J. P. Tracking polysaccharides during white winemaking using glycan microarrays reveals glycoprotein-rich sediments. Food Research International. 123, 662-673 (2019).
- Solden, L. M., et al. Interspecies cross-feeding orchestrates carbon degradation in the rumen ecosystem. Nature Microbiology. 3 (11), 1274-1284 (2018).
- Fangel, J. U., et al. Tracking polysaccharides through the brewing process. Carbohydrate Polymers. 196, 465-473 (2018).
- Mravec, J., et al. Pea border cell maturation and release involve complex cell wall structural dynamics. Plant Physiology. 174 (2), 1051-1066 (2017).
- Wickham, H. . ggplot2: elegant graphics for data analysis. , (2009).
- Gu, Z. Complex heatmap visualization. iMeta. 1 (3), 43 (2022).
- Nasrollahzadeh, M., Nezafat, Z., Shafiei, N., Soleimani, F. . Polysaccharides in Food Industry. , (2021).
- Shao, P., et al. Recent advances in improving stability of food emulsion by plant polysaccharides. Food Research International. 137, 109376 (2020).
- Sanz, M. L., Martínez-Castro, I. Recent developments in sample preparation for chromatographic analysis of carbohydrates. Journal of Chromatography. A. 1153 (1-2), 74-89 (2007).
- Bethke, G., Glazebrook, J. Cyclohexane diamine tetraacetic acid (CDTA) extraction of plant cell wall pectin. Bio-Protocol. 4 (24), e1357 (2014).
- Lu, Y., He, Q., Fan, G., Cheng, Q., Song, G. Extraction and modification of hemicellulose from lignocellulosic biomass: A review. Green Processing and Synthesis. 10 (1), 779-804 (2021).
- Jayasekara, S., Ratnayake, R. Microbial cellulases: an overview and applications. Cellulose. 22, 92 (2019).
- Verhertbruggen, Y., Marcus, S. E., Haeger, A., Ordaz-Ortiz, J. J., Knox, J. P. An extended set of monoclonal antibodies to pectic homogalacturonan. Carbohydrate Research. 344 (14), 1858-1862 (2009).
- Villares, A., Mateo-Vivaracho, L., Guillamón, E. Structural features and healthy properties of polysaccharides occurring in mushrooms. Agriculture. 2 (4), 452-471 (2012).
- Kračun, S. K., et al. Carbohydrate microarray technology applied to high-throughput mapping of plant cell wall glycans using comprehensive microarray polymer profiling (CoMPP). Methods in Molecular Biology. 1503, 147-165 (2017).
- Rajasundaram, D., et al. Understanding the relationship between cotton fiber properties and non-cellulosic cell wall polysaccharides. PLoS One. 9 (11), e112168 (2014).
- Michalak, L., et al. Microbiota-directed fibre activates both targeted and secondary metabolic shifts in the distal gut. Nature Communications. 11 (1), 5773 (2020).
- Salmeán, A. A., Hervé, C., Jørgensen, B., Willats, W. G., Mravec, J. Microarray glycan profiling reveals algal fucoidan epitopes in diverse marine metazoans. Frontiers in Marine Science. 4, 293 (2017).
- Knox, J. P. Revealing the structural and functional diversity of plant cell walls. Current Opinion in Plant Biology. 11 (3), 308-313 (2008).
- Manimala, J. C., Roach, T. A., Li, Z., Gildersleeve, J. C. High-throughput carbohydrate microarray profiling of 27 antibodies demonstrates widespread specificity problems. Glycobiology. 17 (8), 17-23 (2007).
- Stephen, P., Tseng, K. -. L., Liu, Y. -. N., Lyu, P. -. C. Circular permutation of the starch-binding domain: inversion of ligand selectivity with increased affinity. Chemical Communications. 48 (20), 2612-2614 (2012).
- Gunnarsson, L. C., Dexlin, L., Karlsson, E. N., Holst, O., Ohlin, M. Evolution of a carbohydrate binding module into a protein-specific binder. Biomolecular Engineering. 23 (2-3), 111-117 (2006).
- Moller, I., et al. High-throughput screening of monoclonal antibodies against plant cell wall glycans by hierarchical clustering of their carbohydrate microarray binding profiles. Glycoconjugate Journal. 25 (1), 37-48 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved