Method Article
توليد الخلايا المتغصنة المشتقة من الخلايا الوحيدة مع أنماط ظاهرية مختلفة من السياليل
In This Article
Summary
يتم تقديم بروتوكول فريد وشامل لتوليد خلايا متغصنة مشتقة من الخلايا الأحادية البشرية (mo-DCs) من خلايا الدم أحادية النواة المحيطية المعزولة (PBMCs) باستخدام علاج sialidase. علاوة على ذلك ، يتم وصف طرق تقييم التوصيف الظاهري والوظيفي ل mo-DCs وتقييم كيفية تحسين علاج sialidase لمستوى نضج mo-DCs.
Abstract
أحماض السياليك هي السكريات الأحادية سالبة الشحنة التي توجد عادة في تيرميني جليكان سطح الخلية. نظرا لخصائصها المائية والفيزيائية الحيوية ، فإنها تشارك في العديد من العمليات البيولوجية ، مثل تعديل الاستجابة المناعية ، والتعرف على المستضدات الذاتية وغير الذاتية ، وتفاعلات الكربوهيدرات والبروتين ، إلخ. يتم تنظيم المحتوى الخلوي لحمض السياليك بواسطة السياليداز ، الذي يحفز إزالة بقايا حمض السياليك. أظهرت العديد من الدراسات أن sialo-glycans ضرورية في مراقبة المراقبة المناعية من خلال التعامل مع رابطة الدول المستقلة ومستقبلات Siglec المثبطة عبر الخلايا المناعية. وبالمثل ، أصبحت نقاط التفتيش المناعية للسكر في السرطان أهدافا حاسمة لتطوير العلاجات المناعية. بالإضافة إلى ذلك ، يتم تصور الخلايا المتغصنة (DCs) كعنصر مهم في العلاجات المناعية ، خاصة في أبحاث السرطان ، نظرا لدورها الفريد كخلايا محترفة لتقديم المستضد (APC) وقدرتها على تحفيز الاستجابات المناعية التكيفية وتوليد الذاكرة المناعية. ومع ذلك، فإن وظيفة البلدان النامية تتوقف على نضجها الكامل. DCs غير الناضجة لها وظيفة معارضة لنضج DCs ومحتوى عالي من حمض السياليك ، مما يزيد من تثبيط مستوى نضجها. هذا يقلل من قدرة DCs غير الناضجة على تنشيط الخلايا التائية ، مما يؤدي إلى استجابة مناعية ضعيفة. وبالتالي ، فإن إزالة حمض السياليك من سطح الخلية في DCs البشرية يؤدي إلى نضوجها ، وبالتالي زيادة التعبير عن جزيئات MHC وعرض المستضد. بالإضافة إلى ذلك ، يمكنه استعادة التعبير عن جزيئات التحفيز المشترك و IL-12 ، مما يؤدي إلى امتلاك DCs قدرة أعلى على استقطاب الخلايا التائية نحو النمط الظاهري Th1 وتنشيط الخلايا التائية السامة على وجه التحديد لقتل الخلايا السرطانية. لذلك ، برز حمض السياليك كمغير رئيسي لل DCs ويتم استخدامه كهدف جديد لتعزيز استخدامها العلاجي. توفر هذه الدراسة نهجا فريدا لعلاج DCs المشتقة من الخلايا الوحيدة في المختبر مع sialidase ، والتي تهدف إلى توليد مجموعات DC مع أنماط ظاهرية مختلفة لحمض السياليك على سطح الخلية وملامح نضج وتحفيز مشتركة مخصصة.
Introduction
اكتسبت الجليكان الحاملة لحمض السياليك (السيالوغليكان) اهتماما كبيرا بسبب دورها المناعي. يقدم حمض السياليك أحادي السكاريد ، الأكثر انتشارا في البشر في شكل حمض N-acetylneuraminic ، روابط أساسية للمحاضرات ذات دور معترف به في علم المناعة ، مثل Selectins و Siglecs. تتعرف هذه المحاضرات على السيالوغليكان إما على نفس الخلية (رابطة الدول المستقلة) أو على خلايا مختلفة (ترانس) وتلعب دورا مهما في تفاعلات المضيف الممرض والأنشطة الخلوية الفسيولوجية والمرضيةالمختلفة 1،2،3. علاوة على ذلك ، نظرا لأن حمض السياليك يحتل المواضع النهائية لجليكوكوجينات سطح الخلية ، فإنه يمكن أن يخفي الهياكل الأساسية ، وبالتالي يثبط الاتصال من خلية إلى خلية عبر تأثيرات تنافر غير محددة أو عن طريق إعاقة الكشف بواسطة محاضرات أخرى4. يحدد نشاط مجموعة متنوعة من سياليل ترانسفيراز (التي تنقل أحماض السياليك) وسياليداز (التي تشق روابط حمض السياليك) داخل الخلية كمية حمض السياليك الموجود على السطح. بالإضافة إلى ذلك ، يمكن للسياليل ترانسفيراز القابل للذوبان والسياليداز المعبر عنه من قبل المضيف أو مسببات الأمراض تعديل كمية حمض السياليك خارجيا على سطح الخلية 5,6.
sialylation الشاذة هي سمة من سمات العديد من الحالات المرضية. في أمراض المناعة الذاتية ، يمكن أن يساهم نقص التحفيز في تنشيط المناعة غير المقيد وتلف الأعضاء ، لأن حمض السياليك يساعد على تمييز المستضدات الذاتية وتنظيم الاستجابات الالتهابية7. على العكس من ذلك ، يؤدي فرط السياليل إلى الإفراط في التعبير عن السيالوغليكان ، مثل سياليل-TN ، مستضدات سياليل لويس ، حمض polysialic ، و gangliosides ، والتي تشكل السمة المميزة لبعض أنواع السرطان 8,9. يعتمد فرط السياليل أيضا على زيادة التعبير عن إنزيمات معينة مثل N-acetylglucosaminyltransferase (GNT-V) ، والذي يولد جليكان مرتبط بثلاثي و / أو رباعي الهوائيات N ، والذي ارتبط بنمو السرطان وورم خبيث10. ينظم محتوى حمض السياليك أيضا استقرار البروتين ووظيفته ، وهما أساسيان لدور اللاعبين المسرطنين ذوي الصلة11. لذلك ، يمكن أن تسهل زيادة السياليل تطور الورم ، ورم خبيث ، ومقاومة الأدوية ، والتهرب المناعي. علاوة على ذلك ، فإن تنظيم السيالوغليكان يمكن الأورام من التفاعل مع مستقبلات Siglec المثبطة على الخلايا المناعية وتجنب المراقبة المناعية. لهذا السبب ، تعتبر السيالوغليكان الآن نقاط تفتيش مناعية للسكر وأهدافا علاجية جذابة. على سبيل المثال ، مثبطات المحور المناعي Siglec موجودة بالفعل في التجارب السريرية المبكرة ، لأن مستقبلات الخلايا المناعية Siglec (LECtin) الشبيهة بالغلوبولين المناعي المرتبط بحمض السياليك) تلعب دورا مثبطا للمناعة12.
تم استخدام الإنزيمات لتعديل ملف تعريف الجليكان كأدوات للدراسة أو للاستراتيجيات العلاجية13,14. تم استخدام Sialidase لتغيير الورم الخبيث للخلايا السرطانية لأن الجليكان sialylated مثل sialyl Lewis X ضرورية لهجرة الخلايا وورم خبيثللسرطان 15. في الوقت نفسه ، وصلت مثبطات السياليداز ، التي تعيق انقسام حمض السياليك ، إلى عيادات لعلاج الالتهابات الفيروسية المعتمدة على حمض السياليك16. في الآونة الأخيرة ، اكتسب تعديل حمض السياليك مزيدا من الاهتمام بسبب الدور الحاسم لأحماض السياليك كروابط في محور Siglec المناعي ، مما يعني أنها توفر وسائل جديدة لتقليل هروب السرطان من الاستجابات المناعية. تم تعزيز هذا الاهتمام بشكل أكبر من خلال مساهمة برتوزي الحائزة على جائزة نوبل لعام 2022 وفريقها في العديد من الاستراتيجيات التي تشق بشكل انتقائي السيالوغليكان المتنوع وتحسن الاستجابات المناعية المضادة للسرطان17. وبالتالي ، فإن الاستراتيجيات القائمة على السياليداز تمثل طريقة واعدة للعلاج بنقاط التفتيش المناعية للغليكو. يعتمد النمط الجليكوفينوتايب لخلايا الجهاز المناعي على نوع الخلية وحالة تنشيطها. فيما يتعلق بالخلايا التائية ، تلعب الجليكان دورا رئيسيا في الخطوات الفيزيولوجية المرضية لتطور الخلايا التائية واختيار الخلايا الصعترية ونشاط الخلايا التائية والتمايز والانتشار18. على سبيل المثال ، يؤثر polylactosamine على البروتينات السكرية على المستويات القاعدية للخلايا الليمفاوية B والخلايا الليمفاوية التائية وتنشيط البلاعم19. في البلاعم ، تلعب أنماط تعبير الجليكان المميزة دورا مهما في تجنيد البلاعم إلى البيئة المكروية للورم (TME)20. وبالتالي ، يمكن استخدام التعبير عن الجليكان المرتبط ب O و N بواسطة الخلايا المناعية كمؤشرات جليكوبية محتملة للنهج العلاجية في علاج السرطان وأمراض المناعة الذاتية.
الخلايا المتغصنة (DCs) هي خلايا محددة تقدم المستضد ولديها قدرة فريدة على تحفيز الاستجابات المناعية ، مثل المناعة المضادة للسرطان21. يجب أن تخضع DCs لتنظيم جزيئات MHC التي تقدم المستضد لتقديم المستضدات إلى الخلايا التائية (الإشارة 1) ، والجزيئات المحفزة المشتركة لتنشيط الخلايا التائية (الإشارة 2) والسيتوكينات المؤيدة للالتهابات ، مثل IL-12 ، لتحفيز تكاثر الخلايا التائية المساعدة من النوع 1 (الإشارة 3) 22. يتم تنظيم الملف المناعي الناتج بإحكام ، ونقاط التفتيش ضرورية لمنع تعرض الخلايا السليمة للهجوم. نظرا لأن DCs يمكن أن تحفز الاستجابات المناعية المختلفة ضد الخلايا السرطانية ، يتم استخدامها كلقاحات قائمة على الخلايا ، وقد أظهر عدد كبير من الدراسات السريرية فوائدها المحتملة23,24. بعد أن وافقت إدارة الغذاء والدواء الأمريكية على أول لقاح قائم على DC في عام 201025,26 ، تم تطوير العديد من اللقاحات الأخرى القائمة على DC. يتم إنتاج اللقاحات القائمة على DC بشكل أساسي خارج الجسم الحي وتدار للمرضى لاستنباط استجابات مناعية ضد الأورام. ومع ذلك ، فإن النضج غير الكافي أو القصير هو حاليا أحد العوامل التي تحد من الفعالية السريرية ل DCs ويعني أنه يجب استخدام كوكتيلات السيتوكين باهظة الثمن. بدون النضج الكافي ، لا يمكن ل DCs تنشيط الخلايا التائية في الظروف السريرية. بدلا من ذلك ، تعبر DCs عن نقاط التفتيش المناعية وتؤدي إلى استجابة مناعية متسامحة تمنع الخلايا التائية السامة للخلايا من العمل ضد الخلايا السرطانية.
تحتوي DCs البشرية على أسطح شديدة السياليل ، وينخفض هذا السياليل عند النضج وأثناء الاستجابة المناعية الشاملة27. يمكن تحفيز نضوج DCs عن طريق القضاء على هذه الأحماض السياليك مع sialidase. ينظم Desialylation بشكل كبير العديد من السيتوكينات ، بما في ذلك IL-12 ، بسبب نقل عامل النسخ NF-kB إلى النواة 6,28. بالإضافة إلى ذلك ، يحسن إزالة الشوائب العرض المتقاطع للمستضد من خلال MHC-I والاستجابات المناعية المضادة للورم29,30. وبناء على ذلك ، فإن خروج المغلوب من sialyltransferases ST3Gal.l و ST6Gal.l ، والتي لها دور رئيسي في سياليل DC ، يولد نمطا ظاهريا أكثر نضجا في الفئرانDCs 31.
يوفر علاج سياليداز طريقة لتحفيز جميع جوانب نضج DC ، بما في ذلك زيادة عرض المستضد ، وزيادة التعبير عن جزيئات التحفيز المشترك ، وزيادة إنتاج السيتوكين ، لمعالجة أوجه القصور المذكورة أعلاه وتمكين DCs من استنباط استجابات فعالة. تقدم هذه المقالة إجراء للحصول على DCs البشرية القابلة للحياة من خلال استخدام السياليداز البكتيري. تظهر DCs منزوعة السياليل ملف تعريف نضج محسن ويمكن استخدامها كنماذج للخلايا لتعزيز الاستجابات المناعية المضادة للورم في المختبر. يتم الحصول على DCs من وحيدات الدم ، والتي يتم تمييزها بعد ذلك في المختبر في وجود السيتوكين إنترلوكين -4 (IL-4) وعامل تحفيز مستعمرة البلاعم المحببة (GM-CSF). يصف هذا العمل أيضا الطرق القائمة على الليكتين لتحليل حمض السياليك على سطح الخلية وطرق النمط المناعي لمستوى نضج التيار المستمر. يمكن استخدام الإجراء الموصوف هنا لإزالة أنواع الخلايا الأخرى ، وبالتالي توفير نهج للتحقيق في دور السيالوغليكان ، وهي نقاط تفتيش حيوية للمناعة السكرية وذات صلة بالتعديل المناعي.
Protocol
تم عزل الخلايا من المعاطف المنتفخة للمتبرعين بالدم المجهولين الأصحاء ، الذين كانوا متطوعين قدمهم بنك الدم الوطني ، المعهد البرتغالي في Sangue e da Transplantação (IPST) ، بعد الحصول على موافقة خطية ومستنيرة من المتبرع (IMP.74.52.4). تمت الموافقة على استخدام الدم من قبل لجنة الأخلاقيات (IPST 30072015) ، وفقا للتوجيه 2004/23 / EC بشأن معايير الجودة والسلامة للتبرع والشراء والاختبار والمعالجة والحفظ والتخزين والتوزيع للأنسجة والخلايا البشرية (القانون البرتغالي 22/2007 ، 29 يونيو). يقوم البنك الحيوي IPST بجمع الدم وتخزينه في كيس تجميع بلاستيكي محدد يحتوي على سترات سكر العنب الفوسفاتية (CPD) ، وهو محلول حفظ ومضاد للتخثر ، للحفاظ على سلامة الدم حتى المعالجة. لتقييم ما إذا كانت المادة البيولوجية مناسبة للتلاعب ، يتم إجراء مكافحة مصلية للتريبونيما الشاحبة وفيروس التهاب الكبد B (HBV) وفيروس التهاب الكبد C (HCV) وفيروس نقص المناعة البشرية (HIV) ، وكلها يجب أن تكون سلبية. بالنسبة للدراسة الحالية ، تم توفير معطف بافي بواسطة IPST لأغراض التحقيق ، إلى جانب المعلومات المتعلقة بتاريخ الجمع والنتائج المصلية وفصيلة الدم وعمر المتبرع32. يمكن أن يبقى معطف بافي في درجة حرارة الغرفة لمدة أقصاها 1 يوم.
1. الحصول على الخلايا المتغصنة المشتقة من وحيدات
ملاحظة: من المهم الإشارة إلى أنه عندما يتم التلاعب بالدم المحيطي البشري ، ينبغي للمرء أن يفكر في احتياطات السلامة العالمية المحددة والتخلص المناسب من المواد. قبل البدء ، تأكد من أن جميع الكواشف والمواد اللازمة جاهزة وجاهزة للاستخدام.
- عزل خلايا الدم أحادية النواة المحيطية
- الوصول إلى معطف بافي البشري.
ملاحظة: معطف بافي هو منتج ثانوي مشتق من الدم الذي تم جمعه عن طريق فصادة الكريات البيض32 ، والذي يتم تخصيبه في خلايا الدم البيضاء من خلال الطرد المركزي. تم تنفيذ جميع الخطوات في خزانة السلامة البيولوجية لغرفة التدفق الرأسي (BSC). - افتح عبوة معطف بافي عن طريق قطع أنبوب المخرج المختوم بمشرط ، ونقل المحتويات إلى أنبوب سعة 50 مل. انقل 7 مل من عينة معطف بافي لكل أنبوب مخروطي معقم سعة 15 مل ، وأضف 6 مل من محلول ملحي مخزن بالفوسفات (PBS) لإجراء غسيل أولي. تعد خطوة الغسيل الأولية هذه ضرورية لتنظيف العينة من كمية كبيرة من خلايا الدم الحمراء (RBC) والبلازما بحيث يتم تحسين العينة لفصل التدرج باستخدام وسط تدرج الكثافة (انظر جدول المواد).
- جهاز طرد مركزي الأنبوب في درجة حرارة الغرفة لمدة 10 دقائق عند 1100 × جم في جهاز طرد مركزي مع دوار متأرجح مع إيقاف تشغيل الفرامل (انظر جدول المواد).
- بعد الطرد المركزي ، اجمع تعليق الكريات البيض (الحلقة البيضاء بين البلازما وكرات الدم الحمراء) باستخدام ماصة باستور ، وانقلها إلى أنبوب مخروطي معقم جديد سعة 15 مل.
- املأ تعليق الكريات البيض حتى 10 مل باستخدام برنامج تلفزيوني للمساعدة في خطوة الفصل التالية ، واخلطه عن طريق السحب برفق لأعلى ولأسفل.
- تحضير محلول وسط تدرج الكثافة (الكثافة: 1.077 جم / مل): ضع 3 مل من وسط تدرج الكثافة في أنبوب مخروطي معقم جديد سعة 15 مل ، واتركه دافئا إلى درجة حرارة الغرفة.
- أضف 5 مل من معلق الكريات البيض المخفف (من الخطوة 1.1.5) إلى الأنبوب المخروطي الذي يحتوي على وسط تدرج الكثافة (5: 3) لإجراء فصل تدرج الكثافة. أضف العينة ببطء ، قطرة قطرة ، باستخدام جدران الأنبوب لتجنب إزعاج وسط تدرج الكثافة.
- فصل التدرج: أجهزة الطرد المركزي التعليق المتوسط المتدرج الكثافة في درجة حرارة الغرفة لمدة 30 دقيقة عند 1100 × جم في جهاز طرد مركزي مع دوار متأرجح مع إيقاف تشغيل الفرامل.
- بعد الطرد المركزي ، قم بإزالة الأنابيب المخروطية بعناية من جهاز الطرد المركزي. بعد هذه الخطوة ، تظهر مجموعة من الطبقات المحددة جيدا ، بما في ذلك ما يلي ، بدءا من الأسفل: طبقة حمراء (كرات الدم الحمراء والخلايا المحببة) ، ووسط تدرج الكثافة ، وطبقة شاحبة رقيقة من خلايا الدم أحادية النواة المحيطية (PBMC) ، والبلازما.
- اجمع الطبقة الرقيقة من PBMCs باستخدام ماصة باستور ، وتجنب تناول وسط تدرج الكثافة أدناه أو الكثير من البلازما أعلاه. ضع عينة PBMC في أنبوب مخروطي جديد سعة 50 مل ، واملأها حتى 25 مل باستخدام PBS ، وامزج العينة عن طريق السحب برفق لأعلى ولأسفل.
- قم بطرد العينات في درجة حرارة الغرفة لمدة 10 دقائق عند 600 × جم (الفرامل العادية) لغسل الخلايا المتبقية والحطام ، والتخلص من المادة الطافية عن طريق قلب الأنبوب بعناية.
ملاحظة: إذا كان هناك الكثير من تلوث خلايا الدم الحمراء ، وهو أمر يمكن ملاحظته عندما لا يتم فصل حبيبات الخلية أو معطف بافي تماما أو يبدو محمرا ، فمن المستحسن تحلل كرات الدم الحمراء المتبقية. في هذه الحالة ، أضف 5 مل من محلول تحلل كرات الدم الحمراء (انظر جدول المواد) ، واخلطه جيدا ، واحتضنه لمدة 5 دقائق. املأ ما يصل إلى 40 مل باستخدام PBS ، وطرد مركزي للعينات في درجة حرارة الغرفة لمدة 10 دقائق عند 900 × جم (الفرامل العادية) ، وتخلص من المادة الطافية عن طريق قلب الأنبوب بعناية. - املأ العينة إلى 10 مل باستخدام برنامج تلفزيوني ، وخذ قسمة لحساب الخلايا. لإزالة الصفائح الدموية ، قم باستخدام جهاز الطرد المركزي في درجة حرارة الغرفة لمدة 5 دقائق عند 400 × جم (الفرامل العادية) ، وتخلص من المادة الطافية عن طريق قلب الأنبوب بعناية.
ملاحظة: في حالة وجود عدد كبير من الصفائح الدموية ، يتم استخدام أجهزة الطرد المركزي في درجة حرارة الغرفة لمدة 10 دقائق عند 200 × جم (الفرامل العادية) مرتين. يتم تحديد الصفائح الدموية عن طريق تصور العينة أثناء عد الخلايا.
- الوصول إلى معطف بافي البشري.
- عزل الوحيدات عن طريق الفصل المناعي المغناطيسي
- تحضير المخزن المؤقت للميكروبيدات عن طريق استكمال برنامج تلفزيوني مع 0.5٪ ألبومين مصل البقر (BSA) و 2 mM حمض الإيثيلين ديامينيترايتيك (EDTA). تعقيم المحلول عن طريق الترشيح (0.2 ميكرومتر) ، والحفاظ على المخزن المؤقت في الثلاجة (2-8 درجة مئوية).
- قم بإجراء عزل وحيد الخلية CD14 + عن طريق فرز الخلايا المنشط مغناطيسيا (MACS).
- بعد عد الخلايا باستخدام عداد الخلايا الآلي (الخطوة 1.4.1) ، احسب الحجم المناسب للمخزن المؤقت للميكروبيدات والخرز المغناطيسي المناعي CD14 (انظر جدول المواد) المطلوب. تأكد من الاحتفاظ بهذه الحلول على الجليد. أضف 80 ميكرولتر من المخزن المؤقت للميكروبيدات لكل 1 × 10 7 خلايا و 20 ميكرولتر من حبات CD14 لكل 1 × 107 خلايا.
- أعد تعليق حبيبات الخلية بالأحجام المحددة مسبقا ، واحتضانها لمدة 15 دقيقة عند 4 درجات مئوية (2-8 درجة مئوية).
ملاحظة: في حالة الحاجة إلى التحقق من مستويات الخلايا الوحيدة في عينات PBMC ، قم بإجراء تحليل قياس خلوي للتدفق باستخدام الأجسام المضادة للتلطيخ (على سبيل المثال ، CD14 [Monoclonal TÜK4]). اتبع الخطوة 3.2 للحصول على تفاصيل حول تحليل قياس التدفق الخلوي. - أضف 1-2 مل من المخزن المؤقت للميكروبيدات لكل 1 × 107 خلايا ، وأجهزة الطرد المركزي في درجة حرارة الغرفة لمدة 10 دقائق عند 600 × جم (الفرامل العادية) لإزالة الخرز غير المرتبط ، وتخلص من المادة الطافية عن طريق قلب الأنبوب بعناية.
- قم بإعداد عمود LS. تحتوي أعمدة LS على كرات مغناطيسية حديدية تسمح ، عند وضعها على مغناطيس ، بالاحتفاظ الإيجابي واللطيف بالخلايا ذات العلامات المغناطيسية33. قبل الاستخدام مباشرة ، ضع عمود LS (انظر جدول المواد) على المغناطيس ، واشطفه ب 3 مل من المخزن المؤقت للميكروبيدات دون تجفيف كامل ، وانتقل فورا إلى الخطوة التالية.
ملاحظة: لا تدع العمود يجف أبدا أثناء الإجراء لتجنب المساس بالمحصول. - أعد تعليق حبيبات الخلية في 500 ميكرولتر من المخزن المؤقت للميكروبيدات لكل 1 × 108 خلايا. إذا كان رقم الخلية أعلى من 4 × 108 ، فاستخدم مصفاة خلية 40 ميكرومتر لمنع تجميع الخلايا.
- أضف تعليق الخلية إلى مدخل العمود ، ضع أنبوبا مخروطيا سعة 15 مل أسفل مخرج العمود لجمع جزء الخلية السالبة ، واغسل العمود ثلاث مرات باستخدام 3 مل من المخزن المؤقت للميكروبيدات. يتكون الجزء السالب من الخلايا التي لم يتم جمعها مع حبات CD14 (أي خلايا CD14− ).
- بعد الغسيل النهائي ، قم بإزالة العمود من المغناطيس ، وضعه على أنبوب مخروطي معقم سعة 15 مل ، ماصة 5 مل من الميكروبيدات العازلة في مدخل العمود ، وأدخل مكبس المحقنة على الفور في مدخل العمود وادفعه لتوزيع الخلايا المستهدفة.
- اجمع الخلايا ذات العلامات المغناطيسية (خلايا CD14 + ) ، وخذ قسمة لحساب الخلايا ، كما هو موضح في الخطوة 1.4.1.
- أجهزة الطرد المركزي على حد سواء كسور الخلية ، خلايا CD14− و CD14 + ، في درجة حرارة الغرفة لمدة 10 دقائق عند 600 × جم (الفرامل العادية). تخلص من المادة الطافية ، واحتفظ بجزء CD14 + للخطوات التالية ، وقم بتخزين جزء CD14− للمقايسات المستقبلية ، مثل مقايسات الثقافة المشتركة ، إذا لزم الأمر. إذا لزم الأمر ، يمكن حفظ الخلايا من جزء CD14− بالتبريد في RPMI-1640 20٪ FBS و 10٪ DMSO عند -80 درجة مئوية.
- تمايز الوحيدات إلى خلايا متغصنة
- قم بإعداد وسط RPMI-1640 الكامل عن طريق استكمال الوسط الأساسي RPMI-1640 (يحتوي على 11.1 مللي مول من الجلوكوز) مع مصل بقري جنيني 10٪ (FBS) ، و 1٪ من 2 mM من L-glutamine ، و 1٪ أحماض أمينية غير أساسية (NEAA) ، و 1٪ بيروفات الصوديوم ، و 1٪ من 100 ميكروغرام / مل من البنسلين / الستربتومايسين (انظر جدول المواد).
- إجراء تمايز وحيدات في mo-DCs ، والذي يحدث على مدى ~ 5-6 أيام.
- احسب حجم الوسط اللازم لعدد خلايا CD14 + التي تم الحصول عليها ، وقم بلوحة الخلايا وفقا لإعداد التجربة التالي.
ملاحظة: في هذا البروتوكول ، تم طلاء الخلايا بتركيز 1.3 × 106 خلايا / مل لمراعاة موت الخلايا وأخطاء القياس ، وتم تحضير الوسط بإضافة 1000 وحدة / مل من GM-CSF و 750 وحدة / مل من IL-4 (انظر جدول المواد) في وسط كامل وخلطه جيدا. - أضف الحجم المناسب من الوسيط إلى خلايا CD14 + ، وأعد التعليق عن طريق السحب لأعلى ولأسفل باستخدام ماصة باستور. صفيحة معلق الخلية في 24 لوحة بئر (لكل بئر: 1.3 × 106 خلايا / مل) ، واحتضانها في حاضنة استزراع عند 37 درجة مئوية مع 5٪ CO2.
- قم بتغيير وسط الاستزراع ، واستكمله بالسيتوكينات الطازجة كل 2-3 أيام (عادة مرة واحدة لكل عملية تمايز). للقيام بذلك ، قم بإزالة نصف وسط الثقافة بعناية دون إزعاج الخلايا. أضف نفس الكمية من الوسط الطازج مع التركيز المناسب من السيتوكينات ، كما هو موضح سابقا في ملاحظة الخطوة 1.3.2.1 ، واحتضان فترة التمايز المتبقية.
ملاحظة: DCs ، عند التمايز عن الخلايا الوحيدة ، هي خلايا ملتصقة بشكل فضفاض. خلايا mo-DCs غير الناضجة المتمايزة تماما هي خلايا على شكل مغزل ، وحرة الطفو ، وخلايا ملتصقة بشكل فضفاض. قد تشكل الخلايا أيضا وريدات ، خاصة عندما تنضج34. - لجمع الخلايا بعد التمايز ، استخدم ماصة صغيرة لنقل تعليق الخلية بالكامل إلى أنبوب مخروطي معقم ، واغسل آبار اللوحة مرتين باستخدام PBS ، مع النقر برفق على الجزء السفلي (الشكل 1 أ).
ملاحظة: تجنب جمع الخلايا شديدة الالتصاق ، لأنها على الأرجح بلاعم. لتجنب نضوج الخلايا أو تنشيطها بشكل غير صحيح ، تأكد من التعامل مع الخلايا بعناية فائقة. - قم بطرد الخلايا في درجة حرارة الغرفة لمدة 10 دقائق عند 180 × جم (الفرامل العادية) لإزالة أي بقايا أو خلايا ميتة ، وإعادة التعليق في الوسط / المخزن المؤقت المناسب للإعداد التجريبي.
- احسب حجم الوسط اللازم لعدد خلايا CD14 + التي تم الحصول عليها ، وقم بلوحة الخلايا وفقا لإعداد التجربة التالي.
- أداء نضوج mo-DCs.
- في حالة الحاجة إلى نضوج mo-DCs ، استخدم صفيحة أو قارورة بئر ، مع الأخذ في الاعتبار مثال تركيز الخلية الذي تم استخدامه سابقا (1.3 × 10 6 خلايا / مل) ، وقم بإدارة كوكتيل السيتوكين عن طريق استكمال الوسط بكوكتيل سيتوكين يتكون من IL-1β (10 نانوغرام / مل) ،IL-6 (1000 وحدة / مل) ، البروستاجلاندين E2 (PGE2 ؛ 1 ميكروغرام / مل) ، وعامل نخر الورم α (TNF-α ؛ 10 نانوغرام / مل) (انظر جدول المواد). احتضان الخلايا عند 37 درجة مئوية مع 5٪ CO2 لمدة 24 ساعة أو 48 ساعة.
- عد الخلايا وصلاحيتها
- أداء عد الخلايا وتلطيخ التريبان الأزرق.
- لتحديد عدد الخلايا وصلاحية تعليق الخلية ، خذ حصة 10 ميكرولتر من تعليق الخلية ، واخلطها مع 10 ميكرولتر من تريبان الأزرق (تخفيف 1: 1).
- خذ 10 ميكرولتر من المزيج السابق ، واستخدم عداد الخلايا الآلي لحساب عدد الخلايا وفقا لتعليمات الشركة المصنعة.
ملاحظة: إذا كان تركيز الخلايا مرتفعا جدا ، فقم بتخفيف القسمة ، وبعد عد الخلايا ، ضع في اعتبارك عامل التخفيف في الحسابات. - اضبط رقم الخلية والوسيط / المخزن المؤقت للإعداد التجريبي.
- تحديد صلاحية الخلية وموت الخلايا المبرمج30.
ملاحظة: في هذا العمل ، بعد معالجة sialidase (القسم 2) ، تم إجراء اختبار الجدوى.- قم بتلطيخ mo-DCs ب 5 ميكروغرام / مل 7-أمينوأكتينومايسين D (7-AAD) والملحق الخامس ، وحدد موت الخلايا المبرمج وفقا لتعليمات الشركة الصانعة (انظر جدول المواد).
- تحليل النتائج باستخدام قياس التدفق الخلوي29,30.
- أداء عد الخلايا وتلطيخ التريبان الأزرق.
2. علاج الخلايا مع سياليداز
ملاحظة: بعد التمايز إلى mo-DCs ، في اليوم السادس ، تكون الخلايا جاهزة لمقايسة علاج sialidase.
- بالنظر إلى الإعداد التجريبي المطلوب ، اجمع ~ 10 × 10 6 mo-DCs من 10 آبار من ألواح 24 بئرا مع 1.3 × 106 خلايا / بئر ، وانقلها إلى أنبوب مخروطي معقم جديد سعة 15 مل.
ملاحظة: افترض بعض فقدان الخلايا; عادة ، في هذه المرحلة ، يكون التركيز الموجود هو 1.3 × 106 خلايا / مل لأن mo-DCs وسلائفها لا تتكاثر وتعاني من فقدان الصلاحية بنسبة 20٪ أثناء التمايز إلى mo-DCs. - جهاز طرد مركزي في درجة حرارة الغرفة لمدة 5-7 دقائق عند 300 × جم (فرامل عادية) ، وتخلص من المادة الطافية لإزالة الخلايا الميتة والحطام.
- أضف 10 مل من متوسط RPMI-1640 (يحتوي على 11.1 مللي متر من الجلوكوز) ، وأجهزة الطرد المركزي في درجة حرارة الغرفة لمدة 4 دقائق عند 300 × جم (الفرامل العادية) ، وتخلص من المادة الطافية ، وأضف 2 مل من RPMI-1640 ، واخلطها جيدا.
- ضع 1 مل من الخلايا في RPMI-1640 في أنابيب دقيقة معقمة جديدة ، # 1 و # 2 ؛ سيحتوي كل أنبوب دقيق على ما يقرب من 5 × 106 خلايا.
- إلى microtube # 1 ، أضف 500 mU من sialidase من Clostridium perfringens (انظر جدول المواد). إلى microtube # 2 ، أضف sialidase المعالج بوهمية ، وهو عنصر تحكم سلبي ، لتأكيد ما إذا كانت التأثيرات التي لوحظت مرتبطة مباشرة بإزالة حمض السياليك وليست بسبب القطع الأثرية. السياليداز المعالج بالوهمية هو سياليداز معطل بالحرارة ، والذي يتم الحصول عليه عن طريق غلي الإنزيم لمدة 20 دقيقة عند 100 درجة مئوية.
- احتضان لمدة 60 دقيقة عند 37 درجة مئوية.
- بعد الحضانة ، ضع الخلايا في أنابيب مخروطية معقمة جديدة سعة 15 مل بنفس الترقيم ، # 1 و # 2. أضف حوالي 4 مل من وسط RPMI-1640 الكامل (يحتوي على 10٪ FBS) إلى كلا الأنبوبين لإيقاف التفاعل الأنزيمي.
- أجهزة الطرد المركزي في درجة حرارة الغرفة لمدة 4 دقائق عند 300 × جم (الفرامل العادية) ، وتخلص من المادة الطافية.
- أضف 5 مل من وسط RPMI-1640 الكامل لكل أنبوب ، ولوحة 1 مل من الخلايا لكل بئر.
3. تحديد الملف الشخصي حمض السياليك
- تلطيخ الليكتين
- جمع وغسل الخلايا في درجة حرارة الغرفة لمدة 5 دقائق عند 300 × غرام (الفرامل العادية).
- أعد تعليق الخلايا في RPMI-1640 + 10٪ FBS ، وقم بتوزيع الخلايا (100000/100 ميكرولتر) في الأنابيب الدقيقة.
- إجراء تلطيخ لقياس التدفق الخلوي في RPMI-1640 مع 10٪ FBS باستخدام تركيز 0.01 مجم / مل لكل ليكتين: Sambucus nigra (SNA) lectin ، و peanut agglutinin (PNA) lectin ، و Maackia amurensis (MAA) lectin (انظر جدول المواد). احتضان لمدة 30 دقيقة عند 4 درجات مئوية.
- اغسل الخلايا ب 1 مل من PBS تحتوي على 10٪ FBS أو 10٪ BSA ، وأجهزة الطرد المركزي في درجة حرارة الغرفة لمدة 4 دقائق عند 300 × جم (الفرامل العادية).
- إلى الخلايا الملطخة بالمحاضرات البيوتينيلاتيد ، أضف 0.0005 مجم / مل ستربتافيدين PE (انظر جدول المواد) ، واحتضنها لمدة 15 دقيقة في درجة حرارة الغرفة في الظلام. اغسل الخلايا ب 1 مل من PBS ، وأجهزة الطرد المركزي في درجة حرارة الغرفة لمدة 4 دقائق عند 300 × جم (الفرامل العادية).
- تخلص من المادة الطافية ، وأضف إلى كل أنبوب 300 ميكرولتر من 2٪ بارافورمالدهيد (PFA 2٪). قم بحماية الأنابيب من الضوء ، وإذا لزم الأمر ، قم بتخزينها في درجة حرارة 4 درجات مئوية حتى الحصول على البيانات.
- الحصول على البيانات باستخدام مقياس التدفق الخلوي في غضون 1 أسبوع من إعداد العينة29,30.
- قياس التدفق الخلوي
- أعد تعليق الخلايا في 1 مل من PBS ، واحصل على العينة باستخدام مقياس التدفق الخلوي للحصول على البيانات على الفور.
- للحصول على البيانات المتأخرة ، أعد التعليق في 300 ميكرولتر من 2٪ PFA ، واحصل على البيانات في غضون أسبوع واحد.
- مجهر المسح الضوئي بالليزر متحد البؤر
- قم بطلاء الخلايا على أغطية زجاجية مطلية بالبولي ليسين بقطر 12 مم ، واحتضانها لمدة 5 دقائق في درجة حرارة الغرفة.
- أجهزة الطرد المركزي أغطية في درجة حرارة الغرفة لمدة 1 دقيقة عند 100 × جم (الفرامل العادية) لتعزيز التصاق الخلايا.
- ثبت في درجة حرارة الغرفة لمدة 30 دقيقة مع 4٪ PFA قبل الغسيل مع 1٪ BSA في PBS.
- استخدم ليكتين SNA المترافق FITC (0.01 مجم / مل) لتلطيخ أحماض السياليك المرتبطة ب α2،6 على أسطح الخلايا (انظر جدول المواد).
- الحصول على الصور على المجهر متحد البؤر (انظر جدول المواد).
- بعد معالجة Z-stack ، حدد صور المقطع العرضي التمثيلية متحدة البؤر.
- قم بتحليل كثافة التلوين باستخدام مضان الخلية الكلي المصحح (CTCF).
ملاحظة: CTCF = الكثافة المتكاملة - (مساحة الخلية المحددة × متوسط مضان قراءات الخلفية)29.
4. التنميط النضوج للمو-البلدان النامية
- تلطيخ الأجسام المضادة وقياس التدفق الخلوي
- اجمع عينة جديدة من الخلايا محل الاهتمام لإجراء تلطيخ الأجسام المضادة. اغسل الخلايا في درجة حرارة الغرفة لمدة 5 دقائق عند 300 × جم (الفرامل العادية) ، ووزع الخلايا في الأنابيب الدقيقة (100000 خلية لكل أنبوب).
- قم بإجراء تلطيخ لقياس التدفق الخلوي باستخدام الأجسام المضادة المطلوبة (ab) و MHI-I و MHC-II و CD80 و CD86 (انظر جدول المواد).
- احتضان أب مترافق مضان لمدة 15 دقيقة في درجة حرارة الغرفة في الظلام.
- اغسل الخلايا ب 1 مل PBS ، وأجهزة الطرد المركزي في درجة حرارة الغرفة لمدة 5 دقائق عند 300 × جم (الفرامل العادية).
ملاحظة: في حالة استخدام ab، أضف أب ثانوي مترافق بالفلورسنت، واحتضنه في الظلام لمدة 15 دقيقة وفقا لتعليمات الشركة المصنعة. اغسل الخلايا ب 1 مل من PBS ، وأجهزة الطرد المركزي في درجة حرارة الغرفة لمدة 5 دقائق عند 300 × جم (الفرامل العادية). - إلى جميع الأنابيب الدقيقة ، أضف ما يصل إلى 100 ميكرولتر من PBS ، وأعد تعليق الخلايا في 300 ميكرولتر من 2٪ بارافورمالدهيد (PFA 2٪) ، واحتفظ بالأنابيب في الظلام عند 4 درجات مئوية حتى الحصول على البيانات.
- الحصول على البيانات باستخدام مقياس التدفق الخلوي.
ملاحظة: بعد تلطيخ وتثبيت، يمكن الحصول على العينات عن طريق قياس التدفق الخلوي على الفور أو في غضون فترة 1 أسبوع. في هذه الحالة ، قم بتخزين الأنابيب في درجة حرارة 4 درجات مئوية في الظلام.
5. مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA)
ملاحظة: في هذا العمل ، تم قياس إنتاج IFN-γ باستخدام اختبار ELISA باتباع تعليمات الشركة المصنعة (انظر جدول المواد).
- لطلاء اللوحة في مخزن مؤقت للطلاء ، قم بتخفيف الجسم المضاد للالتقاط (1: 100 ، التقاط الجسم المضاد في PBS) ، ونقل 100 ميكرولتر من محلول العمل هذا إلى كل بئر ، واحتضانه طوال الليل في درجة حرارة الغرفة.
- تخلص من الجسم المضاد الملتقط تماما.
- أضف المخزن المؤقت للحظر (على سبيل المثال ، PBS + 2٪ BSA + 0.05٪ Tween20) ، واحتضن لمدة 1 ساعة في درجة حرارة الغرفة قبل إزالة المخزن المؤقت للحظر.
- أضف المعيار والعينة ، مع المزيج والتخفيفات ذات الصلة ، واحتضانها لمدة 2 ساعة في درجة حرارة الغرفة. يغسل خمس مرات مع العازلة الغسيل.
- أضف الجسم المضاد لكاشف البيوتينيلات ، واحتضن لمدة 2 ساعة في درجة حرارة الغرفة ، متبوعا بخمس غسلات.
- يضاف بولي-HRP-streptavidin-HS ، ويحتضن لمدة 30 دقيقة في درجة حرارة الغرفة ، تليها خمس غسلات مع عازلة للغسيل.
- أضف ركيزة TMB (انظر جدول المواد) ، واحتضانها لمدة تصل إلى 60 دقيقة في درجة حرارة الغرفة ، مع مراعاة نظام الاختبار المستخدم. يغسل خمس مرات مع العازلة الغسيل.
- اقرأ العينات على قارئ الصفائح الدقيقة عند 450 نانومتر.
النتائج
عزل الوحيدات وتمايز الوحيدات إلى mo-DCs
وفقا للبروتوكول ، تم عزل PBMCs البشرية من معطف بافي باستخدام فصل تدرج الكثافة مع وسط تدرج الكثافة وغسلها جيدا. تم استخدام Trypan blue لإجراء عد الخلايا القابلة للحياة في يوم العزل ، كما هو موضح سابقا في الخطوة 1.4.1. بعد ذلك ، تم إجراء عزل وحيدات CD14 + من خلال الاختيار الإيجابي. لتحقيق ذلك ، تم تحضين PBMCs بخرز مغناطيسي يحتوي على جسم مضاد يتعرف على مستضد CD14. تم استزراع الخلايا الوحيدة CD14 + المختارة في وسط مكمل ب GM-CSF و IL-4 لمدة 5-6 أيام27 للتمايز إلى mo-DCs غير ناضجة (الشكل 1 أ). يمكن الحصول على نضوج mo-DCs من خلال تطبيق مزيج من السيتوكينات ، بما في ذلك IL-6 و IL-1β و TNF-α و PGE235 (الشكل 1 أ).
أثناء عملية التمايز ، نتيجة لتحفيز IL-4 و GMCSF ، من المتوقع أن يتغير النمط الظاهري للخلية. تظهر البيانات أن mo-DCs تفقد التعبير عن علامة السطح CD14 ، والتي يتم التعبير عنها بشكل أساسي بواسطة الخلايا الوحيدة (الشكل 1B) ، وتكتسب تعبيرا كبيرا عن CD1a ، وهي علامة تعبر عنها DCs البشرية36,37. تحصل mo-DCs أيضا على تعبير MHC-II (HLA-DR) أعلى ، وهو جزيء مقدم للمستضد يعبر عنه DCs البشرية والخلايا الأخرى المقدمة للمستضد38 (الشكل 1B).
محتوى حمض السياليك سطح الخلية
يقلل علاج mo-DCs مع sialidase من محتوى حمض السياليك على سطح mo-DCs ، والذي يمكن تأكيده عن طريق تلطيخ المحاضرات ، وهي بروتينات قادرة على الارتباط بالكربوهيدرات39. نظرا لأن الإنزيم المستخدم يزيل كلا من أحماض السياليك المرتبطة ب α2,3 و α2,6 من سطح الخلية ، فقد تم تلطيخ mo-DCs ب PNA ، الذي يتعرف على مستضد T Galβ1-3GalNAcα1-Ser / Thr ، بالإضافة إلى محاضرات MAA و SNA ، والتي ترتبط ب α2,3- و α2,6-sialic ، على التوالي. تم تقييم فعالية علاج سياليداز عن طريق قياس التدفق الخلوي والفحص المجهري متحد البؤر (الشكل 2). كما هو موضح في الشكل 2 أ ، قلل علاج السياليداز بشكل كبير من ارتباط MAA و SNA مع زيادة تلطيخ PNA. تم تأكيد الانخفاض في تلطيخ SNA بعد علاج sialidase من خلال التحليل المجهري متحد البؤر الذي أظهر انخفاضا كبيرا في تلطيخ SNA على سطح الخلية (الشكل 2B).
التوصيف الوظيفي ل mo-DCs المعالجة بالسياليداز
لتقييم كيفية تأثير علاج سياليداز على وظائف mo-DC ، تم تقييم مستوى نضج mo-DCs بعد علاج sialidase. كما هو موضح في الشكل 3 أ ، تؤدي معاملة sialidase إلى زيادة كبيرة في التعبير عن جزيئات تقديم مولد الضد MHC I و MHC II والتعبير عن جزيئات التحفيز المشترك CD80 و CD86. لتقييم تأثير إزالة حمض السياليك على قدرة mo-DCs على تحفيز استجابات الخلايا التائية ، تم استخدام mo-DCs المعالجة بالسياليداز المحملة بمحللات الخلايا السرطانية لتحضير الخلايا التائية الذاتية (الشكل 3). بعد ذلك ، تم تمييز ملف تعريف الخلايا التائية الناتجة بناء على قدرتها على إفراز السيتوكين Th1 IFN-γ. كما هو موضح في الشكل 3 ب ، عند مقارنتها بالخلايا التائية المحضرة بواسطة mo-DCs الملتهبة بالكامل ، فإن الخلايا التائية المحضرة بواسطة mo-DCs المعالجة بالسياليداز تفرز مستويات أعلى بكثير من IFN-γ. تشير هذه النتائج إلى أن mo-DCs المعالجة بالسياليداز قد حسنت قدرتها على الخلايا التائية الذاتية.
صلاحية الخلية
بعد علاج سياليداز ، تم إجراء فحص الجدوى للتأكد من أن العلاج لم يكن ساما للخلايا للخلايا. بعد العلاج ، تم تلطيخ mo-DCs ب 7-AAD و Annexin V ، للكشف عن الخلايا غير القابلة للحياة وموت الخلايا المبرمج ، وتحليلها بواسطة قياس التدفق الخلوي (الشكل 4). لا تظهر البيانات أي فرق كبير في صلاحية الخلية بين الخلايا غير المعالجة (الشكل 4 ، اللوحة اليسرى) والخلايا المعالجة بالسياليداز (الشكل 4 ، اللوحة اليمنى).
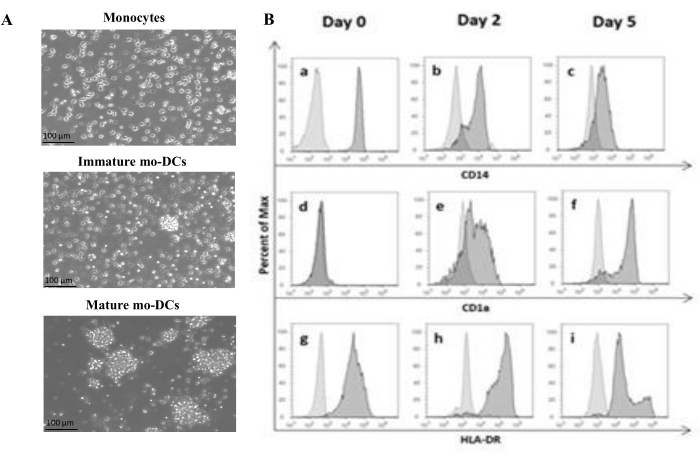
الشكل 1: تمايز الخلايا الوحيدة المعزولة إلى mo-DCs. (أ) تم عزل وحيدات CD14 + من المعاطف المنتفخة واستزراعها بتركيز 1.3 × 106 خلايا / مل عند 37 درجة مئوية. تم تمييز الخلايا الوحيدة في وسط مكمل ب 750 وحدة / مل من IL-4 و 1000 وحدة / مل من GM-CSF. التحليل المجهري لمورفولوجيا الخلايا الوحيدة المعزولة من معطف بافي البشري في اليوم 0 (الصورة العلوية). مو-دي سي غير ناضجة؛ تم تمييز الخلايا خلال فترة 5 أيام باستخدام IL-4 و GM-CSF (الصورة الوسطى). تم الحصول على mo-DCs الناضجة باستخدام السيتوكينات IL-6 و IL-1β و TNF-α و PGE2 لمدة 24 ساعة (الصورة السفلية). قضبان المقياس: 100 ميكرومتر. (ب) تم تحليل الخلايا في اليوم 0 واليوم 2 واليوم 5 طوال فترة التمايز باستخدام قياس التدفق الخلوي. تم استخدام الأجسام المضادة التالية لتوصيف علامات سطح الخلية: (أ-ج) CD14; (د-و) CD1a و (g-i) HLA-DR (MHC الفئة II). يوضح الشكل الرسوم البيانية التمثيلية لثلاثة مقايسات مستقلة على الأقل. تم تعديل اللوحة (B) من Videira et al.40 ، براءة اختراع WO2017002045A1. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
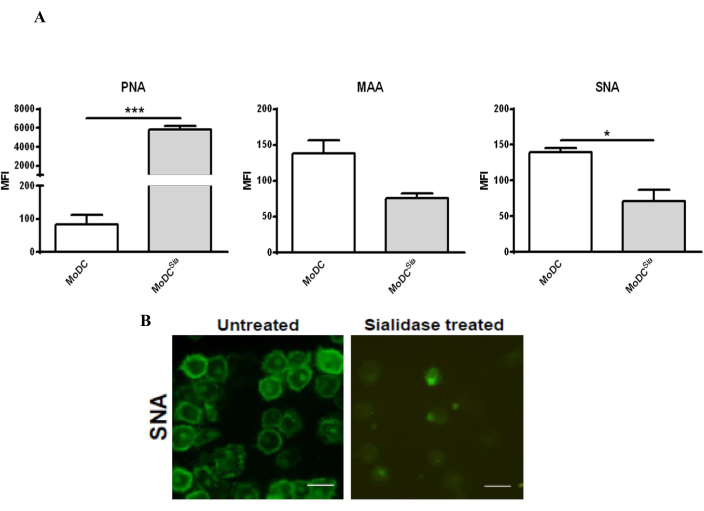
الشكل 2: معالجة سياليداز ل mo-DCs البشرية لإزالة أحماض السياليك المرتبطة ب α2،6 و α2،3 من سطح الخلية . (أ) تحليل mo-DCs عن طريق قياس التدفق الخلوي باستخدام تلطيخ الليكتين لاختبار فعالية علاج السياليداز. عولجت مو-DCs البشرية بالسياليداز (الأشرطة الرمادية) أو تركت دون معالجة (أشرطة بيضاء) وصبغت ب SNA lectin (التعرف على [2،6] - أحماض السياليك) ، و MAA lectin (التعرف على [2،3] - أحماض السياليك) ، و PNA lectin (التعرف على مستضد T - Galβ1-3GalNAcα1-Ser / Thr). تمثل القيم متوسط شدة التألق (MFI) لثلاثة مقايسات مستقلة على الأقل. تم تحديد الدلالة الإحصائية باستخدام اختبار t المزدوج ثنائي الطرف (* P < 0.05 أو ** P < 0.0001) ، في إشارة إلى الفرق بين DCs غير المعالجة والمعالجة بالسياليداز. قلل علاج سياليداز من ارتباط MAA وزيادة تلطيخ PNA في البلدان النامية النشطة البشرية ، الناتجة عن إزالة أحماض السياليك المرتبطة ب α (2،3) ؛ تم الكشف عن إزالة أحماض السياليك المرتبطة ب α (2،6) بعد معالجة السياليداز من خلال انخفاض في تلطيخ SNA. (ب) الفحص المجهري متحد البؤر ل mo-DCs المعالجة بالسياليداز والمحضرة على أغطية للمراقبة. تم جمع مجموعة من صور z-stack من خلايا مختلفة ومعالجتها لتشمل متوسط شدة التلطيخ. قضبان المقياس: 20 ميكرومتر. () عدلت اللوحة (ألف) من قضية سيلفا وآخرين (Silva et al.30)؛ تم تعديل اللوحة (B) من Silva et al.29. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
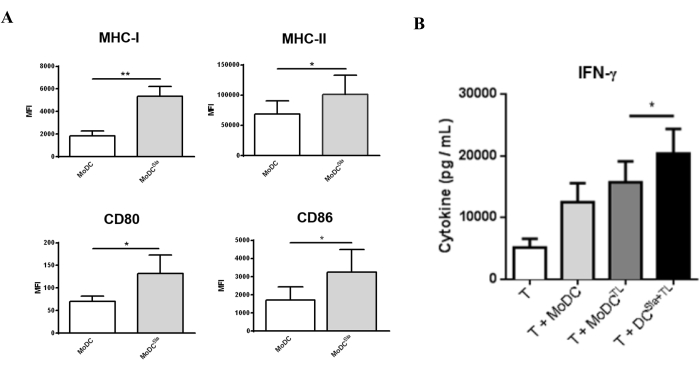
الشكل 3: معالجة سياليداز ل mo-DCs التي تحفز تعبيرا أعلى عن علامات النضج. (أ) أظهرت مو-DCs المعالجة بالسياليداز نمطا ظاهريا أعلى نضجا من مو-DCs المشعوذة بالكامل. تم استخدام قياس التدفق الخلوي لتقييم التعبير عن العديد من علامات النضج. وعولجت مو-DCs بالسياليداز لمدة 1 ساعة عند 37 درجة مئوية؛ تمثل قيم الرسم البياني متوسط شدة التألق (MFI) (متوسط ± SEM) لثلاثة مقايسات مستقلة على الأقل. تم حساب الفروق ذات الدلالة الإحصائية باستخدام اختبار t (* P < 0.05 ، ** P < 0.01) ، في إشارة إلى الفرق بين الحالات غير المعالجة والمعالجة بالسياليداز. (ب) تحفز الخلايا الجذعية البشرية المحملة بمولدات ضد الورم الكاملة استجابات محددة للخلايا التائية. تمت معالجة mo-DCs بالسياليداز لمدة 1 ساعة عند 37 درجة مئوية أو تركت دون علاج ، تليها التحميل مع MCF-7 lysates (TL) كمصدر لمستضدات الخلايا السرطانية الكاملة. تم إجراء الاستزراع المشترك بين mo-DCs والخلايا التائية الذاتية لمدة 4-8 أيام في وجود IL-2 (10 U / mL). أظهرت الخلايا التائية المحضرة ب mo-DCs المنزوعة الإفراز بشكل ملحوظ للسيتوكين Th1 ، IFN-γ. بعد تحفيز الخلايا التائية باستخدام mo-DCs ، تم قياس السيتوكينات التي تم إفرازها في المواد الطافية للثقافة المشتركة بواسطة ELISA (n = 7). تمثل قيم الرسم البياني التركيز (pg / mL) (متوسط ± SEM). تم حساب الفروق ذات الدلالة الإحصائية باستخدام اختبار t (* P < 0.05). تم تعديل الرقم من Silva et al.30. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
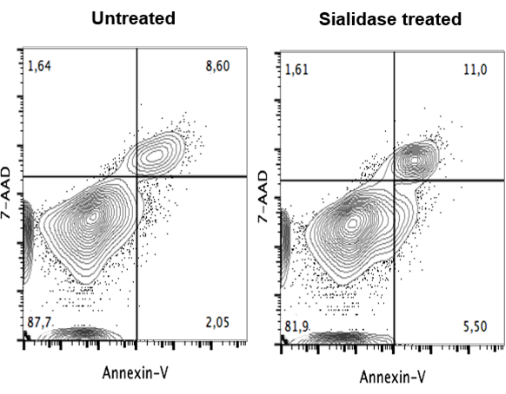
الشكل 4: عدم وجود تأثير لمعاملة السياليداز على صلاحية البلدان النامية المو-البشرية تعرضت mo-DCs غير المعالجة (اللوحة اليسرى) و mo-DCs المعالجة بالسياليداز (اللوحة اليمنى) لتلطيخ مزدوج مع الملحق V و 7-AAD ، وتم تحليل التلوين بواسطة قياس التدفق الخلوي. أظهرت البيانات عدم وجود فرق كبير في صلاحية الخلية بين الخلايا غير المعالجة والخلايا المعالجة بالسياليداز ، مما يشير إلى أن mo-DCs يمكن أن تتسامح مع علاج sialidase وتظل قابلة للحياة لممارسة وظيفتها المناعية. تم تعديل الرقم من Silva et al.30. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
عزل الوحيدات
تصف هذه المخطوطة بروتوكولا لتوليد mo-DCs من الخلايا الوحيدة المعزولة بشريا CD14 + (الشكل 1 أ) ، متبوعا بإجراء علاج سياليداز لتقليل محتوى حمض السياليك على سطح هذه الخلايا.
هناك طرق مختلفة للحصول على DCs البشرية ، مثل مباشرة من الدم أو الأنسجة المحيطية أو من خلال التمايز عن السلائف مثل الخلايا الجذعية أو الخلايا الوحيدة. يعد الحصول على DCs المتمايزة عن الخلايا الوحيدة المعزولة من الدم المحيطي أكثر وضوحا نظرا لسهولة الحصول على كميات كبيرة من الخلايا الوحيدة مقارنة بمصادر DC الأخرى41. ومع ذلك ، للحصول على نسبة عالية من الخلايا الوحيدة المعزولة ، يجب اتباع جميع خطوات البروتوكول بعناية. على سبيل المثال ، قد يكون وسط تدرج الكثافة ساما للخلايا ، ولمنع موت الخلايا ، يجب على المرء تجنب ملامسة الخلية لفترات طويلة مع وسط تدرج الكثافة وغسل الخلايا جيدا. يجب أن يتم التلاعب بالخلايا في أسرع وقت ممكن لتجنب فقدان صلاحية الخلية. من PBMCs ، يمكن عزل الخلايا الوحيدة من خلال الاختيار الإيجابي باستخدام طريقة فرز الخلايا المنشطة مغناطيسيا (MACS) ، وهي تقنية مناسبة لإنتاج عدد كبير من الخلايا الوحيدة. بالإضافة إلى ذلك ، بالمقارنة مع طرق اختيار الخلايا الوحيدة الأخرى ، تمتلك mo-DCs المشتقة من الخلايا الوحيدة المعزولة بنظام MACS قدرة أكبر على تحفيز نشاط الخلايا التائية المضادة للورم42. في هذا البروتوكول ، بمجرد عزلها ، تم تحضين الخلايا الوحيدة باستخدام IL-4 و GM-CSF لمدة 5-6 أيام لتحقيق التمايز إلى mo-DCs غير ناضجة (الشكل 1). أظهرت النتائج أنه من الناحية الشكلية (الشكل 1 أ) والظاهري (الشكل 1 ب) ، تمايزت الخلايا الوحيدة المعزولة إلى مو-DCs غير ناضجة. علاوة على ذلك ، طوال فترة التمايز ، فقدت mo-DCs التعبير عن علامات CD14 واكتسبت تعبير CD1a و MHC-II (الشكل 1B) ، وهي مطلوبة لعرض المستضد على الخلايا التائية.
هذا العزل والتمايز بين الخلايا الوحيدة إلى mo-DCs هي قيود على هذا البروتوكول. عملية العزل هي خطوة حساسة يجب تنفيذها بعناية وسرعة لتجنب موت الخلايا ، ويجب أن تتم هذه الخطوة أيضا في كل مرة تكون فيها هناك حاجة إلى mo-DCs لتجربة جديدة. تستغرق عملية التمايز من 5 إلى 6 أيام مما يشكل صعوبة من حيث استخدام هذه الطريقة للتحليلات عالية الإنتاجية. ومع ذلك ، فإن طريقة العزل واستخدام السيتوكينات للتمييز بين mo-DCs مفيدة لتوليد عدد كبير من mo-DCs الوظيفية في المختبر لأغراض التجريب. إن mo-DCs المتولدة في هذا البروتوكول قادرة على الخضوع لعلاج sialidase ، وقياس التدفق الخلوي ، و ELISA ، والفحص المجهري متحد البؤر ، وما إلى ذلك ، مما يؤكد على أهمية وفائدة هذه الطريقة30.
مو-DCs غير الناضجة والعلاج سياليداز
Sialidases ضرورية في تنظيم sialylation وهي مسؤولة عن إزالة أحماض السياليك من جليكان سطح الخلية. في mo-DCs ، تؤدي إزالة حمض السياليك بواسطة السياليداز إلى نضوج هذه الخلايا ، مما يزيد من عرض المستضد المتقاطع وتنشيط الخلايا التائية اللاحقة والنشاط المضاد للورم30.
تعرض mo-DCs البشرية غير الناضجة نسبة عالية من أحماض السياليك المرتبطة بسطح الخلية α (2،6) و α (2،3)27 مقارنة ب mo-DCsالناضجة 31,43. علاوة على ذلك ، فإن إزالة أحماض السياليك عن طريق معالجة mo-DCs باستخدام sialidase يحسن نضوج DCs28،30،31. كان السياليداز المختار لهذه التجربة من بكتيريا كلوستريديوم بيرفرينجنز. ومع ذلك ، فإن الكائنات الحية الأخرى تنتج أيضا السياليداز ، مثل بكتيريا العقدية الرئوية ، ضمة الكوليرا ، أو السالمونيلا التيفية44 ، Macrobdella decora45 ، وحتى الإنسان العاقل46 ، كما تستخدم sialidases من هذه الكائنات بشكل تجريبي. ومع ذلك ، فإن كل سياليداز له خصائص ركيزة مختلفة. بالإضافة إلى ذلك ، يمكن أن يكون لاستخدام إنزيم سياليداز حدوده. على سبيل المثال ، يمكن أن يؤدي التلاعب ب mo-DCs أثناء العلاج إلى تحفيز هذه الخلايا. علاوة على ذلك ، يجب تحسين كمية السياليداز وأوقات الحضانة بناء على نوع الخلايا المستخدمة وتكوينها من حمض السياليك. إزالة حمض السياليك ليست تأثيرا دائما بل هي ظاهرة عابرة ، لأن الخلية ستستعيد محتوى حمض السياليك على سطح الخلية. إلى جانب السياليداز ، هناك طرق أخرى لتقليل جزيئات حمض السياليك على سطح الخلايا ، مثل استخدام مثبطات سياليل ترانسفيراز ، أو خروج المغلوب الجيني لجينات سياليل ترانسفيراز ، أو الحصار الأيضي لحمض السياليك باستخدام محاكيات حمض السياليك47،48،49. ومع ذلك ، قد تقدم هذه الطرق تأثيرات مميزة على الخلايا ، وإلى جانب إزالة الخلايا ، يجب مراعاة صلاحية الخلية. علاج إنزيم سياليداز هو طريقة عملية لإزالة أحماض السياليك على سطح الخلية بشكل فعال وعابر مع الحفاظ على صلاحية الخلية.
في هذا العمل ، تمت إضافة sialidase إلى mo-DCs غير الناضجة بتركيز 500 mU / 5 × 106 خلايا / مل ، وتم تحضين الخلايا عند 37 درجة مئوية لمدة 60 دقيقة. تم إجراء العلاج باستخدام RPMI-1640 بدون مصل للحفاظ على صلاحية الخلية وتجنب أي تفاعل بين جزيئات sialylated الموجودة في المصل30. يمكن إجراء علاج سياليداز باستخدام مخازن أخرى إلى جانب RPMI ، مثل 50 mM أسيتات الصوديوم ، أو درجة الحموضة 5.1 (في حالة C. perfingens sialidase) ، أو PBS50،51،52. ومع ذلك ، فإن RPMI-1640 هو وسيط الاستزراع الأكثر شيوعا ل DCs لأنه يحافظ على ظروف تجريبية ثابتة أثناء الإجراء ، ويتجنب إحداث النضج ، ويقلل من أي إجهاد قد يكون ناتجا عن مخازن sialidase أو PBS53،54،55،56. بعد الحضانة مع sialidase ، من الأهمية بمكان غسل الخلايا جيدا باستخدام وسيط مكمل بالمصل لضمان توقف تفاعل الإنزيم. سوف يتنافس وجود جزيئات سياليل في المصل كركائز للسياليداز ، مما يضمن توقف التفاعل السريع.
توصيف علامات السطح عن طريق قياس التدفق الخلوي والفحص المجهري متحد البؤر
لتحديد ملف حمض السياليك ، في قسم البروتوكول 3 ، استخدمنا تلطيخ الليكتين متبوعا بقياس التدفق الخلوي والفحص المجهري بالليزر متحد البؤر. بالنسبة لإجراء تلطيخ الخلايا ، في كلتا الحالتين ، تم تحسين تركيزات الليكتين وظروف الحضانة لتجنب تراص الخلايا وموتها. من الأهمية بمكان إجراء الحضانة عند 4 درجات مئوية في مخازن تحتوي على 2٪ على الأقل من FBS أو BSA لتجنب الارتباط غير المحدد للمحاضرات. في هذا البروتوكول ، تم استخدام RPMI-1640 الذي يحتوي على 10٪ FBS للحفاظ على ظروف تجريبية ثابتة وتجنب إجهاد الخلايا. فيما يتعلق بالفحص المجهري متحد البؤر ، يعد تثبيت الخلايا قبل التلوين أمرا ضروريا للحفاظ على التشكل ومنع التحلل الذاتي والحفاظ على المستضد.
أظهر تحليل النمط الظاهري mo-DC عن طريق قياس التدفق الخلوي أن mo-DCs المعالجة بالسياليداز تحتوي على كمية أعلى بكثير من محاضرات PNA المرتبطة بسطح الخلية مقارنة بمحاضرات MMA و SNA ، والتي انخفضت بعد معالجة السياليداز (الشكل 2 أ). كما هو متوقع ، زاد تلطيخ PNA ، حيث يتعرف PNA على المستضدات غير السياليل ، على عكس MAA و SNA ، والتي ترتبط مباشرة بأحماض α2،3- و α2،6-sialic ، على التوالي30. يؤكد هذا التلوين الإزالة الفعالة لأحماض السياليك من سطح الخلية باستخدام هذا البروتوكول. هناك طريقة أخرى يمكن استخدامها للتحقق من صحة العلاج وتحليل محتوى حمض السياليك على سطح الخلية وهي تلطيخ الليكتين متبوعا بالفحص المجهري متحد البؤر ، كما هو موضح في الشكل 2 ب.
إلى جانب الأمثلة السابقة ، توجد طرق بديلة لتقييم وتوصيف محتوى حمض السياليك ، مثل فحص الليكتين بواسطة النشاف الغربي. تتوفر أيضا محاضرات بديلة خاصة بحمض السياليك ، مثل Siglecs ، وهي مجموعة من المحاضرات التي لها تفضيل واضح لأنواع حمض السياليك والروابط57. إلى جانب استخدام المحاضرات في أي من التقنيتين (قياس التدفق الخلوي أو الفحص المجهري أو اللطخة الغربية) ، من الممكن أيضا توصيف محتوى حمض السياليك باستخدام الأجسام المضادة. على سبيل المثال ، يمكن تقييم أحماض α2،8-sialic بواسطة الأجسام المضادة مثل Clone 735 ، وهو خاص بحمض polysialic58. بالإضافة إلى ذلك ، بعد علاج sialidase ، يمكن اختبار الخلايا وظيفيا لكفاءتها البيولوجية أو العلاجية من خلال تقييم النمط الظاهري والقدرة على تنشيط الخلايا التائية40. في الواقع ، كما هو موضح في الأمثلة المقدمة ، أظهرت mo-DCs المعالجة بالسياليداز نمطا ظاهريا أعلى نضجا ، بالإضافة إلى تعبير مرتفع عن جزيئات تقديم المستضد والتحفيز المشترك.
علاوة على ذلك ، يمكن تحميل mo-DCs المعالجة بالسياليداز بالمستضدات وزراعتها المشتركة مع الخلايا التائية أو الخلايا الأخرى ومن ثم يمكن دراستها فيما يتعلق بالنمط الظاهري أو ملف إفراز السيتوكين أو ميزات أخرى. في المثال المقدم ، تظهر البيانات أنه يمكن تحميل mo-DCs المعالجة بالسياليداز بمستضدات الورم ثم استخدامها لتنشيط الخلايا التائية. في الواقع ، أظهرت الخلايا التائية الناتجة زيادة إفراز IFN-γ ، وهو ما يتفق مع التقارير السابقة حول تأثير نقص حمض السياليك على تعزيز قدرة mo-DCs على تنشيط الخلايا التائية27،28،29،30،31.
في الختام ، يوضح هذا البروتوكول طريقة مجدية وقابلة للتطبيق وعملية لتوليد mo-DCs لمعالجة محتوى حمض السياليك عن طريق العلاج باستخدام sialidase. يقدم هذا البروتوكول منهجية يمكن أن تخدم أغراضا وتطبيقات مختلفة. لا يمكن أن يكون لهذه الطريقة دور حاسم في فهم دور أحماض السياليك في نضج الخلايا المناعية واستجابتها فحسب ، بل يمكن استخدامها أيضا كأداة مناعية.
Disclosures
يعلن المؤلفون عدم وجود مصالح مالية متنافسة أو تضارب مصالح آخر.
Acknowledgements
يقر المؤلفون بالتمويل المقدم من المفوضية الأوروبية GLYCOTwinning GA 101079417 و EJPRD / 0001/2020 EU 825575 ؛ مؤسسة العلوم والتكنولوجيا (FCT) البرتغال ، بموجب المنح FCT 2022.04607.PTDC و UIDP / 04378/2020 و UIDB / 04378/2020 (UCIBIO) و LA / P / 0140/2020 (i4HB). FCT-NOVA. و Stemmatters تم تمويلها أيضا من قبل الصندوق الأوروبي للتنمية الإقليمية (FEDER) ، من خلال البرنامج التشغيلي الإقليمي للشمال (Norte 2020) ل SI I & مشروع DT DCMatters (NORTE-01-0247-FEDER-047212). نحن نعترف بمنشأة Biolabs في FCT-NOVA و GLYCOVID NOVA Saude.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | AstiK’s | CTGP-E15-050 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase |
| 24-well plate | Greiner Bio-one | 662 160 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase |
| 50 mL conical tube | AstiK’s | CTGP-E50-050 | Obtaining Monocyte-derived Dendritic Cells |
| 7-Aminoactinomycin D (7-AAD) | BioLegend | 420404 | Obtaining Monocyte-derived Dendritic Cells |
| Annexin V | Immunotools | 31490013 | Obtaining Monocyte-derived Dendritic Cells |
| Attune Acoustic Focusing Flow Cytometer | Thermo Fisher Scientific | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs | |
| BSA | Sigma - Aldrich | A3294-100G | Obtaining Monocyte-derived Dendritic Cells; Determination of Sialic Acid Profile |
| CD14 (Monoclonal TÜK4) | Miltenyi Biotec | 130-080-701 | Obtaining Monocyte-derived Dendritic Cells |
| CD80 | Immunotools | 21270803 | Maturation Profiling of mo-DCs |
| CD86 | Immunotools | 21480863 | Maturation Profiling of mo-DCs |
| Cell counting slides and trypan blue | EVE | EVS-050 | Obtaining Monocyte-derived Dendritic Cells |
| Centrifuge | Eppendorf | 5430 R | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Density gradient medium (Histopaque) | Sigma - Aldrich | 10771-100ML | Obtaining Monocyte-derived Dendritic Cells |
| EDTA | Gibco, ThermoFisher | 15400054 | Obtaining Monocyte-derived Dendritic Cells |
| Elisa kit (IFN-γ) | Immunotools | 31673539 | Maturation Profiling of mo-DCs |
| EVE automated cell count | NanoEntek | 10027-452 | Obtaining Monocyte-derived Dendritic Cells |
| Fetal bovine serum (FBS) | Gibco | 10500064 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile |
| Granulocyte-macrophage colony-stimulating factor (GM-CSF) | Miltenyi Biotec | 130-093-864 | Obtaining Monocyte-derived Dendritic Cells |
| Human CD14 microbeads (Immunomagnetic beads) | Miltenyi Biotec | 130-050-201 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-1β | Sigma - Aldrich | I9401 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-4 | Miltenyi Biotec | 130-093-919 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-6 | Sigma - Aldrich | SRP3096 | Obtaining Monocyte-derived Dendritic Cells |
| L-glutamine | Gibco | A2916801 | Obtaining Monocyte-derived Dendritic Cells |
| LS column and plunger | Miltenyi Biotec | 130-042-401 | Obtaining Monocyte-derived Dendritic Cells |
| Maackia amurensis (MAA) lectin (MAA lectin - Biotinylated) | Vector labs | B-1265-1 | Determination of Sialic Acid Profile |
| MHC-I (HLA-ABC) | Immunotools | 21159033 | Maturation Profiling of mo-DCs |
| MHC-II (HLA-DR) | Immunostep | HLADRA-100T | Maturation Profiling of mo-DCs |
| Microtubes | AstiK’s | PCRP-E015-500 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Neuraminidase (Sialidase) | Roche | 11585886001 | Treatment of Cells with Sialidase |
| Non-essential amino acids (NEAA) | Gibco | 11140-050 | Obtaining Monocyte-derived Dendritic Cells |
| Paraformaldehyde (PFA 2%) | Polysciences Europe | 25085-1 | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Paraformaldehyde (PFA 4%) | Biotium | 22023 | Determination of Sialic Acid Profile |
| Pasteur pipettes | Labbox | PIPP-003-500 | Obtaining Monocyte-derived Dendritic Cells |
| Peanut (Arachis hypogaea) Agglutinin (PNA) lectin (PNA lectin - FITC) | Vector labs | FL-1071 | Determination of Sialic Acid Profile |
| Penicillin/streptomycin | Gibco | 15140163 | Obtaining Monocyte-derived Dendritic Cells |
| Phosphate Buffered Saline (PBS) | NZYTech | MB18201 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Prostaglandin E2 (PGE2) | Sigma - Aldrich | P0409 | Obtaining Monocyte-derived Dendritic Cells |
| RBC lysis buffer | BioLegend | 420302 | Obtaining Monocyte-derived Dendritic Cells |
| RPMI-1640 medium (containing 11.1 mM glucose) | Gibco | 31870074 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile |
| Sambucus nigra lectin (SNA lectin - Biotinylated) | Vector labs | B-1305-2 | Determination of Sialic Acid Profile |
| Sambucus nigra lectin (SNA lectin - FITC) | Vector labs | FL-1301-2 | Determination of Sialic Acid Profile |
| Sodium pyruvate | Thermofisher | 11360-070 | Obtaining Monocyte-derived Dendritic Cells |
| SpectroMax190 | Molecular Devices | Maturation Profiling of mo-DCs | |
| Streptavidin-PE | BioLegend | 405203 | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Tetramethylbenzidine (TMB) | Sigma - Aldrich | T0440 | Maturation Profiling of mo-DCs |
| Tumour necrosis factor-α (TNF-α) | Sigma - Aldrich | H8916 | Obtaining Monocyte-derived Dendritic Cells |
| Zeiss LSM710 confocal microscope | Zeiss | Determination of Sialic Acid Profile |
References
- Varki, A., Gagneux, P. Multifarious roles of sialic acids in immunity. Annals of the New York Academy of Sciences. 1253, 16-36 (2012).
- Bochner, B. S., Zimmermann, N. Role of Siglecs and related glycan-binding proteins in immune responses and immunoregulation. The Journal of Allergy and Clinical Immunology. 135 (3), 598-608 (2015).
- Smith, B. A. H., Bertozzi, C. R. The clinical impact of glycobiology: Targeting selectins, Siglecs and mammalian glycans. Nature Reviews Drug Discovery. 20, 217-243 (2021).
- Schauer, R. Sialic acids as regulators of molecular and cellular interactions. Current Opinion in Structural Biology. 19 (5), 507-514 (2009).
- Manhardt, C. T., Punch, P. R., Dougher, C. W. L., Lau, J. T. Y. Extrinsic sialylation is dynamically regulated by systemic triggers in vivo. Journal of Biological Chemistry. 292 (33), 13514-13520 (2017).
- Cabral, M. G., et al. Human dendritic cells contain cell surface sialyltransferase activity. Immunology Letters. 131 (1), 89-96 (2010).
- Bordron, A., et al. Hyposialylation must be considered to develop future therapies in autoimmune diseases. International Journal of Molecular Sciences. 22 (7), 3402(2021).
- Julien, S., Videira, P. A., Delannoy, P. Sialyl-Tn in cancer: (How) did we miss the target. Biomolecules. 2 (4), 435-466 (2012).
- Munkley, J. Aberrant sialylation in cancer: Therapeutic opportunities. Cancers. 14 (17), 4248(2022).
- Dennis, J. W., Laferte, S., Waghorne, C., Breitman, M. L., Kerbel, R. S. S1-6 Branching of Asn-linked oligosaccharides is directly associated with metastasis. Science. 236 (4801), 582-585 (1987).
- Pinho, S. S., Reis, C. A. Glycosylation in cancer: Mechanisms and clinical implications. Nature Reviews Cancer. 15 (9), 540-555 (2015).
- Manni, M., Läubli, H. Targeting glyco-immune checkpoints for cancer therapy. Expert Opinion on Biological Therapy. 21 (8), 1063-1071 (2021).
- Sjögren, J., Lood, R., Nägeli, A. On enzymatic remodeling of IgG glycosylation; Unique tools with broad applications. Glycobiology. 30 (4), 254-267 (2020).
- Trastoy, B., et al. Sculpting therapeutic monoclonal antibody N-glycans using endoglycosidases. Current Opinion in Structural Biology. 72, 248-259 (2022).
- Pascoal, C., et al. Sialyl LewisX/A and cytokeratin crosstalk in triple negative breast cancer. Cancers. 15 (3), 731(2023).
- von Itzstein, M., et al. Rational design of potent sialidase-based inhibitors of influenza virus replication. Nature. 363 (6428), 418-423 (1993).
- Gray, M. A., et al. Targeted glycan degradation potentiates the anticancer immune response in vivo. Nature Chemical Biology. 16 (12), 1376-1384 (2020).
- Fernandes, Â, et al. Glycans as shapers of tumour microenvironment: A sweet driver of T-cell-mediated anti-tumour immune response. Immunology. 168 (2), 217-232 (2023).
- Togayachi, A., et al. Polylactosamine on glycoproteins influences basal levels of lymphocyte and macrophage activation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15829-15834 (2007).
- Park, D. D. Resident and elicited murine macrophages differ in expression of their glycomes and glycan-binding proteins. Cell Chemical Biology. 28 (4), 567-582 (2021).
- Steinman, R. M. Dendritic cells and immune-based therapies. Experimental Hematology. 24 (8), 859-862 (1996).
- Sabado, R. L., Bhardwaj, N. Directing dendritic cell immunotherapy towards successful cancer treatment. Immunotherapy. 2 (1), 37-56 (2010).
- Pardoll, D. M. The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews Cancer. 12 (4), 252-264 (2012).
- Steinman, R. M., Banchereau, J. Taking dendritic cells into medicine. Nature. 449 (7161), 419-426 (2007).
- So-Rosillo, R., Small, E. J. Sipuleucel-T (APC8015) for prostate cancer. Expert Review of Anticancer Therapy. 6 (9), 1163-1167 (2006).
- Cheever, M. A., Higano, C. S. PROVENGE (Sipuleucel-T) in prostate cancer: The first FDA-approved therapeutic cancer vaccine. Clinical Cancer Research. 17 (11), 3520-3526 (2011).
- Videira, P. A., et al. Surface α2-3- and α2-6-sialylation of human monocytes and derived dendritic cells and its influence on endocytosis. Glycoconjugate Journal. 25 (3), 259-268 (2008).
- Cabral, M. G., et al. The phagocytic capacity and immunological potency of human dendritic cells is improved by α2,6-sialic acid deficiency. Immunology. 138 (3), 235-245 (2013).
- Silva, Z., et al. MHC class I stability is modulated by cell surface sialylation in human dendritic cells. Pharmaceutics. 12 (3), 249(2020).
- Silva, M., et al. Sialic acid removal from dendritic cells improves antigen cross-presentation and boosts anti-tumor immune responses. Oncotarget. 7 (27), 41053-41066 (2016).
- Crespo, H. J., et al. Effect of sialic acid loss on dendritic cell maturation. Immunology. 128, 621-631 (2009).
- Council of Europe. Guide to the Preparation, Use and Quality Assurance of Blood Components. Council of Europe. , Strasbourg, France. (2017).
- LS Columns. Miltenyi Biotec. , Available from: https://www.miltenyibiotec.com/US-en/products/Is-columns.html#130-042-401 (2012).
- Nair, S., Archer, G. E., Tedder, T. F. Isolation and generation of human dendritic cells. Current Protocols in Immunology. 07, Unit 7.32 (2012).
- Wu, X., Xu, F., Liu, J., Wang, G. Comparative study of dendritic cells matured by using IL-1β, IL-6, TNF-α and prostaglandins E2 for different time span. Experimental and Therapeutic Medicine. 14 (2), 1389-1394 (2017).
- Naeim, F., Nagesh Rao, P., Song, S., Phan, R. Chapter 2 - Principles of Immunophenotyping. Atlas of Hematopathology. , Academic Press. Cambridge, MA. 29-56 (2018).
- Cernadas, M., Lu, J., Watts, G., Brenner, M. B. CD1a expression defines an interleukin-12 producing population of human dendritic cells. Clinical and Experimental Immunology. 155, 523-533 (2009).
- Santambrogio, L., Strominger, J. L. The ins and outs of MHC class II proteins in dendritic cells. Immunity. 25 (6), 857-859 (2006).
- Raposo, C. D., Canelas, A. B., Barros, M. T. Human lectins, their carbohydrate affinities and where to find them. Biomolecules. 11 (2), 188(2021).
- Videira, P. A. Q., et al. Patent WO2017002045. A viable cell population, method for production and uses thereof. Portugal patent. , Universidade NOVA de Lisboa. Lisbon, Portugal. (2017).
- Bai, L., Feuerer, M., Beckhove, P., Umansky, V., Schirrmacher, V. Generation of dendritic cells from human bone marrow mononuclear cells: Advantages for clinical application in comparison to peripheral blood monocyte derived cells. International Journal of Oncology. 20 (2), 247-253 (2002).
- Marques, G. S., Silva, Z., Videira, P. A. Antitumor efficacy of human monocyte-derived dendritic cells: Comparing effects of two monocyte isolation methods. Biological Procedures Online. 20, 4(2018).
- Bax, M., et al. Dendritic cell maturation results in pronounced changes in glycan expression affecting recognition by Siglecs and galectins. Journal of Immunology. 179 (12), 8216-8224 (2007).
- Chinoy, Z. S., Montembault, E., Moremen, K. W., Royou, A., Friscourt, F. Impacting bacterial sialidase activity by incorporating bioorthogonal chemical reporters onto mammalian cell-surface sialosides. ACS Chemical Biology. 16 (11), 2307-2314 (2021).
- Chou, M. -Y., Li, S. -C., Li, Y. -T. Cloning and expression of sialidase L, a NeuAcα2→3Gal-specific sialidase from the leech, Macrobdella decora. Journal of Biological Chemistry. 271 (32), 19219-19224 (1996).
- Crespo, H. J., Lau, J. T. Y., Videira, P. A. Dendritic cells: A spot on sialic acid. Frontiers in Immunology. 4, 491(2013).
- Büll, C. Metabolic sialic acid blockade lowers the activation threshold of moDCs for TLR stimulation. Immunology & Cell Biology. 95 (4), 408-415 (2017).
- Ohmi, Y., et al. Majority of alpha2,6-sialylated glycans in the adult mouse brain exist in O -glycans: SALSA-MS analysis for knockout mice of alpha2,6-sialyltransferase genes. Glycobiology. 31 (5), 557-570 (2021).
- Chung, C., et al. Integrated genome and protein editing swaps α-2,6 sialylation for α-2,3 sialic acid on recombinant antibodies from CHO. Biotechnology Journal. 12 (2), 1600502(2017).
- Hyvärinen, S., Meri, S., Jokiranta, T. S. Disturbed sialic acid recognition on endothelial cells and platelets in complement attack causes atypical hemolytic uremic syndrome. Blood. 127 (22), 2701-2710 (2016).
- Powell, L. D., Whiteheart, S. W., Hart, G. W. Cell surface sialic acid influences tumor cell recognition in the mixed lymphocyte reaction. Journal of Immunology. 139, 262-270 (1987).
- Corfield, A. P., Higa, H., Paulson, J. C., Schauer, R. The specificity of viral and bacterial sialidases for α(2-3)- and α(2-6)-linked sialic acids in glycoproteins. Biochimica et Biophysica Acta - Protein Structure and Molecular Enzymology. 744 (2), 121-126 (1983).
- Tkachenko, N., Wojas, K., Tabarkiewicz, J., Rolinski, J. Generation of dendritic cells from human peripheral blood monocytes - Comparison of different culture media. Folia Histochemica et Cytobiologica. 43, 25-30 (2005).
- Kim, S. J., et al. Human CD141+ dendritic cells generated from adult peripheral blood monocytes. Cytotherapy. 21 (10), 1049-1063 (2019).
- Calmeiro, J., et al. In-depth analysis of the impact of different serum-free media on the production of clinical grade dendritic cells for cancer immunotherapy. Frontiers in Immunology. 11, 593363(2021).
- Stamatos, N. M., et al. LPS-induced cytokine production in human dendritic cells is regulated by sialidase activity. Journal of Leukocyte Biology. 88 (6), 1227-1239 (2010).
- Lehmann, F., Tiralongo, E., Tiralongo, J. Sialic acid-specific lectins: Occurrence, specificity and function. Cellular and Molecular Life Sciences. 63 (12), 1331-1354 (2006).
- Frosch, M., Görgen, I., Boulnois, G. J., Timmis, K. N., Bitter-Suermann, D. NZB mouse system for production of monoclonal antibodies to weak bacterial antigens: Isolation of an IgG antibody to the polysaccharide capsules of Escherichia coli K1 and group B meningococci. Proceedings of the National Academy of Sciences of the United States of America. 82 (4), 1194-1198 (1985).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved