Method Article
Generazione di cellule dendritiche derivate da monociti con diversi fenotipi sialilati
In questo articolo
Riepilogo
Viene presentato un protocollo unico e completo per generare cellule dendritiche (mo-DC) derivate da monociti umani desialilati da cellule mononucleate isolate del sangue periferico (PBMC) utilizzando un trattamento con sialidasi. Inoltre, vengono descritti metodi per valutare la caratterizzazione fenotipica e funzionale delle mo-DC e valutare come il trattamento con sialidasi migliora il livello di maturazione delle mo-DC.
Abstract
Gli acidi sialici sono monosaccaridi caricati negativamente che si trovano tipicamente ai termini dei glicani della superficie cellulare. Per la loro idrofilia e le loro caratteristiche biofisiche, sono coinvolti in numerosi processi biologici, come la modulazione della risposta immunitaria, il riconoscimento di antigeni self e non-self, le interazioni carboidrati-proteine, ecc. Il contenuto cellulare dell'acido sialico è regolato dalla sialidasi, che catalizza la rimozione dei residui di acido sialico. Diversi studi hanno dimostrato che i sialo-glicani sono fondamentali nel monitoraggio della sorveglianza immunitaria interagendo con i recettori siglec cis e trans inibitori sulle cellule immunitarie. Allo stesso modo, i checkpoint glico-immunitari nel cancro stanno diventando bersagli cruciali per lo sviluppo di immunoterapie. Inoltre, le cellule dendritiche (DC) sono considerate un componente importante nelle immunoterapie, in particolare nella ricerca sul cancro, grazie al loro ruolo unico come cellule presentanti l'antigene professionale (APC) e alla loro capacità di innescare risposte immunitarie adattative e generare memoria immunologica. Tuttavia, la funzione delle DC dipende dalla loro piena maturazione. Le DC immature hanno una funzione opposta a quella delle DC mature e un alto contenuto di acido sialico, che ne smorza ulteriormente il livello di maturazione. Ciò riduce la capacità delle DC immature di attivare le cellule T, portando a una risposta immunitaria compromessa. Di conseguenza, la rimozione dell'acido sialico dalla superficie cellulare delle DC umane induce la loro maturazione, aumentando così l'espressione delle molecole MHC e la presentazione dell'antigene. Inoltre, può ripristinare l'espressione di molecole co-stimolatorie e IL-12, con il risultato che le DC hanno una maggiore capacità di polarizzare le cellule T verso un fenotipo Th1 e attivare specificamente le cellule T citotossiche per uccidere le cellule tumorali. Pertanto, l'acido sialico è emerso come un modulatore chiave delle DC e viene utilizzato come nuovo bersaglio per far progredire il loro uso terapeutico. Questo studio fornisce un approccio unico per il trattamento in vitro delle DC derivate da monociti con sialidasi, volto a generare popolazioni di DC con diversi fenotipi di acido sialico della superficie cellulare e profili di maturazione e co-stimolazione personalizzati.
Introduzione
I glicani portatori di acido sialico (sialoglicani) hanno guadagnato un notevole interesse a causa del loro ruolo immunomodulatorio. L'acido sialico monosaccaride, che è più diffuso nell'uomo sotto forma di acido N-acetilneuraminico, presenta ligandi fondamentali per le lectine con un ruolo riconosciuto in immunologia, come le selectine e le sigliec. Queste lectine riconoscono i sialoglici sia sulla stessa cellula (cis) che su cellule diverse (trans) e svolgono un ruolo significativo nelle interazioni ospite-patogeno e in varie attività cellulari fisiologiche e patologiche 1,2,3. Inoltre, poiché l'acido sialico occupa le posizioni terminali dei glicoconiugati della superficie cellulare, può nascondere le strutture sottostanti, inibendo così il contatto cellula-cellula attraverso effetti repulsivi aspecifici o ostruendo il rilevamento da parte di altre lectine4. L'attività di una varietà di sialiltransferasi (che trasferiscono gli acidi sialici) e delle sialidasi (che scindono i legami dell'acido sialico) all'interno della cellula determina la quantità di acido sialico presente in superficie. Inoltre, le sialiltransferasi solubili e le sialidasi espresse dall'ospite o dai patogeni possono modificare estrinsecamente la quantità di acido sialico sulla superficie cellulare 5,6.
La sialilazione aberrante è una caratteristica di diverse condizioni patologiche. Nelle malattie autoimmuni, l'iposializzazione può contribuire all'attivazione immunitaria sfrenata e al danno d'organo, poiché l'acido sialico aiuta a discriminare gli autoantigeni e a regolare le risposte infiammatorie7. Al contrario, l'ipersialilazione provoca la sovraespressione di sialoglicani, come il sialil-Tn, gli antigeni sialil-Lewis, l'acido polisialico e i gangliosidi, che costituiscono un segno distintivo di alcuni tumori 8,9. L'ipersilazione dipende anche dall'aumento dell'espressione di enzimi specifici come la N-acetilglucosaminiltransferasi (GNT-V), che genera glicani ipersialicati tri- e/o tetra-antennari legati all'N, che sono stati associati alla crescita del cancro e alle metastasi10. Il contenuto di acido sialico regola anche la stabilità e la funzione delle proteine, che sono fondamentali per il ruolo dei principali attori oncogenici11. Pertanto, l'aumento della sialilazione può facilitare lo sviluppo del tumore, le metastasi, la resistenza ai farmaci e l'evasione immunitaria. Inoltre, la sovraregolazione dei sialoglici consente ai tumori di interagire con i recettori inibitori di Siglec sulle cellule immunitarie ed evitare la sorveglianza immunitaria. Per questo motivo, i sialoglicani sono ora considerati punti di controllo glico-immunitari e bersagli terapeutici attraenti. Ad esempio, gli inibitori dell'asse Siglec-immunitario sono già in fase di sperimentazione clinica, poiché il recettore delle cellule immunitarie Siglec (LECtin-binding ImmunoGlobulin-like legante l'acido sialico) svolge un ruolo immuno-inibitorio12.
Gli enzimi sono stati utilizzati per modulare il profilo glicanico come strumenti di studio o per strategie terapeutiche13,14. La sialidasi, infatti, è stata impiegata per alterare la malignità delle cellule tumorali poiché i glicani sialilati come il sialil Lewis X sono fondamentali per la migrazione cellulare e le metastasi tumorali15. Allo stesso tempo, gli inibitori della sialidasi, che impediscono la scissione dell'acido sialico, hanno raggiunto le cliniche per il trattamento delle infezioni virali dipendenti dall'acido sialico16. Recentemente, la modulazione dell'acido sialico ha guadagnato ulteriore interesse a causa del ruolo critico degli acidi sialici come ligandi nell'asse Siglec-immunitario, il che significa che offrono nuovi mezzi per ridurre la fuga del cancro dalle risposte immunitarie. Questo interesse è stato ulteriormente rafforzato dal contributo del premio Nobel 2022 Bertozzi e del suo team di diverse strategie che scindono selettivamente diversi sialoglicani e migliorano le risposte immunitarie antitumorali17. Pertanto, le strategie basate sulla sialidasi, rappresentano una modalità promettente per la terapia del checkpoint glico-immunitario. Il glicofenotipo delle cellule del sistema immunitario dipende dal tipo di cellula e dal loro stato di attivazione. Per quanto riguarda le cellule T, i glicani hanno un ruolo chiave nelle fasi fisiopatologiche dello sviluppo delle cellule T e della selezione dei timociti, dell'attività delle cellule T, della differenziazione e della proliferazione delle cellule T18. Ad esempio, la polilattosamina sulle glicoproteine influenza i livelli basali dei linfociti B e dei linfociti T e l'attivazione dei macrofagi19. Nei macrofagi, distinti modelli di espressione dei glicani hanno un ruolo importante nel reclutamento dei macrofagi nel microambiente tumorale (TME)20. Quindi, l'espressione di glicani O-linked e N-linked da parte delle cellule immunitarie potrebbe essere utilizzata come potenziali glicobiomarcatori per approcci terapeutici nel trattamento del cancro e delle malattie autoimmuni.
Le cellule dendritiche (DC) sono cellule presentanti l'antigene specifico con una capacità unica di innescare risposte immunitarie, come l'immunità antitumorale21. Le DC devono subire una sovraregolazione delle loro molecole MHC che presentano l'antigene per presentare antigeni alle cellule T (segnale 1), molecole co-stimolatorie per attivare le cellule T (segnale 2) e citochine pro-infiammatorie, come IL-12, per innescare la proliferazione delle cellule T helper di tipo 1 (segnale 3)22. Il profilo immunitario risultante è strettamente regolato e i checkpoint sono essenziali per prevenire l'attacco delle cellule sane. Poiché le DC possono stimolare varie risposte immunitarie contro le cellule tumorali, sono utilizzate come vaccini a base cellulare e un numero considerevole di studi clinici ha dimostrato i loro potenziali benefici23,24. Dopo che la FDA ha approvato il primo vaccino a base di DC nel 201025,26, sono stati sviluppati molti altri vaccini a base di DC. I vaccini a base di DC sono principalmente prodotti ex vivo e somministrati ai pazienti per suscitare risposte immunitarie contro i tumori. Tuttavia, una maturazione insufficiente o breve è attualmente uno dei fattori che limitano l'efficacia clinica delle DC e significa che devono essere utilizzati costosi cocktail di citochine. Senza un'adeguata maturazione, le DC non possono attivare le cellule T in circostanze cliniche. Invece, le DC esprimono checkpoint immunitari e innescano una risposta immunitaria tollerogenica che impedisce alle cellule T citotossiche di agire contro le cellule tumorali.
Le DC umane hanno superfici fortemente sialilate, e questa sialilazione diminuisce con la maturazione e durante una risposta immunitaria generale27. La maturazione delle DC può essere indotta eliminando questi acidi sialici con la sialidasi. La desililazione sovraregola notevolmente varie citochine, tra cui IL-12, a causa della traslocazione del fattore di trascrizione NF-kB nel nucleo 6,28. Inoltre, la desialilazione migliora la presentazione incrociata dell'antigene attraverso MHC-I e le risposte immunitarie antitumorali29,30. Di conseguenza, il knockout delle sialiltransferasi ST3Gal.l e ST6Gal.l, che hanno un ruolo importante nella sialilazione delle DC, genera un fenotipo più maturo nelle DCmurine 31.
Il trattamento con sialidasi fornisce un metodo per stimolare tutti gli aspetti della maturazione delle DC, tra cui l'aumento della presentazione dell'antigene, l'aumento dell'espressione di molecole costimolatorie e l'aumento della produzione di citochine, per affrontare le carenze sopra menzionate e consentire alle DC di suscitare risposte efficaci. Questo articolo presenta una procedura per ottenere DC umane desialilate vitali attraverso l'uso di una sialidasi batterica. Le DC de-sialilate mostrano un profilo di maturazione migliorato e possono essere utilizzate come modelli cellulari per potenziare le risposte immunitarie antitumorali in vitro. Le DC sono ottenute dai monociti del sangue, che vengono poi differenziati in vitro in presenza della citochina interleuchina-4 (IL-4) e del fattore stimolante le colonie di macrofagi granulocitari (GM-CSF). Questo lavoro descrive anche metodi basati sulla lectina per analizzare l'acido sialico sulla superficie cellulare e metodi per immunofenotipizzare il livello di maturazione delle DC. La procedura qui descritta può essere utilizzata per desialilare altri tipi di cellule, fornendo così un approccio per studiare il ruolo dei sialoglicani, che sono checkpoint glico-immunitari vitali e rilevanti nell'immunomodulazione.
Protocollo
Le cellule sono state isolate dai buffy coat di donatori di sangue anonimi sani, che erano volontari forniti dalla banca nazionale del sangue, Instituto Português do Sangue e da Transplantação (IPST), dopo aver ottenuto il consenso scritto e informato del donatore (IMP.74.52.4). L'uso del sangue è stato approvato dal comitato etico (IPST 30072015), secondo la direttiva 2004/23/CE sulle norme di qualità e di sicurezza per la donazione, l'approvvigionamento, il controllo, la lavorazione, la conservazione, lo stoccaggio e la distribuzione di tessuti e cellule umani (legge portoghese 22/2007, 29 giugno). La biobanca IPST raccoglie e conserva il sangue in un apposito sacchetto di plastica contenente destrosio fosfato citrato (CPD), una soluzione conservante e anticoagulante, per mantenere l'integrità del sangue fino al trattamento. Per valutare se il materiale biologico è appropriato per la manipolazione, viene eseguito un controllo sierologico per il Treponema pallidum, il virus dell'epatite B (HBV), il virus dell'epatite C (HCV) e il virus dell'immunodeficienza umana (HIV), che devono essere tutti negativi. Per il presente studio, il buffy coat è stato fornito dall'IPST a scopo di indagine, insieme alle informazioni riguardanti la data di raccolta, i risultati sierologici, il gruppo sanguigno e l'età del donatore32. Il buffy coat può rimanere a temperatura ambiente per un massimo di 1 giorno.
1. Ottenere cellule dendritiche derivate da monociti
NOTA: È importante ricordare che quando il sangue periferico umano viene manipolato, è necessario prendere in considerazione specifiche precauzioni di sicurezza universali e un appropriato smaltimento del materiale. Prima di iniziare, verificare che tutti i reagenti e i materiali necessari siano preparati e pronti per l'uso.
- Isolamento di cellule mononucleate del sangue periferico
- Accedi al cappotto buffy umano.
NOTA: Il buffy coat è un sottoprodotto derivato dal sangue raccolto tramite leucoaferesi32, che viene arricchito nei globuli bianchi attraverso la centrifugazione. Tutte le fasi sono state eseguite in una camera di biosicurezza a flusso verticale (BSC). - Aprire la confezione del buffy coat tagliando il tubo di uscita sigillato con un bisturi e trasferire il contenuto in un tubo da 50 ml. Trasferire 7 mL di campione di buffy coat per provetta conica sterile da 15 mL e aggiungere 6 mL di soluzione salina tamponata con fosfato (PBS) per eseguire un lavaggio preliminare. Questa fase iniziale di lavaggio è necessaria per pulire il campione dalla notevole quantità di globuli rossi (RBC) e plasma in modo che il campione sia ottimizzato per la separazione a gradiente con un mezzo a gradiente di densità (vedere la tabella dei materiali).
- Centrifugare la provetta a temperatura ambiente per 10 minuti a 1.100 x g in una centrifuga con rotore oscillante e con il freno disinserito (vedere la tabella dei materiali).
- Dopo la centrifugazione, raccogliere la sospensione leucocitaria (l'anello bianco tra il plasma e i globuli rossi) con una pipetta Pasteur e trasferirla in una nuova provetta conica sterile da 15 ml.
- Riempire la sospensione leucocitaria fino a 10 ml con PBS per favorire la successiva fase di separazione e mescolare pipettando delicatamente su e giù.
- Preparare la soluzione del terreno a gradiente di densità (densità: 1,077 g/mL): Mettere 3 mL di mezzo a gradiente di densità in una nuova provetta conica sterile da 15 mL e lasciarla riscaldare a temperatura ambiente.
- Aggiungere 5 mL della sospensione leucocitaria diluita (dal punto 1.1.5) nella provetta conica contenente il mezzo del gradiente di densità (5:3) per eseguire la separazione del gradiente di densità. Aggiungere il campione lentamente, goccia a goccia, utilizzando le pareti della provetta per evitare di disturbare il mezzo del gradiente di densità.
- Separazione del gradiente: centrifugare la sospensione del mezzo a gradiente di densità a temperatura ambiente per 30 minuti a 1.100 x g in una centrifuga con rotore oscillante e con il freno disinserito.
- Dopo la centrifugazione, rimuovere con cautela le provette coniche dalla centrifuga. Dopo questo passaggio, sono visibili una serie di strati ben definiti, tra cui, a partire dal basso: uno strato rosso (globuli rossi e granulociti), un mezzo a gradiente di densità, un sottile strato chiaro di cellule mononucleate del sangue periferico (PBMC) e plasma.
- Raccogliere lo strato sottile di PBMC utilizzando una pipetta Pasteur ed evitare di prelevare il mezzo del gradiente di densità sottostante o troppo plasma sopra. Inserire il campione PBMC in una nuova provetta conica da 50 mL, riempirla fino a 25 mL con PBS e mescolare il campione pipettando delicatamente su e giù.
- Centrifugare i campioni a temperatura ambiente per 10 minuti a 600 x g (freno normale) per lavare via le cellule residue e i detriti e scartare il surnatante capovolgendo con cautela la provetta.
NOTA: Se c'è troppa contaminazione da globuli rossi, che è osservabile quando il pellet cellulare o il buffy coat non sono completamente separati o appaiono rossastri, si consiglia di lisare i restanti globuli rossi. In questo caso, aggiungere 5 mL di tampone di lisi per globuli rossi (vedere la tabella dei materiali), mescolare accuratamente e incubare per 5 minuti. Riempire fino a 40 mL con PBS, centrifugare i campioni a temperatura ambiente per 10 minuti a 900 x g (freno normale) ed eliminare il surnatante capovolgendo con cautela la provetta. - Riempire il campione fino a 10 mL con PBS e prelevare un'aliquota per contare le cellule. Per rimuovere le piastrine, centrifugare a temperatura ambiente per 5 minuti a 400 x g (freno normale) ed eliminare il surnatante capovolgendo con cautela la provetta.
NOTA: Nel caso in cui ci sia un numero considerevole di piastrine, centrifugare a temperatura ambiente per 10 minuti a 200 x g (freno normale) due volte. Le piastrine vengono identificate visualizzando il campione mentre si contano le cellule.
- Accedi al cappotto buffy umano.
- Isolamento dei monociti mediante separazione immunomagnetica
- Preparare il tampone delle microsfere integrando PBS con albumina sierica bovina (BSA) allo 0,5% e acido etilendiamminotetraacetico (EDTA) 2 mM. Sterilizzare la soluzione mediante filtrazione (0,2 μm) e conservare il tampone in frigorifero (2-8 °C).
- Eseguire l'isolamento dei monociti CD14+ mediante smistamento cellulare attivato magneticamente (MACS).
- Dopo aver contato le cellule utilizzando un contatore di cellule automatizzato (passaggio 1.4.1), calcolare il volume appropriato di microsfere tampone e microsfere immunomagnetiche CD14 (vedere la tabella dei materiali) necessarie. Assicurati che queste soluzioni siano mantenute in ghiaccio. Aggiungere 80 μL di tampone di microsfere per 1 x 10 7 cellule e 20 μL di microsfere per 1 x 107 cellule.
- Risospendere il pellet cellulare nei volumi precedentemente determinati e incubare per 15 minuti a 4 °C (2-8 °C).
NOTA: Nel caso in cui sia necessaria la verifica dei livelli di monociti nei campioni PBMC, eseguire un'analisi citofluorimetrica utilizzando anticorpi coloranti (ad es. CD14 [Monoclonal TÜK4]). Seguire il passaggio 3.2 per i dettagli sull'analisi citofluorimetrica. - Aggiungere 1-2 mL di tampone di microsfere per 1 x 107 cellule, centrifugare a temperatura ambiente per 10 minuti a 600 x g (freno normale) per rimuovere le perle non legate ed eliminare il surnatante capovolgendo con cura la provetta.
- Preparare la colonna LS. Le colonne LS contengono sfere ferromagnetiche che, se posizionate su un magnete, consentono una ritenzione positiva e delicata delle cellule marcate magneticamente33. Immediatamente prima dell'uso, posizionare una colonna LS (vedere la Tabella dei materiali) sul magnete, risciacquare con 3 mL di tampone di microsfere senza asciugare completamente e procedere immediatamente al passaggio successivo.
NOTA: Non lasciare mai asciugare la colonna durante la procedura per evitare di compromettere la resa. - Risospendere il pellet cellulare in 500 μL di tampone di microsfere per 1 x 108 cellule. Se il numero di cellule è superiore a 4 x 108, utilizzare un filtro cellulare da 40 μm per impedire l'aggregazione cellulare.
- Aggiungere la sospensione cellulare all'ingresso della colonna, posizionare una provetta conica da 15 mL sotto l'uscita della colonna per raccogliere la frazione cellulare negativa e lavare la colonna tre volte con 3 mL di tampone di microsfere. La frazione negativa comprende le cellule che non sono state raccolte con le perle CD14 (cioè le cellule CD14− ).
- Dopo il lavaggio finale, rimuovere la colonna dal magnete, posizionarla su una provetta conica sterile da 15 mL, pipettare 5 mL di tampone di microsfere nell'ingresso della colonna e inserire immediatamente lo stantuffo della siringa nell'ingresso della colonna e spingere per erogare le cellule target.
- Raccogliere le cellule marcate magneticamente (cellule CD14+ ) e prelevare un'aliquota per contare le cellule, come descritto al punto 1.4.1.
- Centrifugare entrambe le frazioni cellulari, CD14− e CD14+ , a temperatura ambiente per 10 minuti a 600 x g (freno normale). Scartare il surnatante, conservare la frazione CD14+ per le fasi successive e conservare la frazione CD14− per saggi futuri, come i saggi di co-coltura, se necessario. Se necessario, le cellule della frazione CD14− possono essere crioconservate in RPMI-1640 20% FBS e 10% DMSO a -80 °C.
- Differenziazione dei monociti in cellule dendritiche
- Preparare il terreno RPMI-1640 completo integrando il terreno di base RPMI-1640 (contenente 11,1 mM di glucosio) con il 10% di siero fetale bovino (FBS), l'1% di 2 mM di L-glutammina, l'1% di aminoacidi non essenziali (NEAA), l'1% di piruvato di sodio e l'1% di 100 μg/mL di penicillina/streptomicina (vedere la tabella dei materiali).
- Eseguire la differenziazione dei monociti in mo-DC, che si verifica nell'arco di ~5-6 giorni.
- Calcolare il volume di terreno necessario per il numero di cellule CD14+ ottenute e piastrare le cellule secondo la seguente configurazione dell'esperimento.
NOTA: In questo protocollo, le cellule sono state piastrate a una concentrazione di 1,3 x 106 cellule/mL per prendere in considerazione la morte cellulare e gli errori di misurazione, e il terreno è stato preparato aggiungendo 1.000 U/mL di GM-CSF e 750 U/mL di IL-4 (vedere la tabella dei materiali) in un terreno completo e mescolandolo accuratamente. - Aggiungere il volume appropriato di terreno alle cellule CD14+ e risospendere pipettando su e giù con una pipetta Pasteur. Placcare la sospensione cellulare in piastre da 24 pozzetti (per pozzetto: 1,3 x 106 cellule/mL) e incubare in un incubatore di coltura a 37 °C con il 5% di CO2 .
- Cambiare il terreno di coltura e integrarlo con citochine fresche ogni 2-3 giorni (di solito una volta per processo di differenziazione). Per eseguire questa operazione, rimuovere con cautela metà del terreno di coltura senza disturbare le cellule. Aggiungere la stessa quantità di terreno fresco con l'appropriata concentrazione di citochine, come descritto in precedenza nella nota del punto 1.3.2.1, e incubare per il restante periodo di differenziazione.
NOTA: Le DC, quando si differenziano dai monociti, sono cellule debolmente aderenti. Le mo-DC immature completamente differenziate sono cellule a forma di fuso, fluttuanti e debolmente aderenti. Le cellule possono anche formare rosette, soprattutto quando sono mature34. - Per raccogliere le cellule dopo la differenziazione, utilizzare una micropipetta per trasferire l'intera sospensione cellulare in una provetta conica sterile e lavare due volte i pozzetti della piastra con PBS, picchiettando delicatamente sul fondo (Figura 1A).
NOTA: Evitare di raccogliere le cellule fortemente aderenti, poiché probabilmente si tratta di macrofagi. Per evitare una maturazione o un'attivazione impropria delle cellule, assicurarsi che le cellule siano maneggiate con estrema cura. - Centrifugare le cellule a temperatura ambiente per 10 minuti a 180 x g (freno normale) per rimuovere eventuali residui o cellule morte e risospendere nel terreno/tampone appropriato per la configurazione sperimentale.
- Calcolare il volume di terreno necessario per il numero di cellule CD14+ ottenute e piastrare le cellule secondo la seguente configurazione dell'esperimento.
- Eseguire la maturazione delle mo-DC.
- Nel caso in cui sia necessaria la maturazione di mo-DC, utilizzare una piastra a pozzetti o un pallone, prendendo in considerazione l'esempio di concentrazione cellulare utilizzato in precedenza (1,3 x 10 6 cellule/mL), e somministrare un cocktail di citochine integrando il terreno con un cocktail di citochine comprendente IL-1β (10 ng/mL),IL-6 (1.000 U/mL), prostaglandina E2 (PGE2; 1 μg/mL), e il fattore di necrosi tumorale-α (TNF-α; 10 ng/mL) (vedi la tabella dei materiali). Incubare le cellule a 37 °C con il 5% di CO2 per 24 o 48 ore.
- Conteggio e vitalità cellulare
- Eseguire il conteggio delle cellule e la colorazione blu del tripano.
- Per determinare il numero di cellule e la vitalità di una sospensione cellulare, prelevare un'aliquota di 10 μL dalla sospensione cellulare e mescolarla con 10 μL di blu di tripano (diluizione 1:1).
- Prelevare 10 μL della miscela precedente e utilizzare il contatore automatico di cellule per contare il numero di cellule secondo le istruzioni del produttore.
NOTA: Se la concentrazione di cellule è troppo alta, diluire l'aliquota e, dopo il conteggio delle cellule, considerare il fattore di diluizione nei calcoli. - Regolare il numero di celle e il mezzo/tampone per la configurazione sperimentale.
- Determinare la vitalità cellulare e l'apoptosi30.
NOTA: In questo lavoro, dopo il trattamento con sialidasi (sezione 2), è stato eseguito il test di vitalità.- Colorare le mo-DC con 5 μg/mL di 7-aminoactinomicina D (7-AAD) e annessina V e determinare l'apoptosi secondo le istruzioni del produttore (vedere la tabella dei materiali).
- Analizzare i risultati utilizzando la citometria a flusso 29,30.
- Eseguire il conteggio delle cellule e la colorazione blu del tripano.
2. Trattamento delle cellule con sialidasi
NOTA: Dopo la differenziazione in mo-DC, il sesto giorno, le cellule sono pronte per il test di trattamento con sialidasi.
- Considerando la configurazione sperimentale desiderata, raccogliere ~10 x 10 6 mo-DC da 10 pozzetti delle piastre a 24 pozzetti con 1,3 x 106 cellule/pozzetto e trasferirli in una nuova provetta conica sterile da 15 mL.
NOTA: Supporre una certa perdita di cellule; tipicamente, in questa fase, la concentrazione riscontrata è di 1,3 x 106 cellule/mL perché le mo-DC e i loro precursori non proliferano e subiscono una perdita di vitalità del 20% durante il differenziamento in mo-DC. - Centrifugare a temperatura ambiente per 5-7 minuti a 300 x g (freno normale) ed eliminare il surnatante per rimuovere le cellule morte e i detriti.
- Aggiungere 10 mL di terreno RPMI-1640 (contenente 11,1 mM di glucosio), centrifugare a temperatura ambiente per 4 minuti a 300 x g (freno normale), scartare il surnatante, aggiungere 2 mL di RPMI-1640 e mescolare accuratamente.
- Inserire 1 mL di cellule in RPMI-1640 in nuove microprovette sterili, #1 e #2; Ogni microprovetta conterrà circa 5 x 106 cellule.
- Alla microprovetta #1, aggiungere 500 mU di sialidasi da Clostridium perfringens (vedi la tabella dei materiali). Alla microprovetta #2, aggiungere sialidasi, che è un controllo negativo, per confermare se gli effetti osservati sono direttamente correlati alla rimozione dell'acido sialico e non sono dovuti ad artefatti. La sialidasi trattata con mock è una sialidasi inattivata termicamente, che si ottiene facendo bollire l'enzima per 20 minuti a 100 °C.
- Incubare per 60 minuti a 37 °C.
- Dopo l'incubazione, inserire le cellule in nuove provette coniche sterili da 15 mL con la stessa numerazione, #1 e #2. Aggiungere circa 4 mL di terreno RPMI-1640 completo (contenente il 10% di FBS) in entrambe le provette per arrestare la reazione enzimatica.
- Centrifugare a temperatura ambiente per 4 minuti a 300 x g (freno normale) ed eliminare il surnatante.
- Aggiungere 5 mL di terreno RPMI-1640 completo a ciascuna provetta e piastra 1 mL di cellule per pozzetto.
3. Determinazione del profilo dell'acido sialico
- Colorazione della lectina
- Raccogliere e lavare le cellule a temperatura ambiente per 5 minuti a 300 x g (freno normale).
- Risospendere le cellule in RPMI-1640 + 10% FBS e distribuire le cellule (100.000/100 μL) nelle microprovette.
- Eseguire la colorazione per citometria a flusso in RPMI-1640 con FBS al 10% utilizzando una concentrazione di 0,01 mg/mL per ciascuna lectina: lectina di Sambucus nigra (SNA), lectina di agglutinina di arachidi (PNA) e lectina di Maackia amurensis (MAA) (vedere la tabella dei materiali). Incubare per 30 minuti a 4 °C.
- Lavare le cellule con 1 mL di PBS contenente il 10% di FBS o il 10% di BSA e centrifugare a temperatura ambiente per 4 minuti a 300 x g (freno normale).
- Alle cellule colorate con le lectine biotinilate, aggiungere 0,0005 mg/mL di streptavidina-PE (vedere la tabella dei materiali) e incubare per 15 minuti a temperatura ambiente al buio. Lavare le cellule con 1 mL di PBS e centrifugare a temperatura ambiente per 4 minuti a 300 x g (freno normale).
- Scartare il surnatante e, a ciascuna provetta, aggiungere 300 μL di paraformaldeide al 2% (PFA 2%). Proteggere i tubi dalla luce e, se necessario, conservarli a 4 °C fino all'acquisizione dei dati.
- Acquisire i dati utilizzando un citometro a flusso entro 1 settimana dalla preparazione del campione29,30.
- Citometria a flusso
- Risospendere le cellule in 1 mL di PBS e acquisire il campione con un citometro a flusso per l'acquisizione immediata dei dati.
- Per l'acquisizione ritardata dei dati, risospendere in 300 μL di PFA al 2% e acquisire i dati entro 1 settimana.
- Microscopia confocale a scansione laser
- Placcare le cellule su vetrini coprioggetti rivestiti in polilisina di 12 mm di diametro e incubare per 5 minuti a temperatura ambiente.
- Centrifugare i vetrini coprioggetti a temperatura ambiente per 1 minuto a 100 x g (freno normale) per favorire l'adesione cellulare.
- Fissare a temperatura ambiente per 30 minuti con il 4% di PFA prima di lavare con l'1% di BSA in PBS.
- Utilizzare la lectina SNA coniugata con FITC (0,01 mg/mL) per colorare gli acidi sialici α2,6-legati sulle superfici cellulari (vedere la tabella dei materiali).
- Acquisire immagini su un microscopio confocale (vedere la Tabella dei Materiali).
- Dopo l'elaborazione Z-stack, selezionare immagini rappresentative della sezione trasversale confocale.
- Quantificare analiticamente l'intensità della colorazione utilizzando la fluorescenza cellulare totale (CTCF) corretta.
NOTA: CTCF = Integrated density − (Area della cella selezionata × Fluorescenza media delle letture di fondo)29.
4. Profilazione di maturazione delle mo-DC
- Colorazione anticorpale e citometria a flusso
- Raccogliere un nuovo campione delle cellule di interesse per eseguire la colorazione degli anticorpi. Lavare le cellule a temperatura ambiente per 5 minuti a 300 x g (freno normale) e distribuire le cellule nelle microprovette (100.000 cellule per provetta).
- Eseguire la colorazione per la citometria a flusso utilizzando gli anticorpi desiderati (ab), MHI-I, MHC-II, CD80 e CD86 (vedere la tabella dei materiali).
- Incubare l'ab coniugato con fluorescenza per 15 minuti a temperatura ambiente al buio.
- Lavare le cellule con 1 mL di PBS e centrifugare a temperatura ambiente per 5 minuti a 300 x g (freno normale).
NOTA: Se si utilizzano addominali non marcati, aggiungere addominali secondari coniugati fluorescenti e incubare al buio per 15 minuti secondo le istruzioni del produttore. Lavare le cellule con 1 mL di PBS e centrifugare a temperatura ambiente per 5 minuti a 300 x g (freno normale). - A tutte le microprovette aggiungere fino a 100 μL di PBS, risospendere le cellule in 300 μL di paraformaldeide al 2% (PFA 2%) e tenere le provette al buio a 4 °C fino all'acquisizione dei dati.
- Acquisire i dati utilizzando un citometro a flusso.
NOTA: Dopo la colorazione e la fissazione, i campioni possono essere acquisiti mediante citometria a flusso immediatamente o entro un periodo di 1 settimana. In questo caso, conservare le provette a 4 °C al buio.
5. Saggio di immunoassorbimento enzimatico (ELISA)
NOTA: In questo lavoro, la produzione di IFN-γ è stata misurata utilizzando il test ELISA seguendo le istruzioni del produttore (vedere la tabella dei materiali).
- Per rivestire la piastra in un tampone di rivestimento, diluire l'anticorpo di cattura (1:100, anticorpo di cattura in PBS), trasferire 100 μL di questa soluzione di lavoro in ciascun pozzetto e incubare per una notte a temperatura ambiente.
- Eliminare completamente l'anticorpo di cattura.
- Aggiungere il tampone bloccante (ad es. PBS + 2% BSA + 0,05% Tween20) e incubare per 1 ora a temperatura ambiente prima di rimuovere il tampone bloccante.
- Aggiungere lo standard e il campione, con la rispettiva miscela e diluizioni, e incubare per 2 ore a temperatura ambiente. Lavare cinque volte con tampone di lavaggio.
- Aggiungere l'anticorpo rivelatore biotinilato e incubare per 2 ore a temperatura ambiente, seguito da cinque lavaggi.
- Aggiungere poli-HRP-streptavidina-HS e incubare per 30 minuti a temperatura ambiente, seguiti da cinque lavaggi con tampone di lavaggio.
- Aggiungere il substrato TMB (vedere la tabella dei materiali) e incubare per un massimo di 60 minuti a temperatura ambiente, tenendo conto del sistema di prova utilizzato. Lavare cinque volte con tampone di lavaggio.
- Leggere i campioni su un lettore di micropiastre a 450 nm.
Risultati
Isolamento dei monociti e differenziamento dei monociti in mo-DC
In conformità con il protocollo, le PBMC umane sono state isolate dal buffy coat utilizzando la separazione del gradiente di densità con il mezzo del gradiente di densità e lavate accuratamente. Il blu di tripano è stato utilizzato per eseguire la conta delle cellule vitali il giorno dell'isolamento, come descritto in precedenza al punto 1.4.1. Successivamente, l'isolamento dei monociti CD14+ è stato effettuato attraverso la selezione positiva. Per raggiungere questo obiettivo, le PBMC sono state incubate con microsfere magnetiche contenenti un anticorpo che riconosce l'antigene CD14. I monociti CD14+ selezionati sono stati coltivati in un terreno integrato con GM-CSF e IL-4 per 5-6 giorni27 per differenziarsi in mo-DC immature (Figura 1A). La maturazione delle mo-DC può essere ottenuta applicando un cocktail di citochine, tra cui IL-6, IL-1β, TNF-α e PGE235 (Figura 1A).
Durante il processo di differenziamento, come risultato della stimolazione di IL-4 e GMCSF, ci si aspetta che il fenotipo cellulare cambi. I dati mostrano che le mo-DC perdono l'espressione del marcatore di superficie CD14, espresso principalmente dai monociti (Figura 1B), e acquisiscono un'espressione significativa di CD1a, un marcatore espresso dalle DC umane36,37. Le mo-DC ottengono anche una maggiore espressione di MHC-II (HLA-DR), una molecola presentante l'antigene espressa dalle DC umane e da altre cellule presentanti l'antigene38 (Figura 1B).
Contenuto di acido sialico sulla superficie cellulare
Il trattamento delle mo-DC con sialidasi riduce il contenuto di acido sialico sulla superficie delle mo-DC, il che può essere confermato dalla colorazione con le lectine, che sono proteine in grado di legarsi ai carboidrati39. Poiché l'enzima utilizzato rimuove sia gli acidi sialici α2,3 che α2,6 dalla superficie cellulare, le mo-DC sono state colorate con PNA, che riconosce l'antigene T-Galβ1-3GalNAcα1-Ser/Thr, nonché lectine MAA e SNA, che si legano rispettivamente a α2,3- e α2,6-sialica. L'efficacia del trattamento con sialidasi è stata valutata mediante citometria a flusso e microscopia confocale (Figura 2). Come mostrato nella Figura 2A, il trattamento con sialidasi ha ridotto significativamente il legame di MAA e SNA, aumentando al contempo la colorazione del PNA. La diminuzione della colorazione dell'SNA dopo il trattamento con sialidasi è stata ulteriormente confermata dall'analisi al microscopio confocale che ha mostrato una colorazione dell'SNA significativamente ridotta sulla superficie cellulare (Figura 2B).
Caratterizzazione funzionale delle mo-DC trattate con sialidasi
Per valutare in che modo il trattamento con sialidasi influisce sulle funzioni delle mo-DC, il livello di maturazione delle mo-DC è stato valutato dopo il trattamento con sialidasi. Come mostrato nella Figura 3A, il trattamento con sialidasi porta ad un aumento significativo dell'espressione delle molecole presentanti l'antigene MHC I e MHC II e dell'espressione delle molecole co-stimolatorie CD80 e CD86. Per valutare l'effetto della rimozione dell'acido sialico sulla capacità delle mo-DC di indurre risposte delle cellule T, sono state utilizzate mo-DC trattate con sialidasi caricate con lisati di cellule tumorali per innescare le cellule T autologhe (Figura 3). Successivamente, il profilo delle cellule T risultanti è stato caratterizzato in base alla loro capacità di secernere la citochina Th1 IFN-γ. Come mostrato nella Figura 3B, se confrontate con le cellule T innescate da mo-DC completamente sialilate, le cellule T innescate da mo-DC trattate con sialidasi secernono livelli significativamente più elevati di IFN-γ. Questi risultati suggeriscono che le mo-DC trattate con sialidasi hanno migliorato la capacità di innescare le cellule T autologhe.
Vitalità cellulare
Dopo il trattamento con sialidasi, è stato eseguito un test di vitalità per garantire che il trattamento non fosse citotossico per le cellule. Dopo il trattamento, le mo-DC sono state colorate con 7-AAD e Annexin V, per rilevare cellule non vitali e apoptotiche, e analizzate mediante citometria a flusso (Figura 4). I dati non mostrano differenze significative nella vitalità cellulare tra le cellule non trattate (Figura 4, pannello di sinistra) e quelle trattate con sialidasi (Figura 4, pannello di destra).
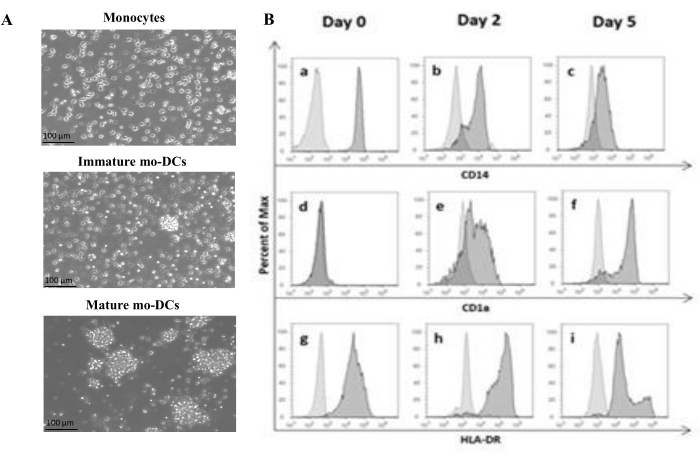
Figura 1: Differenziazione dei monociti isolati in mo-DC. (A) I monociti CD14+ sono stati isolati da buffy coat e coltivati ad una concentrazione di 1,3 x 106 cellule/mL a 37 °C. I monociti sono stati differenziati in terreno integrato con 750 U/mL di IL-4 e 1.000 U/mL di GM-CSF. Analisi microscopica della morfologia dei monociti isolati dal buffy coat umano al giorno 0 (immagine in alto). Mo-DC immaturi; le cellule sono state differenziate durante un periodo di 5 giorni utilizzando IL-4 e GM-CSF (immagine centrale). Le mo-DC mature sono state ottenute utilizzando citochine IL-6, IL-1β, TNF-α e PGE2 per 24 ore (immagine in basso). Barre della scala: 100 μm. (B) Le cellule sono state analizzate al giorno 0, al giorno 2 e al giorno 5 durante il periodo di differenziazione utilizzando la citometria a flusso. I seguenti anticorpi sono stati utilizzati per caratterizzare i marcatori di superficie cellulare: (a-c) CD14; (d-f) CD1a e (g-i) HLA-DR (MHC classe II). La figura mostra istogrammi rappresentativi di almeno tre saggi indipendenti. Il pannello (B) è stato modificato da Videira et al.40, brevetto WO2017002045A1. Fare clic qui per visualizzare una versione più grande di questa figura.
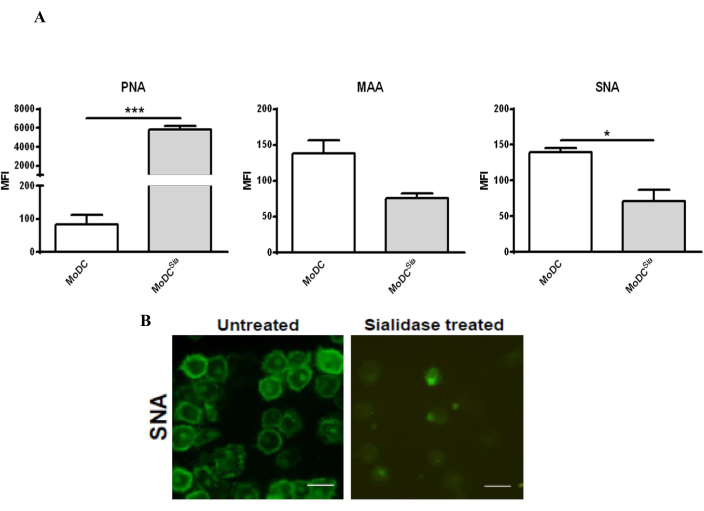
Figura 2: Trattamento con sialidasi di mo-DC umane per rimuovere gli acidi sialici legati a α2,6 e α2,3 dalla superficie cellulare. (A) Analisi delle mo-DC mediante citometria a flusso utilizzando la colorazione con lectina per testare l'efficacia del trattamento con sialidasi. Le mo-DC umane sono state trattate con sialidasi (barre grigie) o lasciate non trattate (barre bianche) e colorate con lectina SNA (che riconosce gli acidi [2,6]-sialici), lectina MAA (che riconosce gli acidi [2,3]-sialici) e lectina PNA (che riconosce l'antigene T-Galβ1-3GalNAcα1-Ser/Thr). I valori rappresentano l'intensità media di fluorescenza (MFI) di almeno tre saggi indipendenti. La significatività statistica è stata determinata utilizzando un test t accoppiato a due code (*P < 0,05 o ***P < 0,0001), riferendosi alla differenza tra le DC non trattate e quelle trattate con sialidasi. Il trattamento con sialidasi ha ridotto il legame con MAA e ha aumentato la colorazione di PNA nelle mo-DC umane, derivante dalla rimozione degli acidi sialici legati al α(2,3); la rimozione degli acidi sialici legati all'α(2,6) dopo il trattamento con sialidasi è stata rilevata da una diminuzione della colorazione SNA. (B) Microscopia confocale di mo-DC trattate con sialidasi e preparate su vetrini coprioggetti per l'osservazione. Una serie di immagini z-stack è stata raccolta da diverse cellule ed elaborata per includere l'intensità media della colorazione. Barre graduate: 20 μm. Il pannello (A) è stato modificato da Silva et al.30; Il pannello (B) è stato modificato da Silva et al.29. Fare clic qui per visualizzare una versione più grande di questa figura.
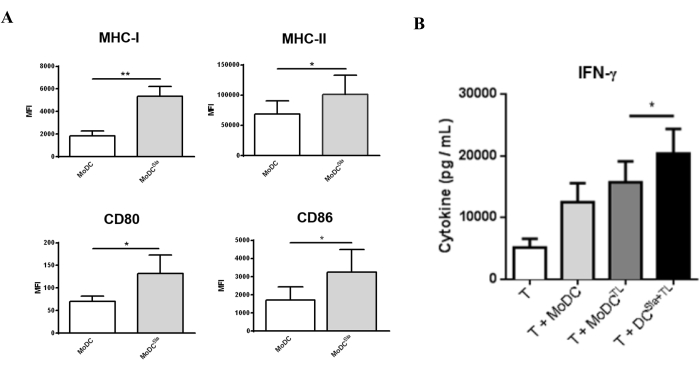
Figura 3: Trattamento con sialidasi delle mo-DC che induce una maggiore espressione dei marcatori di maturazione. (A) le mo-DC trattate con sialidasi hanno mostrato un fenotipo di maturazione più elevato rispetto alle mo-DC completamente sialilate. La citometria a flusso è stata utilizzata per valutare l'espressione di diversi marcatori di maturazione. Le mo-DC sono state trattate con sialidasi per 1 ora a 37 °C; i valori del grafico rappresentano l'intensità media di fluorescenza (MFI) (media ± SEM) di almeno tre saggi indipendenti. Le differenze statisticamente significative sono state calcolate utilizzando un t-test (*P < 0,05, **P < 0,01), riferendosi alla differenza tra le condizioni non trattate e quelle trattate con sialidasi. (B) Mo-DC umane desialilate caricate con antigeni tumorali interi hanno indotto risposte specifiche delle cellule T. Le mo-DC sono state trattate con sialidasi per 1 ora a 37 °C o non trattate, seguite da un carico con lisati MCF-7 (TL) come fonte di antigeni di cellule tumorali intere. La co-coltura tra mo-DC e cellule T autologhe è stata eseguita per 4-8 giorni in presenza di IL-2 (10 U/mL). Le cellule T innescate con mo-DC desialilate hanno mostrato una secrezione significativamente più elevata della citochina Th1, IFN-γ. A seguito della stimolazione delle cellule T con mo-DC, le citochine secrete nei surnatanti di co-coltura sono state misurate mediante ELISA (n = 7). I valori del grafico rappresentano la concentrazione (pg/mL) (media ± SEM). Le differenze statisticamente significative sono state calcolate utilizzando un test t (*P < 0,05). La figura è stata modificata da Silva et al.30. Fare clic qui per visualizzare una versione più grande di questa figura.
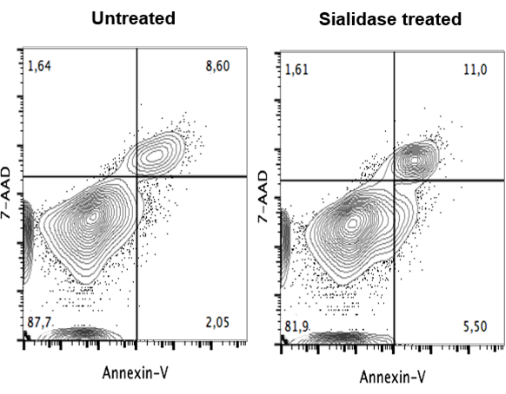
Figura 4: Mancanza di impatto del trattamento con sialidasi sulla vitalità delle mo-DC umane. Le mo-DC non trattate (pannello di sinistra) e le mo-DC trattate con sialidasi-(pannello di destra) sono state sottoposte a doppia colorazione con annessina V e 7-AAD e la colorazione è stata analizzata mediante citometria a flusso. I dati non hanno mostrato differenze significative nella vitalità cellulare tra le cellule non trattate e quelle trattate con sialidasi, suggerendo che le mo-DC possono tollerare il trattamento con sialidasi e rimanere vitali per esercitare la loro funzione immunologica. La figura è stata modificata da Silva et al.30. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Isolamento dei monociti
Questo manoscritto descrive un protocollo per generare mo-DC da monociti CD14+ isolati dall'uomo (Figura 1A), seguito dall'esecuzione di un trattamento con sialidasi per ridurre il contenuto di acido sialico sulla superficie di queste cellule.
Esistono diversi modi per ottenere le DC umane, ad esempio direttamente dal sangue o dai tessuti periferici o attraverso la differenziazione da precursori come le cellule staminali o i monociti. Ottenere DC differenziate dai monociti isolati dal sangue periferico è molto più semplice grazie alla facilità di ottenere elevate quantità di monociti rispetto ad altre fonti di DC41. Tuttavia, per ottenere un'alta percentuale di monociti isolati, è necessario seguire attentamente tutti i passaggi del protocollo. Ad esempio, il mezzo a gradiente di densità può essere tossico per le cellule e, per prevenire la morte cellulare, è necessario evitare il contatto prolungato delle cellule con il mezzo a gradiente di densità e lavare accuratamente le cellule. La manipolazione cellulare deve essere eseguita il più rapidamente possibile per evitare la perdita di vitalità cellulare. Dalle PBMC, i monociti possono essere isolati attraverso la selezione positiva utilizzando il metodo MACS (Magnetic-Activated Cell Sorting), che è una tecnologia adatta per produrre un numero elevato di monociti. Inoltre, rispetto ad altri metodi di selezione dei monociti, le mo-DC derivate da monociti isolati da MACS possiedono una maggiore capacità di stimolare l'attività antitumorale delle cellule T42. In questo protocollo, una volta isolati, i monociti sono stati incubati con IL-4 e GM-CSF per un periodo di 5-6 giorni per ottenere la differenziazione in mo-DC immature (Figura 1). I risultati hanno mostrato che morfologicamente (Figura 1A) e fenotipicamente (Figura 1B), i monociti isolati si differenziavano in mo-DC immature. Inoltre, durante la differenziazione, le mo-DC hanno perso l'espressione dei marcatori CD14 e hanno guadagnato l'espressione di CD1a e MHC-II (Figura 1B), che sono necessari per la presentazione dell'antigene alle cellule T.
L'isolamento e la differenziazione dei monociti in mo-DC sono limitazioni di questo protocollo. Il processo di isolamento è un passaggio delicato che deve essere eseguito con attenzione e rapidamente per evitare la morte cellulare, e questo passaggio deve essere eseguito ogni volta che sono necessarie mo-DC per un nuovo esperimento. Il processo di differenziazione richiede 5-6 giorni, il che rappresenta una difficoltà in termini di utilizzo di questo metodo per analisi ad alto rendimento. Ciononostante, il metodo di isolamento e l'utilizzo di citochine per differenziare le mo-DC sono utili per generare un elevato numero di mo-DC funzionali in vitro a scopo sperimentale. Le mo-DC generate in questo protocollo sono in grado di essere sottoposte a trattamento sialidasi, citometria a flusso, ELISA, microscopia confocale e così via, sottolineando così l'importanza e l'utilità di questo metodo30.
Trattamento con mo-DC immature e sialidasi
Le sialidasi, sono essenziali nella regolazione della sialilazione e sono responsabili della rimozione degli acidi sialici dai glicani della superficie cellulare. Nelle mo-DC, la rimozione dell'acido sialico da parte della sialidasi porta alla maturazione di queste cellule, che aumenta la presentazione dell'incrocio dell'antigene e la successiva attivazione delle cellule T e l'attività antitumorale30.
Le mo-DC umane immature mostrano un alto contenuto di acidi sialici legati alle α(2,6) e α(2,3) della superficie cellulare27 rispetto alle mo-DC mature31,43. Inoltre, la rimozione degli acidi sialici trattando le mo-DC con sialidasi migliora la maturazione delle DC 28,30,31. La sialidasi selezionata per questo esperimento proveniva dal batterio Clostridium perfringens. Tuttavia, anche altri organismi producono sialidasi, come i batteri Streptococcus pneumoniae, Vibrio cholerae o Salmonella typhimurium44, la sanguisuga Macrobdella decora45 e persino Homo sapiens46, e anche le sialidasi di questi organismi sono utilizzate sperimentalmente. Tuttavia, ogni sialidasi ha diverse specificità del substrato. Inoltre, l'uso dell'enzima sialidasi può avere i suoi limiti; ad esempio, la manipolazione delle mo-DC durante il trattamento può stimolare ulteriormente queste cellule. Inoltre, la quantità di sialidasi e i tempi di incubazione devono essere ottimizzati in base al tipo di cellule utilizzate e alla loro composizione in acido sialico. La rimozione dell'acido sialico non è un effetto permanente, ma piuttosto un fenomeno transitorio, perché la cellula ripristinerà il suo contenuto di acido sialico sulla superficie cellulare. Oltre alla sialidasi, ci sono altri metodi per ridurre le molecole di acido sialico sulla superficie delle cellule, come l'uso di inibitori della sialiltransferasi, knockout genici dei geni della sialiltransferasi o blocco metabolico dell'acido sialico utilizzando mimetici dell'acido sialico47,48,49. Ciononostante, questi metodi possono presentare effetti distinti sulle cellule e, oltre alla desialazione, deve essere considerata la vitalità cellulare. Il trattamento con enzima sialidasi è un metodo pratico per rimuovere in modo efficace e transitorio gli acidi sialici della superficie cellulare, mantenendo la vitalità cellulare.
In questo lavoro, la sialidasi è stata aggiunta alle mo-DC immature alla concentrazione di 500 mU/5 x 106 cellule/mL e le cellule sono state incubate a 37 °C per 60 minuti. Il trattamento è stato eseguito utilizzando RPMI-1640 senza siero per preservare la vitalità cellulare ed evitare qualsiasi interazione tra le molecole sialilate presenti nel siero30. Il trattamento con sialidasi può essere eseguito con altri tamponi oltre all'RPMI, come l'acetato di sodio 50 mM, pH 5,1 (nel caso di C. perfingens sialidasi) o PBS50,51,52. Ciononostante, RPMI-1640 è il terreno di coltura più comune per le DC in quanto mantiene costanti le condizioni sperimentali durante la procedura, evita di indurre la maturazione e riduce lo stress che può essere causato dai tamponi sialidasi o PBS 53,54,55,56. Dopo l'incubazione con sialidasi, è fondamentale lavare accuratamente le cellule con un terreno integrato con siero per garantire che la reazione enzimatica si sia arrestata. La presenza di molecole sialilate nel siero competerà come substrati per la sialidasi, assicurando così un rapido arresto della reazione.
Caratterizzazione di marcatori di superficie mediante citometria a flusso e microscopia confocale
Per la determinazione del profilo dell'acido sialico, nella sezione 3 del protocollo, abbiamo utilizzato la colorazione con lectina seguita da citometria a flusso e microscopia a scansione laser confocale. Per la procedura di colorazione cellulare, in entrambi i casi, le concentrazioni di lectina e le condizioni di incubazione sono state ottimizzate per evitare l'agglutinazione e la morte cellulare. È fondamentale eseguire l'incubazione a 4 °C in tamponi contenenti almeno il 2% di FBS o BSA per evitare il legame aspecifico delle lectine. In questo protocollo, RPMI-1640 contenente il 10% di FBS è stato utilizzato per mantenere costanti le condizioni sperimentali ed evitare lo stress cellulare. Per quanto riguarda la microscopia confocale, la fissazione delle cellule prima della colorazione è essenziale per preservare la morfologia, prevenire l'autolisi e mantenere l'antigenicità.
L'analisi del fenotipo mo-DC mediante citometria a flusso ha mostrato che le mo-DC trattate con sialidasi avevano una quantità significativamente maggiore di lectina PNA legata alla superficie cellulare rispetto alle lectine MMA e SNA, che è diminuita dopo il trattamento con sialidasi (Figura 2A). Come previsto, la colorazione del PNA è aumentata, poiché il PNA riconosce gli antigeni non sialilati, a differenza di MAA e SNA, che si legano direttamente rispettivamente agli acidi α2,3- e α2,6-sialici30. Questa colorazione conferma l'efficace rimozione degli acidi sialici dalla superficie cellulare utilizzando questo protocollo. Un altro metodo che può essere utilizzato per convalidare il trattamento e analizzare il contenuto di acido sialico sulla superficie cellulare è la colorazione della lectina seguita dalla microscopia confocale, come esemplificato nella Figura 2B.
Oltre ai primi esempi, esistono approcci alternativi per valutare e caratterizzare il contenuto di acido sialico, come il sondaggio della lectina mediante western blotting. Sono disponibili anche lectine alternative specifiche per l'acido sialico, come le Siglec, un gruppo di lectine che hanno una netta preferenza per i tipi di acido sialico e i legami57. Oltre all'utilizzo delle lectine in entrambe le tecniche (citometria a flusso, microscopia o western blot), è anche possibile caratterizzare il contenuto di acido sialico utilizzando anticorpi; Ad esempio, gli acidi α2,8-sialici possono essere valutati mediante anticorpi come il clone 735, che è specifico per l'acido polisialico58. Inoltre, dopo il trattamento con sialidasi, le cellule possono essere testate funzionalmente per la loro efficienza biologica o terapeutica valutando il loro fenotipo e la capacità di attivare le cellule T40. Infatti, come mostrato negli esempi forniti, le mo-DC trattate con sialidasi, hanno mostrato un fenotipo di maturazione più elevato, nonché un'elevata espressione di molecole presentanti l'antigene e co-stimolatorie.
Inoltre, le mo-DC trattate con sialidasi possono essere caricate con antigeni e co-coltivate con cellule T o altre cellule e quindi possono essere studiate per quanto riguarda il fenotipo, il profilo di secrezione di citochine o altre caratteristiche. Nell'esempio fornito, i dati mostrano che le mo-DC trattate con sialidasi possono essere caricate con antigeni tumorali e quindi utilizzate per attivare le cellule T. In effetti, le cellule T risultanti hanno mostrato un aumento della secrezione di IFN-γ, che è in accordo con i precedenti rapporti sull'effetto della carenza di acido sialico sull'aumento della capacità delle mo-DC di attivare le cellule T 27,28,29,30,31.
In conclusione, questo protocollo mostra un metodo fattibile, praticabile e pratico per generare mo-DC per la manipolazione del contenuto di acido sialico mediante trattamento con sialidasi. Questo protocollo presenta una metodologia che può servire a diversi scopi e applicazioni. Questo metodo non solo può avere un ruolo cruciale nella comprensione del ruolo degli acidi sialici nella maturazione e nella risposta delle cellule immunitarie, ma può anche essere utilizzato come strumento immunomodulatorio.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti o altri conflitti di interesse.
Riconoscimenti
Gli autori riconoscono il finanziamento della Commissione europea GLYCOTwinning GA 101079417 e EJPRD/0001/2020 EU 825575; la Fundação para a Ciência e Tecnologia (FCT) Portugal, nell'ambito delle sovvenzioni FCT 2022.04607.PTDC, UIDP/04378/2020, UIDB/04378/2020 (UCIBIO) e LA/P/0140/2020 (i4HB). FCT-NOVA. e Stemmatters sono stati finanziati anche dal Fundo Europeu de Desenvolvimento Regional (FEDER), attraverso il Programa Operacional Regional do Norte (Norte 2020) per il SI I& Progetto DT DCMatters (NORTE-01-0247-FEDER-047212). Riconosciamo la struttura Biolabs presso FCT-NOVA e GLYCOVID NOVA Saude.
Materiali
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | AstiK’s | CTGP-E15-050 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase |
| 24-well plate | Greiner Bio-one | 662 160 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase |
| 50 mL conical tube | AstiK’s | CTGP-E50-050 | Obtaining Monocyte-derived Dendritic Cells |
| 7-Aminoactinomycin D (7-AAD) | BioLegend | 420404 | Obtaining Monocyte-derived Dendritic Cells |
| Annexin V | Immunotools | 31490013 | Obtaining Monocyte-derived Dendritic Cells |
| Attune Acoustic Focusing Flow Cytometer | Thermo Fisher Scientific | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs | |
| BSA | Sigma - Aldrich | A3294-100G | Obtaining Monocyte-derived Dendritic Cells; Determination of Sialic Acid Profile |
| CD14 (Monoclonal TÜK4) | Miltenyi Biotec | 130-080-701 | Obtaining Monocyte-derived Dendritic Cells |
| CD80 | Immunotools | 21270803 | Maturation Profiling of mo-DCs |
| CD86 | Immunotools | 21480863 | Maturation Profiling of mo-DCs |
| Cell counting slides and trypan blue | EVE | EVS-050 | Obtaining Monocyte-derived Dendritic Cells |
| Centrifuge | Eppendorf | 5430 R | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Density gradient medium (Histopaque) | Sigma - Aldrich | 10771-100ML | Obtaining Monocyte-derived Dendritic Cells |
| EDTA | Gibco, ThermoFisher | 15400054 | Obtaining Monocyte-derived Dendritic Cells |
| Elisa kit (IFN-γ) | Immunotools | 31673539 | Maturation Profiling of mo-DCs |
| EVE automated cell count | NanoEntek | 10027-452 | Obtaining Monocyte-derived Dendritic Cells |
| Fetal bovine serum (FBS) | Gibco | 10500064 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile |
| Granulocyte-macrophage colony-stimulating factor (GM-CSF) | Miltenyi Biotec | 130-093-864 | Obtaining Monocyte-derived Dendritic Cells |
| Human CD14 microbeads (Immunomagnetic beads) | Miltenyi Biotec | 130-050-201 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-1β | Sigma - Aldrich | I9401 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-4 | Miltenyi Biotec | 130-093-919 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-6 | Sigma - Aldrich | SRP3096 | Obtaining Monocyte-derived Dendritic Cells |
| L-glutamine | Gibco | A2916801 | Obtaining Monocyte-derived Dendritic Cells |
| LS column and plunger | Miltenyi Biotec | 130-042-401 | Obtaining Monocyte-derived Dendritic Cells |
| Maackia amurensis (MAA) lectin (MAA lectin - Biotinylated) | Vector labs | B-1265-1 | Determination of Sialic Acid Profile |
| MHC-I (HLA-ABC) | Immunotools | 21159033 | Maturation Profiling of mo-DCs |
| MHC-II (HLA-DR) | Immunostep | HLADRA-100T | Maturation Profiling of mo-DCs |
| Microtubes | AstiK’s | PCRP-E015-500 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Neuraminidase (Sialidase) | Roche | 11585886001 | Treatment of Cells with Sialidase |
| Non-essential amino acids (NEAA) | Gibco | 11140-050 | Obtaining Monocyte-derived Dendritic Cells |
| Paraformaldehyde (PFA 2%) | Polysciences Europe | 25085-1 | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Paraformaldehyde (PFA 4%) | Biotium | 22023 | Determination of Sialic Acid Profile |
| Pasteur pipettes | Labbox | PIPP-003-500 | Obtaining Monocyte-derived Dendritic Cells |
| Peanut (Arachis hypogaea) Agglutinin (PNA) lectin (PNA lectin - FITC) | Vector labs | FL-1071 | Determination of Sialic Acid Profile |
| Penicillin/streptomycin | Gibco | 15140163 | Obtaining Monocyte-derived Dendritic Cells |
| Phosphate Buffered Saline (PBS) | NZYTech | MB18201 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Prostaglandin E2 (PGE2) | Sigma - Aldrich | P0409 | Obtaining Monocyte-derived Dendritic Cells |
| RBC lysis buffer | BioLegend | 420302 | Obtaining Monocyte-derived Dendritic Cells |
| RPMI-1640 medium (containing 11.1 mM glucose) | Gibco | 31870074 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile |
| Sambucus nigra lectin (SNA lectin - Biotinylated) | Vector labs | B-1305-2 | Determination of Sialic Acid Profile |
| Sambucus nigra lectin (SNA lectin - FITC) | Vector labs | FL-1301-2 | Determination of Sialic Acid Profile |
| Sodium pyruvate | Thermofisher | 11360-070 | Obtaining Monocyte-derived Dendritic Cells |
| SpectroMax190 | Molecular Devices | Maturation Profiling of mo-DCs | |
| Streptavidin-PE | BioLegend | 405203 | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Tetramethylbenzidine (TMB) | Sigma - Aldrich | T0440 | Maturation Profiling of mo-DCs |
| Tumour necrosis factor-α (TNF-α) | Sigma - Aldrich | H8916 | Obtaining Monocyte-derived Dendritic Cells |
| Zeiss LSM710 confocal microscope | Zeiss | Determination of Sialic Acid Profile |
Riferimenti
- Varki, A., Gagneux, P. Multifarious roles of sialic acids in immunity. Annals of the New York Academy of Sciences. 1253, 16-36 (2012).
- Bochner, B. S., Zimmermann, N. Role of Siglecs and related glycan-binding proteins in immune responses and immunoregulation. The Journal of Allergy and Clinical Immunology. 135 (3), 598-608 (2015).
- Smith, B. A. H., Bertozzi, C. R. The clinical impact of glycobiology: Targeting selectins, Siglecs and mammalian glycans. Nature Reviews Drug Discovery. 20, 217-243 (2021).
- Schauer, R. Sialic acids as regulators of molecular and cellular interactions. Current Opinion in Structural Biology. 19 (5), 507-514 (2009).
- Manhardt, C. T., Punch, P. R., Dougher, C. W. L., Lau, J. T. Y. Extrinsic sialylation is dynamically regulated by systemic triggers in vivo. Journal of Biological Chemistry. 292 (33), 13514-13520 (2017).
- Cabral, M. G., et al. Human dendritic cells contain cell surface sialyltransferase activity. Immunology Letters. 131 (1), 89-96 (2010).
- Bordron, A., et al. Hyposialylation must be considered to develop future therapies in autoimmune diseases. International Journal of Molecular Sciences. 22 (7), 3402(2021).
- Julien, S., Videira, P. A., Delannoy, P. Sialyl-Tn in cancer: (How) did we miss the target. Biomolecules. 2 (4), 435-466 (2012).
- Munkley, J. Aberrant sialylation in cancer: Therapeutic opportunities. Cancers. 14 (17), 4248(2022).
- Dennis, J. W., Laferte, S., Waghorne, C., Breitman, M. L., Kerbel, R. S. S1-6 Branching of Asn-linked oligosaccharides is directly associated with metastasis. Science. 236 (4801), 582-585 (1987).
- Pinho, S. S., Reis, C. A. Glycosylation in cancer: Mechanisms and clinical implications. Nature Reviews Cancer. 15 (9), 540-555 (2015).
- Manni, M., Läubli, H. Targeting glyco-immune checkpoints for cancer therapy. Expert Opinion on Biological Therapy. 21 (8), 1063-1071 (2021).
- Sjögren, J., Lood, R., Nägeli, A. On enzymatic remodeling of IgG glycosylation; Unique tools with broad applications. Glycobiology. 30 (4), 254-267 (2020).
- Trastoy, B., et al. Sculpting therapeutic monoclonal antibody N-glycans using endoglycosidases. Current Opinion in Structural Biology. 72, 248-259 (2022).
- Pascoal, C., et al. Sialyl LewisX/A and cytokeratin crosstalk in triple negative breast cancer. Cancers. 15 (3), 731(2023).
- von Itzstein, M., et al. Rational design of potent sialidase-based inhibitors of influenza virus replication. Nature. 363 (6428), 418-423 (1993).
- Gray, M. A., et al. Targeted glycan degradation potentiates the anticancer immune response in vivo. Nature Chemical Biology. 16 (12), 1376-1384 (2020).
- Fernandes, Â, et al. Glycans as shapers of tumour microenvironment: A sweet driver of T-cell-mediated anti-tumour immune response. Immunology. 168 (2), 217-232 (2023).
- Togayachi, A., et al. Polylactosamine on glycoproteins influences basal levels of lymphocyte and macrophage activation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15829-15834 (2007).
- Park, D. D. Resident and elicited murine macrophages differ in expression of their glycomes and glycan-binding proteins. Cell Chemical Biology. 28 (4), 567-582 (2021).
- Steinman, R. M. Dendritic cells and immune-based therapies. Experimental Hematology. 24 (8), 859-862 (1996).
- Sabado, R. L., Bhardwaj, N. Directing dendritic cell immunotherapy towards successful cancer treatment. Immunotherapy. 2 (1), 37-56 (2010).
- Pardoll, D. M. The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews Cancer. 12 (4), 252-264 (2012).
- Steinman, R. M., Banchereau, J. Taking dendritic cells into medicine. Nature. 449 (7161), 419-426 (2007).
- So-Rosillo, R., Small, E. J. Sipuleucel-T (APC8015) for prostate cancer. Expert Review of Anticancer Therapy. 6 (9), 1163-1167 (2006).
- Cheever, M. A., Higano, C. S. PROVENGE (Sipuleucel-T) in prostate cancer: The first FDA-approved therapeutic cancer vaccine. Clinical Cancer Research. 17 (11), 3520-3526 (2011).
- Videira, P. A., et al. Surface α2-3- and α2-6-sialylation of human monocytes and derived dendritic cells and its influence on endocytosis. Glycoconjugate Journal. 25 (3), 259-268 (2008).
- Cabral, M. G., et al. The phagocytic capacity and immunological potency of human dendritic cells is improved by α2,6-sialic acid deficiency. Immunology. 138 (3), 235-245 (2013).
- Silva, Z., et al. MHC class I stability is modulated by cell surface sialylation in human dendritic cells. Pharmaceutics. 12 (3), 249(2020).
- Silva, M., et al. Sialic acid removal from dendritic cells improves antigen cross-presentation and boosts anti-tumor immune responses. Oncotarget. 7 (27), 41053-41066 (2016).
- Crespo, H. J., et al. Effect of sialic acid loss on dendritic cell maturation. Immunology. 128, 621-631 (2009).
- Council of Europe. Guide to the Preparation, Use and Quality Assurance of Blood Components. Council of Europe. , Strasbourg, France. (2017).
- LS Columns. Miltenyi Biotec. , Available from: https://www.miltenyibiotec.com/US-en/products/Is-columns.html#130-042-401 (2012).
- Nair, S., Archer, G. E., Tedder, T. F. Isolation and generation of human dendritic cells. Current Protocols in Immunology. 07, Unit 7.32 (2012).
- Wu, X., Xu, F., Liu, J., Wang, G. Comparative study of dendritic cells matured by using IL-1β, IL-6, TNF-α and prostaglandins E2 for different time span. Experimental and Therapeutic Medicine. 14 (2), 1389-1394 (2017).
- Naeim, F., Nagesh Rao, P., Song, S., Phan, R. Chapter 2 - Principles of Immunophenotyping. Atlas of Hematopathology. , Academic Press. Cambridge, MA. 29-56 (2018).
- Cernadas, M., Lu, J., Watts, G., Brenner, M. B. CD1a expression defines an interleukin-12 producing population of human dendritic cells. Clinical and Experimental Immunology. 155, 523-533 (2009).
- Santambrogio, L., Strominger, J. L. The ins and outs of MHC class II proteins in dendritic cells. Immunity. 25 (6), 857-859 (2006).
- Raposo, C. D., Canelas, A. B., Barros, M. T. Human lectins, their carbohydrate affinities and where to find them. Biomolecules. 11 (2), 188(2021).
- Videira, P. A. Q., et al. Patent WO2017002045. A viable cell population, method for production and uses thereof. Portugal patent. , Universidade NOVA de Lisboa. Lisbon, Portugal. (2017).
- Bai, L., Feuerer, M., Beckhove, P., Umansky, V., Schirrmacher, V. Generation of dendritic cells from human bone marrow mononuclear cells: Advantages for clinical application in comparison to peripheral blood monocyte derived cells. International Journal of Oncology. 20 (2), 247-253 (2002).
- Marques, G. S., Silva, Z., Videira, P. A. Antitumor efficacy of human monocyte-derived dendritic cells: Comparing effects of two monocyte isolation methods. Biological Procedures Online. 20, 4(2018).
- Bax, M., et al. Dendritic cell maturation results in pronounced changes in glycan expression affecting recognition by Siglecs and galectins. Journal of Immunology. 179 (12), 8216-8224 (2007).
- Chinoy, Z. S., Montembault, E., Moremen, K. W., Royou, A., Friscourt, F. Impacting bacterial sialidase activity by incorporating bioorthogonal chemical reporters onto mammalian cell-surface sialosides. ACS Chemical Biology. 16 (11), 2307-2314 (2021).
- Chou, M. -Y., Li, S. -C., Li, Y. -T. Cloning and expression of sialidase L, a NeuAcα2→3Gal-specific sialidase from the leech, Macrobdella decora. Journal of Biological Chemistry. 271 (32), 19219-19224 (1996).
- Crespo, H. J., Lau, J. T. Y., Videira, P. A. Dendritic cells: A spot on sialic acid. Frontiers in Immunology. 4, 491(2013).
- Büll, C. Metabolic sialic acid blockade lowers the activation threshold of moDCs for TLR stimulation. Immunology & Cell Biology. 95 (4), 408-415 (2017).
- Ohmi, Y., et al. Majority of alpha2,6-sialylated glycans in the adult mouse brain exist in O -glycans: SALSA-MS analysis for knockout mice of alpha2,6-sialyltransferase genes. Glycobiology. 31 (5), 557-570 (2021).
- Chung, C., et al. Integrated genome and protein editing swaps α-2,6 sialylation for α-2,3 sialic acid on recombinant antibodies from CHO. Biotechnology Journal. 12 (2), 1600502(2017).
- Hyvärinen, S., Meri, S., Jokiranta, T. S. Disturbed sialic acid recognition on endothelial cells and platelets in complement attack causes atypical hemolytic uremic syndrome. Blood. 127 (22), 2701-2710 (2016).
- Powell, L. D., Whiteheart, S. W., Hart, G. W. Cell surface sialic acid influences tumor cell recognition in the mixed lymphocyte reaction. Journal of Immunology. 139, 262-270 (1987).
- Corfield, A. P., Higa, H., Paulson, J. C., Schauer, R. The specificity of viral and bacterial sialidases for α(2-3)- and α(2-6)-linked sialic acids in glycoproteins. Biochimica et Biophysica Acta - Protein Structure and Molecular Enzymology. 744 (2), 121-126 (1983).
- Tkachenko, N., Wojas, K., Tabarkiewicz, J., Rolinski, J. Generation of dendritic cells from human peripheral blood monocytes - Comparison of different culture media. Folia Histochemica et Cytobiologica. 43, 25-30 (2005).
- Kim, S. J., et al. Human CD141+ dendritic cells generated from adult peripheral blood monocytes. Cytotherapy. 21 (10), 1049-1063 (2019).
- Calmeiro, J., et al. In-depth analysis of the impact of different serum-free media on the production of clinical grade dendritic cells for cancer immunotherapy. Frontiers in Immunology. 11, 593363(2021).
- Stamatos, N. M., et al. LPS-induced cytokine production in human dendritic cells is regulated by sialidase activity. Journal of Leukocyte Biology. 88 (6), 1227-1239 (2010).
- Lehmann, F., Tiralongo, E., Tiralongo, J. Sialic acid-specific lectins: Occurrence, specificity and function. Cellular and Molecular Life Sciences. 63 (12), 1331-1354 (2006).
- Frosch, M., Görgen, I., Boulnois, G. J., Timmis, K. N., Bitter-Suermann, D. NZB mouse system for production of monoclonal antibodies to weak bacterial antigens: Isolation of an IgG antibody to the polysaccharide capsules of Escherichia coli K1 and group B meningococci. Proceedings of the National Academy of Sciences of the United States of America. 82 (4), 1194-1198 (1985).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon