Method Article
具有不同唾液酸化表型的单核细胞来源的树突状细胞的生成
摘要
提出了一种独特的、全面的方案,使用唾液酸酶处理从分离的外周血单核细胞 (PBMC) 中产生去唾液酸化的人单核细胞来源的树突状细胞 (mo-DC)。此外,还描述了评估mo-DCs的表型和功能表征以及评估唾液酸酶处理如何改善mo-DCs成熟水平的方法。
摘要
唾液酸是带负电荷的单糖,通常存在于细胞表面聚糖的末端。由于它们的亲水性和生物物理特性,它们参与了许多生物过程,例如免疫反应的调节、自身和非自身抗原的识别、碳水化合物-蛋白质相互作用等。唾液酸的细胞含量受唾液酸酶调节,唾液酸酶催化唾液酸残基的去除。几项研究表明,唾液聚糖通过与免疫细胞上的 顺 式和 反式 抑制性Siglec受体结合,在监测免疫监视方面至关重要。同样,癌症中的糖免疫检查点正在成为开发免疫疗法的关键靶点。此外,树突状细胞 (DC) 被认为是免疫疗法的重要组成部分,尤其是在癌症研究中,因为它们作为专业抗原呈递细胞 (APC) 的独特作用以及触发适应性免疫反应和产生免疫记忆的能力。然而,DC的功能取决于它们的完全成熟。未成熟的DC与成熟的DC具有相反的功能,唾液酸含量高,这进一步抑制了它们的成熟水平。这下调了未成熟DC激活T细胞的能力,导致免疫反应受损。因此,从人DC的细胞表面去除唾液酸会诱导其成熟,从而增加MHC分子的表达和抗原呈递。此外,它可以恢复共刺激分子和IL-12的表达,使DC具有更高的能力,使T细胞向Th1表型极化,并特异性激活细胞毒性T细胞以杀死肿瘤细胞。因此,唾液酸已成为DC的关键调节剂,并被用作推进其治疗用途的新靶点。本研究提供了一种用唾液酸酶处理 体外 单核细胞来源的 DC 的独特方法,旨在生成具有不同细胞表面唾液酸表型和定制成熟和共刺激特征的 DC 群体。
引言
携带唾液酸的聚糖(唾液酸聚糖)因其免疫调节作用而引起了人们的极大兴趣。单糖唾液酸以 N-乙酰神经氨酸的形式在人类中最为普遍,是凝集素的基本配体,在免疫学中具有公认的作用,例如选择素和 Siglecs。这些凝集素可识别同一细胞 (cis) 或不同细胞 (trans) 上的唾液聚糖,并在宿主-病原体相互作用以及各种生理和病理细胞活动中发挥重要作用 1,2,3。此外,由于唾液酸占据细胞表面糖缀合物的末端位置,它可以隐藏潜在的结构,从而通过非特异性排斥作用或阻碍其他凝集素的检测来抑制细胞间接触4。细胞内各种唾液酸转移酶(转移唾液酸)和唾液酸酶(裂解唾液酸键)的活性决定了表面存在的唾液酸的量。此外,宿主或病原体表达的可溶性唾液酸转移酶和唾液酸酶可以外在地改变细胞表面唾液酸的量5,6。
异常唾液酸化是几种病理状况的特征。在自身免疫性疾病中,唾液酸化会导致不受限制的免疫激活和器官损伤,因为唾液酸有助于区分自身抗原和调节炎症反应7。相反,唾液酸化会导致唾液酸聚糖的过度表达,例如唾液酸-Tn、唾液酸-路易斯抗原、多唾液酸和神经节苷脂,这构成了某些癌症的标志 8,9。高唾液酸化还取决于特定酶的表达增加,例如 N-乙酰氨基葡萄糖基转移酶 (GNT-V),该酶产生高唾液酸化的三和/或四触角 N-连接聚糖,这些聚糖与癌症生长和转移有关10。唾液酸含量还调节蛋白质的稳定性和功能,这是相关致癌参与者发挥作用的关键11。因此,唾液酸化增加可以促进肿瘤的发展、转移、耐药性和免疫逃避。此外,唾液聚糖的上调使肿瘤能够与免疫细胞上的抑制性Siglec受体相互作用,避免免疫监视。因此,唾液聚糖现在被认为是糖免疫检查点和有吸引力的治疗靶点。例如,Siglec免疫轴的抑制剂已经处于早期临床试验阶段,因为免疫细胞受体Siglec(唾液酸结合的免疫球蛋白样LECtin)起免疫抑制作用12。
酶已被用于调节聚糖谱,作为研究或治疗策略的工具13,14。唾液酸酶已被用于改变癌细胞恶性肿瘤,因为唾液酸化聚糖(如唾液酸 Lewis X)对细胞迁移和癌症转移至关重要15。同时,阻碍唾液酸裂解的唾液酸酶抑制剂已进入治疗唾液酸依赖性病毒感染的临床16。最近,由于唾液酸作为配体在免疫轴中的关键作用,唾液酸调节引起了人们的进一步关注,这意味着它们提供了减少癌症从免疫反应中逃逸的新方法。2022 年诺贝尔奖获得者 Bertozzi 和她的团队贡献了几种策略,这些策略选择性地切割不同的唾液聚糖并改善抗癌免疫反应,进一步加强了这种兴趣17.因此,基于唾液酸酶的策略代表了一种很有前途的糖免疫检查点治疗方式。免疫系统细胞的糖表型取决于细胞的类型及其活化状态。关于 T 细胞,聚糖在 T 细胞发育和胸腺细胞选择、T 细胞活性、分化和增殖的病理生理学步骤中起着关键作用18。例如,糖蛋白上的多乳糖胺会影响 B 淋巴细胞和 T 淋巴细胞的基础水平以及巨噬细胞活化19。在巨噬细胞中,不同的聚糖表达模式在巨噬细胞募集到肿瘤微环境 (TME) 中起重要作用20。因此,免疫细胞对O-连接和N-连接聚糖的表达可作为治疗癌症和自身免疫性疾病的潜在糖生物标志物。
树突状细胞 (DC) 是特异性抗原呈递细胞,具有触发免疫反应(如抗癌免疫)的独特能力21。DC 必须上调其抗原呈递 MHC 分子以将抗原呈递给 T 细胞(信号 1)、共刺激分子以激活 T 细胞(信号 2)和促炎细胞因子(如 IL-12)以触发 1 型辅助性 T 细胞增殖(信号 3)22。由此产生的免疫特征受到严格监管,检查点对于防止健康细胞受到攻击至关重要。由于DC可以刺激针对肿瘤细胞的各种免疫反应,因此它们被用作基于细胞的疫苗,并且大量临床研究已经证明了它们的潜在益处23,24。在 FDA 于 2010 年批准了第一种基于 DC 的疫苗25,26 之后,已经开发了许多其他基于 DC 的疫苗。基于DC的疫苗主要在体外生产并给患者接种,以引发针对肿瘤的免疫反应。然而,成熟不足或短暂是目前限制DCs临床疗效的因素之一,这意味着必须使用昂贵的细胞因子混合物。如果没有足够的成熟度,DCs在临床情况下就无法激活T细胞。相反,DC 表达免疫检查点并触发耐受性免疫反应,阻止细胞毒性 T 细胞对肿瘤细胞起作用。
人类 DC 具有高度唾液酸化的表面,这种唾液酸化在成熟时和整体免疫反应期间减少27。DC的成熟可以通过用唾液酸酶消除这些唾液酸来诱导。由于 NF-kB 转录因子易位到细胞核 6,28,脱唾液酸化极大地上调了各种细胞因子,包括 IL-12。此外,脱唾液酸化通过 MHC-I 和抗肿瘤免疫反应改善抗原交叉呈递29,30。因此,在DC唾液酸化中起主要作用的唾液酸转移酶ST3Gal.l和ST6Gal.l的敲除在小鼠DC中产生更成熟的表型31。
唾液酸酶治疗提供了一种刺激 DC 成熟各个方面的方法,包括增加抗原呈递、增加共刺激分子的表达和增加细胞因子的产生,以解决上述缺点并使 DC 能够引起有效的反应。本文介绍了一种通过使用细菌唾液酸酶获得可行的去唾液酸化人 DC 的程序。去唾液酸化的 DC 显示出改善的成熟曲线,可用作细胞模型以增强 体外抗肿瘤免疫反应。DC 从血液单核细胞中获得,然后在细胞因子白细胞介素-4 (IL-4) 和粒细胞巨噬细胞集落刺激因子 (GM-CSF) 存在下在 体外 分化。这项工作还描述了基于凝集素的细胞表面唾液酸分析方法以及对DC成熟水平进行免疫表型分析的方法。这里描述的程序可用于对其他细胞类型进行脱水,从而提供了一种研究唾液聚糖作用的方法,唾液聚糖是重要的糖免疫检查点,与免疫调节相关。
研究方案
在获得书面和知情的献血者同意后,从健康的匿名献血者的血沉棕黄层中分离出细胞,这些献血者是由国家血库葡萄牙桑格和移植研究所(IPST)提供的志愿者(IMP.74.52.4)。根据关于人体组织和细胞捐赠、采购、测试、加工、保存、储存和分发的质量和安全标准的指令 2004/23/EC(葡萄牙法律 22/2007,6 月 29 日),伦理委员会 (IPST 30072015) 批准了血液使用。IPST生物样本库将血液收集并储存在含有柠檬酸磷酸葡萄糖(CPD)的特定塑料收集袋中,CPD是一种保存和抗凝固溶液,以保持血液的完整性,直到处理。为了评估生物材料是否适合操作,对 梅毒螺旋体、乙型肝炎病毒 (HBV)、丙型肝炎病毒 (HCV) 和人类免疫缺陷病毒 (HIV) 进行血清学控制,所有这些都必须为阴性。在本研究中,IPST 提供了血沉棕黄层用于调查目的,以及有关采集日期、血清学结果、血型和供体年龄的信息32.血沉棕黄层在室温下最多可以保存 1 天。
1. 获得单核细胞来源的树突状细胞
注意:值得一提的是,当人类外周血纵时,应考虑特定的通用安全预防措施和适当的材料处置。在开始之前,确认所有必要的试剂和材料都已准备好并可以使用。
- 外周血单核细胞的分离
- 进入人类血沉棕黄的外套。
注:血沉棕黄层是来自通过白细胞分离术32 收集的血液的副产品,通过离心富集在白细胞中。所有步骤均在垂直流动室生物安全柜(BSC)中进行。 - 用手术刀切开密封的出口管,打开血沉棕黄涂层包装,然后将内容物转移到 50 mL 管中。每个无菌 15 mL 锥形管转移 7 mL 血沉棕黄层样品,并加入 6 mL 磷酸盐缓冲盐水溶液 (PBS) 进行初步洗涤。为了从大量红细胞 (RBC) 和血浆中清除样品,该初始洗涤步骤是必要的,以便使用密度梯度培养基优化样品进行梯度分离(参见 材料表)。
- 在室温下以1,100× g 离心管在具有摆动转子并关闭制动器的离心机中离心10分钟(参见 材料表)。
- 离心后,用巴斯德移液管收集白细胞悬浮液(血浆和红细胞之间的白环),并将其转移到新的无菌 15 mL 锥形管中。
- 用 PBS 填充至 10 mL 的白细胞悬浮液以帮助下一步分离,并通过轻轻上下移液进行混合。
- 制备密度梯度培养基(密度:1.077 g/mL)溶液:将 3 mL 密度梯度培养基放入新的无菌 15 mL 锥形管中,使其加热至室温。
- 将5mL稀释的白细胞悬浮液(来自步骤1.1.5)加入含有密度梯度培养基(5:3)的锥形管中,以进行密度梯度分离。使用管壁缓慢、逐滴添加样品,以避免干扰密度梯度介质。
- 梯度分离:在室温下以1,100× g 离心密度梯度培养基悬浮液在带有摆动转子并关闭制动器的离心机中离心30分钟。
- 离心后,小心地从离心机中取出锥形管。在此步骤之后,可以看到一系列定义明确的层,包括以下内容,从底部开始:红色层(红细胞和粒细胞)、密度梯度培养基、外周血单核细胞 (PBMC) 的薄层苍白和血浆。
- 使用巴斯德移液管收集薄层PBMC,并避免吸收下方的密度梯度介质或上方过多的血浆。将 PBMC 样品放入新的 50 mL 锥形管中,用 PBS 填充至 25 mL,然后轻轻上下移液混合样品。
- 将样品在室温下以600× g (正常制动器)离心10分钟以洗去残留的细胞和碎片,并通过小心地倒置试管弃去上清液。
注意:如果红细胞污染过多,当细胞沉淀或血沉棕黄层未完全分离或呈红色时,建议裂解剩余的红细胞。在这种情况下,加入 5 mL RBC 裂解缓冲液(参见 材料表),充分混合,孵育 5 分钟。用PBS填充至40mL,在室温下以900× g (正常制动)离心样品10分钟,并通过小心地倒置试管弃去上清液。 - 用PBS填充样品至10mL,并取等分试样对细胞进行计数。为了除去血小板,在室温下以400× g (正常制动)离心5分钟,并通过小心地倒置管弃去上清液。
注意:如果有大量血小板,则在室温下以200× g (正常制动)离心10分钟两次。通过在计数细胞的同时可视化样品来识别血小板。
- 进入人类血沉棕黄的外套。
- 通过免疫磁性分离分离单核细胞
- 通过用 0.5% 牛血清白蛋白 (BSA) 和 2 mM 乙二胺四乙酸 (EDTA) 补充 PBS 来制备微珠缓冲液。通过过滤(0.2μm)对溶液进行灭菌,并将缓冲液冷藏(2-8°C)。
- 通过磁激活细胞分选 (MACS) 进行单核细胞 CD14+ 分离。
- 使用自动细胞计数仪(步骤1.4.1)进行细胞计数后,计算所需的适当体积的微珠缓冲液和CD14免疫磁珠(参见材料表)。确保这些溶液保持在冰上。每 1 x 10 7 个细胞加入 80 μL 微珠缓冲液,每 1 x 107 个细胞加入 20 μL CD14 微珠。
- 将细胞沉淀重悬于先前确定的体积中,并在4°C(2-8°C)下孵育15分钟。
注意:如果需要验证PBMC样品中的单核细胞水平,请使用染色抗体(例如CD14 [单克隆TÜK4])进行流式细胞术分析。按照步骤3.2了解流式细胞术分析的详细信息。 - 每 1 x 107 个细胞加入 1-2 mL 微珠缓冲液,在室温下以 600 x g (正常制动)离心 10 分钟以除去未结合的珠子,并通过小心倒置管弃去上清液。
- 准备 LS 色谱柱。LS 色谱柱包含铁磁球,当放置在磁铁上时,可以积极、温和地保留磁性标记的细胞33。使用前,将 LS 色谱柱(参见 材料表)放在磁铁上,用 3 mL 微珠缓冲液冲洗,不要完全干燥,然后立即进行下一步。
注意:切勿在操作过程中让色谱柱变干,以免影响产量。 - 将细胞沉淀重悬于每 1 x 108 个细胞的 500 μL 微珠缓冲液中。如果细胞数高于 4 x 108,请使用 40 μm 细胞过滤器以防止细胞聚集。
- 将细胞悬液加入色谱柱入口,在色谱柱出口下方放置一个15 mL锥形管以收集阴性细胞部分,并用3 mL微珠缓冲液洗涤色谱柱三次。阴性部分包括未用 CD14 珠收集的细胞(即 CD14− 细胞)。
- 最终洗涤后,从磁铁上取下色谱柱,将其置于无菌的 15 mL 锥形管上,将 5 mL 微珠缓冲液移液到色谱柱入口中,然后立即将注射器柱塞插入色谱柱入口并推动以分配目标细胞。
- 收集磁性标记的细胞(CD14 + 细胞),并取等分试样对细胞进行计数,如步骤1.4.1所述。
- 将两种细胞组分,CD14 - 和CD14 +细胞在室温下以600×g离心10分钟(正常制动)。弃去上清液,保留CD14 +级分用于后续步骤,并储存CD14 - 级分用于将来的测定,如必要时共培养测定。如果需要,CD14 - 部分的细胞可以在-80°C下冷冻保存在RPMI-1640 20%FBS和10%DMSO中。
- 单核细胞分化为树突状细胞
- 通过用 10% 胎牛血清 (FBS)、1% 的 2 mM L-谷氨酰胺、1% 非必需氨基酸 (NEAA)、1% 丙酮酸钠和 1% 的 100 μg/mL 青霉素/链霉素补充 RPMI-1640 基础培养基(含有 11.1 mM 葡萄糖)来制备完整的 RPMI-1640 培养基(参见 材料表)。
- 将单核细胞分化为 mo-DC,这发生在 ~5-6 天内。
- 计算获得的CD14 + 细胞数量所需的培养基体积,并根据以下实验设置铺板细胞。
注:在该方案中,细胞以1.3×106 个细胞/ mL的浓度接种,以考虑细胞死亡和测量误差,并通过将1,000 U / mL GM-CSF和750 U / mL IL-4(参见 材料表)加入完全培养基中并充分混合来制备培养基。 - 向CD14+ 细胞中加入适当体积的培养基,并用巴斯德移液管上下移液重悬。将细胞悬液铺入24孔板(每孔:1.3×106 个细胞/ mL)中,并在37°C的培养箱中用5%CO2孵育。
- 更换培养基,每 2-3 天补充一次新鲜细胞因子(通常每个分化过程一次)。为此,小心地去除一半的培养基,不要干扰细胞。如前面步骤1.3.2.1的注释所述,加入相同量的具有适当浓度的细胞因子的新鲜培养基,并孵育剩余的分化期。
注意:DCs从单核细胞中分化出来时,是松散贴壁的细胞。完全分化的未成熟 mo-DC 是纺锤形、自由漂浮且贴壁松散的细胞。细胞也可能形成莲座,尤其是在成熟时34. - 为了在分化后收集细胞,使用微量移液管将整个细胞悬浮液转移到无菌锥形管中,并用PBS洗涤板的孔两次,轻轻敲击底部(图1A)。
注意:避免收集大量贴壁细胞,因为这些可能是巨噬细胞。为避免细胞成熟或活化不当,请确保格外小心地处理细胞。 - 在室温下以180× g (正常制动)离心细胞10分钟以除去任何残留物或死细胞,并重悬于适当的培养基/缓冲液中用于实验设置。
- 计算获得的CD14 + 细胞数量所需的培养基体积,并根据以下实验设置铺板细胞。
- 执行 mo-DC 的成熟。
- 如果需要 mo-DC 的成熟,使用孔板或烧瓶,同时考虑到先前使用的细胞浓度示例(1.3 x 10 6 个细胞/mL),并通过补充含有 IL-1β (10 ng/mL)、IL-6 (1,000 U/mL)、前列腺素 E2 (PGE2; 1 μg/mL) 的细胞因子混合物来施用细胞因子混合物, 和肿瘤坏死因子-α (TNF-α; 10 ng/mL)(参见 材料表)。将细胞在37°C下用5%CO2 孵育24小时或48小时。
- 细胞计数和活力
- 进行细胞计数和台盼蓝染色。
- 要确定细胞数和细胞悬液的活力,请从细胞悬液中取出 10 μL 的等分试样,并将其与 10 μL 台盼蓝(1:1 稀释度)混合。
- 取 10 μL 先前的混合物,然后根据制造商的说明使用自动细胞计数仪计数细胞数。
注意:如果细胞浓度过高,请稀释等分试样,细胞计数后,在计算中考虑稀释因子。 - 调整实验设置的细胞数和培养基/缓冲液。
- 确定细胞活力和凋亡30.
注:在这项工作中,在唾液酸酶处理(第2节)之后,进行活力测定。- 用5μg/ mL 7-氨基放线菌素D(7-AAD)和膜联蛋白V染色mo-DC,并根据制造商的说明测定细胞凋亡(参见 材料表)。
- 使用流式细胞术分析结果29,30。
- 进行细胞计数和台盼蓝染色。
2.用唾液酸酶处理细胞
注意:分化成mo-DC后,在第六天,细胞准备好进行唾液酸酶处理测定。
- 考虑到所需的实验设置,从 1.3 x 10 6 个细胞/孔的 24 孔板的 10 个孔中收集 ~10 x 106 mo-DC,并将它们转移到新的无菌 15 mL 锥形管中。
注意:假设一些细胞损失;通常,在此阶段,发现的浓度为 1.3 x 106 个细胞/mL,因为 mo-DC 及其前体在分化为 mo-DC 的过程中不会增殖并经历 20% 的活力损失。 - 在室温下以300× g 离心5-7分钟(正常制动),弃去上清液以除去死细胞和碎片。
- 加入 10 mL RPMI-1640 培养基(含 11.1 mM 葡萄糖),在室温下以 300 x g (正常制动)离心 4 分钟,弃去上清液,加入 2 mL RPMI-1640,并充分混合。
- 将 RPMI-1640 中的 1 mL 细胞放入新的无菌微管 #1 和 #2 中;每个微管将包含大约 5 x 106 个细胞。
- 向微管 #1 中加入 500 mU 产 气荚膜梭菌唾液酸酶(参见 材料表)。向微管 #2 中加入模拟处理的唾液酸酶,这是一种阴性对照,以确认观察到的效果是否与唾液酸去除直接相关,而不是由于伪影。模拟处理的唾液酸酶是热灭活的唾液酸酶,其通过在100°C下将酶煮沸20分钟而获得。
- 在37°C孵育60分钟。
- 孵育后,将细胞放入新的无菌 15 mL 锥形管中,编号相同,#1 和 #2。向两个试管中加入约 4 mL 完全 RPMI-1640 培养基(含有 10% FBS)以停止酶促反应。
- 在室温下以300× g (正常制动)离心4分钟,弃去上清液。
- 向每个试管中加入 5 mL 完全 RPMI-1640 培养基,每孔铺板 1 mL 细胞。
3. 唾液酸谱的测定
- 凝集素染色
- 收集细胞并在室温下以300× g (正常制动)洗涤5分钟。
- 将细胞重悬于RPMI-1640 + 10%FBS中,并将细胞(100,000 / 100μL)分配到微管中。
- 使用浓度为0.01mg / mL的每种凝集素在RPMI-1640中用10%FBS进行流式细胞术染色: 接骨木 (SNA)凝集素,花生凝集素(PNA)凝集素和 Maackia amurensis (MAA)凝集素(参见 材料表)。在4°C孵育30分钟。
- 用含有10%FBS或10%BSA的1mL PBS洗涤细胞,并在室温下以300× g 离心4分钟(正常制动)。
- 向用生物素化凝集素染色的细胞中,加入0.0005mg / mL链霉亲和素-PE(参见 材料表),并在室温下在黑暗中孵育15分钟。用 1 mL PBS 洗涤细胞,并在室温下以 300 x g (正常制动)离心 4 分钟。
- 弃去上清液,向每个试管中加入 300 μL 2% 多聚甲醛 (PFA 2%)。保护管免受光照,如果需要,储存在4°C直至数据采集。
- 在样品制备后1周内使用流式细胞仪采集数据29,30。
- 流式细胞术
- 将细胞重悬于 1 mL PBS 中,并用流式细胞仪采集样品以立即采集数据。
- 对于延迟的数据采集,重悬于300μL的2%PFA中,并在1周内采集数据。
- 激光共聚焦扫描显微镜
- 将细胞铺在直径为12mm的聚赖氨酸涂层玻璃盖玻片上,并在室温下孵育5分钟。
- 在室温下以100× g (正常制动)离心盖玻片1分钟以促进细胞粘附。
- 在室温下用4%PFA固定30分钟,然后用PBS中的1%BSA洗涤。
- 使用FITC偶联的SNA凝集素(0.01mg / mL)对细胞表面的α2,6-连接的唾液酸进行染色(参见 材料表)。
- 在共聚焦显微镜上获取图像(参见 材料表)。
- Z-stack处理后,选择具有代表性的共聚焦截面图像。
- 使用校正后的总细胞荧光 (CTCF) 分析量化染色强度。
注:CTCF = 积分密度 − (所选细胞面积 × 背景读数的平均荧光)29.
4. mo-DCs的成熟谱
- 抗体染色和流式细胞术
- 收集目标细胞的新样本以进行抗体染色。在室温下以300× g (正常制动)洗涤细胞5分钟,并将细胞分布到微管中(每管100,000个细胞)。
- 使用所需的抗体(ab),MHI-I,MHC-II,CD80和CD86进行流式细胞术染色(参见 材料表)。
- 将荧光偶联的抗体在室温下在黑暗中孵育15分钟。
- 用 1 mL PBS 洗涤细胞,并在室温下以 300 x g(正常制动)离心 5 分钟。
注意:如果使用未标记的抗体,请加入荧光偶联的二级抗体,并按照制造商的说明在黑暗中孵育15分钟。用 1 mL PBS 洗涤细胞,并在室温下以 300 x g (正常制动器)离心 5 分钟。 - 向所有微管中加入多达100μL的PBS,将细胞重悬于300μL的2%多聚甲醛(PFA 2%)中,并将试管保持在4°C的黑暗中,直到数据采集。
- 使用流式细胞仪采集数据。
注:染色和固定后,可以立即或在1周内通过流式细胞术获取样品。在这种情况下,将试管在4°C的黑暗中储存。
5. 酶联免疫吸附试验(ELISA)
注:在这项工作中,按照制造商的说明使用ELISA测定法测量IFN-γ的产生(参见 材料表)。
- 为了在包被缓冲液中包被板,稀释捕获抗体(1:100,PBS中的捕获抗体),将100μL该工作溶液转移到每个孔中,并在室温下孵育过夜。
- 完全丢弃捕获抗体。
- 加入封闭缓冲液(例如,PBS + 2% BSA + 0.05% Tween20),并在室温下孵育 1 小时,然后去除封闭缓冲液。
- 加入标准品和样品,以及各自的混合物和稀释液,并在室温下孵育2小时。用洗涤缓冲液洗涤五次。
- 加入生物素化检测抗体,在室温下孵育2小时,然后洗涤5次。
- 加入聚-HRP-链霉亲和素-HS,在室温下孵育30分钟,然后用洗涤缓冲液洗涤五次。
- 加入TMB底物(参见 材料表),并在室温下孵育长达60分钟,同时考虑到所使用的测试系统。用洗涤缓冲液洗涤五次。
- 在酶标仪上以 450 nm 的波长读取样品。
结果
单核细胞分离和单核细胞分化为mo-DC
根据该方案,使用密度梯度分离和密度梯度培养基从血沉棕黄层中分离人PBMC并彻底洗涤。如前面步骤1.4.1所述,使用台盼蓝在分离当天进行活细胞计数。随后,通过阳性选择进行CD14+ 单核细胞分离。为了实现这一点,将PBMC与含有识别CD14抗原的抗体的磁珠一起孵育。将选定的CD14 + 单核细胞在补充有GM-CSF和IL-4的培养基中培养5-6天27 ,以分化为未成熟的mo-DC(图1A)。mo-DC的成熟可以通过应用细胞因子的混合物获得,包括IL-6,IL-1β,TNF-α和PGE235 (图1A)。
在分化过程中,由于IL-4和GMCSF的刺激,细胞表型有望发生变化。数据显示,mo-DC失去主要由单核细胞表达的表面标志物CD14的表达(图1B),并获得CD1a的显着表达,CD1a是由人DC表达的标志物36,37。mo-DCs还获得更高的MHC-II(HLA-DR)表达,这是一种由人DCs和其他抗原呈递细胞表达的抗原呈递分子38(图1B)。
细胞表面唾液酸含量
用唾液酸酶处理mo-DCs会降低mo-DCs表面的唾液酸含量,这可以通过用凝集素染色来证实,凝集素是能够与碳水化合物结合的蛋白质39。由于所用酶从细胞表面去除α2,3和α2,6-连接的唾液酸,因此用PNA染色mo-DCs,PNA可识别T抗原-Galβ1-3GalNAcα1-Ser/Thr,以及MAA和SNA凝集素,它们分别与α2,3-和α2,6-唾液酸结合。通过流式细胞术和共聚焦显微镜评估唾液酸酶处理的有效性(图2)。 如图2A所示,唾液酸酶处理显著降低了MAA和SNA的结合,同时增加了PNA染色。通过共聚焦显微镜分析进一步证实了唾液酸酶处理后SNA染色的减少,显示细胞表面的SNA染色显着减少(图2B)。
唾液酸酶处理的mo-DC的功能表征
为了评估唾液酸酶处理如何影响mo-DC功能,评估唾液酸酶处理后mo-DCs的成熟水平。 如图3A所示,唾液酸酶处理导致抗原呈递分子MHC I和MHC II的表达以及CD80和CD86共刺激分子的表达显着增加。为了评估唾液酸去除对mo-DC诱导T细胞反应能力的影响,使用唾液酸酶处理的装有肿瘤细胞裂解物的mo-DC来引发自体T细胞(图3)。接下来,根据其分泌Th1细胞因子IFN-γ的能力来表征所得T细胞的特征。 如图3B所示,与由完全唾液酸化的mo-DCs引发的T细胞相比,由唾液酸酶处理的mo-DC引发的T细胞分泌的IFN-γ水平显著更高。这些结果表明,唾液酸酶处理的mo-DC具有提高启动自体T细胞的能力。
细胞活力
唾液酸酶处理后,进行活力测定以确保处理对细胞无细胞毒性。处理后,用7-AAD和膜联蛋白V染色mo-DC以检测非活细胞和凋亡细胞,并通过流式细胞术进行分析(图4)。数据显示,未经处理的细胞(图4,左图)和唾液酸酶处理的细胞(图4,右图)之间的细胞活力没有显着差异。
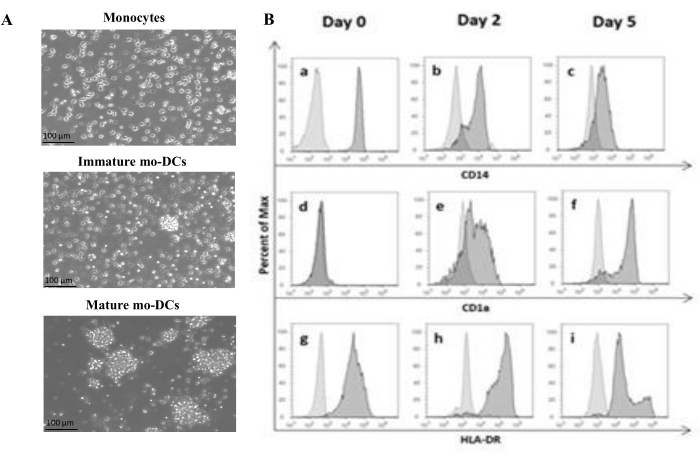
图1:分离的单核细胞分化为mo-DC。 (A)从血沉棕黄层中分离CD14 +单核细胞,并在37°C下以1.3×106个细胞/ mL的浓度培养。 单核细胞在补充有 750 U/mL IL-4 和 1,000 U/mL GM-CSF 的培养基中分化。第 0 天从人血沉棕黄层中分离出的单核细胞形态的显微分析(上图)。未成熟的mo-DC;使用 IL-4 和 GM-CSF 在 5 天内分化细胞(中图)。通过使用 IL-6、IL-1β、TNF-α 和 PGE2 细胞因子 24 小时获得成熟的 mo-DC(下图)。比例尺:100μm。 (B) 在整个分化期的第 0 天、第 2 天和第 5 天使用流式细胞术分析细胞。以下抗体用于表征细胞表面标志物:(a-c) CD14;(d-f)CD1a 和 (g-i) HLA-DR(MHC II 类)。该图显示了至少三种独立检测的代表性直方图。图(B)已修改自Videira等人40,专利WO2017002045A1。请点击这里查看此图的较大版本.
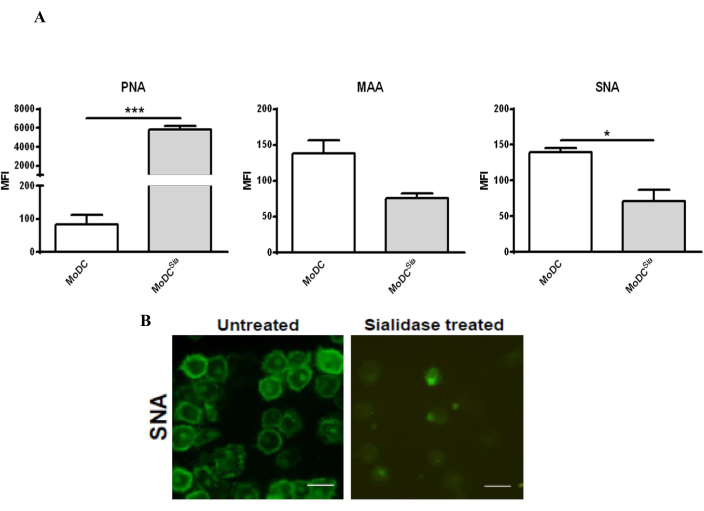
图 2:人 mo-DC 的唾液酸酶处理,以去除细胞表面的 α2,6- 和 α2,3-连接的唾液酸。 (A) 使用凝集素染色通过流式细胞术分析 mo-DCs,以测试唾液酸酶处理的疗效。人 mo-DC 用唾液酸酶(灰色条)处理或未经处理(白色条)并染色 SNA 凝集素(识别 [2,6]-唾液酸)、MAA 凝集素(识别 [2,3]-唾液酸)和 PNA 凝集素(识别 T 抗原-Galβ1-3GalNAcα1-Ser/Thr)。这些值代表至少三个独立测定的平均荧光强度 (MFI)。使用双尾配对 t 检验(*P < 0.05 或 ***P < 0.0001)确定统计学意义,指的是未处理和唾液酸酶处理的 DC 之间的差异。 唾液酸酶处理降低了人 mo-DC 中的 MAA 结合并增加了 PNA 染色,这是由于去除了 α(2,3) 连接的唾液酸;唾液酸酶处理后α(2,6)-连接的唾液酸的去除通过SNA染色的减少来检测。(B)用唾液酸酶处理并在盖玻片上制备用于观察的mo-DC的共聚焦显微镜。从不同的细胞收集一系列 z 堆栈图像并进行处理以包括平均染色强度。比例尺:20μm。图(A)已根据Silva等人30;图(B)已根据Silva等人29修改而来。请点击这里查看此图的较大版本.
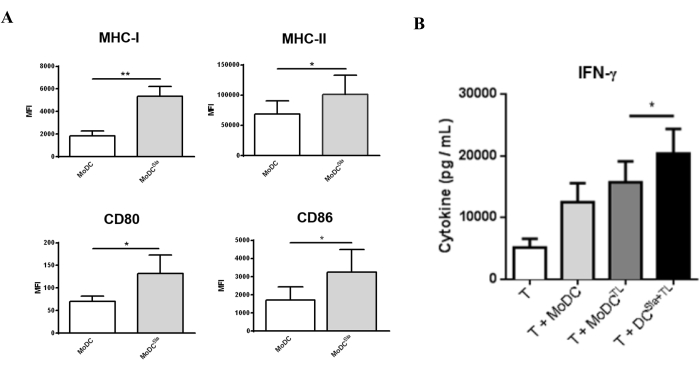
图 3:唾液酸酶处理诱导成熟标志物表达更高的 mo-DC。 (A)用唾液酸酶处理的mo-DCs比完全唾液酸化的mo-DCs表现出更高的成熟表型。流式细胞术检测几种成熟标志物的表达。在37°C下用唾液酸酶处理mo-DCs1小时;图形值表示至少三个独立测定的平均荧光强度 (MFI)(平均 ± SEM)。使用t检验(*P < 0.05,**P < 0.01)计算具有统计学意义的差异,指的是未处理和唾液酸酶处理条件之间的差异。(B) 负载全肿瘤抗原的去唾液酸化人 mo-DC 诱导特异性 T 细胞反应。在37°C下用唾液酸酶处理mo-DCs1小时或未处理,然后用MCF-7裂解物(TL)加载作为整个肿瘤细胞抗原的来源。在 IL-2 (10 U/mL) 存在下进行 mo-DC 和自体 T 细胞之间的共培养 4-8 天。用去唾液酸化 mo-DC 引发的 T 细胞显示 Th1 细胞因子 IFN-γ 的分泌显着增加。在用mo-DC刺激T细胞后,通过ELISA测量分泌到共培养上清液中的细胞因子(n = 7)。图形值表示浓度 (pg/mL)(SEM ±平均值)。使用t检验计算具有统计学意义的差异(*P < 0.05)。该图由Silva等人修改而来,30。请点击这里查看此图的较大版本.
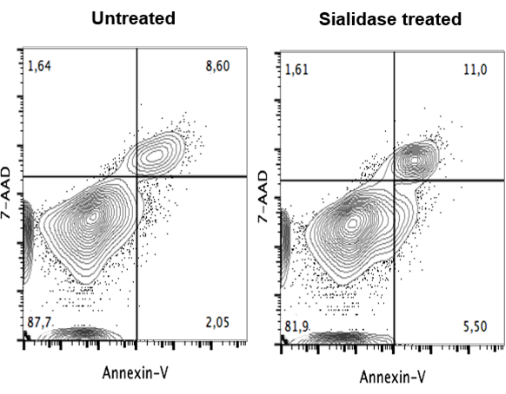
图 4:唾液酸酶处理对人类 mo-DC 的活力缺乏影响。 未处理的mo-DCs(左图)和唾液酸酶处理的mo-DCs(右图)用膜联蛋白V和7-AAD双重染色,并通过流式细胞术分析染色。数据显示,未经处理的细胞和经唾液酸酶处理的细胞之间的细胞活力没有显着差异,表明mo-DC可以耐受唾液酸酶处理,并保持活力以发挥其免疫功能。该图由Silva等人修改而来,30。 请点击这里查看此图的较大版本.
讨论
单核细胞分离
本手稿描述了从人分离的单核细胞CD14 + 中产生mo-DC的方案(图1A),然后进行唾液酸酶处理以降低这些细胞表面的唾液酸含量。
有多种方法可以获得人类 DC,例如直接从外周血或组织中获取,或通过从干细胞或单核细胞等前体分化。由于与其他 DC 来源相比,更容易获得大量单核细胞,因此获得从外周血中分离的单核细胞分化的 DC 要简单得多41。尽管如此,为了获得高百分比的分离单核细胞,必须仔细遵循所有方案步骤。例如,密度梯度培养基可能对细胞有毒,为了防止细胞死亡,必须避免细胞长时间接触密度梯度培养基并彻底清洗细胞。必须尽快进行细胞操作,以避免细胞活力的丧失。从PBMC中,可以使用磁激活细胞分选(MACS)方法通过阳性选择分离单核细胞,这是一种产生大量单核细胞的合适技术。此外,与其他单核细胞选择方法相比,源自 MACS 分离的单核细胞的 mo-DC 具有更强的刺激抗肿瘤 T 细胞活性的能力42。在该方案中,一旦分离,将单核细胞与IL-4和GM-CSF一起孵育5-6天,以实现分化为未成熟的mo-DCs(图1)。结果表明,在形态学(图1A)和表型(图1B)上,分离的单核细胞分化为未成熟的mo-DC。此外,在整个分化过程中,mo-DC失去了CD14标志物的表达,并获得了CD1a和MHC-II的表达(图1B),这是抗原呈递给T细胞所必需的。
这种将单核细胞分离和分化为mo-DC是该协议的局限性。分离过程是一个敏感步骤,必须谨慎而迅速地执行以避免细胞死亡,并且每次需要mo-DC进行新实验时也必须完成此步骤。分化过程需要 5-6 天,这给采用这种方法进行高通量分析带来了困难。尽管如此,分离方法和使用细胞因子区分mo-DCs对于 在体外 产生大量功能性mo-DCs用于实验目的非常有用。在该方案中产生的mo-DC能够进行唾液酸酶处理,流式细胞术,ELISA,共聚焦显微镜等,从而强调了该方法30的重要性和有用性。
未成熟的mo-DCs和唾液酸酶治疗
唾液酸酶在唾液酸化调节中是必不可少的,负责从细胞表面聚糖中去除唾液酸。在 mo-DC 中,唾液酸酶去除唾液酸导致这些细胞成熟,从而增加抗原交叉呈递和随后的 T 细胞活化和抗肿瘤活性30。
与成熟的 mo-DC 31,43 相比,未成熟的人 mo-DC 显示出高含量的细胞表面 α(2,6)- 和 α(2,3) 连接的唾液酸27。此外,通过用唾液酸酶处理 mo-DC 去除唾液酸可改善 DC 的成熟 28,30,31。为本实验选择的唾液酸酶来自产气荚膜梭菌。 尽管如此,其他生物体也会产生唾液酸酶,例如细菌肺炎链球菌、霍乱弧菌或鼠伤寒沙门氏菌44、水蛭 Macrobdella decora45,甚至智人46,这些生物体的唾液酸酶也被用于实验。然而,每种唾液酸酶具有不同的底物特异性。此外,使用唾液酸酶可能有其局限性;例如,在治疗过程中操纵mo-DCs可以进一步刺激这些细胞。此外,唾液酸酶的量和孵育时间必须根据所使用的细胞类型及其唾液酸组成进行优化。唾液酸的去除不是永久性的效果,而是一种瞬时现象,因为细胞会恢复其细胞表面的唾液酸含量。除唾液酸酶外,还有其他方法可以减少细胞表面的唾液酸分子,例如使用唾液酸转移酶抑制剂、唾液酸转移酶基因的基因敲除或使用唾液酸模拟物对唾液酸进行代谢阻断47,48,49。尽管如此,这些方法可能对细胞产生不同的影响,除了脱唾液化外,还必须考虑细胞活力。唾液酸酶处理是一种实用的方法,可在保持细胞活力的同时有效和瞬时去除细胞表面唾液酸。
在这项工作中,将唾液酸酶以500 mU/5 x 106个细胞/mL的浓度添加到未成熟的mo-DC中,并将细胞在37°C下孵育60分钟。使用不含血清的 RPMI-1640 进行治疗,以保持细胞活力并避免血清中存在的唾液酸化分子之间的任何相互作用30。唾液酸酶处理可以使用RPMI以外的其他缓冲液进行,例如50mM乙酸钠,pH 5.1(在Perfingens唾液酸梭菌的情况下)或PBS50,51,52。尽管如此,RPMI-1640 是 DC 最常见的培养基,因为它在手术过程中保持恒定的实验条件,避免诱导成熟,并减少唾液酸酶缓冲液或 PBS53、54、55、56 可能引起的任何应激。与唾液酸酶孵育后,用补充血清的培养基彻底洗涤细胞以保证酶反应停止至关重要。血清中唾液酸化分子的存在将作为唾液酸酶的底物竞争,从而确保快速停止反应。
通过流式细胞术和共聚焦显微镜表征表面标记物
为了测定唾液酸谱,在方案第3节中,我们利用凝集素染色,然后进行流式细胞术和共聚焦激光扫描显微镜。对于细胞染色程序,在这两种情况下,凝集素浓度和孵育条件都进行了优化,以避免细胞凝集和死亡。在含有至少2%FBS或BSA的缓冲液中在4°C下进行孵育至关重要,以避免凝集素的非特异性结合。在该协议中,使用含有10%FBS的RPMI-1640来维持恒定的实验条件并避免细胞应激。关于共聚焦显微镜,染色前固定细胞对于保持形态、防止自溶和保持抗原性至关重要。
通过流式细胞术对mo-DC表型的分析表明,与MMA和SNA凝集素相比,唾液酸酶处理的mo-DCs与细胞表面结合的PNA凝集素量显着更高,在唾液酸酶处理后减少(图2A)。正如预期的那样,PNA染色增加,因为PNA识别非唾液酸化抗原,而MAA和SNA分别直接与α2,3-和α2,6-唾液酸结合30。该染色证实了使用该方案从细胞表面有效去除唾液酸。另一种可用于验证处理和分析细胞表面唾液酸含量的方法是凝集素染色,然后进行共聚焦显微镜,如图 2B所示。
除上述示例外,还存在评估和表征唾液酸含量的替代方法,例如通过蛋白质印迹法进行凝集素探测。也可以使用替代的唾液酸特异性凝集素,例如 Siglecs,这是一组对唾液酸类型和键具有明显偏好的凝集素57。除了在任一技术(流式细胞术、显微镜或蛋白质印迹)中使用凝集素外,还可以使用抗体表征唾液酸含量;例如,α2,8-唾液酸可以通过克隆 735 等抗体进行评估,克隆 735 对聚唾液酸58 具有特异性。此外,在唾液酸酶处理后,可以通过评估细胞的表型和激活 T 细胞的能力40 来测试细胞的生物学或治疗效率。事实上,如提供的示例所示,唾液酸酶处理的 mo-DC 显示出更高的成熟表型,以及抗原呈递和共刺激分子的表达升高。
此外,唾液酸酶处理的mo-DC可以装载抗原并与T细胞或其他细胞共培养,然后可以研究表型、细胞因子分泌谱或其他特征。在提供的示例中,数据显示唾液酸酶处理的mo-DC可以加载肿瘤抗原,然后用于激活T细胞。事实上,由此产生的 T 细胞显示出 IFN-γ 分泌增加,这与先前关于唾液酸缺乏对提高 mo-DC 激活 T 细胞能力的影响的报道一致 27,28,29,30,31。
总之,该协议显示了一种可行的,可行和实用的方法,通过用唾液酸酶处理产生用于唾液酸含量操纵的mo-DC。该协议提出了一种可以用于不同目的和应用的方法。该方法不仅可以在理解唾液酸在免疫细胞成熟和反应中的作用方面发挥关键作用,还可以用作免疫调节工具。
披露声明
作者声明不存在相互竞争的经济利益或其他利益冲突。
致谢
作者感谢欧盟委员会 GLYCOTwinning GA 101079417 和 EJPRD/0001/2020 EU 825575 的资助;葡萄牙科学和技术基金会 (FCT),根据 FCT 2022.04607.PTDC、UIDP/04378/2020、UIDB/04378/2020 (UCIBIO) 和 LA/P/0140/2020 (i4HB) 赠款。FCT-新星。和 Stemmatters 还由 Fundo Europeu de Desenvolvimento Regional (FEDER) 通过 Programa Operacional Regional do Norte (Norte 2020) 为 SI I&DT DCMatters 项目 (NORTE-01-0247-FEDER-047212)。我们承认 FCT-NOVA 和 GLYCOVID NOVA Saude 的 Biolabs 设施。
材料
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | AstiK’s | CTGP-E15-050 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase |
| 24-well plate | Greiner Bio-one | 662 160 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase |
| 50 mL conical tube | AstiK’s | CTGP-E50-050 | Obtaining Monocyte-derived Dendritic Cells |
| 7-Aminoactinomycin D (7-AAD) | BioLegend | 420404 | Obtaining Monocyte-derived Dendritic Cells |
| Annexin V | Immunotools | 31490013 | Obtaining Monocyte-derived Dendritic Cells |
| Attune Acoustic Focusing Flow Cytometer | Thermo Fisher Scientific | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs | |
| BSA | Sigma - Aldrich | A3294-100G | Obtaining Monocyte-derived Dendritic Cells; Determination of Sialic Acid Profile |
| CD14 (Monoclonal TÜK4) | Miltenyi Biotec | 130-080-701 | Obtaining Monocyte-derived Dendritic Cells |
| CD80 | Immunotools | 21270803 | Maturation Profiling of mo-DCs |
| CD86 | Immunotools | 21480863 | Maturation Profiling of mo-DCs |
| Cell counting slides and trypan blue | EVE | EVS-050 | Obtaining Monocyte-derived Dendritic Cells |
| Centrifuge | Eppendorf | 5430 R | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Density gradient medium (Histopaque) | Sigma - Aldrich | 10771-100ML | Obtaining Monocyte-derived Dendritic Cells |
| EDTA | Gibco, ThermoFisher | 15400054 | Obtaining Monocyte-derived Dendritic Cells |
| Elisa kit (IFN-γ) | Immunotools | 31673539 | Maturation Profiling of mo-DCs |
| EVE automated cell count | NanoEntek | 10027-452 | Obtaining Monocyte-derived Dendritic Cells |
| Fetal bovine serum (FBS) | Gibco | 10500064 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile |
| Granulocyte-macrophage colony-stimulating factor (GM-CSF) | Miltenyi Biotec | 130-093-864 | Obtaining Monocyte-derived Dendritic Cells |
| Human CD14 microbeads (Immunomagnetic beads) | Miltenyi Biotec | 130-050-201 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-1β | Sigma - Aldrich | I9401 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-4 | Miltenyi Biotec | 130-093-919 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-6 | Sigma - Aldrich | SRP3096 | Obtaining Monocyte-derived Dendritic Cells |
| L-glutamine | Gibco | A2916801 | Obtaining Monocyte-derived Dendritic Cells |
| LS column and plunger | Miltenyi Biotec | 130-042-401 | Obtaining Monocyte-derived Dendritic Cells |
| Maackia amurensis (MAA) lectin (MAA lectin - Biotinylated) | Vector labs | B-1265-1 | Determination of Sialic Acid Profile |
| MHC-I (HLA-ABC) | Immunotools | 21159033 | Maturation Profiling of mo-DCs |
| MHC-II (HLA-DR) | Immunostep | HLADRA-100T | Maturation Profiling of mo-DCs |
| Microtubes | AstiK’s | PCRP-E015-500 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Neuraminidase (Sialidase) | Roche | 11585886001 | Treatment of Cells with Sialidase |
| Non-essential amino acids (NEAA) | Gibco | 11140-050 | Obtaining Monocyte-derived Dendritic Cells |
| Paraformaldehyde (PFA 2%) | Polysciences Europe | 25085-1 | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Paraformaldehyde (PFA 4%) | Biotium | 22023 | Determination of Sialic Acid Profile |
| Pasteur pipettes | Labbox | PIPP-003-500 | Obtaining Monocyte-derived Dendritic Cells |
| Peanut (Arachis hypogaea) Agglutinin (PNA) lectin (PNA lectin - FITC) | Vector labs | FL-1071 | Determination of Sialic Acid Profile |
| Penicillin/streptomycin | Gibco | 15140163 | Obtaining Monocyte-derived Dendritic Cells |
| Phosphate Buffered Saline (PBS) | NZYTech | MB18201 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Prostaglandin E2 (PGE2) | Sigma - Aldrich | P0409 | Obtaining Monocyte-derived Dendritic Cells |
| RBC lysis buffer | BioLegend | 420302 | Obtaining Monocyte-derived Dendritic Cells |
| RPMI-1640 medium (containing 11.1 mM glucose) | Gibco | 31870074 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile |
| Sambucus nigra lectin (SNA lectin - Biotinylated) | Vector labs | B-1305-2 | Determination of Sialic Acid Profile |
| Sambucus nigra lectin (SNA lectin - FITC) | Vector labs | FL-1301-2 | Determination of Sialic Acid Profile |
| Sodium pyruvate | Thermofisher | 11360-070 | Obtaining Monocyte-derived Dendritic Cells |
| SpectroMax190 | Molecular Devices | Maturation Profiling of mo-DCs | |
| Streptavidin-PE | BioLegend | 405203 | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Tetramethylbenzidine (TMB) | Sigma - Aldrich | T0440 | Maturation Profiling of mo-DCs |
| Tumour necrosis factor-α (TNF-α) | Sigma - Aldrich | H8916 | Obtaining Monocyte-derived Dendritic Cells |
| Zeiss LSM710 confocal microscope | Zeiss | Determination of Sialic Acid Profile |
参考文献
- Varki, A., Gagneux, P. Multifarious roles of sialic acids in immunity. Annals of the New York Academy of Sciences. 1253, 16-36 (2012).
- Bochner, B. S., Zimmermann, N. Role of Siglecs and related glycan-binding proteins in immune responses and immunoregulation. The Journal of Allergy and Clinical Immunology. 135 (3), 598-608 (2015).
- Smith, B. A. H., Bertozzi, C. R. The clinical impact of glycobiology: Targeting selectins, Siglecs and mammalian glycans. Nature Reviews Drug Discovery. 20, 217-243 (2021).
- Schauer, R. Sialic acids as regulators of molecular and cellular interactions. Current Opinion in Structural Biology. 19 (5), 507-514 (2009).
- Manhardt, C. T., Punch, P. R., Dougher, C. W. L., Lau, J. T. Y. Extrinsic sialylation is dynamically regulated by systemic triggers in vivo. Journal of Biological Chemistry. 292 (33), 13514-13520 (2017).
- Cabral, M. G., et al. Human dendritic cells contain cell surface sialyltransferase activity. Immunology Letters. 131 (1), 89-96 (2010).
- Bordron, A., et al. Hyposialylation must be considered to develop future therapies in autoimmune diseases. International Journal of Molecular Sciences. 22 (7), 3402 (2021).
- Julien, S., Videira, P. A., Delannoy, P. Sialyl-Tn in cancer: (How) did we miss the target. Biomolecules. 2 (4), 435-466 (2012).
- Munkley, J. Aberrant sialylation in cancer: Therapeutic opportunities. Cancers. 14 (17), 4248 (2022).
- Dennis, J. W., Laferte, S., Waghorne, C., Breitman, M. L., Kerbel, R. S. S1-6 Branching of Asn-linked oligosaccharides is directly associated with metastasis. Science. 236 (4801), 582-585 (1987).
- Pinho, S. S., Reis, C. A. Glycosylation in cancer: Mechanisms and clinical implications. Nature Reviews Cancer. 15 (9), 540-555 (2015).
- Manni, M., Läubli, H. Targeting glyco-immune checkpoints for cancer therapy. Expert Opinion on Biological Therapy. 21 (8), 1063-1071 (2021).
- Sjögren, J., Lood, R., Nägeli, A. On enzymatic remodeling of IgG glycosylation; Unique tools with broad applications. Glycobiology. 30 (4), 254-267 (2020).
- Trastoy, B., et al. Sculpting therapeutic monoclonal antibody N-glycans using endoglycosidases. Current Opinion in Structural Biology. 72, 248-259 (2022).
- Pascoal, C., et al. Sialyl LewisX/A and cytokeratin crosstalk in triple negative breast cancer. Cancers. 15 (3), 731 (2023).
- von Itzstein, M., et al. Rational design of potent sialidase-based inhibitors of influenza virus replication. Nature. 363 (6428), 418-423 (1993).
- Gray, M. A., et al. Targeted glycan degradation potentiates the anticancer immune response in vivo. Nature Chemical Biology. 16 (12), 1376-1384 (2020).
- Fernandes, &. #. 1. 9. 4. ;., et al. Glycans as shapers of tumour microenvironment: A sweet driver of T-cell-mediated anti-tumour immune response. Immunology. 168 (2), 217-232 (2023).
- Togayachi, A., et al. Polylactosamine on glycoproteins influences basal levels of lymphocyte and macrophage activation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15829-15834 (2007).
- Park, D. D. Resident and elicited murine macrophages differ in expression of their glycomes and glycan-binding proteins. Cell Chemical Biology. 28 (4), 567-582 (2021).
- Steinman, R. M. Dendritic cells and immune-based therapies. Experimental Hematology. 24 (8), 859-862 (1996).
- Sabado, R. L., Bhardwaj, N. Directing dendritic cell immunotherapy towards successful cancer treatment. Immunotherapy. 2 (1), 37-56 (2010).
- Pardoll, D. M. The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews Cancer. 12 (4), 252-264 (2012).
- Steinman, R. M., Banchereau, J. Taking dendritic cells into medicine. Nature. 449 (7161), 419-426 (2007).
- So-Rosillo, R., Small, E. J. Sipuleucel-T (APC8015) for prostate cancer. Expert Review of Anticancer Therapy. 6 (9), 1163-1167 (2006).
- Cheever, M. A., Higano, C. S. PROVENGE (Sipuleucel-T) in prostate cancer: The first FDA-approved therapeutic cancer vaccine. Clinical Cancer Research. 17 (11), 3520-3526 (2011).
- Videira, P. A., et al. Surface α2-3- and α2-6-sialylation of human monocytes and derived dendritic cells and its influence on endocytosis. Glycoconjugate Journal. 25 (3), 259-268 (2008).
- Cabral, M. G., et al. The phagocytic capacity and immunological potency of human dendritic cells is improved by α2,6-sialic acid deficiency. Immunology. 138 (3), 235-245 (2013).
- Silva, Z., et al. MHC class I stability is modulated by cell surface sialylation in human dendritic cells. Pharmaceutics. 12 (3), 249 (2020).
- Silva, M., et al. Sialic acid removal from dendritic cells improves antigen cross-presentation and boosts anti-tumor immune responses. Oncotarget. 7 (27), 41053-41066 (2016).
- Crespo, H. J., et al. Effect of sialic acid loss on dendritic cell maturation. Immunology. 128, 621-631 (2009).
- Council of Europe. Guide to the Preparation, Use and Quality Assurance of Blood Components. Council of Europe. , (2017).
- LS Columns. Miltenyi Biotec Available from: https://www.miltenyibiotec.com/US-en/products/Is-columns.html#130-042-401 (2012)
- Nair, S., Archer, G. E., Tedder, T. F. Isolation and generation of human dendritic cells. Current Protocols in Immunology. 07, (2012).
- Wu, X., Xu, F., Liu, J., Wang, G. Comparative study of dendritic cells matured by using IL-1β, IL-6, TNF-α and prostaglandins E2 for different time span. Experimental and Therapeutic Medicine. 14 (2), 1389-1394 (2017).
- Naeim, F., Nagesh Rao, P., Song, S., Phan, R. Chapter 2 - Principles of Immunophenotyping. Atlas of Hematopathology. , 29-56 (2018).
- Cernadas, M., Lu, J., Watts, G., Brenner, M. B. CD1a expression defines an interleukin-12 producing population of human dendritic cells. Clinical and Experimental Immunology. 155, 523-533 (2009).
- Santambrogio, L., Strominger, J. L. The ins and outs of MHC class II proteins in dendritic cells. Immunity. 25 (6), 857-859 (2006).
- Raposo, C. D., Canelas, A. B., Barros, M. T. Human lectins, their carbohydrate affinities and where to find them. Biomolecules. 11 (2), 188 (2021).
- Videira, P. A. Q., et al. Patent WO2017002045. A viable cell population, method for production and uses thereof. Portugal patent. , (2017).
- Bai, L., Feuerer, M., Beckhove, P., Umansky, V., Schirrmacher, V. Generation of dendritic cells from human bone marrow mononuclear cells: Advantages for clinical application in comparison to peripheral blood monocyte derived cells. International Journal of Oncology. 20 (2), 247-253 (2002).
- Marques, G. S., Silva, Z., Videira, P. A. Antitumor efficacy of human monocyte-derived dendritic cells: Comparing effects of two monocyte isolation methods. Biological Procedures Online. 20, 4 (2018).
- Bax, M., et al. Dendritic cell maturation results in pronounced changes in glycan expression affecting recognition by Siglecs and galectins. Journal of Immunology. 179 (12), 8216-8224 (2007).
- Chinoy, Z. S., Montembault, E., Moremen, K. W., Royou, A., Friscourt, F. Impacting bacterial sialidase activity by incorporating bioorthogonal chemical reporters onto mammalian cell-surface sialosides. ACS Chemical Biology. 16 (11), 2307-2314 (2021).
- Chou, M. -. Y., Li, S. -. C., Li, Y. -. T. Cloning and expression of sialidase L, a NeuAcα2→3Gal-specific sialidase from the leech, Macrobdella decora. Journal of Biological Chemistry. 271 (32), 19219-19224 (1996).
- Crespo, H. J., Lau, J. T. Y., Videira, P. A. Dendritic cells: A spot on sialic acid. Frontiers in Immunology. 4, 491 (2013).
- Büll, C. Metabolic sialic acid blockade lowers the activation threshold of moDCs for TLR stimulation. Immunology & Cell Biology. 95 (4), 408-415 (2017).
- Ohmi, Y., et al. Majority of alpha2,6-sialylated glycans in the adult mouse brain exist in O -glycans: SALSA-MS analysis for knockout mice of alpha2,6-sialyltransferase genes. Glycobiology. 31 (5), 557-570 (2021).
- Chung, C., et al. Integrated genome and protein editing swaps α-2,6 sialylation for α-2,3 sialic acid on recombinant antibodies from CHO. Biotechnology Journal. 12 (2), 1600502 (2017).
- Hyvärinen, S., Meri, S., Jokiranta, T. S. Disturbed sialic acid recognition on endothelial cells and platelets in complement attack causes atypical hemolytic uremic syndrome. Blood. 127 (22), 2701-2710 (2016).
- Powell, L. D., Whiteheart, S. W., Hart, G. W. Cell surface sialic acid influences tumor cell recognition in the mixed lymphocyte reaction. Journal of Immunology. 139, 262-270 (1987).
- Corfield, A. P., Higa, H., Paulson, J. C., Schauer, R. The specificity of viral and bacterial sialidases for α(2-3)- and α(2-6)-linked sialic acids in glycoproteins. Biochimica et Biophysica Acta - Protein Structure and Molecular Enzymology. 744 (2), 121-126 (1983).
- Tkachenko, N., Wojas, K., Tabarkiewicz, J., Rolinski, J. Generation of dendritic cells from human peripheral blood monocytes - Comparison of different culture media. Folia Histochemica et Cytobiologica. 43, 25-30 (2005).
- Kim, S. J., et al. Human CD141+ dendritic cells generated from adult peripheral blood monocytes. Cytotherapy. 21 (10), 1049-1063 (2019).
- Calmeiro, J., et al. In-depth analysis of the impact of different serum-free media on the production of clinical grade dendritic cells for cancer immunotherapy. Frontiers in Immunology. 11, 593363 (2021).
- Stamatos, N. M., et al. LPS-induced cytokine production in human dendritic cells is regulated by sialidase activity. Journal of Leukocyte Biology. 88 (6), 1227-1239 (2010).
- Lehmann, F., Tiralongo, E., Tiralongo, J. Sialic acid-specific lectins: Occurrence, specificity and function. Cellular and Molecular Life Sciences. 63 (12), 1331-1354 (2006).
- Frosch, M., Görgen, I., Boulnois, G. J., Timmis, K. N., Bitter-Suermann, D. NZB mouse system for production of monoclonal antibodies to weak bacterial antigens: Isolation of an IgG antibody to the polysaccharide capsules of Escherichia coli K1 and group B meningococci. Proceedings of the National Academy of Sciences of the United States of America. 82 (4), 1194-1198 (1985).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。