Method Article
Generación de células dendríticas derivadas de monocitos con diferentes fenotipos sialilados
En este artículo
Resumen
Se presenta un protocolo único y completo para generar células dendríticas derivadas de monocitos humanos desialiladas (mo-DC) a partir de células mononucleares aisladas de sangre periférica (PBMC) utilizando un tratamiento con siaridasa. Además, se describen métodos para evaluar la caracterización fenotípica y funcional de las mo-DC y evaluar cómo el tratamiento con sialidasa mejora el nivel de maduración de las mo-DC.
Resumen
Los ácidos siálicos son monosacáridos cargados negativamente que se encuentran típicamente en el extremo de los glicanos de la superficie celular. Debido a su hidrofilicidad y características biofísicas, intervienen en numerosos procesos biológicos, como la modulación de la respuesta inmunitaria, el reconocimiento de antígenos propios y no propios, las interacciones hidratos de carbono-proteína, etc. El contenido celular del ácido siálico está regulado por la sialidasa, que cataliza la eliminación de los residuos de ácido siálico. Varios estudios han demostrado que los sialoglicanos son fundamentales en el seguimiento de la vigilancia inmunitaria mediante la interacción con los receptores Siglec inhibidores cis y trans en las células inmunitarias. Del mismo modo, los puntos de control glicoinmunes en el cáncer se están convirtiendo en objetivos cruciales para el desarrollo de inmunoterapias. Además, las células dendríticas (CD) se conciben como un componente importante en las inmunoterapias, especialmente en la investigación del cáncer, debido a su papel único como células presentadoras de antígenos (APC) profesionales y su capacidad para desencadenar respuestas inmunitarias adaptativas y generar memoria inmunológica. Sin embargo, la función de las CD depende de su plena maduración. Las CD inmaduras tienen una función opuesta a las DC maduras y un alto contenido de ácido siálico, lo que amortigua aún más su nivel de maduración. Esto regula a la baja la capacidad de las CD inmaduras para activar las células T, lo que lleva a una respuesta inmunitaria comprometida. En consecuencia, la eliminación del ácido siálico de la superficie celular de las CD humanas induce su maduración, aumentando así la expresión de las moléculas MHC y la presentación de antígenos. Además, puede restaurar la expresión de moléculas coestimuladoras e IL-12, lo que hace que las CD tengan una mayor capacidad para polarizar las células T hacia un fenotipo Th1 y activar específicamente las células T citotóxicas para matar las células tumorales. Por lo tanto, el ácido siálico se ha convertido en un modulador clave de las CD y se está utilizando como una nueva diana para avanzar en su uso terapéutico. Este estudio proporciona un enfoque único para tratar in vitro las CD derivadas de monocitos con sialidasa, con el objetivo de generar poblaciones de CD con diferentes fenotipos de ácido siálico en la superficie celular y perfiles personalizados de maduración y coestimulación.
Introducción
Los glicanos portadores de ácido siálico (sialoglicanos) han ganado un interés significativo debido a su papel inmunomodulador. El monosacárido ácido siálico, que es más prevalente en humanos en forma de ácido N-acetilneuramínico, presenta ligandos fundamentales para lectinas con un papel reconocido en inmunología, como Selectinas y Siglecs. Estas lectinas reconocen sialoglicanos en la misma célula (cis) o en células diferentes (trans) y desempeñan un papel importante en las interacciones huésped-patógeno y en diversas actividades celulares fisiológicas y patológicas 1,2,3. Además, dado que el ácido siálico ocupa las posiciones terminales de los glicoconjugados de la superficie celular, puede ocultar las estructuras subyacentes, inhibiendo así el contacto de célula a célula a través de efectos repulsivos inespecíficos o al obstruir la detección por otras lectinas4. La actividad de una variedad de sialiltransferasas (que transfieren ácidos siálicos) y de sialidasas (que escinden los enlaces del ácido siálico) dentro de la célula determina la cantidad de ácido siálico presente en la superficie. Además, las sialiltransferasas solubles y las sialidasas expresadas por el huésped o los patógenos pueden modificar extrínsecamente la cantidad de ácido siálico en la superficie celular 5,6.
La sialilación aberrante es una característica de varias condiciones patológicas. En las enfermedades autoinmunes, la hiposialilación puede contribuir a la activación inmunitaria desenfrenada y al daño de los órganos, ya que el ácido siálico ayuda a discriminar los antígenos propios y a regular las respuestas inflamatorias7. Por el contrario, la hipersialilación resulta en la sobreexpresión de sialoglicos, como los antígenos sialil-Tn, sialil-Lewis, ácido polisiálico y gangliósidos, lo que constituye un sello distintivo de algunos cánceres 8,9. La hipersialilación también depende del aumento de la expresión de enzimas específicas como la N-acetilglucosaminiltransferasa (GNT-V), que genera glicanos ligados a N tri y/o tetraantenarios hipersialilados, que se han asociado con el crecimiento del cáncer y la metástasis10. El contenido de ácido siálico también regula la estabilidad y la función de las proteínas, que son clave para el papel de los actores oncogénicos relevantes11. Por lo tanto, el aumento de la sialilación puede facilitar el desarrollo tumoral, la metástasis, la resistencia a los medicamentos y la evasión inmunitaria. Además, la regulación positiva de los sialoglicanos permite que los tumores interactúen con los receptores inhibidores de Siglec en las células inmunitarias y eviten la vigilancia inmunitaria. Por esa razón, los sialoglicanos ahora se consideran puntos de control glicoinmunes y dianas terapéuticas atractivas. Por ejemplo, los inhibidores del eje Siglec-inmune ya se encuentran en los primeros ensayos clínicos, ya que el receptor de células inmunes Siglec (LECtina similar a la inmunoglobulina de unión al ácido siálico) desempeña un papel inmunoinhibidor12.
Las enzimas han sido utilizadas para modular el perfil de glicanos como herramientas para el estudio o para estrategias terapéuticas13,14. La sialidasa se ha empleado para alterar la malignidad de las células cancerosas, ya que los glicanos sialilados, como el sialil Lewis X, son fundamentales para la migración celular y la metástasis del cáncer15. Al mismo tiempo, los inhibidores de la sialidasa, que impiden la escisión del ácido siálico, han llegado a las clínicas para el tratamiento de las infecciones virales dependientes del ácido siálico16. Recientemente, la modulación del ácido siálico ha ganado más interés debido al papel crítico de los ácidos siálicos como ligandos en el eje Siglec-inmune, lo que significa que ofrecen nuevos medios para reducir el escape del cáncer de las respuestas inmunes. Este interés se vio reforzado por la contribución de la premio Nobel de 2022 Bertozzi y su equipo a varias estrategias que escinden selectivamente diversos sialoglicanos y mejoran las respuestas inmunitarias contra el cáncer17. Por lo tanto, las estrategias basadas en sialidasa representan una modalidad prometedora para la terapia de puntos de control glicoinmune. El glicofenotipo de las células del sistema inmunitario depende del tipo de célula y de su estado de activación. Con respecto a las células T, los glicanos tienen un papel clave en los pasos fisiopatológicos del desarrollo de las células T y la selección de timocitos, la actividad, la diferenciación y la proliferación de las células T18. Por ejemplo, la polilactosamina sobre las glicoproteínas influye en los niveles basales de linfocitos B y linfocitos T y en la activación de macrófagos19. En los macrófagos, los distintos patrones de expresión de glicanos tienen un papel importante en el reclutamiento de macrófagos hacia el microambiente tumoral (TME)20. Por lo tanto, la expresión de glicanos ligados a O y N por parte de las células inmunitarias podría utilizarse como posibles glicobiomarcadores para enfoques terapéuticos en el tratamiento del cáncer y las enfermedades autoinmunes.
Las células dendríticas (CD) son células presentadoras de antígenos específicas con una capacidad única para desencadenar respuestas inmunitarias, como la inmunidad anticancerígena21. Las CD deben someterse a una regulación positiva de sus moléculas MHC presentadoras de antígenos para presentar antígenos a las células T (señal 1), moléculas coestimuladoras para activar las células T (señal 2) y citocinas proinflamatorias, como la IL-12, para desencadenar la proliferación de células T auxiliares de tipo 1 (señal 3)22. El perfil inmunitario resultante está estrechamente regulado, y los puntos de control son esenciales para evitar que las células sanas sean atacadas. Dado que las CD pueden estimular diversas respuestas inmunitarias contra las células tumorales, se utilizan como vacunas basadas en células, y un número considerable de estudios clínicos han demostrado sus beneficios potenciales23,24. Después de que la FDA aprobara la primera vacuna basada en DC en 201025,26, se han desarrollado muchas otras vacunas basadas en DC. Las vacunas basadas en CD se producen principalmente ex vivo y se administran a los pacientes para provocar respuestas inmunitarias contra los tumores. Sin embargo, la maduración insuficiente o breve es actualmente uno de los factores que limitan la eficacia clínica de las CD y significa que se deben utilizar costosos cócteles de citoquinas. Sin una maduración adecuada, las CD no pueden activar las células T en circunstancias clínicas. En cambio, las CD expresan puntos de control inmunitario y desencadenan una respuesta inmunitaria tolerogénica que impide que las células T citotóxicas actúen contra las células tumorales.
Las CD humanas tienen superficies fuertemente sialiladas, y esta sialilación disminuye durante la maduración y durante una respuesta inmunitaria general27. La maduración de las CD se puede inducir mediante la eliminación de estos ácidos siálicos con sialidasa. La desialilación regula en gran medida varias citoquinas, incluida la IL-12, debido a la translocación del factor de transcripción NF-kB al núcleo 6,28. Además, la desialilación mejora la presentación cruzada de antígenos a través del MHC-I y las respuestas inmunes antitumorales29,30. En consecuencia, el knockout de las sialiltransferasas ST3Gal.l y ST6Gal.l, que tienen un papel importante en la sialilación de las DC, genera un fenotipo más maduro en las CD murinas31.
El tratamiento con sialidasa proporciona un método para estimular todos los aspectos de la maduración de las DC, incluido el aumento de la presentación de antígenos, el aumento de la expresión de moléculas coestimuladoras y el aumento de la producción de citocinas, para abordar las deficiencias mencionadas anteriormente y permitir que las CD provoquen respuestas efectivas. En este artículo se presenta un procedimiento para la obtención de CD humanas desialiladas viables mediante el uso de una sialidasa bacteriana. Las CD desialiladas muestran un perfil de maduración mejorado y pueden utilizarse como modelos celulares para potenciar las respuestas inmunitarias antitumorales in vitro. Las CD se obtienen a partir de monocitos sanguíneos, que luego se diferencian in vitro en presencia de la citoquina interleucina-4 (IL-4) y el factor estimulante de colonias de granulocitos y macrófagos (GM-CSF). Este trabajo también describe métodos basados en lectinas para analizar el ácido siálico en la superficie celular y métodos para inmunofenotipar el nivel de maduración de DC. El procedimiento descrito aquí se puede utilizar para desializar otros tipos de células, proporcionando así un enfoque para investigar el papel de los sialoglicanos, que son puntos de control glicoinmunes vitales y relevantes en la inmunomodulación.
Protocolo
Las células fueron aisladas de los abrigos leucocitarios de donantes de sangre anónimos sanos, que eran voluntarios proporcionados por el banco nacional de sangre, Instituto Português do Sangue e da Transplantação (IPST), después de obtener el consentimiento escrito e informado del donante (IMP.74.52.4). El uso de la sangre fue aprobado por el Comité de Ética (IPST 30072015), de acuerdo con la directiva 2004/23/CE sobre normas de calidad y seguridad para la donación, obtención, análisis, procesamiento, preservación, almacenamiento y distribución de células y tejidos humanos (Ley 22/2007, de 29 de junio). El biobanco del IPST recoge y almacena la sangre en una bolsa de plástico específica que contiene citrato fosfato dextrosa (CPD), una solución conservante y anticoagulante, para mantener la integridad de la sangre hasta su procesamiento. Para evaluar si el material biológico es apto para su manipulación, se realiza un control serológico de Treponema pallidum, virus de la hepatitis B (VHB), virus de la hepatitis C (VHC) y virus de la inmunodeficiencia humana (VIH), todos ellos negativos. Para el presente estudio, el IPST proporcionó el abrigo leucocitario con fines de investigación, junto con información sobre la fecha de colecta, los resultados serológicos, el grupo sanguíneo y la edad del donante32. El pelaje buffy puede permanecer a temperatura ambiente durante un máximo de 1 día.
1. Obtención de células dendríticas derivadas de monocitos
NOTA: Es importante mencionar que cuando se manipula sangre periférica humana, se deben tener en cuenta las precauciones de seguridad universales específicas y la eliminación adecuada del material. Antes de comenzar, confirme que todos los reactivos y materiales necesarios estén preparados y listos para usar.
- Aislamiento de células mononucleares de sangre periférica
- Accede al abrigo buffy humano.
NOTA: El pelaje leucocitario es un subproducto derivado de la sangre recolectada a través de la leucoféresis32, que se enriquece en glóbulos blancos a través de la centrifugación. Todos los pasos se realizaron en una cabina de bioseguridad (BSC) con cámara de flujo vertical. - Abra el envase de la capa leucocitaria cortando el tubo de salida sellado con un bisturí y transfiera el contenido a un tubo de 50 ml. Transfiera 7 ml de muestra de capa leucitaria por tubo cónico estéril de 15 ml y agregue 6 ml de solución salina tamponada con fosfato (PBS) para realizar un lavado preliminar. Este paso de lavado inicial es necesario para limpiar la muestra de la cantidad considerable de glóbulos rojos (RBC) y plasma, de modo que la muestra esté optimizada para la separación en gradiente con un medio de gradiente de densidad (consulte la Tabla de materiales).
- Centrifugar el tubo a temperatura ambiente durante 10 min a 1.100 x g en una centrífuga con rotor oscilante y con el freno apagado (ver Tabla de Materiales).
- Después de la centrifugación, recoja la suspensión leucocitaria (el anillo blanco entre el plasma y los glóbulos rojos) con una pipeta Pasteur y transfiérala a un nuevo tubo cónico estéril de 15 ml.
- Llene la suspensión de leucocitos hasta 10 ml con PBS para ayudar en el siguiente paso de separación, y mezcle pipeteando suavemente hacia arriba y hacia abajo.
- Prepare la solución de medio de gradiente de densidad (densidad: 1,077 g/ml): Coloque 3 ml de medio de gradiente de densidad en un tubo cónico nuevo estéril de 15 ml y déjelo calentar a temperatura ambiente.
- Añadir 5 ml de la suspensión leucocitaria diluida (del paso 1.1.5) en el tubo cónico que contiene el medio de gradiente de densidad (5:3) para realizar la separación del gradiente de densidad. Agregue la muestra lentamente, gota a gota, utilizando las paredes del tubo para evitar perturbar el medio de gradiente de densidad.
- Separación de gradiente: Centrifugar la suspensión del medio de gradiente de densidad a temperatura ambiente durante 30 min a 1.100 x g en una centrífuga con rotor oscilante y con el freno apagado.
- Después de la centrifugación, retire con cuidado los tubos cónicos de la centrífuga. Después de este paso, se puede ver una serie de capas bien definidas, entre las que se incluyen las siguientes, empezando por la parte inferior: una capa roja (glóbulos rojos y granulocitos), un medio de gradiente de densidad, una capa delgada y pálida de células mononucleares de sangre periférica (PBMC) y plasma.
- Recoja la capa delgada de PBMC con una pipeta Pasteur y evite ocupar el medio de gradiente de densidad por debajo o demasiado plasma por encima. Coloque la muestra de PBMC en un tubo cónico nuevo de 50 ml, llénelo hasta 25 ml con PBS y mezcle la muestra pipeteando suavemente hacia arriba y hacia abajo.
- Centrifugar las muestras a temperatura ambiente durante 10 minutos a 600 x g (freno normal) para eliminar las células residuales y los residuos, y desechar el sobrenadante invirtiendo cuidadosamente el tubo.
NOTA: Si hay demasiada contaminación de glóbulos rojos, que es observable cuando el gránulo celular o la capa leucocitaria no están completamente separados o aparecen rojizos, se recomienda lisar los glóbulos rojos restantes. En este caso, agregue 5 ml de tampón de lisis de glóbulos rojos (consulte la Tabla de materiales), mezcle bien e incube durante 5 minutos. Llene hasta 40 ml con PBS, centrifugue las muestras a temperatura ambiente durante 10 minutos a 900 x g (freno normal) y deseche el sobrenadante invirtiendo cuidadosamente el tubo. - Llene la muestra hasta 10 ml con PBS y tome una alícuota para contar las células. Para eliminar las plaquetas, centrifugar a temperatura ambiente durante 5 min a 400 x g (freno normal) y desechar el sobrenadante invirtiendo cuidadosamente el tubo.
NOTA: En caso de que haya un número sustancial de plaquetas, centrifugar a temperatura ambiente durante 10 minutos a 200 x g (freno normal) dos veces. Las plaquetas se identifican visualizando la muestra mientras se cuentan las células.
- Accede al abrigo buffy humano.
- Aislamiento de monocitos por separación inmunomagnética
- Prepare el tampón de microesferas suplementando PBS con albúmina sérica bovina (BSA) al 0,5% y ácido etilendiaminotetraacético (EDTA) 2 mM. Esterilizar la solución por filtración (0,2 μm) y mantener el tampón refrigerado (2-8 °C).
- Realizar el aislamiento de monocitos CD14+ mediante clasificación de células activadas magnéticamente (MACS).
- Después del recuento de células utilizando un contador de células automatizado (paso 1.4.1), calcule el volumen adecuado de tampón de microperlas y perlas inmunomagnéticas CD14 (consulte la Tabla de materiales) necesario. Asegúrese de que estas soluciones se mantengan en hielo. Añadir 80 μL de tampón de microperlas por 1 x 10 7 células y 20 μL de perlas CD14 por 1 x 107 células.
- Vuelva a suspender el gránulo celular en los volúmenes previamente determinados e incube durante 15 min a 4 °C (2-8 °C).
NOTA: En caso de que sea necesaria la verificación de los niveles de monocitos en las muestras de PBMC, realice un análisis de citometría de flujo utilizando anticuerpos de tinción (p. ej., CD14 [TÜK4 monoclonal]). Siga el paso 3.2 para obtener detalles sobre el análisis citométrico de flujo. - Agregue 1-2 ml de tampón de microperlas por 1 x 107 celdas, centrifugue a temperatura ambiente durante 10 min a 600 x g (freno normal) para eliminar las perlas sueltas y deseche el sobrenadante invirtiendo cuidadosamente el tubo.
- Prepare la columna LS. Las columnas LS contienen esferas ferromagnéticas que, cuando se colocan sobre un imán, permiten una retención positiva y suave de las células marcadas magnéticamente33. Inmediatamente antes de su uso, coloque una columna LS (consulte la Tabla de materiales) sobre el imán, enjuague con 3 ml de tampón de microperlas sin secar completamente e inmediatamente continúe con el siguiente paso.
NOTA: Nunca deje que la columna se seque durante el procedimiento para evitar comprometer el rendimiento. - Vuelva a suspender el gránulo celular en 500 μL de tampón de microperlas por 1 x 108 células. Si el número de células es superior a 4 x 108, utilice un filtro de células de 40 μm para evitar la agregación celular.
- Agregue la suspensión celular a la entrada de la columna, coloque un tubo cónico de 15 ml debajo de la salida de la columna para recolectar la fracción celular negativa y lave la columna tres veces con 3 ml de tampón de microperlas. La fracción negativa comprende las células que no se recogieron con las perlas CD14 (es decir, las células CD14− ).
- Después del lavado final, retire la columna del imán, colóquela en un tubo cónico estéril de 15 ml, pipetee 5 ml de tampón de microperlas en la entrada de la columna e inserte inmediatamente el émbolo de la jeringa en la entrada de la columna y empuje para dispensar las células objetivo.
- Recoja las células marcadas magnéticamente (células CD14+ ) y tome una alícuota para contar las células, como se describe en el paso 1.4.1.
- Centrifugar ambas fracciones celulares, células CD14− y CD14+ , a temperatura ambiente durante 10 min a 600 x g (freno normal). Deseche el sobrenadante, conserve la fracción CD14+ para los siguientes pasos y almacene la fracción CD14− para futuros ensayos, como los ensayos de cocultivo, si es necesario. Si es necesario, las células de la fracción CD14− pueden criopreservarse en RPMI-1640 20% FBS y 10% DMSO a −80 °C.
- Diferenciación de monocitos en células dendríticas
- Prepare el medio RPMI-1640 completo complementando el medio base RPMI-1640 (que contiene 11,1 mM de glucosa) con 10% de suero fetal bovino (FBS), 1% de 2 mM de L-glutamina, 1% de aminoácidos no esenciales (NEAA), 1% de piruvato de sodio y 1% de 100 μg/mL de penicilina/estreptomicina (ver la Tabla de Materiales).
- Realizar la diferenciación de monocitos en mo-DC, que ocurre durante ~ 5-6 días.
- Calcule el volumen de medio necesario para el número de células CD14+ obtenidas y coloque las células de acuerdo con la siguiente configuración del experimento.
NOTA: En este protocolo, las células se sembraron a una concentración de 1,3 x 106 células/mL para tener en cuenta la muerte celular y los errores de medición, y el medio se preparó añadiendo 1.000 U/mL de GM-CSF y 750 U/mL de IL-4 (véase la Tabla de Materiales) en un medio completo y mezclándolo bien. - Añada el volumen adecuado de medio a las células CD14+ y vuelva a suspender pipeteando hacia arriba y hacia abajo con una pipeta Pasteur. Colocar la suspensión celular en placas de 24 pocillos (por pocillo: 1,3 x 106 células/ml) e incubar en una incubadora de cultivo a 37 °C con 5% de CO2.
- Cambie el medio de cultivo y compleméntelo con citocinas frescas cada 2-3 días (generalmente una vez por proceso de diferenciación). Para realizar esto, retire con cuidado la mitad del medio de cultivo sin alterar las células. Añadir la misma cantidad de medio fresco con la concentración adecuada de citocinas, como se ha descrito anteriormente en la nota del paso 1.3.2.1, e incubar durante el período de diferenciación restante.
NOTA: Las DC, cuando se diferencian de los monocitos, son células poco adherentes. Las mo-DC inmaduras totalmente diferenciadas son células fusiformes, flotantes y poco adherentes. Las células también pueden formar rosetas, especialmente cuando maduran34. - Para recolectar las células después de la diferenciación, use una micropipeta para transferir toda la suspensión celular a un tubo cónico estéril y lave los pocillos de la placa dos veces con PBS, golpeando suavemente el fondo (Figura 1A).
NOTA: Evite recolectar las células fuertemente adheridas, ya que probablemente sean macrófagos. Para evitar una maduración o activación celular inadecuada, asegúrese de que las células se manipulen con extremo cuidado. - Centrifugar las celdas a temperatura ambiente durante 10 min a 180 x g (freno normal) para eliminar cualquier residuo o celda muerta, y volver a suspender en el medio/tampón apropiado para la configuración experimental.
- Calcule el volumen de medio necesario para el número de células CD14+ obtenidas y coloque las células de acuerdo con la siguiente configuración del experimento.
- Realizar la maduración de los mo-DCs.
- En caso de que se requiera la maduración de las MO-DC, utilizar una placa o matraz de pocillos, teniendo en cuenta el ejemplo de concentración celular que se utilizó anteriormente (1,3 x 10 6 células/mL), y administrar un cóctel de citoquinas complementando el medio con un cóctel de citoquinas que comprenda IL-1β (10 ng/mL),IL-6 (1.000 U/mL), prostaglandina E2 (PGE2; 1 μg/mL), y factor de necrosis tumoral α (TNF-α; 10 ng/mL) (ver la Tabla de Materiales). Incubar las células a 37 °C con 5% de CO2 durante 24 h o 48 h.
- Recuento celular y viabilidad
- Realice el recuento de células y la tinción con azul de tripano.
- Para determinar el número de células y la viabilidad de una suspensión celular, tome una alícuota de 10 μL de la suspensión celular y mézclela con 10 μL de azul de tripano (dilución 1:1).
- Tome 10 μL de la mezcla anterior y use el contador de celdas automatizado para contar el número de celdas de acuerdo con las instrucciones del fabricante.
NOTA: Si la concentración de células es demasiado alta, diluya la alícuota y, después del recuento de células, considere el factor de dilución en los cálculos. - Ajuste el número de celdas y el medio/tampón para la configuración experimental.
- Determinar la viabilidad celular y la apoptosis30.
NOTA: En este trabajo, tras el tratamiento con sialidasa (sección 2), se realizó el ensayo de viabilidad.- Tiñir los mo-DC con 5 μg/mL de 7-aminoactinomicina D (7-AAD) y anexina V, y determinar la apoptosis de acuerdo con las instrucciones del fabricante (ver la Tabla de Materiales).
- Analizar los resultados mediante citometría de flujo29,30.
- Realice el recuento de células y la tinción con azul de tripano.
2. Tratamiento de las células con sialidasa
NOTA: Después de la diferenciación en mo-DC, al sexto día, las células están listas para el ensayo de tratamiento con siaridasa.
- Teniendo en cuenta la configuración experimental deseada, recoja ~ 10 x 106 mo-DC de 10 pocillos de las placas de 24 pocillos con 1,3 x 106 células/pocillo, y transfiéralos a un nuevo tubo cónico estéril de 15 ml.
NOTA: Suponga alguna pérdida celular; típicamente, en esta etapa, la concentración encontrada es de 1,3 x 106 células/mL porque las mo-DC y sus precursores no proliferan y experimentan una pérdida de viabilidad del 20% durante la diferenciación en mo-DC. - Centrifugar a temperatura ambiente durante 5-7 min a 300 x g (freno normal) y desechar el sobrenadante para eliminar las células muertas y los residuos.
- Agregue 10 mL de medio RPMI-1640 (que contenga 11.1 mM de glucosa), centrifugue a temperatura ambiente durante 4 min a 300 x g (freno normal), deseche el sobrenadante, agregue 2 mL de RPMI-1640 y mezcle bien.
- Coloque 1 mL de células en RPMI-1640 en nuevos microtubos estériles, #1 y #2; Cada microtubo contendrá aproximadamente 5 x 106 células.
- Al microtubo #1, agregue 500 mU de sialidasa de Clostridium perfringens (ver la Tabla de Materiales). Al microtubo #2, agregue sialidasa tratada simuladamente, que es un control negativo, para confirmar si los efectos observados están directamente relacionados con la eliminación del ácido siálico y no se deben a artefactos. La sialidasa tratada simuladamente es sialidasa inactivada por calor, que se obtiene hirviendo la enzima durante 20 minutos a 100 °C.
- Incubar durante 60 min a 37 °C.
- Después de la incubación, coloque las células en nuevos tubos cónicos estériles de 15 ml con la misma numeración, # 1 y # 2. Agregue alrededor de 4 ml de medio RPMI-1640 completo (que contenga 10% de FBS) a ambos tubos para detener la reacción enzimática.
- Centrifugar a temperatura ambiente durante 4 min a 300 x g (freno normal) y desechar el sobrenadante.
- Agregue 5 mL de medio RPMI-1640 completo a cada tubo y coloque 1 mL de células por pocillo.
3. Determinación del perfil de ácido siálico
- Tinción de lectina
- Recoja y lave las celdas a temperatura ambiente durante 5 minutos a 300 x g (freno normal).
- Resuspender las células en RPMI-1640 + 10% FBS, y distribuir las células (100.000/100 μL) en los microtubos.
- Realice la tinción para citometría de flujo en RPMI-1640 con FBS al 10 % utilizando una concentración de 0,01 mg/ml para cada lectina: lectina de Sambucus nigra (SNA), lectina de aglutinina de cacahuete (PNA) y lectina de Maackia amurensis (MAA) (consulte la Tabla de materiales). Incubar durante 30 min a 4 °C.
- Lavar las celdas con 1 ml de PBS que contenga 10% de FBS o 10% de BSA, y centrifugar a temperatura ambiente durante 4 min a 300 x g (freno normal).
- A las células teñidas con las lectinas biotiniladas, añadir 0,0005 mg/mL de estreptavidina-PE (ver la Tabla de Materiales), e incubar durante 15 min a temperatura ambiente en la oscuridad. Lavar las celdas con 1 mL de PBS, y centrifugar a temperatura ambiente durante 4 min a 300 x g (freno normal).
- Deseche el sobrenadante y, a cada tubo, agregue 300 μL de paraformaldehído al 2% (PFA 2%). Proteja los tubos de la luz y, si es necesario, guárdelos a 4 °C hasta la adquisición de datos.
- Adquiera los datos utilizando un citómetro de flujo dentro de 1 semana de la preparación de la muestra29,30.
- Citometría de flujo
- Resuspenda las células en 1 mL de PBS y adquiera la muestra con un citómetro de flujo para la adquisición inmediata de datos.
- Para la adquisición diferida de datos, vuelva a suspender 300 μL de PFA al 2 % y adquiera los datos en el plazo de 1 semana.
- Microscopía de barrido láser confocal
- Coloque las células en cubreobjetos de vidrio recubiertos de polilisina de 12 mm de diámetro e incube durante 5 minutos a temperatura ambiente.
- Centrifugar los cubreobjetos a temperatura ambiente durante 1 min a 100 x g (freno normal) para promover la adhesión celular.
- Fijar a temperatura ambiente durante 30 min con PFA al 4% antes de lavar con BSA al 1% en PBS.
- Utilice lectina SNA conjugada con FITC (0,01 mg/ml) para teñir ácidos siálicos ligados a α2,6 en las superficies celulares (consulte la Tabla de materiales).
- Adquirir imágenes en un microscopio confocal (ver la Tabla de Materiales).
- Después del procesamiento de la pila Z, seleccione imágenes representativas de la sección transversal confocal.
- Cuantifique analíticamente la intensidad de la tinción utilizando la fluorescencia celular total corregida (CTCF).
NOTA: CTCF = Densidad integrada − (Área de la célula seleccionada × Fluorescencia media de las lecturas de fondo)29.
4. Perfil de maduración de los mo-DC
- Tinción de anticuerpos y citometría de flujo
- Recolectar una nueva muestra de las células de interés para realizar la tinción de anticuerpos. Lavar las células a temperatura ambiente durante 5 min a 300 x g (freno normal) y distribuir las células en los microtubos (100.000 células por tubo).
- Realice la tinción para la citometría de flujo utilizando los anticuerpos deseados (ab), MHI-I, MHC-II, CD80 y CD86 (consulte la Tabla de materiales).
- Incubar el ab conjugado con fluorescencia durante 15 min a temperatura ambiente en la oscuridad.
- Lave las celdas con 1 ml de PBS y centrifugue a temperatura ambiente durante 5 minutos a 300 x g (freno normal).
NOTA: Si usa ab sin etiquetar, agregue ab secundario conjugado con fluorescencia e incube en la oscuridad durante 15 minutos de acuerdo con las instrucciones del fabricante. Lavar las celdas con 1 mL de PBS, y centrifugar a temperatura ambiente durante 5 min a 300 x g (freno normal). - A todos los microtubos, añadir hasta 100 μL de PBS, resuspender las células en 300 μL de paraformaldehído al 2% (PFA 2%) y mantener los tubos en la oscuridad a 4 °C hasta la adquisición de datos.
- Adquiera los datos utilizando un citómetro de flujo.
NOTA: Después de la tinción y la fijación, las muestras se pueden adquirir mediante citometría de flujo inmediatamente o dentro de un período de 1 semana. En este caso, guarde los tubos a 4 °C en la oscuridad.
5. Ensayo de inmunoabsorción ligado a enzimas (ELISA)
NOTA: En este trabajo se midió la producción de IFN-γ mediante el ensayo ELISA siguiendo las instrucciones del fabricante (ver Tabla de Materiales).
- Para recubrir la placa con un tampón de recubrimiento, diluya el anticuerpo de captura (1:100, anticuerpo de captura en PBS), transfiera 100 μL de esta solución de trabajo a cada pocillo e incube durante la noche a temperatura ambiente.
- Deseche el anticuerpo de captura por completo.
- Agregue el tampón de bloqueo (por ejemplo, PBS + 2 % BSA + 0,05 % Tween20) e incube durante 1 h a temperatura ambiente antes de retirar el tampón de bloqueo.
- Añadir el patrón y la muestra, con la respectiva mezcla y diluciones, e incubar durante 2 h a temperatura ambiente. Lavar cinco veces con tampón de lavado.
- Añadir el anticuerpo detector biotinilado, e incubar durante 2 h a temperatura ambiente, seguido de cinco lavados.
- Agregue poli-HRP-estreptavidina-HS e incube durante 30 minutos a temperatura ambiente, seguido de cinco lavados con tampón de lavado.
- Añadir sustrato TMB (ver Tabla de Materiales) e incubar hasta 60 min a temperatura ambiente, teniendo en cuenta el sistema de ensayo que se esté utilizando. Lavar cinco veces con tampón de lavado.
- Lea las muestras en un lector de microplacas a 450 nm.
Resultados
Aislamiento de monocitos y diferenciación de monocitos en mo-DC
De acuerdo con el protocolo, las PBMC humanas se aislaron del pelaje leucocitario mediante separación por gradiente de densidad con medio de gradiente de densidad y se lavaron a fondo. El azul de tripano se utilizó para realizar el recuento de células viables el día del aislamiento, como se describió anteriormente en el paso 1.4.1. Posteriormente, se realizó el aislamiento de monocitos CD14+ mediante selección positiva. Para lograr esto, las PBMC se incubaron con perlas magnéticas que contenían un anticuerpo que reconoce el antígeno CD14. Los monocitos CD14+ seleccionados se cultivaron en un medio suplementado con GM-CSF e IL-4 durante 5-6 días27 para diferenciarlos en mo-DC inmaduros (Figura 1A). La maduración de las mo-DC se puede obtener mediante la aplicación de un cóctel de citoquinas, incluyendo IL-6, IL-1β, TNF-α y PGE235 (Figura 1A).
Durante el proceso de diferenciación, como resultado de la estimulación de IL-4 y GMCSF, se espera que el fenotipo celular cambie. Los datos muestran que las mo-DC pierden la expresión del marcador de superficie CD14, expresado principalmente por los monocitos (Figura 1B), y ganan una expresión significativa de CD1a, un marcador expresado por las CD humanas36,37. Las MO-DC también obtienen una mayor expresión de MHC-II (HLA-DR), una molécula presentadora de antígenos expresada por las CD humanas y otras células presentadoras de antígenos38 (Figura 1B).
Contenido de ácido siálico en la superficie celular
El tratamiento de las mo-DC con sialidasa reduce el contenido de ácido siálico en la superficie de las mo-DC, lo que puede confirmarse mediante la tinción con lectinas, que son proteínas capaces de unirse a los carbohidratos39. Dado que la enzima utilizada elimina los ácidos siálicos ligados a α2,3 y α2,6 de la superficie celular, las mo-DC se tiñeron con PNA, que reconoce el antígeno T-Galβ1-3GalNAcα1-Ser/Thr, así como las lectinas MAA y SNA, que se unen a α2,3- y α2,6-siálico, respectivamente. La efectividad del tratamiento con sialidasa se evaluó mediante citometría de flujo y microscopía confocal (Figura 2). Como se muestra en la Figura 2A, el tratamiento con sialidasa disminuyó significativamente la unión de MAA y SNA mientras aumentaba la tinción de PNA. La disminución de la tinción de SNA después del tratamiento con sialidasa se confirmó aún más mediante un análisis de microscopía confocal que mostró una reducción significativa de la tinción de SNA en la superficie celular (Figura 2B).
Caracterización funcional de las mo-DC tratadas con sialidasa
Para evaluar cómo el tratamiento con sialidasa afecta las funciones de las mo-DC, se evaluó el nivel de maduración de las mo-DC después del tratamiento con sialidasa. Como se muestra en la Figura 3A, el tratamiento con sialidasa conduce a un aumento significativo en la expresión de las moléculas presentadoras de antígenos MHC I y MHC II y en la expresión de las moléculas coestimuladoras CD80 y CD86. Para evaluar el efecto de la eliminación del ácido siálico sobre la capacidad de las mo-DC para inducir respuestas de células T, se utilizaron mo-DC tratadas con sialidasa cargadas con lisados de células tumorales para preparar las células T autólogas (Figura 3). A continuación, se caracterizó el perfil de las células T resultantes en función de su capacidad para secretar la citoquina Th1 IFN-γ. Como se muestra en la Figura 3B, cuando se comparan con las células T cebadas por mo-DC completamente sialiladas, las células T cebadas por mo-DC tratadas con sialidasa secretaron niveles significativamente más altos de IFN-γ. Estos resultados sugieren que las mo-DC tratadas con sialidasa tienen una capacidad mejorada para preparar las células T autólogas.
Viabilidad celular
Después del tratamiento con siaridasa, se realizó un ensayo de viabilidad para garantizar que el tratamiento no fuera citotóxico para las células. Tras el tratamiento, las mo-DC se tiñeron con 7-AAD y anexina V, para detectar células no viables y apoptóticas, y se analizaron mediante citometría de flujo (Figura 4). Los datos no muestran diferencias significativas en la viabilidad celular entre las células no tratadas (Figura 4, panel izquierdo) y las tratadas con sialidasa (Figura 4, panel derecho).
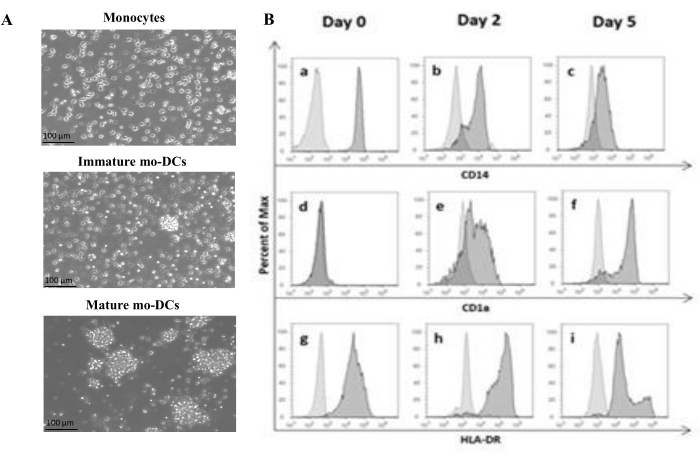
Figura 1: Diferenciación de monocitos aislados en mo-DCs. (A) Los monocitos CD14+ se aislaron de las capas leucocitarias y se cultivaron a una concentración de 1,3 x 106 células/mL a 37 °C. Los monocitos se diferenciaron en medio suplementado con 750 U/mL de IL-4 y 1.000 U/mL de GM-CSF. Análisis microscópico de la morfología de monocitos aislados de la capa leucocitaria humana en el día 0 (imagen superior). Mo-DC inmaduros; Las células se diferenciaron durante un período de 5 días utilizando IL-4 y GM-CSF (imagen central). Las MO-DC maduras se obtuvieron mediante el uso de citocinas IL-6, IL-1β, TNF-α y PGE2 durante 24 h (imagen inferior). Barras de escala: 100 μm. (B) Las células se analizaron en el día 0, el día 2 y el día 5 durante todo el período de diferenciación mediante citometría de flujo. Para caracterizar los marcadores de superficie celular se utilizaron los siguientes anticuerpos: (a-c) CD14; (d-f) CD1a, y (g-i) HLA-DR (MHC clase II). La figura muestra histogramas representativos de al menos tres ensayos independientes. El panel (B) ha sido modificado a partir de Videira et al.40, patente WO2017002045A1. Haga clic aquí para ver una versión más grande de esta figura.
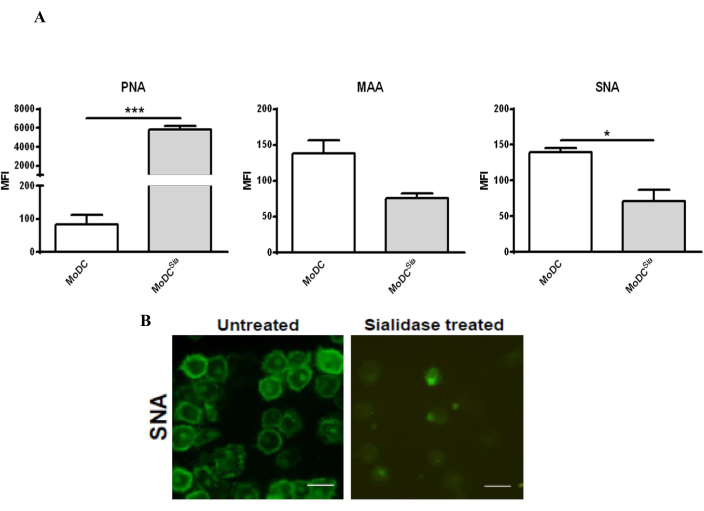
Figura 2: Tratamiento con sialidasa de mo-DC humanas para eliminar los ácidos siálicos ligados a α2,6 y α2,3 de la superficie celular. (A) Análisis de mo-DC mediante citometría de flujo utilizando tinción de lectina para probar la eficacia del tratamiento con sialidasa. Las MO-DC humanas se trataron con sialidasa (barras grises) o se dejaron sin tratar (barras blancas) y se tiñeron con lectina SNA (que reconoce los ácidos [2,6]-siálico), lectina MAA (que reconoce los ácidos [2,3]-siálico) y lectina PNA (que reconoce el antígeno T-Galβ1-3GalNAcα1-Ser/Thr). Los valores representan la intensidad media de fluorescencia (MFI) de al menos tres ensayos independientes. La significación estadística se determinó mediante una prueba t pareada de dos colas (*P < 0,05 o ***P < 0,0001), referida a la diferencia entre las CD no tratadas y las tratadas con sialidasa. El tratamiento con sialidasa disminuyó la unión a MAA y aumentó la tinción de PNA en las MO-DC humanas, como resultado de la eliminación de los ácidos siálicos ligados a α(2,3); la eliminación de los ácidos siálicos ligados a α(2,6) después del tratamiento con sialidasa se detectó por una disminución de la tinción de SNA. (B) Microscopía confocal de mo-DC tratadas con sialidasa y preparadas en cubreobjetos para su observación. Se recopiló una serie de imágenes de la pila z de diferentes células y se procesaron para incluir la intensidad media de la tinción. Barras de escala: 20 μm. El panel (A) ha sido modificado a partir de Silva et al.30; El panel (B) ha sido modificado a partir de Silva et al.29. Haga clic aquí para ver una versión más grande de esta figura.
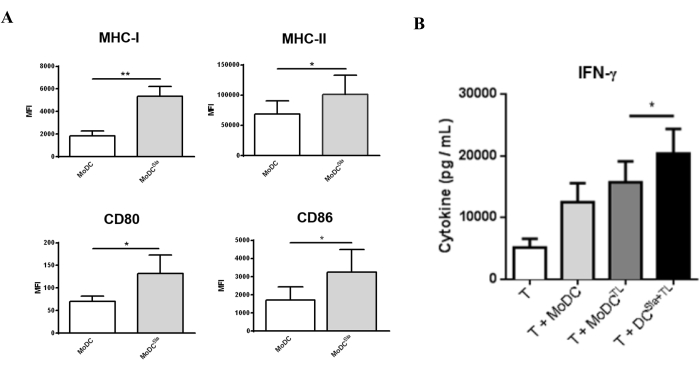
Figura 3: Tratamiento con sialidasa de mo-DCs que inducen una mayor expresión de marcadores de maduración. (A) las mo-DC tratadas con sialidasa mostraron un fenotipo de maduración más alto que las mo-DC completamente sialiadas. Se utilizó citometría de flujo para evaluar la expresión de varios marcadores de maduración. Los mo-DC se trataron con sialidasa durante 1 h a 37 °C; los valores del gráfico representan la intensidad media de fluorescencia (MFI) (media ± SEM) de al menos tres ensayos independientes. Las diferencias estadísticamente significativas se calcularon mediante una prueba t (*P < 0,05, **P < 0,01), referida a la diferencia entre las condiciones no tratadas y las tratadas con sialidasa. (B) Las mo-DC humanas desialiladas cargadas con antígenos tumorales completos indujeron respuestas específicas de células T. Las mo-DC se trataron con sialidasa durante 1 h a 37 °C o se dejaron sin tratar, seguidas de la carga con lisados de MCF-7 (TL) como fuente de antígenos de células tumorales completas. El cocultivo entre mo-DCs y células T autólogas se realizó durante 4-8 días en presencia de IL-2 (10 U/mL). Las células T cebadas con mo-DC desialiladas mostraron una secreción significativamente mayor de la citocina Th1, IFN-γ. Después de la estimulación de las células T con mo-DC, las citocinas secretadas en los sobrenadantes de cocultivo se midieron mediante ELISA (n = 7). Los valores del gráfico representan la concentración (pg/mL) (promedio ± SEM). Las diferencias estadísticamente significativas se calcularon mediante una prueba t (*P < 0,05). La figura ha sido modificada a partir de Silva et al.30. Haga clic aquí para ver una versión más grande de esta figura.
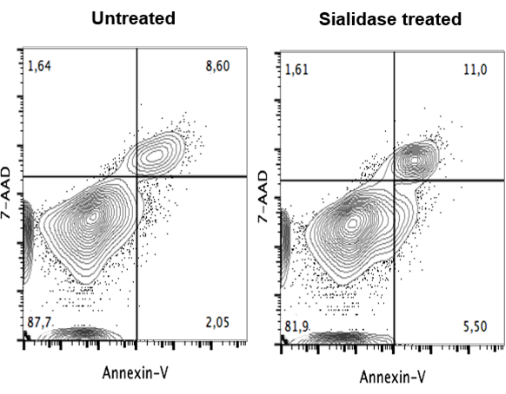
Figura 4: Falta de impacto del tratamiento con sialidasa en la viabilidad de las MO-DC humanas. Las mo-DC no tratadas (panel izquierdo) y las mo-DC tratadas con sialidasa (panel derecho) se sometieron a tinción dual con anexina V y 7-AAD, y la tinción se analizó mediante citometría de flujo. Los datos no mostraron diferencias significativas en la viabilidad celular entre las células no tratadas y las tratadas con sialidasa, lo que sugiere que las mo-DC pueden tolerar el tratamiento con sialidasa y seguir siendo viables para ejercer su función inmunológica. La figura ha sido modificada a partir de Silva et al.30. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aislamiento de monocitos
En este manuscrito se describe un protocolo para generar mo-DCs a partir de monocitos CD14+ aislados en humanos (Figura 1A), seguido de la realización de un tratamiento con sialidasa para reducir el contenido de ácido siálico en la superficie de estas células.
Existen diferentes formas de obtener CD humanas, como directamente a partir de sangre o tejidos periféricos o mediante la diferenciación a partir de precursores como células madre o monocitos. La obtención de CD diferenciadas de monocitos aislados de sangre periférica es mucho más sencilla debido a la facilidad de obtención de altas cantidades de monocitos en comparación con otras fuentes de CD41. Aún así, para obtener un alto porcentaje de monocitos aislados, se deben seguir cuidadosamente todos los pasos del protocolo. Por ejemplo, el medio de gradiente de densidad puede ser tóxico para las células, y para prevenir la muerte celular, se debe evitar el contacto prolongado de las células con el medio de gradiente de densidad y lavar bien las células. La manipulación celular debe realizarse lo más rápido posible para evitar la pérdida de viabilidad celular. A partir de las PBMC, los monocitos se pueden aislar mediante selección positiva utilizando el método de clasificación celular activada magnéticamente (MACS), que es una tecnología adecuada para producir un alto número de monocitos. Además, en comparación con otros métodos de selección de monocitos, las mo-DC derivadas de monocitos aislados con MACS poseen una mayor capacidad para estimular la actividad de las células T antitumorales42. En este protocolo, una vez aislados, los monocitos se incubaron con IL-4 y GM-CSF durante un periodo de 5-6 días para conseguir la diferenciación en mo-DCs inmaduros (Figura 1). Los resultados mostraron que morfológicamente (Figura 1A) y fenotípicamente (Figura 1B), los monocitos aislados se diferenciaron en mo-DC inmaduros. Además, a lo largo de la diferenciación, las mo-DC perdieron la expresión de los marcadores CD14 y ganaron la expresión de CD1a y MHC-II (Figura 1B), que son necesarios para la presentación de antígenos a las células T.
Este aislamiento y diferenciación de monocitos en mo-DC son limitaciones de este protocolo. El proceso de aislamiento es un paso delicado que debe ejecutarse con cuidado y rapidez para evitar la muerte celular, y este paso también debe realizarse cada vez que se necesiten mo-DC para un nuevo experimento. El proceso de diferenciación dura entre 5 y 6 días, lo que supone una dificultad en cuanto al empleo de este método para análisis de alto rendimiento. No obstante, el método de aislamiento y el uso de citoquinas para diferenciar las mo-DC son útiles para generar un elevado número de mo-DC funcionales in vitro con fines de experimentación. Las mo-DC generadas en este protocolo son capaces de someterse a tratamiento con sialidasa, citometría de flujo, ELISA, microscopía confocal, etc., lo que enfatiza la importancia y utilidad de este método30.
Tratamiento con mo-DCs inmaduros y sialidasa
Las sialidasas son esenciales en la regulación de la sialilación y son responsables de eliminar los ácidos siálicos de los glicanos de la superficie celular. En las mo-DC, la eliminación del ácido siálico por la sialidasa conduce a la maduración de estas células, lo que aumenta la presentación cruzada de antígenos y la posterior activación de las células T y la actividad antitumoral30.
Las mo-DC humanas inmaduras muestran un alto contenido de ácidos siálicos ligados a la superficie celular α(2,6)- y α(2,3)27 en comparación con las mo-DC maduras31,43. Además, la eliminación de los ácidos siálicos mediante el tratamiento de las MO-DC con sialidasa mejora la maduración de las CD 28,30,31. La sialidasa seleccionada para este experimento procedía de la bacteria Clostridium perfringens. Sin embargo, otros organismos también producen sialidasas, como las bacterias Streptococcus pneumoniae, Vibrio cholerae o Salmonella typhimurium44, la sanguijuela Macrobdella decora45 e incluso Homo sapiens46, y las sialidasas de estos organismos también se utilizan experimentalmente. Sin embargo, cada sialidasa tiene diferentes especificidades de sustrato. Además, el uso de la enzima sialidasa puede tener sus limitaciones; por ejemplo, la manipulación de mo-DC durante el tratamiento puede estimular aún más estas células. Además, la cantidad de sialidasa y los tiempos de incubación deben optimizarse en función del tipo de células que se utilicen y de su composición en ácido siálico. La eliminación del ácido siálico no es un efecto permanente, sino más bien un fenómeno transitorio, porque la célula restaurará su contenido de ácido siálico en la superficie celular. Además de la siarilidasa, existen otros métodos para reducir las moléculas de ácido siálico en la superficie de las células, como el uso de inhibidores de la sialiltransferasa, la eliminación génica de genes de sialiltransferasa o el bloqueo metabólico del ácido siálico mediante miméticos del ácido siálico47,48,49. Sin embargo, estos métodos pueden presentar efectos distintos en las células, y además de la desialilación, se debe considerar la viabilidad celular. El tratamiento con enzimas sialidasa es un método práctico para eliminar de manera efectiva y transitoria los ácidos siálicos de la superficie celular mientras se mantiene la viabilidad celular.
En este trabajo, se adicionó sialidasa a las mo-DC inmaduras a una concentración de 500 mU/5 x 106 células/mL, y las células se incubaron a 37 °C durante 60 min. El tratamiento se realizó con RPMI-1640 sin suero para preservar la viabilidad celular y evitar cualquier interacción entre las moléculas sialiladas presentes en el suero30. El tratamiento con sialidasa se puede realizar con otros tampones además del RPMI, como acetato de sodio 50 mM, pH 5,1 (en el caso de C. perfingens sialidasa) o PBS50,51,52. No obstante, RPMI-1640 es el medio de cultivo más común para las CD, ya que mantiene condiciones experimentales constantes durante el procedimiento, evita la inducción de la maduración y reduce cualquier estrés que pueda ser causado por los tampones de sialidasa o PBS53,54,55,56. Después de la incubación con sialidasa, es fundamental lavar bien las células con un medio suplementado con suero para garantizar que la reacción enzimática se haya detenido. La presencia de moléculas sialiladas en el suero competirá como sustratos para la sialidasa, asegurando así una rápida parada de la reacción.
Caracterización de marcadores de superficie mediante citometría de flujo y microscopía confocal
Para la determinación del perfil de ácido siálico, en la sección 3 del protocolo, se utilizó la tinción con lectina seguida de citometría de flujo y microscopía de barrido láser confocal. Para el procedimiento de tinción celular, en ambos casos, se optimizaron las concentraciones de lectina y las condiciones de incubación para evitar la aglutinación y muerte celular. Es fundamental realizar la incubación a 4 °C en tampones que contengan al menos un 2% de FBS o BSA para evitar la unión inespecífica de las lectinas. En este protocolo, se utilizó RPMI-1640 que contiene un 10% de FBS para mantener condiciones experimentales constantes y evitar el estrés celular. En cuanto a la microscopía confocal, la fijación de las células antes de la tinción es esencial para preservar la morfología, evitar la autólisis y mantener la antigenicidad.
El análisis del fenotipo mo-DC mediante citometría de flujo mostró que las MO-DC tratadas con sialidasa tenían una cantidad significativamente mayor de lectina PNA unida a la superficie celular en comparación con las lectinas MMA y SNA, que disminuyeron después del tratamiento con sialidasa (Figura 2A). Como era de esperar, la tinción de PNA aumentó, ya que la PNA reconoce antígenos no sialilados, a diferencia de MAA y SNA, que se unen directamente a los ácidos α2,3- y α2,6-siálico, respectivamente30. Esta tinción confirma la eliminación efectiva de los ácidos siálicos de la superficie celular utilizando este protocolo. Otro método que se puede utilizar para validar el tratamiento y analizar el contenido de ácido siálico de la superficie celular es la tinción de lectina seguida de microscopía confocal, como se ejemplifica en la Figura 2B.
Además de los ejemplos anteriores, existen enfoques alternativos para evaluar y caracterizar el contenido de ácido siálico, como el sondeo de lectina mediante Western blot. También están disponibles lectinas alternativas específicas para el ácido siálico, como las Siglecs, un grupo de lectinas que tienen una clara preferencia por los tipos y enlaces de ácido siálico57. Además del uso de lectinas en cualquiera de las dos técnicas (citometría de flujo, microscopía o Western blot), también es posible caracterizar el contenido de ácido siálico mediante anticuerpos; Por ejemplo, los ácidos α2,8-siálicos pueden evaluarse mediante anticuerpos como el clon 735, que es específico para el ácido polisiálico58. Además, después del tratamiento con sialidasa, las células pueden ser probadas funcionalmente para determinar su eficacia biológica o terapéutica mediante la evaluación de su fenotipo y capacidad para activar las células T40. De hecho, como se muestra en los ejemplos proporcionados, las mo-DC tratadas con sialidasa mostraron un fenotipo de maduración más alto, así como una expresión elevada de moléculas presentadoras de antígenos y coestimuladoras.
Además, las mo-DC tratadas con sialidasa pueden cargarse con antígenos y cocultivarse con células T u otras células, y luego pueden estudiarse en relación con el fenotipo, el perfil de secreción de citocinas u otras características. En el ejemplo proporcionado, los datos muestran que las mo-DC tratadas con sialidasa pueden cargarse con antígenos tumorales y luego usarse para activar las células T. De hecho, las células T resultantes mostraron un aumento de la secreción de IFN-γ, lo que concuerda con informes anteriores sobre el efecto de la escasez de ácido siálico en el aumento de la capacidad de las mo-DC para activar las células T 27,28,29,30,31.
En conclusión, este protocolo muestra un método factible, viable y práctico para generar mo-DCs para la manipulación del contenido de ácido siálico mediante tratamiento con sialidasa. Este protocolo presenta una metodología que puede servir para diferentes propósitos y aplicaciones. Este método no solo puede tener un papel crucial en la comprensión del papel de los ácidos siálicos en la maduración y respuesta de las células inmunitarias, sino que también puede utilizarse como herramienta inmunomoduladora.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia ni otros conflictos de intereses.
Agradecimientos
Los autores agradecen la financiación de la Comisión Europea GLYCOTwinning GA 101079417 y EJPRD/0001/2020 EU 825575; la Fundação para a Ciência e Tecnologia (FCT) Portugal, en el marco de las subvenciones FCT 2022.04607.PTDC, UIDP/04378/2020, UIDB/04378/2020 (UCIBIO) y LA/P/0140/2020 (i4HB). FCT-NOVA. y Stemmatters también fueron financiados por el Fundo Europeu de Desenvolvimento Regional (FEDER), a través del Programa Operacional Regional do Norte (Norte 2020) para el SI I& Proyecto DT DCMatters (NORTE-01-0247-FEDER-047212). Reconocemos las instalaciones de Biolabs en FCT-NOVA y GLYCOVID NOVA Saude.
Materiales
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | AstiK’s | CTGP-E15-050 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase |
| 24-well plate | Greiner Bio-one | 662 160 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase |
| 50 mL conical tube | AstiK’s | CTGP-E50-050 | Obtaining Monocyte-derived Dendritic Cells |
| 7-Aminoactinomycin D (7-AAD) | BioLegend | 420404 | Obtaining Monocyte-derived Dendritic Cells |
| Annexin V | Immunotools | 31490013 | Obtaining Monocyte-derived Dendritic Cells |
| Attune Acoustic Focusing Flow Cytometer | Thermo Fisher Scientific | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs | |
| BSA | Sigma - Aldrich | A3294-100G | Obtaining Monocyte-derived Dendritic Cells; Determination of Sialic Acid Profile |
| CD14 (Monoclonal TÜK4) | Miltenyi Biotec | 130-080-701 | Obtaining Monocyte-derived Dendritic Cells |
| CD80 | Immunotools | 21270803 | Maturation Profiling of mo-DCs |
| CD86 | Immunotools | 21480863 | Maturation Profiling of mo-DCs |
| Cell counting slides and trypan blue | EVE | EVS-050 | Obtaining Monocyte-derived Dendritic Cells |
| Centrifuge | Eppendorf | 5430 R | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Density gradient medium (Histopaque) | Sigma - Aldrich | 10771-100ML | Obtaining Monocyte-derived Dendritic Cells |
| EDTA | Gibco, ThermoFisher | 15400054 | Obtaining Monocyte-derived Dendritic Cells |
| Elisa kit (IFN-γ) | Immunotools | 31673539 | Maturation Profiling of mo-DCs |
| EVE automated cell count | NanoEntek | 10027-452 | Obtaining Monocyte-derived Dendritic Cells |
| Fetal bovine serum (FBS) | Gibco | 10500064 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile |
| Granulocyte-macrophage colony-stimulating factor (GM-CSF) | Miltenyi Biotec | 130-093-864 | Obtaining Monocyte-derived Dendritic Cells |
| Human CD14 microbeads (Immunomagnetic beads) | Miltenyi Biotec | 130-050-201 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-1β | Sigma - Aldrich | I9401 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-4 | Miltenyi Biotec | 130-093-919 | Obtaining Monocyte-derived Dendritic Cells |
| Interleukin (IL)-6 | Sigma - Aldrich | SRP3096 | Obtaining Monocyte-derived Dendritic Cells |
| L-glutamine | Gibco | A2916801 | Obtaining Monocyte-derived Dendritic Cells |
| LS column and plunger | Miltenyi Biotec | 130-042-401 | Obtaining Monocyte-derived Dendritic Cells |
| Maackia amurensis (MAA) lectin (MAA lectin - Biotinylated) | Vector labs | B-1265-1 | Determination of Sialic Acid Profile |
| MHC-I (HLA-ABC) | Immunotools | 21159033 | Maturation Profiling of mo-DCs |
| MHC-II (HLA-DR) | Immunostep | HLADRA-100T | Maturation Profiling of mo-DCs |
| Microtubes | AstiK’s | PCRP-E015-500 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Neuraminidase (Sialidase) | Roche | 11585886001 | Treatment of Cells with Sialidase |
| Non-essential amino acids (NEAA) | Gibco | 11140-050 | Obtaining Monocyte-derived Dendritic Cells |
| Paraformaldehyde (PFA 2%) | Polysciences Europe | 25085-1 | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Paraformaldehyde (PFA 4%) | Biotium | 22023 | Determination of Sialic Acid Profile |
| Pasteur pipettes | Labbox | PIPP-003-500 | Obtaining Monocyte-derived Dendritic Cells |
| Peanut (Arachis hypogaea) Agglutinin (PNA) lectin (PNA lectin - FITC) | Vector labs | FL-1071 | Determination of Sialic Acid Profile |
| Penicillin/streptomycin | Gibco | 15140163 | Obtaining Monocyte-derived Dendritic Cells |
| Phosphate Buffered Saline (PBS) | NZYTech | MB18201 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Prostaglandin E2 (PGE2) | Sigma - Aldrich | P0409 | Obtaining Monocyte-derived Dendritic Cells |
| RBC lysis buffer | BioLegend | 420302 | Obtaining Monocyte-derived Dendritic Cells |
| RPMI-1640 medium (containing 11.1 mM glucose) | Gibco | 31870074 | Obtaining Monocyte-derived Dendritic Cells; Treatment of Cells with Sialidase; Determination of Sialic Acid Profile |
| Sambucus nigra lectin (SNA lectin - Biotinylated) | Vector labs | B-1305-2 | Determination of Sialic Acid Profile |
| Sambucus nigra lectin (SNA lectin - FITC) | Vector labs | FL-1301-2 | Determination of Sialic Acid Profile |
| Sodium pyruvate | Thermofisher | 11360-070 | Obtaining Monocyte-derived Dendritic Cells |
| SpectroMax190 | Molecular Devices | Maturation Profiling of mo-DCs | |
| Streptavidin-PE | BioLegend | 405203 | Determination of Sialic Acid Profile; Maturation Profiling of mo-DCs |
| Tetramethylbenzidine (TMB) | Sigma - Aldrich | T0440 | Maturation Profiling of mo-DCs |
| Tumour necrosis factor-α (TNF-α) | Sigma - Aldrich | H8916 | Obtaining Monocyte-derived Dendritic Cells |
| Zeiss LSM710 confocal microscope | Zeiss | Determination of Sialic Acid Profile |
Referencias
- Varki, A., Gagneux, P. Multifarious roles of sialic acids in immunity. Annals of the New York Academy of Sciences. 1253, 16-36 (2012).
- Bochner, B. S., Zimmermann, N. Role of Siglecs and related glycan-binding proteins in immune responses and immunoregulation. The Journal of Allergy and Clinical Immunology. 135 (3), 598-608 (2015).
- Smith, B. A. H., Bertozzi, C. R. The clinical impact of glycobiology: Targeting selectins, Siglecs and mammalian glycans. Nature Reviews Drug Discovery. 20, 217-243 (2021).
- Schauer, R. Sialic acids as regulators of molecular and cellular interactions. Current Opinion in Structural Biology. 19 (5), 507-514 (2009).
- Manhardt, C. T., Punch, P. R., Dougher, C. W. L., Lau, J. T. Y. Extrinsic sialylation is dynamically regulated by systemic triggers in vivo. Journal of Biological Chemistry. 292 (33), 13514-13520 (2017).
- Cabral, M. G., et al. Human dendritic cells contain cell surface sialyltransferase activity. Immunology Letters. 131 (1), 89-96 (2010).
- Bordron, A., et al. Hyposialylation must be considered to develop future therapies in autoimmune diseases. International Journal of Molecular Sciences. 22 (7), 3402 (2021).
- Julien, S., Videira, P. A., Delannoy, P. Sialyl-Tn in cancer: (How) did we miss the target. Biomolecules. 2 (4), 435-466 (2012).
- Munkley, J. Aberrant sialylation in cancer: Therapeutic opportunities. Cancers. 14 (17), 4248 (2022).
- Dennis, J. W., Laferte, S., Waghorne, C., Breitman, M. L., Kerbel, R. S. S1-6 Branching of Asn-linked oligosaccharides is directly associated with metastasis. Science. 236 (4801), 582-585 (1987).
- Pinho, S. S., Reis, C. A. Glycosylation in cancer: Mechanisms and clinical implications. Nature Reviews Cancer. 15 (9), 540-555 (2015).
- Manni, M., Läubli, H. Targeting glyco-immune checkpoints for cancer therapy. Expert Opinion on Biological Therapy. 21 (8), 1063-1071 (2021).
- Sjögren, J., Lood, R., Nägeli, A. On enzymatic remodeling of IgG glycosylation; Unique tools with broad applications. Glycobiology. 30 (4), 254-267 (2020).
- Trastoy, B., et al. Sculpting therapeutic monoclonal antibody N-glycans using endoglycosidases. Current Opinion in Structural Biology. 72, 248-259 (2022).
- Pascoal, C., et al. Sialyl LewisX/A and cytokeratin crosstalk in triple negative breast cancer. Cancers. 15 (3), 731 (2023).
- von Itzstein, M., et al. Rational design of potent sialidase-based inhibitors of influenza virus replication. Nature. 363 (6428), 418-423 (1993).
- Gray, M. A., et al. Targeted glycan degradation potentiates the anticancer immune response in vivo. Nature Chemical Biology. 16 (12), 1376-1384 (2020).
- Fernandes, &. #. 1. 9. 4. ;., et al. Glycans as shapers of tumour microenvironment: A sweet driver of T-cell-mediated anti-tumour immune response. Immunology. 168 (2), 217-232 (2023).
- Togayachi, A., et al. Polylactosamine on glycoproteins influences basal levels of lymphocyte and macrophage activation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15829-15834 (2007).
- Park, D. D. Resident and elicited murine macrophages differ in expression of their glycomes and glycan-binding proteins. Cell Chemical Biology. 28 (4), 567-582 (2021).
- Steinman, R. M. Dendritic cells and immune-based therapies. Experimental Hematology. 24 (8), 859-862 (1996).
- Sabado, R. L., Bhardwaj, N. Directing dendritic cell immunotherapy towards successful cancer treatment. Immunotherapy. 2 (1), 37-56 (2010).
- Pardoll, D. M. The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews Cancer. 12 (4), 252-264 (2012).
- Steinman, R. M., Banchereau, J. Taking dendritic cells into medicine. Nature. 449 (7161), 419-426 (2007).
- So-Rosillo, R., Small, E. J. Sipuleucel-T (APC8015) for prostate cancer. Expert Review of Anticancer Therapy. 6 (9), 1163-1167 (2006).
- Cheever, M. A., Higano, C. S. PROVENGE (Sipuleucel-T) in prostate cancer: The first FDA-approved therapeutic cancer vaccine. Clinical Cancer Research. 17 (11), 3520-3526 (2011).
- Videira, P. A., et al. Surface α2-3- and α2-6-sialylation of human monocytes and derived dendritic cells and its influence on endocytosis. Glycoconjugate Journal. 25 (3), 259-268 (2008).
- Cabral, M. G., et al. The phagocytic capacity and immunological potency of human dendritic cells is improved by α2,6-sialic acid deficiency. Immunology. 138 (3), 235-245 (2013).
- Silva, Z., et al. MHC class I stability is modulated by cell surface sialylation in human dendritic cells. Pharmaceutics. 12 (3), 249 (2020).
- Silva, M., et al. Sialic acid removal from dendritic cells improves antigen cross-presentation and boosts anti-tumor immune responses. Oncotarget. 7 (27), 41053-41066 (2016).
- Crespo, H. J., et al. Effect of sialic acid loss on dendritic cell maturation. Immunology. 128, 621-631 (2009).
- Council of Europe. Guide to the Preparation, Use and Quality Assurance of Blood Components. Council of Europe. , (2017).
- LS Columns. Miltenyi Biotec Available from: https://www.miltenyibiotec.com/US-en/products/Is-columns.html#130-042-401 (2012)
- Nair, S., Archer, G. E., Tedder, T. F. Isolation and generation of human dendritic cells. Current Protocols in Immunology. 07, (2012).
- Wu, X., Xu, F., Liu, J., Wang, G. Comparative study of dendritic cells matured by using IL-1β, IL-6, TNF-α and prostaglandins E2 for different time span. Experimental and Therapeutic Medicine. 14 (2), 1389-1394 (2017).
- Naeim, F., Nagesh Rao, P., Song, S., Phan, R. Chapter 2 - Principles of Immunophenotyping. Atlas of Hematopathology. , 29-56 (2018).
- Cernadas, M., Lu, J., Watts, G., Brenner, M. B. CD1a expression defines an interleukin-12 producing population of human dendritic cells. Clinical and Experimental Immunology. 155, 523-533 (2009).
- Santambrogio, L., Strominger, J. L. The ins and outs of MHC class II proteins in dendritic cells. Immunity. 25 (6), 857-859 (2006).
- Raposo, C. D., Canelas, A. B., Barros, M. T. Human lectins, their carbohydrate affinities and where to find them. Biomolecules. 11 (2), 188 (2021).
- Videira, P. A. Q., et al. Patent WO2017002045. A viable cell population, method for production and uses thereof. Portugal patent. , (2017).
- Bai, L., Feuerer, M., Beckhove, P., Umansky, V., Schirrmacher, V. Generation of dendritic cells from human bone marrow mononuclear cells: Advantages for clinical application in comparison to peripheral blood monocyte derived cells. International Journal of Oncology. 20 (2), 247-253 (2002).
- Marques, G. S., Silva, Z., Videira, P. A. Antitumor efficacy of human monocyte-derived dendritic cells: Comparing effects of two monocyte isolation methods. Biological Procedures Online. 20, 4 (2018).
- Bax, M., et al. Dendritic cell maturation results in pronounced changes in glycan expression affecting recognition by Siglecs and galectins. Journal of Immunology. 179 (12), 8216-8224 (2007).
- Chinoy, Z. S., Montembault, E., Moremen, K. W., Royou, A., Friscourt, F. Impacting bacterial sialidase activity by incorporating bioorthogonal chemical reporters onto mammalian cell-surface sialosides. ACS Chemical Biology. 16 (11), 2307-2314 (2021).
- Chou, M. -. Y., Li, S. -. C., Li, Y. -. T. Cloning and expression of sialidase L, a NeuAcα2→3Gal-specific sialidase from the leech, Macrobdella decora. Journal of Biological Chemistry. 271 (32), 19219-19224 (1996).
- Crespo, H. J., Lau, J. T. Y., Videira, P. A. Dendritic cells: A spot on sialic acid. Frontiers in Immunology. 4, 491 (2013).
- Büll, C. Metabolic sialic acid blockade lowers the activation threshold of moDCs for TLR stimulation. Immunology & Cell Biology. 95 (4), 408-415 (2017).
- Ohmi, Y., et al. Majority of alpha2,6-sialylated glycans in the adult mouse brain exist in O -glycans: SALSA-MS analysis for knockout mice of alpha2,6-sialyltransferase genes. Glycobiology. 31 (5), 557-570 (2021).
- Chung, C., et al. Integrated genome and protein editing swaps α-2,6 sialylation for α-2,3 sialic acid on recombinant antibodies from CHO. Biotechnology Journal. 12 (2), 1600502 (2017).
- Hyvärinen, S., Meri, S., Jokiranta, T. S. Disturbed sialic acid recognition on endothelial cells and platelets in complement attack causes atypical hemolytic uremic syndrome. Blood. 127 (22), 2701-2710 (2016).
- Powell, L. D., Whiteheart, S. W., Hart, G. W. Cell surface sialic acid influences tumor cell recognition in the mixed lymphocyte reaction. Journal of Immunology. 139, 262-270 (1987).
- Corfield, A. P., Higa, H., Paulson, J. C., Schauer, R. The specificity of viral and bacterial sialidases for α(2-3)- and α(2-6)-linked sialic acids in glycoproteins. Biochimica et Biophysica Acta - Protein Structure and Molecular Enzymology. 744 (2), 121-126 (1983).
- Tkachenko, N., Wojas, K., Tabarkiewicz, J., Rolinski, J. Generation of dendritic cells from human peripheral blood monocytes - Comparison of different culture media. Folia Histochemica et Cytobiologica. 43, 25-30 (2005).
- Kim, S. J., et al. Human CD141+ dendritic cells generated from adult peripheral blood monocytes. Cytotherapy. 21 (10), 1049-1063 (2019).
- Calmeiro, J., et al. In-depth analysis of the impact of different serum-free media on the production of clinical grade dendritic cells for cancer immunotherapy. Frontiers in Immunology. 11, 593363 (2021).
- Stamatos, N. M., et al. LPS-induced cytokine production in human dendritic cells is regulated by sialidase activity. Journal of Leukocyte Biology. 88 (6), 1227-1239 (2010).
- Lehmann, F., Tiralongo, E., Tiralongo, J. Sialic acid-specific lectins: Occurrence, specificity and function. Cellular and Molecular Life Sciences. 63 (12), 1331-1354 (2006).
- Frosch, M., Görgen, I., Boulnois, G. J., Timmis, K. N., Bitter-Suermann, D. NZB mouse system for production of monoclonal antibodies to weak bacterial antigens: Isolation of an IgG antibody to the polysaccharide capsules of Escherichia coli K1 and group B meningococci. Proceedings of the National Academy of Sciences of the United States of America. 82 (4), 1194-1198 (1985).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados