A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التنميط الظاهري للخلايا العصبية الدوبامينية المشتقة من الخلايا الجذعية البشرية في الدماغ المتوسط
In This Article
Summary
يصف هذا البروتوكول زراعة الخلايا للخلايا العصبية الدوبامينية في الدماغ المتوسط البشري ، يليها تلطيخ مناعي وتوليد ملامح النمط الظاهري للخلايا العصبية من الصور المجهرية عالية المحتوى المكتسبة مما يسمح بتحديد الاختلافات المظهرية بسبب التحويرات الجينية أو الكيميائية.
Abstract
يرتبط مرض باركنسون (PD) بمجموعة من العمليات البيولوجية الخلوية التي تسبب فقدان الخلايا العصبية الدوبامينية في الدماغ المتوسط (mDA). تفتقر العديد من النماذج الخلوية PD الحالية في المختبر إلى التعقيد ولا تأخذ في الاعتبار الأنماط الظاهرية المتعددة. يمكن أن يعالج التنميط الظاهري في الخلايا العصبية mDA المشتقة من الخلايا الجذعية متعددة القدرات (iPSC) التي يسببها الإنسان أوجه القصور هذه عن طريق قياس مجموعة من الأنماط الظاهرية العصبية في وقت واحد في نوع الخلية ذات الصلة PD بالتوازي. هنا ، نصف بروتوكولا للحصول على ملفات تعريف النمط الظاهري وتحليلها من الخلايا العصبية mDA البشرية المتاحة تجاريا. يتم استخدام لوحة تلطيخ الفلورسنت الخاصة بالخلايا العصبية لتصور الأنماط الظاهرية ذات الصلة بالبروتين النووي ، α-synuclein ، هيدروكسيلاز التيروزين (TH) ، والبروتين المرتبط بالأنابيب الدقيقة 2 (MAP2). بروتوكول التنميط الظاهري الموصوف قابل للتطوير لأنه يستخدم ألواح 384 بئرا ومعالجة السوائل التلقائية والفحص المجهري عالي الإنتاجية. تتمثل فائدة البروتوكول في استخدام الخلايا العصبية mDA المانحة السليمة والخلايا العصبية mDA التي تحمل طفرة G2019S المرتبطة ب PD في جين كيناز 2 (LRRK2) الغني بالليوسين. تمت معالجة كلا خطي الخلايا بمثبط كيناز LRRK2 PFE-360 وتم قياس التغيرات الظاهرية. بالإضافة إلى ذلك ، نوضح كيف يمكن تحليل ملفات تعريف النمط الظاهري متعددة الأبعاد باستخدام طرق التصنيف الخاضعة للإشراف القائمة على التجميع أو التعلم الآلي. سيثير البروتوكول الموصوف اهتمام الباحثين الذين يعملون على نمذجة الأمراض العصبية أو دراسة تأثيرات المركبات الكيميائية في الخلايا العصبية البشرية.
Introduction
يتم إزعاج مجموعة متنوعة من العمليات البيولوجية الخلوية في مرض باركنسون (PD). على سبيل المثال ، ارتبط الخلل الوظيفي في الميتوكوندريا ، والإجهاد التأكسدي ، وعيوب تحلل البروتين ، وتعطيل الاتجار الحويصلي ووظيفة الليزوزومات الداخلية بفقدان الخلايا العصبية الدوبامينية في الدماغ المتوسط (mDA) ، ويلاحظ بشكل شائع في PD1. لذلك ، يبدو أن مرض باركنسون ينطوي على آليات مرضية متعددة يمكن أن تتفاعل مع بعضها البعض وتزيد من تفاقمها. تتمثل إحدى الطرق المفيدة للتحقيق في هذا التفاعل الميكانيكي في إنشاء بصمة مظهرية شاملة أو ملف تعريف للخلايا العصبية الدوبامينية في الدماغ المتوسط (mDA).
التنميط الظاهري هو نهج يتضمن إنشاء ملف تعريف لعينة بناء على مجموعة من الخصائص القابلة للقياس ، وثانيا ، يتضمن إجراء تنبؤات حول عينة بناء على هذا الملف الشخصي 2,3. الهدف من التنميط هو التقاط مجموعة متنوعة من الميزات ، قد لا يكون بعضها مرتبطا سابقا بمرض أو علاج3. نتيجة لذلك ، يمكن أن يكشف التنميط عن عمليات بيولوجية غير متوقعة. يعتمد التنميط الظاهري عادة على الخلايا الملطخة بالفلورسنت ، وقد تم تطوير فحوصات موحدة ، مثل طلاء الخلية ، لإنشاء ملامح النمط الظاهري4. في الآونة الأخيرة ، تم تطبيق التنميط الظاهري ، على سبيل المثال ، لتوصيف الجزيئات الصغيرة أو التنبؤ الدقيق بأنواع PD الفرعية فقط بناء على الخلايا الليفية المشتقة من المريض 5,6. على الرغم من هذه التطورات ، نادرا ما تم تطبيق التنميط الظاهري على الخلايا المتمايزة بعد الانقسام ، مثل الخلايا العصبية mDA المشتقة من الخلايا الجذعية متعددة القدرات التي يسببها الإنسان (iPSC) والتي تعبر عن طفرات مرتبطة بمرض باركنسون مثل LRRK2 G2019S. تشمل التحديات الكبيرة للنماذج المشتقة من iPSC وجود سمات مرضية دقيقة أو متغيرة عبر دفعات التمايز أو الأنماط الجينية ، وحقيقة أن الأنماط الظاهرية المعزولة لمرض باركنسون لا تلتقط التعقيد الكامل للمرض. علاوة على ذلك ، في حين أن النماذج العصبية iPSC ذات صلة من الناحية الفسيولوجية ، إلا أنها نادرا ما تستخدم في عمليات اكتشاف أدوية PD بسبب مخاوف بشأن التعقيد التقني 7,8.
لقد طورنا سابقا منهجية قوية لقياس الأنماط الظاهرية الفيزيولوجية المرضية المتعددة المرتبطة بمرض باركنسون في الخلايا العصبية mDA البشرية الحساسة للتغيرات المظهرية التي يسببها المركبات الجينيةوالكيميائية 9. توضح هذه المقالة بالتفصيل نسخة محسنة أخرى من هذه المنهجية لإنشاء ملفات تعريف النمط الظاهري من الخلايا العصبية mDA (الشكل 1). يتمتع هذا البروتوكول بالعديد من المزايا مقارنة بنهج التنميط الظاهري الموصوفة سابقا ، مثل استخدام الخلايا العصبية mDA عالية الجودة والتكاثر التقني. لأول مرة ، يتيح هذا البروتوكول التنميط الظاهري في الخلايا العصبية mDA ذات الصلة من الناحية الفسيولوجية بعد الانقسام بعد الاضطرابات الكيميائية بطريقة قابلة للتطوير بدرجة كبيرة. تتوفر الخلايا العصبية mDA المتمايزة والمحفوظة بالتبريد تجاريا ، مما يقلل بشكل كبير من تباين التمايز من دفعة إلى أخرى. ثانيا، يمكن زيادة تقليل التباين التقني باستخدام تصميم تجريبي محدد جيدا (أي مدة الاستزراع أو تجنب الآبار الحافة)، والمناولة الآلية للسوائل والفحص المجهري الآلي. بالإضافة إلى ذلك ، يتم توضيح الخطوات الأولية لتحليل ملف تعريف النمط الظاهري باستخدام نهج التجميع غير الخاضع للإشراف أو التصنيف الخاضع للإشراف هنا ، مما يشير إلى كيفية تحليل بيانات التنميط الظاهري. سيكون هذا البروتوكول مفيدا للباحثين المهتمين بالتغيرات المظهرية للخلايا العصبية mDA الناتجة عن الاضطرابات الجينية أو الكيميائية ، وتحديدا عندما تكون هناك حاجة إلى إعداد دراسة قابلة للتطوير بدرجة كبيرة ، على سبيل المثال ، أثناء حملات الفحص أو عندما يتم دراسة تأثيرات عدد أقل من المركبات ، على سبيل المثال ، لتحديد الآثار السامة. باختصار ، من المتوقع أن يكون تطبيق التنميط الظاهري للخلايا العصبية البشرية تقنية قيمة لدراسة الأنماط الظاهرية المعقدة المرتبطة بالأمراض وتوصيف التأثيرات الخلوية للأدوية المرشحة.
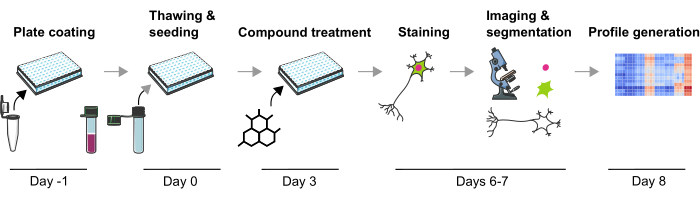
الشكل 1: تصوير تخطيطي للبروتوكول التجريبي لتوليد ملامح النمط الظاهري القائمة على الصور من الخلايا العصبية mDA المشتقة من iPSC البشرية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
1. تحضير الوسط والألواح لبذر الخلايا العصبية (اليوم الأول)
- لتحضير الأطباق لبذر الخلايا العصبية في اليوم 1 ، قم بتسخين اللامينين إلى درجة حرارة الغرفة (RT) قبل الاستخدام مباشرة. تحضير محلول Laminin عن طريق تخفيف محلول مخزون Laminin (0.1 مجم / مل) 1/10 في PBS +/+ البارد (مع Ca 2+ و Mg2+).
ملاحظة: جميع الكواشف مدرجة في جدول المواد. يتم وصف تركيبات الحلول والمخازن المؤقتة في الجداول 1-4. - بعد ذلك ، أضف 25 ميكرولتر من محلول Laminin إلى كل بئر من لوحة Poly-D-Lysine (PDL) المغلفة مسبقا ب 384 بئرا ، واحتضانها طوال الليل عند 4 درجات مئوية. يمكن تخزين الألواح المطلية في درجة حرارة 4 درجات مئوية لمدة تصل إلى أسبوع واحد.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا لمدة تصل إلى أسبوع واحد. لوحات الختم باستخدام فيلم من البلاستيك. - قم بإعداد وسائط الصيانة الكاملة وتخزينها في درجة حرارة 4 درجات مئوية لمدة تصل إلى شهر واحد (الجدول 1).
2. ذوبان الخلايا العصبية (اليوم 0)
- لإذابة الخلايا العصبية في اليوم 0 ، قم بتسخين حمام مائي إلى 37 درجة مئوية ، وقم بموازنة وسائط الصيانة الكاملة مع RT ، المحمية من الضوء.
- أخرج القارورة التي تحتوي على الخلايا العصبية المجمدة التي تم الحصول عليها تجاريا (انظر جدول المواد) من خزان النيتروجين السائل وضعها على الثلج الجاف. ثم ضع القارورة في حمام مائي لمدة 2 دقيقة. بمجرد إذابة السائل تماما ، قم بتطهير القارورة بنسبة 70٪ من الإيثانول.
- استنشاق الخلايا العصبية المذابة باستخدام ماصة P1000 (حوالي 370 ميكرولتر) ونقلها في أنبوب طرد مركزي سعة 50 مل دون سحب ماصة لأعلى ولأسفل. بعد ذلك ، اشطف القارورة ب 630 ميكرولتر من وسط الصيانة الكاملة ، واستغني قطرة قطرة (زاوية 45 درجة) في أنبوب 50 مل. حرك ببطء أثناء الاستغناء.
ملاحظة: من الأهمية بمكان الاستغناء عن الوسط ببطء ، قطرة قطرة ، لتجنب التمزق التناضحي للخلايا. تعمل الزاوية 45 درجة وتحريض الضوء على تقليل الضغط الاسموزي المحلي المرتفع أثناء الماصة. - وبالمثل ، أضف 1 مل من وسيط الصيانة الكاملة في أنبوب الطرد المركزي سعة 50 مل مع ماصة P1000. ثم أضف ببطء 2 مل من وسط الصيانة الكاملة. حرك بعناية أثناء الاستغناء.
- عد الخلايا. قم بإعداد أنبوب دقيق مع تعليق خلية Trypan Blue سعة 10 ميكرولتر و 10 ميكرولتر وإضافته إلى شريحة غرفة العد (10 ميكرولتر). قم بإجراء العد باستخدام عداد خلية آلي (انظر جدول المواد) أو يدويا.
- بعد العد ، قم بطرد مركزي أنبوب 50 مل يحتوي على الخلايا العصبية عند 400 × جم لمدة 5 دقائق في RT ، وإزالة المادة الطافية. أعد تعليق الحبيبات بعناية باستخدام ماصة P1000 و 1 مل من وسط الصيانة الكاملة. ثم أضف الحجم اللازم للوصول إلى التركيز المطلوب (300000 خلية / مل ، انظر أيضا الخطوة التالية).
3. بذر الخلايا العصبية على لوحات محضرة (اليوم 0)
- لزرع الخلايا العصبية على الأطباق المعدة في اليوم 0 ، أخرج الألواح المطلية من الثلاجة ، وضعها تحت غطاء زراعة الخلايا واتركها تتوازن مع RT لمدة 30 دقيقة تقريبا.
- قبل البذر مباشرة ، قم بنضح محلول طلاء سعة 15 ميكرولتر باستخدام معالج سائل آلي أو ماصة ذات 16 قناة. اترك حوالي 10 ميكرولتر لكل بئر لمنع تلف الطلاء.
- بعد ذلك ، قم بتوزيع 50 ميكرولتر من محلول الخلية الذي يحتوي على 300000 خلية / مل (تم تحضيره في الخطوة 2.6) لكل بئر باستخدام ماصة ذات 16 قناة ، مما ينتج عنه 15000 خلية عصبية مصنفة لكل بئر وحجم نهائي لكل بئر يبلغ 60 ميكرولتر.
- في لوحة 384 بئرا ، تجنب استخدام الأعمدة 1 و 2 و 23 و 24 والصفوف A و B و O و P لتقليل تأثيرات الحافة المحتملة التي يمكن أن تؤثر على ملامح النمط الظاهري. املأ الآبار الفارغة غير المستخدمة ب 80 ميكرولتر من برنامج تلفزيوني. احتضان الألواح عند 37 درجة مئوية و 5٪ CO2.
4. تغيير متوسط أو معالجة مركبة (اليوم 3)
- اعتمادا على عدد الآبار ، قم بتسخين حجم مناسب من وسيط الصيانة الكاملة مسبقا في RT.
- إذا كان التغيير المتوسط مطلوبا ، فانتقل إلى الخطوة 4.4. إذا كانت المعالجة المركبة مطلوبة ، تحقق من تركيز المخزون المركب والمذيب المستخدم (الماء ، DMSO ، الميثانول ، إلخ).
- قم بإعداد محلول مركب مركز 1.5x لجميع التركيزات المطلوبة المراد اختبارها. تحضير التخفيفات المركبة باستخدام وسيط الصيانة الكامل.
ملاحظة: كعنصر تحكم محايد ، استخدم المذيب المعني بنفس تركيز المركب المختبر. إذا تم استخدام مركبات متعددة أو غير معروفة بتركيزات مختلفة ، فمن المستحسن إجراء تجربة استجابة منفصلة للجرعة لقياس تأثيرات المذيبات على المظهر الظاهري. - إذا تم استخدام نظام سحب تلقائي ، أضف 60 ميكرولتر من المحلول المركب 1.5x إلى لوحة تخزين 384 بئرا. بدلا من ذلك ، استخدم ماصة ذات 16 قناة. إذا كان التغيير المتوسط مطلوبا ، أضف 60 ميكرولتر من وسيط الصيانة الكاملة بدلا من ذلك.
- باستخدام نظام السحب التلقائي ، قم بشفط وتجاهل 40 ميكرولتر من الوسط لكل بئر من اللوحة المحتوية على الخلايا العصبية للحفاظ على 20 ميكرولتر / بئر. ثم أضف 40 ميكرولتر / بئر من محلول مركب 1.5x من لوحة تخزين 384 بئرا إلى كل بئر للحصول على التركيز النهائي المطلوب.
ملاحظة: من الأهمية بمكان عدم إجراء تغييرات متوسطة كاملة ولكن ترك الوسط المتبقي دائما في البئر لمنع تلف السجادة العصبية أو الطلاء. - في حالة إجراء الثقافة العصبية لأكثر من 6 أيام موصوفة في هذا البروتوكول ، قم بتغيير الوسيط كل 2-3 أيام.
5. تثبيت الخلايا العصبية وتلطيخها (الأيام من 6 إلى 7)
- لإصلاح الخلايا العصبية وتلطيخها في اليومين 6 و 7 ، استخدم معالج سائل آلي لجميع خطوات التوزيع والغسيل. بدلا من ذلك ، استخدم ماصة ذات 16 قناة.
- قم بإعداد محلول Triton X-100 بنسبة 10٪ عن طريق تخفيف Triton X-100 في 1x PBS. دوامة حتى الحل متجانسة. يحفظ في درجة حرارة 4 درجة مئوية.
- لإصلاح الخلايا العصبية ، قم بتوزيع 20 ميكرولتر / بئر من 16٪ PFA مما يؤدي إلى تركيز نهائي بنسبة 4٪. احتضن الطبق لمدة 30 دقيقة في RT ، واغسله ثلاث مرات باستخدام 1x PBS. اترك 20 ميكرولتر / بئر من برنامج تلفزيوني بعد الغسيل الأخير.
تنبيه: يتم التعرف على PFA كمادة خطرة معروفة بأنها تسبب سمية الفم والجلد والجهاز التنفسي. كما أنه يشكل تهديدا للعيون وقد يؤدي إلى طفرات جينية وسرطان. يتطلب التعامل السليم مع PFA استخدام معدات الحماية الشخصية المناسبة ، مثل حماية العين والوجه ، بالإضافة إلى ضمان التهوية المناسبة. من المهم منع إطلاق PFA في البيئة. - للنفاذية والحجب ، قم بإعداد حل حظر 2x (الجدول 2).
- أضف 20 ميكرولتر / بئر من محلول مانع 2x (تركيز نهائي 1x) ، واحتضان لمدة 1 ساعة في RT ، واغسله مرة واحدة باستخدام PBS. احتفظ ب 20 ميكرولتر / بئر من PBS بعد الغسيل.
- بالنسبة لتلطيخ الأجسام المضادة الأولية (انظر جدول المواد) ، قم بإعداد مخزن مؤقت للتلطيخ الأولي 2x (الجدول 3).
- أضف 20 ميكرولتر / بئر من 2x مخزن تلطيخ أولي (1x تركيز نهائي) واحتضان طوال الليل عند 4 درجات مئوية. في صباح اليوم التالي في اليوم 7 ، اغسل ثلاث مرات باستخدام برنامج تلفزيوني. اترك 20 ميكرولتر / بئر من PBS بعد الغسيل.
- بالنسبة لتلطيخ الأجسام المضادة الثانوية (انظر جدول المواد) ، قم بإعداد مخزن مؤقت ثانوي للتلطيخ 2x (الجدول 4).
- أضف 20 ميكرولتر / بئر من 2x مخزن تلطيخ ثانوي (1x تركيز نهائي) ، واحتضان لمدة ساعتين في RT بعيدا عن الضوء ، واغسل ثلاث مرات باستخدام PBS. اترك 100 ميكرولتر PBS / جيدا بعد آخر غسلة.
- أضف ختم الألومنيوم على اللوحة لتقليل التبخر. بدلا من ذلك ، قم بتغطية اللوحة باستخدام فيلم بلاستيكي وورق الألمنيوم. انتقل إلى الحصول على الصور ، أو قم بتخزين اللوحة في درجة حرارة 4 درجات مئوية.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا لمدة تصل إلى أسبوع واحد. إذا لوحظ مضان الخلفية ، ففكر في زيادة وقت الحظر. إذا كان التلوين غير كاف ، فحاول زيادة تركيز الأجسام المضادة الأولية أو وقت الحضانة.
- أضف ختم الألومنيوم على اللوحة لتقليل التبخر. بدلا من ذلك ، قم بتغطية اللوحة باستخدام فيلم بلاستيكي وورق الألمنيوم. انتقل إلى الحصول على الصور ، أو قم بتخزين اللوحة في درجة حرارة 4 درجات مئوية.
6. تصوير الخلايا العصبية الملطخة بالفلورسنت (اليوم 7)
- احصل على صور للخلايا العصبية المطلية والمستزرعة والملطخة في اليوم 7. من الناحية المثالية ، استخدم مجهرا مضان متحد البؤر آليا (انظر جدول المواد). بدلا من ذلك ، احصل على الصور يدويا.
- احصل على قنوات Hoechst و TH و α-synuclein و MAP2 باستخدام ليزر 405 نانومتر و 488 نانومتر و 561 نانومتر و 647 نانومتر على التوالي (الشكل 2).
ملاحظة: لتوليد كمية كافية من البيانات التفصيلية للتنميط الظاهري ، استخدم هدف 40x واحصل على 16 حقلا / بئرا باستخدام مداخن Z تتكون من 3 شرائح Z مفصولة ب 2 ميكرومتر. في حالة وجود أضرار متعلقة بالماصة في السجادة العصبية ، حاول تجنب تصوير هذه المناطق. - اعتمادا على المجهر والكاميرا ، اضبط أوقات التعرض وشدة الإثارة لكل قناة من قنوات الفلورسنت الأربع بشكل منفصل للحصول على نطاق ديناميكي مثالي لشدة الفلورسنت.
ملاحظة: غالبا ما يوفر برنامج التصوير مدرجا تكراريا لتحديد وقت التعرض المثالي. إذا تم إزاحة الرسم البياني كثيرا إلى اليسار في نطاق الإشارة المنخفض ، فإن وقت التعرض قصير جدا أو تكون شدة الإثارة منخفضة جدا. إذا كان هناك جرف حاد عند الحد الأقصى لمستوى الإشارة على اليمين ، فإن قيمة الإشارة مشبعة. في هذه الحالة ، قلل من شدة الإثارة أو تقصير وقت التعرض. - قم بتخزين الصور بتنسيق مفتوح وخالي من الضياع مثل .tif.
7. معالجة الصور (اليوم 8)
- تجزئة الصورة واستخراج ميزة النمط الظاهري مطلوبة لإنشاء ملفات تعريف النمط الظاهري الكمية. استخدم برنامج PhenoLink لتجزئة الصور واستخراج الميزات (جدول المواد). يمكن العثور على تعليمات تثبيت PhenoLink في مستودع GitHub (https://github.com/Ksilink/PhenoLink).
ملاحظة: يتم استخدام تجزئة الصورة لتحديد وفصل الكائنات أو المناطق المختلفة في الصورة ، بينما يتم استخدام استخراج ميزة النمط الظاهري لتحليل واستخراج المعلومات ذات الصلة من تلك المناطق. تتوفر العديد من حلول البرامج البديلة ، مثل CellProfiler 10 أو ImageJ / FIJI11 أو Napari12 أو Knime AnalyticsPlatform 13 لاستخراج المعلومات الكمية من الصور الفلورية متعددة القنوات. - قم بإجراء تجزئة الصورة على الصور الأولية المصححة للإضاءة. حدد عتبات شدة قناة الفلورسنت المعنية تجريبيا لكل لوحة بحيث تكون إشارة الخلفية ضئيلة ، وتتوافق الإشارة المجزأة المطلوبة مع الإشارة في الصورة الأولية. عادة ما تتطلب اللوحات المعالجة والملطخة في نفس اليوم عتبات كثافة قناة مماثلة للتجزئة.
- تحديد حجم النواة وشدتها لفصل الخلايا الحية عن الخلايا الميتة. عند استخدام صور 40x ، احتفظ بجميع المعلمات الافتراضية الأخرى وقم بتشغيل البرنامج. سيتم حساب مائة وستة وعشرين معلما كميا للصور لكل بئر (الجدول التكميلي 1).
- استخدم البيانات الكمية الجدولية الناتجة لبناء ملامح النمط الظاهري ومقارنة ملامح النمط الظاهري من خطوط الخلايا المختلفة أو ظروف العلاج. يتوافق كل صف مع حالة بيولوجية (بئر) ويتوافق كل عمود مع ميزة النمط الظاهري المحددة.
ملاحظة: نقدم مثالا لملف الإخراج مع خط أنابيب تحليل البيانات لتوضيح استخدامه (انظر جدول المواد). بالإضافة إلى ذلك ، يوضح الشكل 3 تكوين ملف تعريف النمط الظاهري.
8. توليد ملف تعريف النمط الظاهري والتصور (اليوم 8)
- إذا لم يكن لديك Python و Jupyter مثبتين على جهاز الكمبيوتر الخاص بك ، فقم بتثبيت توزيع Anaconda وافتح برنامج Jupyter. قم بتنزيل دفتر ملاحظات Jupyter المقدم وجميع الملفات الأخرى المتوفرة واحفظها في نفس الدليل (انظر جدول المواد). افتح ملف دفتر ملاحظات Jupyter باستخدام برنامج Jupyter.
ملاحظة: Anaconda عبارة عن نظام أساسي مجاني ومفتوح المصدر للغات البرمجة مثل Python. تأتي هذه المنصة مع مترجم Python Jupyter الذي يمكنه تنفيذ دفتر Jupyter المقدم لإنشاء وتحليل ملفات تعريف النمط الظاهري (https://github.com/Ksilink/Notebooks/tree/main/Neuro/DopaNeuronProfiling). - قم بتنفيذ دفتر ملاحظات Jupyter خلية تلو الأخرى باستخدام برنامج Jupyter. يجب وضع نموذج البيانات المتوفرة .fth وملفات .txt المتطلبات في نفس الدليل مثل دفتر ملاحظات Jupyter. يتم شرح كل خلية دفتر ملاحظات Jupyter لشرح وظائفها.
ملاحظة: من الضروري استخدام دفتر ملاحظات Jupyter بالترتيب الصحيح بدءا من تحميل البيانات وقياسها والمتابعة خلية تلو الأخرى حتى النهاية. سيتم تخزين جميع البيانات ومخرجات الرسومات في مجلد تم إنشاؤه حديثا في دليل مصدر دفتر ملاحظات Jupyter. يوضح الشكل 4 سير العمل وإخراج سير العمل.
النتائج
يعد التنميط الظاهري في الخلايا العصبية mDA طريقة فعالة لتحديد جوانب متعددة من البيولوجيا الخلوية وتغيراتها أثناء التعديل التجريبي. لتجسيد هذه المنهجية ، استخدمت هذه الدراسة LRRK2 G2019S المحفوظة بالتبريد والخلايا العصبية mDA المانحة الصحية. تم تمييز هذه الخلايا العصبية لمدة 37 يوما تقريبا ، وهي ?...
Discussion
التنميط الظاهري هو تقنية لقياس عدد كبير من الأنماط الظاهرية في الخلايا عن طريق تطبيق تلطيخ الفلورسنت والفحص المجهري وتحليل الصور3. يمكن الحصول على ملامح النمط الظاهري ومقارنتها عبر خطوط الخلايا أو الظروف التجريبية الأخرى لفهم التغيرات المعقدة في البيولوجيا الخلوية التي قد ?...
Disclosures
يتم توظيف جميع المؤلفين من قبل Ksilink.
Acknowledgements
يود المؤلفون أن يشكروا جميع الزملاء في Ksilink على مساعدتهم القيمة ومناقشاتهم التي أدت إلى تصميم البروتوكول المقدم.
Materials
| Name | Company | Catalog Number | Comments |
| Anti- chicken – Alexa 647 | Jackson ImmunoRearch | 703-605-155 | Immunofluorescence |
| Anaconda | https://www.anaconda.com/download | ||
| Anti-Map2 | Novus | NB300-213 | Immunofluorescence |
| Anti-mouse - Alexa 488 | Thermo Fisher | A11001 | Immunofluorescence |
| Anti-rabbit - Alexa 555 | Thermo Fisher | A21429 | Immunofluorescence |
| Anti-Tyrosine Hydroxylase | Merck | T2928 | Immunofluorescence |
| Anti-α-synuclein | Abcam | 138501 | Immunofluorescence |
| Bravo Automated Liquid Handling Platform with 384ST head | Agilent | If no liquid handler is available, the use of an electronic multichannel pipette is recommended. | |
| Confocal microscope | Yokogawa | CV7000 | The use of an automated confocal fluorescence microscope is recommended to ensure image quality consistency. |
| Countess Automated cell counter | Invitrogen | Cell counting before seeding. Can also be done using a manual counting chamber. | |
| DPBS +/+ | Gibco | 14040-133 | Buffer for washing |
| EL406 Washer Dispenser | BioTek (Agilent) | If no liquid handler is available, the use of an electronic multichannel pipette is recommended. | |
| Formaldehyde Solution (PFA 16 %) | Euromedex | EM-15710-S | Fixation before staining |
| Hoechst 33342 | Invitrogen | H3570 | Nuclear staining |
| iCell Base Medium 1 | Fujifilm | M1010 | Base medium for neurons |
| iCell DPN, Donor#01279, Phenotype AHN, lot#106339, 1M | Fujifilm | C1087 | Apparently healthy donor |
| iCell DPN, Donor#11299, Phenotype LRRK2 G2019S, phenotype PD lot#106139 | Fujifilm | C1149 | Donor carrying LRRK2 G2019S mutation |
| iCell Nervous System Supplement | Fujifilm | M1031 | Supplement for base medium |
| iCell Neural Supplement B | Fujifilm | M1029 | Supplement for base medium |
| Jupyter Python Notebook | In-house development | https://github.com/Ksilink/Notebooks/tree/main/Neuro/DopaNeuronProfiling | Notebook to perform phenotypic profile visualization and classification from raw data. |
| Laminin | Biolamina | LN521 | Plate coating |
| PFE-360 | MedChemExpress | HY-120085 | LRRK2 kinase inhibitor |
| PhenoLink | In-house development | https://github.com/Ksilink/PhenoLink | Software for image analysis |
| PhenoPlate 384w, PDL coated | Perkin Elmer | 6057500 | Pre-coated plate for cell culture and imaging. This plate allows imaging of all wells using all objectives of the Yokogawa CV7000 microscope. |
| Storage plates Abgene 120 µL | Thermo Scientific | AB-0781 | Necessary for compound dispensing using the Vprep pipetting system. If not available, the use of an electronic multichannel pipette is recommended. |
| Triton | Sigma | T9284 | Permeabilization before lysis |
| Trypan Blue | Sigma | T8154-20ML | Determination of living cells |
| Vprep Pipetting System | Agilent | Medium change and compound dispensing. Alternatively, an electronic multichannel pipette can be used. |
References
- Panicker, N., Ge, P., Dawson, V. L., Dawson, T. M. The cell biology of Parkinson's disease. The Journal of Cell Biology. 220 (4), 202012095 (2021).
- Caicedo, J. C., et al. Data-analysis strategies for image-based cell profiling. Nature Methods. 14 (9), 849-863 (2017).
- Chandrasekaran, S. N., Ceulemans, H., Boyd, J. D., Carpenter, A. E. Image-based profiling for drug discovery: due for a machine-learning upgrade. Nature Reviews Drug Discovery. 20 (2), 145-159 (2021).
- Bray, M. -. A., et al. Cell Painting, a high-content image-based assay for morphological profiling using multiplexed fluorescent dyes. Nature Protocols. 11 (9), 1757-1774 (2016).
- Schiff, L., et al. Integrating deep learning and unbiased automated high-content screening to identify complex disease signatures in human fibroblasts. Nature Communications. 13 (1), 1590 (2022).
- Ziegler, S., Sievers, S., Waldmann, H. Morphological profiling of small molecules. Cell Chemical Biology. 28 (3), 300-319 (2021).
- Cobb, M. M., Ravisankar, A., Skibinski, G., Finkbeiner, S. iPS cells in the study of PD molecular pathogenesis. Cell and Tissue Research. 373 (1), 61-77 (2018).
- Elitt, M. S., Barbar, L., Tesar, P. J. Drug screening for human genetic diseases using iPSC models. Human Molecular Genetics. 27 (R2), 89-98 (2018).
- Vuidel, A., et al. High-content phenotyping of Parkinson's disease patient stem cell-derived midbrain dopaminergic neurons using machine learning classification. Stem Cell Reports. 17 (10), 2349-2364 (2022).
- Stirling, D. R., Swain-Bowden, M. J., Lucas, A. M., Carpenter, A. E., Cimini, B. A., Goodman, A. CellProfiler 4: improvements in speed, utility and usability. BMC Bioinformatics. 22 (1), 433 (2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Sofroniew, N., et al. . napari: a multi-dimensional image viewer for Python. , (2022).
- Berthold, M. R., et al. KNIME: The Konstanz Information Miner. Data Analysis, Machine Learning and Applications. , 319-326 (2008).
- Fathi, A., et al. Diverging Parkinson's Disease Pathology between patient-derived GBAN370S, LRRK2G2019S and engineered SNCAA53T iPSC-derived Dopaminergic Neurons. bioRxiv. , (2023).
- Wang, Y., Huang, H., Rudin, C., Shaposhnik, Y. Understanding How Dimension Reduction Tools Work: An Empirical Approach to Deciphering t-SNE, UMAP, TriMap, and PaCMAP for Data Visualization. Journal of Machine Learning Research. 22 (201), 1-73 (2021).
- Ke, G., et al. LightGBM: A highly efficient gradient boosting decision tree. Advances in Neural Information Processing Systems. 30, (2017).
- Avazzadeh, S., Baena, J. M., Keighron, C., Feller-Sanchez, Y., Quinlan, L. R. Modelling Parkinson's Disease: iPSCs towards Better Understanding of Human Pathology. Brain Sciences. 11 (3), 373 (2021).
- Sánchez-Danés, A., et al. Disease-specific phenotypes in dopamine neurons from human iPS-based models of genetic and sporadic Parkinson's disease. EMBO Molecular Medicine. 4 (5), 380-395 (2012).
- Oosterveen, T., et al. Pluripotent stem cell derived dopaminergic subpopulations model the selective neuron degeneration in Parkinson's disease. Stem Cell Reports. 16 (11), 2718-2735 (2021).
- Hughes, R. E., et al. Multiparametric high-content cell painting identifies copper ionophores as selective modulators of esophageal cancer phenotypes. ACS Chemical Biology. 17 (7), 1876-1889 (2022).
- Akbarzadeh, M., et al. Morphological profiling by means of the Cell Painting assay enables identification of tubulin-targeting compounds. Cell Chemical Biology. 29 (6), 1053-1064 (2022).
- Schiff, L., et al. Integrating deep learning and unbiased automated high-content screening to identify complex disease signatures in human fibroblasts. Nature Communications. 13 (1), 1590 (2022).
- Way, G. P., et al. Morphology and gene expression profiling provide complementary information for mapping cell state. Cell Systems. 13 (11), 911-923 (2022).
- Feng, Y., Mitchison, T. J., Bender, A., Young, D. W., Tallarico, J. A. Multi-parameter phenotypic profiling: using cellular effects to characterize small-molecule compounds. Nature Reviews Drug Discovery. 8 (7), 567-578 (2009).
- Antonov, S. A., Novosadova, E. V. Current state-of-the-art and unresolved problems in using human induced pluripotent stem cell-derived dopamine neurons for parkinson's disease drug development. International Journal of Molecular Sciences. 22 (7), 3381 (2021).
- Miller, J. D., et al. Human iPSC-based modeling of late-onset disease via progerin-induced aging. Cell Stem Cell. 13 (6), 691-705 (2013).
- Bezard, E., Gross, C. E., Brotchie, J. M. Presymptomatic compensation in Parkinson's disease is not dopamine-mediated. Trends in Neurosciences. 26 (4), 215-221 (2003).
- Wu, Y., Le, W., Jankovic, J. Preclinical Biomarkers of parkinson disease. Archives of Neurology. 68 (1), 22-30 (2011).
- Verstraelen, P., et al. Systematic quantification of synapses in primary neuronal culture. iScience. 23 (9), 101542 (2020).
- Liu-Yesucevitz, L., et al. ALS-Linked mutations enlarge TDP-43-enriched neuronal RNA granules in the dendritic arbor. The Journal of Neuroscience. 34 (12), 4167-4174 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved