A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
منهجية لتعطيل البكتيريا الأيضية لأبحاث التهاب Caenorhabditis elegans
In This Article
Summary
مصدر الغذاء ل Caenorhabditis elegans في المختبر هو الإشريكية القولونية الحية. نظرا لأن البكتيريا نشطة في التمثيل الغذائي ، فإنها تقدم متغيرا مربكا في الدراسات الأيضية والدوائية في C. elegans. يتم وصف بروتوكول مفصل لتعطيل البكتيريا الأيضية باستخدام بارافورمالدهيد هنا.
Abstract
Caenorhabditis elegans هو كائن نموذجي شائع للبحث في علم الوراثة والتنمية والشيخوخة والتمثيل الغذائي والسلوك. نظرا لأن C. elegans تستهلك نظاما غذائيا من البكتيريا الحية ، فإن النشاط الأيضي لمصدر غذائها يمكن أن يربك التجارب التي تبحث عن التأثيرات المباشرة للتدخلات المختلفة على الدودة. لتجنب الآثار المربكة لعملية التمثيل الغذائي البكتيرية ، استخدم باحثو C. elegans طرقا متعددة لتعطيل البكتيريا الأيضية ، بما في ذلك الأشعة فوق البنفسجية (UV) ، والقتل الحراري ، والمضادات الحيوية. المعالجة بالأشعة فوق البنفسجية منخفضة الإنتاجية نسبيا ولا يمكن استخدامها في الثقافة السائلة لأنه يجب فحص كل لوحة بحثا عن قتل بكتيري ناجح. تؤثر طريقة العلاج الثانية ، القتل الحراري ، سلبا على نسيج البكتيريا وجودتها الغذائية ، مما يؤدي إلى توقف نمو C. elegans. أخيرا ، يمكن للعلاج بالمضادات الحيوية أن يغير بشكل مباشر فسيولوجيا C. elegans بالإضافة إلى منع نمو البكتيريا. تصف هذه المخطوطة طريقة بديلة لتعطيل البكتيريا الأيضية باستخدام بارافورمالدهايد (PFA). يربط علاج PFA البروتينات داخل الخلايا البكتيرية لمنع النشاط الأيضي مع الحفاظ على البنية الخلوية والمحتوى الغذائي. هذه الطريقة عالية الإنتاجية ويمكن استخدامها في الزراعة السائلة أو الألواح الصلبة ، حيث أن اختبار لوحة واحدة من البكتيريا المعالجة ب PFA للنمو يتحقق من صحة الدفعة بأكملها. يمكن استخدام تعطيل التمثيل الغذائي من خلال علاج PFA للقضاء على الآثار المربكة لعملية التمثيل الغذائي البكتيرية على دراسات مكملات الأدوية أو المستقلب ، ومقاومة الإجهاد ، والأيض ، والسلوك في C. elegans.
Introduction
تم اقتراح Caenorhabditis elegans في الأصل ككائن نموذجي في عام 19651 ومنذ ذلك الحين تم اعتماده على نطاق واسع في دراسات علم الوراثة والتنمية والسلوك والشيخوخة والتمثيل الغذائي2. نظرا لحجم الحضنة الكبير والبشرة الشفافة ، فإن C. elegans مناسبة بشكل خاص للفحص عالي الإنتاجية مع مراسلي الفلورسنت3. كما أن دورة حياتها القصيرة ، والتكاثر الخنثى ، والتماثل الجيني مع البشر تجعل من C. elegans نظاما نموذجيا قيما للدراسات حول التطور4 وبيولوجيا الشيخوخة5. علاوة على ذلك ، من السهل نسبيا الحفاظ على C. elegans. يمكن زراعة الديدان في الثقافة السائلة أو على ألواح أجار صلبة وتستهلك نظاما غذائيا من بكتيريا الإشريكية القولونية OP50 الحية4.
ومع ذلك ، فإن مصدر الغذاء الحي ل C. elegans يمكن أن يربك دراسات التمثيل الغذائي ومكملات الأدوية والسلوك. نظرا لأن البكتيريا الحية لها عملية التمثيل الغذائي الخاصة بها ، فإن الظروف التجريبية التي تؤثر على البكتيريا تغير أيضا العناصر الغذائية والمستقلبات المتاحة للديدان. على سبيل المثال ، الاختلافات في تركيزات الحديد البكتيري والأحماض الأمينية وحمض الفوليك لها تأثيرات متنوعة على تطور C. elegans وعلم وظائف الأعضاء وعمر6. يمكن للعديد من الممارسات المعملية الشائعة أن تثير مثل هذه التغييرات في تكوين المغذيات والمستقلبات التي ينتجها OP50. على وجه التحديد ، فإن التعرض ل 5-fluoro-2'-deoxyuridine (FUdR) ، وهو مركب شائع الاستخدام لمنع التكاثر في C. elegans ، يثير تغييرات واسعة في التعبير الجيني OP50 ، بما في ذلك مسارات التخليق الحيويللأحماض الأمينية 7. يمكن للبكتيريا الحية أيضا أن تربك الدراسات التي تستكمل فيها C. elegans بجزيئات صغيرة لأن البكتيريا يمكنها استقلاب المركبات النشطة جزئيا أو كليا. علاوة على ذلك ، فإن تأثيرات هذه الجزيئات الصغيرة على البكتيريا يمكن ، بدورها ، تغيير فسيولوجيا C. elegans ، كما ورد مع عقار الميتفورمين8 الذي يطيل العمر. أخيرا ، يمكن للبكتيريا الحية تغيير بيئة الدودة بطرق تغير السلوك ، مثل إفراز الروائحالجذابة 9 ، وإنتاج معدلات عصبية خارجية10 ، وإنشاء تدرجات الأكسجين في حديقة بكتيرية كثيفة11.
للتخفيف من الآثار المربكة لعملية التمثيل الغذائي البكتيرية على أبحاث C. elegans ، تم تطوير طرق متعددة لقتل البكتيريا (الجدول 1). ثلاث استراتيجيات شائعة لقتل OP50 هي الأشعة فوق البنفسجية والقتل الحراري والعلاج بالمضادات الحيوية. على الرغم من أنها مباشرة ومنخفضة التكلفة نسبيا ، إلا أن كل طريقة من هذه الطرق يمكن أن يكون لها تأثيرات غير مرغوب فيها على كل من البكتيريا و C. elegans. قتل الأشعة فوق البنفسجية عبر رابط متشابك للأشعة فوق البنفسجية12 منخفض الإنتاجية والمعدل محدود بعدد اللوحات التي يمكن وضعها في الوصلة المتشابكة للأشعة فوق البنفسجية. علاوة على ذلك ، يمكن أن تختلف فعالية قتل الأشعة فوق البنفسجية من لوحة إلى أخرى داخل دفعة ، وقد يصبح اختبار النمو على جميع الألواح صعبا في التجارب الكبيرة. يأتي OP50 القاتل للحرارة من خلال تعريض الثقافة لدرجات حرارة تصل إلى >60 درجة مئوية مع مجموعة منفصلة من التحديات. يمكن أن تؤدي الحرارة العالية إلى إتلاف العناصر الغذائية الضرورية للدودة وتدمير البنية الخلوية للبكتيريا ، مما يخلق نسيجا أكثر نعومة يقلل من مقدار الوقت الذي تقضيه الديدان في الطعام13. لا يمكن استخدام هذه الطريقة أيضا طوال دورة حياة C. elegans لأن الديدان التي تتغذى على البكتيريا المقتولة بالحرارة يمكن أن تتوقف في وقت مبكر من التطور13. العلاج بالمضادات الحيوية هو طريقة ثالثة شائعة لقمع التمثيل الغذائي البكتيري14 ، ولكن المضادات الحيوية يمكن أن تغير أيضا نمو الدودة والتمثيل الغذائي15.
أحد الحلول للقضاء على الآثار الأيضية للبكتيريا الحية مع الحفاظ على البنية البكتيرية والعناصر الغذائية الأساسية هو قتل OP50 باستخدام بارافورمالدهيد (PFA) 16. PFA هو بوليمر من الفورمالديهايد يمكنه ربط البروتينات داخل الخلايا17 لمنع تكاثر البكتيريا دون تدمير هياكل الخلايا الداخلية مثل غشاء البلازما الداخلي18. بسبب هذا الحفاظ على البنية الخلوية الداخلية ، لا تظهر البكتيريا المعالجة ب PFA أي نمو أو نشاط استقلابي ولكنها تظل مصدرا غذائيا صالحا للأكل وغنيا بالمغذيات ل C. elegans16. هنا ، يتم توفير بروتوكول مفصل يوضح كيفية تعطيل البكتيريا الأيضية باستخدام بارافورمالدهيد.
| أسلوب | المواد المطلوبة | قابله؟ | الغذائيه؟ | الآثار على الدودة؟ | ||||
| الاشعه فوق البنفسجيه | الأشعة فوق البنفسجية المتقاطعة | مقيد ب: | نعم | تأثيرات متغيرة على العمر الافتراضي على NGM12 و 23 و 24 | ||||
| عدد اللوحات التي تتناسب مع الأشعة فوق البنفسجية المتشابكة | التأثيرات المتغيرة على العمر الافتراضي على FUdR24 و 26 و 27 | |||||||
| وقت التشعيع لكل لوحة | انخفاض تفضيل الطعام16 | |||||||
| القدرة على فحص كل لوحة للنمو8 | ||||||||
| حرارة | حاضنة >60 درجة مئوية | نعم | لا: يدمر جدار الخلية ، ويقلل من القيمة الغذائية | السكتة التنموية 13 | ||||
| انخفاض تفضيل الطعام13 | ||||||||
| يطيل العمر الافتراضي على NGM31 | ||||||||
| المضادات الحيويه | المضادات الحيوية (كاناميسين ، كاربينيسيلين ، إلخ) | نعم | نعم | يؤخر النمو والتنمية15 | ||||
| يطيل العمر الافتراضي في الوسائط السائلة19 | ||||||||
| يطيل العمر الافتراضي على NGM15 | ||||||||
| بفا | 0.5٪ بارافورمالدهيد | نعم | نعم | انخفاض حجم الحضنة الصغيرة16 | ||||
| زيادة وقت التطوير الصغير16 | ||||||||
| انخفاض تفضيل الطعام16 | ||||||||
الجدول 1. مقارنات طرق قتل OP50. القتل بالأشعة فوق البنفسجية ، والقتل الحراري ، والعلاج بالمضادات الحيوية ، والعلاج ب PFA لها تأثيرات متنوعة على الحالة التغذوية للبكتيريا وصحة الديدان التي تتغذى على البكتيريا المعالجة. تختلف طرق تعطيل الإشريكية القولونية هذه أيضا في المواد المطلوبة وقابلية التوسع.
Protocol
1. تلقيح البكتيريا
- تحضير مرق لوريا (LB) عن طريق إذابة 10 غرام من التربتون ، و 5 غرام من خلاصة الخميرة ، و 10 غرام من كلوريد الصوديوم (كلوريد الصوديوم) في 950 مل من الماء المقطر.
- اضبط الرقم الهيدروجيني ل LB إلى 7.0 بإضافة 5M هيدروكسيد الصوديوم (NaOH). يجب أن يتطلب هذا حوالي 0.2 مل فقط من هيدروكسيد الصوديوم.
- الأوتوكلاف وسائط LB المعدلة بالأس الهيدروجيني على دورة سائلة لمدة 45 دقيقة عند 15 رطل / بوصة مربعة. اترك المحلول يبرد ويخزن في درجة حرارة الغرفة.
- تلقيح مستعمرة واحدة من البكتيريا في 100 مل من LB في دورق Erlenmeyer سعة 500 مل. استزرع البكتيريا طوال الليل في حاضنة خلط 37 درجة مئوية.
- اعتمادا على صحة المستعمرة البكتيرية وحجم القارورة والسرعة التي يتم ضبط شاكر عليها ، قد يختلف الوقت الذي تستغرقه البكتيريا لتنمو. بعد ~ 14 ساعة ، تحقق من الكثافة البصرية (OD) للبكتيريا عند 600 نانومتر (OD600).
- قم بإزالة البكتيريا من شاكر عندما يكون OD600 هو 3.0 (1 × 109 وحدات تشكيل مستعمرة (CFU) / مل). إذا كان OD600 أقل من 3.0 ، فأعد القارورة إلى حاضنة شاكر حتى يتم الوصول إلى OD المطلوب.
- قسمة البكتيريا في أنابيب مخروطية سعة 50 مل وتخزينها في درجة حرارة 4 درجات مئوية أو انتقل إلى الخطوة التالية.
2. العمل مع بارافورمالدهيد
ملاحظة: قد يختلف تركيز بارافورمالدهيد (PFA) المستخدم ومدة التعرض إلى حد ما اعتمادا على المناخ والموقع ونوع البكتيريا التي يتم علاجها. نقطة انطلاق جيدة ل OP50 هي التعرض ل 0.5٪ PFA لمدة 1 ساعة ، في حين أن 0.25٪ PFA لمدة 1 ساعة قد تكون كافية ل HT115.
- قم بإعداد 32٪ من مخزون PFA أو استخدم حل PFA 32٪ الذي تم شراؤه تجاريا. استخدم معدات الحماية الشخصية المناسبة (PPE) عند العمل مع PFA. ارتداء القفازات وحماية العين.
- أضف PFA داخل غطاء دخان كيميائي مع تهوية مناسبة. تخلص من PFA المحتوي على الغسالات والنصائح في حاويات الخطر الكيميائي المناسبة في غطاء الدخان.
3. العلاج البكتيري مع بارافورمالدهيد
- بمجرد أن تصل البكتيريا إلى OD600 من 3.0 ، استخدم ماصة مصلية لنقل 50 مل إلى دورق Erlenmeyer جديد سعة 250 مل. احفظ الباقي لعنصر تحكم مباشر ، أو عنصر تحكم معالج وهميا (انظر الخطوة 4) ، أو للتعامل أيضا مع PFA حسب الحاجة.
- تجنب السكب من قارورة إلى أخرى وكن حذرا حتى لا ترش جوانب القارورة الجديدة بالبكتيريا. قد تتلقى المستعمرات الموجودة على جانب القارورة جرعة أقل من PFA.
- في الغطاء الكيميائي ، أضف 781 ميكرولتر من 32٪ PFA إلى 50 مل من البكتيريا ليصل التركيز النهائي إلى 0.5٪. تخلص من الطرف المستخدم في حاوية النفايات الصلبة الخطرة الكيميائية.
- قم بتغطية القارورة بورق القصدير والعودة إلى حاضنة الخفق 37 درجة مئوية لمدة 1 ساعة. بعد 1 ساعة ، قم بإزالة القارورة من الحاضنة وانتقل إلى الخطوة 5.
4. السيطرة على وهمية
- بمجرد أن تصل البكتيريا إلى OD600 من 3.0 ، استخدم ماصة مصلية لنقل 50 مل من البكتيريا إلى أنبوب مخروطي 50 مل.
- انتقل إلى الخطوة 5.3 لإكمال خطوات الغسيل المشابهة للمجموعة المعالجة ب PFA.
5. غسل البكتيريا لإزالة PFA المتبقية
- في الغطاء الكيميائي ، استخدم ماصة مصلية لنقل البكتيريا المعالجة من دورق Erlenmeyer إلى أنبوب مخروطي سعة 50 مل. إن استخدام ماصة مصلية بدلا من صب البكتيريا سيمنع التلوث من أي مستعمرات بكتيرية على حافة القارورة التي ربما تجنبت العلاج المباشر باستخدام PFA.
- البكتيريا المعالجة بالطرد المركزي عند حوالي 3000 × جم لمدة 20 دقيقة. قم بإزالة المادة الطافية عن طريق التخلص منها في حاوية خطر كيميائي للنفايات السائلة في الغطاء الكيميائي.
- أضف 25 مل من LB والدوامة لإعادة تعليق الحبيبات البكتيرية (ملء الأنبوب بالكامل يجعل من الصعب إعادة تعليق الحبيبات). كرر الطرد المركزي وإعادة تعليق الحبيبات 4x.
- أعد تعليق الحبيبات بأحجام مثالية للمقايسات المختلفة. لمقايسات العمر الافتراضي ، يتم إعادة تعليق ألواح البذور 60 مم مع 200 ميكرولتر من البكتيريا في 10 مل من LB. يؤدي تعليق البكتيريا في 10 مل من LB إلى تركيز 5x من مزرعة 50 مل الأصلية.
- قم بتخزين البكتيريا في درجة حرارة 4 درجات مئوية.
6. فحص جودة نمو البكتيريا
- بعد الغسيل النهائي والتعليق ، قم بخط لوحة LB (باستخدام طرف ماصة معقمة) مع البكتيريا المعدة. من الممارسات الجيدة وضع خط LB المستخدم للغسيل والتعليق على لوحة منفصلة أيضا للتأكد من أن LB المستخدم غير ملوث.
- ضع الأطباق في حاضنة 37 درجة مئوية طوال الليل. تحقق من أي نمو. تعتبر البكتيريا ميتة بشكل متماثل عندما لا تنمو المستعمرات على صفيحة LB.
7. فحص الجودة لعملية التمثيل الغذائي البكتيرية باستخدام مقياس التنفس
- بعد الغسيل النهائي وإعادة التعليق من الخطوة 5.4 ، تأكد من أن البكتيريا ميتة أيضيا باستخدام الأدوات المتاحة مثل مقاييس التنفس19,20 وقياس معدل استهلاك الأكسجين الأساسي (OCR).
- تحضير محلول M9: قم بإذابة 3 جم من فوسفات البوتاسيوم أحادي القاعدة (KH 2PO 4) ، و 6 جم من فوسفات الصوديوم ثنائي القاعدة (Na2HPO4) ، و 5 جم من كلوريد الصوديوم (NaCl) في 950 مل من الماء المقطر. الأوتوكلاف على دورة سائلة لمدة 45 دقيقة عند 15 رطل / بوصة مربعة ، ثم اترك المحلول يبرد إلى درجة حرارة الغرفة. أضف 1 مل من 1 M كبريتات المغنيسيوم (MgSO4) وتخزينها في درجة حرارة الغرفة.
- قم بترطيب خرطوشة مقياس التنفس: أضف 200 ميكرولتر من المعايرة إلى جميع آبار لوحة 96 بئرا. ضع الخرطوشة في لوحة 96 بئرا واحتضانها طوال الليل في حاضنة 37 درجة مئوية.
- معايرة الفحص: في اليوم التالي ، ضع الخرطوشة المائية في الجهاز وابدأ المعايرة.
- إعداد لوحة اختبار الفحص: باستخدام لوحة جديدة من 96 بئرا ، أضف 160 ميكرولتر من M9 و 40 ميكرولتر من البكتيريا الجاهزة (1 × 109 CFU / mL) لاختبار الآبار. أضف 200 ميكرولتر من M9 إلى 4 آبار زاوية لاستخدامها كآبار فارغة. أضف 160 ميكرولتر من M9 و 40 ميكرولتر من LB المستخدمة للغسيل والتعليق لاستخدامها كعناصر تحكم سلبية. أضف 200 ميكرولتر من M9 إلى بقية الآبار التي لن يتم استخدامها.
- قم بتشغيل الفحص: بمجرد اكتمال معايرة الخرطوشة، أدخل لوحة الفحص من الخطوة 7.5 في الجهاز لتحليلها. تتضمن الإعدادات خطوات الخلط والانتظار والقياس والتكرار. ستظهر النتائج كمعدل استهلاك الأكسجين (OCR). البكتيريا ميتة أيضيا وجاهزة للاستخدام عندما يكون OCR صفرا.
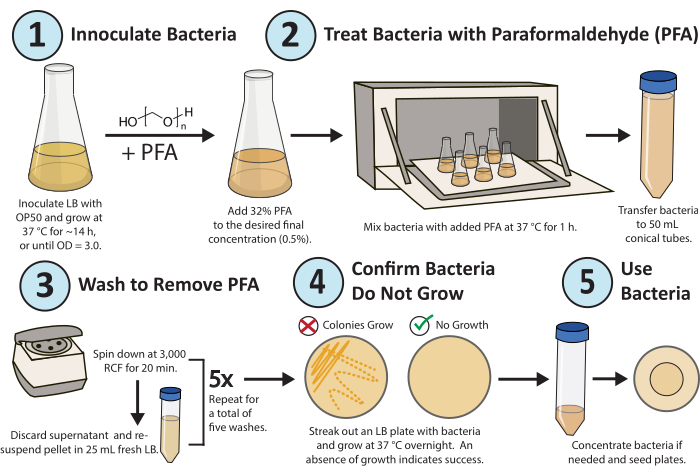
الشكل 1. سير العمل لعلاج بارافورمالدهايد. تزرع مستعمرة واحدة من بكتيريا E. coli OP50 بين عشية وضحاها. يضاف PFA إلى تركيز نهائي بنسبة 0.5٪ ، ويتم اهتزاز الثقافة المعالجة ب PFA لمدة 1 ساعة عند 37 درجة مئوية. أخيرا ، تتم إزالة PFA عن طريق غسل الثقافة باستخدام LB 5x جديد. للتأكد من أن البكتيريا المعالجة غير نشطة بشكل متكرر ، قم بإخراج صفيحة LB من البكتيريا المعالجة وتنمو بين عشية وضحاها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
يظهر سير عمل مفصل للبروتوكول في الشكل 1. تم تطوير طريقة عالية الإنتاجية وتحسينها لتعطيل التكاثر البكتيري باستمرار (الشكل 2 أ) والتمثيل الغذائي (الشكل 2 ب) للدراسات الأيضية والدوائية في أبحاث C. elegans باستخدام بارافورمالدهايد16...
Discussion
فوائد قتل PFA بالنسبة إلى طرق القتل البكتيرية الأخرى
علاج PFA هو طريقة عالية الإنتاجية لمنع التمثيل الغذائي البكتيري مع الحفاظ على مصدر غذائي مغذي ل C. elegans. قتل البكتيريا عن طريق علاج PFA له مزايا متعددة على الطرق الأخرى. على عكس المعالجة بالأشعة فوق البنفسجية ، حيث يجب اختبار ك?...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم تمويل هذا العمل من قبل المعاهد الوطنية للصحة R21AG059117 ومختبرات بول إف جلين لبيولوجيا أبحاث الشيخوخة في جامعة ميشيغان. تم تمويل SB من قبل T32AG000114. تم تمويل ESK من قبل NSF DGE 1841052.
Materials
| Name | Company | Catalog Number | Comments |
| Aluminum Foil | Staples | 2549291 | |
| Bunsen burner | VWR | 470121-700 | |
| Cell Density Meter | Denville | 80-3000-45 | |
| Centrifuge | Eppendorg | 5430 | |
| Chemical fume hood | Labcono | 975050411384RG | |
| Conincal tubes (50 mL) | Fisher | 339652 | |
| Cuvettes | Fisher | 14-955-127 | |
| E. coli OP50 | CGC | OP50 | |
| Erlenmyer flasks | Fisher | 250 mL: FB501250 500 mL: FB501500 1000 mL: FB5011000 | |
| Inoculation loop | Fisher | 22-363-605 | |
| LB Agar | Fisher | BP1425500 | |
| Liquid waste collection bottle | Thomas Scientific | 1230G50 | |
| Magnesium Sulfate (MgSO4) | Sigma | M7506 | |
| Paraformaldehyde (32%) | Electron Microscopy Sciences | 15714-S | Paraformaldehyde – methanol free solution |
| Pipettor | Eppendorf | Eppendorf Easypet 3 | |
| Plastic dishes (100 mm) | Fisher | FB0875712 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher | P2853 | |
| Seahorse XF Calibrant | Agilent | 100840-000 | |
| Seahorse XFe96 Extracellular Flux Assay Kit and Cell Culture Microplate | Agilent | 101085-004 | |
| Serological pipettes (50 mL) | Genesee Scientific | 12-107 | |
| Shaker incubator | Thermo | 11 676 083 | |
| Sodium Chloride (NaCl) | Fisher | S640-3 | |
| Sodium Hydroxide (NaOH) | Fisher | S318500 | |
| Sodium Phosphate Dibasic Anhydrous (Na2HPO4) | Sigma | S374-500 | |
| Solid waste collection bucket | M&M Industries | 5.0 Gallon M1 Traditional Pail | |
| Tryptone | Genesee Scientific | 20-251 | |
| Vortex | Thermo | 11676331 | |
| Weighing balance | C Goldenwall | HZ10K6B | |
| Yeast Extract | Genesee Scientific | 20-255 |
References
- Riddle, D. L., Blumenthal, T., Meyer, B. J., Priess, J. R. C. . Elegans II. 33, (1997).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: A primer on caenorhabditis elegans. WormBook. , 1-31 (2015).
- Kaletta, T., Hengartner, M. O. Finding function in novel targets: C. elegans as a model organism. Nature reviews. Drug discovery. 5 (5), 387-398 (2006).
- Meneely, P. M., Dahlberg, C. L., Rose, J. K. Working with worms: Caenorhabditis elegans as a model organism. Current Protocols Essential Laboratory Techniques. 19 (1), (2019).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Frontiers in Endocrinology. 11, 554994 (2020).
- Feng, M., Gao, B., Garcia, L. R., Sun, Q. Microbiota-derived metabolites in regulating the development and physiology of Caenorhabditis elegans. Frontiers in Microbiology. 14, 1035582 (2023).
- McIntyre, G., Wright, J., Wong, H. T., Lamendella, R., Chan, J. Effects of FUdR on gene expression in the C. elegans bacterial diet OP50. BMC Research Notes. 14 (1), 207 (2021).
- Cabreiro, F., et al. Metformin retards aging in c. Elegans by altering microbial folate and methionine metabolism. Cell. 153 (1), 228-239 (2013).
- Worthy, S. E., et al. Identification of attractive odorants released by preferred bacterial food found in the natural habitats of c. Elegans. PLoS One. 13 (7), e0201158 (2018).
- Chen, Y. C., Seyedsayamdost, M. R., Ringstad, N. A microbial metabolite synergizes with endogenous serotonin to trigger C. elegans reproductive behavior. Proceedings of the National Academy of Sciences of the United States of America. 117 (48), 30589-30598 (2020).
- Kim, D. H., Flavell, S. W. Host-microbe interactions and the behavior of Caenorhabditis elegans. Journal of Neurogenetics. 34 (3-4), 500-509 (2020).
- Gems, D., Riddle, D. L. Genetic, behavioral, and environmental determinants of male longevity in Caenorhabditis elegans. Genetics. 154 (4), 1597-1610 (2000).
- Qi, B., Kniazeva, M., Han, M. A vitamin-b2-sensing mechanism that regulates gut protease activity to impact animal's food behavior and growth. eLife. 6, e26243 (2017).
- Garigan, D., et al. Genetic analysis of tissue aging in caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Virk, B., et al. Folate acts in E. coli to accelerate C. elegans aging independently of bacterial biosynthesis. Cell Reports. 14 (7), 1611-1620 (2016).
- Beydoun, S., et al. An alternative food source for metabolism and longevity studies in Caenorhabditis elegans. Communications Biology. 4 (1), 258 (2021).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral and Maxillofacial Pathology. 16 (3), 400-405 (2012).
- Felix, H. Permeabilized and immobilized cells. Methods in Enzymology. 137, 637-641 (1988).
- Lobritz, M. A., et al. Antibiotic efficacy is linked to bacterial cellular respiration. Proceedings of the National Academy of Sciences of the United States of America. 112 (27), 8173-8180 (2015).
- Nadanaciva, S., et al. Assessment of drug-induced mitochondrial dysfunction via altered cellular respiration and acidification measured in a 96-well platform. Journal of Bioenergetics and Biomembranes. 44 (4), 421-437 (2012).
- Shtonda, B. B., Avery, L. Dietary choice behavior in Caenorhabditis elegans. The Journal of Experimental biology. 209 (Pt 1), 89-102 (2006).
- MacNeil, L. T., Watson, E., Arda, H. E., Zhu, L. J., Walhout, A. J. Diet-induced developmental acceleration independent of tor and insulin in C. elegans. Cell. 153 (1), 240-252 (2013).
- Kumar, S., et al. Lifespan extension in C. elegans caused by bacterial colonization of the intestine and subsequent activation of an innate immune response. Developmental Cell. 49 (1), 100-117 (2019).
- Nakagawa, H., et al. Effects and mechanisms of prolongevity induced by Lactobacillus gasseri sbt2055 in Caenorhabditis elegans. Aging Cell. 15 (2), 227-236 (2016).
- Kaeberlein, T. L., et al. Lifespan extension in Caenorhabditis elegans by complete removal of food. Aging Cell. 5 (6), 487-494 (2006).
- Beaudoin-Chabot, C., et al. The unfolded protein response reverses the effects of glucose on lifespan in chemically-sterilized C. elegans. Nature Communication. 13 (1), 5889 (2022).
- Komura, T., Takemoto, A., Kosaka, H., Suzuki, T., Nishikawa, Y. Prolonged lifespan, improved perception, and enhanced host defense of Caenorhabditis elegans by Lactococcus cremoris subsp. cremoris.Microbiology Spectrum. 10 (3), e0045421 (2022).
- Ye, X., Linton, J. M., Schork, N. J., Buck, L. B., Petrascheck, M. A pharmacological network for lifespan extension in Caenorhabditis elegans. Aging Cell. 13 (2), 206-215 (2014).
- Hastings, J., et al. Wormjam: A consensus C. elegans metabolic reconstruction and metabolomics community and workshop series. Worm. 6 (2), e1373939 (2017).
- O'Donnell, M. P., Fox, B. W., Chao, P. H., Schroeder, F. C., Sengupta, P. A neurotransmitter produced by gut bacteria modulates host sensory behaviour. Nature. 583 (7816), 415-420 (2020).
- Stuhr, N. L., Curran, S. P. Bacterial diets differentially alter lifespan and healthspan trajectories in C. elegans. Communications Biology. 3 (1), 653 (2020).
- Dirksen, P., et al. Cembio - the Caenorhabditis elegans microbiome resource. G3 (Bethesda). 10 (9), 3025-3039 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved