A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מתודולוגיה להשבתה מטבולית של חיידקים למחקר Caenorhabditis elegans
In This Article
Summary
מקור המזון של Caenorhabditis elegans במעבדה הוא Escherichia coli חי. מכיוון שחיידקים פעילים מטבולית, הם מציגים משתנה מבלבל במחקרים מטבוליים ותרופתיים ב- C. elegans. כאן מתואר פרוטוקול מפורט לנטרול מטבולי של חיידקים באמצעות פרפורמלדהיד.
Abstract
Caenorhabditis elegans הוא אורגניזם מודל נפוץ למחקר בגנטיקה, התפתחות, הזדקנות, מטבוליזם והתנהגות. מכיוון ש-C. elegans צורכים תזונה של חיידקים חיים, הפעילות המטבולית של מקור המזון שלהם יכולה לבלבל ניסויים המחפשים את ההשפעות הישירות של התערבויות שונות על התולעת. כדי להימנע מההשפעות המבלבלות של חילוף החומרים של חיידקים, חוקרי C. elegans השתמשו בשיטות רבות כדי להשבית חיידקים מבחינה מטבולית, כולל קרינה אולטרה סגולה (UV), הרג חום ואנטיביוטיקה. טיפול UV הוא בעל תפוקה נמוכה יחסית ולא ניתן להשתמש בו בתרבית נוזלית מכיוון שיש לבדוק כל צלחת להרג חיידקים מוצלח. שיטת טיפול שנייה, קוטלת חום, משפיעה לרעה על המרקם והאיכות התזונתית של החיידק, מה שמוביל למעצר התפתחותי של C. elegans. לבסוף, טיפול אנטיביוטי יכול לשנות ישירות את הפיזיולוגיה של C. elegans בנוסף למניעת צמיחת חיידקים. כתב יד זה מתאר שיטה חלופית לנטרול מטבולי של חיידקים באמצעות פרפורמלדהיד (PFA). טיפול PFA מצליב חלבונים בתוך תאי חיידקים כדי למנוע פעילות מטבולית תוך שמירה על מבנה התא ותכולת התזונה. שיטה זו היא בעלת תפוקה גבוהה וניתן להשתמש בה בתרבית נוזלית או בצלחות מוצקות, שכן בדיקת צלחת אחת של חיידקים שטופלו ב- PFA לגדילה מאמתת את כל האצווה. ניתן להשתמש בהשבתה מטבולית באמצעות טיפול PFA כדי לחסל את ההשפעות המבלבלות של מטבוליזם חיידקי על מחקרים של תוספי תרופות או מטבוליטים, עמידות ללחץ, מטבוליזם והתנהגות ב- C. elegans.
Introduction
Caenorhabditis elegans הוצע במקור כאורגניזם מודל בשנת 19651 ומאז אומץ באופן נרחב במחקרים על גנטיקה, התפתחות, התנהגות, הזדקנות ומטבוליזם2. בשל גודלם הגדול והציפורן השקופה שלהם, C. elegans מתאים במיוחד לסינון בתפוקה גבוהה עם כתבי פלורסנט3. מחזור החיים הקצר שלהם, הרבייה ההרמפרודיטית וההומולוגיה הגנטית שלהם עם בני אדם הופכים גם את C. elegans למערכת מודל רבת ערך למחקרים על התפתחות4 וביולוגיה של הזדקנות5. יתר על כן, C. elegans הם יחסית קל לתחזוקה. ניתן לגדל תולעים בתרבית נוזלית או על צלחות אגר מוצקות ולצרוך תזונה של חיידקי Escherichia coli OP50 חיים4.
עם זאת, מקור המזון החי של C. elegans יכול לבלבל מחקרים על חילוף חומרים, תוספי תרופות והתנהגות. מאחר שלחיידקים חיים יש חילוף חומרים משלהם, תנאי ניסוי שמשפיעים על החיידקים משנים גם את חומרי המזון והמטבוליטים הזמינים לתולעים. לדוגמה, להבדלים בריכוזי חיידקי ברזל, חומצות אמינו וחומצה פולית יש השפעות מגוונות על התפתחותו, הפיזיולוגיה ותוחלת החיים של C. elegans 6. שיטות מעבדה נפוצות רבות יכולות לגרום לשינויים כאלה בהרכב החומרים המזינים ובמטבוליטים המיוצרים על ידי OP50. באופן ספציפי, חשיפה ל-5-fluoro-2'-deoxyuridine (FUdR), תרכובת נפוצה למניעת רבייה ב-C. elegans, מעוררת שינויים נרחבים בביטוי גנים מסוג OP50, כולל מסלולי ביוסינתזה של חומצות אמינו7. חיידקים חיים יכולים גם לבלבל מחקרים שבהם C. elegans מקבלים תוספת של מולקולות קטנות מכיוון שחיידקים יכולים לעכל באופן חלקי או מלא את החומרים הפעילים. יתר על כן, ההשפעות של מולקולות קטנות אלה על החיידקים יכולות, בתורן, לשנות את הפיזיולוגיה של C. elegans, כפי שדווח עם התרופה מאריכת תוחלת החיים מטפורמין8. לבסוף, חיידקים חיים יכולים לשנות את סביבת התולעת בדרכים שמשנות התנהגות, כגון הפרשת ריחות אטרקטיביים9, ייצור נוירומודולטורים אקסוגניים10 ויצירת שיפועי חמצן במדשאת חיידקים צפופה11.
כדי למתן את ההשפעות המבלבלות של מטבוליזם חיידקי על מחקר C. elegans , פותחו שיטות רבות להרג חיידקים (טבלה 1). שלוש אסטרטגיות נפוצות לחיסול OP50 הן הקרנת UV, הרג חום וטיפול אנטיביוטי. אמנם הן פשוטות וזולות יחסית, אך לכל אחת מהשיטות הללו יכולות להיות השפעות בלתי רצויות הן על חיידקים והן על C. elegans. הריגת UV באמצעות קרוסלינקר UV12 היא תפוקה נמוכה והקצב מוגבל על ידי מספר הלוחות שיכולים להתאים לקרוסלינקר UV. יתר על כן, היעילות של הרג UV יכולה להשתנות מצלחת לצלחת בתוך אצווה, ובדיקת צמיחה על כל הצלחות יכולה להיות קשה בניסויים גדולים. OP50 הורג חום על ידי חשיפת תרבית לטמפרטורות של >60 מעלות צלזיוס מגיע עם קבוצה נפרדת של אתגרים. חום גבוה עלול לפגוע בחומרים מזינים החיוניים לתולעת ולהרוס את המבנה התאי של החיידקים, וליצור מרקם רך יותר שמקטין את משך הזמן שהתולעים מבלות במזון13. שיטה זו גם אינה יכולה לשמש לאורך מחזור החיים של C. elegans מכיוון שתולעים הניזונות מחיידקים שנהרגו בחום יכולות לעצור בשלב מוקדם בהתפתחות13. טיפול אנטיביוטי הוא שיטה נפוצה שלישית לדיכוי חילוף החומרים של חיידקים14, אך אנטיביוטיקה יכולה גם לשנות את גדילת התולעים ואת חילוף החומרים15.
פתרון אחד לסילוק ההשפעות המטבוליות של חיידקים חיים תוך שמירה על מבנה החיידקים וחומרי המזון החיוניים הוא להרוג OP50 באמצעות פרפורמלדהיד (PFA)16. PFA הוא פולימר של פורמלדהיד שיכול להצליב חלבונים בתוך תאים17 כדי למנוע שכפול חיידקים מבלי להרוס מבני תאים פנימיים כמו קרום הפלזמה הפנימי18. בשל שימור זה של המבנה התאי הפנימי, חיידקים שטופלו ב-PFA אינם מפגינים גדילה או פעילות מטבולית, אך נשארים מקור מזון אכיל ועשיר בחומרים מזינים עבור C. elegans16. כאן, פרוטוקול מפורט מסופק אשר מראה כיצד להשבית מטבולית חיידקים באמצעות paraformaldehyde.
| שיטת | חומרים נדרשים | מדרגי? | תזונתי? | השפעות על תולעת? | ||||
| UV | UV-crosslinker | מוגבל על ידי: | כן | השפעות משתנות על תוחלת החיים של NGM12, 23, 24 | ||||
| מספר צלחות שמתאימות לקרוסלינקר UV | השפעות משתנות על תוחלת החיים ב-FUdR24, 26, 27 | |||||||
| זמן הקרנה לצלחת | ירידה בהעדפת מזון16 | |||||||
| יכולת לבדוק כל צלחת לצמיחה8 | ||||||||
| חום | אינקובטור >60 מעלות צלזיוס | כן | לא: הורס את דופן התא, יורד בערך התזונתי | מעצר התפתחותי 13 | ||||
| ירידה בהעדפת מזון13 | ||||||||
| מאריך את תוחלת החיים של NGM31 | ||||||||
| אנטיביוטיקה | אנטיביוטיקה (קנמיצין, קרבניצלין וכו ') | כן | כן | מעכב צמיחה והתפתחות15 | ||||
| מאריך את תוחלת החיים במדיה נוזלית19 | ||||||||
| מאריך את תוחלת החיים של NGM15 | ||||||||
| פיפ"א | 0.5% פרפורמאלדהיד | כן | כן | הקטנת גודל ברוד קטן16 | ||||
| הגדלת זמן פיתוח קטנה16 | ||||||||
| ירידה בהעדפת מזון16 | ||||||||
טבלה 1. השוואות של שיטות להרוג OP50. להרג קרינת UV, קוטל חום, טיפול אנטיביוטי וטיפול ב-PFA יש השפעות מגוונות על המצב התזונתי של החיידקים ועל בריאותם של תולעים הניזונות מחיידקים מטופלים. שיטות אלה להשבתה משכפלת של E. coli נבדלות גם בחומרים הנדרשים שלהן ובמדרגיות.
Protocol
1. חיסון חיידקים
- הכינו ציר לוריא (LB) על ידי המסת 10 גרם טריפטון, 5 גרם תמצית שמרים ו-10 גרם נתרן כלורי (NaCl) ב-950 מ"ל מים מזוקקים.
- התאם את ה- pH של LB ל- 7.0 על ידי הוספת 5M נתרן הידרוקסידי (NaOH). זה צריך לדרוש רק כ 0.2 מ"ל של NaOH.
- בצע Autoclave של מדיית LB מותאמת pH במחזור נוזל למשך 45 דקות ב- 15 psi. אפשר לתמיסה להתקרר ולאחסן בטמפרטורת החדר.
- חסן מושבה אחת של חיידקים ב 100 מ"ל של LB בבקבוק Erlenmeyer 500 מ"ל. תרבית את החיידקים למשך הלילה באינקובטור שייקר של 37 מעלות צלזיוס.
- בהתאם לבריאות מושבת החיידקים, גודל הבקבוק והמהירות אליה מכוון השייקר, הזמן שלוקח לחיידקים לגדול עשוי להשתנות. לאחר ~14 שעות, בדוק את הצפיפות האופטית (OD) של החיידקים ב- 600 ננומטר (OD600).
- הסר את החיידקים מהשייקר כאשר OD600 הוא 3.0 (1 x 109 יחידות יוצרות מושבה (CFU)/מ"ל). אם OD600 קטן מ- 3.0, החזר את הבקבוק לאינקובטור השייקר עד שתגיע ל- OD הרצוי.
- Aliquot את החיידקים ב 50 מ"ל צינורות חרוטי ולאחסן ב 4 °C או להמשיך לשלב הבא.
2. עבודה עם paraformaldehyde
הערה: ריכוז הפרפורמאלדהיד (PFA) שבו נעשה שימוש, ומשך החשיפה עשויים להשתנות במידת מה בהתאם לאקלים, מיקום וסוג החיידקים המטופלים. נקודת התחלה טובה עבור OP50 היא חשיפה ל-0.5% PFA למשך שעה אחת, בעוד ש-0.25% PFA למשך שעה אחת עשוי להספיק עבור HT115.
- הכן מלאי PFA של 32% או השתמש בפתרון PFA 32% שנרכש באופן מסחרי. השתמש בציוד מגן אישי מתאים (PPE) בעת עבודה עם PFA. יש ללבוש כפפות והגנה על העיניים.
- יש להוסיף PFA בתוך מכסה אדים כימי עם אוורור מתאים. יש להשליך את ה-PFA המכיל שטיפות וקצוות במיכלים מתאימים לסיכון כימי במכסה האדים.
3. טיפול חיידקי עם paraformaldehyde
- ברגע שהחיידקים מגיעים ל-OD600 של 3.0, השתמשו בפיפט סרולוגי כדי להעביר 50 מ"ל לתוך בקבוק חדש של 250 מ"ל Erlenmeyer. שמור את השאר עבור פקד חי, פקד מטופל דמה (ראה שלב 4), או כדי לטפל גם עם PFA לפי הצורך.
- הימנעו ממזיגה מבקבוק אחד למשנהו והיזהרו שלא להתיז את דפנות הבקבוק החדש בחיידקים. מושבות בצד הבקבוק עשויות לקבל מינון נמוך יותר של PFA.
- במכסה המנוע הכימי, הוסף 781 μL של 32% PFA לחיידקים 50 מ"ל כדי להביא את הריכוז הסופי ל -0.5%. יש להשליך את החוד המשמש במיכל מסוכן כימי מפסולת מוצקה.
- מכסים את הבקבוק בנייר כסף וחוזרים לאינקובטור השייקר של 37 מעלות צלזיוס למשך שעה אחת. לאחר 1 שעה, להסיר את הבקבוק מן האינקובטור ולהמשיך לשלב 5.
4. שליטה מטופלת דמה
- ברגע שהחיידקים מגיעים ל-OD600 של 3.0, השתמשו בפיפט סרולוגי כדי להעביר 50 מ"ל של החיידק לצינור חרוטי של 50 מ"ל.
- המשך לשלב 5.3 כדי להשלים את שלבי הכביסה בדומה לקבוצה שטופלה ב- PFA.
5. שטיפת החיידקים כדי להסיר שאריות PFA
- במכסה המנוע הכימי, השתמש פיפטה סרולוגית כדי להעביר את החיידקים המטופלים מבקבוק Erlenmeyer לצינור חרוטי 50 מ"ל. שימוש בפיפטה סרולוגית במקום לשפוך את החיידק ימנע זיהום מכל מושבות חיידקים בשולי הבקבוק שאולי נמנעו מטיפול ישיר ב- PFA.
- צנטריפוגה טיפלה בחיידקים בערך 3000 x גרם במשך 20 דקות. הסר את הסופרנאטנט על ידי השלכתו במיכל סיכון כימי לפסולת נוזלית במכסה המנוע הכימי.
- הוסף 25 מ"ל של LB ומערבולת כדי להשהות מחדש את הגלולה החיידקית (מילוי הצינור במלואו מקשה על השעיית הכדורית). צנטריפוגה חוזרת ומתלה כדורי 4x.
- השהה מחדש את הגלולה בנפחים אופטימליים לבדיקות שונות. עבור בדיקות תוחלת חיים, זרע 60 מ"מ לוחות עם 200 μL של חיידקים resuspended ב 10 מ"ל של LB. השעיה מחדש של החיידקים ב 10 מ"ל של LB מביא לריכוז 5x מן התרבית המקורית 50 מ"ל.
- אחסנו את החיידקים בטמפרטורה של 4°C.
6. בדיקת איכות של צמיחת חיידקים
- לאחר השטיפה הסופית וההשעיה, פזרו צלחת LB (באמצעות קצה פיפטה סטרילי) עם החיידקים המוכנים. זה נוהג טוב לפזר את LB המשמש לשטיפה ו resuspending על צלחת נפרדת, כמו גם כדי לוודא כי LB בשימוש לא היה מזוהם.
- מניחים את הצלחות באינקובטור של 37 מעלות צלזיוס למשך הלילה. בדוק אם יש גידול. החיידקים נחשבים למתים באופן כפול כאשר מושבות אינן גדלות על צלחת LB.
7. בדיקת איכות חילוף החומרים של חיידקים באמצעות רספירומטר
- לאחר השטיפה הסופית וההשעיה משלב 5.4, ודא שהחיידקים מתים מטבולית באמצעות כלים זמינים כגון ספירומטרים19,20 ומדידת קצב צריכת החמצן הבסיסית (OCR).
- הכנת תמיסת M9: המסת 3 גרם אשלגן פוספט חד-בסיסי (KH 2 PO 4),6 גרם נתרן פוספט דיבסיסי (Na2HPO4), ו-5 גרם נתרן כלורי (NaCl) ב-950 מ"ל מים מזוקקים. Autoclave על מחזור נוזל במשך 45 דקות ב 15 psi, ולאחר מכן לאפשר את הפתרון להתקרר לטמפרטורת החדר. יש להוסיף 1 מ"ל של מגנזיום גופרתי בנפח 1 מ"מ (MgSO4) ולאחסן בטמפרטורת החדר.
- לחות את מחסנית הרספירומטר: הוסף 200 μL של כיול לכל הבארות של צלחת 96 בארות. מניחים את המחסנית בצלחת 96 בארות ודגרים למשך הלילה באינקובטור של 37 מעלות צלזיוס.
- כיול מבחן: ביום המחרת, הכנס את המחסנית המיובשת למכונה והתחל בכיול.
- הגדרת צלחת בדיקה: באמצעות צלחת חדשה של 96 בארות, הוסף 160 μL של M9 ו- 40 μL של החיידקים המוכנים (1 x 109 CFU/mL) כדי לבדוק בארות. הוסף 200 μL של M9 לארבע הבארות הפינתיות לשימוש כבארות ריקות. הוסף 160 μL של M9 ו- 40 μL של LB המשמש לשטיפה והשהייה מחדש לשימוש כבקרות שליליות. הוסף 200 μL של M9 לשאר הבארות שלא ישמשו.
- הפעל את הבדיקה: לאחר השלמת כיול המחסנית, הכנס את לוחית הבדיקה משלב 7.5 למכשיר לצורך ניתוח. ההגדרות כוללות שלבים לערבוב, המתנה, מדידה ולולאה. התוצאות יוצגו כקצב צריכת חמצן (OCR). החיידקים מתים מטבולית ומוכנים לשימוש כאשר זיהוי תווים אופטי (OCR) הוא אפס.
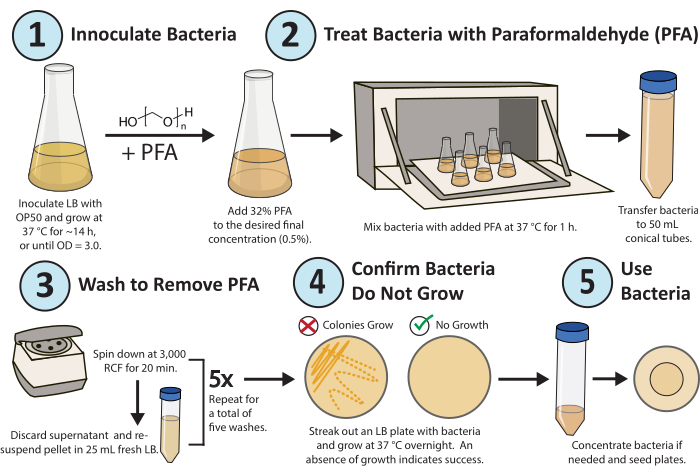
איור 1. זרימת עבודה לטיפול paraformaldehyde. מושבה אחת של חיידקי E. coli OP50 גדלה בן לילה. PFA מתווסף לריכוז סופי של 0.5%, והתרבית שטופלה ב- PFA מזועזעת במשך שעה אחת ב 37 מעלות צלזיוס. לבסוף, PFA מוסר על ידי שטיפת התרבית עם LB 5x טרי. כדי לוודא שהחיידקים המטופלים אינם פעילים באופן משכפל, הוציאו צלחת LB של החיידקים המטופלים וגדלו בן לילה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
זרימת עבודה מפורטת של הפרוטוקול מוצגת באיור 1. שיטה בעלת תפוקה גבוהה פותחה ועברה אופטימיזציה כדי להשבית באופן עקבי שכפול חיידקים (איור 2A) ומטבוליזם (איור 2B) עבור מחקרים מטבוליים ותרופתיים במחקר C. elegans באמצעות פרפורמלדהיד16. ...
Discussion
היתרונות של הרג PFA ביחס לשיטות הרג חיידקים אחרות
טיפול PFA הוא שיטה בעלת תפוקה גבוהה למניעת חילוף חומרים חיידקי תוך שמירה על מקור מזון מזין עבור C. elegans. להרג חיידקים באמצעות טיפול PFA יש יתרונות רבים על פני שיטות אחרות. שלא כמו טיפול UV, שבו כל צלחת חייבת להיבדק להרג מוצלח, צלחת אח...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו מומנה על ידי NIH R21AG059117 ומעבדות פול פ. גלן לביולוגיה של חקר ההזדקנות באוניברסיטת מישיגן. SB מומן על ידי T32AG000114. ESK מומנה על ידי NSF DGE 1841052.
Materials
| Name | Company | Catalog Number | Comments |
| Aluminum Foil | Staples | 2549291 | |
| Bunsen burner | VWR | 470121-700 | |
| Cell Density Meter | Denville | 80-3000-45 | |
| Centrifuge | Eppendorg | 5430 | |
| Chemical fume hood | Labcono | 975050411384RG | |
| Conincal tubes (50 mL) | Fisher | 339652 | |
| Cuvettes | Fisher | 14-955-127 | |
| E. coli OP50 | CGC | OP50 | |
| Erlenmyer flasks | Fisher | 250 mL: FB501250 500 mL: FB501500 1000 mL: FB5011000 | |
| Inoculation loop | Fisher | 22-363-605 | |
| LB Agar | Fisher | BP1425500 | |
| Liquid waste collection bottle | Thomas Scientific | 1230G50 | |
| Magnesium Sulfate (MgSO4) | Sigma | M7506 | |
| Paraformaldehyde (32%) | Electron Microscopy Sciences | 15714-S | Paraformaldehyde – methanol free solution |
| Pipettor | Eppendorf | Eppendorf Easypet 3 | |
| Plastic dishes (100 mm) | Fisher | FB0875712 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher | P2853 | |
| Seahorse XF Calibrant | Agilent | 100840-000 | |
| Seahorse XFe96 Extracellular Flux Assay Kit and Cell Culture Microplate | Agilent | 101085-004 | |
| Serological pipettes (50 mL) | Genesee Scientific | 12-107 | |
| Shaker incubator | Thermo | 11 676 083 | |
| Sodium Chloride (NaCl) | Fisher | S640-3 | |
| Sodium Hydroxide (NaOH) | Fisher | S318500 | |
| Sodium Phosphate Dibasic Anhydrous (Na2HPO4) | Sigma | S374-500 | |
| Solid waste collection bucket | M&M Industries | 5.0 Gallon M1 Traditional Pail | |
| Tryptone | Genesee Scientific | 20-251 | |
| Vortex | Thermo | 11676331 | |
| Weighing balance | C Goldenwall | HZ10K6B | |
| Yeast Extract | Genesee Scientific | 20-255 |
References
- Riddle, D. L., Blumenthal, T., Meyer, B. J., Priess, J. R. C. . Elegans II. 33, (1997).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: A primer on caenorhabditis elegans. WormBook. , 1-31 (2015).
- Kaletta, T., Hengartner, M. O. Finding function in novel targets: C. elegans as a model organism. Nature reviews. Drug discovery. 5 (5), 387-398 (2006).
- Meneely, P. M., Dahlberg, C. L., Rose, J. K. Working with worms: Caenorhabditis elegans as a model organism. Current Protocols Essential Laboratory Techniques. 19 (1), (2019).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Frontiers in Endocrinology. 11, 554994 (2020).
- Feng, M., Gao, B., Garcia, L. R., Sun, Q. Microbiota-derived metabolites in regulating the development and physiology of Caenorhabditis elegans. Frontiers in Microbiology. 14, 1035582 (2023).
- McIntyre, G., Wright, J., Wong, H. T., Lamendella, R., Chan, J. Effects of FUdR on gene expression in the C. elegans bacterial diet OP50. BMC Research Notes. 14 (1), 207 (2021).
- Cabreiro, F., et al. Metformin retards aging in c. Elegans by altering microbial folate and methionine metabolism. Cell. 153 (1), 228-239 (2013).
- Worthy, S. E., et al. Identification of attractive odorants released by preferred bacterial food found in the natural habitats of c. Elegans. PLoS One. 13 (7), e0201158 (2018).
- Chen, Y. C., Seyedsayamdost, M. R., Ringstad, N. A microbial metabolite synergizes with endogenous serotonin to trigger C. elegans reproductive behavior. Proceedings of the National Academy of Sciences of the United States of America. 117 (48), 30589-30598 (2020).
- Kim, D. H., Flavell, S. W. Host-microbe interactions and the behavior of Caenorhabditis elegans. Journal of Neurogenetics. 34 (3-4), 500-509 (2020).
- Gems, D., Riddle, D. L. Genetic, behavioral, and environmental determinants of male longevity in Caenorhabditis elegans. Genetics. 154 (4), 1597-1610 (2000).
- Qi, B., Kniazeva, M., Han, M. A vitamin-b2-sensing mechanism that regulates gut protease activity to impact animal's food behavior and growth. eLife. 6, e26243 (2017).
- Garigan, D., et al. Genetic analysis of tissue aging in caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Virk, B., et al. Folate acts in E. coli to accelerate C. elegans aging independently of bacterial biosynthesis. Cell Reports. 14 (7), 1611-1620 (2016).
- Beydoun, S., et al. An alternative food source for metabolism and longevity studies in Caenorhabditis elegans. Communications Biology. 4 (1), 258 (2021).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral and Maxillofacial Pathology. 16 (3), 400-405 (2012).
- Felix, H. Permeabilized and immobilized cells. Methods in Enzymology. 137, 637-641 (1988).
- Lobritz, M. A., et al. Antibiotic efficacy is linked to bacterial cellular respiration. Proceedings of the National Academy of Sciences of the United States of America. 112 (27), 8173-8180 (2015).
- Nadanaciva, S., et al. Assessment of drug-induced mitochondrial dysfunction via altered cellular respiration and acidification measured in a 96-well platform. Journal of Bioenergetics and Biomembranes. 44 (4), 421-437 (2012).
- Shtonda, B. B., Avery, L. Dietary choice behavior in Caenorhabditis elegans. The Journal of Experimental biology. 209 (Pt 1), 89-102 (2006).
- MacNeil, L. T., Watson, E., Arda, H. E., Zhu, L. J., Walhout, A. J. Diet-induced developmental acceleration independent of tor and insulin in C. elegans. Cell. 153 (1), 240-252 (2013).
- Kumar, S., et al. Lifespan extension in C. elegans caused by bacterial colonization of the intestine and subsequent activation of an innate immune response. Developmental Cell. 49 (1), 100-117 (2019).
- Nakagawa, H., et al. Effects and mechanisms of prolongevity induced by Lactobacillus gasseri sbt2055 in Caenorhabditis elegans. Aging Cell. 15 (2), 227-236 (2016).
- Kaeberlein, T. L., et al. Lifespan extension in Caenorhabditis elegans by complete removal of food. Aging Cell. 5 (6), 487-494 (2006).
- Beaudoin-Chabot, C., et al. The unfolded protein response reverses the effects of glucose on lifespan in chemically-sterilized C. elegans. Nature Communication. 13 (1), 5889 (2022).
- Komura, T., Takemoto, A., Kosaka, H., Suzuki, T., Nishikawa, Y. Prolonged lifespan, improved perception, and enhanced host defense of Caenorhabditis elegans by Lactococcus cremoris subsp. cremoris.Microbiology Spectrum. 10 (3), e0045421 (2022).
- Ye, X., Linton, J. M., Schork, N. J., Buck, L. B., Petrascheck, M. A pharmacological network for lifespan extension in Caenorhabditis elegans. Aging Cell. 13 (2), 206-215 (2014).
- Hastings, J., et al. Wormjam: A consensus C. elegans metabolic reconstruction and metabolomics community and workshop series. Worm. 6 (2), e1373939 (2017).
- O'Donnell, M. P., Fox, B. W., Chao, P. H., Schroeder, F. C., Sengupta, P. A neurotransmitter produced by gut bacteria modulates host sensory behaviour. Nature. 583 (7816), 415-420 (2020).
- Stuhr, N. L., Curran, S. P. Bacterial diets differentially alter lifespan and healthspan trajectories in C. elegans. Communications Biology. 3 (1), 653 (2020).
- Dirksen, P., et al. Cembio - the Caenorhabditis elegans microbiome resource. G3 (Bethesda). 10 (9), 3025-3039 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved