需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
秀丽隐杆线虫研究的代谢灭活细菌的方法
摘要
实验室中 秀丽隐杆线虫 的食物来源是活 的大肠杆菌。由于细菌具有代谢活性,因此它们在 秀丽隐杆线虫 的代谢和药物研究中存在混杂变量。本文描述了使用多聚甲醛代谢灭活细菌的详细方案。
摘要
秀丽隐杆线虫是一种常见的模式生物,用于遗传学、发育、衰老、代谢和行为研究。由于秀丽隐杆线虫以活细菌为食,因此其食物来源的代谢活动可能会混淆寻找各种干预措施对蠕虫的直接影响的实验。为了避免细菌代谢的混杂效应,秀丽隐杆线虫研究人员使用了多种方法来代谢灭活细菌,包括紫外线 (UV) 照射、热杀灭和抗生素。紫外线处理的通量相对较低,不能用于液体培养,因为必须检查每个培养板是否成功杀灭细菌。第二种治疗方法是热杀灭,会对细菌的质地和营养质量产生负面影响,导致秀丽隐杆线虫的发育停滞。最后,抗生素治疗除了防止细菌生长外,还可以直接改变秀丽隐杆线虫的生理机能。本手稿描述了一种使用多聚甲醛 (PFA) 代谢灭活细菌的替代方法。PFA处理使细菌细胞内的蛋白质交联,以防止代谢活动,同时保持细胞结构和营养成分。该方法通量高,可用于液体培养或固体培养板,因为测试一板 PFA 处理过的细菌的生长可以验证整个批次。通过PFA处理的代谢灭活可用于消除细菌代谢对药物或代谢物补充、应激抗性、代谢组学和秀丽隐杆线虫行为研究的混杂影响。
引言
秀丽隐杆线 虫最初于 1965 年被提出为模式生物1 ,此后被广泛用于遗传学、发育、行为、衰老和代谢的研究2。由于其育雏尺寸大和角质层透明, 秀丽隐杆线 虫特别适合使用荧光报告基因进行高通量筛选3。它们的短生命周期、雌雄同体的繁殖以及与人类的遗传同源性也使 秀丽隐杆线虫 成为研究发育4 和衰老生物学5 的有价值的模型系统。此外, 秀丽隐杆线虫 相对容易维护。蠕虫可以在液体培养物或固体琼脂平板上生长,并食用活 的大肠杆菌 OP50 细菌4。
然而, 秀丽隐杆线虫 的活食来源可能会混淆新陈代谢、药物补充和行为的研究。由于活细菌有自己的新陈代谢,因此影响细菌的实验条件也会改变蠕虫可用的营养物质和代谢物。例如,细菌铁、氨基酸和叶酸浓度的差异对 秀丽隐杆线虫的 发育、生理和寿命有不同的影响6。许多常见的实验室实践可以引起OP50产生的营养成分和代谢物的这种变化。具体而言,暴露于5-氟-2'-脱氧尿苷(FUdR)(一种常用于防止 秀丽隐杆线虫繁殖的化合物)会引起OP50基因表达的广泛变化,包括氨基酸生物合成途径7。活细菌也可能混淆秀 丽隐杆线 虫补充小分子的研究,因为细菌可以部分或完全代谢活性化合物。此外,这些小分子对细菌的影响反过来可以改变 秀丽隐杆线虫 的生理机能,正如延长寿命的药物二甲双胍8所报道的那样。最后,活细菌可以通过改变行为的方式改变蠕虫的环境,例如分泌有吸引力的气味剂9,产生外源性神经调节剂10,以及在密集的细菌草坪中产生氧气梯度11。
为了减轻细菌代谢对 秀丽隐杆线虫 研究的混杂影响,已经开发了多种杀死细菌的方法(表1)。杀死OP50的三种常见策略是紫外线照射、热杀灭和抗生素治疗。虽然简单且成本相对较低,但这些方法中的每一种都可能对细菌和 秀丽隐杆线虫 产生不良影响。通过UV交联剂12 进行UV杀灭是低通量的,其速率受UV交联剂中可容纳的板数的限制。此外,在批次内,紫外线杀灭的功效可能因板而异,并且在大型实验中测试所有板的生长可能变得困难。通过将培养物暴露在 >60 °C 的温度下来热杀灭 OP50 会带来一系列单独的挑战。高温会破坏蠕虫所必需的营养物质并破坏细菌的细胞结构,从而产生更柔软的质地,从而减少蠕虫在食物上花费的时间13.这种方法也不能在 秀丽隐杆 线虫的整个生命周期中使用,因为喂食热杀灭细菌的蠕虫可以在发育早期停滞13。抗生素治疗是抑制细菌代谢的第三种常用方法14,但抗生素也可以改变蠕虫的生长和代谢15。
消除活细菌代谢效应同时保留细菌结构和必需营养素的一种解决方案是用多聚甲醛 (PFA) 杀死 OP5016。PFA 是一种甲醛聚合物,可以在细胞内交联蛋白质17,以防止细菌复制,而不会破坏内部细胞结构,如内质膜18。由于这种内部细胞结构的保留,PFA 处理的细菌没有表现出生长或代谢活动,但仍然是秀丽隐杆线虫16 的可食用和营养丰富的食物来源。 在这里,提供了一个详细的方案,显示了如何使用多聚甲醛代谢灭活细菌。
| 方法 | 所需材料 | 可 伸缩? | 营养? | 对蠕虫的影响? | ||||
| 紫外线 | UV交联剂 | 受限于: | 是的 | 对 NGM12、23、24 寿命的可变影响 | ||||
| 适合UV交联剂的板数 | 对 FUdR24、26、27 寿命的可变影响 | |||||||
| 每块板的照射时间 | 食物偏好降低16 | |||||||
| 能够检查每个板的生长情况8 | ||||||||
| 热 | >60°C培养箱 | 是的 | 否:破坏细胞壁,降低营养价值 | 发育停滞 13 | ||||
| 食物偏好降低13 | ||||||||
| 延长 NGM31 的使用寿命 | ||||||||
| 抗生素 | 抗生素(卡那霉素、羧苄西林等) | 是的 | 是的 | 延迟生长发育15 | ||||
| 延长液体介质的使用寿命19 | ||||||||
| 延长 NGM15 的使用寿命 | ||||||||
| 全氟辛烷磺酸 | 0.5% 多聚甲醛 | 是的 | 是的 | 小育雏减少16 | ||||
| 开发时间增加小16 | ||||||||
| 食物偏好降低16 | ||||||||
表 1.杀死OP50的方法比较。 紫外线杀灭、热杀灭、抗生素治疗和 PFA 治疗对细菌的营养状况和喂食处理细菌的蠕虫的健康有不同的影响。这些复制灭活 大肠杆菌 的方法在所需的材料和可扩展性方面也有所不同。
研究方案
1.细菌接种
- 通过将 10 g 胰蛋白胨、5 g 酵母提取物和 10 g 氯化钠 (NaCl) 溶解在 950 mL 蒸馏水中来制备 Luria 肉汤 (LB)。
- 通过加入5M氢氧化钠(NaOH)将LB的pH值调节至7.0。这应该只需要大约 0.2 mL 的 NaOH。
- 在15psi下以液体循环高压灭菌pH调节的LB培养基45分钟。让溶液冷却并在室温下储存。
- 在 500 mL 锥形瓶中接种 100 mL LB 中的单个菌落。将细菌在37°C振荡培养箱中培养过夜。
- 根据细菌菌落的健康状况、烧瓶的大小和振荡器设置的速度,细菌生长所需的时间可能会有所不同。~14小时后,检查细菌在600nm(OD600)处的光密度(OD)。
- 当OD600 为3.0(1×109 菌落形成单位(CFU)/ mL)时,从振荡器中除去细菌。如果 OD600 小于 3.0,则将烧瓶放回摇床培养箱,直到达到所需的 OD。
- 将细菌分装在50mL锥形管中,并储存在4°C或进行下一步。
2. 使用多聚甲醛
注意:使用的多聚甲醛 (PFA) 浓度和暴露时间可能因气候、位置和所治疗细菌的类型而略有不同。OP50 的良好起点是暴露于 0.5% PFA 1 小时,而 HT115 的 0.25% PFA 可能就足够了。
- 准备 32% PFA 原液或使用市售的 32% PFA 溶液。使用 PFA 时,请使用适当的个人防护设备 (PPE)。戴上手套和护目镜。
- 在通风良好的化学通风橱内添加 PFA。将含有 PFA 的洗涤剂和吸头丢弃在通风橱中的适当化学危险容器中。
3.用多聚甲醛进行细菌处理
- 一旦细菌达到 OD600 为 3.0,使用血清移液管将 50 mL 转移到新的 250 mL 锥形瓶中。将其余部分保存为活对照、模拟处理的对照(参见步骤 4),或根据需要用 PFA 处理。
- 避免从一个烧瓶倒到另一个烧瓶,并注意不要用细菌溅到新烧瓶的侧面。烧瓶侧面的菌落可以接受较低剂量的PFA。
- 在化学罩中,向 50 mL 细菌中加入 781 μL 32% PFA,使最终浓度达到 0.5%。处理固体废物化学危险容器中使用的吸头。
- 用箔纸盖住烧瓶,然后返回37°C振荡器培养箱1小时。1小时后,从培养箱中取出烧瓶并继续进行步骤5。
4.模拟处理对照
- 一旦细菌达到 OD600 为 3.0,使用血清移液管将 50 mL 细菌转移到 50 mL 锥形管中。
- 继续执行步骤5.3以完成类似于PFA处理组的洗涤步骤。
5.清洗细菌以去除残留的PFA
- 在化学罩中,使用血清移液管将处理过的细菌从锥形瓶转移到 50 mL 锥形管中。使用血清移液管代替倒入细菌将防止烧瓶边缘任何细菌菌落的污染,这些菌落可能避免了直接用PFA处理。
- 将处理过的细菌以约3000× g 离心20分钟。将上清液丢弃在化学罩中的液体废物化学危害容器中,以去除上清液。
- 加入 25 mL LB 并涡旋以重悬细菌沉淀(完全填充试管会使沉淀更难重悬)。重复离心和沉淀重悬 4 次。
- 以适合不同测定的体积重悬沉淀。对于寿命测定,将装有 200 μL 细菌的 60 mm 培养板重新悬浮在 10 mL LB 中,将细菌重悬于 10 mL LB 中,可得到原始 50 mL 培养物的 5 倍浓度。
- 将细菌储存在4°C。
6. 细菌生长质量检查
- 在最终洗涤和重悬后,用准备好的细菌划出LB板(使用无菌移液器吸头)。最好将用于清洗和重悬的 LB 划在单独的板上,以确保使用的 LB 没有被污染。
- 将板置于37°C培养箱中过夜。检查是否有任何增长。当菌落不在LB平板上生长时,细菌被认为是复制死亡的。
7. 使用呼吸计进行细菌代谢质量检查
- 在步骤5.4的最终洗涤和重悬后,使用可用的工具(如呼吸计19,20)确认细菌代谢死亡并测量基础耗氧率(OCR)。
- 制备M9溶液:将3g磷酸二氢钾(KH2PO 4),6g磷酸氢二钠(Na2HPO4)和5g氯化钠(NaCl)溶于950mL蒸馏水中。在15psi下在液体循环中高压灭菌45分钟,然后让溶液冷却至室温。加入 1 mL 的 1 M 硫酸镁 (MgSO4) 并在室温下储存。
- 水合呼吸计墨盒:向 96 孔板的所有孔中加入 200 μL 校准品。将小柱置于96孔板中,并在37°C培养箱中孵育过夜。
- 测定校准:第二天,将水合卡盒放入机器中并开始校准。
- 测定测试板设置:使用新的 96 孔板,向测试孔中加入 160 μL M9 和 40 μL 制备的细菌 (1 x 109 CFU/mL)。向 4 个角孔中加入 200 μL M9 用作空白孔。加入 160 μL M9 和 40 μL LB 用于洗涤和重悬,用作阴性对照。将 200 μL M9 添加到其余不使用的孔中。
- 运行检测:墨盒校准完成后,将步骤7.5中的检测板插入机器进行分析。这些设置包括混合、等待、测量和循环的步骤。结果将显示为耗氧率 (OCR)。当 OCR 为零时,细菌在代谢上死亡并准备使用。
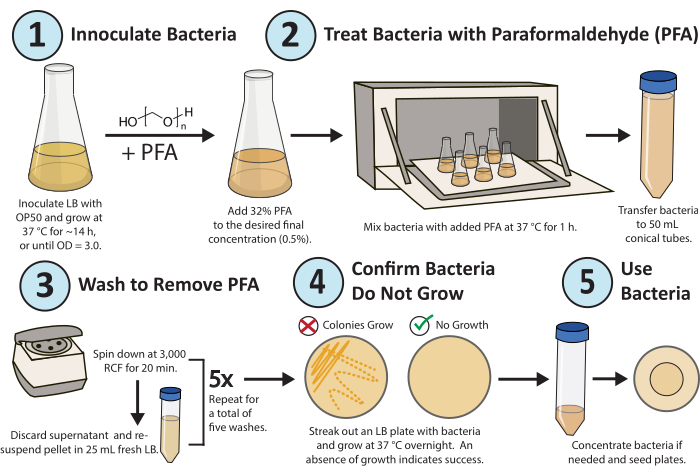
图 1.多聚甲醛处理的工作流程。大肠杆菌OP50细菌的单个菌落在一夜之间生长。将PFA加入至0.5%的终浓度,并将PFA处理的培养物在37°C下振荡1小时。 最后,通过用新鲜的LB 5x洗涤培养物来除去PFA。为了确认处理过的细菌是复制性无活性的,划出处理过的细菌的LB板并生长过夜。请点击这里查看此图的较大版本.
结果
该协议的详细工作流程如图1所示。开发并优化了一种高通量方法,以一致地灭活细菌复制(图2A)和代谢(图2B),用于使用多聚甲醛16进行秀丽隐杆线虫研究的代谢和药物研究。目标是确定所需的最低PFA浓度和持续杀死细菌所需的最短时间,而不会影响蠕虫的各种健康措施。这些值可能因实验室环境而异...
讨论
相对于其他细菌杀灭方法,PFA杀灭的益处
PFA处理是一种高通量方法,可防止细菌代谢,同时保持秀丽隐杆线虫的营养食物来源。与其他方法相比,通过PFA处理杀死细菌具有多种优势。与紫外线处理不同,紫外线处理必须测试每个板才能成功杀灭,而一批 PFA 处理细菌中的单个板可以测试以验证第16 批。PFA处理在消除细菌代谢方面也非常有效(
披露声明
作者没有什么可透露的。
致谢
这项工作由美国国立卫生研究院R21AG059117和密歇根大学Paul F. Glenn衰老生物学研究实验室资助。SB由T32AG000114资助。ESK由NSF DGE 1841052资助。
材料
| Name | Company | Catalog Number | Comments |
| Aluminum Foil | Staples | 2549291 | |
| Bunsen burner | VWR | 470121-700 | |
| Cell Density Meter | Denville | 80-3000-45 | |
| Centrifuge | Eppendorg | 5430 | |
| Chemical fume hood | Labcono | 975050411384RG | |
| Conincal tubes (50 mL) | Fisher | 339652 | |
| Cuvettes | Fisher | 14-955-127 | |
| E. coli OP50 | CGC | OP50 | |
| Erlenmyer flasks | Fisher | 250 mL: FB501250 500 mL: FB501500 1000 mL: FB5011000 | |
| Inoculation loop | Fisher | 22-363-605 | |
| LB Agar | Fisher | BP1425500 | |
| Liquid waste collection bottle | Thomas Scientific | 1230G50 | |
| Magnesium Sulfate (MgSO4) | Sigma | M7506 | |
| Paraformaldehyde (32%) | Electron Microscopy Sciences | 15714-S | Paraformaldehyde – methanol free solution |
| Pipettor | Eppendorf | Eppendorf Easypet 3 | |
| Plastic dishes (100 mm) | Fisher | FB0875712 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher | P2853 | |
| Seahorse XF Calibrant | Agilent | 100840-000 | |
| Seahorse XFe96 Extracellular Flux Assay Kit and Cell Culture Microplate | Agilent | 101085-004 | |
| Serological pipettes (50 mL) | Genesee Scientific | 12-107 | |
| Shaker incubator | Thermo | 11 676 083 | |
| Sodium Chloride (NaCl) | Fisher | S640-3 | |
| Sodium Hydroxide (NaOH) | Fisher | S318500 | |
| Sodium Phosphate Dibasic Anhydrous (Na2HPO4) | Sigma | S374-500 | |
| Solid waste collection bucket | M&M Industries | 5.0 Gallon M1 Traditional Pail | |
| Tryptone | Genesee Scientific | 20-251 | |
| Vortex | Thermo | 11676331 | |
| Weighing balance | C Goldenwall | HZ10K6B | |
| Yeast Extract | Genesee Scientific | 20-255 |
参考文献
- Riddle, D. L., Blumenthal, T., Meyer, B. J., Priess, J. R. C. . Elegans II. 33, (1997).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: A primer on caenorhabditis elegans. WormBook. , 1-31 (2015).
- Kaletta, T., Hengartner, M. O. Finding function in novel targets: C. elegans as a model organism. Nature reviews. Drug discovery. 5 (5), 387-398 (2006).
- Meneely, P. M., Dahlberg, C. L., Rose, J. K. Working with worms: Caenorhabditis elegans as a model organism. Current Protocols Essential Laboratory Techniques. 19 (1), (2019).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Frontiers in Endocrinology. 11, 554994 (2020).
- Feng, M., Gao, B., Garcia, L. R., Sun, Q. Microbiota-derived metabolites in regulating the development and physiology of Caenorhabditis elegans. Frontiers in Microbiology. 14, 1035582 (2023).
- McIntyre, G., Wright, J., Wong, H. T., Lamendella, R., Chan, J. Effects of FUdR on gene expression in the C. elegans bacterial diet OP50. BMC Research Notes. 14 (1), 207 (2021).
- Cabreiro, F., et al. Metformin retards aging in c. Elegans by altering microbial folate and methionine metabolism. Cell. 153 (1), 228-239 (2013).
- Worthy, S. E., et al. Identification of attractive odorants released by preferred bacterial food found in the natural habitats of c. Elegans. PLoS One. 13 (7), e0201158 (2018).
- Chen, Y. C., Seyedsayamdost, M. R., Ringstad, N. A microbial metabolite synergizes with endogenous serotonin to trigger C. elegans reproductive behavior. Proceedings of the National Academy of Sciences of the United States of America. 117 (48), 30589-30598 (2020).
- Kim, D. H., Flavell, S. W. Host-microbe interactions and the behavior of Caenorhabditis elegans. Journal of Neurogenetics. 34 (3-4), 500-509 (2020).
- Gems, D., Riddle, D. L. Genetic, behavioral, and environmental determinants of male longevity in Caenorhabditis elegans. Genetics. 154 (4), 1597-1610 (2000).
- Qi, B., Kniazeva, M., Han, M. A vitamin-b2-sensing mechanism that regulates gut protease activity to impact animal's food behavior and growth. eLife. 6, e26243 (2017).
- Garigan, D., et al. Genetic analysis of tissue aging in caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Virk, B., et al. Folate acts in E. coli to accelerate C. elegans aging independently of bacterial biosynthesis. Cell Reports. 14 (7), 1611-1620 (2016).
- Beydoun, S., et al. An alternative food source for metabolism and longevity studies in Caenorhabditis elegans. Communications Biology. 4 (1), 258 (2021).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral and Maxillofacial Pathology. 16 (3), 400-405 (2012).
- Felix, H. Permeabilized and immobilized cells. Methods in Enzymology. 137, 637-641 (1988).
- Lobritz, M. A., et al. Antibiotic efficacy is linked to bacterial cellular respiration. Proceedings of the National Academy of Sciences of the United States of America. 112 (27), 8173-8180 (2015).
- Nadanaciva, S., et al. Assessment of drug-induced mitochondrial dysfunction via altered cellular respiration and acidification measured in a 96-well platform. Journal of Bioenergetics and Biomembranes. 44 (4), 421-437 (2012).
- Shtonda, B. B., Avery, L. Dietary choice behavior in Caenorhabditis elegans. The Journal of Experimental biology. 209 (Pt 1), 89-102 (2006).
- MacNeil, L. T., Watson, E., Arda, H. E., Zhu, L. J., Walhout, A. J. Diet-induced developmental acceleration independent of tor and insulin in C. elegans. Cell. 153 (1), 240-252 (2013).
- Kumar, S., et al. Lifespan extension in C. elegans caused by bacterial colonization of the intestine and subsequent activation of an innate immune response. Developmental Cell. 49 (1), 100-117 (2019).
- Nakagawa, H., et al. Effects and mechanisms of prolongevity induced by Lactobacillus gasseri sbt2055 in Caenorhabditis elegans. Aging Cell. 15 (2), 227-236 (2016).
- Kaeberlein, T. L., et al. Lifespan extension in Caenorhabditis elegans by complete removal of food. Aging Cell. 5 (6), 487-494 (2006).
- Beaudoin-Chabot, C., et al. The unfolded protein response reverses the effects of glucose on lifespan in chemically-sterilized C. elegans. Nature Communication. 13 (1), 5889 (2022).
- Komura, T., Takemoto, A., Kosaka, H., Suzuki, T., Nishikawa, Y. Prolonged lifespan, improved perception, and enhanced host defense of Caenorhabditis elegans by Lactococcus cremoris subsp. cremoris.Microbiology Spectrum. 10 (3), e0045421 (2022).
- Ye, X., Linton, J. M., Schork, N. J., Buck, L. B., Petrascheck, M. A pharmacological network for lifespan extension in Caenorhabditis elegans. Aging Cell. 13 (2), 206-215 (2014).
- Hastings, J., et al. Wormjam: A consensus C. elegans metabolic reconstruction and metabolomics community and workshop series. Worm. 6 (2), e1373939 (2017).
- O'Donnell, M. P., Fox, B. W., Chao, P. H., Schroeder, F. C., Sengupta, P. A neurotransmitter produced by gut bacteria modulates host sensory behaviour. Nature. 583 (7816), 415-420 (2020).
- Stuhr, N. L., Curran, S. P. Bacterial diets differentially alter lifespan and healthspan trajectories in C. elegans. Communications Biology. 3 (1), 653 (2020).
- Dirksen, P., et al. Cembio - the Caenorhabditis elegans microbiome resource. G3 (Bethesda). 10 (9), 3025-3039 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。