Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Методология метаболически инактивировать бактерии для исследования Caenorhabditis elegans
В этой статье
Резюме
Источником пищи для Caenorhabditis elegans в лаборатории является живая кишечная палочка. Поскольку бактерии метаболически активны, они представляют собой искажающую переменную в метаболических и лекарственных исследованиях C. elegans. Подробный протокол метаболической инактивации бактерий с использованием параформальдегида описан здесь.
Аннотация
Caenorhabditis elegans является распространенным модельным организмом для исследований в области генетики, развития, старения, метаболизма и поведения. Поскольку C. elegans потребляют пищу из живых бактерий, метаболическая активность их источника пищи может запутать эксперименты, направленные на изучение прямого воздействия различных вмешательств на червя. Чтобы избежать сбивающих с толку эффектов бактериального метаболизма, исследователи C. elegans использовали несколько методов метаболической инактивации бактерий, включая ультрафиолетовое (УФ)-облучение, тепловое убийство и антибиотики. УФ-обработка имеет относительно низкую пропускную способность и не может быть использована в жидких культурах, поскольку каждая пластина должна быть исследована на предмет успешного уничтожения бактерий. Второй метод обработки, тепловое умерщвление, отрицательно влияет на текстуру и питательные качества бактерий, что приводит к остановке развития C. elegans. Наконец, лечение антибиотиками может напрямую изменить физиологию C. elegans в дополнение к предотвращению роста бактерий. В данной статье описывается альтернативный метод метаболической инактивации бактерий с использованием параформальдегида (PFA). Лечение PFA сшивает белки в бактериальных клетках, чтобы предотвратить метаболическую активность, сохраняя при этом клеточную структуру и содержание питательных веществ. Этот метод является высокопроизводительным и может быть использован в жидких культурах или твердых планшетах, так как тестирование одной пластины бактерий, обработанных PFA, на рост проверяет всю партию. Метаболическая инактивация с помощью лечения PFA может быть использована для устранения искажающих эффектов бактериального метаболизма в исследованиях лекарственного или метаболитного приема добавок, стрессоустойчивости, метаболомики и поведения C. elegans.
Введение
Caenorhabditis elegans был первоначально предложен в качестве модельного организма в 1965 году1 и с тех пор широко используется в исследованиях генетики, развития, поведения, старенияи метаболизма. Благодаря большому размеру выводка и прозрачной кутикуле C. elegans особенно хорошо подходит для высокопроизводительного скрининга с флуоресцентными репортерами3. Их короткий жизненный цикл, гермафродитное размножение и генетическая гомология с человеком также делают C. elegans ценной модельной системой для исследований развития4 и биологии старения5. Кроме того, C. elegans относительно просты в уходе. Червей можно выращивать в жидкой культуре или на твердых агаровых планшетах и потреблять пищу из живых бактерий Escherichia coli OP504.
Тем не менее, живой источник пищи C. elegans может запутать исследования метаболизма, добавок лекарств и поведения. Поскольку живые бактерии имеют свой собственный метаболизм, экспериментальные условия, влияющие на бактерии, также изменяют питательные вещества и метаболиты, доступные червям. Например, различия в концентрациях бактериального железа, аминокислот и фолиевой кислоты оказывают различное влияние на развитие, физиологию и продолжительность жизни C. elegans. Многие распространенные лабораторные практики могут вызвать такие изменения в составе питательных веществ и метаболитах, продуцируемых OP50. В частности, воздействие 5-фтор-2'-дезоксиуридина (FUdR), соединения, обычно используемого для предотвращения размножения у C. elegans, вызывает широкие изменения в экспрессии гена OP50, включая пути биосинтеза аминокислот7. Живые бактерии также могут запутать исследования, в которых C. elegans дополняют малыми молекулами, потому что бактерии могут частично или полностью метаболизировать активные соединения. Более того, воздействие этих малых молекул на бактерии может, в свою очередь, изменить физиологию C. elegans, как это было показано с препаратом для продления жизни метформином8. Наконец, живые бактерии могут изменять среду обитания червя таким образом, что это изменяет его поведение, например, выделять привлекательные пахучие вещества9, вырабатывать экзогенные нейромодуляторы10 и создавать кислородные градиенты в густом бактериальном газоне11.
Чтобы смягчить влияние бактериального метаболизма на исследования C. elegans , было разработано несколько методов уничтожения бактерий (табл. 1). Тремя распространенными стратегиями уничтожения OP50 являются УФ-облучение, тепловое умерщвление и лечение антибиотиками. Несмотря на то, что каждый из этих методов прост и относительно недорог, он может оказывать нежелательное воздействие как на бактерии, так и на C. elegans. Уничтожение УФ-излучения с помощью УФ-сшивателя12 имеет низкую пропускную способность, и скорость ограничена количеством пластин, которые могут поместиться в УФ-сшиватель. Кроме того, эффективность УФ-уничтожения может варьироваться от планшета к планшету в рамках партии, и тестирование роста на всех планшетах может стать затруднительным в больших экспериментах. Термическое уничтожение OP50 путем воздействия культуры при температуре >60 °C сопряжено с рядом проблем. Высокая температура может повредить питательные вещества, необходимые для червя, и разрушить клеточную структуру бактерий, создавая более мягкую текстуру, которая уменьшает количество времени, которое черви проводят на пище13. Этот метод также не может быть использован на протяжении всего жизненного цикла C. elegans , потому что черви, которых кормят бактериями, убитыми теплом, могут останавливаться на раннихстадиях развития. Лечение антибиотиками является третьим распространенным методом подавления бактериального метаболизма14, но антибиотики также могут изменять рост и метаболизм червей15.
Одним из решений для устранения метаболических эффектов живых бактерий при сохранении бактериальной структуры и основных питательных веществ является уничтожение OP50 параформальдегидом (PFA)16. PFA представляет собой полимер формальдегида, который может сшивать белки в клетках17 для предотвращения репликации бактерий без разрушения внутренних клеточных структур, таких как внутренняя плазматическая мембрана18. Благодаря сохранению внутренней клеточной структуры, бактерии, обработанные PFA, не проявляют роста или метаболической активности, но остаются съедобным и богатым питательными веществами источником пищи для C. elegans16. Здесь представлен подробный протокол, который показывает, как метаболически инактивировать бактерии с помощью параформальдегида.
| Метод | Необходимые материалы | Масштабируемый? | Питательный? | Влияние на червя? | ||||
| УЛЬТРАФИОЛЕТОВЫЙ | УФ-сшиватель | Ограничено: | Да | Вариабельное влияние на продолжительность жизни NGM12, 23, 24 | ||||
| Количество пластин, которые помещаются в УФ-сшиватель | Переменное влияние на срок службы FUdR24, 26, 27 | |||||||
| Время облучения на пластину | Снижение предпочтений в еде16 | |||||||
| Возможность проверить каждую пластину на рост8 | ||||||||
| Жара | Инкубатор >60 °C | Да | Нет: разрушает клеточную стенку, снижается пищевая ценность | Остановка развития 13 | ||||
| Снижение предпочтений в еде13 | ||||||||
| Продлевает срок службы NGM31 | ||||||||
| Антибиотики | Антибиотики (канамицин, карбенициллин и др.) | Да | Да | Задержки роста и развития15 | ||||
| Продлевает срок службы в жидких средах19 | ||||||||
| Продлевает срок службы NGM15 | ||||||||
| ПФА | 0,5% параформальдегида | Да | Да | Уменьшение размера маленького расплода16 | ||||
| Небольшое увеличение времени разработки16 | ||||||||
| Снижение предпочтений в еде16 | ||||||||
Таблица 1. Сравнение методов уничтожения OP50. Уничтожение ультрафиолетом, тепловое уничтожение, лечение антибиотиками и обработка PFA оказывают различное влияние на питательный статус бактерий и здоровье червей, которых кормили обработанными бактериями. Эти методы репликативной инактивации кишечной палочки также различаются по требуемым материалам и масштабируемости.
протокол
1. Посев бактерий
- Приготовьте отвар Лурия (LB), растворив 10 г триптона, 5 г дрожжевого экстракта и 10 г хлорида натрия (NaCl) в 950 мл дистиллированной воды.
- Отрегулируйте pH LB до 7,0, добавив 5M гидроксида натрия (NaOH). Для этого потребуется всего около 0,2 мл NaOH.
- Автоклавируйте среду LB с регулируемым pH в жидком цикле в течение 45 минут при давлении 15 фунтов на квадратный дюйм. Дайте раствору остыть и храните при комнатной температуре.
- Инокулируют одну колонию бактерий в 100 мл LB в колбу Эрленмейера объемом 500 мл. Культивируйте бактерии в течение ночи в инкубаторе-шейкере при температуре 37 °C.
- В зависимости от состояния бактериальной колонии, размера колбы и скорости, на которую настроен встряхиватель, время, необходимое для роста бактерий, может варьироваться. Через ~14 ч проверьте оптическую плотность (OD) бактерий на длине волны 600 нм (OD600).
- Удалите бактерии из шейкера, когда OD600 станет 3,0 (1 x 10,9 колониеобразующих единиц (КОЕ)/мл). Если наружный диаметр600 меньше 3,0, верните колбу в встряхивающий инкубатор до тех пор, пока не будет достигнут желаемый внешний диаметр.
- Распределите бактерии по 50 мл в конические пробирки и храните при температуре 4 °C или перейдите к следующему этапу.
2. Работа с параформальдегидом
ПРИМЕЧАНИЕ: Используемая концентрация параформальдегида (PFA) и продолжительность воздействия могут несколько варьироваться в зависимости от климата, местоположения и типа обрабатываемых бактерий. Хорошей отправной точкой для OP50 является воздействие 0,5% PFA в течение 1 ч, тогда как 0,25% PFA в течение 1 ч может быть достаточно для HT115.
- Приготовьте 32%-ный раствор PFA или используйте коммерчески купленный 32%-ный раствор PFA. Используйте надлежащие средства индивидуальной защиты (СИЗ) при работе с PFA. Наденьте перчатки и защитные очки.
- Добавьте PFA в химический вытяжной шкаф с надлежащей вентиляцией. Утилизируйте промывочные средства и наконечники, содержащие PFA, в надлежащие контейнеры для химической опасности в вытяжном шкафу.
3. Бактериальная обработка параформальдегидом
- Как только бактерии достигнут наружного диаметра600 3,0, используйте серологическую пипетку, чтобы переложить 50 мл в новую колбу Эрленмейера объемом 250 мл. Остальное сохраните для динамического контроля, имитационного контроля (см. шаг 4) или для обработки PFA по мере необходимости.
- Не переливайте из одной колбы в другую и будьте осторожны, чтобы не забрызгать стенки новой колбы бактериями. Колонии на боковой стороне колбы могут получать меньшую дозу PFA.
- В химическом колпаке добавьте 781 мкл 32% PFA к 50 мл бактерий, чтобы довести конечную концентрацию до 0,5%. Утилизируйте наконечник, используемый в контейнере для твердых отходов, химически опасных веществ.
- Накройте колбу фольгой и верните в инкубатор-шейкер с температурой 37 °C на 1 ч. Через 1 ч извлеките колбу из инкубатора и приступайте к шагу 5.
4. Контроль, прошедший имитационную обработку
- Как только бактерии достигнут наружного диаметра600 3,0, используйте серологическую пипетку, чтобы перенести 50 мл бактерий в коническую пробирку объемом 50 мл.
- Перейдите к шагу 5.3, чтобы выполнить этапы промывки, аналогичные группе, обработанной PFA.
5. Промывка бактерий для удаления остатков PFA
- В химическом колпаке используйте серологическую пипетку для переноса обработанных бактерий из колбы Эрленмейера в коническую пробирку объемом 50 мл. Использование серологической пипетки вместо выливания бактерий предотвратит загрязнение любыми колониями бактерий на краю колбы, которые, возможно, избежали прямой обработки PFA.
- Центрифугой обрабатывают бактерии при концентрации примерно 3000 х г в течение 20 мин. Удалите надосадочную жидкость, выбросив ее в контейнер для жидких отходов химической опасности в химическом колпаке.
- Добавьте 25 мл LB и вмешайте, чтобы повторно взвеснить бактериальную гранулу (полное заполнение пробирки затрудняет повторное суспендирование гранулы). Повторите центрифугирование и ресуспендирование гранул 4 раза.
- Ресуспендируйте гранулы в объемах, оптимальных для различных анализов. Для анализа продолжительности жизни засейте 60-миллиметровые планшеты 200 мкл бактерий, ресуспендированных в 10 мл LB. Ресуспендирование бактерий в 10 мл LB приводит к 5-кратной концентрации по сравнению с исходной культурой в 50 мл.
- Храните бактерии при температуре 4 °C.
6. Проверка качества роста бактерий
- После окончательной промывки и ресуспензии прополосьте пластину LB (с помощью стерильного наконечника пипетки) подготовленными бактериями. Хорошей практикой является нанесение LB, используемого для промывки и ресуспендирования, на отдельную пластину, чтобы убедиться, что используемый LB не загрязнен.
- Поместите планшеты в инкубатор с температурой 37 °C на ночь. Проверьте, нет ли нароста. Бактерии считаются репликативно мертвыми, когда колонии не растут на пластине LB.
7. Проверка качества бактериального метаболизма с помощью респирометра
- После окончательной промывки и ресуспензии, начиная с шага 5.4, подтвердите, что бактерии метаболически мертвы, используя доступные инструменты, такие как респирометры19,20 и измерение базальной скорости потребления кислорода (OCR).
- Приготовьте раствор М9: растворите 3 г одноосновного фосфата калия (KH 2 PO 4), 6г натрия фосфата двухосновного (Na2HPO4) и 5 г хлорида натрия (NaCl) в 950 мл дистиллированной воды. Автоклав в жидком цикле в течение 45 мин при давлении 15 фунтов на квадратный дюйм, затем дайте раствору остыть до комнатной температуры. Добавьте 1 мл 1 М сульфата магния (MgSO4) и храните при комнатной температуре.
- Гидратация картриджа респирометра: добавьте 200 мкл калибранта во все лунки 96-луночной пластины. Поместите картридж в 96-луночный планшет и инкубируйте в течение ночи в инкубаторе при температуре 37 °C.
- Калибровка пробирного анализа: На следующий день поместите гидратированный картридж в машину и начните калибровку.
- Настройка тест-планшета: Используя новую 96-луночную планшет, добавьте 160 мкл M9 и 40 мкл подготовленных бактерий (1 x 109 КОЕ/мл) для тестирования лунок. Добавьте 200 мкл M9 в 4 угловые лунки, чтобы использовать их в качестве глухих лунок. Добавьте 160 мкл M9 и 40 мкл LB, используемых для промывки и ресуспендирования, для использования в качестве отрицательного контроля. Добавьте 200 мкл M9 к остальным лункам, которые не будут использоваться.
- Запустите анализ: После завершения калибровки картриджа вставьте пробирную пластину из шага 7.5 в машину для анализа. Настройки включают в себя шаги для микширования, ожидания, измерения и цикла. Результаты будут показаны в виде коэффициента потребления кислорода (OCR). Бактерии метаболически мертвы и готовы к использованию, когда OCR равен нулю.
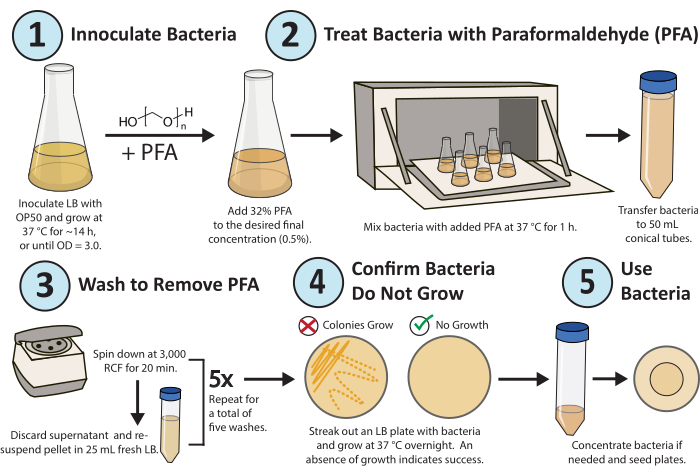
Рисунок 1. Рабочий процесс для обработки параформальдегидом. Одна колония бактерий E. coli OP50 выращивается за ночь. ПФА добавляют до конечной концентрации 0,5%, а обработанную ПФА культуру встряхивают в течение 1 ч при 37 °С. Наконец, PFA удаляют, промывая культуру свежим LB 5x. Чтобы убедиться, что обработанные бактерии реплицистически неактивны, выделите пластину LB обработанных бактерий и вырастите их в течение ночи. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Результаты
Подробный рабочий процесс протокола показан на рисунке 1. Был разработан и оптимизирован высокопроизводительный метод последовательной инактивации репликации бактерий (рис. 2A) и метаболизма (рис. 2B) для метаболических и лекарственных ис...
Обсуждение
Преимущества уничтожения PFA по сравнению с другими методами уничтожения бактерий
Обработка PFA является высокопроизводительным методом предотвращения бактериального метаболизма при сохранении питательного источника пищи для C. elegans. Уничтожение бактерий с помощью PFA-о?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа финансировалась NIH R21AG059117 и Лабораториями Пола Ф. Гленна по исследованию биологии старения в Мичиганском университете. SB финансировался компанией T32AG000114. ESK финансировался NSF DGE 1841052.
Материалы
| Name | Company | Catalog Number | Comments |
| Aluminum Foil | Staples | 2549291 | |
| Bunsen burner | VWR | 470121-700 | |
| Cell Density Meter | Denville | 80-3000-45 | |
| Centrifuge | Eppendorg | 5430 | |
| Chemical fume hood | Labcono | 975050411384RG | |
| Conincal tubes (50 mL) | Fisher | 339652 | |
| Cuvettes | Fisher | 14-955-127 | |
| E. coli OP50 | CGC | OP50 | |
| Erlenmyer flasks | Fisher | 250 mL: FB501250 500 mL: FB501500 1000 mL: FB5011000 | |
| Inoculation loop | Fisher | 22-363-605 | |
| LB Agar | Fisher | BP1425500 | |
| Liquid waste collection bottle | Thomas Scientific | 1230G50 | |
| Magnesium Sulfate (MgSO4) | Sigma | M7506 | |
| Paraformaldehyde (32%) | Electron Microscopy Sciences | 15714-S | Paraformaldehyde – methanol free solution |
| Pipettor | Eppendorf | Eppendorf Easypet 3 | |
| Plastic dishes (100 mm) | Fisher | FB0875712 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher | P2853 | |
| Seahorse XF Calibrant | Agilent | 100840-000 | |
| Seahorse XFe96 Extracellular Flux Assay Kit and Cell Culture Microplate | Agilent | 101085-004 | |
| Serological pipettes (50 mL) | Genesee Scientific | 12-107 | |
| Shaker incubator | Thermo | 11 676 083 | |
| Sodium Chloride (NaCl) | Fisher | S640-3 | |
| Sodium Hydroxide (NaOH) | Fisher | S318500 | |
| Sodium Phosphate Dibasic Anhydrous (Na2HPO4) | Sigma | S374-500 | |
| Solid waste collection bucket | M&M Industries | 5.0 Gallon M1 Traditional Pail | |
| Tryptone | Genesee Scientific | 20-251 | |
| Vortex | Thermo | 11676331 | |
| Weighing balance | C Goldenwall | HZ10K6B | |
| Yeast Extract | Genesee Scientific | 20-255 |
Ссылки
- Riddle, D. L., Blumenthal, T., Meyer, B. J., Priess, J. R. C. . Elegans II. 33, (1997).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: A primer on caenorhabditis elegans. WormBook. , 1-31 (2015).
- Kaletta, T., Hengartner, M. O. Finding function in novel targets: C. elegans as a model organism. Nature reviews. Drug discovery. 5 (5), 387-398 (2006).
- Meneely, P. M., Dahlberg, C. L., Rose, J. K. Working with worms: Caenorhabditis elegans as a model organism. Current Protocols Essential Laboratory Techniques. 19 (1), (2019).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Frontiers in Endocrinology. 11, 554994 (2020).
- Feng, M., Gao, B., Garcia, L. R., Sun, Q. Microbiota-derived metabolites in regulating the development and physiology of Caenorhabditis elegans. Frontiers in Microbiology. 14, 1035582 (2023).
- McIntyre, G., Wright, J., Wong, H. T., Lamendella, R., Chan, J. Effects of FUdR on gene expression in the C. elegans bacterial diet OP50. BMC Research Notes. 14 (1), 207 (2021).
- Cabreiro, F., et al. Metformin retards aging in c. Elegans by altering microbial folate and methionine metabolism. Cell. 153 (1), 228-239 (2013).
- Worthy, S. E., et al. Identification of attractive odorants released by preferred bacterial food found in the natural habitats of c. Elegans. PLoS One. 13 (7), e0201158 (2018).
- Chen, Y. C., Seyedsayamdost, M. R., Ringstad, N. A microbial metabolite synergizes with endogenous serotonin to trigger C. elegans reproductive behavior. Proceedings of the National Academy of Sciences of the United States of America. 117 (48), 30589-30598 (2020).
- Kim, D. H., Flavell, S. W. Host-microbe interactions and the behavior of Caenorhabditis elegans. Journal of Neurogenetics. 34 (3-4), 500-509 (2020).
- Gems, D., Riddle, D. L. Genetic, behavioral, and environmental determinants of male longevity in Caenorhabditis elegans. Genetics. 154 (4), 1597-1610 (2000).
- Qi, B., Kniazeva, M., Han, M. A vitamin-b2-sensing mechanism that regulates gut protease activity to impact animal's food behavior and growth. eLife. 6, e26243 (2017).
- Garigan, D., et al. Genetic analysis of tissue aging in caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Virk, B., et al. Folate acts in E. coli to accelerate C. elegans aging independently of bacterial biosynthesis. Cell Reports. 14 (7), 1611-1620 (2016).
- Beydoun, S., et al. An alternative food source for metabolism and longevity studies in Caenorhabditis elegans. Communications Biology. 4 (1), 258 (2021).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral and Maxillofacial Pathology. 16 (3), 400-405 (2012).
- Felix, H. Permeabilized and immobilized cells. Methods in Enzymology. 137, 637-641 (1988).
- Lobritz, M. A., et al. Antibiotic efficacy is linked to bacterial cellular respiration. Proceedings of the National Academy of Sciences of the United States of America. 112 (27), 8173-8180 (2015).
- Nadanaciva, S., et al. Assessment of drug-induced mitochondrial dysfunction via altered cellular respiration and acidification measured in a 96-well platform. Journal of Bioenergetics and Biomembranes. 44 (4), 421-437 (2012).
- Shtonda, B. B., Avery, L. Dietary choice behavior in Caenorhabditis elegans. The Journal of Experimental biology. 209 (Pt 1), 89-102 (2006).
- MacNeil, L. T., Watson, E., Arda, H. E., Zhu, L. J., Walhout, A. J. Diet-induced developmental acceleration independent of tor and insulin in C. elegans. Cell. 153 (1), 240-252 (2013).
- Kumar, S., et al. Lifespan extension in C. elegans caused by bacterial colonization of the intestine and subsequent activation of an innate immune response. Developmental Cell. 49 (1), 100-117 (2019).
- Nakagawa, H., et al. Effects and mechanisms of prolongevity induced by Lactobacillus gasseri sbt2055 in Caenorhabditis elegans. Aging Cell. 15 (2), 227-236 (2016).
- Kaeberlein, T. L., et al. Lifespan extension in Caenorhabditis elegans by complete removal of food. Aging Cell. 5 (6), 487-494 (2006).
- Beaudoin-Chabot, C., et al. The unfolded protein response reverses the effects of glucose on lifespan in chemically-sterilized C. elegans. Nature Communication. 13 (1), 5889 (2022).
- Komura, T., Takemoto, A., Kosaka, H., Suzuki, T., Nishikawa, Y. Prolonged lifespan, improved perception, and enhanced host defense of Caenorhabditis elegans by Lactococcus cremoris subsp. cremoris.Microbiology Spectrum. 10 (3), e0045421 (2022).
- Ye, X., Linton, J. M., Schork, N. J., Buck, L. B., Petrascheck, M. A pharmacological network for lifespan extension in Caenorhabditis elegans. Aging Cell. 13 (2), 206-215 (2014).
- Hastings, J., et al. Wormjam: A consensus C. elegans metabolic reconstruction and metabolomics community and workshop series. Worm. 6 (2), e1373939 (2017).
- O'Donnell, M. P., Fox, B. W., Chao, P. H., Schroeder, F. C., Sengupta, P. A neurotransmitter produced by gut bacteria modulates host sensory behaviour. Nature. 583 (7816), 415-420 (2020).
- Stuhr, N. L., Curran, S. P. Bacterial diets differentially alter lifespan and healthspan trajectories in C. elegans. Communications Biology. 3 (1), 653 (2020).
- Dirksen, P., et al. Cembio - the Caenorhabditis elegans microbiome resource. G3 (Bethesda). 10 (9), 3025-3039 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены